1.酸、碱、盐的性质总结
浓盐酸 . 浓硫酸 . 浓硝酸的基本性质
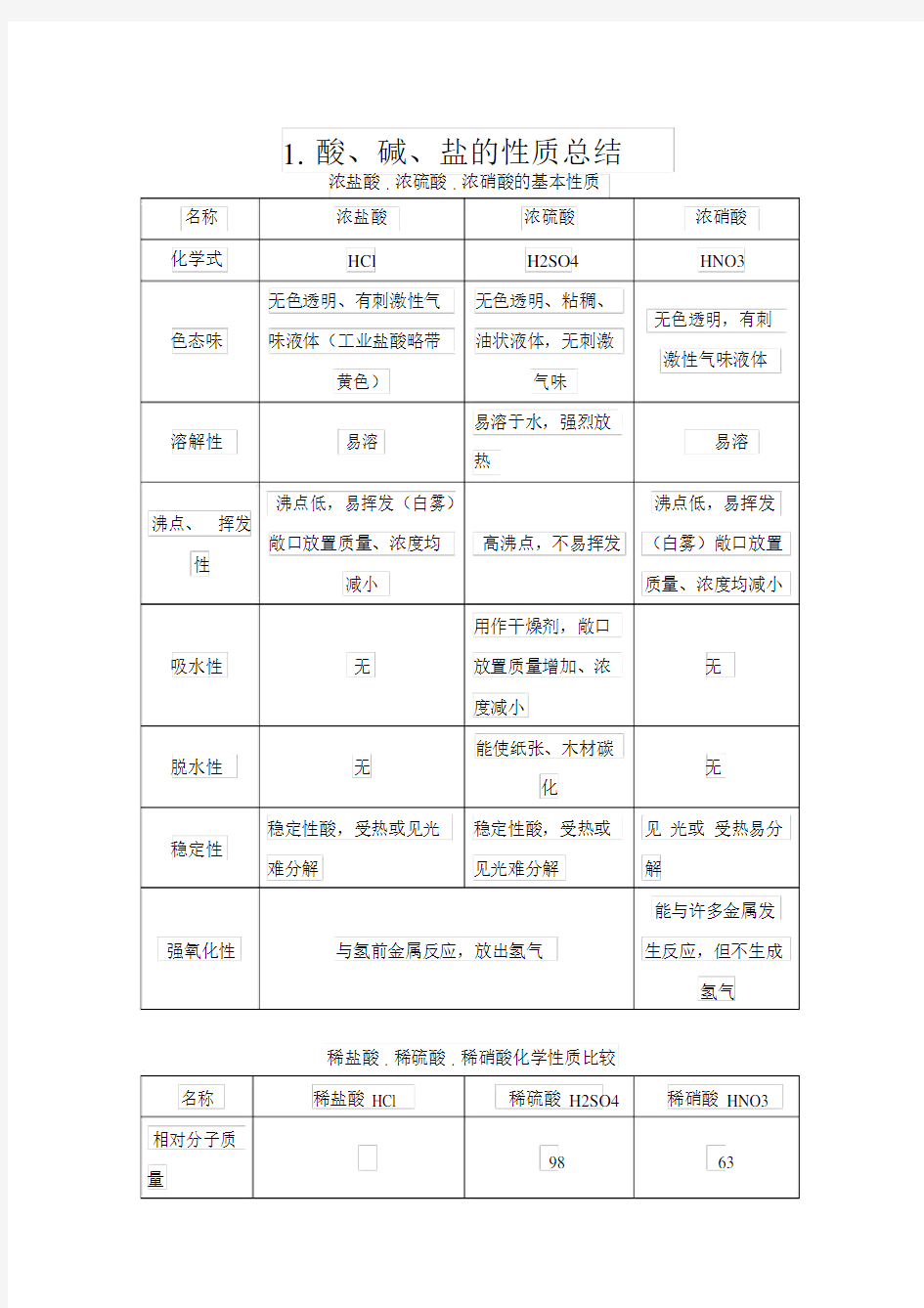
名称浓盐酸浓硫酸浓硝酸
化学式HCl H2SO4 HNO3 无色透明、有刺激性气无色透明、粘稠、
无色透明,有刺色态味味液体(工业盐酸略带油状液体,无刺激
激性气味液体
黄色)气味
溶解性易溶易溶于水,强烈放
易溶热
沸点低,易挥发(白雾)沸点低,易挥发沸点、挥发
敞口放置质量、浓度均高沸点,不易挥发(白雾)敞口放置性
减小质量、浓度均减小
用作干燥剂,敞口
吸水性无放置质量增加、浓无
度减小
脱水性无能使纸张、木材碳
无
化
稳定性酸,受热或见光稳定性酸,受热或见光或受热易分稳定性
难分解见光难分解解
能与许多金属发强氧化性与氢前金属反应,放出氢气生反应,但不生成
氢气
稀盐酸 . 稀硫酸 . 稀硝酸化学性质比较
名称稀盐酸 HCl 稀硫酸 H2SO4 稀硝酸 HNO3 相对分子质
98 63
量
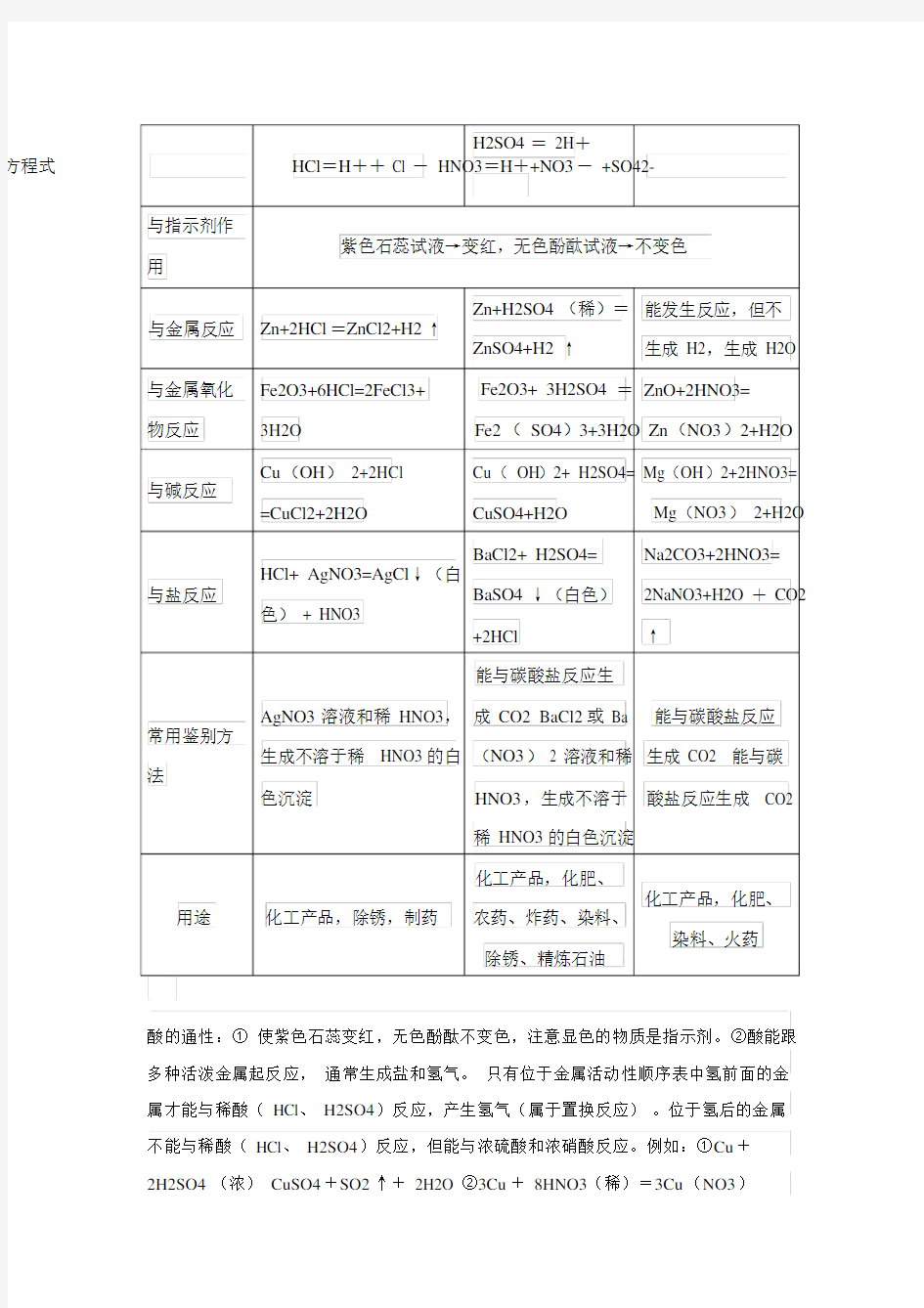
H2SO4= 2H+
方程式HCl=H++ Cl - HNO3=H++NO3- +SO42-
与指示剂作
紫色石蕊试液→变红,无色酚酞试液→不变色
用
Zn+H2SO4(稀)=能发生反应,但不与金属反应Zn+2HCl=ZnCl2+H2↑
ZnSO4+H2↑生成 H2,生成 H2O 与金属氧化Fe2O3+6HCl=2FeCl3+ Fe2O3+ 3H2SO4=ZnO+2HNO3=
物反应3H2O Fe2( SO4)3+3H2O Zn(NO3)2+H2O
Cu(OH) 2+2HCl Cu( OH)2+ H2SO4= Mg(OH)2+2HNO3= 与碱反应
=CuCl2+2H2O CuSO4+H2O Mg(NO3) 2+H2O
BaCl2+ H2SO4= Na2CO3+2HNO3=
HCl+ AgNO3=AgCl↓(白
与盐反应BaSO4↓(白色)2NaNO3+H2O+ CO2
色) + HNO3
+2HCl ↑
能与碳酸盐反应生
AgNO3溶液和稀 HNO3,成 CO2 BaCl2或 Ba 能与碳酸盐反应常用鉴别方
生成不溶于稀 HNO3的白(NO3) 2 溶液和稀生成 CO2 能与碳法
HNO3,生成不溶于酸盐反应生成 CO2
色沉淀
稀 HNO3的白色沉淀
化工产品,化肥、
化工产品,化肥、用途化工产品,除锈,制药农药、炸药、染料、
染料、火药
除锈、精炼石油
酸的通性:① 使紫色石蕊变红,无色酚酞不变色,注意显色的物质是指示剂。②酸能跟
多种活泼金属起反应,通常生成盐和氢气。只有位于金属活动性顺序表中氢前面的金
属才能与稀酸( HCl、 H2SO4)反应,产生氢气(属于置换反应)。位于氢后的金属
不能与稀酸( HCl、 H2SO4)反应,但能与浓硫酸和浓硝酸反应。例如:①Cu+
2H2SO4(浓) CuSO4+SO2↑+ 2H2O ②3Cu+ 8HNO3(稀)=3Cu(NO3)
2+2NO↑+ 4H2O 可见,金属和浓硫酸、硝酸反应都没有氢气产生,这就是实验
室不能用浓硫酸和硝酸与锌反应制氢气的原因。
③酸能跟碱性氧化物反应生成盐和水:H2SO4 + CaO == CaSO4 + H2O
④酸能跟某些盐反应生成新酸和新盐:H2SO4 + BaCl2 === BaSO4↓+ 2HCl
⑤酸跟碱起中和反应生成盐和水:H2SO4+ Ba(OH)2 === BaSO4↓(白色沉淀)+2H2O
常见的酸有盐酸、硫酸和硝酸,它们虽然具有上述五点通性(因为电离出的阳离子都是 H+)。但又各具不同的物理化学性质。
①盐酸是氯化氢的水溶液,是一种混合物。纯净的盐酸是无色的液体,有刺激性气味。工业品浓盐酸因含有杂质( Fe3+)带有黄色。浓盐酸具有挥发性,打开浓
盐酸的瓶盖在瓶口立即产生白色酸雾。这是因为从浓盐酸中挥发出来的氯化氢气体跟空气中水蒸汽接触,形成盐酸小液滴分散在空气中形成酸雾。②硫酸是一种含氧酸,对应的酸酐是 SO3(SO3+H2O==H2SO4)。纯净的硫酸是没有颜色、粘稠、
油状的液体,不易挥发。常用的浓硫酸中的 H2SO4的质量分数为98%,密度为克
/厘米 3。稀 H2SO4具有酸的通性。浓硫酸除去具有酸的通性外,还具有三大特性:
a、吸水性:浓 H2SO4吸收水形成水合硫酸分子(H2SO4?nH2O),并放出大量热,所以浓硫酸通常用作干燥剂。
b、脱水剂:浓硫酸可将有机化合物中的氢原子和氧原子按水分子的构成(H:O
=2:1)夺取而使有机物脱水碳化。纸、木柴、衣服等遇浓硫酸变黑,这就是
因为浓硫酸的脱水性使其碳化的缘故。
C、强氧化性:在浓硫酸溶液中大量存在的是H2SO4分子而不是 H+,H2SO4分子具强氧化性。浓硫酸可使金属活动性顺序表氢后面的一些金属溶解,可将C、S 等非金属单质氧化,而浓硫酸本身还原成SO2。但是,冷的浓硫酸不能与较活泼的金属 Fe 和 Al 反应。原因是浓硫酸可以使Fe 和 Al 的表面形成一层致密的氧化
物薄膜,阻止了里面的金属与浓硫酸继续反应,这种现象在化学上叫钝化。
由于浓硫酸有脱水性和强氧化性,我们往蔗糖上滴加浓硫酸,会看到蔗糖变黑并
且体积膨胀。发生反应的化学方程式:
C12H22O11= 12C+11H2O
C+2 H2SO4=CO2↑+ 2SO2↑+ 2 H2O
产生的 CO2 、SO2气体使蔗糖的体积膨胀。
又由于浓硫酸有吸水性,浓盐酸有挥发性,所以,往浓盐酸中滴加浓硫酸会产生
大量酸雾,可用此法制得氯化氢气体。
③硝酸也是一种含氧酸,对应的酸酐是N2O5,而不是 NO2。
纯净的硝酸是无色的液体,具有刺激性气味,能挥发。打开浓硝酸的瓶盖在瓶口
会产生白色酸雾。浓硝酸通常带黄色,而且硝酸越浓,颜色越深。这是因为硝酸
具有不稳定性,光照或受热时分解产生红棕色的NO2气体, NO2又溶于硝酸溶液中而呈黄色。所以,实验室保存硝酸时要用棕色(避光)玻璃试剂瓶,贮存在黑
暗低温的地方。硝酸又有很强的腐蚀性,保存硝酸的试剂瓶不能用橡胶塞,只能用玻璃塞。
除具有酸的通性外,不管是稀硝酸还是浓硝酸都具有强氧化性。硝酸能溶解除金
和铂以外的所有金属。金属与硝酸反应时,金属被氧化成高价硝酸盐,浓硝酸还原成 NO2,稀硝酸还原成 NO。但是,不管是稀硝酸还是浓硝酸,与金属反应时都
没有氢气产生。较活泼的金属铁和铝可在冷浓硝酸中钝化,冷浓硝酸同样可用铝
槽车和铁罐车运输和贮存。硝酸不仅能氧化金属,也可氧化C、 S、 P 等非金属。硝酸与 Cu、C 发生反应的化学方程式:
Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+ 2H2O
3Cu+ 8 HNO3(稀)= 3Cu(NO3)2+2NO↑+
4H2O C+4HNO3(浓) CO2↑+ 4NO2↑+ 2H2O
④磷酸是一种中等强度的三元酸,可以形成一种正盐和两种酸式盐。
如:磷酸氢二钠( Na2HPO4),磷酸二氢钠( NaH2PO4),磷酸二氢铵 [NH4H2PO4] ,磷酸氢二铵 [(NH4)2HPO4 ] ,磷酸二氢钙 [Ca(H2PO4)2] (溶于水)。
两种常见的碱的性质
名称氢氧化钠氢氧化钙
俗称火碱、烧碱、苛性钠熟石灰、消石灰(溶液为石灰水)化学式NaOH Ca(OH)2
相对分子质量40 74
电离方程式NaOH===Na+ +OH-Ca(OH)2===Ca2++2OH-
物理性质 . 色态白色固体白色粉末状固体
吸湿性有强吸湿性,在空气中吸收无吸湿性( CaO有吸湿性)
水分,潮解
溶解性极易溶于水,强烈放热微溶于水,溶解度随温度升高而
减小
腐蚀性有强腐蚀性有强腐蚀性
化学性质① 使紫色石蕊试液变蓝②① 使紫色石蕊试液变蓝②使
使无色酚酞试液变红③使无色酚酞试液变红③使湿润
湿润的红色石蕊试纸变蓝的红色石蕊试纸变蓝
跟酸性氧化物反应2NaOH+ CO2= Na2CO3+ H2O Ca(OH)2+CO2=CaCO3↓+ H2O
2NaOH+SO2=Na2SO3+ H2O Ca(OH)2+SO2=CaSO3↓+ H2O 跟酸发生中和反应NaOH+ HCl = NaCl + H2O Ca(OH)2+ 2HCl= CaCl2+H2O
2NaOH+ H2SO4= Na2SO4+Ca( OH)2+ H2SO4=CaSO4+ 2H2O
2H2O 3Ca( OH) 2 + 2H3PO4= Ca3
3NaOH+ H3PO4= Na3PO4+(PO4)2↓+ 6H2O
3H2O
跟某些盐反应2NaOH+ CuSO4= Na2SO4+Ca( OH) 2+ Na2CO3= CaCO3↓
Cu(OH)2↓( 蓝色 ) +2NaOH
3Na+ FeCl3 = 3NaCl + Fe Ca(OH)2+ MgCl2=CaCl2+Mg
(OH) 3 ↓( 红褐色 ) (OH) 2 ↓( 白色 )
用途化工原料,用于肥皂、石油、建筑业,制三合土,抹墙,农业
造纸、纺织、印染等工业上改良酸性土壤,配制波尔多
液、石硫合剂,工业上制取
NaOH、漂白粉
制取Ca(OH)2+Na2CO3= CaCO3 CaO+ H2O= Ca(OH)2
↓+ 2NaOH
碱的通性
★★常见的碱氢氧化钠氢氧化钙氨水
(1) 碱溶液能跟酸碱指示剂起反应,紫色石蕊试液遇碱变蓝,无色酚酞试液遇碱
变红。不溶性碱,如不能使酸碱指示剂变色。
(2)碱能跟酸性氧化物起反应生成盐和水。
(3)碱能跟酸起中和反应生成盐和水。
(4)碱能跟某些盐起反应生成新碱与新盐。
常见的碱有 NaOH、KOH、Ca(OH) 2、氨水等,它们各自具有一些特性。
①氢氧化钠( NaOH)俗名苛性钠、火碱、烧碱,这是因为它有强腐蚀性。 NaOH 是一种可溶性强碱。白色固体,极易溶于水,暴露在空气中易潮解,可用作碱性
气体(如NH3)或中性气体(如H2、O2、CO等)的干燥剂。NaOH易与空气中
的CO2反应生成 Na2CO3固体。NaOH溶液可以腐蚀玻璃,盛 NaOH溶液的试剂
瓶不能用磨口的玻璃塞,只能用橡胶塞。
②氢氧化钙 [Ca(OH)2] 是白色粉末,微溶于水,俗称熟石灰或消石灰,其水溶液
称为石灰水。Ca(OH)2 也有腐蚀作用。 Ca(OH)2 与 CO2反应生成白色沉淀
CaCO3,常用于检验 CO2。
Ca(OH)2+CO2= CaCO3↓+ H2O
Ca(OH)2能跟 Na2CO3反应生成 NaOH,用于制取 NaOH。反应方程式为:
Ca(OH)2+Na2CO3=CaCO3↓+ 2NaOH
③氨水( NH3?H2O)是一种可溶性弱碱, NH3 溶于水可得氨水。有刺激性气味,
有
挥发性。将氨气通过盛放氧化铜的玻璃管,生成氮气、水和铜,其反应方程式为:2NH3 + 3CuO 3Cu + N2↑ +3H2O,说明氨气具有还原性。
此外,KOH、Ba(OH)2也是常见的可溶性强碱。不溶的碱大多是弱碱,如:Fe(OH)3、Cu(OH)2等。他们的共同性质是热稳定性差,受热易分解生成对应的金属氧化物
和水。
三种常见的盐
名称氯化钠( NaCl)碳酸钠( Na2CO3)硫酸铜( CuSO4)结晶水合物——Na2CO3?10H2O CuSO4?5H2O 俗称食盐纯碱
结晶水合物俗称
胆矾、蓝矾
盐湖或碱性土壤
分布海水、盐湖、盐井、盐
里,天然碱(俗称——
矿
口碱)
CuSO4为白色固白色固体,易溶于水,
白色固体,易溶于体,易溶,水溶液
为蓝色, CuSO4?
物理性质粗盐中因含 MgCl2、
水(水溶液显碱
性),其结晶水合物5H2O为蓝色晶体,
CaCl2 而易潮解
易失去水而风化易溶,加热失去结
晶水,由蓝变白。
化工原料,可制取钠、化工产品,用于洗
精炼铜、电镀、配氯气、 NaOH和纯碱,调
用途涤剂、造纸、纺织
制农药波尔多液味、腌渍食品等及制玻璃等工业
★★★常见的盐NaCl Na2CO3 NaHCO3 CuSO4铵盐 KMnO4
(1)盐跟某些金属反应生成新的金属和新的盐。例如:
① Zn+CuSO4 === ZnSO4+Cu
②Cu+Hg(NO3)2 === Cu(NO3)2+Hg
只有排在金属活动性顺序表前面的金属才能把排在后面的金属从它们的盐溶液
里置换出来。
( 2)盐跟酸反应生成新酸与新盐。例如:
BaCl2+H2SO4= BaSO4↓+2HCl;
(3)盐跟碱反应生成新盐与新碱。例如:
① MgSO4+2NaOH=Mg(OH)2↓+ Na2SO4;
② MgSO4 + Ba(OH)2 == BaSO4↓ + Mg(OH)2↓
(4)盐跟另一种盐反应生成两种新盐,例如:
2AgNO3+ Na2CO3 === Ag2CO3↓+ 2NaNO3
也有例外,如: Al2(SO4)3 + 6NaHCO3 == 2Al(OH)3 ↓+ 6CO2↑+ 3Na2SO4。(5)不溶性碳酸盐,高温下可分解生成对应金属氧化物和二氧化碳气体。
① CaCO3 CaO + CO2↑ , ②BaCO3 BaO + CO2↑;
② Cu2(OH)2CO3(绿色 ) 2CuO + H2O + CO2↑。
2.常见物质的溶解性
常见酸中除硅酸( H2SiO3)外均可溶;
常见碱中除 NaOH、KOH、Ca(OH) 2 、NH3?H2O可溶,微溶外其余均为难溶碱。其中 Cu(OH)2 为蓝色沉淀, Fe(OH)3 为红褐色沉淀,其余均为白色沉淀;常见的盐的溶解性规律是:钾、钠、铵、硝溶;盐酸银不溶;硫酸钡不溶硫酸钙、硫酸银微溶;碳酸钾、钠、铵能溶;碳酸镁微溶。
3.金属活动顺序表的应用金属活动顺序表:
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au ———————————————————————————————→
金属活动性由强到弱金属活动顺序表的应用主要是在置换反应中的应用。
( 1)金属 + 酸→盐 + 氢气(2)金属 + 盐→另一种盐 + 另一种金属
4.复分解反应发生的条件:生成物起码具备下列三个条件之一:①有沉淀析出;
② 有气体放出;③有水生成。