
第九单元溶液(溶质的质量分数)同步练习
1.溶液质量分数是表示的一种方法,其数学意义是之比。现有溶质质量分数为20%的氯化钠溶液,其20%表示的含义就是每g 氯化钠溶液中含有g。
2、将30g氯化钠溶于70g水中,制取氯化钠溶液,则氯化钠溶液中溶质的质量分数是。
3、100g 溶质质量分数为20%的硫酸溶液中含H2SO4g,水g;100毫升20%的硫酸溶液(密度1.14g/mL)的质量是,其中含溶质H2SO4 g,含溶剂水g。
4、现有80g 质量分数为10% 的硝酸钠溶液,试回答下列问题:
(1)上述硝酸钠溶液中含溶质的质量为,溶剂的质量为。
(2)若向上述溶液中加入20 g 水,则所得溶液中溶质的质量分数为;
(3)若向上述溶液中加入20 g 硝酸钠,则所得溶液中溶质的质量分数为;
(4)若使上述溶液中溶质的质量分数变为20%,则应加入硝酸钠g;
(5)若使上述溶液中溶质的质量分数变为20%,则应蒸发水g;
(6)若使上述溶液中溶质的质量分数变为5%,则应加水g;5、配制一定溶质质量分数的氯化钠溶液的一些操作步骤见下图,正确的操作顺序是()
A、④⑤①②③
B、①②③④⑤
C、③④①②⑤
D、②①④③⑤
6、溶质质量分数为10%的氢氧化钠溶液100g,欲将其溶质的质量分数增大一倍,可采用的方法有()
A、加入固体氢氧化钠12.5g
B、将溶液中溶剂水蒸发一半
C、加入100g10%的氢氧化钠溶液
D、蒸发掉50g水
E、加入50g40%的氢氧化钠溶液
7、将m g 硝酸钾的不饱和溶液恒温蒸发水分至有晶体析出,在此变化过程中溶液里溶质质量分数p% 与时间t的关系正确的是()
8、在45g20%的KCl 溶液中加入8g KCl后再加入14g水,所得溶液恰好为20℃的饱和溶液,则所得溶液中溶质的质量分数为。
9、下图是某同学配制一定质量的0.9%生理盐水的全过程:
(1)请找出上图中的错误:
①;②。
(2)如果配制的生理盐水中NaCl 的质量分数小于0.9%,则可能造成误差的原因有(至少举出三点)
①②③
10、汽车、电机车一般要使用铅酸蓄电池。某铅酸蓄电池用的酸溶液是溶质质量分数为28%的稀硫酸,现用 1 L 溶质质量分数为98%的浓硫酸(密度为1.84g/cm3)配制该稀硫酸。问:
A
B
C
D
⑴1 L 溶质质量分数为98%的浓硫酸的质量为 ,其中溶质的质量为 。
⑵将1 L 溶质质量分数为98%的浓硫酸配制成28%的稀硫酸,需要蒸馏水(密度为1g/cm 3) L ,配得稀硫酸的质量为 kg 。
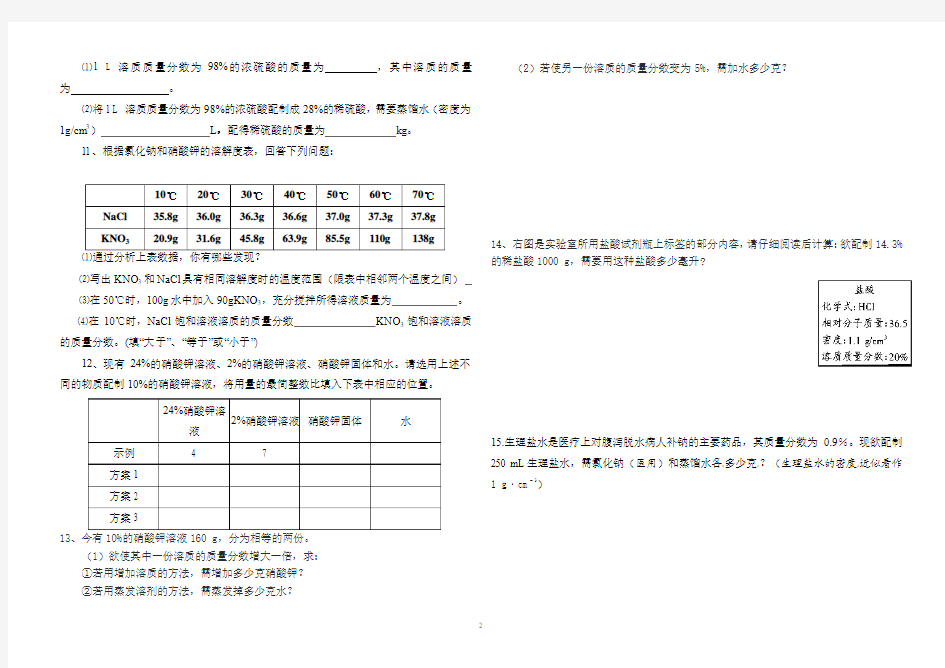
11、根据氯化钠和硝酸钾的溶解度表,回答下列问题:
⑴通过分析上表数据,你有哪些发现?
⑵写出KNO 3和NaCl 具有相同溶解度时的温度范围(限表中相邻两个温度之间) ⑶在50℃时,100g 水中加入90gKNO 3,充分搅拌所得溶液质量为 。 ⑷在10℃时,NaCl 饱和溶液溶质的质量分数 KNO 3饱和溶液溶质的质量分数。(填“大于”、
“等于”或“小于”)
12、现有24%的硝酸钾溶液、2%的硝酸钾溶液、硝酸钾固体和水。请选用上述不同的物质配制10%的硝酸钾溶液,将用量的最简整数比填入下表中相应的位置。
13 (1)欲使其中一份溶质的质量分数增大一倍,求: ①若用增加溶质的方法,需增加多少克硝酸钾? ②若用蒸发溶剂的方法,需蒸发掉多少克水?
(2)若使另一份溶质的质量分数变为5%,需加水多少克?
14、右图是实验室所用盐酸试剂瓶上标签的部分内容,请仔细阅读后计算:欲配制14.3%
的稀盐酸1000 g ,需要用这种盐酸多少毫升?
15.生理盐水是医疗上对腹泻脱水病人补钠的主要药品,其质量分数为0.9%。现欲配制250 mL 生理盐水,需氯化钠(医用)和蒸馏水各多少克?(生理盐水的密度近似看作1 g ·cm -3
)
【参考答案】
1、溶质质量与溶液质量之比,,100,溶质氯化钠20
2、30%
3、20,80,114g,22.8,91.2
4、⑴8g,72g ;⑵8%;⑶28%;⑷10;⑸40;⑹80
5、A
6、ADE
7、C
8、25.4%
9、⑴①广口瓶塞放反了(或瓶塞放反了);②砝码和药品放反了
⑵[提示:这是一道开放性试题,可以从不同的侧面回答]
计算错误如:①水算多了;②氯化钠算少了;
称量氯化钠操作错误如:③天平读数有误;④氯化钠和砝码放反了;⑤左盘放了纸片,右盘未放纸片;⑥天平未调零等;
用量筒量取水时错误如:⑦水量多了(或量取水读数时仰视);⑧氯化钠中混有杂质;⑨烧杯中有水等。
10、(1)1840g,1803.2g 4.6L 6.44kg
11、⑴①氯化钠的溶解度随温度的升高而增大,但变化不明显;
②硝酸钾的溶解度随温度的升高而增大,但变化非常显著。
⑵20℃~30℃。⑶185.5g。⑷大于。
12、
13、(1)计算:所需高锰酸钾的质量为400g×0.5%=2g,所需水的质量为400g-2g=398g,相当于398mL水。(2)称量:用天平称取2g高锰酸钾,放入500mL大烧杯中,用量筒量取398mL水,倒入盛有2g高锰酸钾的烧杯中。(3)溶解:用玻璃棒搅拌,使高锰酸钾完全溶解即可。
14、分三次漂洗好。提示:用4500g水一次漂洗“拧干”的湿衣服上含有洗涤剂的质量为:
。
分三次漂洗,第一次漂洗“拧干”的湿衣服上留有洗涤剂的质量为:
第二次漂洗“拧干”的湿衣服上留有洗涤剂的质量为:第三次漂洗“拧干”的湿衣服上留有洗涤剂的质量为:
关于溶质质量分数的练习 1.6g大理石样品与50g稀盐酸恰好完全反应(杂质不参与反应且不溶于水),生成二氧化碳2.2g。求:反应后溶液中溶质的质量分数(计算结果保留一位小数)。 2.将6.8 g含杂质的锌粒加入到80 g过量的稀硫酸中(锌与稀硫酸反应的化学方程式:Zn+H2SO4==ZnSO4+H2↑;杂质不溶于水,也不与稀硫酸反应),充分反应后过滤,称得滤液质量为86.3 g。试计算: (1)反应生成氢气的质量; (2)锌粒中所含锌的质量分数(精确到0.1%)。 3.鸡蛋壳的主要成分是碳酸钙。小丽称取15g干燥的碎鸡蛋壳放入烧杯中,并向其中加入了40g稀盐酸恰好完全反应(假设鸡蛋壳中除碳酸钙外的其他成分都不溶于水,且不与稀盐酸反应),反应后烧杯中物质的总质量50.6g。计算:当碳酸钙恰好完全反应时所得溶液中溶质的质量分数。(结果保留1位小数) 4.28g石灰石样品与210.8g稀盐酸恰好完全反应后(样品中的杂质既难溶于水,又不与稀盐酸反应),
生成了8.8g二氧化碳。(溶解在水中的二氧化碳忽略不计)计算: (1)该石灰石样品中碳酸钙的质量分数。 (2)所得溶液的溶质质量分数。 5. 向某铁粉样品中,加入溶质质量分数为16%的硫酸铜溶液100 g,恰好完全反应,样品中杂质不溶于水也不与硫酸铜反应。请结合下图提供的数据计算。 (1)框图中的“固体6.8g”是(“纯净物”或“混合物”) (2)求a的数值。 (3)向不饱和滤液中加入100.8 g水,求所得溶液中溶质的质量分数。 6.(3分)现有一瓶标签已破损的过氧化氢溶液,为测定瓶内溶液中溶质的质量分数,取该溶液34g 于烧杯中,加入一定量的二氧化锰,完全反应后,称得烧杯内剩余 物质的总质量是34.4g,将烧杯内剩余物质过滤、洗涤、干燥后得滤渣2g。请计算 瓶内过氧化氢溶液中溶质的质量分数。 7.(3分)课外小组同学将100g盐酸分5次加入到35g某石灰石样品中(已知杂质不与盐酸反应),得到如下部分数据和图象。(最后结果保留一位小数)
例一、实验室用120克石灰石和100克稀盐酸恰好完全反应,制得二氧化碳44克,求所用稀盐酸的溶质质量分数和反应后溶液溶质的质量分数。 1、金属钠跟硫酸铜溶液发生如下反应:2Na+2H2O+CuSO4Na2SO4+Cu(OH)2↓+H2↑,向73.7g硫酸铜溶液中加入2.3g钠,恰好反应完全。试计算: (1)生成沉淀和氢气的质量各为多少克? (2)反应停止后,滤去沉淀,所得溶液中溶质的质量分数是多少? 2、有一种未知浓度的稀硫酸600g,向其中加入足量的锌粉,充分反应后过滤,反应中共收集到氢气1.2g,求: (1)有多少克锌粉参加反应? (2)该硫酸溶液的质量分数是多少? (3)所得滤液中溶质的质量分数是多少?(计算结果保留一位小数) 例二、将铁粉和铜粉的混合物7g,加入到盛有58.1g稀盐酸的烧杯中,恰好完全反应。此时烧杯内各物质的总质量为64.9g。试计算: (1)原混合物中铁粉的质量分数; (2)反应后所得溶液中溶质的质量分数; (3)配制上述反应中所用稀盐酸需要质量分数为38%的浓盐酸(密度为1.19g/cm3)的体积(计算结果精确到0.1) 1、实验室有一瓶存放时间过长的氢氧化钠,其中一部分已转化成为了碳酸钠。现需用该药品配制氢氧化钠溶液。取50克该药品,溶于200mL水中(水的密度为1g/cm3),然后慢慢地滴加7.4%的澄清石灰水,当用去100克澄清石灰水时,碳酸钠恰好反应完全。计算: (1)50克该药品中碳酸钠的质量; (2)滤出沉淀后所得溶液的溶质质量分数。(精确到0.01%) 2、某同学为了测定一瓶过氧化氢溶液中溶质的质量分数,取该溶液20g,加入二氧化锰0.5g,完全反应后,称得烧杯内剩余物质的总质量为19.7g。请回答下列问题: (1)二氧化锰在反应中的作用是_____________________。 (2)计算该过氧化氢溶液中溶质的质量分数。 (3)利用上述溶液配制100g溶质质量分数为3%的过氧化氢消毒液,需该溶液的质量为__________g(结果保留一位小数)。 3、某补钙品(有效成分为碳酸钙,其它成分不含钙元素)的说明中标明含钙量为30%。李琳同学为了检验该产品,取10g补钙品放入100g稀盐酸中,HCl与补钙品的有效成分刚好完全反应(其它成分不与盐酸反应)。反应后剩余固体和液体的总质量比反应前减少了2.2g.求: (1)补钙品中实际含钙的质量分数是多少? (2)所用稀盐酸中溶质的质量分数是多少? 例三、有一种含碳酸钙的“石头纸”:为测定其中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品。分别在5只烧杯中进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与水反应):
课题3溶质的质量分数 一.选择题 1.(2019?西湖区模拟)20℃时,把40g的某物质加入到60g水中,全部溶解,所得溶液中溶质的质量分数是() A.20%B.40%C.25%D.66.7% 【答案】B。 【解析】把40g的某物质加入到60g水中,全部溶解,所得溶液中溶质的质量分数是 颸? 颸?? 颸? 颸颸? 40% 2.(2019?下城区二模)现有100克20℃饱和KOH溶液,向其中加入少量K2O固体(K2O+H2O═2KOH)充分反应并恢复20℃,所得溶液与与原溶液保持一致的是() A.K+总数B.溶剂的质量 C.溶液的质量D.溶质的质量分数 【答案】D。 【解析】20℃时,向饱和的KOH溶液中加入少量的量K2O固体,则发生反应K2O+H2O═2KOH,恢复20℃时,溶液仍为该温度下的饱和溶液。由于部分水参加反应,所以溶剂的质量减少,所溶解的KOH的质量减少,因此溶液中K+总数减少,溶液的质量也减少。因为该溶液仍为该温度下KOH的饱和溶液,温度没有改变,溶解度也不改变,所以溶质的质量分数不变。 3.(2019?西湖区校级模拟)在以下各操作均没有达到饱和的情况下,现有40g质量分数为10%的食盐水,要使其质量分数达到20%,可采用的方法是() ①蒸发掉20克水②蒸发后溶液中还剩20克水③加入3.2克食盐④加入5克食盐 A.①④B.①②C.②④D.①②④ 【答案】A。 【解析】设需要蒸发水的质量为x,(40g﹣x)×20%=40g×10%,x=20g,由于原溶液中水的质量少于40g,
而不是蒸发后溶液中还剩20克水。 设需要再溶解该物质的质量为y,(40g+y)×20%=40g×10%+y,y=5g。 故①④方法正确。 4.根据如图原理可:海水加压一段时间后,(从海水中的主要溶质﹣﹣氯化钠和溶剂﹣﹣水两个方面来看)剩余海水的组成不变的是() A.溶质质量B.溶质质量分数 C.溶液质量D.溶剂质量 【答案】A。 【解析】A、加压后,水分子通过淡化膜,溶质质量不变,故选项正确。 B、加压后,水分子通过淡化膜,溶质质量不变,溶剂质量减小,溶质质量分数增大,故选项错误。 C、加压后,溶质不能通过淡化膜,加压后的上层海水中溶质不变,溶剂质量减少,溶液质量减少,故选项错误。 D、加压后,淡化膜允许水分子通过,故溶剂质量减小,故选项错误。 5.(2019?深圳模拟)如表为硝酸钾和氯化钠在不同温度下的溶解度,下列说法中正确的是()温度/℃010******** KNO313.320.931.645.863.985.5
关于溶质质量分数计算的几种类型 溶液中溶质的质量分数各种计算类型,包括一些较难的计算题,只要能牢牢掌握溶质的质量分数的计算公式,并能灵活的将各种计算类型中的有关溶质、溶剂、溶液等质量找出代入公式中,各种题目都会迎刃而解。 溶液中溶质的质量分数计算公式如下: 100%=?溶质质量溶质的质量分数溶液质量(或溶剂质量+溶质质量) 一、已知溶液中溶质质量、溶剂质量,求溶质的质量分数 例1 20g 食盐全部溶于80克水中,求此食盐溶液中溶质的质量分数。 简析:溶质质量为20克食盐,溶剂质量为80克水。则: 20 100%20%2080=?=+溶质的质量分数 二、已知某温度下的溶解度,求溶质的质量分数 例2 20℃时,将20克食盐在50g 水中充分搅拌,所得食盐溶液中溶质的质量分数(20℃时,食盐的溶解度为36克)。 简析:温度一定,溶剂的量一定,20g 食盐能否全部溶于50g 水中,必须先由溶解度计算出。设50g 水在20℃最多可溶解食盐Xg ,100∶36=50∶X X=18g ,20g 盐在50g 水中不能全溶,所得溶液为饱和溶液。故:溶质的质量为20℃的溶解度,溶剂质量为100g 水。则: 36100%100%26.5%10010036=?=?=++溶解度 溶质的质量分数溶解度 三、在一定溶质的质量分数的溶液中,加入溶质或溶剂,求所得溶液中溶质的质量分数 例3 80g15%的硝酸钠溶液中,加入20g 硝酸钠全部溶解,求此硝酸钠溶液中溶质的质量分数。 简析:溶质质量为(80×15%+20)g ,溶液质量为(80+20)g 。则: 8015%+20 100%32%8020?=?=+溶质的质量分数 例4 80g15%的硝酸钠溶液中,加入20g 水,求此硝酸钠溶液中溶质的质量分数。 简析:溶质质量为(80×15%)g ,溶液质量为(80+20)g 。则: 8015% 100%12%8020?=?=+溶质的质量分数 四、同一种溶质的两种不同溶质的质量分数的溶液混合,求混合后溶质的质量分数 例5 将10%的硝酸钠溶液100g ,与25%的硝酸钠溶液200g 混合,求混合后溶液中溶质的质量分数。 简析:溶质质量为(100×10%+200×25%)g ,溶液质量为(100+200)g ,则: 10010%+20025% 100%20%100200??=?=+溶质的质量分数 五、已知溶液的体积比浓度,求此溶液中溶质的质量分数 例6 将100mL98%(密度为1.84g/cm 3)的浓硫酸,加入500mL 的水中(即配成体积比为1∶5的稀硫酸),求此稀
【知识要点】一、溶质的质量分数 溶液的浓稀、有色溶液的颜色都可以粗略的表示一定量的溶液中含有溶质的多少,溶液中溶质的质量分数可以准确地表示一定量的溶液中含有溶质的多少。 1.定义:溶液中溶质的质量分数是溶质质量与溶液质量之比。 数学表达式: 特点:无单位、是个比值、一般不受温度的影响等。 饱和溶液溶质的质量分数的计算: (其中S为该温度下物质的溶解度) 2.配制溶质质量分数一定的溶液 以配制100g溶质质量分数为5%的氯化钠溶液为例分析: (1)计算:计算配制100g溶质质量分数为5%的氯化钠溶液所需氯化钠和水的质量。 (2)称量:用托盘天平称量所需的氯化钠。 (3)量取:用量筒量取所需的水(水的密度近似看作1g/cm3)。 (4)溶解:将量好的水倒入盛有称量好氯化钠的烧杯中,用玻璃棒搅拌,使氯化钠溶解。 (5)装瓶、贴签:把配制好的溶液装入试剂瓶中,盖好瓶塞并贴上标签,备用。 操作示意图可简单表示如下: 说明:如果用液体溶质来配制溶质质量分数一定的溶液,其步骤为:计算→量取→溶解→装瓶、贴签。想一想,这是为什么? 二、关于溶质的质量分数的计算几种类型1.根据定义式的基本计算 (只要已知其中的两个量,就可以求出第三个量) 例如:20克硝酸钾完全溶解在60克水中,所得溶液中溶质的质量分数是多少? 解:根据溶质的质量分数的定义可得 ==25% 注意:饱和溶液溶质的质量分数的计算: (其中S为该温度下物质的溶解度) 2.溶液的稀释和浓缩问题的计算 根据稀释前后溶质的质量不变进行运算,无论是用水或用稀溶液来稀释浓溶液,都可计算。 (1)用水稀释浓溶液 设稀释前浓溶液的质量为m,其溶质的质量分数为a%,稀释时加入水的质量为n,稀释后溶质的质量分数为b%。则可得m×a%=(m+n)×b% (2)用稀溶液稀释浓溶液 设浓溶液的质量为A,其溶质的质量分数为a%,稀溶液的质量为B,其溶质的质量分数为b%,两溶液混合后所得溶液溶质的质量分数为c%。则可得A×a%+B×b%=(A+B)×c% (3)蒸发水进行浓缩 设浓缩前稀溶液的质量为m,其溶质的质量分数为a%,蒸发水的质量为n,浓缩后溶质的质量分数为b%。则可得m×a%=(m-n)×b% 说明:如果采用加入溶质的方法使溶液中溶质的质量分数增大,那么可以根据:
关于溶质质量分数计算 一、基础知识 1.溶质质量分数:是溶质质量与溶液质量之比. 2.主要计算依据: (1) (2)溶液质量=溶液体积×溶液密度 3.常见题型及基本思路: (1)溶液加水稀释的计算: 根据稀释前后溶质的质量相等,可用以下计算式计算:m(浓)×a% (浓)=[m(浓)+m(水)] ×a%(稀) (2)溶质质量分数不同的同溶质溶液混合问题: 一般可用下式计算: m(浓)×a%(浓)+m(稀)×a%(稀)=m(混)×a%(混) (3)求化学反应后所得溶液中溶质质量分数的问题: 通过化学反应计算出溶质质量,再分析各量间关系求出溶液总质量,运用公式计算出反应后溶液中溶质的质量分数. 求反应后所得溶液质量的一般方法:质量守恒法.溶液质量=m(反应物)-m↓-m↑. 二、典型例题 例1:现有100g溶质质量分数为15%的过氧乙酸溶液,欲配制成溶质质量分数为1.5%的溶液来使用,需加水多少克? 解:设需加水质量为x, 100g×15%=(100g+x)×1.5% x=900g 答:略. 例2:配制2000g20%的稀硫酸用以除锈,需98%的浓硫酸和水各多少毫升? 解:设需浓硫酸的质量为x 2000g×20%=x×98% x=408.2g 浓硫酸体积=408.2g÷1.84g/cm3=221.8mL 水的体积=(2000g-408.2g)÷1g/cm3=1591.8mL 答:略. 例3:实验室用95%的浓硫酸与5%的稀硫酸来配制20%的硫酸180g,需要95%的硫酸和5%的硫酸各多少克? 解:设需要95%,5%硫酸的质量分别为x,y
人教版化学九年级下册第九单元溶液溶质质量分数与化学方程式的综合计算专题训练 方法指导 1.求反应后所得溶液的溶质质量分数,关键是求出反应后溶液中溶质的质量和溶液的质量。 2.求反应后溶液中溶质的质量时,一方面要看生成的溶质的质量,另一方面要看原固体中所含溶质的质量。 3.求反应后溶液的质量时,要用反应物溶液的质量和减去生成气体以及沉淀的质量,同时要注意杂质的质量。 1.实验室取68 g过氧化氢溶液和2 g二氧化锰混合制取氧气,充分反应后,称量剩余溶液和滤渣为68.4 g。求: (1)充分反应后,生成氧气的质量为______g; (2)参加反应的过氧化氢溶液中溶质的质量分数。 2.取氯酸钾和二氧化锰的混合物26 g,加热至混合物固体质量不再减少为止,冷却后称得剩余固体质量为16.4 g,将剩余固体加入到134.1 g水中,充分搅拌后过滤。计算(已知氯化钾易溶于水,二氧化锰不溶于水): (1)生成氧气的质量; (2)二氧化锰的质量; (3)最终所得滤液中溶质的质量分数。 3.向盛有20.0 g稀硫酸的烧杯中倒入5.0 g黄铜(铜锌合金)样品粉末,恰好完全反应。称得未溶物质量为3.7 g。完成下列计算: (1)该黄铜样品中含Zn的质量为______g。 (2)所用稀硫酸中溶质的质量分数。 (3)反应后所得溶液中溶质质量分数(结果保留一位小数)。 4.实验室用石灰石与稀盐酸反应制取二氧化碳。若要制取 4.4 g二氧化碳,需要溶质质量分数为10%的稀盐酸多少克? 5.硫酸铜溶液对过氧化氢的分解有催化作用,取一定质量8.5%的过氧化氢溶液倒入烧杯中,加入一定质量15%的硫酸铜溶液,过氧化氢完全分解,有关实验数据如表所示(不考虑气体在水中的溶解)。请计算:
溶质的质量分数学以致用(一) 1.现有 20℃时 NH4Cl 饱和溶液 200g,今欲改变该饱和溶液中溶质的质量分数,可采取的措施是() A.保持温度不变,蒸发掉20g 水 B.保持温度不变,加入20gNH4Cl 固体 C.保持温度不变,取出20g 溶液 D.保持温度不变,加入20g 水 2.用溶质的质量分数为 98%的 H2SO4(密度为 1.84g/cm3)来配制 44mL 20%的 H2SO4(密度为 1.14g/cm3),需要 98%H2SO4的体积是() A.1.8mL B.5.6mL C.7.8mL D.10.2mL 3.把 70%的硝酸(密度为 1.44g/cm3)与等体积的水混合,所得稀硝酸中溶质的质量 分数是() A.等于 35% B.小于 35% C.大于 35% D.无法确定 4.今有 60g 溶质的质量分数为10%的 NaNO3溶液,欲将其溶质的质量分数增大一倍, 应采用的方法是()
A.把溶剂蒸发掉一半 B.加入 6gNaNO3晶体 C.把溶剂蒸发掉30g D.加入 20%的 NaNO3溶液 30g 5.将 80g10%的 NaOH 溶液与 20g15%的 NaOH 溶液混合,混合溶液中溶质的质量分数为() A.13% B.12% C.11% D.16% 6.下图是 a、b 两种固体物质的溶解度曲线,下列说法中不正确的是() A.a 的溶解度大于 b 的溶解度 B.在 25℃时, a、b 的饱和溶液中溶质的质量分数相等 C.当 a 中混有少量 b 时,可用结晶法提纯 D.a、b 都属于易溶物质 7.将质量各为 mg 的 Na2O 和 NaCl,分别加入到 ng 水中,完全溶解后得到 a 和 b 两种溶液。下列说法中正确的是()
知识整理 溶液是由溶质和溶剂组成的,我们常用溶质的质量分数来定量的表示溶液的组成。 2、溶液中溶质的质量分数计算的有关公式(注意单位统一): (1)溶液的质量=溶质的质量+溶剂的质量=溶液的体积×溶液的密度 (1)溶质的质量分数= 的质量÷的质量×100% (2)溶液的稀释(浓缩): 依据:溶液的稀释(浓缩)前后溶质的质量。如有溶液Ag,其溶质的质量分数为a%,稀释(浓缩)成溶质的质量分数为b%的溶液Bg,则:Ag×a% =Bg×b% (4)同溶质不同溶质的质量分数的溶液混合: 依据:混合溶液的质量混合前各溶液的质量之和,混合溶液中溶质的质量混合前各溶液中溶质的质量之和。如Ag溶质的质量分数为a%的溶液与Bg溶质的质量分数为b%的溶液混合得到Cg溶质的质量分数为的溶液,则有下列关系: Ag + Bg = CgAg×a% + Bg×b% = Cg×c% (5)饱和溶液中溶质的质量分数和溶解度的换算: 饱和溶液中溶质的质量分数=————————×100% 三、重点疑点讨论
句话?举例说明。 2、为什么说一定温度下,某物质饱和溶液的溶质的质量分数最大? 3、“饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液”此说法合理吗?为什么? 4、不饱和溶液变为饱和溶液后溶质的质量分数一定增大吗?饱和溶液中析出晶体后,剩余溶液的溶 质的质量分数一定减小吗?请分别举例说明。 5、溶液混合时,溶液的质量可以相加,其体积能否直接相加?为什么? 四、解题方法指导 例题1 将10g某物质投入到90g水中,充分溶解后所得溶液中溶质的质量分数是() A、等于10% B、大于10% C、小于10% D、无法确定 思考:“10g某物质”指的是什么物质?充分溶解是否完全溶解?溶液的质量是否一定为10g+90g ? 例题2 50℃时某物质的溶解度是25g,现有50℃时溶质的质量分数为16%的该物质的溶液200g,恒温蒸发掉50g水后,所得溶液的溶质的质量分数是() A、16% B、20% C、21.3% D、25% 思考:恒温蒸发掉50g水后,所得溶液是否是饱和溶液?怎样判断? 例题3 在20℃时,向174.3g饱和K2SO4溶液中加入104g20%的BaCl2溶液,恰好完全反应。计算(1)20℃时K2SO4的溶解度;(2)完全反应后所得溶液中溶质的质量分数。 思考:(1)怎样求饱和K2SO4溶液中溶质的质量?K2SO4溶液和BaCl2溶液反应的化学方程式为。(2)完全反应后所得溶液的质量是174.3g+104g吗?如果不是,用什么方法求得? 五、知识能力训练 1、对溶质的质量分数是10%的NaCl溶液含义的解释错误的是() A、100g水中溶解了10g NaCl B、100g NaCl溶液中含有10g NaCl
溶质的质量分数练习题 TTA standardization office【TTA 5AB- TTAK 08- TTA 2C】
第九单元溶液(溶质的质量分数)同步练习1.溶液质量分数是表示的一种方法,其数学意义是之比。现有溶质质量分数为20%的氯化钠溶液,其20%表示的含义就是每 g氯化钠溶液中含有g。 2、将30g氯化钠溶于70g水中,制取氯化钠溶液,则氯化钠溶液中溶质的质量分数是。 3、100g 溶质质量分数为20%的硫酸溶液中含H2SO4 g,水 g;100毫升20%的硫酸溶液(密度 mL)的质量是,其中含溶质H2SO4 g,含溶剂水 g。 4、现有 80g 质量分数为 10% 的硝酸钠溶液,试回答下列问题: (1)上述硝酸钠溶液中含溶质的质量为,溶剂的质量为。 (2)若向上述溶液中加入20 g 水,则所得溶液中溶质的质量分数为; (3)若向上述溶液中加入20 g 硝酸钠,则所得溶液中溶质的质量分数 为; (4)若使上述溶液中溶质的质量分数变为 20%,则应加入硝酸钠 g; (5)若使上述溶液中溶质的质量分数变为 20%,则应蒸发水 g; (6)若使上述溶液中溶质的质量分数变为 5%,则应加水 g; 5、配制一定溶质质量分数的氯化钠溶液的一些操作步骤见下图,正确的操作顺序是() A、④⑤①②③ B、①②③④⑤ C、③④①②⑤ D、②①④③⑤ 6、溶质质量分数为10%的氢氧化钠溶液100g,欲将其溶质的质量分数增大一倍,可采用的方法有() A、加入固体氢氧化钠 B、将溶液中溶剂水蒸发一半 C、加入100g10%的氢氧化钠溶液 D、蒸发掉50g水 E、加入50g40%的氢氧化钠溶液 7、将m g 硝酸钾的不饱和溶液恒温蒸发水分至有晶体析出,在此变化过程中溶液里溶质质量分数 p% 与时间t的关系正确的是()
第九单元溶液(溶质的质量分数)同步练习 1 ?溶液质量分数是表示 ___________________ 的一种方法,其数学意义是______________________ 之比。现有溶质质量分数为20%的氯化钠溶液,其20%表示的含义就是每 __________________________ g氯化钠溶液中含有_______________________ g o 2、将30g氯化钠溶于70g水中,制取氯化钠溶液,则氯化钠溶液中溶质的质量分数 3、100g 溶质质量分数为20%的硫酸溶液中含H2SO4 _____________________ g,水______________ g; 100毫升20%的硫酸溶液(密度1.14g/mL )的质量是___________________ ,其中含溶质H2SO4 _____________ g, 含溶剂水______________ g o 4、现有80g质量分数为10%的硝酸钠溶液,试回答下列问题: (1)上述硝酸钠溶液中含溶质的质量为___________________________________________ ,溶剂的质量 为_______________________ o (2 )若向上述溶液中加入20 g水,则所得溶液中溶质的质量分数 (3 )若向上述溶液中加入20 g硝酸钠,则所得溶液中溶质的质量分数 (4 )若使上述溶液中溶质的质量分数变为20% ,则应加入硝酸钠 g; (5)若使上述溶液中溶质的质量分数变为 20%,则应蒸发水________________________ g; (6)若使上述溶液中溶质的质量分数变为______ 5%,则应加水g; 5、配制一定溶质质量分数的氯化钠溶液的一些操作步骤见下图,正确的操作顺序是 ( ) ①②③④ A、④⑤①②③ B、①②③④⑤ C、③④①②⑤ 6、溶质质量分数为10%的氢氧化钠溶液100g,欲将其溶质的质量分数增大一倍,可采 用的方法有( )
溶质质量分数计算练习专题一、学习目标 知识目标: 1.理解溶质质量分数的定义,清楚公式中各个物理量的含义。 2.熟悉溶质质量分数公式,学会溶质质量分数各种类型的计算。 能力目标: 培养学生的发散思维,提高分析问题、解决问题的能力 情感目标: 了解溶液组成的定量表示在工农业生产和生活中的应用,学会利用溶质质量分数解决生产和生活中的实际问题。 重点:溶质质量分数公式的理解与应用。 难点:涉及溶液体积的计算及溶液配置中的误差分析 二、溶质质量分数计算的基本类型 1.溶质质量分数定义式及变形计算: 溶质的质量×100% 解析:溶质质量分数= 溶液的质量 溶质质量=溶液质量×溶质质量分数 溶剂质量=溶液质量—溶质质量 此类题重点考察考查对溶液质量分数定义的准确理解及根据定义式进行溶液质量、溶质质量、溶剂质量和溶质质量分数的相互换算。此类题关键是找准溶液、溶质、溶剂的质量。 例1. 对“10%的蔗糖溶液”含义的解释错误的是() A.100g水中溶解了10g蔗糖 B.将10g蔗糖溶解于90g水
中所得到的溶液 C.100g蔗糖溶液中溶解10g蔗糖 D.将蔗糖与水按1:10的质量比配成的溶液 答案:BC 变式训练1 1.判断题:(请在题后括号里打“√”或“×”) (1)在100 g水里加入20 g氯化钠,溶液中氯化钠的质量分数为20%() (2)10%的食盐溶液”表示100 g水中溶解了10 g食盐()(3)10 g硝酸钾完全溶解于90 kg水中,得到10%的硝酸钾溶液()(4)40 g 20%的NaCl溶液等分成四份,则每一份溶液中氯化钠的质量分数为5%() 2.配制400g20%的氢氧化钠溶液,需要氢氧化钠多少克?应加水多少克? 3.常温下,向100g10%的NaCl溶液中加入10g蔗糖充分溶解后,求所得溶液中NaCl的质量分数 4.80g15%的硝酸钠溶液中,加入20g硝酸钠全部溶解,求此硝酸钠溶液中溶质的质量分数。 5.80g15%的硝酸钠溶液中,加入20g水,求此硝酸钠溶液中溶质的质量分数 2.溶液的稀释: 解析:溶液稀释的计算要抓住溶液稀释前后溶质的质量不变这一关
专题训练--溶质质量分数和溶解度 一、基础知识要点: 1、 溶质质量分数概念:溶质质量与溶液质量之比,可用小数或者是百分数表示。 2、 科学上用溶质的质量分数来定量表示溶液的组成。 3、 有关计算公式:溶质质量分数=溶质质量÷溶液质量 液 质M M a % 4、 溶解度与溶质质量分数的比较 二、有关溶质质量分数基础知识专题训练; 1、食盐水的浓度5%,它表示 克溶液里有 克食盐水和 克 水。10千克这样的食盐水中含食盐 千克,含水 克。 2、 克氯化钠溶于 克水中,可制的60克5%的食盐溶液: 克
10%的氯化钠溶液蒸干可得氯化钠20克,克10%的氯化钠溶液中含水45克。 3、现有20℃时10%的硝酸钾溶液50克:(要求列式计算) ⑴加入10克硝酸钾后,其质量分数为 ⑵加入50克水后,其质量分数为 ⑶加入10克硝酸钾和15克水后,其质量分数为 ⑷蒸发掉10克水后,其质量分数为 ⑸加入20%的硝酸钾溶液50克后,其质量分数为 ⑹已知20℃时,硝酸钾的溶解度为31.6克,现加入20克硝酸钾,其饱和溶液的质量分数为 4、T℃时,将某物质a 克溶于水恰好制成V毫升饱和溶液(此时溶液密度为d克/ 厘米3)则T℃时该物质溶液为,饱和溶液质量分数为。 5、配制50克5%的氯化钠溶液,其步骤是:(1)(2)(3) 6、在一定温度下,A物质的溶解度为25克,则此温度下,该物质的饱和溶液的质量分数为 :在一定温度下,B物质的饱和溶液的溶质质量分数为40%,则此温度下,B物质的溶解度为克 7、从60克15%的食盐溶液中取出20克溶液,则这20克溶液中溶质的质量分数为 8、现将20℃100克15%的食盐溶液升温到60%时(溶液中溶质和溶剂的量不变)溶液中溶质的质量分数为:现将20℃100克15%的食盐溶液恒温蒸发水分,则溶液中溶质质量分数在(增大或减少),当溶液成为20℃时的时,溶液浓度达到最大,其最大值为(20℃时,食盐的溶解度为36克) 9、向20℃时100克食盐饱和溶液中加入3克食盐,则此时食盐中溶质的质量分数是多大? 10、已知20℃时,食盐的溶解度为36克,40克水中加入18克食盐,充分溶解后,能得到食盐溶液多少克?这种溶液的溶质质量分数为多少? 11、已知40℃,A物质饱和溶液的质量分数为40%,求A物质在40℃时的溶解度。
课题3 溶质的质量分数 5分钟训练 1.对5%的食盐溶液含义的解释错误的是( ) A.100克水中溶解了5克食盐 B.100克食盐溶液中含有5克食盐 C.将5克食盐溶于95克水中所得溶液 D.该溶液中溶质与溶液的质量比为1∶20 解析:5%的食盐溶液是指100克溶液中含有5克溶质食盐。A 项中溶液的质量分数为4.76%而不是5%。 答案:A 2.从1升10%的硫酸溶液中取出100毫升这种溶液,则100毫升硫酸溶液中溶质的质量分数为( ) A.1% B.10% C.11.1% D.9% 解析:溶液具有均一性,溶液的均一性是溶液的基本属性,与溶液的体积无关。 答案:B 3.将M 克食盐溶液蒸发掉全部水得食盐m 克,则M 克食盐溶液中溶质的质量分数为( ) A. M m ×100% B.m M m -×100% C.m M m +×100% D.M m 100×100% 解析:根据溶质和溶液的定义以及溶液质量分数的定义得M m ×100%。 答案:A 4.在100克的稀硫酸中加入质量分数为20%的硫酸溶液100克,使所得溶液的质量分数为12%,则原稀硫酸的质量分数是__________。 解析:根据溶质守恒可知,令原溶液的质量分数为x,则:(100 gx+100 g×20%)/200 g=12%,则x=4%。 答案:4% 10分钟训练 1.根据你对溶液组成的认识,判断下列说法正确的是( ) A.溶液的质量等于溶质与溶剂的质量之和 B.20 mL 浓硫酸与80 mL 水混合后得到100 mL 稀硫酸 C.20 g 氯化钠完全溶于100 g 水中,所得溶液的质量分数为20% D.20 mL 酒精放入盛有80 mL 水的烧杯中,所得酒精溶液的质量分数为20% 解析:溶液质量可以相加,溶液的体积不能相加,溶液中溶质质量分数是溶质质量与溶液质量的比值。 答案:A 2.用密度为1.03 g·cm -3,质量分数为5%的食盐溶液配制成50 g 质量分数为1%的食盐溶液,其操作顺序为( ) A.量取→溶解→计算 B.称量→溶解→计算 C.计算→称量→溶解 D.计算→量取→溶解 解析:首先进行计算,看需要密度为1.03 g·cm -3,质量分数为5%的食盐溶液的体积多少毫升,需要蒸馏水多少毫升(蒸馏水的密度为1 g·mol -1)。然后根据计算结果进行溶液的量取,最后把量取的两液体混合。即得到50 g 质量分数为1%的食盐溶液。
第十一讲 质量分数的相关计算 核心知识 1、溶质质量分数定义:溶质质量分数就是溶质质量与溶液质量的比值,其表达式为: %100?=溶液质量溶质质量 溶质质量分数或 %100?+=溶剂质量 溶质质量溶质质量 溶质质量分数 2、溶解度与饱和溶液的溶质质量分数的关系 在一定温度下,饱和溶液的溶质质量分数可由溶解度得到: %100g 100?+=溶解度溶解度 饱和溶质质量分数 3、配制一定质量分数的溶液的计算方法 配制前的溶质质量=配制后的溶质质量,有两种情况: (1)用固体配制: 固体质量=溶液质量×溶质质量分数; (2)用浓溶液配制稀溶液: 浓溶液质量×浓溶液的溶质质量分数 =稀溶液质量×稀溶液的溶质质量分数 4、化学反应中的质量分数计算,核心要点就是找准溶质,并算出溶质和溶液的质量,常用的方法就是质量守恒和由化学方程式计算。 质量分数的基本计算 1、将10.8g 固体氢氧化钠完全溶于49.2g 水,配 成密度为1.2g/cm 3 的溶液,则该溶液的质量分数为多少? 2、要配制200g 质量分数为0.9%的NaCl 溶液,需要NaCl 多少g 和H 2O 多少mL ? 3、配制980g 10%的稀硫酸需要多少mL 质量分数 为98%的浓硫酸?(98%的浓硫酸密度为1.84g/cm 3 ) 4、把200g 质量分数为10%的CaCl 2溶液稀释为4%的溶液,应该加水多少mL ? 5、已知某物质的水溶液中有90g 水,取样5g 检测,发现其中有溶质2g ,则原溶液中有溶质多少g ? 溶解度与饱和溶液的质量分数 6、已知在20o C 时氯化钠的溶解度为36g ,求20o C 时: (1)9g 氯化钠溶于25g 水中,所得溶液的质量分数; (2)12g 氯化钠溶于25g 水中,所得溶液的质量分数; (3)5g 氯化钠溶于25g 水中所得溶液的质量分数。 7、已知50o C 时氯化铵的溶解度为50g ,则此温度下1800g 氯化铵饱和溶液中含水多少g ? 8、已知硝酸钾10o C 时的溶解度为22g ,80o C 时的 溶解度为170g ,问:把一瓶10o C 时的硝酸钾饱和溶液 升温到80o C 后的溶质质量分数为多少? 9、已知硝酸钾10o C 时的溶解度为22g ,80o C 时的 溶解度为170g ,问:把一瓶80o C 时的硝酸钾饱和溶液 降温到10o C 后的溶质质量分数为多少?有多少g 固体析出? 10、已知硝酸钾10o C 时的溶解度为22g ,80o C 时 的溶解度为170g 。在10o C 时将20g 硝酸钾溶于30g 水, 再升温到80o C ,所得溶液的溶质质量分数为多少? 11、有一瓶12o C 时的硝酸铵饱和溶液,其溶质质量分数为60%,求此温度下硝酸铵的溶解度。 12、已知硝酸钾10o C 时的溶解度为22g ,80o C 时 的溶解度为170g ,问:把135g80o C 时的硝酸钾饱和溶 液降温到10o C 后的溶质质量分数为多少?有多少g 固体析出?
1. 为了测定某地石灰石中碳酸钙的质量分数,取7.5g样品放入烧杯,加入稀盐酸至恰好不再产生气体时消耗34.7g,放出的气体在常温下体积为1.1L。 (1)常温下CO2气体的密度为2.0g/L,则上述反应放出气体的质量为 g。 (2)如石灰石中的杂质均不溶于水且不与盐酸反应,计算石灰石中CaCO3的质量分数和反应所得溶液中溶质的质量分数(计算最终结果保留1位小数)。 2. 将50gCaCl2溶液与77gNa2CO3溶液混合后,恰好完全反应,过滤、洗涤、烘干后,得到10g白色固体.请计算: (1)CaCl2溶液中溶质的质量为____________g. (2)过滤后所得溶液中溶质的质量分数.(写出计算过程) 3. 某同学将一定质量的锌粒放入200g稀硫酸溶液中,恰好完全反应,并产生了0.4g氢气.计算:(1)参加反应的锌的质量. (2)所用稀硫酸溶液中溶质的质量分数 4. 黄铜是铜和锌的合金,可以用来制造机器、电器零件及日用品.为了测定某黄铜样品中铜的质量分数,取20g该样品向其中加入一定量的稀硫酸,恰好完全反应,产生氢气的质量与加入稀硫酸的质量关系如图所示.
请解答下列问题: (1)完全反应后,生成H2的质量为___________ g. (2)该黄铜样品中铜的质量分数为多少? (3)完全反应后所得溶液的溶质质量分数是多少? 5. 将铁粉和铜粉混合物7.0g,加入到盛有60.0g稀盐酸的烧杯中,恰好完全反应.此时烧杯内各物质的总质量为6 6.8g.试计算: (1)原混合物中铁粉的质量分数.(精确到0.1%) (2)反应后所得溶液中溶质的质量分数.(精确到0.1%) 6. 为测定某黄铜样品中锌的含量,某同学称取20g黄铜(铜和锌的合金)样品于烧杯中,向其中加入稀硫酸至不再产生气泡为止,共消耗100g质量分数为9.8%的稀硫酸,请计算:(1)该黄铜样品中锌的质量. (2)反应后所得溶液的溶质质量分数(计算结果保留0.1%). 7. 已知氯化钠溶液和硝酸银溶液反应生成氯化银(AgCl〕沉淀和硝酸钠溶液.为测定某氯化钠溶液的溶质质量分数,将该溶液与一定量的硝酸银溶液混合,恰好完全反应,有关实验数据如表:
第九单元溶液(溶质的质量分数)同步练习 1.溶液质量分数是表示的一种方法,其数学意义是之比。现有溶质质量分数为20%的氯化钠溶液,其20%表示的含义就是每g 氯化钠溶液中含有g。 2、将30g氯化钠溶于70g水中,制取氯化钠溶液,则氯化钠溶液中溶质的质量分数是。 3、100g 溶质质量分数为20%的硫酸溶液中含H2SO4g,水g;100毫升20%的硫酸溶液(密度 1.14g/mL)的质量是,其中含溶质H2SO4 g,含溶剂水g。 4、现有80g 质量分数为10% 的硝酸钠溶液,试回答下列问题: (1)上述硝酸钠溶液中含溶质的质量为,溶剂的质量为。 (2)若向上述溶液中加入20 g 水,则所得溶液中溶质的质量分数为; (3)若向上述溶液中加入20 g 硝酸钠,则所得溶液中溶质的质量分数为; (4)若使上述溶液中溶质的质量分数变为20%,则应加入硝酸钠g; (5)若使上述溶液中溶质的质量分数变为20%,则应蒸发水g; (6)若使上述溶液中溶质的质量分数变为5%,则应加水g;5、配制一定溶质质量分数的氯化钠溶液的一些操作步骤见下图,正确的操作顺序是() A、④⑤①②③ B、①②③④⑤ C、③④①②⑤ D、②①④③⑤ 6、溶质质量分数为10%的氢氧化钠溶液100g,欲将其溶质的质量分数增大一倍,可采用的方法有() A、加入固体氢氧化钠12.5g B、将溶液中溶剂水蒸发一半 C、加入100g10%的氢氧化钠溶液 D、蒸发掉50g水 E、加入50g40%的氢氧化钠溶液 7、将m g 硝酸钾的不饱和溶液恒温蒸发水分至有晶体析出,在此变化过程中溶液里溶质质量分数p% 与时间t的关系正确的是() 8、在45g20%的KCl 溶液中加入8g KCl后再加入14g水,所得溶液恰好为20℃的饱和溶液,则所得溶液中溶质的质量分数为。 9、下图是某同学配制一定质量的0.9%生理盐水的全过程: (1)请找出上图中的错误: ①;②。 (2)如果配制的生理盐水中NaCl 的质量分数小于0.9%,则可能造成误差的原因有(至少举出三点) ①②③ 10、汽车、电机车一般要使用铅酸蓄电池。某铅酸蓄电池用的酸溶液是溶质质量分 t p% A t p% B t p% C t p% D
初中化学溶质质量分数计算题题型和解决方法 一、直接利用公式法 例题1、40 克氯化钠投入100 克水中完全溶解后剩余固体 4 克,求此时该溶液中溶质的质量分数。 例题2、20克明矾晶体(化学式是KAl(SO4)2?12H2O )投入100 克水中完全溶解,求所得溶液中溶质的质量分数。 例题3、已知氧化钠和水反应生成氢氧化钠( Na2O+H2O=2NaOH ),问把3.1 克氧化钠加入50 克水中,形成溶液中溶质的质量分数。 例题4、已知某温度时氢氧化钙的溶解度为0.18 克,氧化钙和水反应生成氢氧化钙 ( CaO+H 2O=Ca(OH) 2 ),问把5.6 克氧化钙加入50 克水中,形成溶液中溶质的质量分数。 二、利用公式直接求溶质或者溶剂 例题5、欲配制溶质的质量分数浓度为2%AgNO3 溶液500 克,应称取AgNO3 多少克?加入水多少毫升? 思考:溶液配制的三个步骤是什么? 三、溶液的稀释 例题6、溶质质量分数为98% 浓硫酸500 克,加多少水可以配制成溶质质量分数为20%的稀硫酸。 例题7、配制溶质的质量分数浓度为20% ,溶液密度为1.14 克/厘米3,体积为500 毫升的稀硫酸,需要量取溶质的质量分数浓度为98% ,密度为1.84 克/厘米3的浓硫酸多少毫升?四、两液相混 例题8、10% 的氢氧化钠溶液与20%的氢氧化钠溶液等质量混合,问所得溶液中溶质的质量分数。 例题9、50 克10%的氢氧化钠溶液与200 克20% 的氢氧化钠溶液混合,问所得溶液中溶质的质量分数。 五、溶液的增浓例题10、10 克20%的硫酸钠溶液中含有溶质多少,溶剂多少?欲使 10 克20% 的硫酸钠溶液浓度增加一倍,应该:
溶质的质量分数的计算 (1)例1 向质量分数为20%的氯化钠溶液中,再加入3克氯化钠和12克水,所得溶液中溶质的质量分数是() A.25% B.20.5% C.20% D.无法求解 常见错误:一般认为20%的氯化钠溶液质量未知,不易求出混合后溶质和溶液的总质量,故此题无解,选D。 分析:抛开20%的氯化钠溶液,先求出3克氯化钠溶于12克水中所得溶液的溶质质量分数=(3/12+3)×100%=20%。相同质量分数的同一溶液混合其溶质质量分数仍然不变。故正确答案为:C (2)结晶水合物溶于水 例2把25g胆矾(CuSO4·5H2O)全部溶于175g水中,求溶液的溶质质量分数。 分析:结晶水合物溶于水后,其中的结晶水成为溶剂的一部分,溶质的质量只是水合物中所含的无水化合物的质量。 解:25g胆矾中含无水CuSO4的质量是: 25g×(CuSO4/CuSO4·5H2O)=25g×(160/250)=16g 溶液的溶质质量分数=[16/(25+175)]×100%=8% 答:略。 (3)与溶剂水反应 例3将4gSO3溶于46g水中,计算所得溶液的溶质质量分数。 分析:由于得到的溶液并非是原物质的溶液,而是反应后生成的新物质的溶液,所以解题时,必须先根据反应的化学方程式计算出溶质的质量,然后再求其质量分数。 解:设SO3与水反应生成H2SO4的质量为x SO3+H2O=H2SO4 80 98 4g x
x=4.9g 溶液的溶质质量分数=[4.9/(4+46)]×100%=9.8% (4)两两反应有气体或沉淀生成 例4 2.4g镁恰好与47.6g稀硫酸完全反应,求所得溶液的溶质质量分数。 分析:解这类试题要特别注意二点:一是溶质的质量要根据化学方程式计算得到;二是溶液的质量等于两反应物的质量之和减去反应生成的气体或沉淀的质量。 解:设生成MgSO4和H2的质量分别为x、y。 Mg+H2SO4=MgSO4+H2↑ 24120 2 2.4g x y 得x=12g y=0.2g MgSO4的质量分数=[12/(2.4+47.6-0.2)]×100%=24.1% 答:略。
专题训练--溶质质量分数和溶解度 一、基础知识要点: 1、 溶质质量分数概念:溶质质量与溶液质量之比,可用小数或者是百分数表示。 2、 科学上用溶质的质量分数来定量表示溶液的组成。 3、 有关计算公式:溶质质量分数=溶质质量÷溶液质量 液 质M M a % 4、 二、有关溶质质量分数基础知识专题训练; 1、食盐水的浓度5%,它表示 克溶液里有 克食盐水和 克水。10千克这样的食盐水中含食盐 千克,含水 克。 2、 克氯化钠溶于 克水中,可制的60克5%的食盐溶液: 克10%的氯化钠溶液蒸干可得氯化钠20克, 克10%的氯化钠溶液中含水45克。 3、现有20℃时10%的硝酸钾溶液50克:(要求列式计算) ⑴ 加入10克硝酸钾后,其质量分数为 ⑵ 加入50克水后,其质量分数为 ⑶ 加入10克硝酸钾和15克水后,其质量分数为 ⑷ 蒸发掉10克水后,其质量分数为 ⑸ 加入20%的硝酸钾溶液50克后,其质量分数为 ⑹ 已知20℃时,硝酸钾的溶解度为31.6克 ,现加入20克硝酸钾,其饱和溶液的质量分数为 4、T ℃时,将某物质a 克溶于水恰好制成V 毫升饱和溶液(此时溶液密度为d 克/ 厘米3)则T ℃时该物质溶液 为 ,饱和溶液质量分数为 。 5、配制50克5%的氯化钠溶液,其步骤是:(1) (2) (3) 6、在一定温度下,A 物质的溶解度为25克,则此温度下,该物质的饱和溶液的质量分数为 :在一定温度下,B 物质的饱和溶液的溶质质量分数为40%,则此温度下,B 物质的溶解度为 克 7、从60克15%的食盐溶液中取出20克溶液,则这20克溶液中溶质的质量分数为 8、现将20℃100克15%的食盐溶液升温到60%时(溶液中溶质和溶剂的量不变)溶液中溶质的质量分数