选修四第四章电化学基础测试题
高二化学选修四《电化学基础》复习检测试题 可能用到的相对原子质量:H:1 C:12 N:14 O:16 Cu:64 Ag:108 第I卷(选择题共51分) 一、选择题(本题包括17小题,每题只有一个选项符合题意,每题3分共51分)1.下列金属防腐的措施中,属于牺牲阳极的阴极保护法的是( ) A.水中的钢闸门连接电源的负极 B.金属护拦表面涂漆 C.汽水底盘喷涂高分子膜 D.地下钢管连接锌板 2.下列叙述正确的是( ) A.电镀时,通常把待镀的金属制品作阳极 B.氯碱工业是电解熔融的NaCl,在阳极能得到Cl 2 C.氢氧燃料电池(酸性电解质)中O 2通入正极,电极反应为O 2 +4H++4e- ===2H 2 O D.下图中电子由Zn极流向Cu,盐桥中的Cl-移向CuSO 4 溶液 3.下列有关电化学的示意图中正确的是( ) 4.用铁丝、铜丝和CuSO 4 正确的是( ) A.构成原电池时Cu极反应为:Cu—2e =Cu2+ B.构成电解池时Cu极质量可能减少也可能增加 C.构成电解池时Fe极质量一定减少 D.构成的原电池或电解池工作后就可能产生大量气体 Fe Cu
5.如图,将纯Fe棒和石墨棒插入1 L饱和NaCl溶液中。下列说法正确的是A.M接负极,N接正极,当两极产生气体总量为22.4 L(标准状况) 时,生成1 mol NaOH B.M接负极,N接正极,在溶液中滴人酚酞试液,C电极周围溶液变红 C.M接负极,N接正极,若把烧杯中溶液换成1 L CuSO 4 溶液,反 应一段时间后,烧杯中产生蓝色沉淀 D.M接电源正极,N接电源负极,将C电极换成Cu电极,电解质溶 液换成CuSO 4 溶液,则可实现在铁上镀铜 6.为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,铝表面的氧化膜增厚。其反应原理如下: 电池:Pb(s)+PbO 2(s)+2H 2 SO 4 (aq)=2PbSO 4 (s)+2H 2 O(l) 电解池:2Al+3H 2O Al 2 O 3 +3H 2 电池电解池 A H+移向Pb电极H+移向Pb电极 B 每消耗3molPb 生成2molAl 2O 3 C 正极:PbO 2+4H++2e=Pb2++2H 2 O 阳极:2Al+3H 2 O-6e=Al 2 O 3 +6H+ D 7 极b和d上没有气体逸出,但质量均增大,且增重b<d。 选项X Y A.MgSO 4CuSO 4 B.AgNO 3Pb(NO 3 ) 2 C.FeSO 4 Al 2 (SO 4 ) 3 D.CuSO 4AgNO 3 8 2O 7 2-)时,以铁板作阴、阳极,处理 过程中存在反应Cr 2O 7 2+6Fe2++14H+=2Cr3++6Fe3++7H 2 O,最后Cr3+以Cr(OH) 3 形式除 去,说法不正确 ...的是 A.阳极反应为Fe-2e-=Fe2+ B.电解过程中溶液pH不会变化 C.过程中有Fe(OH) 3沉淀生成 D.电路中每转移12mol电子,最多有 Fe C 饱和NaCl溶液 电源 M N
化学选修4电化学基础导学案
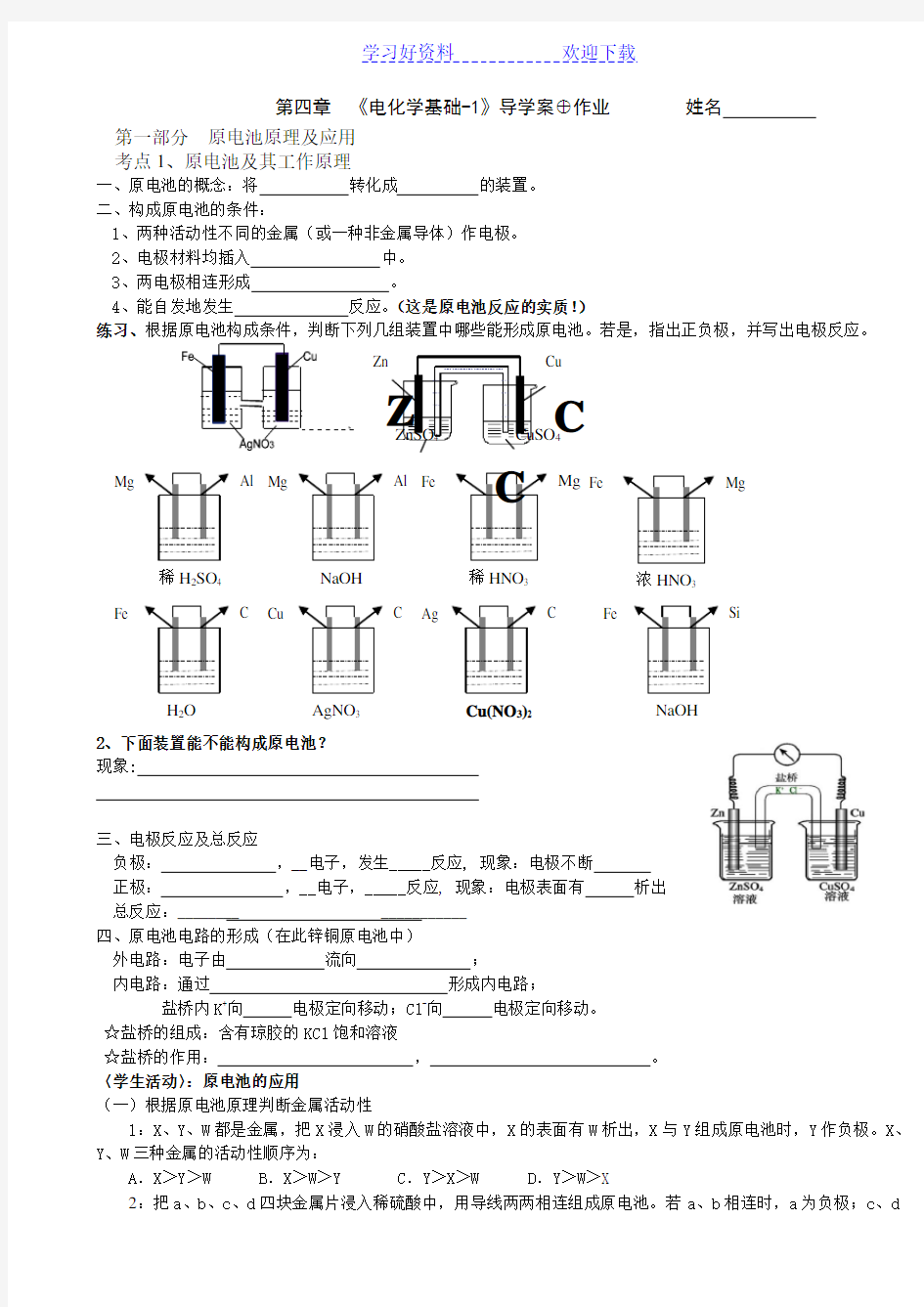
第四章电化学基础 第一节原电池 教学目标:知识与技能: 1、了解原电池原理; 2、掌握原电池正、负极的判断及构成原电池的条件; 3、理解铜锌原电池的原理与结构,初步学会制作水果电池。 过程与方法: 1、培养学生的探究精神和依据实验事实得出结论的科学方法; 2、培养学生的观察能力; 3、培养学生的实验设计能力。 教学重点:原电池原理 教学难点:原电池设计 基础知识预备: 1、原电池是将转化为的装置。其本质是原理的应用。 2、判断下列装置为原电池的是: 镁铜 稀H2SO4 稀H2SO4 稀H2SO4 稀H2SO4 稀H2SO4 稀H2SO4 NaOH溶液 E F G 小结:构成原电池的4个条件是: ⑴________________________________________________________________________ ⑵ ________________________________________________________________________ ⑶ _______________________________________________________________________ ⑷___________________________________________________________________________ 3、写出上图中原电池的电极反应式和总反应式: ______________________________________________________________________ ______________________________________________________________________ 〈〉 找规律,小结:①负极产生阳离子或消耗阴离子, 正极〈〉产生阴离子或消耗阳离子 ②注意溶液的酸碱性,适当在电极反应式两边添加___________、________、或 ___________,以遵循电荷守恒和质量守恒。 [自主学习]:一、盐桥在原电池工作中的应用
1-定积分与微积分基本定理(理)含答案版
定积分与微积分基本定理(理) 基础巩固强化 1.求曲线y =x 2与y =x 所围成图形的面积,其中正确的是( ) A .S =?? ?0 1(x 2-x )d x B .S =?? ?0 1 (x -x 2)d x C .S =?? ?0 1 (y 2-y )d y D .S =??? 1 (y - y )d y [答案] B [分析] 根据定积分的几何意义,确定积分上、下限和被积函数. [解析] 两函数图象的交点坐标是(0,0),(1,1),故积分上限是1,下限是0,由于在[0,1]上,x ≥x 2,故函数y =x 2与y =x 所围成图 形的面积S =?? ?0 1 (x -x 2)d x . 2.如图,阴影部分面积等于( ) A .2 3 B .2-3 [答案] C [解析] 图中阴影部分面积为
S =??? -3 1 (3-x 2 -2x )d x =(3x -1 3x 3-x 2)|1 -3=32 3. 4-x 2d x =( ) A .4π B .2π C .π [答案] C [解析] 令y =4-x 2,则x 2+y 2=4(y ≥0),由定积分的几何意义知所求积分为图中阴影部分的面积, ∴S =1 4×π×22=π. 4.已知甲、乙两车由同一起点同时出发,并沿同一路线(假定为直线)行驶.甲车、乙车的速度曲线分别为v 甲和v 乙(如图所示).那么对于图中给定的t 0和t 1,下列判断中一定正确的是( ) A .在t 1时刻,甲车在乙车前面 B .在t 1时刻,甲车在乙车后面 C .在t 0时刻,两车的位置相同 D .t 0时刻后,乙车在甲车前面 [答案] A [解析] 判断甲、乙两车谁在前,谁在后的问题,实际上是判断在t 0,t 1时刻,甲、乙两车行驶路程的大小问题.根据定积分的几何意义知:车在某段时间内行驶的路程就是该时间段内速度函数的定积
《电化学基础》考题分析与解题方法
《电化学基础》考题分析与解题方法 广州市真光中学化学科王国强 一、课程标准、考试说明的要求 新课程内容标准新课程活动 与探究建议 2010年广东省高考 考试说明要求 1.体验化学能与电能相互转化的探究过程,了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。2.通过查阅资料了解常见化学电源的种类及其工作原理,认识化学能与电能相互转化的实际意义及其重要应用。 3.能解释金属发生电化学腐蚀的原因,认识金属腐蚀的危害,通过实验探究防止金属腐蚀的措施。①实验探究:电能与 化学能的相互转化。 ②调查市场常见化学 电池的种类,讨论它 们的工作原理、生产 工艺和回收价值。 ③查阅资料并交流: 防止钢铁腐蚀的方 法。 1. 了解原电池和电解池 的工作原理,能写出电极 反应和电池反应方程式。 了解常见化学电源的种 类及其工作原理。 2.理解金属发生电化学 腐蚀的原因,金属腐蚀的 危害,防止金属腐蚀的措 施。 二、近三年高考有关电化学知识考题分析 从新课程实验省(如山东、宁夏、广东、海南、江苏、天津等)近三年化学考题分析,其中考查原电池、电解池原理及电化学腐蚀的考题有19题,全国所有省份2009年高考题就有20题之多,可见这部分知识重要性。 (一)原电池及原理其综合考查 1、在书本锌铜原电池原理基础上稍有变化的原电池:从原电池的组成、电极反应(或原电 池反应)、电流方向(或电子流向)、盐桥的作用等多方面来考查原电池的基本原理,在多年来高考题中时有出现,体现了对基础知识和能力的考查。如(09福建卷11)(08年广东化学·5)(07年海南卷第14题)有盐桥的铜银电池;(07年宁夏理综·26)锌银原电池工作原理与阿伏伽德罗常数关系;(07年山东理综·29)简单原电池设计。(见附件1)【复习建议】高考命题的原则是万变不离其宗,无论谁命题考查的都是教材的核心知识内容。必须抓好基础,重视课本,重视主干知识,逐一过关。同样是重点知识内容,复习方法可以有所不同。电化学部分知识是学生易弄错易弄混的难点知识内容。学习和复习的过程中都不能赶进度,也不能搞“题海战术”。要引导学生认真阅读教材,深入思考核心知识内容,最关键的知识内容一定要让学生自己理解记忆,而不是死记硬背。学生把难点真正“消化”了就可以做到一通百通,题目再怎么变换形式,学生也能会答,而不用老师讲个面面俱道。复习
电化学基础练习题及答案
第11章氧化还原反应电化学基础 一、单选题 1. 下列电对中,θ值最小的是:D A: Ag+/Ag;B: AgCl/Ag;C: AgBr/Ag;D: AgI/Ag 2. θ(Cu2+/Cu+)=,θ(Cu+/Cu)=,则反应2 Cu+Cu2+ + Cu的Kθ为:C A: ×10-7;B: ×1012;C: ×106;D: ×10-13 3. 已知θ(Cl2/ Cl-)= +,在下列电极反应中标准电极电势为+ 的电极反应是:D A:Cl2+2e- = 2Cl- B: 2 Cl-- 2e- = Cl2C:1/2 Cl2+e-=Cl- D:都是 4. 下列都是常见的氧化剂,其中氧化能力与溶液pH 值的大小无关的是:D A: K2Cr2O7 B: PbO2C: O2D: FeCl3 5. 下列电极反应中,有关离子浓度减小时,电极电势增大的是:B A: Sn4+ + 2e- = Sn2+ B: Cl2+2e- = 2Cl- C: Fe - 2e- = Fe2+ D: 2H+ + 2e- = H2 6. 为防止配制的SnCl2溶液中Sn2+被完全氧化,最好的方法是:A A: 加入Sn 粒B:. 加Fe 屑C: 通入H2D: 均可 二、是非题(判断下列各项叙述是否正确,对的在括号中填“√”,错的填“×”) 1. 在氧化还原反应中,如果两个电对的电极电势相差越大,反应就进行得越快。 ×(电极电势为热力学数据,不能由此判断反应速率)2.由于θ(Cu+/Cu)= + , θ(I2/ I-)= + , 故Cu+和I2不能发生氧化还原反应。×(标态下不反应,改变浓度可反应。) 3.氢的电极电势是零。×(标准电极电势) 4.FeCl3,KMnO4和H2O2是常见的氧化剂,当溶液中[H+]增大时,它们的氧化能力都增加。×(电对电极电势与PH无关的不变化。) 三、填空题
高三复习电化学学案
第六章第2讲电化学基础 【复习重点】 1.掌握原电池和电解池的工作原理,能写出电极反应和电池反应方程式。 2.了解常见化学电源的种类及其工作原理。 3.理解金属发生电化学腐蚀的原因,掌握一般防护方法,能区别化学腐蚀与电化学腐蚀。4.掌握铜的电解精炼、电镀铜、氯碱工业等反应原理。 【知识梳理】 一、原电池 1.定义:___________________________________________________。 2.组成原电池的条件:_________________;______________;___________________。 3.原电池的工作原理: (1)以Zn---Cu(H2SO4)设计的不带盐桥的原电池 负极:作负极,负极发生反应 电极反应式: 正极:作正极,正极发生反应 电极反应式: 总反应式: 电子流向:外电路中电子由到 溶液中离子移动方向: (2)依据氧化还原反应:2Ag+(aq) +Cu(s)=Cu2+(aq) +2Ag(s)设计的带盐桥的原电池 负极:作负极,负极发生 电极反应式: 正极电解质溶液为:,正极发生 电极反应式: 电子流向:外电路中电子由到 盐桥中离子移动方向: 4.原电池正负极判断方法; (1) 根据电极材料判断: (2)根据电子的流向判断: (3)根据发生的反应类型判断: (4)根据反应现象判断:
(5)根据给出的方程式判断: (6) 根据溶液中阴、阳离子的定向移动判断: 5.电极反应式的书写: (1)先确定原电池的正负极,列出正负极上的反应物质,并标出相同数目电子的得失。(2)注意负极反应生成的阳离子与电解质溶液中的阴离子是否共存。若不共存,则该电解质溶液中的阴离子应写入负极反应式。 (3)若正极上的反应物质是O2,且电解质溶液为中性或碱性,电极反应式中不能出现H+,且水必须写入正极反应式中,与O2结合生成OH-,若电解质溶液为酸性,电极反应式中不能出现OH-,且H+必须写入正极反应式中,与O2结合生成水。 (4)正负极反应式相加(电子守恒)得到电池反应的总反应式。若已知电池反应的总反应式,可先写出较易书写的电极反应式,然后在电子守恒的基础上,总反应式减去较易写出的电极反应式,即得到较难写出的电极反应式 (5)对于可逆电池反应,需要看清楚―充电、放电‖的方向,放电过程是体现原电池原理, 充电过程是体现电解池原理。 【练习】 1)如下图所示,用Mg和Al组成一个原电池. (1)当电解质溶液为稀硫酸时: ① Mg电极是____极,其电极反应式为,该反应是_____反应; ②Al电极是____极,其电极反应式为,该反应是_____反应. (2)当电解质溶液为NaOH溶液时: ①Mg电极是_____极,其电极反应式为,该反应是_____反应. ②Al电极是_____极,其电极反应式为,该反应是_____反应. 2)氢氧燃料电池一般是以惰性金属铂(Pt)或石墨做电极材料,负极通入H2,正极通入O2,总反应为:2H2 + O2 === 2H2O (1)电解质是KOH溶液(碱性电解质) 负极:正极: (2)电解质是H2SO4溶液(酸性电解质) 负极:正极:
微积分基本定理导学案
微积分基本定理导学案 【学习要求】 1.直观了解并掌握微积分基本定理的含义. 2.会利用微积分基本定理求函数的积分. 【学法指导】 微积分基本定理不仅揭示了导数和定积分之间的内在联系,而且还提供了计算定积分的一种有效方法. 【知识要点】 1.微积分基本定理:如果f(x)在区间[a,b]上可积,并且_________,那么?b a f(x)d x =. 2.定积分和曲边梯形面积的关系 设曲边梯形在x轴上方的面积为S上,x轴下方的面积为S下,则 (1)当曲边梯形的面积在x轴上方时,如图(1),则?b a f(x)d x=. (2)当曲边梯形的面积在x轴下方时,如图(2),则?b a f(x)d x=_______. (3)当曲边梯形的面积在x轴上方、x轴下方均存在时,如图(3),则?b a f(x)d x=,若S上=S下,则?b a f(x)d x=. 【问题探究】 探究点一微积分基本定理 问题1如下图,一个做变速直线运动的物体的运动规律是y=y(t),并且y(t)有连续的导数,由导数的概念可知,它在任意时刻t的速度v(t)=y′(t).设这个物体在时间段[a,b]内的位移为s,你能分别用y(t),v(t)表示s吗? 问题2对一个连续函数f(x)来说,是否存在唯一的F(x),使F′(x)=f(x)? 例1计算下列定积分:
(1)?211x d x ; (2)?31(2x -1x 2)d x ; (3)?0-π(cos x -e x )d x . 跟踪训练1 计算下列定积分: (1)?1025x 4d x ; (2)?31(x +1x )26x d x . 探究点二 分段函数的定积分 例2 已知函数f (x )=????? sin x ,0≤x ≤π2,1,π2≤x ≤2,x -1,2≤x ≤4. 先画出函数图象,再求这个函数在[0,4]上的定积分. 跟踪训练2 (1)设f (x )=????? x 2, x ≤0,cos x -1, x >0, 求?1-1f (x )d x ; (2)求?a -a x 2d x (a >0). 探究点三 定积分的应用 例3 计算下列定积分:?π0sin x d x ,?2ππsin x d x ,?2π0 sin x d x .由计算结果你能发现什么结论?试利用曲边梯形的面积表示所发现的结论. 跟踪训练3 求曲线y =sin x 与直线x =-π2,x =54 π,y =0所围图形的面积(如图所示). 【当堂检测】 1. (1+cos x )d x 等于 ( ) A .π B .2 C .π-2 D .π+2 2.若?a 1(2x +1x )d x =3+ln 2,则a 的值是 ( ) A .5 B .4 C .3 D .2 3.?20(x 2-23x )d x =_______ 4.已知f (x )=??? 4x -2π,0≤x ≤π2, cos x ,π2 电化学基础复习题
选择题满分策略第一篇专题六电化学基础复习 题 1.(2017·全国卷Ⅰ,11)支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( ) A.通入保护电流使钢管桩表面腐蚀电流接近于零 B.通电后外电路电子被强制从高硅铸铁流向钢管桩 C.高硅铸铁的作用是作为损耗阳极材料和传递电流 D.通入的保护电流应该根据环境条件变化进行调整 答案 C 解析钢管桩接电源的负极,高硅铸铁接电源的正极,通电后,外电路中的电子从高硅铸铁(阳极)流向正极,从负极流向钢管桩(阴极),A、B正确;C项,题给信息高硅铸铁为“惰性辅助阳极”不损耗,错误。 2.(2017·全国卷Ⅱ,11)用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4-H2C2O4混合溶液。下列叙述错误的是( ) A.待加工铝质工件为阳极
B.可选用不锈钢网作为阴极 C.阴极的电极反应式:Al3++3e-===Al D.硫酸根离子在电解过程中向阳极移动 答案 C 解析A项,根据电解原理可知,Al要形成氧化膜,化合价升高失电子,因此铝为阳极,正确;B项,阴极仅作导体,可选用不锈钢网,且不锈钢网接触面积大,能增加电解效率,正确;C项,阴极应为氢离子得电子生成氢气,错误;D 项,电解时,阴离子移向阳极,正确。 3.(2017·全国卷Ⅲ,11)全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为16Li+ xS8===8Li2Sx(2≤x≤8)。下列说法错误的是( ) A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-===3Li2S4 B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g C.石墨烯的作用主要是提高电极a的导电性 D.电池充电时间越长,电池中Li2S2的量越多 答案 D
电化学基础导学案
Zn Cu × 专题二电化学基础强化 第一节原电池 一、学习目标体验化学能与电能相互转化的过程 二、学习重点初步认识原电池概念、原理、组成及应用。 三、学习难点 通过对原电池实验的研究,从电子转移角度理解化学能向电能转化的本质,以及这种转化的综合利用价值。 四、学习过程【温习旧知】 1、原电池是______________________的装置。原电池反应的本质是_______________ 反应。 2、如右图所示,组成的原电池: (1)当电解质溶液为稀H2S O4时:Z n电极是____(填“正”或“负”)极,其电极 反应为_______________,该反应是______(填“氧化”或“还原”,下同)反应;C u 电极是______极,其电极反应为_______________,该反应是_________反应。 (2)当电解质溶液为C u S O4溶液时:Z n电极是____极,其电极反应为_____________, 该反应是________反应;C u电极是____极,其电极反应为_______________,该反应_________反应. 3、原电池原理: 填写页表中的空白 【学习新知】 一、对锌铜原电池工作原理的进一步探究 【思考与交流】上图是我们在必修2中学习过的将锌片和铜片置于稀硫酸的原电池,如果用它做电源,不但效率低,而且时间稍长电流就很快减弱,因此不适合实际应用。这是什么原因造成的呢?有没有什么改进措施?原因: 改进措施: 【自学指导一】观察实验4-1,说出实验现象。 【思考与交流】改进后的装置为什么能够持续、稳定的产生电流?盐桥在此的作用是什么?[附:盐桥制法:1)将热的琼胶溶液倒入U形管中(注意不要产生裂隙),将冷却后的U形管浸泡在K C l或N H4N O3的饱和溶液中即可。2)将K C l或N H4N O3的饱和溶液装入U形管,用棉花都住管口即可] 产生持续、稳定的电流的原因
微积分基本定理教案
1.6微积分基本定理 一:教学目标 知识与技能目标 通过实例,直观了解微积分基本定理的内容,会用牛顿-莱布尼兹公式求简单的定积分 过程与方法 通过实例探求微分与定积分间的关系,体会微积分基本定理的重要意义 情感态度与价值观 通过微积分基本定理的学习,体会事物间的相互转化、对立统一的辩证关系,培养学生辩证唯物主义观点,提高理性思维能力。 二:教学重难点 重点:通过探究变速直线运动物体的速度与位移的关系,使学生直观了解微积分基本定理 的含义,并能正确运用基本定理计算简单的定积分。 难点:了解微积分基本定理的含义 三:教学过程: 1、知识链接: 定积分的概念: 用定义计算的步骤: 2、合作探究: ⑴导数与积分的关系; 我们讲过用定积分定义计算定积分,但其计算过程比较复杂,所以不是求定积分的一般方法。有没有计算定积分的更直接方法,也是比较一般的方法呢? 下面以变速直线运动中位置函数与速度函数之间的联系为例: 设一物体沿直线作变速运动,在时刻t 时物体所在位置为S(t),速度为v(t)(()v t o ≥), 则物体在时间间隔12[,]T T 内经过的路程可用速度函数表示为2 1()T T v t dt ?。 另一方面,这段路程还可以通过位置函数S (t )在12[,]T T 上的增量12()()S T S T -来表达,即 2 1()T T v t dt ?=12()()S T S T - 而()()S t v t '=。 说出你的发现 ⑵ 微积分基本定理 对于一般函数()f x ,设()()F x f x '=,是否也有 ()()()b a f x dx F b F a =-?? 若上式成立,我们就找到了用()f x 的原函数(即满足()()F x f x '=)的数值差()()F b F a -来计算()f x 在[,]a b 上的定积分的方法。 设()()F x f x '=则在[,]a b 上,⊿y=()()F b F a - 将[,]a b 分成n 等份,在第i 个区间[x i-1,x i ]上,记⊿yi=F(x i )-F(x i-1),则 ⊿y=∑⊿y i 如下图,因为⊿h i =f(x i-1) ⊿x 而⊿y i ≈⊿h i 所以 ⊿y ≈∑⊿h i =∑f(x i-1) ⊿x 故
电化学基础测试题一
第四章《电化学基础》测试题(一) 原子量:Cu-64 Ag-108 N-14 H-1 O-16 一、选择题(每题只有一个正确选项符合题意,每题3分,共9题27分) 1、锌锰干电池在放电时,电池总反应方程式可以表示为: Zn+2MnO 2+2NH 4+ Zn 2++Mn 2O 3+2NH 3+H 2O 此电池放电时,正极上发生反应的物质是( ) A .Zn B .碳棒 C .MnO 2和NH 4+ D .Zn 2+和NH 4+ 2、在铁制品上镀上一定厚度的锌层,以下设计方案正确的是( ) A .锌作阳极,镀件作阴极,溶液含有锌离子 B .铂作阴极,镀件作阳极,溶液含有锌离子 C .铁作阳极,镀件作阴极,溶液含有亚铁离子 D .锌用阴极,镀件作阳极,溶液含有锌离子 3、关于如图所示装置的叙述,正确..的是( ) A .锌是负极,锌片上有气泡产生 B .铜片质量逐渐减少 C .电流从锌片经导线流向铜片 D .氢离子在铜片表面被还原 4、X 、Y 、Z 、M 代表四种金属元素。金属X 和Z 用导线连接放入稀硫酸中时,Z 极上有H 2放出;若电解Y 2+和Z 2+共存的溶液时,Y 先析出;又知M 2+的氧化性强于Y 2+。则这四种金属的活动性由强到弱的顺序为( ) A . X>Z>Y>M B . X>Y>Z>M C . M>Z>X>Y D . X>Z>M>Y 5、用石墨为电极材料电解时,下列说法正确的是( ) A .电解NaOH 溶液时,溶液浓度将减小,pH 不变 B .电解H 2SO 4溶液时,溶液浓度将增大,pH 不变 C .电解Na 2SO 4溶液时,溶液浓度将增大,pH 不变 D .电解NaCl 溶液时,溶液浓度将减小,pH 不变 6、银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为: 2Ag+Zn(OH)2 Ag 2O+Zn+H 2O ,在此电池放电时,负极上发生反应的物质是( ) A .Ag B .Zn(OH)2 C .Ag 2O D.Zn 7、下列各变化中属于原电池反应的是( ) A .在空气中金属铝表面迅速氧化形成保护层 B .镀锌铁表面有划损时,也能阻止铁被氧化 C .红热的铁丝与冷水接触,表面形成蓝黑色保护层 D .浓硝酸比稀硝酸更能氧化金属铜 8、100mL 浓度为2mol/L 的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的 量,可采用的方法是( ) A . 加入适量的6mol/L 的盐酸 B . 加入数滴氯化铜溶液 C . 加入适量蒸馏水 D . 加入适量的氯化钠溶液 9、在外界提供相同电量的条件,Cu 2+或Ag +分别按Cu 2++2e →Cu 或Ag ++e →Ag 在电极上放电, 充电 放电
高三复习电化学学案
第六章 第2讲 电化学基础 【复习重点】 1.掌握原电池和电解池的工作原理,能写出电极反应和电池反应方程式。 2.了解常见化学电源的种类及其工作原理。 3.理解金属发生电化学腐蚀的原因,掌握一般防护方法,能区别化学腐蚀与电化学腐蚀。 4.掌握铜的电解精炼、电镀铜、氯碱工业等反应原理。 【知识梳理】 一、原电池 1.定义:___________________________________________________。 2.组成原电池的条件:_________________;______________;___________________。 3.原电池的工作原理: (1)以Zn---Cu (H 2SO 4)设计的不带盐桥的原电池 负极: 作负极,负极发生 反应 电极反应式: 正极: 作正极,正极发生 反应 电极反应式: 总反应式: 电子流向:外电路中电子由 到 溶液中离子移动方向: (2)依据氧化还原反应:2Ag +(aq) +Cu(s)=Cu 2+ (aq) +2Ag(s)设计的带盐桥的原电池 负极: 作负极,负极发生 电极反应式: 正极电解质溶液为: ,正极发生 电极反应式: 电子流向:外电路中电子由 到 盐桥中离子移动方向: 学案 班级: 姓名: 组题人: 刘红林 审核人:
4.原电池正负极判断方法; (1) 根据电极材料判断: (2)根据电子的流向判断: (3)根据发生的反应类型判断: (4)根据反应现象判断: (5)根据给出的方程式判断: (6) 根据溶液中阴、阳离子的定向移动判断: 5.电极反应式的书写: (1)先确定原电池的正负极,列出正负极上的反应物质,并标出相同数目电子的得失。(2)注意负极反应生成的阳离子与电解质溶液中的阴离子是否共存。若不共存,则该电解质溶液中的阴离子应写入负极反应式。 (3)若正极上的反应物质是O2,且电解质溶液为中性或碱性,电极反应式中不能出现H+,且水必须写入正极反应式中,与O2结合生成OH-,若电解质溶液为酸性,电极反应式中不能出现OH-,且H+必须写入正极反应式中,与O2结合生成水。 (4)正负极反应式相加(电子守恒)得到电池反应的总反应式。若已知电池反应的总反应式,可先写出较易书写的电极反应式,然后在电子守恒的基础上,总反应式减去较易写出的电极反应式,即得到较难写出的电极反应式 (5)对于可逆电池反应,需要看清楚“充电、放电”的方向,放电过程是体现原电池原理,充电过程是体现电解池原理。 【练习】 1)如下图所示,用Mg和Al组成一个原电池. (1)当电解质溶液为稀硫酸时: Mg电极是____极,其电极反应式为,该反应是_____反应; ② Al电极是____极,其电极反应式为,该反应是_____反应. (2)当电解质溶液为NaOH溶液时: ①Mg电极是_____极,其电极反应式为,该反应是_____反应.
高中数学16微积分基本定理(教案)
三、教学过程 1、复习: 定积分的概念及用定义计算 2、引入新课 我们讲过用定积分定义计算定积分,但其计算过程比较复杂,所以不是求定积分的一般方法。我们必须寻求计算定积分的新方法,也是比较一般的方法。 变速直线运动中位置函数与速度函数之间的联系 设一物体沿直线作变速运动,在时刻t 时物体所在位置为S(t),速度为v(t)(()v t o ≥), 则物体在时间间隔12[,]T T 内经过的路程可用速度函数表示为 2 1 ()T T v t dt ? 。 另一方面,这段路程还可以通过位置函数S (t )在12[,]T T 上的增量12()()S T S T -来表达,即 2 1 ()T T v t dt ? =12()()S T S T - 而()()S t v t '=。 对于一般函数()f x ,设()()F x f x '=,是否也有 ()()()b a f x dx F b F a =-? 若上式成立,我们就找到了用()f x 的原函数(即满足()()F x f x '=)的数值差()()F b F a -来计算 ()f x 在[,]a b 上的定积分的方法。 注:1:定理 如果函数()F x 是[,]a b 上的连续函数()f x 的任意一个原函数,则 ()()()b a f x dx F b F a =-? 证明:因为()x Φ= ()x a f t dt ? 与()F x 都是()f x 的原函数,故 ()F x -()x Φ=C (a x b ≤≤) 其中C 为某一常数。 令x a =得()F a -()a Φ=C ,且()a Φ= ()a a f t dt ? =0 即有C=()F a ,故()F x =()x Φ+()F a ∴ ()x Φ=()F x -()F a =()x a f t dt ? 令x b =,有 ()()()b a f x dx F b F a =-? 此处并不要求学生理解证明的过程 为了方便起见,还常用()|b a F x 表示()()F b F a -,即 ()()|()()b b a a f x dx F x F b F a ==-? 该式称之为微积分基本公式或牛顿—莱布尼兹公式。它指出了求连续函数定积分的一般方法,把求 定积分的问题,转化成求原函数的问题,是微分学与积分学之间联系的桥梁。 它不仅揭示了导数和定积分之间的内在联系,同时也提供计算定积分的一种有效方法,为后面的学习奠定了基础。因此它在教材中处于极其重要的地位,起到了承上启下的作用,不仅如此,它甚至给微积分学的发展带来了深远的影响,是微积分学中最重要最辉煌的成果。
2020年高考化学试题分类汇编——电化学基础
2020年高考化学试题分类汇编——电化学基础 电化学基础 1.〔2018全国卷1〕右图是一种染料敏化太 阳能电池的示意图。电池的一个点极由有机 光敏燃料〔S 〕涂覆在2TiO 纳米晶体表面制 成,另一电极由导电玻璃镀铂构成,电池中 发生的反应为: 22TiO /S TiO /S h ν*??→〔激发态〕 +-22TiO /S TiO /S +e *??→ 3I +2e 3I ---??→ 2232TiO /S 3I 2TiO /S+I +--+??→ 以下关于该电池表达错误的选项是...... : A .电池工作时,是将太阳能转化为电能 B .电池工作时,I -离子在镀铂导电玻璃电极上放电 C .电池中镀铂导电玻璃为正极 D .电池的电解质溶液中I -和I 3-的浓度可不能减少 【解析】B 选项错误,从示意图可看在外电路中电子由负极流向正极,也即 镀铂电极做正极,发生还原反应:I 3-+2e -=3I -;A 选项正确,这是个太阳能电池,从装置示意图可看出是个原电池,最终是将光能转化为化学能,应为把上面四个 反应加起来可知,化学物质并没有减少;C 正确,见B 选项的解析;D 正确,此 太阳能电池中总的反应一部分实质确实是:I 3-3I -的转化〔还有I 2+I -I 3-〕,另一部分确实是光敏有机物从激发态与基态的相互转化而已,所 有化学物质最终均不被损耗! 【答案】B 【命题意图】考查新型原电池,原电池的两电极反应式,电子流向与电流流 向,太阳能电池的工作原理,原电池的总反应式等,还考查考生变通能力和心理 氧化 还原
素养,能否适应生疏的情境下应用所学知识解决新的咨询题等 【点评】此题立意专门好,然而考查过为单薄,而且取材不是最新的,在3 月份江苏省盐都市高三第二次调研考试化学试题第17题〔3〕咨询,与此题极为 相似的模型,这对一些考生显得不公平! 〔2018浙江卷〕9. Li-Al/FeS 电池是一种正在开 发的车载电池,该电池中正极的电极反应式 为: 2Li ++FeS+2e -=Li 2S+Fe 有关该电池的 以下中,正确的选项是 A. Li-Al 在电池中作为负极材料,该材料 中Li 的化合价为+1价 B. 该电池的电池反应式为:2Li+FeS =Li 2S+Fe C. 负极的电极反应式为Al-3e -=Al 3+ D. 充电时,阴极发生的电极反应式为:2Li s+Fe-22e Li FeS -+=+ 试题解析: 此题涵盖电解池与原电池的主体内容,涉及电极判定与电极反应式书写等咨 询题。依照给出的正极得电子的反应,原电池的电极材料Li-Al/FeS 能够判定放电 时〔原电池〕负极的电极反应式为Al-3e -=Al 3+。A 、Li 和Al 分不是两极材料。B 、 应有Al 的参加。D 、应当是阳极失电子反应。 此题答案:C 教与学提示: 原电池与电解池的教学一定要重视电极反应式书写。电极反应式书写是原电 池和电解池内容或原理的核心。原电池的教学能够从原电池反应的总反应式:能 够自发进行的氧化还原反应,负极反应〔因负极确实是参加反应的电极〕开始。 电解池的教学要从外加电源的正负极,分析阳极〔活性电极时本身参加反应〕开 始,最终获得被进行的氧化还原反应。简单记住:沸〔负〕羊〔阳〕羊〔氧化〕。 〔2018广东理综卷〕23.铜锌原电池〔如图9〕工作时,以下表达正确的选项是 A 正极反应为:Zn —2e -=Zn 2+ B 电池反应为:Zn+Cu 2+=Zn 2+ +CU C 在外电路中,电子从负极流向正极
201X-201x年高中化学 第04章 电化学基础 专题4.1 原电池导学案 新人教版选修4
4-1 原电池 【学习目标】 1.以铜锌原电池为例,熟悉原电池的工作原理 2.会正确判断原电池的正极和负极 3.学会原电池电极反应式的书写方法 【学习重难点】 学习重点:原电池的工作原理及电极反应式的书写。 学习难点:原电池的工作原理及电极反应式的书写。 【自主预习】 一.1.氧化还原反应的本质是 2.原电池是将转化为的装置。其本质是原理的应用。二.原电池工作原理: 1.知识回顾—以Cu-Zn-硫酸铜原电池为例,如右图 锌片:极,_________ 电子,发生________ 反应。 铜片:极,_________ 电子,发生________ 反应。 外电路:电子从极流入极 内电路:________向负极移动,______ 向正极移动 思考:如果用以上装置作电源,能持续稳定地产生电流吗?怎样进行改进? 2.探究活动—有盐桥的原电池的工作原理:阅读课本P71页有关【实验4-1】的论述,结合 图4-1,和上述“题1”的Cu-Zn原电池装置对照,实验装置有何变化 _____________________ 根据实验,填写下表: 电极Zn电极Cu电极 现象 得失电子 电极名称 电子流向 反应类型 电极反应式
总反应式 【思考】原电池的工作原理是怎样的?(教材P72) 【结论】把氧化反应和还原反应分开在不同的区域进行,再以适当的方式连接起来,就可以获得电流 三.原电池的形成条件: (1)两个活泼性不同的电极.相对活泼的金属作,较不活泼的金属或能导电的非金属作;(2)有溶液; (3)形成回路; (4)能自发地发生反应。 四.原电池的设计方法—构成原电池的基本条件,是进行原电池设计的基本依据。 1、根据电池反应写出电极反应式,以2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s)为例。把以上反 应分解为氧化反应和还原反应两个半反应,从而确定电极反应。 氧化反应(负极):; 还原反应(正极):。 2.电极材料的选择:电池的电极必须导电。一般电池的负极必须能够与电解质溶液反应,容易失去电子,往往以负极反应为依据确定电极材料,这里选用为负极。正极与负极之间只有产生电势差,电子才能定向移动,所以正极和负极一般不用同一种材料,且正极材料的活动性比Ag弱,多采用惰性电极C。本例也可用等金属3.电解质溶液的选择。电解质溶液一般要能够与负极发生反应。本例电解质溶液要含有,可以为溶液。 但若是两个半反应分别在两个烧杯中进行,则左右两个烧杯中的电解质溶液应与电极材料具有相同的,如下图,图中的X是,Y是