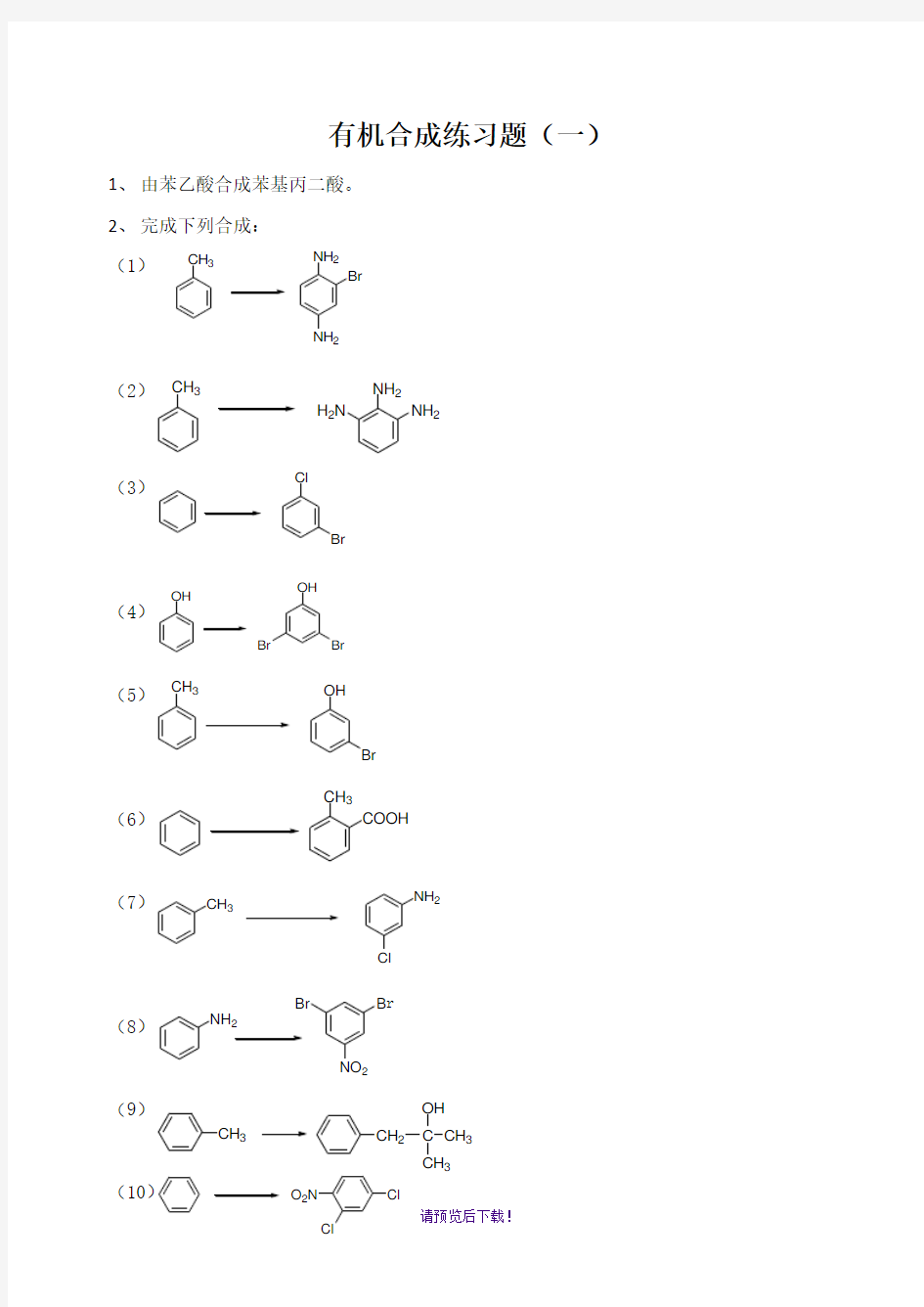

有机合成练习题(一)
1、由苯乙酸合成苯基丙二酸。
2、完成下列合成:
(1)(2)(3)(4)(5)(6)(7)(8)(9)(10)
CH3NH2
2
Br
CH3NH2
H2N NH2
Cl
Br
OH
OH
Br Br
CH3OH
Br
CH3
COOH
CH3
NH2
Cl
NH2
B r
Br
2
CH3CH
2
C CH3
OH
CH3
Cl
O2N
3、 由乙醛合成丁酸。
4、 由丙烯合成丁酸。
5、 由乙酰乙酸乙酯合成3-甲基-2-环己烯酮。(难)
6、 由4-氯丁酮为主要原料合成5-羟基-2-己酮。
7、 由丙二酸二乙酯为主要原料合成3-甲基丁酸。
8、 以乙炔及必要的无机试剂为原料合成4-己烯3-醇。
9、 以丙烯及必要的无机试剂为原料合成2-甲基-3-戊醇。 10、 完成下列合成:
(1)
(2)
11、由醋酸合成丙二酸二乙酯。
12、由乙烯、丙烯及必要的无机试剂合成3-甲基-1-丁醇。 13、由乙炔为原料合成2,2-二氯丁烷。 14、由乙酰乙酸乙酯合成2-戊酮。
15、由4,5-二甲基环己烯合成3,4-二甲基环戊烯(无机试剂任选)。
OH
CH 2NH 2OH
C
CH 3
O
参考答案
1、
2、(1)(2)(3)
CH2COOH
2
CHCOOH
Br
CHCOOH
CN
+
CH(COOH)2
CH3
H
CH3
NO2
23
CH3
NO2
Br
23
COOH
NO2
Br
5 CCl
2
Br NH
3
O
2
-
NH2
NO2
Br HCl
NH2
NH2
Br
CH3NH2
2
-
NHCCH3
KMnO4 / H+PCl3
CCl
Br
O
NH3
32
O
NHCCH3
O
SO3H
NHCCH3
O
SO3H
Δ
O2N NO2
稀 H+2
NH2
O2N NO2
NH2
H2N NH2
CNH2
Br
O
HNO3H SO
23
Cl
NO2
Fe / HCl2
Cl
N2+Br-CuBr
Cl
Br
(4) (5) (6) (7) (8)
OH
(CH )SO OCH 3
OCH 3
2
OCH 3
NH 2
Br 2
OCH 3
NH 2
Br
Br NaNO / HCl
32
OCH 3
Br
Br
HI
OH
Br
Br CH 3
+
COOH
2COOH
Br
2. P 2O 5 , Δ
CONH 2
Br
2NH 2
Br
20 ~ 5℃N 2+Cl -Br
H 2O
OH
Br
无水 AlCl 3CH 3
324CH 3
NO 2
Fe + HCl
CH 3
NH 2
0 ~ 5℃
CH 3
N 2+Cl -CH 3
CN
2H CH 3
COOH
+
NO 2
CH 3
分离
CH 3
NO 2
CH 3
KMnO 4
COOH
Cl 3
COOH
3Δ
CO Cl
NH 2
Br + NaOH
NH 2
Cl
NH 2
H
N 2
Br
NH Br
COCH 3
+B r
Br
NH 2
2
0 ~ 5℃
N 2Cl
3
O 浓 H SO 浓 HNO 3
NH NO 2
CO CH 3
NO 2
(9) (10)
3、 4、 5、 6、 7、
2CH 3CHO CH 3CH CH CHO
2CH 3CH 2CH 2CH 2OH
4+
CH 3CH 2CH 2COOH
2CH 3
CH 2O CH 2CH 3
25O
O
2CH 3
C CH
C O CH 2CH 3O O
_CH 3C
CH
CH 2CH C CH 3O
COOC 2H 52H 5
O
CH 3C O
(CH 2)3
C CH 3
O CH 3
O
(2) H ,
CH 3CH 2
CH 2Cl
O
HO OH
O
C O CH 3
CH 2
CH 2Cl
Mg
(CH 3CH 2)2O
O
C O CH 3
CH 2
CH 2Mg Cl
322O
C O CH 3
CH 2
CH 2
CH
CH 3
OMgCl
3+CH 3C CH 2
CH 2O CH
CH 3
OH H 2C
COOC 2H 5
COOC 2H 5C H ONa
HC
COOC 2H 5COOC 2H 5
_CH CH
CH Br HC CH
COOC 2H 5COOC 2H 5
CH 3CH 3
CH 3
CH
CH 2
HBr 22
CH 3CH 2CH 2Br
CH 3CH 2CH 2CN
+2CH 3CH 2CH 2COOH
CH 3
Cl CH 2Cl
CH 2MgCl
CH 3
CH O
CH 2
C CH 3OMgBr CH 3
H H 2O
CH 2
C CH 3OH
CH 3
NO 2
2NO 2
33
O
NH 浓 HNO 浓 H 2SO 43
Cl
NH 2
Cl
C CH 3
O Cl
H + / HNO 0 ~ 5℃
NH 2
Cl
O 2N
H O OH -
NH CH 3
O
Cl
O 2N
3
2
Cl
Cl
O 2N
8、
CH
CH
Pd / PbO
H 2CH 2
CH 2
HCl
CH 3CH 2Cl Et 2O
CH 3CH 2MgCl
CH CH HgSO 4
H SO CH 3CHO
-
CH 3CH
CH 2CHO
OH Δ
CH 3CH CHCHO
CH 3CH CHCHO + CH 3CH 2MgCl CH 3CH
CHCH
CH 2CH 3CH 3CH
CHCH CH 2CH 3
+2
9、
10、(1) (2) 11、
12、
CH 3CH
CH 2
HBr 22CH 3CH 2CH 2Br Mg 2CH 3CH 2CH 2MgBr CH 3CH
CH 2
+2CH 3CHCH 3
OH CH 3
CH 3
O
CH 3CH 3
O + CH 3CH 2CH 2MgBr CH 3
C CH 2CH 2CH 3OMgBr
CH 3
+H 2O CH 3
C CH 2CH 2CH 3OH
CH 3
O
[ O ]OH
HCN CN OH
2Ni
CH 2NH
2OH
HBr
Br
Mg MgBr
1. CH CHO
2. H 2O
CH CH 3
OH K Cr O 24
C
CH 3
O CH 3COOH
CH 2
COOH
Cl CH 2
COOH
CN H O H 2C
COOH
COOH C H OH H 2SO 4 , Δ
H 2C
COOC 2H 5
COOC 2H 5
CH 2CH 2
250℃
H 2C
CH 2
O CH 3CH CH 2 + HBr CH 3
CH Br
3
Mg CH 3
CH MgBr
3
13、
14、 15、
(注:可编辑下载,若有不当之处,请指正,谢谢!)
CH
CH
2液氮
CH
C Na
CH CH + H
2
CH 2
CH 2HCl
CH 3CH 2
Cl
CH
CH 3CH 2
C CH
2HCl
CH 3CH 2
C CH 3Cl
Cl
CH 3C CH 2
C OC 2H 5O O 25
CH 3C CH
C OC 2H 5
O O _CH 3CH 2Br
CH 3C CH 2CH 2CH 3
O
(2)H +Δ
CH 3C CH
C OC 2H 5
O O CH 2CH 3
(1)OH -KMnO 4/H +
COOH
COOH O
LiAlH 4
OH
有机合成及其应用 合成高分子化合物专项训练 一、有机化合物合成 1.中科院首创用CO 2合成可降解塑料聚二氧化碳。下列相关说法合理的是( ) A .聚二氧化碳塑料是通过加聚反应制得的 B .聚二氧化碳塑料与干冰互为同素异形体 C .聚二氧化碳塑料的使用也会产生白色污染 D .聚二氧化碳塑料与干冰都属于纯净物 2.下列物质中,既能发生加成反应,又能发生加聚和自身缩聚反应的是( ) C .HCOOH D .CH 3—CH===CH —CH 3 3.最近科学家研制出一种新材料来代替聚苯乙烯,它是由乳酸(一种有机 羟基羧酸)缩聚而成,能在乳酸菌的作用下降解从而消除对环境的污染。下列关于聚乳酸的说法中正确的是( ) A .聚乳酸是一种纯净物 B .聚乳酸是一种羧酸 C .聚乳酸的单体是CH 3CH(OH)COOH D .其聚合方式与聚苯乙烯的聚合方式相同 4.以淀粉和必要的无机试剂为原料制取 的过程是 淀粉――→① 葡萄糖――→② 乙醇――→③ 乙烯――→④ 1,2-二溴乙烷――→⑤ 乙二醇――→⑥ 乙二酸――→ ⑦ (1)指出反应类型: ③________________________________________________________________________; ④________________________________________________________________________; ⑤________________________________________________________________________;
第二章精细有机合成基础 2.1肪族亲核取代反应有哪几种类型 2.2S N1和S N2反应速度的因素有哪些各是怎样影响的 2.3卤代烷分别与醇钠和酚钠作用生成混醚的反应,为什么通常各在无水和水溶液中进行,且伯卤代物的产率最好,而叔卤代物的产率最差 2.4什么叫试剂的亲核性和碱性二者有何联系 2.5为什么说碘基是一个好的离去基团,而其负离子又是一个强亲核试剂这种性质在合成上有何应用 2.6卤代烷和胺在水和乙醇的混合液中进行反应,试根据下列结果,判断哪些属于S N2历程哪些属于S N1历程并简述其根据。2.7 <1> 产物的构型发生翻转; <2> 重排产物不可避免; <3> 增加胺的浓度,反应速度加快; <4> 叔卤代烷的速度大于仲卤代烷; <5> 增加溶剂中水的含量,反应速度明显加快; <6> 反应历程只有一步; <7> 试剂的亲核性越强,反应速度越快。 2.8比较下列化合物进行S N1反应时的速率,并简要说明理由: 2.9 C2H5CH2Br CH Br C2H5 CH3 C Br CH3 CH3 C2H5 (2) C6H5CH2Cl (C6H5)2CHCl C6H5CH2CH2Cl (1) 2.10比较下列化合物进行S N2反应时的速率,并简要说明理由: 2.11<1>C2H5CH2Br CH Br C2H5 3 C Br CH3 3 C2H5 Br I Cl <2> 2.12下列每对亲核取代反应中,哪一个反应的速度较快为什么? 2.13 2 H2O CH3CH2 CH3 CH3CH2CHBr + NaOH CH3 CH3CH2CH2OH + NaBr CH3CH2CH2Br + NaOH <1> CH3CH2CH2Br + NaOH CH3CH2CH2OH + NaBr H2O H2O CH 3 CH2CH2SH + NaBr CH3CH2CH2Br + NaSH <2> O2N CH2Cl + H2O O2N CH2OH + HCl △ △CH3CH2OH + HCl CH3CH2Cl + H2O <3> 2.14烷和硫脲进行亲核取代后再用碱分解,可以得到硫醇: 2.15RX + H22 S R S C NH2 NH 2 .. + + R S C NH2 NH2 X-RSH + NH2CN - 2.16请解释在硫脲中,为何是硫原子作为亲核质点,而不是氮原子作为亲核质点 2.17为什么说在亲核取代反应中消除反应总是不可避免的 2.18什么叫诱导效应其传递有哪些特点 2.19最常见的共轭体系有哪些 2.20什么叫共轭效应其强度和哪些因素有关传递方式和诱导效应有何不同 2.21在芳环的亲电取代反应中,何谓活化基何谓钝化基何谓邻对位定位基何谓间位定位基 2.22影响芳环上亲电取代反应邻对位产物比例的因素有哪些如何影响 2.23写出下列化合物环上氯化时可能生成的主要产物,并指出每一情况中氯化作用比苯本身的氯化,是快还是慢:
一、名词解释 1.卤化: 在有机化合物分子中引入卤原子,形成碳—卤键,得到含卤化合物的反应被称为卤化反应。根据引入卤原子的不同,卤化反应可分为氯化、溴化、碘化和氟化. 2.磺化 :向有机分子中引入磺酸基团(-SO3H)的反应称磺化或者硫酸盐化反应。. 3. 硝化:在硝酸等硝化剂的作用下,有机物分子中的氢原子被硝基(—NO2)取代的反应叫硝化反应。 4.烷基化: 烷基化反应指的是在有机化合物分子中的碳、硅、氮、磷、氧或硫原子上引入烃基的反应的总 称。引入的烃基可以是烷基、烯基、炔基和芳基,也可以是有取代基的烃基,其中以在有机物分子中引入烷基最为重要 5.酰化:在有机化合物分子中的碳、氮、氧、硫等原子上引入脂肪族或芳香族酰基的反应称为酰化反应。 6.氧化:广义地说,凡是失电子的反应皆属于氧化反应。 狭义地说,凡能使有机物中氧原子增加或氢原子减少的反应称为氧化反应。 7.磺化的π值:当硫酸的浓度降至一定程度时,反应几乎停止,此时的剩余硫酸称为“废酸”;废酸浓度用 含SO3的质量分数表示,称为磺化的“π值”。磺化易,π值小;磺化难,π值大。 8.硫酸的D.V.S: :硫酸的脱水值是指硝化结束时,废酸中硫酸和水的计算质量之比。 9.还原:广义:在还原剂作用下,能使某原子得到电子或电子云密度增加的反应称为还原反应。 狭义:能使有机物分子中增加氢原子或减少氧原子,或两者兼尔有之的反应称为还原反应。 10.氯化深度: 氯与甲苯的物质的量比. 11.废酸的F.N.A:废酸计算浓度(F.N.V)是指混酸硝化结束时,废酸中硫酸的计算浓度(也称硝化活性因素)。 12.相比:指硝酸与被硝化物的量比。 13.硝酸比:指硝酸与被硝化物的量比。 14.氨解:氨解反应是指含有各种不同官能团的有机化合物在胺化剂的作用下生成胺类化合物的过程。氨解 有时也叫做“胺化”或“氨基化”,但是氨与双键加成生成胺的反应则只能叫做胺化不能叫做氨解 (1)Claisen-Schmidt反应; 芳香醛或脂肪酮混合交叉缩合。反应是在氢氧化钠溶液或乙醇溶液中进行,得到很高产率的α、β-不饱和醛或酮。这一反应叫Claisen-Schmidt反应。 (2)Darzen反应; 醛酮(主要是芳醛)与α-卤代酸酯在强碱存在下反应,生α、β-环氧酸酯的反应叫达尔森反应,也称为缩水甘油酯的反应。 (3)Mannich反应; 含活泼H原子的化合物和甲醛及胺(伯胺或仲胺,氨)进行缩合反应,结果活泼氢原子被
精细有机合成原理期末模拟题1 一、填空题 1、精细化工产品的特点是(小批量、多品种)、(高技术密集)、(附加值高)、(综合生产工艺流程和多用途)、(商品性强); 2、石油是由(碳)、(氢)、(氧)、(氮)、(硫)五种元素组成的,这五种元素可以构成(烃类)和(非烃类)两类化合物; 3、化学反应器按催化剂运动状态可分为(固定床)、(流化床)和(移动床); 4、全混流反应器的基本假设之一是,器内各处浓度、温度(相同),且等于(出口)的浓度和温度; 5、单层绝热床反应器适用于热效应(小)的化学反应,否则用(多层)绝热床反应器; 6、精细有机合成中,溶剂的作用主要有(溶解作用)和(影响化学反应); 7、催化剂的使用要求有(活性)、(选择性)、(寿命)和(机械强度); 8、催化剂失活的原因有(热失活)和(中毒)两种; 9、均相配位催化反应的优点是(活性高)、(选择性好)、(有体系预见性); 10、卤代苯(氟苯、氯苯、溴苯、碘苯)的一硝化是一个(亲电取代)反应,由于氟的电负性最大,其负的(吸电诱导)效应也最大,一硝化时异构产物中(对)位的比例大。 11、常用磺化剂有(浓硫酸)、(发烟硫酸)、(氯磺酸)和(三氧化硫)。 12、写出三种不同类型的氢化催化剂(铁粉)、(硫化钠)、(NaBH4)。 13、天然石油中含有(烷烃)、(环烷烃)、(芳烃)三种烃类化合物; 14、催化剂寿命指的是保持其(平衡活性a e)的时间。 二、单选题 1、下列试剂哪一个不是亲电试剂? (a)NO2+(b)Cl2(c)Fe2+(d)Fe3+ 2、按极性分类,下列溶剂中哪一个是非极性溶剂?
(a)丙酮 (b)环己烷 (c) 水 (d)甲醇 3、 下面哪一个不是自由基生成(链引发)的方式? (a)加压 (b)加热 (c)加过氧化苯甲酰 (d)光照 4、 下面哪一个化合物最容易发生硝化反应? (a)苯 (b)一硝基苯 (c) 二硝基苯 (d)苯胺 5、1摩尔硝基苯还原生成1摩尔苯胺,理论上需要铁粉的摩尔数为 (a)1.0 (b)1.25 (c)2.0 (d)2.25 6、下面哪一个是H 酸?(b) HO3S NH2OH (a)(b) H N OH HO S 23 3(c) HO NH 2HO 3S (d) HO 3S SO 3H OH 7、某化学反应的计量方程式为: 2P A 已知:n A0=10mol,n A =1mol,n P =12mol,则: (a)Sp=1/3 (b)Sp=2/3 (c)Yp=3/10 (d)Yp=1/10 8、最常用的胺基化剂是: (a)氨水 (b)气氨 (c)液氨 (d)碳酸氢氨 9、2-氯蒽醌胺解制备2-氨基蒽醌的催化剂是:
1、精细化学品与精细化工的概念与特点。 精细化学品:“凡能增进或赋予一种(类)产品以特定功能,或本身具有特定功能的小批量或高纯度化学品”。 精细化学品的特点:① 产品功能性强(专用性)② 批量小③ 品种多④ 利润率高⑤ 更新换代快 精细化工 :“生产精细化学品的工业”。 “它属于一类化工产品的生产行业” 。 精细化工的特点:① 多品种、小批量 ② 综合生产流程和多功能生产装置 ③ 高技术密集度 ④ 大量应用复配技术 ⑤ 新产品开发周期长,费用高 ⑥ 商品性强、市场竞争激烈 2、新领域精细化学品的类别。 食品添加剂、饲料添加剂、电子化学品、造纸化学品、塑料助剂、皮革化学品、表面活性剂、水处理剂等。 3、精细化率的定义、我国目前的精细化率。 精细化率是一个国家或地区化学工业发达程度和化工科技水平高低的重要标志。我国目前的精细化率为45%。 4、世界精细化工的发展趋势。 发达国家新领域精细化工发展迅速、重视化境友好绿色精细化学品和超高功能及超高附加值产品,发展绿色化生产与生物工程技术。传统精细化工向发展中国家转移。 5、我国精细化工的现状与存在的主要问题。 ●我国精细化工产品的自我供应能力已有了大幅度的提升,传统精细化工产品不仅自给有余,而且大量出口;新领域精细化工产品的整体市场自给率达到70%左右。一些产品在国际市场上具有较大的影响力。 ●目前国精细化工产品尚难以满足细分市场需求。以中低档产品为主,难以满足高端市场要求,以电子化学品为代表的高端精细化学品严重依靠进口。 ● 在快速变化的市场面前,我国的研发力量还很不足的,特别是薄弱的精细化工的基础性研究已成为我国开发新技术和新产品的重要制约因素。 ● 部分国家以保护环境和提高产品安全性为由,陆续实施了一批新的条例和标准;我国也在不断加大与人民生活息息相关的工业品的安全管理力度和提%100?=化工产品的总值精细化工产品的总值)精细化工率(精细化率
全国卷有机高考题 第1天 (2015全国2卷38)(15分)聚戊二酸丙二醇酯(PPG )是一种可降解的聚酯类高分子材料,在材枓的生物相容性方面有很好的应用前景. PPG 的一种合成路线如下: 已知:①烃A 的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢 ②化合物B 为单氯代烃:化合物C 的分子式为C 5H 8 ③E 、F 为相对分子质量差14的同系物,F 是福尔马林的溶质 ④ 冋答下列问题: (1)A 的结构简式为 . (2)由B 生成C 的化学方程式为 . (3)由E 和F 生成G 的反应类型为 ,G 的化学名称为 . (4)①由D 和H 生成PPG 的化学方程式为: ②若PPG 平均相对分子质量为10000,则其平均聚合度约为 (填标号). a . 48 b . 58 c . 76 d .122 (5)D 的同分异构体中能同时满足下列条件的共有 种(不含立体异构): ①能与饱和NaHCO 3溶液反应产生气体②既能发生银镜反应,又能发生水解反应 其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是 (写结构简式) D 的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是 (填标号). a .质谱仪 b .红外光谱仪 c .元素分析仪 d .核磁共振仪. 稀NaOH R 1CHO+ R 2CH 2CHO CH -CH R 1R 2HO CHO
(2013全国2卷38)化合物Ⅰ(C 11H 12O 3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基。Ⅰ可以用E 和H 在一定条件下合成: 已知以下信息: ① A 的核磁共振氢谱表明其只有一种化学环境的氢; RCH=CH 2 RCH 2CH 2OH ② 化合物F 苯环上的一氯代物只有两种; ③ 通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。 回答下列问题: (1)A 的化学名称为 。(2)D 的结构简式为 。 (3)E 的分子式为 。 (4)F 生成G 的化学方程式为 ,该反应类型为__ ___。 (5)I 的结构简式为 。 (6)I 的同系物J 比I 相对分子质量小14,J 的同分异构体中能同时满足如下条件:①苯环上只有两个取代基,②既能发生银镜反应,又能与饱和NaHCO 3溶液反应放出CO 2,共有________种(不考虑立体异构)。J 的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2∶2∶1,写出J 的这种同分异构体的结构简式 。 ①B 2H 6 ②H 2O 2/OH -
精细有机合成原理期末模拟题 1 一、填空题 1、精细化工产品的特点是(小批量、多品种)、(高技术密集)、(附加值高)、(综合生产工艺流程和多用途)、(商品性强); 2、石油是由(碳)、(氢)、(氧)、(氮)、(硫)五种元素组成的,这五种元素可以构成(烃类)和(非烃类)两类化合物; 3、化学反应器按催化剂运动状态可分为(固定床)、(流化床)和(移动床); 4、全混流反应器的基本假设之一是,器内各处浓度、温度(相同),且等于(出口)的浓度和温度; 5、单层绝热床反应器适用于热效应(小)的化学反应,否则用(多层)绝热床反应器; 6、精细有机合成中,溶剂的作用主要有(溶解作用)和(影响化学反应); 7、催化剂的使用要求有(活性)、(选择性)、(寿命)和(机械强度); 8、催化剂失活的原因有(热失活)和(中毒)两种; 9、均相配位催化反应的优点是(活性高)、(选择性好)、(有体系预见性); 10、卤代苯(氟苯、氯苯、溴苯、碘苯)的一硝化是一个(亲电取代)反应,由于氟的电负性最大,其负的(吸电诱导)效应也最大,一硝化时异构产物中(对)位的比例大。 11、常用磺化剂有(浓硫酸)、(发烟硫酸)、(氯磺酸)和(三氧化硫)。 12、写出三种不同类型的氢化催化剂(铁粉)、(硫化钠)、(NaBH4)。 13、天然石油中含有(烷烃)、(环烷烃)、(芳烃)三种烃类化合物; 14、催化剂寿命指的是保持其(平衡活性a e)的时间。 二、单选题 1、下列试剂哪一个不是亲电试剂? (a)NO2+(b)Cl2(c)Fe2+(d)Fe3+ 2、按极性分类,下列溶剂中哪一个是非极性溶剂? (a)丙酮(b)环己烷(c) 水(d)甲醇 3、下面哪一个不是自由基生成(链引发)的方式? (a)加压(b)加热(c)加过氧化苯甲酰(d)光照 4、下面哪一个化合物最容易发生硝化反应? (a)苯(b)一硝基苯(c) 二硝基苯(d)苯胺 5、1摩尔硝基苯还原生成1摩尔苯胺,理论上需要铁粉的摩尔数为 (a) (b) (c) (d) 6、下面哪一个是H酸?(b) 7、某化学反应的计量方程式为: 2P A S 已知:n A0=10mol,n A=1mol,n P=12mol,则: (a)Sp=1/3 (b)Sp=2/3 (c)Yp=3/10 (d)Yp=1/10 8、最常用的胺基化剂是: (a)氨水(b)气氨(c)液氨(d)碳酸氢氨 9、2-氯蒽醌胺解制备2-氨基蒽醌的催化剂是: (a)CuCl (b)CuCl+SnCl2(c)CuCl+FeCl2(d)CuSO4 10、下面哪一个重氮盐偶合时的反应活性最高? (a)Cl-Ar-N=N+(b)O2N-Ar-N=N+(c)H3C-Ar-N=N+ (d)H3CO-Ar-N=N+ 11、用混酸(浓硫酸和硝酸)硝化时,关于浓硫酸的作用,下面哪一个说法是错误的?
中学化学竞赛试题资源库——有机合成 A 组 1.6-羰基庚酸是合成某些高分子材料和药物的重要中间体。某实验室以溴代甲基环己烷为原料合成6-羰基庚酸。 请用合成反应流程图表示出最合理的合成方案(注明反应条件) 提示:①合成过程中无机试剂任选,②如有需要,可以利用试卷中出现过的信息,③合成反应流程图表示方法示例如下: 2.已知①卤代烃(或 -Br )可以和金属反应生成烃基金属有机化合物。后者又 能与含羰基化合物反应生成醇: RBr +Mg ()?? ?→?O H C 252RMgBr ??→?O CH 2RCH 2OMgBr ???→?+ H O H /2RCH 2OH ②有机酸和PCl 3反应可以得到羧酸的衍生物酰卤: ③苯在AlCl 3催化下能与卤代烃作用生成烃基苯: 有机物A 、B 分子式均为C 10H 14O ,与钠反应放出氢气并均可经上述反应合成,但却
又不能从羰基化合物直接加氢还原得到。A与硫酸并热可得到C和C’,而B得到D和D’。 C、D分子中所有碳原子均可共处于同一平面上,而C’和D’却不可。请以最基础的石油产品(乙烯、丙烯、丙烷、苯等)并任选无机试剂为原料依下列路线合成B,并给出A、C’、D的结构简式及下述指定结构简式。 合成B的路线: 3.由指定原料及其他必要的无机及有机试剂会成下列化合物: (1)由丙烯合成甘油。 (2)由丙酮合成叔丁醇。 (3)由1-戊醇合成2-戊炔。 (4)由乙炔合成CH3CH2CH2CH2CH2CH2CH3。 (5)由CH3CH2CH2CHO合成
4.已知苯磺酸在稀硫酸中可以水解而除去磺酸基: 又知苯酚与浓硫酸易发生磺化反应: 请用化学方程式表示苯、水、溴、铁、浓硫酸及烧碱等为原料,合成的过程。 5.以CH2=CH2和H218O为原料,自选必要的其他无机试剂合成CH3--18O-C2H5,用化学方程式表示实现上述合成最理想的反应步骤。
2021届高中化学高三化学二轮复习——有机合成的综合应用专题测试一、单选题 1.标准状况下2.24LCO气体在足量氧气中燃烧后,加足量的过氧化钠充分吸收气体后,过氧化钠质量增加了 A.2.8g B.4.4g C.10.6g D.1.4g 2.等质量 ...的下列有机物完全燃烧,消耗O2最多的是() A.CH4B.CH3CH3C.C3H8D.C5H12 3.有机物烃A、B和C的结构如下图,下列有关说法正确的是 A.A的二氯代物结构有两种 B.B的分子式为C6H12 C.与C互为同分异构体且属于芳香烃的有机物可能使酸性高锰酸钾溶液褪色 D.A、B、C中只有C的最简式为CH 4.由一氧化碳、甲烷和乙烷组成的混合气体8.96L(标准状况),在足量氧气中充分燃烧后,生成气体先通过足量浓硫酸.再通过足量氢氧化钠溶液,测知氢氧化钠溶液增重26.4g,则原混合气体中乙烷的物质的量为:A.0.1mol B.等于0.2 mol C.大于或等于0.2mo1,小于0.3mol D.大于0.1mol小于0.3mol 5.下列反应类型不能 ..引入醇羟基的是 A.加聚反应B.取代反应C.加成反应D.水解反应 6.下列各组混合物总物质的量均为a mol,当每组物质以任意物质的量之比混合完全燃烧时,消耗O2的量
不变的是、 、 A.甲烷、甲醇B.乙醇、乙烯C.乙烯、环丙烷D.乙炔、苯 7.下列有机反应类型中,可能增长碳链的反应类型有 A.取代反应B.消去反应C.水解反应D.还原反应 8.某有机物的氧化产物是甲,还原产物是乙,甲和乙都能与钠反应放出H2,甲和乙反应生成丙,甲和丙都能发生银镜反应。该有机物是 A.甲醛B.乙醛C.甲酸D.甲醇 9.由a g乙酸、b g葡萄糖和c g尿素〔CO、NH2 、2 〕组成的混合物150 g,在一定条件下完全燃烧生成90 g水,则a、b、c的比值为( ) A.1、1、1 B.1、3、1 C.任意比D.无法计算 10.常温常压下,将10ml某气态烃与35m1O2混合点燃。充分反应后恢复到原来状态,剩余气体25ml、反应中O2足量,该烃可能为 A.C3H6B.CH4C.C3H8D.C2H6 11.0.1 mol纯净物R完全燃烧消耗0.75 mol O2,只生成0.5 mol CO2、0.5 mol H2O和0.1 mol HCl,则R可能的结构有(不考虑立体异构) () A.6种B.8种C.10种D.12种 12.试计算相同质量的下列物质,燃烧消耗氧气的质量最多的是() A.氢气B.丙烷C.乙醇D.甲烷 13.下列制取乙醇的反应中,原子经济性最差的是() A.CH2=CH2+H2O→CH3CH2OH B.CH3CHO+H2→CH3CH2OH C.CH3CH2Br+H2O→CH3CH2OH+HBr D.C6H l2O6→2C2H5OH+2CO2↑ 14.只含C、H、O三种元素的化合物完全燃烧后生成CO2和H2O。某物质的分子组成C x H y O z,取该物质
有机合成综合应用 【学习目标】 1、了解有机合成的过程,掌握有机合成的基本原则; 2、了解逆合成分析法,通过简单化合物的逆合成分析,巩固烃、卤代烃、烃的含氧衍生物的性质及相互转化关系,并认识有机合成在人类生活和社会进步中的重大意义。初步学会设计合理的有机合成路线; 3、掌握碳链的增长与缩短、官能团的引入和转化的方法,加深对有机合成的关键步骤的认识。 【要点梳理】 要点一、有机合成的过程 1.有机合成的定义。 有机合成是指利用简单、易得的原料,通过有机反应,生成具有特定结构和功能的有机物的过程。 2.有机合成遵循的原则。 (1)起始原料要廉价、易得、低毒性、低污染。通常采用四个碳以下的单官能团化合物和单取代苯。 (2)应尽量选择步骤最少的合成路线。为减少合成步骤,应尽量选择与目标化合物结构相似的原料。步骤越少,最后产率越高。 (3)合成路线要符合“绿色环保”的要求。高效的有机合成应最大限度地利用原料分子的每一个原子,使之结合到目标化合物中,达到零排放。 (4)有机合成反应要操作简单、条件温和、能耗低、易于实现。 (5)要按一定的反应顺序和规律引入官能团,不能臆造不存在的反应事实。综合运用有机反应中官能团的衍变规律及有关的提示信息,掌握正确的思维方法。有时则要综合运用顺推或逆推的方法导出最佳的合成路线。 原料垐垐?噲垐?顺推逆推 中间产物垐垐?噲垐?顺推 逆推 产品 3.有机合成的任务。 有机合成的任务包括目标化合物分子碳骨架的构建和官能团的引入与转化。 4.有机合成的过程。 有机合成的过程是利用简单的试剂作为基础原料,通过有机反应连上一个官能团或一段碳链,得到一个中间体;在此基础上利用中间体上的官能团,加上辅助原料,进行第二步反应,合成第二个中间体……经过多步反应,按照目标化合物的要求,合成具有一定碳原子数目、一定结构的目标化合物。其合成过程示意图如下: 要点二、有机合成的关键 有机合成的关键是目标化合物分子的碳骨架的构建和官能团的引入与转化。 1.碳骨架的构建。 构建碳骨架是合成有机物的重要途径。构建碳骨架包括在原料分子及中间化合物分子中增长或缩短碳链、成环或开环等。 (1)碳骨架增长。 条件:有机合成所用的有机原料分子中所含碳原子数若小于目标物质的分子中的碳原子数,就需要增长碳链。 碳骨架增长举例: ①卤代烃的取代反应。 a .溴乙烷与氰化钠的醇溶液共热:
精细有机合成原理期末模拟题1 一、 填空题 1、精细化工产品的特点是(小批量、多品种)、(高技术密集)、(附加值高)、(综合生产工艺流程和多用 途)、(商品性强); 2、石油是由(碳)、(氢)、(氧)、(氮)、(硫)五种元素组成的,这五种元素可以构成(烃类)和(非烃 类)两类化合物; 3、化学反应器按催化剂运动状态可分为(固定床)、(流化床)和(移动床); 4、全混流反应器的基本假设之一是,器内各处浓度、温度(相同),且等于(出口)的浓度和温度; 5、单层绝热床反应器适用于热效应(小)的化学反应,否则用(多层)绝热床反应器; 6、精细有机合成中,溶剂的作用主要有(溶解作用)和(影响化学反应); 7、催化剂的使用要求有(活性)、(选择性 )、(寿命)和(机械强度); 8、催化剂失活的原因有(热失活)和(中毒)两种; 9、均相配位催化反应的优点是(活性高)、(选择性好)、(有体系预见性); 10、卤代苯(氟苯、氯苯、溴苯、碘苯)的一硝化是一个(亲电取代)反应,由于氟的电负性最大,其负 的(吸电诱导)效应也最大,一硝化时异构产物中(对)位的比例大。 11、常用磺化剂有(浓硫酸)、(发烟硫酸)、 (氯磺酸)和(三氧化硫)。 12、写出三种不同类型的氢化催化剂(铁粉)、(硫化钠)、(NaBH 4)。 13、天然石油中含有(烷烃)、(环烷烃)、 (芳烃)三种烃类化合物; 14、催化剂寿命指的是保持其(平衡活性a e )的时间。 二、 单选题 1、 下列试剂哪一个不是亲电试剂? (a)NO 2+ (b)Cl 2 (c)Fe 2+ (d)Fe 3+ 2、 按极性分类,下列溶剂中哪一个是非极性溶剂? (a)丙酮 (b)环己烷 (c) 水 (d)甲醇 3、 下面哪一个不是自由基生成(链引发)的方式? (a)加压 (b)加热 (c)加过氧化苯甲酰 (d)光照 4、 下面哪一个化合物最容易发生硝化反应? (a)苯 (b)一硝基苯 (c) 二硝基苯 (d)苯胺 5、1摩尔硝基苯还原生成1摩尔苯胺,理论上需要铁粉的摩尔数为 (a)1.0 (b)1.25 (c)2.0 (d)2.25 6、下面哪一个是H 酸?(b) HO3S NH2OH (a)(b) H N OH HO S SO H 23 3(c) HO NH 2HO 3S (d) HO 3S SO 3H OH 7、某化学反应的计量方程式为: 2P A
《有机合成工艺学》课程综 合复习资料 -标准化文件发布号:(9456-EUATWK-MWUB-WUNN-INNUL-DDQTY-KII
《有机合成工艺学》综合复习资料 一、填空题 1、绝热式乙苯脱氢工艺流程中,原料为和,反应器入口温度需要610~660℃,它是一个吸热反应,热量靠过热蒸汽带入,因此,催化剂床层分段,段间补充过热水蒸汽,全部蒸汽与乙苯的摩尔比为。反应产物经冷凝器冷却后,气液分离,不凝气中含有大量的和CO、CO2,可作燃料使用。冷凝液经精馏后分离出、、和,最后产物是。 2、合成气制备甲醇的工艺流程中,原料为新鲜,由于合成甲醇是多个反应同时进行,除主反应外,还有生成和甲烷等副反应。因此,如何提高合成甲醇反应,提高甲醇收率是 问题,它涉及到催化剂的选择以及操作条件的的控制,诸如、、和原料气。由于反应是个可逆的反应,存在一个温度曲线。 3、烃类氧化反应过程中氧化剂在、纯氧、和其它过氧化物上选择,究竟使用什么氧化剂要视分析而定。近年来,作为氧化剂发展迅速,它具有条件,操作简单,反应选择性,不易发生深度反应,对环境友好和可实现生产的特点。 4、当代环境十大问题是:污染、臭氧层、全球变、海洋、淡水资源和污染、生物多样性、环境公害、有毒化学品和废物、土地和沙漠化、锐减。 5、Monsanto低压法甲醇羰化反应合成醋酸的不利条件是催化剂的资源稀缺,价格较。甲醇低压羰基合成醋酸在上的优越性很大,其特点为:原料可以用煤、和重质油,不受供应和价格波动影响;反应的转化率和选择性,过程能量效率高;所采用的催化系统稳定,用量少,寿命;流程中的反应系统和系统合为一体,工程和控制都很巧妙,结构紧凑;已经解决了设备的问题,找到了耐腐蚀的材料;生产过程中副产物很,三废排放少,操作安全可靠。 6、催化加氢通常用于合成和许多化工产品的过程;催化脱氢可以生成高分子材料的重要,产量最大、用途最广的两个最重要的产品是和。
精细有机合成习题三 姓名学号班级 一、卤代反应 1、芳环上亲电取代卤化时,有哪些重要影响因素? 答: 1)反应物的结构环上已有取代基影响反应活性和取代位置 2)催化剂反应试剂一般单质,催化剂用路易斯酸 3)原料杂质。由于使用路易斯酸催化,原料中的水份、某些杂环化合物会影响催化剂的活性,故工业生产中限制芳烃中水含量。 4)反应温度,温度升高,反应速度快,活性提高,但副产物增多。 5)由于该反应表现连串反应特点,随着反应进程增大,副产物增多,在工艺上必须控制卤化深度。 6)工业生产中,反应器类型对反应有影响。如釜式反应器返混严重,副反应增加,而塔式反应器能够在一定程度上减少返混现象,副反应少。 2、简述由甲苯制备以下卤化合物的合成路线、各步反应的名称和主要反应条件。 解; 1) CH 3 CH 3 CCl 3 CF 3 Cl 2 ,FeCl 3 Cl Cl Cl Cl 2 , hv KF, DMF 环上亲电取代 侧链自由基取代氟的亲核置换 2) CF 3 CF 3 CH 3 CCl 3 Cl 2, hv KF, DMF Cl 2, FeCl 3 侧链自由基取代亲核氟置换 环上亲电取代Cl 3)与反应 1)类似
4) CH 3 CH 3 CCl 3 CF 3 Cl Cl Cl Cl 2 , FeCl 3 Cl 2, hv KF, DMF Cl Cl Cl 5) CH 3 CF 3 CF 3 CH 3 CCl 3 Cl Cl Cl Cl Cl 6) CH 3 CH 3 CCl 3 CF3 CF 3 Cl Cl Cl Cl Br 3、写出以邻二氯苯、对二氯苯或苯胺为原料制备2,4- 二氯氟苯的合成路线、每步反应的名称、各卤化反应的主要反应条件。 Cl Cl F Cl 2, FeCl 3 KF ,DMSO Cl Cl Cl Cl Cl 环上亲电取代氟亲核置换反应 Cl Cl F Cl 2 , FeCl 3 Cl Cl KF , DMSO 环上亲电取代氟亲核置换 Cl Cl Cl 其它卤代烃制备 NH 2 N2+ HSO 4 - Cl Cl Cl Cl Cl Cl NaNO 2 ,H 2 SO4 CH 3OH NH 2 N2+ HSO 4 - Cl Cl Cl Cl Cl Cl NaNO 2 ,H 2 SO4 CH 3OH Cl Cl Cl
精细有机合成课程讲稿 水解的方法很多,包括卤素化合物的水解、芳磺酸及其盐类的水解、芳环上硝基的水 也可使用廉价的温和碱性剂,例如,碳酸钠和氢氧化钙
1975年,环氧乙烷的生产已可用乙烯的空气直接氧化法。丙烯的空气直接氧化法还不成熟,因甲基也会被氧化。环氧丙烷的另一个工业生产方法是丙烯的间接氧化法,国外已实现了工业化生产。 电化氯醇法是利用氯化钠(或氯化钾、溴化钠、碘化钠的水溶液,经电解生成氯气和氢氧化钠的原理。在阳极区通入丙烯,生成氯丙醇;在阴极区氯丙醇与氢氧化钠作 11.1.3苯氯甲烷衍生物的水解 苯环侧链甲基上的氯也相当活泼,其水解反应可在弱碱性缚酸剂或酸性催化剂的存在下进行。通过这类水解反应可以制得一系列产品。 一、苯一氯甲烷(一氯苄)水解制苯甲醇 苯甲醇的工业生产方法主要是氯苄的碱性水解法,分为间歇法和连续法。 间歇法是将一氯苄与碳酸钠水溶液充分混合并在80~90℃反应,水解产物经油水
连续法是将氯化苄与碱的水溶液在高温180~℃及加压1~6.8MPa下充分混合后通过反应区,反应只需要几分钟。采用塔式反应器,用质量分数10%的碳酸钠水溶液℃及1.8MPa下水解反应可得到纯度为98%的苯甲醇,收率98%。 芳环上卤基的水解 氯基水解是制备邻、对硝基酚类的重要方法,还可以制得的硝基酚类有 -3-硝基苯磺酸等,将这些硝基酚类还原可制得相应氨基酚类,它们都
在这里,用浓硫酸水解法的原因,一方面是为了使反应物溶解,另一方面是因为碱性水解法会引起副反应。 用类似的反应条件还可以从1-氨基-2,4-二氯蒽醌的水解制备 芳磺酸及其盐类的水解 酸性水解是磺化反应的逆反应,是亲电取代反应历程。酸性水解可用来除去芳环上的 生成的酚钠盐用无机酸如H2SO4酸化,即转变为游离酚。 一、碱熔反应的影响因素
9.3精细有机合成试题及答案 一.选择题 1. EDTA与金属离子形成配合物的鳌和比为( A ) A、1:1 B、1: 2 C、1: 3 D、1:4 2. 在含有过量配位剂L的配合物ML溶液中,C(M)=A mol/L ,加入等体积的水后, C(M)约等于(B) A、a B、a/2 C、2a D、2/a 3. 金属指示剂In在滴定的PH条件下,本身颜色必须(D ) A、无色 B、蓝色 C、深色 D、与Min不同 4. 二苯胺磺酸钠是丄滴定一丫‘的常用指示剂。它是属于( C ) A、自身指示剂 B、特殊指示剂 C、氧化还原指示剂 D、其他指示剂 5. 碘量法中所需:-:■'1 ■■标准溶液中在保存中吸收了「[而发生下述反应: 丄…「V --------------- * 一若用该滴定12溶液则消耗的量将(B ) A、偏高 B、偏低 C、无影响 D、无法判断 6. 在2KMnO4 + 16HCI = 5CI 2 + 2MnCl2 + 2KCl +8H 2O 的反应中,还原产物是下 面的哪一种(D ) A、Cl2 B、H2O 7. 用同一KMnO4标准溶液分别滴定体积相等的FeSO4和H2C2O4溶液,耗用的标 准溶液体积相等,对两溶液浓度关系正确表述是(C ) A、C(FeSO4)= 5H2C2O4) B、2C(FeSO4)= 5H2C2O4) C、C(FeSO4)=2C(H2C2O4) D、2n(FeSO4)= n(H2C2O4) 8. 下列叙述中正确的是(D ) A、化学反应动力学是研究反应的快慢和限度的 B、反应速率常数大小即是反应速率的大小
C、反应级数越大反应速率越大 D、活化能的大小不一定总能表示一个反应的快慢,但可表示反应速率常数受温 度变化影响的大小 9. Fe3O4中Fe的氧化值为( D ) A、0 B、+2/3 C、-2/3 D、+8/3 10. 下列因素与均相成核速率无关的是( A ) A、陈放时间 B、相对过饱和度 C、物质的性质 D、溶液的浓度 11. 干燥剂干燥适用于下列( D )的物质。 A、受热易分解 B、挥发 C、能升华 D、三种都有 12. 在萃取法操作中,要求分配比D ( B )才可取得较好的萃取效率 A、等于10 B、大于10 C、小于10 D、大于1 1 3.下列试剂能使BaSO 4沉淀的溶解度增加的是( A、) A、浓HCI B、1mol/L NaOH C、1moI/L Na 2SO4 D、1moI/L NH 3 H2O 14. 对显色反应产生影响的因素是下面哪一种( A ) A、显色酸度 B、比色皿 C、测量波长 D、仪器精密度 15. 在光度测定中,当显色剂有色,试液在测定条件下吸收又很小时,参比溶液应选下面哪一种( C ) A、蒸馏水 B、溶样用的酸 C、试剂空白 D、将显色剂注于比色皿 中 16. 物质的颜色是由于选择性地吸收了白光中的某些波长的光所致,硫酸铜呈现 蓝色是由于它吸收了白光中的何种光波( C ) A、蓝色光波 B、绿色光波 C、黄色光波 D、紫色光波 17. 朗伯-比耳定律说明,当一束单色光通过均匀的有色溶液时,有色溶液的吸光 度与什么成正比( C ) A、溶液的温度 B、溶液的酸度
有机合成综合应用 编稿:宋杰审稿:张灿丽 【学习目标】 1、了解有机合成的过程,掌握有机合成的基本原则; 2、了解逆合成分析法,通过简单化合物的逆合成分析,巩固烃、卤代烃、烃的含氧衍生物的性质及相互转化关系,并认识有机合成在人类生活和社会进步中的重大意义。初步学会设计合理的有机合成路线; 3、掌握碳链的增长与缩短、官能团的引入和转化的方法,加深对有机合成的关键步骤的认识。 【要点梳理】 要点一、有机合成的过程 1.有机合成的定义。 有机合成是指利用简单、易得的原料,通过有机反应,生成具有特定结构和功能的有机物的过程。 2.有机合成遵循的原则。 (1)起始原料要廉价、易得、低毒性、低污染。通常采用四个碳以下的单官能团化合物和单取代苯。 (2)应尽量选择步骤最少的合成路线。为减少合成步骤,应尽量选择与目标化合物结构相似的原料。步骤越少,最后产率越高。 (3)合成路线要符合“绿色环保”的要求。高效的有机合成应最大限度地利用原料分子的每一个原子,使之结合到目标化合物中,达到零排放。 (4)有机合成反应要操作简单、条件温和、能耗低、易于实现。 (5)要按一定的反应顺序和规律引入官能团,不能臆造不存在的反应事实。综合运用有机反应中官能团的衍变规律及有关的提示信息,掌握正确的思维方法。有时则要综合运用顺推或逆推的方法导出最佳的合成路线。 原料 顺推 逆推中间产物 顺推 逆推 产品 3.有机合成的任务。 有机合成的任务包括目标化合物分子碳骨架的构建和官能团的引入与转化。 4.有机合成的过程。 有机合成的过程是利用简单的试剂作为基础原料,通过有机反应连上一个官能团或一段碳链,得到一个中间体;在此基础上利用中间体上的官能团,加上辅助原料,进行第二步反应,合成第二个中间体……经过多步反应,按照目标化合物的要求,合成具有一定碳原子数目、一定结构的目标化合物。其合成过程示意图如下: 要点二、有机合成的关键 有机合成的关键是目标化合物分子的碳骨架的构建和官能团的引入与转化。 1.碳骨架的构建。 构建碳骨架是合成有机物的重要途径。构建碳骨架包括在原料分子及中间化合物分子中增长或缩短碳链、成环或开环等。 (1)碳骨架增长。 条件:有机合成所用的有机原料分子中所含碳原子数若小于目标物质的分子中的碳原子数,就需要增长碳链。 碳骨架增长举例: ①卤代烃的取代反应。 a.溴乙烷与氰化钠的醇溶液共热: CH3CH2Br+NaCN? ??→CH3CH2CN+NaBr(取代反应) CH3CH2CN+2H2O+H+—→CH3CH2COOH+NH4+(酸性条件下水解)
《有机合成路线》专题复习 有机合成路线包括官能团的引入、官能团的保护、碳链的增长、碳链的缩短等,它涵盖了有1.有机合成的原则: (1)尽量选择步骤少的合成路线。 (2)合成路线中出现的反应要是书本学过的反应,不能使用考纲外的竞赛知识,更不能臆造不存在的反应。值得说明的是,有机合成题中给出的陌生的有机反应,在合成路线中往往要运用。(3)有机合成产物尽可能要有专一选择性,避免产物多样化。 (4)有机合成路线的评价可从科学性(不违反科学规律)、安全性(避免高温高压等反应条件,试剂低毒或无毒)、可行性(操作简单,易于实现),经济性(原料价廉易得,反应能耗低)、环保性(产物无污染)等五个角度评述。 2.官能团的引入:包括引入C=C双键、C≡C叁键、卤素(-X)、羟基(-OH)、醛基(-CHO)、羧基(-COOH)、酯基等。 (1)引入C=C双键醇的消去:。卤代烃的消去:。炔烃的不完全加成:。 (2)引入C≡C叁键邻二醇的消去:。邻二卤代烃的消去:。邻卤代烯烃的消去:。 (3)引入卤素(-X)烷烃的取代:。苯的取代:。苯的同系物的取代:。烯烃与卤化氢或卤素单质的加成:。醇与卤化氢的取代:。 (4)引入羟基(-OH) 烯烃与水的加成:。 醛的加成:。卤代烃的水解:。 酯的水解:。 ⑤羰基的加成:。 (5)引入醛基(-CHO):________________________________________。
醛的氧化:。 (6)引入羧基(-COOH) 酯的水解:。 (7)引入酯基:________________________________________。 3.有机合成路线常用的表示方式为:A B ??????目标产物,书写时应注意: (1)尽量选择步骤少的合成路线,高考化学有机合成路线一般为3到5步 (2)合成路线中的反应试剂和反应条件要书写明确,不能含糊不清。且书写格式要规范,反应试剂写在箭头线上方,反应条件写在箭头线下面。 (3)合成路线中的有机物的结构简式书写也要规范清晰,易于辨识。 (4)若合成路线涉及多条,那就分条书写,不要在一条线上“节外生枝”,显得杂乱无章。(5)有机合成题中给出的陌生的有机反应,在合成路线中往往要运用。 总之,有机合成路线的书写要做到规范,规范,规范…… 4.有机合成题中常见的陌生反应(信息题): (1)狄尔斯-阿尔德反应(D-A反应): (2)苯环上的烷基化反应(“傅一克”反应): (3)卤代烃与活泼金属作用:2CH3Cl+2Na→CH3-CH3+2NaCl (4)醛、酮与HCN的加成反应: (5)醛、酮与RMgX的加成反应: (6)环氧烷与RMgX的加成反应: (7)醛与醛的缩合反应: 或 (8)羧酸与亚硫酰氯(SOCl2)的取代反应: 注意:有机合成题中常见的陌生反应一般多为碳链增长的反应,在合成路线中往往要运用。
一、名词解释(每题3分) 1卤化 : 2 磺化: 3. 硝化: 4 烷基化: 5 酰化: 6. 氧化: 7 .磺化的π值:; 8.硫酸的D.V.S: 9 还原: 10.氯化深度: 11.废酸的F.N.A: 12 相比: 13 硝酸比: 14 .氨解: 二、填空题(每空1分) 1.从天然气和石油中可获得_______、、、等脂肪烃。 2.萘在低温磺化时主要产物为,在较高温度下为_____________。 3.SO3在室温下有 ____、、、四种聚合形式。其中为液态。 4.用SO3磺化要注意防止_________、、、等副反应。 5. 共沸去水磺化法适用于________________。 6. 氯磺酸磺化时要注意。 7.硝化方法常见有______种,工业上常采用______________________,主要适用于。 8.硝化加料方法有_______ 、、三种。 9.硝化反应的主要活泼质点是___________________________。 10.自由基产生有 _____________、___________、____________三种方法。 11.从天然气和石油中可获得_______、、等芳香烃。 12.硝化反应器常用制成,因此要控制废酸浓度不低于防腐。 13.废酸处理有、、、等方法。 14. 烘培磺化多用于________________。 15.氟化物制备可通过_______________、、。16.链反应有_____________、___________、____________ 三步。 17 卤化技术按其方法可分为_____________、___________、____________三种类型。 18 芳环上的卤化反应属于_____________反应 19 工业发烟硫酸有两种规格,一种含游离SO3约 ,另一种含游离SO3,约 20 在连续分离器中,可加入以加速硝化产物与废酸分离。 21硝酸比指