
第一节元素周期表第1课时(导学案)
课前激趣导案
【情景导入】
1907年1月27日,俄国首都彼得堡寒风凛冽,太阳黯淡无光,寒暑表上的水银柱降到零下20多度,街上到处点着蒙有黑纱的灯笼,显出一派悲哀的气氛。几万人的送葬队伍在街上缓缓移动着,在队伍最前头,既不是花圈,也不是遗像,而是由十几个青年学生扛着的一块大木牌,上面画着好多方格,方格里写着“C”、“O”、“Fe”、“Zn”等元素符号。原来,死者是著名的俄国化学家门捷列夫,木牌上画着好多方格的表是化学元素周期表——门捷列夫对化学的主要贡献。
一、学习目标
1.掌握元素周期表的结构
2.理解原子结构与周期和族的关系
3.根据原子序数推断元素在周期表中的位置
二、学习重难点
掌握元素周期表的结构;根据原子序数推断元素在周期表中的位置。
三、预习内容(分为两组问题,1~2为第一组问题,3为第二组问题)
1.原子序数:按照元素在周期表中的顺序给元素编号,得到原子序数,
原子序数=________=________=________
2.周期表编排规则
把:________________________叫周期。
把:________________________叫族。
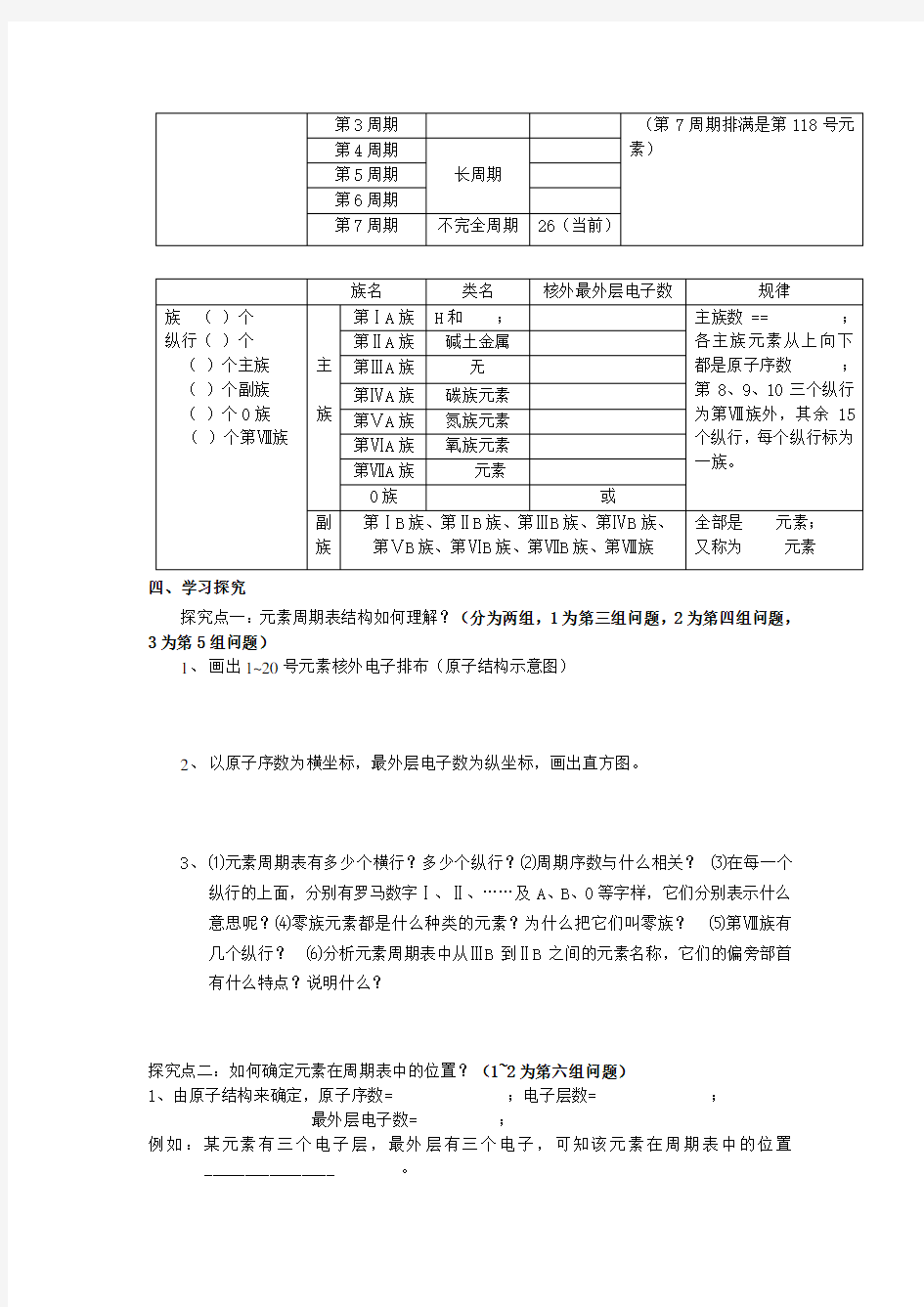
3.元素周期表的结构
周期名称周期别名元素总数规律
周期()个,横行()个第1周期
短周期
周期数== ;各周期元素
从左向右都是原子序数;第2周期
第3周期(第7周期排满是第118号元
素)
第4周期
长周期
第5周期
第6周期
第7周期不完全周期26(当前)
族名类名核外最外层电子数规律
族()个
纵行()个
()个主族()个副族()个0族()个第Ⅷ族主
族
第ⅠA族H和;主族数 == ;
各主族元素从上向下
都是原子序数;
第8、9、10三个纵行
为第Ⅷ族外,其余15
个纵行,每个纵行标为
一族。
第ⅡA族碱土金属
第ⅢA族无
第ⅣA族碳族元素
第ⅤA族氮族元素
第ⅥA族氧族元素
第ⅦA族元素
0族或
副
族
第ⅠB族、第ⅡB族、第ⅢB族、第ⅣB族、
第ⅤB族、第ⅥB族、第ⅦB族、第Ⅷ族
全部是元素;
又称为元素
四、学习探究
探究点一:元素周期表结构如何理解?(分为两组,1为第三组问题,2为第四组问题,3为第5组问题)
1、画出1~20号元素核外电子排布(原子结构示意图)
2、以原子序数为横坐标,最外层电子数为纵坐标,画出直方图。
3、⑴元素周期表有多少个横行?多少个纵行?⑵周期序数与什么相关?⑶在每一个
纵行的上面,分别有罗马数字Ⅰ、Ⅱ、……及A、B、0等字样,它们分别表示什么
意思呢?⑷零族元素都是什么种类的元素?为什么把它们叫零族?⑸第Ⅷ族有
几个纵行?⑹分析元素周期表中从ⅢB到ⅡB之间的元素名称,它们的偏旁部首
有什么特点?说明什么?
探究点二:如何确定元素在周期表中的位置?(1~2为第六组问题)
1、由原子结构来确定,原子序数= ;电子层数= ;
最外层电子数= ;
例如:某元素有三个电子层,最外层有三个电子,可知该元素在周期表中的位置________________ 。
2、由原子序数确定,已知原子序数画原子结构示意图,据电子层数推断周期数,据最外层电子数判断其所在的族序数;
例如: 11号元素,Na , 位置_________________________。
已知某主族元素的原子结构示意图如下,判断其位于第几周期,第几族?
四、反思总结 (熟记周期表结构是学好这部分的基础。)
四、当堂检测(1~3为第七组问题,4~6为第8组问题,7~8为第9组问题)
1.对元素周期表和元素周期律的发现有突出贡献的科学家是()
A.拉瓦锡B.阿伏加德罗 C. 门捷列夫D.道尔顿
2. 在元素周期表中,第三、四、五、六周期所含元素种数分别是()
A. 8、18、32、32
B. 8、8、18、18
C. 8、18、18、32
D. 18、18、32、32
3. 短周期元素中非金属元素共有()
A. 9种
B. 10种
C. 12种
D.13种
4. 下列说法准确的是()
A. 元素周期表中有七个横行,分为七个周期
B. 元素周期表中有九个横行,分为七个周期
C. 元素周期表中有18个纵行,分为18个族
D. 元素周期表中有16个纵行,分为16个族
5. 下列关于元素周期表的说法中,准确的是()
A. 元素周期表是按照元素的相对原子质量大小排布而成的
B. 元素周期表共有7个周期16个族
C. 过渡元素都是金属元素,第IA族都是金属元素
D. 最外层电子数相同的元素都在同一族
6. 下列说法中不准确的是()
A. 元素的原子序数等于核电荷数
B. 元素原子的质子数等于核外电子数
C. 元素所在周期序数等于该元素原子的最外层电子数
D. 元素所在周期序数等于该元素原子的电子层数
7. 下列说法中错误的是()
A. 原子及其离子的核外电子层数等于该元素所在的周期数
B. 元素周期表中从IIIB族到IIB族10个纵行的元素都是金属元素
C. 除氦外的稀有气体原子的最外层电子数是8
D. 第一周期元素、第VIIA族元素和稀有气体都是非金属元素
8. 短周期元素X、Y的原子序数相差2。下列相关叙述准确的是()
A. X与Y不可能位于同一主族
B. X与Y一定位于同一周期
C. X与Y可能有一种是金属有一种是非金属
D. X与Y一定都是金属或都是非金属
第一节元素周期表(第一课) 课题:第一节元素周期表(第一课时) 授课班级高一 课时 教学目的 知识 与 技能 1、了解元素周期表的结构以及周期、族等概念 2、使学生了解原子结构、元素性质及该元素在周期表中的位置三者间的关 系,初步学会运用周期表。 过程 与 方法 1、引导学生自主学习:认识周期表的结构 2、自主探究:探究原子结构与性质的关系 情感 态度 价值观 1、通过对元素周期表编制过程的了解,使学生正确认识科学发展的历程, 并以此来引导自己的实践,同时促使他们逐渐形成为科学献身的高贵品质 2、了解元素周期表的意义,认识事物变化由量变引起质变的规律,对学生 进行辨证唯物主义教育 重点元素周期表的结构以及周期、族等概念难点元素在周期表中的位置和原子结构的关系 知识结构与板书设计第一节元素周期表 一、元素周期表 原子序数=核电荷数=质子数=核外电子数1.周期: 三短,四长 2. 族: 主族:短周期+长周期 A 副族:完全长周期 B 0族:稀有气体元素 Ⅷ族:8,9,10纵行 3.过渡元素:副族+第Ⅷ族 元素位置 电子层数 最外层电子数
教学过程 教学步骤、内容教学方法、手段、师生活动 [视频]《元素周期表之歌》 [引言]到目前为止人类已经发现了112种元素,并随着科技的发展不断地探索发现新的元素。早在人们发现元素的那一刻起,科学家们就一直探索元素的奥秘,这些元素性质不同,有的活泼,有的不活泼。它们之间存在着什么联系呢?元素周期表是根据什么得来的呢?这得从 元素周期表的发展史说起了 讲解元素周期表发展历程 [讲]门捷列夫总结前人的不足,按照元素原子核电荷数递增的顺序将不同种类的元素排入周期表。于是得到了我们今天的元素周期表。在这张表里原子核电荷数即为原子在周期表中的序数。根据我们初中所学的原子核外电子排布知识,即可得到以下的结论。 [板书] 第一节元素周期表 一、元素周期表 原子序数=核电荷数=质子数=核外电子数 [过渡]今后,我们只需知道原子的核电荷数或质子数,就能知道该元素在周期表中的排序了。那我们要想再具体的定位该元素在周期表中的位置,就需要更加详尽的表述喽。 [提问]请同学们数一数,元素周期表有多少个横行? 7个横行 [讲]我们把元素周期表中的每一个横行称作一个周期,每一个纵行称作一个族。下面,我们先来认识元素周期表中的横行——周期。 [板书] 1.周期: [讲]下面请同学们看元素周期表中的前三周期,确定每一周期有多少种元素。然后,在试着数数下面的几个周期,确定每一周期有多少种元素 第一周期2种,第二、三周期8种,第四、五周期18种 第六周期和第七周期由于分别有镧系和锕系元素存在,所以这两个周期应该有32种元素。由于第七周期还有部分元素未发现,所以目前在元素周期表中只有26种元素。一、二、三周期元素种类较少,我们称之为短周期,其它四个周期为长周期。第七周期为排满,故有时也被称为不完全周期。帮助学生正视科学探索的艰辛,培养学生热爱科学,追求真理的执着理念 结合核外电子排布知识 以第三周期前三种元素:Na、Mg、Al 核外电子排布为例 重点内容 逐层分析
第一章物质结构元素周期律 第一节元素周期表第1课时 一、教材分析 《元素周期表》是人教版高中化学必修一第一章第一节的教学内容,主要学习元素周期表的结构;掌握周期、族的概念;以及学会推算元素在周期表中的位置。本节是学好元素性质的基础,也是学好元素周期律的基础。 二、教学目标: 1、知识目标:认识元素周期表的结构;掌握周期、族的概念; 2、能力目标:学会推算元素在周期表中的位置。 3、情感目标:学会合作学习 三、重点和难点元素周期表的结构;推算元素在周期表中的位置。 四、学情分析 元素周期表在初中化学中已有简单介绍,学生已经知道了周期表的大致结构,并会用周期表查找常见元素的相关信息,但对元素与原子结构的关系及元素周期表的具体结构还没有更深的理解。 五、教学方法讨论、讲解、练习相结合 六、课前准备 1、学生的学习准备:预习元素周期表的结构;初步理解周期、族的概念 2、教师的教学准备:多媒体课件制作,课前预习导学案,课内探究导学案,课后延伸拓展 学案,教学环境设计和布置,合理给学生进行分组。 七、课时安排一课时 八、教学过程 (一)预习检查、总结疑惑 检查落实学生的预习情况并了解学生的疑惑,使教学具有了针对性。 (二)情境导入、展示目标 〔提问〕1、原子序数与元素原子结构有什么样的关系? 2、周期表中前18号元素有哪些? 3、表格是按什么原则编排的? 注:编排三原则 (1)按原子序数递增顺序从左到右排列。 (2)将电子层数相同的元素排列成一个横行。 (3)把最外电子层的电子数相同的元素按电子层数递增顺序由上而下排列成纵行。 教师:这节课我们就来学习元素周期表的结构。大家看本节的目标、重点、难点。然后看第一个探究问题,元素周期表的结构如何?每个横行、纵行分别是指什么?已经布置了同学们课前预习这部分,检查学生预习情况并让学生吧预习过程中的疑惑说出来。
【教学设计】第二单元第四节 元素及元素周期表(第二课时) 一、学习目标: 1. 知道元素的简单分类;元素符号所表示的意义;会正确书写元素符号并记住常见的元素符号。 2. 知道元素周期表的结构;能根据原子序数在元素周期表中找到指定元素和有关该元素的一些其它的信息。 二、学习过程: (一)、知识链接: 1、构成物质的基本粒子有、、。 如水是构成的,汞是由构成的,氯化钠是由构成的。 2、决定元素种类的是原子的数,钠原子和钠离子是否属于同种元素?。为什么?。元素:具有相同(即)的一类原子总称。 (二)、温故知新: 1、下列说法有没有错误?将错误的说法加以改正 ⑴水是由一个氧元素和两个氢元素组成的。 ⑵二氧化硫中有硫和氧两个元素。 ⑶水是由氢原子和氧原子构成的. ⑷水分子是由氢元素和氧元素组成的 ⑸一个水分子是由2 个氢原子和1 个氧原子构成的 2、填上合适的元素:
⑴地壳中含量最多的元素是: ⑵地壳中含量最多的非金属元素 ⑶地壳中含量最多的金属元素 ⑷生物细胞中含量最多的元素 3、联系生活:小华用凉开水养鱼,不久鱼全死了,下列哪个是合理的解释 A、凉开水中几乎不含氧元素 B、凉开水中几乎不含氧原子 C、凉开水中几乎不含水分子 D、凉开水中几乎不含氧气 4、5 题见课件。 (三)、自主学习与探究: 阅读课本46-47 页,完成自主学习知识点一、二。 知识点一:元素的种类 1. 稀有气体: 2. 金属元素: 3. 非金属元素:. 知识点二:元素的表示---国际通用(元素符号) 1. 为什么要使用元素符号? 2. 元素符号的读法: 3 .元素符号的书写: (1)由一个字母表示的元素: (2)由两个字母表示的元素: 4.元素符号的意义
第一节元素周期表 第1课时元素周期表 多选 9.X、Y、Z均为短周期元素,在元素周期表中它们的相对位置如下表所示,已知3种元素的原子序数之和为31,下列有关叙述中正确的是()。 A. B.X的氧化物XO有毒 C.Y能与氢氧化钠溶液反应生成氢气 D.Z的氧化物只能与酸反应 10.下列叙述不正确 ...的是()。 A.除0族元素外,短周期元素的最高正化合价在数值上都等于该元素所属族的族序数B.除短周期外,其他周期均为18种元素 C.副族元素没有非金属元素 D.第ⅢB族中所含元素种类最多 12.下列各表为周期表的一部分(表中数字为原子序数),其中正确的是()。 A
B C D 13.A、B、C、D、E五种元素在元素周期表中的位置如图1-1-1所示,已知E的原子序数为x,则五种元素的原子序数之和不可能 ...为()。 图1-1-1 A.5x B.5x+10 C.5x+14 D.5x+25 14.已知115号元素原子有七个电子层,且最外层有5个电子,试判断115号元素在元素周期表中的位置是()。 A.第七周期第ⅢA族B.第七周期第ⅤA族 C.第五周期第ⅦA族D.第五周期第ⅢA族 15.目前人类已发现的非金属元素除稀有气体元素外,共有16种。下列对这16种非金属元素的相关判断()。 ①都是主族元素,最外层电子数都大于4;②单质在反应中都只能作氧化剂;③氢化物常温下都是气态,所以又都叫气态氢化物;④氧化物常温下都可以与水反应生成酸。 A.只有①②正确B.只有①③正确 C.只有③④正确D.①②③④均不正确 16.已知X、Y、Z、W是短周期中的四种非金属元素,它们的原子序数依次增大。X
第一节元素周期表第1课时(导学案) 课前激趣导案 【情景导入】 1907年1月27日,俄国首都彼得堡寒风凛冽,太阳黯淡无光,寒暑表上的水银柱降到零下20多度,街上到处点着蒙有黑纱的灯笼,显出一派悲哀的气氛。几万人的送葬队伍在街上缓缓移动着,在队伍最前头,既不是花圈,也不是遗像,而是由十几个青年学生扛着的一块大木牌,上面画着好多方格,方格里写着“C”、“O”、“Fe”、“Zn”等元素符号。原来,死者是著名的俄国化学家门捷列夫,木牌上画着好多方格的表是化学元素周期表——门捷列夫对化学的主要贡献。 一、学习目标 1.掌握元素周期表的结构 2.理解原子结构与周期和族的关系 3.根据原子序数推断元素在周期表中的位置 二、学习重难点 掌握元素周期表的结构;根据原子序数推断元素在周期表中的位置。 三、预习内容(分为两组问题,1~2为第一组问题,3为第二组问题) 1.原子序数:按照元素在周期表中的顺序给元素编号,得到原子序数, 原子序数=________=________=________ 2.周期表编排规则 把:________________________叫周期。 把:________________________叫族。 3.元素周期表的结构 周期名称周期别名元素总数规律 周期()个,横行()个第1周期 短周期 周期数== ;各周期元素 从左向右都是原子序数;第2周期
第3周期(第7周期排满是第118号元 素) 第4周期 长周期 第5周期 第6周期 第7周期不完全周期26(当前) 族名类名核外最外层电子数规律 族()个 纵行()个 ()个主族()个副族()个0族()个第Ⅷ族主 族 第ⅠA族H和;主族数 == ; 各主族元素从上向下 都是原子序数; 第8、9、10三个纵行 为第Ⅷ族外,其余15 个纵行,每个纵行标为 一族。 第ⅡA族碱土金属 第ⅢA族无 第ⅣA族碳族元素 第ⅤA族氮族元素 第ⅥA族氧族元素 第ⅦA族元素 0族或 副 族 第ⅠB族、第ⅡB族、第ⅢB族、第ⅣB族、 第ⅤB族、第ⅥB族、第ⅦB族、第Ⅷ族 全部是元素; 又称为元素 四、学习探究 探究点一:元素周期表结构如何理解?(分为两组,1为第三组问题,2为第四组问题,3为第5组问题) 1、画出1~20号元素核外电子排布(原子结构示意图) 2、以原子序数为横坐标,最外层电子数为纵坐标,画出直方图。 3、⑴元素周期表有多少个横行?多少个纵行?⑵周期序数与什么相关?⑶在每一个 纵行的上面,分别有罗马数字Ⅰ、Ⅱ、……及A、B、0等字样,它们分别表示什么 意思呢?⑷零族元素都是什么种类的元素?为什么把它们叫零族?⑸第Ⅷ族有 几个纵行?⑹分析元素周期表中从ⅢB到ⅡB之间的元素名称,它们的偏旁部首 有什么特点?说明什么? 探究点二:如何确定元素在周期表中的位置?(1~2为第六组问题) 1、由原子结构来确定,原子序数= ;电子层数= ; 最外层电子数= ; 例如:某元素有三个电子层,最外层有三个电子,可知该元素在周期表中的位置________________ 。
第一节元素周期表 一、元素周期表概述 1、门捷列夫周期表 按相对原子质量由小到大依次排列,将化学性质相似的元素放在一个纵行,通过分类、归纳制出的第一张元素周期表。 2、现行常用元素周期表 ⑴周期表的编排原则 ①按原子序数递增的顺序从左到右排列 ②将电子层数相同的元素排成一个横行 ③把最外层电子数相同的元素(个别例外)按电子层数递增的顺序从上到下排成纵行 ⑵周期表的结构 七个横行;7个周期[三短(2、8、8)、三长(18、18、32)、一不完全] 18个纵行(列),16个族: 7个主族(ⅠA~ⅦA);(1、2、13~17列)7个副族(ⅠB~ⅦB);(3~12列) Ⅷ族:3个纵行;(8、9、10列)零族:稀有气体(18列) 周期表中有些族有特殊的名称: 第ⅠA族:碱金属元素(不包括氢元素)第ⅦA族:卤族元素0族:稀有气体元素3、元素周期表的结构与原子结构的关系 原子序数==核电荷数==质子数==核外电子数周期序数==原子的电子层数 主族序数==最外层电子数==最高正价数(O、F除外)==价电子数 非金属的负价的绝对值==8-主族序数(限ⅣA~ⅦA) 4、由原子序数确定元素位置的规律 ⑴主族元素:周期数==核外电子层数;主族的族序数==最外层电子数 ⑵确定族序数应先确定是主族还是副族,其方法是采用原子序数逐步减去各周期的元素种数,最后的差 值即可确定。 基本公式:原子序数-零族元素的序数(或各周期元素总数)== 差值 ①对于短周期元素: 若差值为0,则为相应周期的零族元素;若0<差值≤7,则元素在下一周期,差值即为主族序数。 ②对于长周期元素:
差值为1~7时,差值即为族序数,位于Ⅷ族左侧; 差值为8、9、10时,为Ⅷ族元素。 差值为11~17时,再减去10所得最后差值,即为Ⅷ族右侧的族序数。 若差值>17,再减14,按同上方法处理。 例:37号和114号元素的推导。 5、同主族元素上、下相邻元素原子序数推导规律: ⑴ⅠA、ⅡA族元素: 元素的原子序数==上一周期的元素的原子序数+上一周期的元素总数 ⑵ⅢA~ⅦA、0族元素: 元素的原子序数==上一周期的元素的原子序数+本周期的元素总数 例1:甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是 A. x+2 B. x+4 C. x+8 D. x+18 例2:X、Y、Z是周期表中相邻的三种短周期元素,X和Y同周期,Y和X同主族,三种元素原子的最外层电子数之和为17,核内质子数之和为31,则X、Y、Z分别是( ) A. Mg、Al、Si B. Li、Be、Mg C. N、O、S D. P、S、O 二、原子结构 1 A Z X 电量:Z==e- ⑴、构成原子的微粒数目的定量关系 符号X表示质子数为Z,质量数为A的一类原子。 ⑵、构成原子的各种微粒存在下列定量关系: ①核电荷数==质子数==核外电子数 ②质量数(A)==质子数(Z)+中子数(N) ③质量数(A)≈原子的相对原子质量 核外电子(e-) 带负电
教师学科教案[ 20 – 20 学年度第__学期] 任教学科:_____________ 任教年级:_____________ 任教老师:_____________ xx市实验学校
《元素周期表》(第一课时) 元素周期表教学设计 一、教材分析 《元素周期表》是高一化学必修2第一节内容,所有的化学知识都会用到元素周期表,是化学学科的基石。 本章以元素周期表和元素周期律为框架,首先介绍元素周期表,再通过一些事实和实验归纳元素周期律。 本节从化学史引入,直接呈现元素周期表的结构。在学生了解一些元素性质和原子结构示意图的基础上,以元素周期表的纵向结构为线索,以碱金属和卤素元素为代表,通过比较原子结构(电子层数,最外层电子数)的异同,突出最外层电子数的相同;并通过实验和事实来呈现主族族元素性质的相似性和递变性。帮助学生认识元素性质与原子核外电子数的关系。 本节内容要达到“能结合有关数据和实验事实认识元素周期律,了解原子结构与元素性质的关系;能描述元素周期表的结构,知道金属、非金属在元素周期表中的位置及其性质的递变规律”。本课是时内容要求达到“能结合有关数据和实验事实认识元素周期律,初步了解原子结构与元素性的关系;能描述元素周期表的结构”。 二、学情分析 学生在初三对1-20号元素的原子结构和元素周期表都有初步了解,但在学习中较多是用机械记忆的方法,对知识的理解不够深刻,易遗忘,解决实际问题的能力较低。这一节课是新学期的第一堂化学课,同时这部分内容又比较枯燥,如何激发学生的学习兴趣,如何引导学生从方法的高度来重新审视这一内容应成为教学设计的关键。 三、教学目标 1、知识与技能 使学生初步掌握元素周期表的结构,以及周期、族等概念。 2、过程与方法 (1)通过学生亲自动手编排元素周期表培养学生的抽象思维能力和逻辑思维能力; (2)通过抢答对身边元素有所了解和重视,分组画曲线培养理性思维能力;
中考化学考点全解考点九元素符及元素周期表 文档编制序号:[KK8UY-LL9IO69-TTO6M3-MTOL89-FTT688]
元素符号及元素周期表元素符号的写法: ①由一个字母表示的元素符号要大写,如 :H、C、 S、P,K。 ②由两个字母表示的元素符号,第一个字母要大写,第二个字母要小写(即“一大二小”)。如:Na、Mg、 Ca、Zn、Si。 元素周期表的结构: ①每一横行(周期):元素周期表每一横行叫做一个周期.共有7个横行,即7个周期。每个周期开头是金属元素(第一周期除外),靠近尾部是非金属元素,结尾的是稀有气体元素。同一周期元素的原子具有相同的电子层数。 ②每一纵行(族):元素周期表共有18个纵行,每一个纵行叫做一个族(第8,9,10三个纵行共同组成一个族),共有16个族。 ③每一格:在元素周期表中,每一种元素均占据一格。对于每一格,均包含元素的原子序数、元素符号、元素名称、相对原了质量等内容,如下图所示: 元素符号和化学式的关系: 化学用语元素符号化学式 易错考点
例题解析 例题1:近阶段多家媒体报道:云南铬污染和问题胶囊铬超标影响甚广.有关铬元素在元素周期表中的位置如图所示.从图中获取的信息正确的是()A.该元素为非金属元素 B.该元素在地壳中的含量为52.00% C.该元素的原子序数为52
D.该元素的原子核外有24个电子 答案:D 解析:A、根据化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁;因此该元素属于金属元素,故A正确; B、根据元素周期表中的信息,52.00是该元素的相对原子质量,而不是该元素在地壳中含量.故B错误; C、根据元素周期表中的信息可知,该元素原子的原子序数为24,故C错误; D、根据元素周期表中的信息可知,铬元素的原子序数=质子数=核外电子数,铬元素的原子核外有24个电子,故D正确. 例题2:下列符号中,既能表示一种元素,又能表示该元素的一个原子,还能表示由该元素组成的单质的是() A、H 2 B.N C.Fe D.CO 2 答案:C 解析:由原子构成的物质,元素既能表示一种元素,又能表示该元素的一个原子,还能表示由该元素组成的单质 课后练习 1、如图为元素周期表的一部分.下列说法不正确的是() A.钠、镁、铝三种原子的电子层都有3个层 B.氢、锂、钠三种原子的最外层都有1个电子
第一章第一节第1课时 一、选择题 1.下列叙述不能作为元素周期表中元素排列顺序依据的是() A.原子的核电荷数 B.原子的中子数 C.原子的质子数 D.原子的核外电子数 答案:B 点拨:元素周期表中元素是按照原子序数由小到大的顺序排列的,而在原子中,原子序数=核电荷数=质子数=核外电子数,但是不一定等于中子数,所以不能用原子的中子数作为元素周期表中元素排列顺序的依据。 2.在周期表中,第3、4、5、6周期元素的数目分别是() A.8,18,32,32 B.8,18,18,32 C.8,18,18,18 D.8,8,18,18 答案:B 点拨:元素周期表中1~6周期的元素种类数分别是2,8,8,18,18,32,故选B。 3.(2014·经典习题选萃)下列对于元素周期表结构的叙述中正确的是() A.7个横行代表7个周期,18个纵行代表18个族 B.副族元素中没有非金属元素 C.除第1周期外,其他周期均有18种元素 D.碱金属元素是指ⅠA族的所有元素 答案:B 点拨:在周期表中18个纵行代表16个族,即7个主族、7个副族、1个0族、1个第Ⅷ族,A 项错误;副族元素全部是金属元素,B项正确;第2、3周期均为8种元素,第6周期有32种元素,C项错误;碱金属元素是指ⅠA族除H以外的所有元素,D项错误。 4.(2014·试题调研)原子序数为Z的元素R,在周期表中位于A、B、C、D四种元素的中间,A、B、C、D四种元素的原子序数之和为下列数据,其中不可能的是() A.4Z C.4Z+5 D.4Z+14
答案:C 点拨:周期表中同一周期左右相邻原子序数差1;由题图中结构可知,C不可能在第1周期,故C与R或R与D的原子序数之差可能为8、18、32,即C、D原子序数之和存在三种情况:2Z、2Z +10或2Z+14,而A、B原子序数之和可能为2Z,即A、B、C、D四种元素的原子序数之和可能为4Z、4Z+10或4Z+14。 5.(2014·西安市一中高一考试)同一主族的两种元素的原子序数之差不可能是() A.16 B.26 C.46 D.36 答案:C 点拨:以第ⅠA族元素的原子序数为例:H(1)、Li(3)、Na(11)、K(19)、Rb(37)、Cs(55),若两元素为Li和K,原子序数差值为16;若两元素为Na和Rb,原子序数差值为26;若两元素为K和Cs,原子序数差值为36。 6.(2014·吉安一中高一月考)由两种短周期元素组成的化合物,其中两种元素的原子个数比为,若两种元素的原子序数分别为a和b,则a和b的关系可能是() ①a=b+4;②a+b=8;③a+b=30;④a=b+8 A.①②③④B.①③④ C.②④D.③④ 答案:A 点拨:组成AlF3的两元素的原子数的关系符合a=b+4; 组成NH3的两元素的原子序数的关系符合a+b=8; 组成AlCl3的两元素的原子序数的关系符合a+b=30; 组成SO3的两元素的原子序数的关系符合a=b+8。 7.(2014·经典习题选萃)如图是元素周期表的一部分,已知A、B、C、D、E五种原子核外共有85个电子,其中只有C元素原子次外层电子数为18,则B元素是() A.铝B.镁 C.磷D.硫 答案:C
元素及元素周期表 一.选择题: 1.地壳中含量最多的金属元素是 ( ) A .氧 B .硅 C .铝 D .铁 2.决定元素种类的是 ( ) A .质子数 B .电子数 C .中子数 D .核外电子数 3.下列化学符号中数字表示的意义正确的是 ( ) A .CO 2:“2”表示一个二氧化碳分子含有两个氧原子 ] B .2Na :“2”表示两个钠元素 C . :“+2”表示镁离子带有两个单位正电荷 D .S 2- :“2–”表示硫元素的化合价为负二价 4.某粒子的结构示意图如图所示,对该粒子的说法错误的是( ) A .[ B . 核电荷数为12 B .核外有3个电子层 C .带12个单位正电荷 D .在化学反应中,易失去最外层上的2个电子 5.根据右图提供的信息,下列说法正确的是( ) A .钠原子最外层有11个电子 B .钠的相对原子质量是 C .钠属于非金属元素 D .钠的原子序数为11 6.生活中常接触到“加碘食盐”、“高钙牛奶”,其中的“碘”和“”应理解为( ) A.单质 B.分子 C.元素 D.原子 7.最近,“镉大米”成为公众关注的热点问题之一。据了解,含镉的大米对人的肝肾损害比较大。镉(Cd)的原子序数为48,中子数为64,下列说法错误的是( ) 【 A 、镉原子的质子数为48 B 、镉原子的相对原子质量为112g C 、镉是金属元素 D 、镉原子的核外电子数为48 8.正确读写化学符号是学好化学的基础。铝元素符号书写正确的是( ) 9.硒被誉为“抗癌大王”。根据右图提供的硒的有关信息,下列说法中,正确的是 ( ) Mg +2
A.硒属于金属元素 B.硒的原子序数是34 C.硒的原子结构示意图中x=4 D.硒的相对原子质量是 g . 10.近来中国部分地区出现镉污染的大米,食用后对人体有害。下列有关镉 的说法中错误 ..的是() A.镉的原子序数是48 B.镉属于非金属元素 C.镉的元素符号是Cd D.镉的相对原子质量是 11.氦是太阳中含量较多的元素,其元素符号为() A.H B. He C. N 12.我市盛产茶叶,“雪青”“清润茗芽”等绿茶享誉省内外。绿茶中的单宁酸具有抑制血 压上升、清热解毒、抗癌等功效,其化学式为C 76H 52 O 46 ,下列说法不正确的是() A.单宁酸由碳、氢、氧三种元素组成 | B.一个单宁酸分子由76个碳原子、52个氢原子和46个氧原子构成 C.单宁酸分子中碳、氢、氧原子个数比为38︰26︰23 D.一个单宁酸分子中含26个氢分子 13.钇(Y)是一种稀土元素,该元素在元素周期表中的信息如图所示。下列有关说法错误的是() A.钇属于金属元素 B.钇原子中的质子数为39 C.钇元素的相对原子质量为 D.钇原子中的中子数为39 14.根据右表提供的信息,下列判断错误的是() } 的原子序数是12 原子核外有三个电子层 C.表中所列元素均为金属元素 D.元素所在周期的序数等于其原子的电子层数
必修2第一章物质结构元素周期律 第一节元素周期表 第1课时 2、据报道, Jl 二可有效地治疗肝癌,该原子核内的中子数与核外电子数之差为( ) 3、在"二;中,m n 、p 、q 表示X 的四个角码,若 X i 和X ?的q 均为1, m p 的值相等,则 X i 和X 2表示的可能是 A 、不同种元素的原子 B 、同种元素的不同种原子 C 同种元素不同种原子形成的离子 D 、不同元素的离子 4、某元素原子核内质子数为 m ,中子数为n ,则下列论断正确的是 A 、 不能由此确定该元素的相对原子质量 B 、 这种元素的相对原子质量为 m+n C 、 若12 C 原子质量为 Wg ,则此元素原子的质量为 (m+n )Wg D 、该元素原子核内中子的总质量小于质子的总质量 5、道尔顿的原子学说曾经起了很大的作用。他的学说中主要有下列三个论点:①原子是不 能再分的粒子;②同种元素的原子的各种性质和质量都相同; ③原子是微小的实心球体。从 现代原子一一分子学说的观点看,你认为不正确..的是 ( ) A .只有① B .只有② C .只有③ D .①②③ 6、 据报道,月球上有大量 3 He 存在,以下关于3 He 的说法正确的是 ( ) A 、是4He 的同素异形体 B 、比4He 多一个中子 C 、是4 He 的同位素 D 、比4 He 少一个质子 7、 1 mol D 2O 和1 mol H 2O 不相同的是 ( ) A .含氧原子的数目 B .质量 C. 含有质子的数目 D ?含有中子的数目 & n mol H 2与n mol T 2气体不同之处是 ( ) A ?物质的量 B ?原子数 C .质量 D .体积(相同状况) 78 80 9、Se 是人体必需微量元素,下列关于 34 Se 和34 Se 说法正确的是 ( ) 1、钛(Ti )金属常被称为未来钢铁。钛元素的同位素 中子数不可.能.为 A 、 28 B 、 30 C 、 26 姓名 ________ 46 47 Ti 48 Ti 22 li 、 22 Ti 、 22 Ti D 、24 成绩 _________ 49> Ti 、52Ti 中, ( ) A. 32 B.67 C.99 D.166 78 80 A . 34 Se 和34 Se 互为同素异形体 78 80 B . 34 Se 和34 Se 互为同位素
— / [ *
、
…
氢(H) [ 主要性质和用途 熔点为℃,沸点为℃,密度为0. 089 88 g/L(10 ℃)。无色无臭气体,不溶于水,能在空气中燃烧,与空气形成爆炸混合物。工业上用于制造氨、环已烷、甲醇等。 发现 1766年由卡文迪许()在英国判明。 氦(He) ; 主要性质和用途 熔点为℃(加压),沸点为-℃,密度为 5 g/L(0 ℃)。无色无臭气体。化学性质不活泼。用于深海潜水、气象气球和低温研究仪器。 发现 1895年由拉姆塞(Sir )在英国、克利夫等(和在瑞典各自独立分离出。 锂(Li)
。 主要性质和用途 熔点为℃,沸点为1 347 ℃,密度为g/cm3(20 ℃)。软的银白色金属,跟氧气和水缓慢反应。用于合金、润滑油、电池、玻璃、医药和核弹。发现 1817年由阿尔费德森(. Arfvedson)在瑞典发现。 铍(Be) 主要性质和用途 ~ 熔点为1 278±5 ℃,沸点为2 970 ℃(加压下),密度为g/cm3(20 ℃)。较软的银白色金属,在空气和水中稳定,即使在红热时也不反应。用于与铜和镍制合金,其导电性和导热性极好。 发现 1798年由沃克兰()发现 硼(B) 主要性质和用途 * 熔点为2 300 ℃,沸点为3 658 ℃,密度为g/cm3(β-菱形)(20 ℃)。具有几种同素异形体,无定形的硼为暗色粉末,跟氧气、水、酸和碱都不起反应,跟大多数金属形成金属硼化物。用于制硼硅酸盐玻璃、漂白和防火。 发现 1808年由戴维(Sir Humphrey Davy)在英国、盖-吕萨克()和泰纳)在法国发现。 碳(C)
第三节元素周期表 ●教学目标 1.使学生了解元素周期表的结构以及周期、族等概念。 2.使学生理解同周期、同主族元素性质的递变规律,并能运用原子结构理论解释这些递变规律。 3.使学生了解原子结构、元素性质及该元素在周期表中的位置三者间的关系,初步学会运用周期表。 4.通过对元素周期律的发现及元素周期表的编制过程的了解,使学生正确认识科学发展的历程,并以此来引导自己的实践,同时促使他们逐渐形成为科学献身的高贵品质。 5.使学生了解元素周期律和周期表的意义,认识事物变化由量变引起质变的规律,对他们进行辩证唯物主义教育。 6.使学生对核素、同位素及元素相对原子质量的测定有常识性的认识。 ●教学重点 元素周期表的结构、元素的性质、元素在周期表中的位置与原子结构的关系。 ●教学难点 元素的性质、元素在周期表中的位置和原子结构的关系、核素、同位素。 ●课时安排 3课时 ●教学用具 投影仪、胶片、元素周期表挂图 ●教学方法 启发、诱导、阅读、讨论、练习、探究等。 ●教学过程 ★第一课时 [引言]上一节我们学习了元素周期律,知道元素的性质随着原子序数的递增而呈现周期性的变化。那么,有没有一种工具可以把我们已知的一百多种元素之间的这种周期性很好地表现出来呢答案是肯定的。那就是元素周期表,也是我们本节课所要讲的主要内容。 [板书]第三节元素周期表(第一课时) [师]请大家拿出自己亲手绘制的元素周期表。 [学生取表,教师把元素周期表的挂图挂于黑板上] [师]根据元素周期律,把电子层数目相同的各种元素,按原子序数递增的顺序从左到右排成横行;再把不同横行中最外层的电子数相同的元素,按电子层数递增的顺序由上而下排成纵行。这样,就可以得到一个表,这个表就叫元素周期表。元素周期表有不同的形式,我们这里介绍的是其中一种常见的形式。 元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律,是我们学习化学的重要工具。下面我们就来学习元素周期表的有关知识。 首先,我们来认识元素周期表的结构。 [板书]元素周期表的结构 [师]数一数元素周期表有多少个横行多少个纵行 [生](数后回答)有7个横行,18个纵行。 [师]对。我们把元素周期表中的每一个横行称作一个周期,每一个纵行称作一族。下面,我们先来认识元素周期表中的横行——周期。 [板书]1.周期 [师]元素周期表中共有7个周期,请大家阅读课本P104的有关内容。 [学生活动]
物质结构及元素周期表 为您服务的教育网络 主题一材料结构和元素周期表 一、审查考试地点 1.考试网站网络建设 (1)元素“位-结构-单位”之间的关系 (2)。推断元素的名称或位置是本节中常见的问题之一。其方法可以大致概括如下: 2.检查现场解释: 测试地点1:同一时期、同一主体群体性质变化的逻辑衍生关系1。相同周期和相同主族元素性质变化规律性质原子半径电子层结构电子损失能力获得电子能力金属非金属主价最高价氧化物酸相应水合物碱性非金属气态氢化物形成困难稳定性相同周期(从左到右)具有相同数量电子层的最外层电子的数量逐渐减少,最外层电子的数量逐渐减少,最外层电子的数量逐渐增加,最外层电子的数量逐渐减少,最外层电子的数量逐渐减少,最外层电子的数量逐渐增加,最外层电子的数量逐渐增加,最大正价(+1→+7)非金属负价=-(8族序数)酸度逐渐增加,最外层电子的数量XK碱度 随着主族(自上而下)电子层数的逐渐增加,最外层电子的数量也在逐渐增加,逐渐减少,逐渐增加,逐渐减少,逐渐减少,逐渐减少,最高正价=族序数(除O,F外)非金属负价=-(8-族序数)酸度逐渐减少,碱度逐渐增加,形成从难到易的稳定性逐渐增加,形成从易到难的稳
定性逐渐减少2。元素周期表中的“三角形”变化规律 如果元素a、b和c位于元素周期表中图5-1所示的位置,所有相关的性质都可以顺利释放。 1 为您服务的教育网络 订单(但D不能参与安排)。(1)原子半径:碳>氮>硼;(2)金属度:碳>碳>硼;(3)非金属:硼>碳>碳3。元素周期表(1)中的相似性规则与主族元素的性质相似(因为最外面的电子是相同的);⑵元素周期表中对角线位置(如2中的A、D位置)的元素具有相似的性质,如锂和镁、铍和铝、硼和硅等。 (3)相邻元素的性质差别不大。 测试点2元素周期定律的普通次定律 1.最外层电子数大于或等于3且小于8的元素必须是主族元素;最外层电子数为1或2的元素可以是主族、次族或0族(he)元素;最外层电子数为8的元素是稀有气体元素(氦除外)。 2.在元素周期表中,IIA族和IIA族元素的原子数有三种不同:①1-3周期(短周期)1元素的原子数不同;(2)第4和第5周期之间的差异为11;③第6和第7周期的差异为25。 3.在每个周期中排列的元素类型满足以下规则:如果n是周期序数,那么在奇数周期中它是(n?1)222(n?2)物种,物种处于偶数周期。2 4.在元素周期表中,除了第八族元素外,具有奇数(或偶数)原子序数的元素,元素所在的族的序数和主价也是奇数(或偶数)。
第一章第一节元素周期表知识点归纳
高中化学必修2知识点归纳总结 第一章物质结构元素周期律 第一节元素周期表 知识点一元素周期表 一、元素周期表的发现 1869年,俄国化学家门捷列夫指出第一张元素周期表。 编制原则:将元素按照相对原子质量由小到大的顺序排列,将化学性质的元素放在一个纵行。 二、原子序数: (1)按照元素在周期表中的顺序给元素编号。 (2)原子序数与原子结构的关系:原子序数=核内质子数=核电荷数=核外电子数 三、元素周期表的结构 1.元素周期表的编排原则: ①按原子序数递增的顺序从左到右排列 ②将电子层数相同 ..。(周期序数......的各元素从左到右排成一横行 =原子电子层数) ③把最外层电子数相同 ........的元素按电子层数递增的顺序从上到 下排成一纵行 ..。主族序数=原子最外层电子数 2.元素周期表的结构——周期和族 ①周期: (1)定义:具有相同电子层数的元素按照原子序数递增的顺序排列的一行,叫周期。(周期序数=原子电子层数) (2)元素周期表有7行,共有7个周期,从上到下依次为第一周期到第七周期。除第一周期外,每一周期的元素都是从
活泼金属元素开始,逐渐过渡到活泼非金属元素,最后以稀有气体元素结束。 (3)数目、分类及各周期特点 类别 周期序数 起止元素 包括元素种数 核外电 子层数 短周期 一 H —He 2 1 二 Li —Ne 8 2 三 Na —Ar 8 3 长周期 四 K —Kr 18 4 五 Rb —Xe 18 5 六 Cs —Rn 32 6 七 (不完全周期) Fr —112号 26(排满应为32种) 7 ②族: (1) 定义:最外层电子数相同的元素按电子层数递增的顺 序排成的纵行叫族。 (主族元素的族序数=元素原子的最外层电子数) (2)分类18个纵行,分为16个族。(7个主族;7个副族;族的分类、数目 分类依据 表示方法 列序号 族序号 主族(7个) 由短周期元素和长周期元素共同构成的族 用族序数(用大写罗马数字表示)后加字母A 表示 1、2、13、14、 15、16、17 ⅠA 、ⅡA 、ⅢA 、ⅣA 、ⅤA 、ⅥA 、ⅦA
必修二第一章第1节元素周期表(第1课时) ●学习目标 1.初步了解元素周期表的发展历程。 2.了解元素周期表的编排原则及结构。 3.能描述元素在元素周期表中的具体位置。 ●新知预习 1.元素周期表的编排原则 (1)按__________递增顺序从左到右排列; (2)将__________相同的元素排成一横行,共有__个横行。 (3)把_______________相同的元素按__________递增顺序从上到下排成一纵行,共有____列。2.元素周期表的结构 (1)周期(横行)——“3短4长” “3短”——三个短周期,即第__________周期; “4长”——四个长周期,即第_____________周期。 (2)族(纵行)——“18个纵行16个族” (3)元素位置与原子结构的关系 周期序数=__________,主族序数=_____________。 3.常见族的特别名称 第ⅠA族(除H外)__________元素,第ⅦA族__________元素,0族__________元素,第__________族和__________族称为过渡元素。 ●自主学习 1.元素周期表提供了每种元素的哪些信息? 提示:在元素周期表中,每一种元素均占据一格。 对于每一格,均包含元素的原子序数、元素符号、 元素名称、外围电子排布、相对原子质量(或质量 数)等内容。 此外,在周期表中,还用不同的颜色来表示金属、 非金属或过渡元素等。若元素符号呈红色表明该元 素是放射性元素。 2.第一张元素周期表是谁排成的?跟现在的元素周期表排列方式一样吗? 提示:历史上第一张元素周期表是1869年,俄国化学家门捷列夫排成的;他是将元素按照相对原子质量由小到大依次排列,将化学性质相似的元素放在一个纵行。通过分类、归纳,制成了第一张元素周期表,揭示了化学元素间的内在联系,使其构成了一个完整的体系。 第一张元素周期表与现在使用的元素周期表排列方式不一样。主要区别是元素周期表中元素的排序依据由相对原子质量改为原子的核电荷数。即现在我们使用的元素周期表是按元素原子的核电荷数由小到大的顺序排列而成的。 ●师生互动 1、元素周期表的发展历程
第一节元素周期表课时1元素周期表 学校:___________姓名:___________班级:___________考号:___________ 一、单选题 1.在元素周期表中横行的编排依据是() A.按元素的相对原子质量递增顺序从左到右排列 B.按元素的原子核外电子层数依次递增顺序从左到右排列 C.电子层相同的元素,按原子序数依次递增顺序从左到右排列 D.按元素的原子最外层电子数依次递增顺序从左到右排列 2.下列有关元素周期表中“族”的说法正确的是() A.元素周期表中共有七个主族、八个副族、一个0族 B.同一主族元素原子最外层的电子数目不一定相同 C.同一主族元素的化学性质相同 D.族序数后标注A的元素是主族元素 3.下列各组元素中,属于同一周期的是 A.Na、P B.N、Cl C.F、Mg D.O、S 4.下列叙述正确的是() A.ⅡA族某元素的原子序数为a,则原子序数为a+1的元素一定位于ⅢA族 B.除短周期外,其他周期均有32种元素 C.原子最外层只有2个电子的元素可能是金属元素,也可能是非金属元素 D.Ca是碱金属元素 5.下列选项能确定主族元素在元素周期表中所处位置的是() A.电子层数和最外层电子数 B.核内中子数 C.次外层电子数 D.相对原子质量 6.原子序数为83的元素位于:①第五周期;②第六周期;③ⅣA族;④ⅤA族;⑤ⅡB族,其中正确的组合是( ) A.①④B.②③C.②④D.①⑤ 7.关于元素周期表的说法中正确的是() A.元素周期表共7个周期、18个族B.38号元素位于第五周期第IIA族C.非金属元素均位于周期表右侧D.第六周期共计18种元素
教学步骤、内容 【引入】活泼的金属元素Na的性质是我们所熟知的,现象是本质的反应,宏观是微观的体现。现在让我们从原子结构这一微观角度来研究微观结构与宏观性质的关系。 【板书】元素的性质与原子结构的关系 一、碱金属元素 【科学探究一】请同学们看书本P5,并完成该表。由此可以得出什么结论?填写情况,总结异同点元素名称核电荷数原子结构示意图最外层电子数电子层数 碱 金 属 元 素 【板书】1、在结构上的相似性与递变性 相同点:最外层电子数都相同为1。 不同点:核电荷数从Li到Cs逐渐增多,电子层数依次增多,从2层增大到6层。 【讲解】金属性:指气态原子失去电子的能力大小的性质(由电离能的大小确定)。 还原性:指含有易失电子元素的物质的性质。具有还原性的不一定有金属性 【思考与交流】物质的性质主要取决于原子的最外层电子数,从碱金属原子的结构可推知其化学性质如何?是否完全相同? 【结论】最外层都有1个电子,化学性质相似;随着核电荷数的增加,原子的电子层数递增,原子核对最外层电子的引力逐渐减弱,金属性逐渐增强。 【讲解】因此、碱金属最外层上都只有一个电子,化学反应中易失去一个电子,形成+1价的阳离子,并能与氧气等非金属元素及水发生化学反应。 【实验一】取钾、钠各一粒,分别放在石棉网上的左、右两边,同时加热。观察实验的现象。 【现象】钾首先熔化(熔点低),先与氧气发生反应,后钠再熔化与氧气反应。 【板书】2、化学性质 (1)、碱金属与氧气的反应 【思考与交流】请写出钠与氧气在加热条件下的化学反应方程式,并尝试的写出锂、钾与氧 气在加热条件下的化学反应方程式。 碱金属与氧气的化学反应方程式(加热) 锂O Li O i 2 2 2 4L燃烧 +(白色、氧化锂) 钠 2 2 2 Na O Na O燃烧 +(淡黄色、过氧化钠)
第一节元素周期表 第1课时 教学目标 一、知识目标 1.使学生了解元素周期表的结构以及周期、族等概念。 2.使学生了解原子结构、元素性质及该元素在周期表中的位置三者间的关系,初步学会运用周期表。 二、能力目标 通过对原子结构的初步认识,树立对立统一的观点,知道有关元素、核素、同位素的涵义及其简单的计算。 三、德育目标 1.通过对元素周期表的编制过程的了解,使学生正确认识科学发展的历程,并以此来引导自己的实践,同时促使他们逐渐形成为科学献身的高贵品质。 2.使学生了解元素周期表的意义,认识事物变化由量变引起质变的规律,对他们进行辩证唯物主义教育。 3.使学生对核素、同位素及元素相对原子质量的测定有常识性的认识。 教学重点 元素周期表的结构、元素在周期表中的位置与原子结构的关系。 教学难点 元素在周期表中的位置和原子结构的关系、核素、同位素。 教学用具 投影仪、胶片、元素周期表挂图 教学方法 启发、诱导、阅读、讨论、练习、探究等。 教学过程 一、引入新课 [引言]通过我们学习知道元素有一百多种。那么,有没有一种工具可以把我们已知的一百多种元素之间的这种周期性很好地表现出来呢?答案是肯定的。那就是元素周期表,也是我们本节课所要讲的主要内容。 二、新课教学 [板书]第一节元素周期表(第一课时) 元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律,是我们学习化学的重要工具。下面我们就来学习元素周期表的有关知识。 首先,我们来认识元素周期表的结构。 [板书]元素周期表的结构 [师]数一数元素周期表有多少个横行?多少个纵行? [生](数后回答)有7个横行,18个纵行。 [师]对。我们把元素周期表中的每一个横行称作一个周期,每一个纵行称作一族。下面,我们先来认识元素周期表中的横行——周期。 [板书]1.周期