
咼考专题练习 工艺流程题
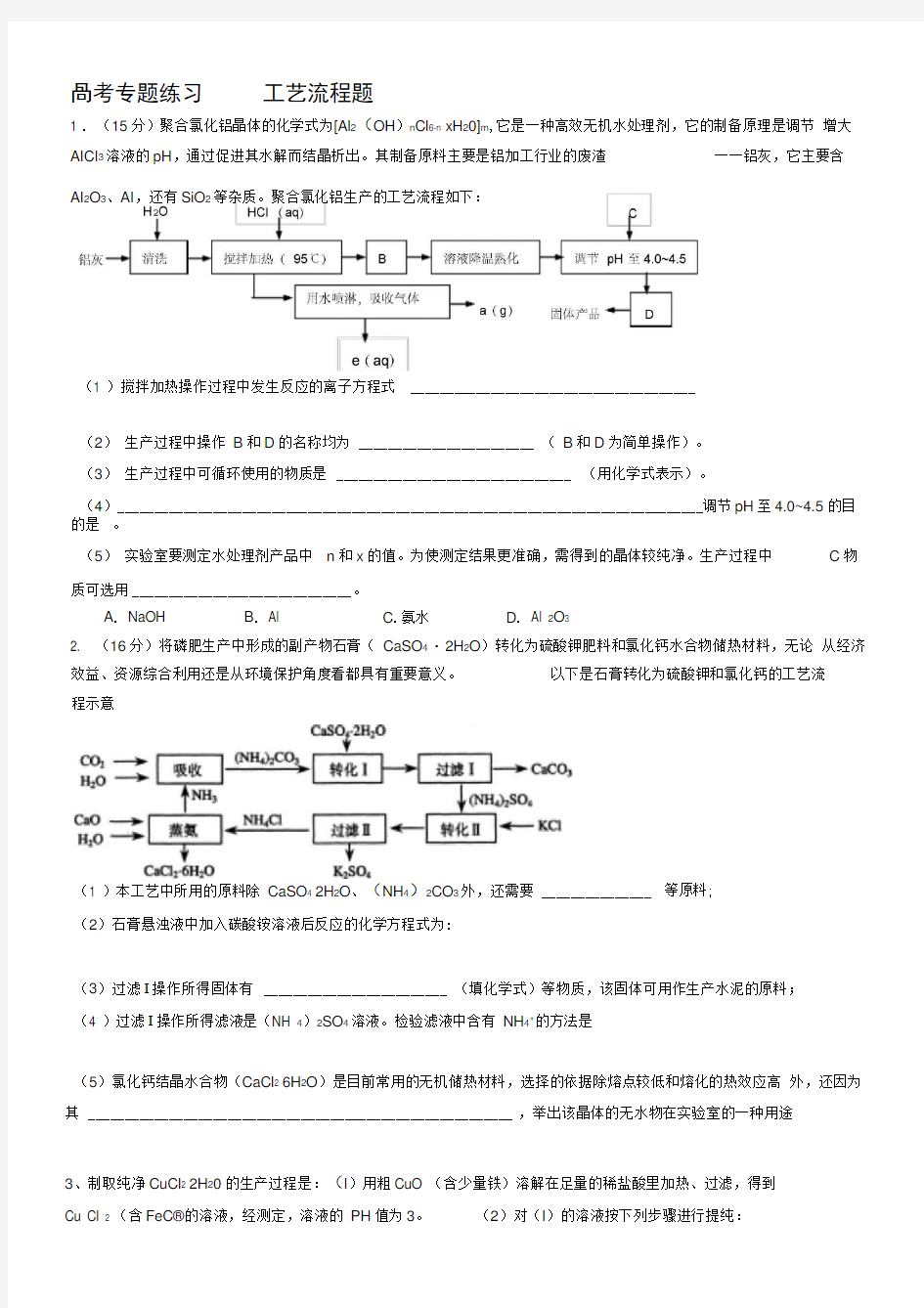
1 . (15分)聚合氯化铝晶体的化学式为[Al 2(OH )n Cl 6-n xH 20]m ,它是一种高效无机水处理剂,它的制备原理是调节 增大AICI 3溶液的pH ,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣 一一铝灰,它主要含
(2) 生产过程中操作 B 和D 的名称均为 ________________________ ( B 和D 为简单操作)。 (3) 生产过程中可循环使用的物质是 ________________________________ (用化学式表示)。
(4) ________________________________________________________________________________调节pH 至4.0~4.5的目的是 。
(5) 实验室要测定水处理剂产品中 n 和x 的值。为使测定结果更准确,需得到的晶体较纯净。生产过程中 C 物
质可选用 ______________________________ 。
2. (16分)将磷肥生产中形成的副产物石膏( CaSO 4?2H 2O )转化为硫酸钾肥料和氯化钙水合物储热材料,无论 从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。 以下是石膏转化为硫酸钾和氯化钙的工艺流
(1 )本工艺中所用的原料除 CaSO 4 2H 2O 、(NH 4)2CO 3外,还需要 _______________ (2)石膏悬浊液中加入碳酸铵溶液后反应的化学方程式为:
(3)过滤I 操作所得固体有 _________________________ (填化学式)等物质,该固体可用作生产水泥的原料; (4 )过滤I 操作所得滤液是(NH 4)2SO 4溶液。检验滤液中含有 NH 4+的方法是
(5)氯化钙结晶水合物(CaCl 2 6H 2O )是目前常用的无机储热材料,选择的依据除熔点较低和熔化的热效应高 外,还因为其 __________________________________________________________ ,举出该晶体的无水物在实验室的一种用途
3、制取纯净CuCl 2 2H 20的生产过程是:(I )用粗CuO (含少量铁)溶解在足量的稀盐酸里加热、过滤,得到 Cu Cl 2 (含FeC?的溶液,经测定,溶液的 PH 值为3。
(2)对(I )的溶液按下列步骤进行提纯:
A . NaOH
B . Al
C .氨水
D . Al 2O
3
等原料; AI 2O 3、AI ,还有SiO 2等杂质。聚合氯化铝生产的工艺流程如下:
(1 )搅拌加热操作过程中发生反应的离子方程式 _______________________________________
程示意
已知:①可做氧化剂的物质有(
A) KMnO 4
( B) K 262O 7 (C) H 2O 2
(D ) NaCIO
②Cu 2+、Fe 2十在PH 值为4 一 5时不水解,而 Fe 3+却几乎全部水解。 试回答:
(I) ____________________________________________________ 加入的氧化剂x 是(答编号): ;
加入x 的作用是: ____________________________________________________________________ ; 反应的离子方程式是: ___________________________________________________________________
(2) 物质 Y 是 _______________________ ;沉淀z 是 ________________________ 。加入Y 能形成沉淀z 的原因是 ________ (3)
分离出沉淀 乙 并将溶液班蒸发欲获得晶体 CuCl 2 2H 20。采取什么措施才能顺利得到晶体
CuCl 2 2H 20?
4 ?碘酸钙是食品及饲料添加剂中补碘补钙的常用试剂,微溶于水。制备碘酸钙的实验流程如下。中间产物碘酸 氢钾的合成原理为:I 2+2KCIO 3+HCI 全KH(IO 3)2+KCI+CI 2 f,回答下列问题:
(1) 制备碘酸氢钾的实验装置(支撑仪器太加热装置略去)如图,请在方框中补充必要的装置图并注明试剂 ?
(2) 若为上图增加加热装置,所需仪器除铁架台
(带铁圈)、石棉网外还有 _____________ 。
(3) 实验中判断碘反应完全的实验现象是 _____________________________________________ 。 ⑷调pH 至10”的目的是 ____________________________________________________________ 。 (5) 加入 CaCl 2时反应的化学方程式为 ______________________________________________ 。 (6) 从水溶液中分离出碘酸钙时,可能得到无水盐、一水合物等,本实验得到的产品是 Ca(IO 3)2 6H 2O ,上述
流程中与此结果密切相关的步骤是 _____________________________ 。 5
5 .
二氧化钛
(TiO 2)广泛用于制造高级白色油漆,也是许多反应的催化剂。工业上用钛铁矿 [主要成分为FeTiO 3(钛
酸亚铁,不溶于水)、Fe 2O 3及少量SiO 2杂质]作原料,制取二氧化钛及绿矶,其生产流程如下:
溶液I
溶液
[f
回答下列问题:
⑴FeTiO 3溶于过量硫酸的离子方程式____________________________________________________ 。
⑵流程中生成TiO2 xH2O离子方程式为___________________________________________________ 。
⑶若铁粉的用量不足,可能导致产品TiO2中混有________ ________ ________ 杂质。
⑷以TiO2为原料制取金属钛的其中一步反应为TiO2+Cl2+C——TiCl4+(),已知该反应中氧化剂与还原剂的物
质的量之比为1:1,则另一生成物为________________________ 。
6 .碳酸锂广泛应用于陶瓷和医药等领域。以一:-锂辉石(主要成分为Li 2O Al 2O3 4SiO2)为原材料制备Li 2CO3的工艺流程如下:
4 ,_, |J ■
萍不一尢HU卜厂■?潘岀港—I !*-> —?浇轻—轟炭康幅—> XM -I-* 4tttf
L?浸出渣!一?遽浚+A
I n si
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、5.2、9.7和12.4; U2SO4、LiOH
和Li 2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g.
(1) _______________________________________________________ 步骤I前,P -锂辉石要粉碎成细颗粒的目的是.
(2)步骤I中,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有A|3+、
Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需
在搅拌下加入_____________ (填石灰石”、氯化钙”或稀硫酸”以调节溶液的PH到6.0~6.5,沉淀部分杂质离子,
然后分离得到浸出液。
(3)步骤n中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有 6 7
6步骤川中,生成沉淀的离子方程式为____________________
7从母液中可回收的主要物质是 _________________ .
7 .I ?硝酸钾既是一种重要的工业原料又是一种优质的无氯钾氮复合肥,某化工厂用KCI、HNO3溶液和。2为
原料反应制备硝酸钾,同时副产C12等,请写出该反应的化学方程
式 ___________________________________________________________________________________ 。反应中还原产物是
(写化学式)。
n.某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg 2+、C「、B「等)中模拟工业生产来提取镁,主要过程如下:
回答下列问
题:
(1)工业上从盐卤中获取Mg(OH) 2用石灰乳而不用NaOH溶液的原因是
O
(2)除去镁离子中的钙离子,可加入MgCO3固体,请利用所学理论加以解释:
(3)向盛有少量Mg ( OH ) 2沉淀的试管中滴加氯化铵溶液,实验现象是其原因
(4)豆腐是日常食品之一,它的制作过程中也使用了盐卤,其中包含的化学原理是
8. KMnO 4是常用的强氧化剂,工业上以软锰矿(主要成分MnO2)为原料,通过液相法生产,即在碱性条件
下用氧气氧化MnO2得到K2MnO 4,分离后得到?Mn04,再用镍板作阳极,铁作阴极电解K2Mn04溶液得到KMnO 4,简略生产过程如下:
牖韵」竺2Q电繰T分离歆
(1)反应器中反应的化学方程式为:
(2)生产过程中最好使用含MnO28O%以上的富矿,因为MnO2含量最低的贫矿中Al、Si的氧化物含量较高, 会导致KOH消耗量
(填偏高”或偏低”)其中Al的氧化物和KOH溶液反应的化学方程式
为:
(3 )电解槽中阳极的电极反应方程式为:
在电解法中循环i、n中利用的共同物质是:
(4)在传统工艺中得到K2Mn04后,向其中通入CO2制备KMnO 4,化学反应方程式为
3 K2MnO4+ 2 CO2=== 2 KMnO 4+ MnO 2+ 2 K2CO3
根据上述反应,从Mn元素的角度考虑KMnO 4的产率最高为__________ 。与该传统工艺相比,电解法的优势
9. (16分)常温下,某工程师以浓硫酸、浓硝酸、粗铜、水和空气为原料,设计如图所示
制取硫酸铜晶体(CUSO4 5H2O)的生产工序和流程:
NO.
回答下列问题:
(1) __________________________________________________________________________ 写出(I)中制取硫酸铜的总反应的化学方程式:__________________________________________________________________
(2 )在上述反应中可以被循环利用的物质的化学式是:______________________________ 。
(3) ①某同学在实验室中模拟上述生产过程实现上述方案,请根据该同学的思路在下列
c
ecu(木、空ri NaOH辭港
(4) 硫酸铜晶体也可以直接用浓硫酸和粗铜反应制取,与上述方法相比,其缺点是:
(1)煅烧1molFeS2放出热量为853kJ,贝U Fe£燃烧的热化学方程式为________________ 。
(2)混合反应”中纯碱(Na z COJ参与反应的化学方程式为________________ (任写一个)。
(3)用NaOH“除杂”时,主要的离子方程式为_______________ (任写一个)。
(4)通过操作I ”可以得到亚硫酸钠晶体,写出主要操作步骤的名称:__________ 。
(5)硫酸生产中炉气转化反应为:2SO2(g)+O 2(g)^^ 2SO3(g)。研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线I所示。下列判断正确的是____________
A. 该反应的正反应为放热反应
B. 曲线I上A、C两点反应速率的关系是:V A VC
10.抗氧剂亚硫酸钠可利用硫酸工业的炉气和尾气与纯碱反应来制取,生产流程如下图:
C?反应达到B点时,2v正(O 2)V(SQ)
D.已知V2O5的催化效果比Fe2O3好,若I表示用V2O5催化剂的曲线,则H是Fe2O3作催化剂的曲线
11. (16分)硅酸钠被国家列为我国优先发展的精细化学品”和今后我国无机化工产品发展重点”之一。下图是
用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的工艺流程示意简图:
(1)要将洗出液中的溶质析出,采用的方法是________________ 。
A .蒸发结晶
B .冷却结晶
C. 先蒸发,再冷却结晶 D ?先冷却,再蒸发结晶
(2)在以上流程中,要将洗净的石英砂研磨成粉末,目的是_____________________ 。
A ?增加反应物的浓度,增大化学反应速率,提高生产效率。
B ?作为催化剂载体,增加反应物与催化剂接触面积,增加反应速率,提高生产效率。
C.增加反应物之间的接触面积,增大反应速率,提高生产效率。
D ?增加正反应速率,减小逆反应速率,使平衡向正反应方向移动,降低生产成本。
(3) ____________________________________________________________ 蒸发时用到的硅酸盐仪器有。
(4) _______________________________________________________________________ 上流程中加入NaOH溶液,反应的离子方程式是____________________________________________________________ 。
(5)硅酸钠溶液呈碱性,其原因是(用一离子方程式表示)
。硅酸钠的用途很广,其
中的一种用途是________________________________ 。
(6 )用上流程中的残渣来焊接铁轨,反应的化学方程式是_______________________________
12. (18分)工业合成氨与制备硝酸一般可连续生产,流程如下:
硝酸镁
蒸馏塔
塔
浓硝酸
(1) 工业生产时,制取氢气的一个反应为:CO+H2O^=CO2+H2
①t c时,往1L密闭容器中充入0.2molCO和0.3mol水蒸气。反应建立平衡后,体系中c( H2)=0.12mol ?