
流体的P-V-T关系和状态方程
教学目的要求
能熟练掌握流体(特别是气体)的各种类型的P、V、T 关系(包括状态方程法和对应状态法)及其应用、优缺点和应用范围。
定性认识流体P-V-T 行为;
掌握描述流体P-V-T 关系的模型化方法,了解几种常见的状态方程;
掌握对比态原理和普遍化状态方程
掌握计算真实气体混合物P-V-T 关系的方法,并会进行计算。
了解液体的P-V-T关系
教学内容
在化工过程的分析、研究与设计中,流体的压力p、体积V 和温度T 是流体最基本的性质之一,并且是可以通过实验直接测量的。而许多其它的热力学性质如内能U、熵S、Gibbs自由能G 等都不方便直接测量,它们需要利用流体的p –V –T 数据和热力学基本关系式进行推算。因此,流体的p –V –T 关系的研究是一项重要的基础工作。
纯流体的P-V-T关系
气体的状态方程
对应态原理和普遍化关联式
真实气体混合物的P-V-T关系
液体的P-V-T关系
状态方程的比较、选用和应用
纯流体的P-V-T关系
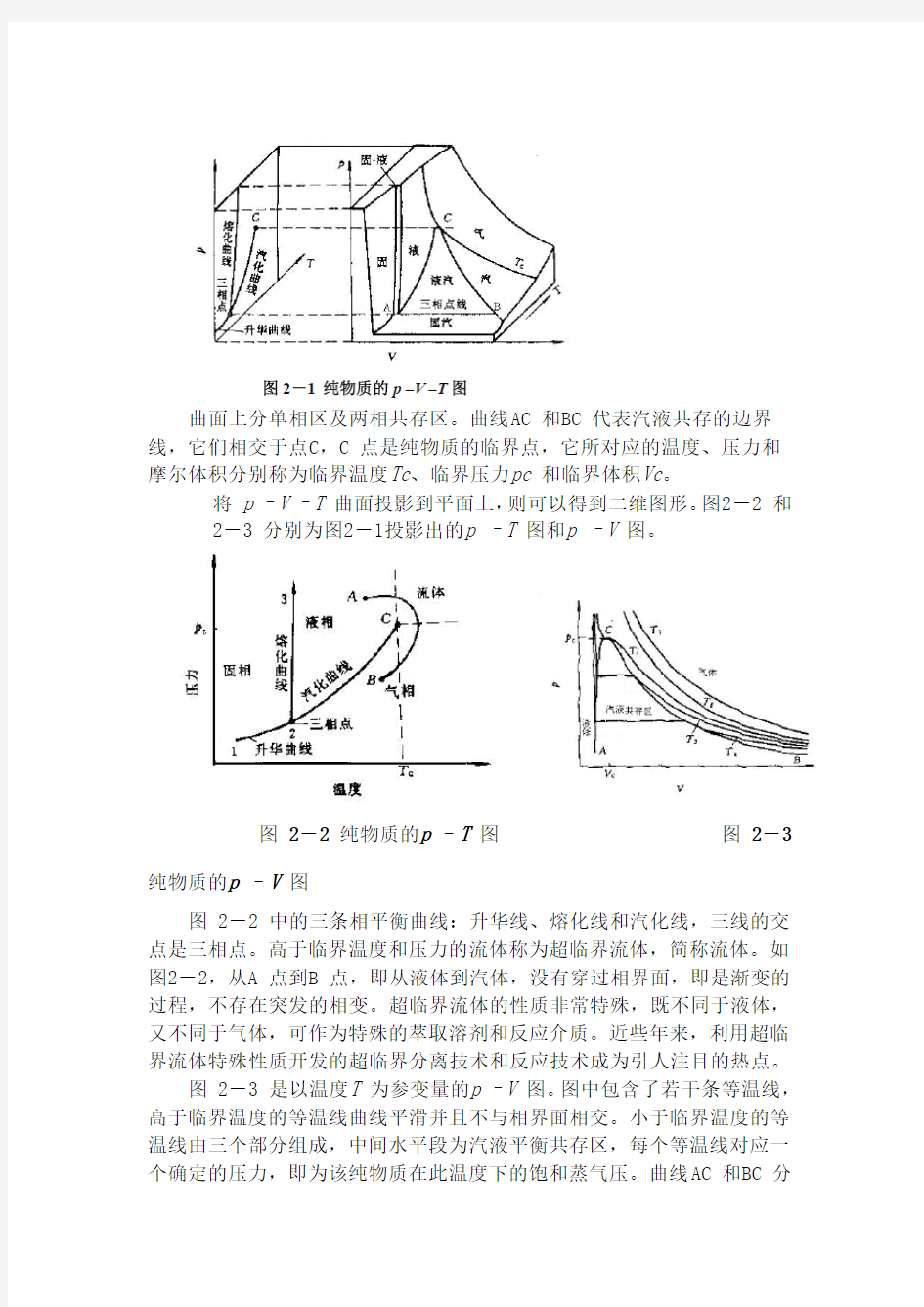
纯物质在平衡态下的p –V –T 关系,可以表示为三维曲面,如
图2-1。
曲面上分单相区及两相共存区。曲线AC 和BC 代表汽液共存的边界线,它们相交于点C,C 点是纯物质的临界点,它所对应的温度、压力和摩尔体积分别称为临界温度Tc、临界压力pc 和临界体积Vc。
将p –V –T 曲面投影到平面上,则可以得到二维图形。图2-2 和
2-3 分别为图2-1投影出的p –T 图和p –V 图。
图2-2 纯物质的p –T 图图2-3 纯物质的p –V 图
图 2-2 中的三条相平衡曲线:升华线、熔化线和汽化线,三线的交点是三相点。高于临界温度和压力的流体称为超临界流体,简称流体。如图2-2,从A 点到B 点,即从液体到汽体,没有穿过相界面,即是渐变的过程,不存在突发的相变。超临界流体的性质非常特殊,既不同于液体,又不同于气体,可作为特殊的萃取溶剂和反应介质。近些年来,利用超临界流体特殊性质开发的超临界分离技术和反应技术成为引人注目的热点。
图 2-3 是以温度T 为参变量的p –V 图。图中包含了若干条等温线,高于临界温度的等温线曲线平滑并且不与相界面相交。小于临界温度的等温线由三个部分组成,中间水平段为汽液平衡共存区,每个等温线对应一个确定的压力,即为该纯物质在此温度下的饱和蒸气压。曲线AC 和BC 分
别为饱和液相线和饱和气相线,曲线ACB 包含的区域为汽液共存区,其左右分别为液相区和气相区。
等温线在两相区的水平段随着温度的升高而逐渐变短,到临界温度时最后缩成一点 C 。从图2-3 中可以看出,临界等温线在临界点上是一个水平拐点,其斜率和曲率都等于零,在数学上表示为:
0)(0)(
22=??=??Tc Tc V P V P 式(2-1)和(2-2)对于不同物质都成立,它们对状态方程等的研究意义重大。
纯物质PVT 关系的应用:超临界技术和液化气体成分的选择
气体的状态方程
纯物质的状态方程(Equation of State, EOS) 是描述流体p-V-T 性质的关系式,即:
f( p, T, V ) = 0
状态方程类型:立方型、多常数型、理论型;
混合物的状态方程从纯物质出发,通过引入混合规则,来计算混合物的热力学性质。
2.2.1 理想气体状态方程
假定分子的大小如同几何点一样,分子间不存在相互作用力,由这样的分子组成的气体叫做理想气体。在极低的压力下,真实气体可以当作理想气体处理,以简化问题。理想气体状态方程是最简单的状态方程:
RT PV =
理想气体状态方程的用途:1)在工程设计中,可以用理想气体状态方程进行近似的估算,低压下的气体(特别是难液化的N2,H2,CO ,CH4,…);
2)可以作为衡量真实气体状态方程是否正确的标准之一,当p →0或者V →∞时,任何真实气体状态方程都应还原为理想气体方程。3)理想气体状态常被作为真实流体的参考态或初值。
立方型状态方程
立方型状态方程是指方程可展开为体积(或密度)的三次方形式。这类方程能够解析求根,有较高精度,又不太复杂,很受工程界欢迎。
(1) van der Waals 状态方程
2V
a b V RT p --= 该方程是第一个适用于实际气体的状态方程,与理想气体状态方程相比,它加入了参数a 和b ,它们分别表征分子间的引力和分子本身体积的影响,可以从流体的 p-V-T 实验数据拟合得到,也可以由纯物质的临界数据计算得到。
(2)Redlich-Kwong (RK) 方程
RK 方程的计算准确度比 van der Waals 方程有较大的提高,可以比较准确地用于非极性和弱极性化合物,但对于强极性及含有氢键的化合物仍会产生较大的偏差。RK 方程能较成功地用于气相P-V-T 的计算,但计算液相体积的准确性不够,不能同时用于汽、液两相。
为了进一步提高 RK 方程的精度,扩大其使用范围,便提出了更多的立方型状态方程。对RK 方程进行修正,但同时降低了RK 的简便性和易算性。
成功的有Soave 的修正式(SRK )。
(3) Soave-Redlish-Kwang 方程( 1972年)
为了提高 RK 方程对极性物质及饱和液体 p –V –T 计算的准确度。Soave 对 RK 方程进行了改进,称为 RKS (或 SRK ,或 Soave )方程。方程形式为:
)
176.0574.148.0()]1(1[)(08664.0)(42748.0)()(22
5.022ωωααα-+=-+====m T m T p RT b T p T R T a T a r r c c
r c
c r c
与RK 方程相比,SRK 方程可计算极性物质,更主要的是可计算饱和液体密度,使之能用于混合物的汽液平衡计算,故在工业上获得了广泛应用。
(4) Peng -Robinson 方程
RK 方程和 RKS 方程在计算临界压缩因子 Z c 和液体密度时都会出现较大的偏差,为了弥补这一明显的不足,Peng -Robinson 于 1976年提出了他们的方程,简称 PR 方程。
)
26992.054226.137464.0()]1(1[)(07780.0)(45724.0)()(22
5.022ωωααα-+=-+====m T m T p RT b T p T R T a T a r r c c
r c
c r c
PR 方程预测液体摩尔体积的准确度较SRK 方程有明显改善,而且也可用于极性物质。能同时适用于汽、液两相,在工程相平衡计算中广泛应用。
立方型状态方程根的求取
当T > Tc 时,立方型状态方程有一个实根,它是气体
容积。
当T 液体容积。低压存在三个不同实根,最大的V 值是蒸气 容积,最小的V 值是液体容积,中间的根无物理意义 求解方法:直接迭代法和牛顿迭代法 三种问题类型: 1)已知T ,V ,求P ; 显压型,直接计算 2)已知P ,T ,求V ; 工程中常见情况,迭代求解。 3)已知P ,V ,求T 。 迭代求解 Virial (维里)方程 维里方程该方程利用统计力学分析了分子间的作用力,具有较坚实的理论基础。方程的形式为: ?++++==?++++== 32321'''1V D V C V B RT PV z P D P C P B RT PV z 维里系数的物理意义:B , B ':第二维里系数,它表示对一定量的真实气体,两个分子间的作用所引起的真实气体与理想气体的偏差。C ,C ':第三维里系数,它表示对一定量的真实气体,三个分子间的作用所引起的真实气体与理想气体的偏差。 维里系数= f (物质,温度) 当方程(2-5)~(2-7)取无穷级数时,不同形式的 virial 系数之间存在着下述关系: Virial 截断式: 1. 2. 多参数状态方程 与简单的状态方程相比,多参数状态方程可以在更宽的 T 、p 范围内准确地描述不同物系的 p-V-T 关系;但其缺点是方程形式复杂,计算难度和工作量都较大。 (1) Benedict -Webb -Rubin 方程(1940年)该方程在计算和关联轻烃及其混合物的液体和气体热力学性质时极有价值。 式中, ρ为密度; A 0, B 0,C 0, a ,b ,c ,α和γ 等 8个常数由纯物质的 p-V-T 数据和蒸气压数据确定。在烃类热力学性质计算中,BWR 方程计算精度很高,但该方程不能用于含水体系。以提高BWR 方程在低温区域的计算精度为目的,Starling 等人提出了 11个常数的Starling 式(或称 BWRS 式) (2) Martin -Hou 方程(1955年) 该方程是 1955年 Martin 教授和我国学者候虞钧提出的,简称 MH 方程。(后又称为 MH-55型方程)。为了提高该方程在高密度区的精确度, 1981年候虞钧教授等又将该方程的适用范围扩展到液相区,称为 MH-81型方程。 () ( )()()()1 52/475.5exp 5 1==≤≤-++=-=∑=i RT T f i T T C T B A T f b V T f p MH i c i i i i i i i 的通式为: MH -81型状态方程能同时用于汽、液两相,方程准确度高,适用范围广,能用于包括非极性至强极性的物质(如 NH 3、H 2O ),对量子气体 H 2、He 等也可应用,在合成氨等工程设计中得到广泛使用。 状态方程的选用: 对应态原理和普遍化关联式 状态方程存在的问题:真实气体状态方程都涉及到物性常数,方程的通用性受到了限制。在实际工作中,当研究的物质其热力学性质既没有足够的实验数据,又没有状态方程中固有的参数时,计算便会产生困难,因此十分需要研究能用于真实气体的普遍化方法。 2.3.1 对比态原理 对比态原理认为,在相同的对比状态下,所有的物质表现出相同的性质。 van der Waals 提出的简单对比态原理方程是: ()()r r r r T V V P 813/32=-+ 简单对应状态原理就是两参数对应状态原理,表述为: 对于不同的流体,当具有相同的对比温度和对比压力时,则具有大致相同的压缩因子。并且其偏离理想气体的程度相同。 这种简单对比态原理对应简单流体(如氩、氪、氙)是非常准确的。这就是二参数压缩因子图的依据。只有在各种气体的临界压缩因子 Z c 相等的条件下,简单对比态原理才能严格成立。而临界压缩因子 Z c 在 ~范围内变动,并不是一个常数。可见,范德华提出的简单对比态原理只是一个近似的关系,只适用于球形非极性的简单分子。拓宽对比态原理的应用范围和提高计算精度的有效方法是在简单对比态原理(二参数对比态原理)的关系式中引入第三参数。 三参数对比态原理 z = f (Tr ,Pr ,第三参数) 第三参数的特性:最灵敏反映物质分子间相互作用力的物性参数,当分子间的作用力稍有不同,就有明显的变化。1955 年, 提出了以偏心因子作为第三因子的关系式: z = f (Tr ,Pr ,ω )。把压缩因子看作是对比温度、对比压力和偏心因子的函数。 纯物质的偏心因子是根据物质的蒸气压来定义的:对于不同的流体,α具有不同的值。但简单流体(氩、氪、氙)的所有蒸气压数据落在了同一条直线上,而且该直线通过T r =,log p r s =?1这一点。对于给定流体对比 蒸气压曲线的位置,用在T r =的流体与氩、氪、氙(简单球形分子)的log p r s 值之差来表征。 Pitzer 把这一差值定义为偏心因子 ω,即 ω=?log p r s ? (T r = 因此,任何流体的 ω值均可由该流体的临界温度 T c 、临界压力 p c 值及T r =时的饱和蒸气压 p s 来确定。氩、氪、氙这类简单球形流体的 ω=0, 而非球形流体的 ω表征物质分子的偏心度,即非球形分子偏离球对称的程度。 根据以上结论,Pitzer 提出了两个非常有用的普遍化关系式: 1、压缩因子的多项式表示的普遍化关系式(简称普压法) 2、两项维里系数表示的普遍化关系式(简称为普维法) 普遍化压缩因子图法 对于所有w 相同的流体,若处在相同的Tr 和pr 下,其压缩因子必定相等。 (0)(1) Z Z Z ω=+ Z (0) ——简单流体的压缩因子 Z (1) ——研究流体相对于简单流体的偏差 Z (0)和Z (1)的都是T r 和p r 的复杂函数,计算时可直接查图 Pitzer 关系式对于非极性或弱极性的气体能够提供可靠的结果,误差 < 3%,应用于极性气体时,误差要增大到 5%~10%,而对于缔合气体和量子气体,使用时应当更加注意。 普遍化第二virial 系数法 所谓普遍化状态方程是指用对比参数T r 、p r 、V r 代替变量T 、p 、V ,消去状态方程中反映气体特性的常数,适用于任何气体的状态方程。 两种普遍化方法适用范围: 真实气体混合物的P-V-T 关系 在化工生产和计算中,处理的物系大都是多组分的真实气体混合物。混合物的实验数据更少,为了满足工程设计计算的需要,必须求助于计算、关联甚至估算的方法,用纯物质的p –V –T 关系预测或推算混合物的性质。 气体的 p –V -T 关系可以概括为:φ( p ,V ,T , x ) = 0 研究思路 1)状态方程是针对纯物质提出的; 2)把混合物看成一个虚拟的纯物质,算出虚拟的特征参数,然后代入纯物质的状态方程计算混合物的性质; ()() 10B B RT Bp c c ω+= 3)混合物的虚拟特征参数是纯物质参数项和组成的函数,即混合规则: ),(i i m y Q f Q = 4)混合规则是计算混合物性质中最关键的一步。 虚拟临界参数法和Kay 规则 如果用对应状态原理处理气体混合物的 p –V -T 关系,就必须涉及到如何解决混合物的临界性质问题。可以将混合物视为假想的纯物质,将虚拟纯物质的临界参数称作虚拟临界参数。这样便可以把适用于纯物质的对比态方法应用到混合物上。最简单的是Kay 规则。该规则将混合物的虚拟临界参数表示成: i i i m ci i i cm ci i i cm y P y P T y T ωω∑∑∑===,, 式中T pm , p pm 分别称为虚拟临界温度与虚拟临界压力。T ci , p ci 分别表示混合物中i 组元的临界温度和临界压力,yi 为i 组元在混合物中的摩尔分率。 注意,虚拟临界温度与虚拟临界压力并不是混合物真实的临界参数,它们仅仅是数学上的参数,为了使用纯物质的p –V -T 关系进行计算时采用的参数,没有任何物理意义。混合物中所有组分的临界温度和临界压力之比在以下范围内: Kay 规则与其他较复杂的规则相比,所得数值的差别不到2%。 Prausnitz -Gunn 提出一个简单的改进规则,将T pm 仍用Kay 规则, p pm 表示为: 以上几个式子表示的混合规则都没有涉及到组元间的相互作用参数。因此,这些混合规则均不能真正反映混合物的性质。对于组分差别很大的混合物,尤其对于具有极性组元的系统以及可以缔合为二聚物的系统均不适用。 气体混合物的第二Virial 系数 维里方程是一个理论型方程,其中维里系数反映分子间的交互作用, 如第二维里系数B 反映两个分子间的交互作用。对于纯气体,仅有同一种分子间的交互作用,但对于混合物而言,第二维里系数B 不仅要反映相同分子之间的相互作用,同时还要反映不同类型的两个分子交互作用的影响。由统计力学可以导出气体混合物的第二Virial 系数为: ij n i n i j i m B y y B ∑∑===11 当i ≠j 时,Bij 为交叉第二Virial 系数,且Bij = Bji 。i=j 时为纯组分i 的第二Virial 系数。对二元混合物: 2222122111212B y B y y B y B m ++= B 12 代表混合物性质,称为交叉第二维里系数,用以下经验式计算。 式中, B (0)和B (1)是对比温度Tr 的函数。Prausnitz 对计算各临界参数提出如下的混合规则: 式中,kij 称为二元交互作用参数。不同分子的交互作用很自然地会影响混合物的性质,若存在极性分子时,影响更大。因此,人们对于kij 极为关注。但至今尚未得到一个计算kij 的通用关联式,一般通过实验的p –V –T 数据或相平衡数据拟合得到。kij 的数值与组成混合物的物质有关,一般在0~ 之间。在近似计算中,kij 可以取作为零。 用普遍化第二维里系数计算气体混合物压缩因子的步骤是:计算纯物质普遍化第二维里系数,再计算各个交互临界参数,计算交叉第二维里系数,然后计算混合物的BM ,最后用下式计算混合物的压缩因子。 可见,气体混合物压缩因子的计算包括许多步骤,但每个步骤都非常方便地可以编成计算机程序完成。 气体混合物的立方型状态方程 若将气体混合物虚拟为一种纯物质,就可以将纯物质的状态方程应用于气体混合物的p-V-T 计算中。不同的状态方程当用于混合物p-V-T 计算时应采用不同的混合规则,一个状态方程也可使用不同的混合规则。大多数状态方程均采用经验的混合规则,混合规则的优劣只能由实践来检验。 立方型状态方程(van der Waals,RK,RKS,PR 方程)用于混合物时,方程中参数a和b常采用以下的混合规则: 同样,对于二元混合物,应写为: bi 是纯组分的参数,没有b的交叉项;aij 既包括纯组分参数(i=j),也包括交叉项i≠j 。交叉项aij 按下式计算: Kij 为经验的二元相互作用参数,一般从混合物的实验数据拟合得到,对组分性质相近的混合物或近似计算可取 Kij = 0 Prausnitz 等人建议用下式计算交叉项aij 通过计算得到混合物参数a M , b M 后,就可以利用立方型状态方程计算混合物的p –V -T关系和其他热力学性质了。 状态方程混合规则是气液两相均适用,但用于液相可靠性较差; 当计算混合物性质时,使用不同的状态方程,应采用不同的混合规 则,计算不同的虚拟特征参数。 液体的P-V-T 关系 前面已经讨论的 p –V -T 关系如RKS 方程、PR 方程及BWR 方程都可以用到液相区,但事实上还有许多状态方程只能较好地说明气体的p –V -T 关系,不适用于液体,当应用到液相区时会产生较大的误差。这是由于液体的p –V -T 关系较复杂,对液体理论的研究远不如对气体研究深入。但是,与气体相比,液体的摩尔体积容易测定。除临界区外,温度(特别是压力)对液体容积性质的影响不大。除状态方程外,工程上还常常选用经验关系式和普遍化关系式等方法来估算。 饱和液体摩尔体积 Rackett 方程 修正的Rackett 方程 Vsl 是饱和液体的摩尔容积;ZRA 值可查阅文献,或用下式估算 ω08775.029056.0-=RA Z 液体摩尔体积 Lyderson 等提出了一个估算液体体积的普遍化方法。 状态方程的比较、选用和应用 每一个方程的特点和适用范围,见表2-1. 作为工程师和设计人员得主要任务就是根据对精度的要求来选择 状态方程。注意每一个方程的特点和适用范围。 状态方程精度粗略评价:多参数状态方程>立方型状态方程>两项截断维里方程>理想气体状态方程。 立方型状态方程中:PR>SRK>RK>vdW 1)若计算液体体积,则直接用修正的Rackett方程既简单精度又高,不需要用立方型状态方程来计算; 2)若计算气体体积。SRK,PR是大多数流体的首选,无论压力、温 度、极性如何,它们能基本满足计算简单。精度较高的要求,因此在工业上已广泛使用。 对于个别流体或精度要求特别高的,则需要使用对应的专用状态方程或多参数状态方程,如对于CO2、H2S和N2首选BWRS方程; 在没有计算机软件又需要快速估算的情况下,精度要求非常低的可用理想气体状态方程,精度要求稍高可以使用普遍化方法。