
2017届东北三省三校(哈尔滨师大附中东北师大附中辽宁省实验中学)高三下学期第二次联合模拟考试理科综合化学试题
7、下列说法不正确的是
A.氧化镁的熔点很高,可用于制作耐高温材料
B.二氧化氯具有氧化性,可用于自来水的杀菌消毒
C.硅单质是半导体材料,可用做光导纤维
D.氨易液化,可用做制冷剂
8、下列说法正确的是
A.异戊烷的系统命名为2-甲基丁烷
B.四氧化碳和乙酸均不能发生氧化反应
C.糖类、油脂和蛋白质在一定条件下能发生水解反应
D.只用一种试剂无法区分苯、硝基苯、乙醇和乙酸四种物质
9、1 mo1分子式为C6H10O4的有机物与足量碳酸氢钠溶液反应可生成2molCO2,符合该条件的有机物共有(不含立体异构)
A.6种
B.7种
C.8 种
D.9种
10
选项实验检测方法
A 向沸水中滴加饱和FeCl3溶液,确认制得胶体用一束平行光照射
B 确认铜与浓硫酸反应生成CuSO4 向反应后的溶液中加入水
C 确定氢氧化钠标准溶液滴定未知浓度的醋酸溶液的终点以甲基橙为指示剂
D 检验乙烯中混有SO2 将气体通入溴水中
11、某小组为研究电化学原理,设计如图所示的装置。下列叙述正确的是
A.若a和b直接用导线相连,则一段时间后溶液质量增加
B.若a和b分别与直流电源正、负极连接,则铜电极上的反应为:2Cl--2e-= Cl2↑
C.a和b无论是用导线相连还是与直流电源连接,铁电极都溶解
D.若工作过程中电解质溶液颜色由蓝色变为浅绿色,则Cl-一定向铁电极移动
12、下列离子方程式正确的是
A. Fe2O3与HI溶液反应:Fe2O3+6H+=2Fe3++3H2O
B.工业制漂白粉:Cl2+2OH-=Cl-+ClO-+H2O
C.Na2S2O3与稀硫酸反应:S2O32-+2H+=S↓+SO2↑+H2O
D.物质的量浓度之比为1:2的NH4Al(SO4)2溶液与Ba(OH)2溶液等体积混合:
Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
13、常温下,关于下列溶液的说法错误的是
A.某物质的溶液中由水电离出的c(H+)=1×10-10mol/L,则该溶液的pH可能为4或10
B.已知0.1 mol/L NaClO溶液的pH为9.7,0.1 mol/LNaF溶液的pH为7.5,则等体积两溶液中离子总数大小关系为:N(NaClO)>N(NaF)
C.将0.2 mol/L的某一元酸HA溶液和0.1 mol/LNaOH溶液等体积混合后溶液pH大于7,则所得溶液中:2c(OH-)=2c(H+)+c(HA)-c(A-)
D.向饱和氯水中加入NaOH溶液至PH=7,则所得溶液中:
c(Na+) >c(Cl-) >c(C1O-) >c(OH-)= c(H+)
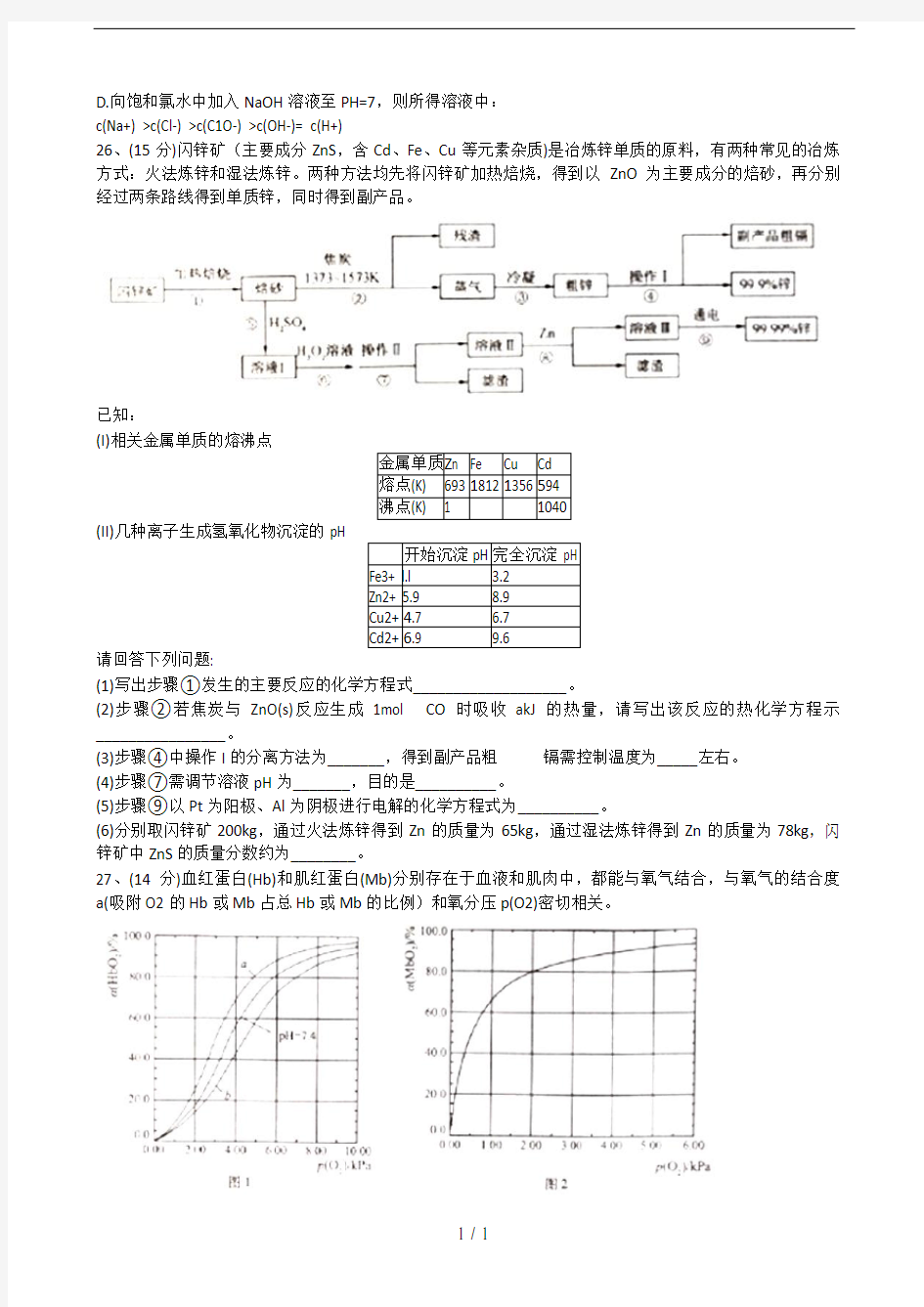
26、(15分)闪锌矿(主要成分ZnS,含Cd、Fe、Cu等元素杂质)是冶炼锌单质的原料,有两种常见的冶炼方式:火法炼锌和湿法炼锌。两种方法均先将闪锌矿加热焙烧,得到以ZnO为主要成分的焙砂,再分别经过两条路线得到单质锌,同时得到副产品。
已知:
(I)相关金属单质的熔沸点
金属单质Z n Fe Cu Cd
熔点(K) 693 1812 1356 594
沸点(K) 1 1040
(II)几种离子生成氢氧化物沉淀的pH
开始沉淀pH 完全沉淀 pH
Fe3+ l.l 3.2
Zn2+ 5.9 8.9
Cu2+ 4.7 6.7
Cd2+ 6.9 9.6
请回答下列问题:
(1)写出步骤①发生的主要反应的化学方程式___________________。
(2)步骤②若焦炭与ZnO(s)反应生成1mol CO时吸收akJ的热量,请写出该反应的热化学方程示________________。
(3)步骤④中操作I的分离方法为_______,得到副产品粗镉需控制温度为_____左右。
(4)步骤⑦需调节溶液pH为_______,目的是__________。
(5)步骤⑨以Pt为阳极、Al为阴极进行电解的化学方程式为__________。
(6)分别取闪锌矿200kg,通过火法炼锌得到Zn的质量为65kg,通过湿法炼锌得到Zn的质量为78kg,闪锌矿中ZnS的质量分数约为________。
27、(14分)血红蛋白(Hb)和肌红蛋白(Mb)分别存在于血液和肌肉中,都能与氧气结合,与氧气的结合度a(吸附O2的Hb或Mb占总Hb或Mb的比例)和氧分压p(O2)密切相关。
I .Hb与氧气的结合能力还受到c(H+)的影响,平衡如下:
HbO2(aq)+H+(aq) HbH+(aq)+O2(g) (反应①)。37℃,PH分别为7.2、7.4、7.6 时氧分压p(O2)和达平衡时的结合度的关系如图1
(1)图1中pH=7.6时的曲线为______ (填“a”或“b”)。
⑵血液中还存在平衡:CO2+H2O H2CO3H++HCO3-(反应②),用平衡理论解释肺部高氧分压有利于CO2排出体外的原因___________。
II.Mb与氧气结合的平衡如下:Mb(aq)+O2(g) MbO2(aq)(反应③),37℃时,氧分压p(O2)和达平衡时的结合度的关系如图2。
(3)若肌肉中Mb的初始浓度为c0 mol/L,结合度达到50%所需的时间为t min,此段时间内用MbO2表示的平均反应速率为____________。
(4)图2中a随p(O2)增大而增大的原因是______________。
(5) Mb与氧气结合的平衡常数的表达式K=
)
(
)
(
)
(
2
2
O
p
Mb
c
MbO
c
,计算37℃时K=_______。
(6) Mb与氧气结合达平衡时结合度a=_______[用含p(O2)和K的代数式表示]。
人正常呼吸时,温度约为37℃,空气中氧分压约为20.0kPa,计算此时Mb与氧气的最大结
合度为________。
28、(14分)有三份白色固体分别为碳酸钠、碳酸氢钠及二者的混合物。某化学课外活动小组对其进行相关实验和探究。
I.甲组同学采用加热的方法确定其成分。
(1)除托盘天平、药匙、三脚架、泥三角、玻璃棒和干燥器外,完成本实验还需要的实验仪器有_________。
(2)该小组同学准确称取一定量的样品m1g,多次加热、冷却、称量直至恒重,质量为m2g。依据得出结论,请完成下表。
m2与m1的关系结论
①样品为Na2CO3
②样品为NaHCO3
③样品为Na2CO3和 NaHCO3的混合物
II.乙组同学利用已鉴别出的NaHCO3和Na2CO3,继续进行实验,对于“能否用CaCl2鉴别的NaHCO3和Na2CO3”的问题进行探究。
(3)小组同学先将NaHCO3、Na2CO3、CaCl2固体分别配制成0.5mol/L的溶液。设汁如下实验
方案:
表1
实验方案预测现象
实验1 向2mL Na2CO3溶液中滴加1mL CaCl2溶液有白色沉淀生成
向2mL NaHCO3溶液中滴加1mL CaCl2溶液无白色沉淀生成
若已知:①室温下,0.5mol/L NaHCO3溶液pH=8.5,溶液中c(HCO3-)=0.49 mol/L 。
②室温下, H2CO3的二级电离常数K2=5.6×10-11。
③Ksp(CaCO3)=2.8×10-9。
试估算使0.5mol/L NaHCO3溶液中的CO32-沉淀所需的c(Ca2+)应不低于_____mol/L,并由此得出结论:实验2的预测现象_____(填“正确”或“不正确”)。
⑷实际实验过程发现实验2的现象为白色沉淀并有无色气体生成。此现象对应的离子方程式为_____________。
(5)该小组同学继续设计实验对NaHCO3溶液与CaCl2溶液的反应进行探究,利用气体压力传感器得到的部分实验数据如下:(注:CaCl2溶液浓度相同)
表2 容器内气体浓度达到10000ppm所需时间
C(NaHCO3)/(mol/L) 所需时间/s
v(CaCl2):v(NaHCO3)
1:5 2:5 4:5 1:1
1. 56
0.5 368 264 244 284
0.25 882 450 354 632
0.1 1126
由实验数据可得出的结论是:
①当v(CaCl2):v(NaHCO3)一定时,随着_____,气体逸出速率减小;
②NaHCO3浓度在0.1~1.0mol/L,v(CaCl2)与v(NaHCO3)的比值为____时,气体逸出速率最快,可获得理想的实验观察效果。
35、【化学一选修3:物质结构与性质】(15分)
M、Q、R、X、Y为原子序数依次增大的短周期主族元素。M原子核外电子有6种运动状态,R和X同主族。Z、W是第四周期过渡元素,Z2+的外围电子数是W+的外围电子数的一半,W+没有未成对电子。请回答下列问题:
(1) W+的外围电子排布图为__________。
(2) M、Q和R第一电离能由小到大的顺序是________(用元素符号表示)。
(3) Q的气态氢化物极易溶于R的常见氢化物,其原因有__________________。该浓液显碱性,请用结构表示出两者的主要结合方式_________。
(4) 在上述元素形成的微粒中,和MR2互为等电子体的有________(分子和离子各写一种),Q与Y形成的QY3分子的空间构型是__________。
(5) MR2晶体和W晶体的晶胞如图表示(●表示一个MR2分子或一个W原子)。
①在MR2晶体中,最近的分子间距为a㎝,则晶体密度为____g/㎝3(阿伏加德罗常数的值用NA表示,不必计算结果)。
②W晶体中A、B、C、D围成正四面体空隙,该晶胞中正四面体空隙的数目为_____。某种Z的硫化物晶体中S2-以W晶体中W原子的方式堆积,Z2+填充在正四面体空隙中,则Z2+的填充率(填充Z2+的正四面体空隙数和正四面体空隙总数之比)为_______。
36、【化学一选修5:有机化学基础】(15分)
卡托普利为血管紧张素抑制剂,临床上用于治疗高血压和充血性心力衰竭,其某种合成路线如下:(部分条件及产物已省略)
巳知:①烃A的相对分子质量为56,有支链
②
(1)A分子中最多有______个原子共平面,I的结构简式为________。
(2)反应②的条件为________。
(3)写出下列反应的化学方程式:C→D________________________________。
E→F____________________________________________________________。
(4)①~⑦中,属于取代反应的是_________。
(5)G中含有的官能团有___________(填官能团名称)。
(6)H的同分异构体中,能发生银镜反应的共有____种(不含立体异构).其中核磁共振氢谱显示三个峰,面积比为3:2:1的结构简式为________(任写一种)。
7-13:C A D A D C B
26、(15分)
(1)2ZnS + 3O2 2ZnO + 2SO2 (2分)
(2)ZnO(s) + C(s)
Zn(g) + CO (g) △H = + a kJ/mol (2分)
(3)蒸馏(2分) 1040 K (2分)
(4)3.2 < pH < 5.9 (2分) 除去溶液中的Fe3+(1分) (5)2ZnSO4 + 2H2O =====电解
2Zn + O2↑+ 2H2SO4(2分)
(6)48.5%(2分) 27、(14分)
(1)a (2分)
(2)氧气分压高,使反应①平衡向逆反应方向移动,c( H+) 增大,导致反应②平衡向逆反应方向移动,释放出更多的CO2(2分)
(3)t C 20
mol/(L ?min) (2分)
(4)反应③正反应是气体体积缩小的反应,p(O2)增大,平衡向正反应方向移动(2分) (5)2.00 kPa-1 (2分)
(6)
)(·1)(·22O p K O p K (2分) 97.6% (2分) 28、(14分)
I.(1)(铁)坩埚 酒精灯 坩埚钳(坩埚钳可不采分)(2分)
(2)① m2 = m1 ②m2 = 8453m1 ③8453
m1 < m2 < m1 (3分)
II.(3) 1.0×10-6.5(2分) 不正确 (1分)
(4)2HCO3- + Ca2+ = CaCO3↓+ H2O + CO2↑ (2分) (5)① c(NaHCO3) 的减小(2分) ②4:5 (2分) 35、(15分)
(1)(2分) 3d
(2)C (3)NH3与H2O 分子间可形成氢键;NH3为极性分子,根据相似相溶原理易溶于极性溶剂水中;NH3与水反应,产物易溶于水(3分) (2分) (4)N2O ,SCN-(2分。合理即可) 三角锥形(1分) (5)①3 ·2 44a N A (2分) ②8(1分) 50% (1分) 36、(15分) (1)8 (1分)(2分) (2)NaOH水溶液,加热(1分) (3)2+O22+2H2O(2分) CH2= +H2O (2分) (4)②⑤⑥⑦(2分) (5)溴原子、羧基(2分) (6)13 (2分)(其他合理答案均可,1分)