
一、目的:规范贝克曼DXC600操作
二、适用范围:贝克曼DXC600检测过程
三、支持性文件:《全国临床检验操作规程》(第三版)、《临床检验操作规程编写
要求》、《DXC600全自动生化仪使用说明书》
四、操作规程:
1. 仪器开机程序
1.1开机运行
开机检查MC部分试剂量是否充足,真空压力,水压,空气压力是否处在正常范围。
1.2 安装试剂
a.首先检查试剂状态,在主菜单选定“试剂/校正”。
b.安装试剂
从主菜单选择“试剂/校正”,点击“排序”(F9),测定项目的剩余测试数量呈升序排列
选中测定项目旁的位置(1,2,3…),点击“加载”(F1),听到试剂舱闸门有响声后打开
添加试剂,在弹出的窗口中清除该试剂原有的测定项目名称、批号、序列号和有效期并修改【如批号设为12345;序列号设为12;有效期设为12 12(即12月12日)】
放入试剂,关闭试剂舱闸门
仪器自动检测试剂液面等,屏幕显示试剂已确定即完成安装试剂
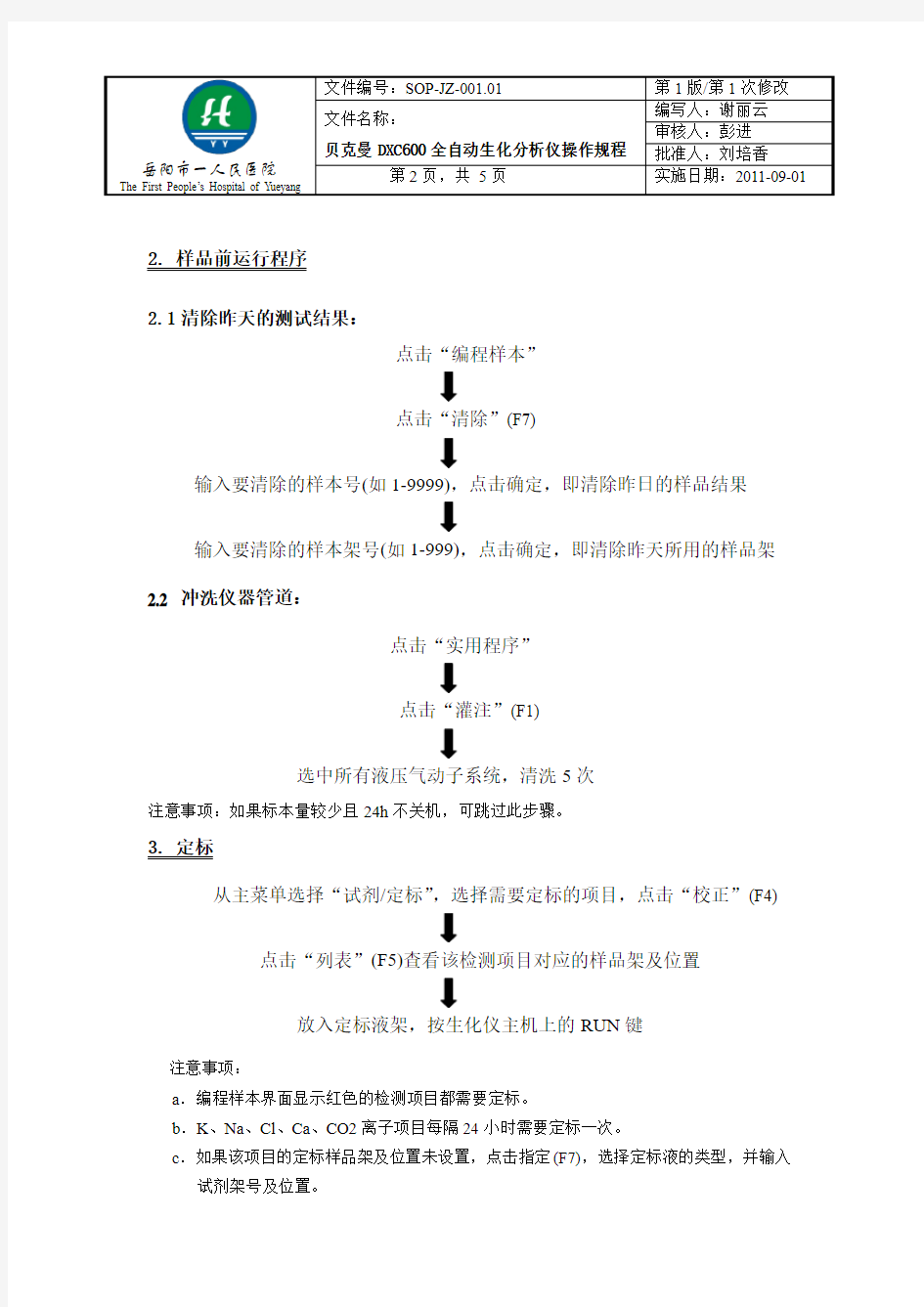
2. 样品前运行程序
2.1清除昨天的测试结果:
点击“编程样本”
点击“清除”(F7)
输入要清除的样本号(如1-9999),点击确定,即清除昨日的样品结果
输入要清除的样本架号(如1-999),点击确定,即清除昨天所用的样品架2.2 冲洗仪器管道:
点击“实用程序”
点击“灌注”(F1)
选中所有液压气动子系统,清洗5次
注意事项:如果标本量较少且24h不关机,可跳过此步骤。
3. 定标
从主菜单选择“试剂/定标”,选择需要定标的项目,点击“校正”(F4)
点击“列表”(F5)查看该检测项目对应的样品架及位置
放入定标液架,按生化仪主机上的RUN键
注意事项:
a.编程样本界面显示红色的检测项目都需要定标。
b.K、Na、Cl、Ca、CO2离子项目每隔24小时需要定标一次。
c.如果该项目的定标样品架及位置未设置,点击指定(F7),选择定标液的类型,并输入试剂架号及位置。
4. 生化室内质控
取RANMOX中值水平质控品,室温放置10-20分钟,摇匀后进行测定,编号9002(100号架子1号位,测试项目组合编号框输入6)随后将质控值输入质控分析软件进行质控分析。要质控在控后才能开机检测病人标本。
注意事项:如有项目失控首先要根该项目的失控类型判断是系统误差还是随机误差引起的,再查找失控原因,解决问题,最后必需重做质控在控后才能做该项目。
5. 样本运行程序
☆~ ?.??.?~☆质控在控后才能检测病人标本☆~?.??.?~☆
从主屏幕选定“编程样本”
输入样本相对应的架号及位置
输入样本ID及检测项目
放入样本架,RUN
注意事项:
a.架子必须未被使用,否则需先清除架号。
b.项目组合:1—电解质;2—肾功能;3—心肌酶;6—质控
6. 审核病人报告
对每个病人报告逐一进行审核。
注意事项:超过生化危急值的报告需立即向医生或病房电话报告。
7. 日常保养
7.1 周保养
擦拭各样本针、试剂针:先按STOP(生化仪主机上的正方形白色键),然后用75%酒精擦拭,做完后点击主屏幕上的“仪器命令”,然后点击1-复位。
7.2 月保养
1. 检查更换比色杯冲洗站上的小橡皮拭。
2. 清洗流动池
(1) 配制清洗液:Diluted Clenz Solution(P/N 664090)4滴,用蒸馏
水或生理盐水加满至2ml。
(2) 在实用程序中选2-维护,再选10-清洗流式单元、样品杯和CC探针/
混合器。按屏幕提示操作,输入样本架号(任意未用),将配制好的清洗液放入样品架中,点击开始,完成后退出。
3. 清洗样本针、试剂针、搅拌针
(1) 将CCWA试剂(Cartridge chemistry wash solution,P/N:657133)
加载入试剂舱中的任意空置位。
(2) 采取普通样本编程方式,选取一个样本架及两个2ml反应杯,测试项
目选择CCWA,第1杯和第2杯添加的液体及分别重复的次数如下表所示(重复次数在选项里面设置),将样本架放入进样轨道后按RUN键:
备注:Diluted Clenz Solution(P/N 664090):加4滴,用生理盐水加满至2ml
Saline为0.9%生理盐水
CCWA(Cartridge chemistry wash solution,P/N:657133)
4. 检查CL定标水平2区间的SPAN值,如果<1800,则需要保养或者更换CL
电极。
7.3 双月保养
1. 更换CO2碱性缓冲液(ALK BUF),并修改容量百分比。
2. 清洁空气过滤网。
7.5 四月保养
更换样本和试剂注射器的活塞。
7.6 半年保养
更换K、Ca电极。
血疟原虫(MP)厚血片检查法(手工法)标准操作规程1. 实验原理 应用瑞氏染色法对制备好的厚血片进行染色后在显微镜下查找疟原虫。 2. 标本采集 2.1标本采集前病人准备:间日疟及三日疟患者应在发作后数小时至10余小时采血;恶性疟患者,应在发作后20h左右采血。 2.2标本种类:全血或末梢血 2.3标本要求:厚血片的溶血要及时。 3. 标本储存:厚血片的放置期限在夏季不超过48h,冬季不超过62h。 4. 标本运输:室温运输。 5. 标本拒收标准:细菌污染。 6. 操作步骤 6.1 在洁净玻片上,滴患者血液2滴。 6.2 用推片角将血液由内向外转涂成直径约1cm、厚薄均匀的血膜,在室温中自然干燥。 6.3 在干燥的血膜上滴加蒸馏水数滴,完全覆盖血膜,溶血数分钟。脱去血红蛋白的血膜呈浅灰色,倾去溶血液。 6.4 不必待干,进行瑞氏染色。 6.5 干后镜检。 7. 结果判断与分析:在油镜下观察20个视野或以上才能报告“未检出疟原虫”;发现虫体后还应在薄血片上进行分类鉴别。 8. 临床意义:本实验有利于提高疟原虫的阳性检出率。 9. 操作性能:快速简便、阳性检出率高、利于人群普查初筛 10. 方法局限性 10.1 易受溶血不完全的影响。 10.2 经验缺乏者易受其他杂物的影响。 10.3 存在主观判断的失误 10.4 不易鉴别出疟原虫的种类。 11. 参考文献
中国人民共和国卫生部医政司编.全国临床检验操作规程(第二版).1997,85-86 12. 注意事项 12.1 染色后,水洗时不要先倒去染液,应让清水流进染液,使沉渣冲走。 12.2 注意区别易与疟原虫混淆的其他杂物。
细菌室工作守则 1.每日工作前用紫外线照射实验室半小时以上。 2.入室前应穿工作服,并做好实验前的各项准备工作。 3.实验室内应保持肃静,不准吸烟、吃东西及用手触摸面部。尽量减少室内活动,以免引起风动,无关人员禁入。 4.非必要物品禁止带入实验室,必要资料和书籍带入后,应远离操作台。 5.做好标本的登记、编号及试验记录。未发出报告前,请勿丢弃标本。 6.标本处理及各项试验应在操作间进行,接种环用完后应立即火焰灭菌,沾菌吸管、玻片等用后应浸泡在消毒液内。 7.实验时手部污染,应立即用过氧乙酸消毒或浸于3%来苏儿溶液中5-10分,再用肥皂洗手并冲洗干净;如误入口内,应立即吐出,并用1:1000高锰酸钾溶液或3%双氧水漱口,根据实际情况服用有关药物。 、 8.实验过程中,如污染了实验台或地面,应用3%来苏儿覆盖其上半小时,然后清洗;如污染工作服,应立即脱下,高压灭菌。 9.若出现着火情况,应沉着处理,切勿慌张,立即关闭电闸,积极灭火。易燃物品(如酒精、二甲苯、乙醚和丙酮等)必须远离火源,妥善保存。 10.工作结束时检查电器、酒精灯等是否关闭,观察记录培养箱、冰箱温度及工作情况,用浸有消毒液的抹布将操作台擦拭干净,并将试剂、用具等放回原处,清理台面,未污染的废弃物扔进污物桶,有菌废弃物应送高压灭菌后处理。
11.离室前工作人员应将双手用消毒液消毒,并用肥皂和清水洗净。 12.爱护仪器设备,经常清洁,注意防尘和防潮。 细菌室消毒隔离措施 1.每天工作前用消毒液消毒工作台,上班前、下班后开紫外灯(最少半小时)进行空气消毒。 2.非必要品禁止带入实验室,必要资料和书籍带入后,应远离操作台。 3.使用后的载玻片、盖片、平皿、试管等用消毒液浸泡,经煮沸后清洗或丢弃。 4.试验后的血液标本用消毒液浸泡后煮沸消毒,所有用于试验的反应板、吸头等用消毒液浸泡(至少24小时以上)后清洗或丢弃。 5.所有微生物培养物(细菌、支原体、真菌等培养物),不管标本阳性或阴性均 - 1 - 用消毒液浸泡后,经煮沸消毒,才能清洗或丢弃。 6.取材、最好采用一次性工具,不能采用一次性工具者,每次取材前均应彻底消毒。 7.用于浸泡各种器械如刮菌刀、持物钳、镊子等的消毒液要定期更换。 8.不慎发生临床标本或培养物污染工作台,不要立即用水冲洗,应先用纸巾、布等敷料加上消毒液(如5%石炭酸、3%来苏儿等)消毒30分钟以上,然后再清洗。如污染工作服,应立即脱下,高压灭菌。
疟原虫检测试剂盒作业指导书 1.目的 指导实验室检验人员正确操作疟原虫检测试剂盒胶体金法 快速检测,保证人员及设备安全。 2.范围 适用于实验室检验人员 3.职责 样品检验员负责正确使用疟原虫检测试剂盒胶体金法快速检测,并做好原始记录; 技术负责人负责解决操作中出现的技术问题。 4.作业指导 4.1试剂储存条件4℃-30℃保存。 4.2使用方法 4.2.1.在紫色加样区滴加 15μ l 血样。 4.2.2.立即在加样垫下方的白色垫片上滴加 2 滴试剂 A。 4.2.3.在书形检测卡左边一侧最上方的白色垫片上滴 4 滴试A。 4.2.4 15 分钟内读取结果,30分钟显示的结果无临床意义。
4.3. 结果判断 2 阳性 间日疟(P.v.)阳性,或卵形疟(P.o.) T1 阳性阳性,或三日疟(P.m.)阳性,在一些病 恶性疟阳性,恶性疟(P.f.)感染。例中,仅 T2 线出现表明可能是(P.v.) (P.o.)、(P.m.)的 2 种或 3 种混合 感 染。 T1+T2 阳性 恶性疟(P.f.)阳性,恶性疟(P.f.)感染。 阴性 在一些病例中,T1 和 T2 线均出现,可能表明是 检测结果阴性,未检测到疟疾抗原。(P.f.)与其它 3 种(P.v.)、(P.o.)、(P.m.) 的不同组合感染。 无效结果或无法解释的结果 如果控制线没有出现,无论出现几条检测线, 检测结果均无效。 4.4注意事项 4.4.1质控区与检测区域均不出现红色反应线,表明发生错误的检验应重试。 4.4.2当疟原虫密度很高时检测线很明显,质控线可能变得很弱,为正常结果。 4.4.3不要混合使用来自不同批次的试条/试卡和裂解液。 4.4.4操作时应注意做好生物安全防护,用过的试条/试卡、裂解液等在废弃之后,进行高压灭菌。
1. 目的 规范生化组组长的职责范围,保证本专业组的各项工作按照既定的质量体系 正常运行。 2. 范围 适用于生化专业组。 3 .职责 3.1 生化组组长为本专业实验室的学科带头人,在科主任领导下,负责本专业的 全面质量管理,科研、教学和部分行政管理工作。 3.2 负责本组人员的工作安排、业务学习、继续教育和技术考核等工作,规划及 落实本专业的发展计划,负责组织编写本组的标准操作规程(SOP),经常检查执行 情况。 3.3 负责制定本专业的室内质量控制方案,每日检查各检验项目的室内质控状态, 分析质控数据,对失控项目提出纠正办法,填写月质控报告。 3.4 积极参加各临床检验中心组织的室间质量评价活动,审查签发室间质评回报 表,分析质评成绩,提出改进措施,填写室间质评总结报告。 3.5 亲自参加检验工作并掌握特殊检验技术,解决本专业的复杂疑难问题。3.6 经常深入临床科室征询对检验质量的意见,介绍新的检验项目及临床意义,有条件时参加临床疑难病例讨论,主动配合临床医疗工作。 3.7 结合临床医疗,制定本专业的科研计划,并不断引进国内外的新成果、新技 术、新方法,开展新项目,提高本专业的技术水平。 3.8 检查督促本组检验人员贯彻执行各项规章制度的情况,进行考勤考绩、人员 安排。 3.9 负责本专业仪器设备和各种设施的管理;负责制定本专业试剂和实验用品的 请购计划,负责本专业范围内试剂和低耗品的保管。 3.10 专业组长外出前,应向科主任提出申请,临时指定人员负责代理。 1. 目的 明确生化组岗位职责,加强岗位责任心,提高工作效率,保证本专业组的各 项工作按照既定的质量体系正常运行,及时、准确地为客户报告检验结果。 2. 范围 适用于生化组。 3. 职责
血液疟原虫检查 [试验名称] 血液疟原虫检查 [试验方法] 薄血片法或厚血片法 [操作] 1.薄血片法:以常法薄推血片,血膜完全干燥后即可染色。染色法同白细胞分 类检查 2.厚血片法:在洁净玻片上,滴患者血液2滴,用推片角将血液由内向外转涂 成直径约1cm,厚薄均匀的血膜,在室温中自然干燥。在干燥的血膜上滴加蒸馏水数滴,完全覆盖血膜,溶血数分钟,脱去血红蛋白的血膜呈浅灰色,倾去溶血液。不必待干,进行染色,干后镜检。 [结果报告] 查见或未查见疟原虫 [注意事项] 1.采血时间:间日疟级三日疟患者应在发作后数小时至10余小时才学,此时, 早期滋养体已发育至易于鉴别的形态晚期;恶性疟患者,应在发作20小时左右采血。 2.厚血片的溶血要及时,厚血片的放置期限在夏季不超过48h,冬季不超过72h, 否则溶血不完全,会影响检验质量。 3.染色后,水洗时不要先倒去染液,应让清水流进染液,使沉渣飘浮冲走。 4.玻片油镜检查,须找100或100个以上视野才能报告“未检出疟原虫”。厚 血片至少20个视野以上。 5.疟原虫须分类报告,找到环状体后,须在仔细寻找更为成熟的阶段,以便分 类。如确实未找到更为成熟的疟原虫,可报告为“检出环状体疟原虫” 6.有可能出现2种或3种疟原虫混合感染时,以间日疟与恶性疟混合感染最常 见,须注意鉴别。 7.注意区别易与疟原虫混淆的其他杂物。特别是厚血片检查时,缺乏经验者必 须在薄血片上仔细寻找证实,才能报告。 8.除上述3种疟原虫外,在我国云南曾发现过少数卵形疟原虫引起的病例。卵 形疟原虫的基本形态与三日疟原虫相似,但虫体稍大,受感染的红细胞略胀
大,滋养体后期与裂殖体前期的原虫呈圆形或卵圆形。
疟原虫镜检操作规程 1.标本采集 1.1标本采集前病人的准备:间日疟及三日疟患者应在发作后数小时至10余小时采血;恶性疟患者,应在发作后20小时左右采血。1.2标本种类:全血或末梢血。 1.3标本要求:厚血片溶血要及时。 2.标本运送:室温运送。 3.标本拒收标准:被细菌污染。 4.操作步骤 4.1 薄血片法: 4.1.1在洁净玻片上,滴血液标本1滴,以常法推制成薄片。 4.1.2 血膜完全干燥后即可用瑞氏法染色,干后用油镜镜检。 4.2厚血片法: 4.2.1在洁净玻片上,滴血液标本2滴。 4.2.2用推片将血液由内向外转涂成直径约1cm、厚薄均匀的血膜,在室温中自然干燥。 4.2.3 在干燥的血膜上滴加蒸馏水数滴,完全覆盖血膜,溶血约5分钟后倾去溶血液。 4.2.4 不必待干,进行瑞氏染色,干后镜检。 5.结果判断 在油镜下观察,薄片须至少100个视野,厚血片至少20个视野,才能报告“未见疟原虫”;发现虫体后还应在薄血片上进行分类鉴别。
疟原虫胶体金法简易操作步骤 原理 基于双抗体夹心法工作原理,检测时,滴加5μL全血样本于试剂卡加样孔处,随之滴加4滴裂解液,裂解后的样本在毛细管效应下向上层析。如样本中含有恶性疟原虫特异性乳酸脱氢酶(pflDH)和疟原虫乳酸脱氢酶(panLDH),将于胶体金标记物panLDH单克隆抗体反应形成复合物,在层析作用下前移,被预先固定在硝酸纤维膜上检测区的pflDH/panLDH单克隆抗体捕获,在检测区内形成1条/2条红色反应线,此时为阳性结果,如样本中无pflDH/panLDH抗原,在检测区内无红色反应线,此时为阴性反应。 步骤 1.无菌采集患者EDTA-2K抗凝静脉血2ml。 1.沿锡箔袋切口,撕开锡箔纸,取出疟原虫抗原检测卡,用铅笔或水写笔编号 并做好登记。 2.吸取5μL全血样本垂直滴加于加样孔A区,同时滴加4滴裂解液于加样孔B 区。 3.15分钟内观察显示结果,超过30分钟无临床意义。 结果
检验科全套SOP文件 124.236.7.* 质量手册目录 01质量手册说明 02质量手册版本控制 03科室简介 04授权书 05批准令 06公正性申明 07修改记录 08质量方针与质量目标 09组织和管理 10投诉地解决 11不符合项地识别和控制 12纠正措施 13预防措施 14内部审核 15管理评审 16人员 17设施和环境 18检验前程序 19检验程序 程序文件目录 001 程序文件目录 002 批准令 003修改爷 01 文件控制程序 02计算机管理程序 03 合同评审程序 04 医疗咨询控制程序
05 客户投诉控制程序 06 不合格项控制程序 07 纠正措施控制程序 08 预防措施控制程序 09 内部质量审核控制程序 10 人员任用资质评定程序 11 仪器管理程序 12 仪器校准程序 13 样本管理程序 14 生物参考范围建立程序 15 实验不确定度评定程序 16、检测结果溯源程序 17、内部质量审核控制程序 18、室间质量评价程序 19、生物安全管理程序 20、需求地确定及实验室能力评审控制程序 21 新检测项目建立程序 22、满意度监测程序 23、标识控制程序 24、仪器标识控制程序 25、质量保证程序 26、检测申请单格式确定程序 27、检测结果报告控制程序 28、检测结果修改与变更程序 29、试剂管理程序 30、结果报告程序 作业指导书 临床检验作业指导书 01静脉血常规样品采集手册 02末梢血常规样品采集手册 03静脉血血沉样品采集手册 04血型鉴定血液标本的采集 05尿液常规标本采集手册 06一般尿液标本的采集手册 07特殊尿液标本的采集手册
血常规SOP文件
全自动血细胞分 析SOP 一,检验目的及原理 1,目的:用BC-3000 Plus 全自动血细胞分析仪,在临床和实验室定量分析血液细胞,对人体的血液中三种有形成分(红细胞,白细胞,血小板)的19项参数和3个直方图进行分析。是人体血液的基本生理病理指标之一。 白细胞计数WBC 淋巴细胞计数Lymph# 中间细胞计数Mid# 中性粒细胞计数Gran# 淋巴细胞百分比Lymph% 中间细胞百分比Mid% 中性粒细胞百分比Gran% 红细胞计数RBC 血红蛋白HGB 平均红细胞体积MCV 平均红细胞血红蛋白含量MCH
平均红细胞血红蛋白浓度MCHC 红细胞分布宽度变异系数RDW-CV 红细胞分布宽度标准差RDW-SD 红细胞压积HCT 血小板计数PLT 平均血小板体积MPV 血小板分布宽度PDW 血小板压积PCT 白细胞分布直方图WBC Histogram 红细胞分布直方图RBC Histogram 血小板分布直方图PLT Histogram 对患者和健康人群来讲,观察有无各种原因引起的贫血,出血和失血,目前机 体有无细菌及病毒感染,可筛查出各种血液病,如白血病,血小板减少性紫癜等。 2,原理:电阻法
测量的血样先用稀释液进行指定比例的稀释,用以测量WBC、RBC、PLT 和HGB等参数。WBC、RBC 计数池的稀释标本在负压作用下,分别通过各自的计数微孔,流入管道,通过两个光电传感器,在这两个光电传感器之间的液量就是仪器分析计数的标本量。 用阻抗法测量WBC、RBC 和PLT 的体积分布和数目。电极插在液体中计数微孔的两边,在计数微孔的两边周围建立了一个电场环境,根据血细胞非传导性的性质,当有细胞通过计数微孔时,将引起阻抗的变化,阻抗变化的大小与细胞体积成正比。 WBC根据体积的大小,它有多种形态,由于稀释液、溶血剂和溶血时间的不同,WBC的体积大小会发生变化。在一定的程序控制下,显示出WBC 的三分类——淋巴细胞、中间细胞(嗜酸+嗜碱+单核)和中性粒细胞。 被稀释的血样加入溶血剂后,红细胞溶解,释放出血红蛋白,血红蛋白与溶血剂结合形成复合物,用波长525nm 的单色光在WBC计数池内测定此化合物的透过光强,用这个透过光强与空
编号:xxx 试剂盒标准操作程序 (20xx年第x版) 产品名称:胱抑素C检测试剂盒(Cys-C) 剂型:液体双试剂 适用仪器:奥林帕斯AU640全自动生化分析仪
1实验原理和检验目的 本试剂采用比浊法测定胱抑素C的含量。试剂中包含乳胶颗粒与抗Cys-C的单克隆 抗体结合,乳胶颗粒在546nm有最大吸收,当和样本中的Cys-C抗原发生凝集,在546nm 处吸光度上升决定于Cys-C的浓度。根据工作曲线可以检测出样本中Cys-C的含量。 本试剂用于体外定量测定人血清中胱抑素C的含量。 2标本采集和处理 2.1标本种类和采集方法 标本:新鲜无溶血血清。如用血浆,主张用不含氨的肝素或EDTA抗凝血浆。 受检者(体检对象或病人)的准备:对于体检对象抽血前应有2周时间保持平时的饮食习惯。 静脉采血:除非是卧床的病人,一般采血时取坐位。 2.2标本处理方法 标本要放在带盖的容器内以防污染和蒸发。样品采集后要离心标本,吸出血清/血浆。处理样品时要将其当成生物污染品。 3试剂及仪器 3.1试剂组成 R1:MOPSO缓冲液(PH=6.7) 0.1mol/L R2:抗人Cys-C抗体胶乳颗粒适量 试剂比例R1:R2为4:1。 3.2试剂准备 试剂为液体双试剂,开瓶即可使用,用后及时置于2~8℃避光保存。 3.3试剂稳定性 原装试剂在2~8℃避光保存,稳定期12个月。试剂开瓶载机2~8℃稳定30天。 新打开试剂不宜与已用过的试剂混合在一起,否则易造成试剂稳定性下降。 3.4 仪器:适用于奥林帕斯AU640 4校准 4.1校准品 每日进行试剂空白校准操作。
4.2校准品准备 Cys-C校准物为液体,从冰箱取出平衡至室温后即可使用。 4.3校准品稳定性 Cys-C校准物2~8℃密闭保存稳定至有效期。 4.4试剂校准周期 推荐校准周期为30天。当试剂批号更换时应重新校准。 5质控 5.1质控品 建议采用试剂配套质控血清进行室内质控。 5.2可接受性判断 质控物的检测值应在给定质控范围,或可以通过参加卫生部室间质评对实验室的运作情况进行系统评估。 5.3 质控操作 每日进行样本检测之前首先应进行质控操作,以考察系统的在控情况。如果检测结果符合质控要求则进行样本操作;如果不符合质控要求,则应重复质控操作,以排除可能发生的偶然误差;如果仍不符合质控要求,则应考虑质控品的重新准备、试剂的重新校准或更新、仪器的维护等。建议在样本的检测过程中和/或结束后再次进行质控操作,以考察样本的检测全过程的在控情况。 6操作 6.1.奥林帕斯
ISO15189质量管理体系范本文件(第七册)管理制度与采集手册 文件编号:ABCD-3-ZH-01~18 ABCD-3-YP-01~16 第A版 编制: 审核: 批准: 生效日期:2015年4月8日ABCD人民医院检验科
目录
修订页
检验科各岗位职责 一、生化室岗位职责 1.岗位设定 生化室设岗位1,2,周二、周五增加岗位3。 2.岗位职责: 岗位1:负责生化常规检验项目的检验,OLYMPUS AU1000生化分析仪室内质控、操作、日常、定期维护及填写相应记录以及环境温湿度检测、冰箱温度检测的记录,与岗位2相互审核记录内容。与岗位3或2在生化常规检验标本的编号、离心、标本吸取方面相互配合。 岗位2:负责生化肝功能检查及防保科检验项目的检验(无岗位3时,需配合岗位1对生化常规检验标本的编号、离心、标本吸取工作),VIROS250干生化分析仪室内质控、操作、日常、定期维护及填写相应记录,与岗位1相互审核记录内容。 岗位3:负责生化杂项检验项目(血气分析、G-6PD、血清胆碱脂酶、每周5的血清蛋白电泳)的检验及生化常规检验标本的编号、离心、标本吸取,填写血气分析、血清蛋白电泳仪的操作、日常、定期维护的相应记录。 二、免疫室岗位职责 1.岗位设定 免疫室设岗位2,3,4,周一增加岗位1。 2.岗位职责: 岗位1:负责免疫室每周一的Vca-IgA、肝炎系列、麻疹抗体检验(包括上周防保科留下的标本),及以上各项目的室内质控。 岗位2:负责免疫肝功能两对半检验工作及室内质控、酶标仪操作、每日及定期维护及填写相应记录,,与岗位4相互审核记录内容。 岗位3:负责免疫室防保科体检项目,每天补体、免疫球蛋白等特种蛋白分析仪检验项目,乙肝表面抗原的急诊检验,每日10点半之前配合岗位4标本的编号、离心等。 岗位4:负责岗位1,2,3之外的其它免疫常规杂项检验,及室内质控;发光免疫分析仪每日及定期维护及填写相应记录,以及环境温湿度检测、冰箱温度检测的记录,与岗位2相互审核记录内容,每日10点半之后配合岗位3体检标本编号、离心。
疟原虫(MP)厚血片检查法(手工法)的标准操作规程 1. 实验原理 应用瑞氏染色法对制备好的厚血片进行染色后在显微镜下查找疟原虫。 2. 标本采集 2.1标本采集前病人准备:间日疟及三日疟患者应在发作后数小时至10余小时采血;恶性疟患者,应在发作后20h 左右采血。 2.2标本种类:全血或末梢血 2.3标本要求:厚血片的溶血要及时。 3. 标本储存:厚血片的放置期限在夏季不超过48h,冬季不超过 62h。 4. 标本运输:室温运输。 5. 标本拒收标准:细菌污染。 6. 操作步骤 6.1 在洁净玻片上,滴患者血液2滴。 6.2 用推片角将血液由内向外转涂成直径约1cm、厚薄均匀的血膜,在室温中自然干燥。 6.3 在干燥的血膜上滴加蒸馏水数滴,完全覆盖血膜,溶血数分钟。脱去血红蛋白的血膜呈浅灰色,倾去溶血液。 6.4 不必待干,进行瑞氏染色。 6.5 干后镜检。 7. 结果判断与分析:在油镜下观察20个视野或以上才能报告“未检出疟原虫”;发现虫体后还应在薄血片上进行分类鉴别。 8. 临床意义:本实验有利于提高疟原虫的阳性检出率。 9. 操作性能:快速简便、阳性检出率高、利于人群普查初筛 10. 方法局限性 10.1 易受溶血不完全的影响。 10.2 经验缺乏者易受其他杂物的影响。 10.3 存在主观判断的失误 10.4 不易鉴别出疟原虫的种类。 11. 参考文献 中国人民共和国卫生部医政司编.全国临床检验操作规程(第二版).1997,85-86 12. 注意事项 12.1 染色后,水洗时不要先倒去染液,应让清水流进染液,使沉渣冲走。 12.2 注意区别易与疟原虫混淆的其他杂物。
临床生化标准操作程序文件(临床生化检验SOP文件) XX医院检验科 CS600B全自动生化分析仪
标准化操作程序文件 单位:山东德棉职工医院 科室: 检验科生化室 文件编号: 版本: 批准施日期: 有校期: 一年 复审计划:每年复审,测定系统变化时需进行修订 发放部门:检验科生化室 编写者:巩建刚 审批者: 保管者: 修订者: CS-600B全自动生化分析仪
标准化操作程序文件 【仪器运行条件】 为保证仪器的正常运行,仪器必须满足下列条件: 1.灰尘少、通风良好的环境,避免阳光直接照射。 2.地面水平良好(斜度<1/200),地面强度要能够承受仪器的重量(850kg)。 3.室内温度保持在15~32℃,温度变化不超过±3℃/小时。 4.室内相对湿度应保持在45~85℃,且不结露。 5.纯水供应:反渗水或离子交换水。出水量:40升/小时,水压:0.5~3.5kg/cm2。 6.电源供应:220V±10%,50~60Hz,最大功率4KVA。有保护性接地(接地电阻<10Ω下)。 7.放置本仪器的房间请不要带入以下电器:手机、对讲机等发出特定电磁波的小功率电器。 【开机程序】 1)开机前检查 1.供电系统(包括UPS)是否正常。 2.供水系统是否正常。 3.检查样品针、试剂针、搅拌针、清洗针是否有弯曲、堵塞、污物、漏水等,如有上述情况发生,参照仪器维护、保养说明书处理。 4.检查清洗液(迪瑞原厂供应),包括样品针、搅拌针、去污剂箱及试剂位45(抗菌无磷)和45位(碱性)各种清洗液,必要时补足。 5.检查打印机是否正常、打印纸是否安装好及是否联机(打印机上Online灯亮)。 6.仪器及操作台面表面干净、无污物,机房空调正常开启。 2)开机 为保证试剂舱的冷藏作用,位于仪器右后下方的总电源(ON)可长期处于开启状态,同时UPS长期处于工作状态。 1.打开仪器右侧电源(ON)开关,记录开机时间。 2.待仪器自检及程序装载(15分钟)结束,仪器至备用(Ready)状态,如有错误(Trouble),根据错误代码查找维护保养说明书检查原因,及时处理。 3.自动开机在自动开机程序中设置开机时间: MAIN MENU F5:DEFINE F6:DEFINE OPTIONAL PARAMETERS F2:FOR AUTOMATIC STARTUP CONDITION 3)执行开机程序Startup1 或Startup2 开机程序设置: MAIN MENU F5:DEFINE F6:DEFINE OPTIONAL PARAMETERS F3:FOR STARTUP1 或F4:FOR STARTUP2
1.检验的适应症: (1)诊断造血系统疾病:骨髓象检验对各种类型白血病、再生障碍性贫血、巨幼红细胞贫血、恶性组织细胞病、戈谢病、尼曼-匹克病、海蓝色组织细胞增生症、多发性骨髓瘤,也常通过复查骨髓象来评价或判断预后。 (2)协助诊断某些疾病:如各种恶性肿瘤的骨髓转移、淋巴瘤的骨髓浸润、骨髓增殖综合症、骨髓增生症、缺铁性贫血、溶血性贫血、脾功能亢进和原发性血小板(特发性)血小板减少性紫癜。 (3)提高某些疾病的诊断率:利用骨髓液检查疟原虫、黑热病原虫、红斑狼疮细胞(细胞)及细菌培养、染色体培养、干细胞培养等,皆可提高阳性率。2.禁忌症: (1)由于凝血因子缺陷引起的出血性疾病如血友病。 (2)晚期妊娠的孕妇做骨髓穿刺时应慎重。 3.检验的方法: (1)显微镜低倍镜观察: 1)判断有核细胞的增生程度:在观察取材、涂片,染色等情况是否满意的基础上。一般均以涂片中有核细胞与成熟红细胞之比来判断骨髓有核细胞的增生程度。通常分为五级。当检验结果介于两级之间时,则将其增生程度向上提一级。例如在增生活跃与增生明显活跃之间时,可判定为增生明显活跃。 2)估计巨核细胞系统的增生情况:低倍镜下逐一浏览视野,计数全部片膜(尤其是两端及上下边缘)内的巨核细胞。正常人于1.5×3的范围内可见巨核细胞7~35个,但必须在油镜下观察得以证实。 3)观察涂片边缘、尾部、骨髓小粒周围,有无体积较大或成堆分布的异常细胞,如转移癌细胞、细胞、多核巨细胞、恶性组织细胞、戈谢细胞、尼曼-匹克细胞等。但也需要在油镜下观察,加以判断。 (2)显微镜油镜观察: 1)选择满意的片膜段,观察200-500个细胞,按细胞的种类、发育阶段分别计数并计算它们各自的百分率。 2)仔细观察各系统的增生程度和各阶段细胞数量和质量的变化。
ICS11.020 C62 WS 中华人民共和国卫生行业标准 WS/T 569—2017 疟原虫检测血涂片镜检法 Microscopic examination of blood films for malaria parasites 2017-08-01发布2018-02-01实施
前言 本标准按照GB/T 1.1—2009给出的规则起草。 本标准起草单位:海南省疾病预防控制中心、江苏省寄生虫病防治研究所、中国疾病预防控制中心寄生虫病预防控制所、云南省寄生虫病防治所、海南省农垦总局医院。 本标准主要起草人:王善青、高琪、汤林华、杨恒林、郑彬、胡锡敏、王光泽、李雨春、刘莹、欧阳范献。
疟原虫检测血涂片镜检法 1 范围 本标准规定了血涂片镜检法检测疟原虫的技术规范。 本标准适用于各级疾病预防控制机构和医疗机构对疟原虫的显微镜检测。 2 术语和定义 下列术语和定义适用于本文件。 2.1 疟原虫Plasmodium spp 疟原虫是一类单细胞、寄生性的真核动物,是疟疾(malaria)的病原体。寄生于人体的疟原虫主要有恶性疟原虫(Plasmodium falciparum)、间日疟原虫(Plasmodium vivax)、三日疟原虫(Plasmodium malariae)和卵形疟原虫(Plasmodium ovale)等。 2.2 血涂片 blood films 将血液涂制于载玻片上制成的涂片。供显微镜疟原虫检查用的血涂片包括厚血膜涂片和薄血膜涂片两种。 3 仪器和器材 3.1 生物显微镜(100×油浸物镜、5×或10×目镜)。 3.2 计数器。 3.3 载玻片(无划痕无油污的洁净载玻片)。 3.4 推片。 3.5 血片染色架。 3.6 血片干燥架。 3.7 玻片盒。 3.8 染色盘和染色缸。 4 试剂和材料
CNAS-CL02-A001 医学实验室质量和能力认可准则 在临床血液学检验领域的应用说明 Guidance on the Application of Accreditation Criteria for the Medical Laboratory Quality and Competence in the Field of Clinical Hematology 中国合格评定国家认可委员会
前言 本文件由中国合格评定国家认可委员会(CNAS)制定,是CNAS根据临床血液学检验的特性而对CNAS-CL02:2012《医学实验室质量和能力认可准则》所作的进一步说明,并不增加或减少该准则的要求。 本文件与CNAS-CL02:2012《医学实验室质量和能力认可准则》同时使用。 在结构编排上,本文件章、节的条款号和条款名称均采用CNAS-CL02:2012中章、节条款号和名称,对CNAS-CL02:2012应用说明的具体内容在对应条款后给出。 本文件的附录A、B为规范性附录。附录的序号及内容与CNAS-CL02:2012不对应。 本文件代替:CNAS-CL43:2012。 本次为换版修订,相对于CNAS-CL43:2012,本次换版仅涉及文件编号改变。
医学实验室质量和能力认可准则在 临床血液学检验领域的应用说明 1 范围 本文件规定了CNAS对医学实验室临床血液学检验领域的认可要求。 临床血液学检验领域包括血细胞分析、血细胞形态学检查、血液寄生虫检查及出凝血检验等。 2 规范性引用文件 下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括修改单)适用于本文件。 GB/T 20468-2006 临床实验室定量测定室内质量控制指南 全国临床检验操作规程 WS/T 347-2011 血细胞分析的校准指南 WS/T 359-2011 血浆凝固实验血液标本的采集及处理指南 WS/T 405-2012 血细胞分析参考区间 WS/T 406-2012 临床血液学检验常规项目分析质量要求 WS/T 407-2012 医疗机构内定量检验结果的可比性验证指南 CNAS-RL02能力验证规则 3 术语和定义 4 管理要求 4.1 组织和管理责任 4.1.1.2医学实验室为独立法人单位的,应有医疗机构执业许可;医学实验室为非独立法人单位的,其所属医疗机构执业证书的诊疗科目中应有医学实验室;自获准执业资格之日起,开展医学检验工作至少2年。 4.1.2.5应至少有1名具有副高及以上专业技术职务任职资格,从事医学检验工作至少5年的人员负责技术管理工作。 4.2 质量管理体系 4.3 文件控制
ISO15189-2012质量管理体系文件(作业指导书) 临检室作业指导书 文件编号:TJDX-3-LJ-01~50 第C版 编制: 审核: 批准: 生效日期:2018年01月01日TJDX附属协和医院检验科
目录
修订页
血红蛋白电泳检查(电泳法) 1. 原理 血红蛋白是由两对多肽链组成的复杂分子。每一条链含有血红素和络合铁原子的卜啉。所有血红蛋白的血红素部分都是相同的。所测定的血红蛋白的蛋白部分称之为珠蛋白。正常人血红蛋白多肽链包括α、β、δ和γ。血红蛋白的结构、分子特性取决于形成其肽链的氨基酸顺序和性状。氨基酸不同可形成不同的血红蛋白,其表面电荷不同,在电场中的泳动率不同。本实验在碱性(PH=8.60)条件下,以琼脂糖凝胶电泳的方法进行,对红细胞洗涤后造成溶血,电泳分离血红蛋白后以氨基黑染色。多余的染色液用酸性液体洗去。待琼脂糖凝胶板干燥后,肉眼可直接判别有无电泳条带异常。运用光密度扫描仪检测准确定量分析电泳条带异常情况。血红蛋白异常有二种类型:血红蛋白性质或结构的异常称之为血红蛋白病。血红蛋白中的一条链合成减少引起血红蛋白性质异常,称之为地中海贫血。 2. 标本采集 2.1 标本采集前病人准备:受检者应空腹。 2.2 标本种类:抗凝血 2.3 标本要求:抗凝剂选用EDTA,柠檬酸或肝素均可,避免碘乙酸。常规静脉采血1.8ml,加入含有109mmol/L枸橼酸钠溶液0.2ml的干燥。清洁试管中,充分混匀。 4. 标本储存:储存于2-8℃冰箱中,5天。 5. 标本运输:储存于2-8℃状态下的冰壶或泡沫箱密封运输。 6. 标本拒收标准:细菌污染、溶血或脂血标本不能作测定。 7. 试剂 7.1 试剂名称:血红蛋白电泳检查试剂 7.2 试剂生产厂家:法国Sebia公司 7.3 包装规格:150tests 7.4 试剂盒组成 琼脂糖凝胶10块溶血素1瓶 缓冲液条带10包×2条薄滤纸1×10张 氨基黑(浓缩液)1瓶×100ml 点样模具滤纸10条×1盒 7.5 试剂储存条件及有效期:贮存于室温(15~30℃)或冰箱(2~8℃),不能冷冻。有效期两年。
疟原虫检测血涂片镜检法 1 范围 本标准规定了血涂片镜检法检测疟原虫的技术规范。 本标准适用于各级疾病预防控制机构和医疗机构对疟原虫的显微镜检测。 2 术语和定义 下列术语和定义适用于本文件。 2.1 疟原虫Plasmodium spp 疟原虫是一类单细胞、寄生性的真核动物,是疟疾(malaria)的病原体。寄生于人体的疟原虫主要有恶性疟原虫(Plasmodium falciparum)、间日疟原虫(Plasmodium vivax)、三日疟原虫(Plasmodium malariae)和卵形疟原虫(Plasmodium ovale)等。 2.2 血涂片 blood films 将血液涂制于载玻片上制成的涂片。供显微镜疟原虫检查用的血涂片包括厚血膜涂片和薄血膜涂片两种。 3 仪器和器材 3.1 生物显微镜(100×油浸物镜、5×或10×目镜)。 3.2 计数器。 3.3 载玻片(无划痕无油污的洁净载玻片)。 3.4 推片。 3.5 血片染色架。 3.6 血片干燥架。 3.7 玻片盒。 3.8 染色盘和染色缸。 4 试剂和材料
4.1 吉氏染色原液。 4.2 pH7.2磷酸盐缓冲液(PBS)。 4.3 甲醇(分析纯)。 4.4 香柏油或专用浸油(折射率≥1.5)。 4.5 二甲苯(分析纯)。 4.6 75%酒精。 4.7 一次性采血针。 4.8 一次性手套。 5 检测步骤 5.1 血涂片的制作 5.1.1 采血部位及取血方法 经75%乙醇消毒采血部位,待干后,用一次性采血针在耳垂或指端扎刺取血,婴儿可从拇趾或足跟扎刺取血。取1张已消毒推片,用拇指和食指夹持推片侧缘中部,用推片左下角刮取血液4μL~5μL用于制作厚血膜,再用该端中部刮取血液1μL~1.5μL用于制作薄血膜。 5.1.2 厚血膜制作 取1张载玻片,将推片左下角的血滴涂于载玻片的中央偏左,由里向外划圈涂成直径0.8cm~1.0cm 的圆形厚血膜,厚度以1个油镜视野内可见到5个~10个白细胞为宜。 5.1.3 薄血膜制作 用干棉球抹净推片左下角上的血渍,然后将推片下缘平抵载玻片的中线,当血液在载玻片与推片之间向两侧扩展至约2cm宽时,使2张玻片保持25°~35°,从右向左迅速向前推成舌状薄血膜。每张载玻片上1个厚血膜和1个薄血膜(参见附录A)。 5.1.4 编号 血膜制好后水平放置,充分干燥后,用铅笔在玻片一侧毛玻璃上或在薄血膜上编号。 5.2 固定与溶血 5.2.1 薄血膜固定 将薄血膜一端朝下呈45°,用棉签蘸取甲醇溶液,均匀轻抹于薄血膜表面,避免碰触厚血膜。 5.2.2 厚血膜溶血 在干燥的厚血膜上滴加蒸馏水数滴,完全覆盖血膜,溶血数分钟,待血膜呈浅灰色,倾去溶血液。厚血膜制作后1d内染色无需溶血,超过1d的应溶血。 5.3 吉氏染色
芜湖市第一人民医院检验科管理文件 1、检验科工作制度 2、检验科值班制度 3、血库工作制度 4、临床室工作制度 5、生化室工作制度 6、细菌室工作制度 7、门诊化验室工作制度 8、质量控制工作制度 9、检验科及实验室消毒隔离制度 10、肠道化验室工作制度 11、检验报告单书写登记制度 12、实习生带教计划 13、年轻医生培养计划 14、仪器设备管理制度 15、医疗安全防范制度 16、医患沟通制度 17、门诊检验科服务公约
18、输血科预防感染制度 19、输血科工作质量管理制度 20、输血科报告登记制度 21、输血反应及处理方法制度 22、临床用血安全管理制度<一>科主任职责 <二>主管检验师职责 <三>检验师职责 <四>检验士职责
检验科工作制度 1、检验科应积极配合临床各科的诊疗活动,进行本专业的检验工作。要认 真制定各工作室:临床、门诊、生化、血液、细菌等室的工作制度。严格按照规章制度和操作要求,认真地进行本室的检测工作。 2、各病区检验标本及化验单,应于每日早晨8:00前送交检验科(急诊除 外)一般检验当日下午下班前发出报告。门诊常规随到随做随报。急诊检验申请单要注明“急”字、优先检验,凡送、收、发的检验标本及申请单都要严格核对姓名、床号、名称、号码等。不符合规定退回重新留取。 3、检验单要遂次填写明确,必须由操作者签全名方可有效,如遇检验结果 可疑时,应立即与临床科联系复查。遇有检验目的项目之外的阳性结果要主动报告。认真做好检验结果的登记工作和报告单发出前的消毒审核工作。 4、使用剧毒、腐蚀、易燃、易爆试剂时要严格执行技术操作,注意安全。 5、检验室要保持清洁、安静。特殊标本如血液发出报告后保留24小时至48 小时,一般标本如尿、大便及一切用具应立即浸泡消毒,传染性标本污染的器皿应煮沸消毒清洗。标本检测后一律消毒后废弃。 6、各种设备、器械要求专人保管、保养。化学试剂专人保管。同时配合医 院做好院内感染监控检测工作。 7、建立实验室室内质量控制制度。积极参加室间质量控制,以保证检验质 量。同时定期向临床科室进行质量随访。 8、配合临床引进新技术、开展新项目。同时认真做好进修实习人员的培训 工作。 9、严格值班制度,坚守工作岗位,遵守院规。提高医疗安全意识,提高检 验质量,协调各专业间的关系和各室技术环节的连结,重视门诊窗口工作,发挥专业特长,提高科室整体水平。
各级医疗机构医院疟原虫检测血涂片镜检法 1 范围 本标准规定了血涂片镜检法检测疟原虫的技术规范。 本标准适用于各级疾病预防控制机构和医疗机构对疟原虫的显微镜检测。 2 术语和定义 下列术语和定义适用于本文件。 2.1 疟原虫Plasmodium spp 疟原虫是一类单细胞、寄生性的真核动物,是疟疾(malaria)的病原体。寄生于人体的疟原虫主要有恶性疟原虫(Plasmodium falciparum)、间日疟原虫(Plasmodium vivax)、三日疟原虫(Plasmodium malariae)和卵形疟原虫(Plasmodium ovale)等。 2.2 血涂片 blood films 将血液涂制于载玻片上制成的涂片。供显微镜疟原虫检查用的血涂片包括厚血膜涂片和薄血膜涂片两种。 3 仪器和器材 3.1 生物显微镜(100×油浸物镜、5×或10×目镜)。 3.2 计数器。 3.3 载玻片(无划痕无油污的洁净载玻片)。 3.4 推片。 3.5 血片染色架。 3.6 血片干燥架。 3.7 玻片盒。 3.8 染色盘和染色缸。 4 试剂和材料
4.1 吉氏染色原液。 4.2 pH7.2磷酸盐缓冲液(PBS)。 4.3 甲醇(分析纯)。 4.4 香柏油或专用浸油(折射率≥1.5)。 4.5 二甲苯(分析纯)。 4.6 75%酒精。 4.7 一次性采血针。 4.8 一次性手套。 5 检测步骤 5.1 血涂片的制作 5.1.1 采血部位及取血方法 经75%乙醇消毒采血部位,待干后,用一次性采血针在耳垂或指端扎刺取血,婴儿可从拇趾或足跟扎刺取血。取1张已消毒推片,用拇指和食指夹持推片侧缘中部,用推片左下角刮取血液4μL~5μL用于制作厚血膜,再用该端中部刮取血液1μL~1.5μL用于制作薄血膜。 5.1.2 厚血膜制作 取1张载玻片,将推片左下角的血滴涂于载玻片的中央偏左,由里向外划圈涂成直径0.8cm~1.0cm 的圆形厚血膜,厚度以1个油镜视野内可见到5个~10个白细胞为宜。 5.1.3 薄血膜制作 用干棉球抹净推片左下角上的血渍,然后将推片下缘平抵载玻片的中线,当血液在载玻片与推片之间向两侧扩展至约2cm宽时,使2张玻片保持25°~35°,从右向左迅速向前推成舌状薄血膜。每张载玻片上1个厚血膜和1个薄血膜(参见附录A)。 5.1.4 编号 血膜制好后水平放置,充分干燥后,用铅笔在玻片一侧毛玻璃上或在薄血膜上编号。 5.2 固定与溶血 5.2.1 薄血膜固定 将薄血膜一端朝下呈45°,用棉签蘸取甲醇溶液,均匀轻抹于薄血膜表面,避免碰触厚血膜。 5.2.2 厚血膜溶血 在干燥的厚血膜上滴加蒸馏水数滴,完全覆盖血膜,溶血数分钟,待血膜呈浅灰色,倾去溶血液。厚血膜制作后1d内染色无需溶血,超过1d的应溶血。 5.3 吉氏染色
寄生虫血液检查 文章目录*一、寄生虫血液检查的基本信息1. 定义2. 专科分类3. 检查分类4. 适用性别5. 是否空腹*二、寄生虫血液检查的正常值和临床意义1. 正常值2. 临床意义*三、寄生虫血液检查的检查过程及注意事项1. 检查过程2. 注意事项*四、寄生虫血液检查的相关疾病和症状1. 相关疾病2. 相关症状*五、寄生虫血液检查的不适宜人群和不良反应1. 不适宜人群2. 不良反应寄生虫血液检查的基本信息 1、定义寄生虫血液检查是一项用于检查寄生虫的辅助检查方法。血液和血细胞内的寄生虫均可在血液中查到,这些原虫和丝虫寄生于人的血液中和红细胞内,需通过血液检查或骨髓检查来进行确诊。常用的方法为血液涂片法(薄血片和厚血片法)和骨髓穿刺法。是一项用于检查寄生虫的辅助检查方法。 2、专科分类传染病检查 3、检查分类病原微生物检查 4、适用性别男女均适用 5、是否空腹非空腹
寄生虫血液检查的正常值和临床意义 1、正常值未查见人体寄生虫 2、临床意义异常结果:血液和血细胞内的寄生虫呈阳性。 需要检查的人群:消化道异常者。 寄生虫血液检查的检查过程及注意事项 1、检查过程疟原虫检查:疟原虫为疟疾病原体,通过蚊子传播,常见的疟原虫有间日疟、三日疟和恶性疟三种。外周血涂片检查疟原虫是诊断疟疾的可靠方法,发现疟原虫既为阳性,就可以作为确诊的可靠依据。阴性结果不能否定诊断,需多次复查,或用基因诊断方法检查。 微丝蚴检查:微丝蚴为丝虫的原虫,我国常见的丝虫感染有班氏丝虫和马来丝虫两种,均通过蚊子传播。外周血涂片检查是诊断的主要方法,阳性结果为诊断依据,阴性结果需多次复查。 回归热螺旋体检查:回归热螺旋体为回归热的病原体,通过人虱传播。阳性结果为诊断依据,阴性结果需多次复查。 弓形体检查:弓形体为弓形虫病的病原体,猫及猫科动物为其主要传染源,人一般呈阴性感染。阳性结果为诊断依据,阴性结果需多次复查,或用免疫学方法及基因诊断方法检查。 立朵小体检查:立朵小体为黑热病的病原体,是鞭毛虫的一