
[Article]
https://www.doczj.com/doc/7e13739281.html,
物理化学学报(Wuli Huaxue Xuebao )
May Acta Phys.鄄Chim.Sin .,2006,22(5):523~527
Received:October 11,2005;Revised:November 2,2005.?
Correspondent,E ?mail:lxchen@https://www.doczj.com/doc/7e13739281.html,;Tel/Fax:0571?87951152.
国家自然科学基金(50271064,50571089)资助项目
?Editorial office of Acta Physico ?Chimica Sinica
V 2.1TiNi 0.4Zr x (x =0~0.06)储氢电极合金的相结构及电化学性能
陈立新?
李露王新华代发帮郑坊平
雷永泉
(浙江大学材料科学与化工学院,杭州
310027)
摘要
系统研究了V 2.1TiNi 0.4Zr x (x =0~0.06)储氢电极合金的相结构及电化学性能.相结构分析表明,所有合金均
由体心立方(bcc)结构的V 基固溶体主相和第二相组成,且第二相沿主相晶界形成三维网状分布;其中,当Zr 含量x ≤0.02时合金的第二相为TiNi 基相,而当Zr 含量x 达0.04时,其第二相变为C14型Laves 相,且主相和第二相的晶胞体积均随着x 的增加而增大.电化学性能测试表明,添加Zr 元素可以改善合金的活化性能和提高最大放电容量;同时,随着Zr 含量x 的增大,合金的高倍率放电性能得到明显提高,但充放电循环稳定性逐渐降低.在所研究的合金样品中,V 2.1TiNi 0.4Zr 0.04合金具有相对较好的综合性能.关键词:储氢电极合金,相结构,
电化学性能,
V 基固溶体
中图分类号:O646,
TG139.7
Phase Structures and Electrochemical Properties of V 2.1TiNi 0.4Zr x
(x =0~0.06)Hydrogen Storage Electrode Alloys
CHEN,Li ?Xin ?
LI,Lu
WANG,Xin ?Hua
DAI,Fa ?Bang
ZHENG,Fang ?Ping
LEI,Yong ?Quan
(College of Materials Science and Chemical Engineering,Zhejiang University,Hangzhou 310027,P.R.China )Abstract
The phase structures and electrochemical properties of the V 2.1TiNi 0.4Zr x (x =0~0.06)hydrogen storage
electrode alloys have been investigated.It is found that all the alloys consist of a main phase of V ?based solid solution with a bcc structure and a secondary phase with a three ?dimensional network structure.The secondary phase precipitates along the grain boundaries of the main phase.For the alloys with Zr content x ≤0.02,the secondary phase is the TiNi ?based phase.As x reaches 0.04,the secondary phase changes into the C14?type Laves phase.Moreover,the unit cells of both the main phase and the secondary phase expand with the increasing Zr content.Electrochemical measurements show that activation behavior and maximum discharge capacities of the Zr ?added alloy are better than those of V 2.1TiNi 0.4alloy.As the Zr content in the alloy increases,their high ?rate dischargeability is improved significantly,but their cycle stability degrades gradually.For the alloy with the Zr content of x =0.04,the best overall electrochemical performances are obtained.Keywords :
Hydrogen storage electrode alloy,Phase structure,
Electrochemical property,
V ?based solid solution
自文献[1]报道V 3TiNi 0.56合金具有较高放电容量(420mAh ·g -1)以来,V ?Ti ?Ni 基固溶体型储氢电极合金受到了许多同行学者的重视和研究.此类合金的一个重要特征就是由V 基固溶体主相和第二相
两相组成,其中V 基固溶体作为主要吸放氢相,而第二相起着导电集流体和电催化的作用.但是这类合金存在高倍率放电能力和循环稳定性较差的问题,从而阻碍了其在Ni/MH 电池中的实际应用[2?4].
523
Acta Phys.鄄Chim.Sin.(Wuli Huaxue Xuebao),2006Vol.22
多元合金化是改善储氢电极综合性能的有效方法之
一[5?11],因此,本研究在前期对V2.1TiNi x(x=0.1~0.9)合
金研究[12?13]的基础上,选用Zr作为合金化添加元
素来进一步提高合金的综合性能,系统地研究
V2.1TiNi0.4Zr x(x=0~0.06)储氢电极合金的相结构及电
化学性能.
1实验
合金试样按设计成分配比后采用磁悬浮真空感
应炉熔炼而成,所用金属原料(V、Ti、Ni、Zr)的纯度
均大于99%,为保证合金成分的均匀性,每个样品
均翻身重熔三次.将部分铸态样品先氢化初碎后再
抽真空脱氢,然后再机械粉碎至小于50μm粒径
待用.取部分块状铸态样品经抛光和腐蚀后,在
Hitachi S?570扫描电镜上观察合金的金相形貌组织,合金中各相的微区成分采用EDS分析.另取部分合金粉在Rikagu D/Max PC2500X射线衍射仪上以Cu K琢为衍射束测定合金试样的晶体结构.
电化学测试在三电极系统中进行,负极是由100mg储氢合金粉末与铜粉以1∶2的质量比混合均匀后冷压(压力18MPa)而成的圆片状测试电极(直径为10mm),正极为高容量的烧结式Ni(OH)2/ NiOOH,参比电极为Hg/HgO,电解液是6mol·L-1 KOH溶液,测试温度298K,仪器为DC?5型电池(电极)测试仪.电极以100mA·g-1电流充电6h,然后以50~300mA·g-1电流放电至截止电位-0.70V.合金的交换电流密度I0采用线性极化法求得,将合金电极活化后放电至50%(即DOD=50%),然后在Solartron1287恒电位仪上进行线性电位扫描,扫描速度为0.1mV·s-1,扫描范围:-5~5mV.
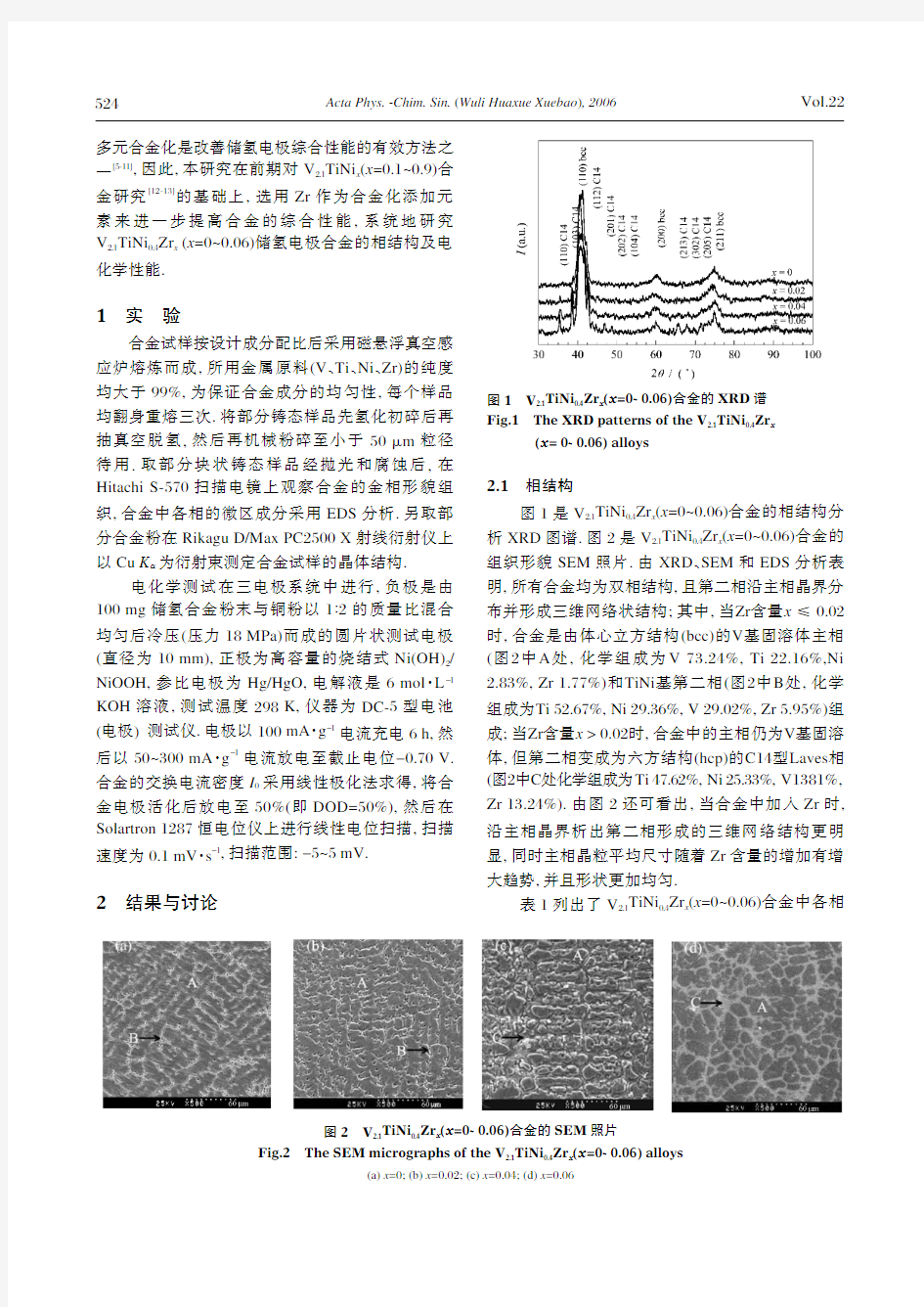
2结果与讨论2.1相结构
图1是V2.1TiNi0.4Zr x(x=0~0.06)合金的相结构分析XRD图谱.图2是V2.1TiNi0.4Zr x(x=0~0.06)合金的组织形貌SEM照片.由XRD、SEM和EDS分析表明,所有合金均为双相结构,且第二相沿主相晶界分布并形成三维网络状结构;其中,当Zr含量x≤0.02时,合金是由体心立方结构(bcc)的V基固溶体主相(图2中A处,化学组成为V73.24%,Ti22.16%,Ni 2.83%,Zr1.77%)和TiNi基第二相(图2中B处,化学组成为Ti52.67%,Ni29.36%,V29.02%,Zr5.95%)组成;当Zr含量x>0.02时,合金中的主相仍为V基固溶体,但第二相变成为六方结构(hcp)的C14型Laves相(图2中C处化学组成为Ti47.62%,Ni25.33%,V1381%, Zr13.24%).由图2还可看出,当合金中加入Zr时,沿主相晶界析出第二相形成的三维网络结构更明显,同时主相晶粒平均尺寸随着Zr含量的增加有增大趋势,并且形状更加均匀.
表1列出了V2.1TiNi0.4Zr x(x=0~0.06)合金中各
相图1V2.1TiNi0.4Zr x(x=0~0.06)合金的XRD谱
Fig.1The XRD patterns of the V2.1TiNi0.4Zr x
(x=0~0.06)
alloys
图2V2.1TiNi0.4Zr x(x=0~0.06)合金的SEM照片
Fig.2The SEM micrographs of the V2.1TiNi0.4Zr x(x=0~0.06)alloys
(a)x=0;(b)x=0.02;(c)x=0.04;(d)x=0.06
524
No.5陈立新等:V 2.1TiNi 0.4Zr x (x =0~0.06)储氢电极合金的相结构及电化学性能的晶胞参数和晶胞体积.可见,随着Zr 含量x 的增加,合金中主相和第二相的晶胞参数和晶胞体积都逐渐增大.这是因为Zr 的原子半径(0.216nm)大于V(0.192nm)、Ti(0.146nm)和Ni(0.124nm)的原子半径,因而随Zr 含量的增加两相中V 、Ti 和Ni 的相对含量减少,导致晶胞体积逐渐增大.2.2电化学性能
图3为V 2.1TiNi 0.4Zr x (x =0~0.06)合金的活化性能和最大放电容量.由图可知,V 2.1TiNi 0.4合金经过3次循环活化后达到最大放电容量439.6mAh ·g -1.当合金中添加Zr 元素后,合金的活化性能得到改善,均只需2次循环即可活化.而当Zr 含量x =0.02时,合金的最大放电容量为432.1mAh ·g -1;随着Zr 含量的增加,合金的放电容量逐渐增大,其中x =0.04合金的放电容量为460.6mAh ·g -1,x =0.06合金的放
电容量为468.5mAh ·g -1.Tsukahara 等[6]研究表明,单一的V 基固溶体在碱液中没有电极活性,不具备可逆充放电能力,但若V 基固溶体相中存在具有催化和导电集流作用的其它相(如TiNi 基相或C14型Laves 相等),可使V 基固溶体相在碱液中被催化激活并实现电化学可逆吸放氢过程.前已述及,当Zr 含量x >0.02时,合金中的第二相由原来的TiNi 基相变成为C14型Laves 相,与TiNi 基相相比,Laves 相既有催化和导电集流作用,本身还具有较高的电化学可逆吸放氢能力,因此,V 2.1TiNi 0.4Zr x (x =0.04~0.06)合金中形成的C14型Laves 第二相是它们最大放电容量提高的主要原因.而V 2.1TiNi 0.4Zr 0.02合金的最大放电容量之所以比V 2.1TiNi 0.4合金低,是由于合金中的Zr 加入量太少,未形成C14型Laves 第二相,反而使V 基固溶体主相含量有所减少(TiNi 基第二相含量增多)而造成的.
图4是V 2.1TiNi 0.4Zr x (x =0~0.06)合金在不同放电电流下的放电容量.由图可见,合金的放电容量随放电电流的增大而相应降低;而在相同放电电流下,合金的放电容量随Zr 含量的增加而增大.由图5中V 2.1TiNi 0.4Zr x (x =0~0.06)合金的高倍率放电能力与放电电流密度的关系可以更清楚地看到,随着Zr 含量
x 的增大,合金电极的高倍率放电性能明显得到改善.如在300mA ·g -1电流的放电条件下,V 2.1TiNi 0.4合金的高倍率放电能力(HRD 300)仅为39.23%,而V 2.1TiNi 0.4Zr 0.04和V 2.1TiNi 0.4Zr 0.06的HRD 300分别达到58.83%和70.13%.
图6是V 2.1TiNi 0.4Zr x (x =0~0.06)合金电极在298K 时的线性极化曲线.当电极过电位在-5~+5mV x Phase a /nm c /nm V /nm 30Main phase
0.3078 0.02943TiNi based secondary phase
0.3025 0.027680.02Main phase
0.3105 0.02994TiNi based secondary phase
0.3075 0.029080.04Main phase 0.3113 0.03017Laves secondary phase
0.50400.82250.208900.06
Main phase 0.3138 0.03090Laves secondary phase
0.5058
0.8270
0.21160
表1V 2.1TiNi 0.4Zr x (x =0~0.06)合金中各相的晶胞参数和
晶胞体积Table 1
The crystal cell parameters and volumes of each phase in the V 2.1TiNi 0.4Zr x (x =0~0.06)
alloys
图3V 2.1TiNi 0.4Zr x (x =0~0.06)合金的活化次数和最大放
电容量
Fig.3The activation number and maximum
discharge capacities (C max )of the V 2.1TiNi 0.4Zr x (x =0~0.06)alloys
图4V 2.1TiNi 0.4Zr x (x =0~0.06)合金在不同放电电流下的放
电容量
Fig.4The discharge capacities of the V 2.1TiNi 0.4Zr x
(x =0~0.06)alloys discharged at various current densities
525
Acta Phys.鄄Chim.Sin.(Wuli Huaxue Xuebao ),2006
Vol.22
范围内变化时,电极极化电流与过电位之间呈现出良好的线性关系.根据线性极化曲线斜率可以求出合金电极的交换电流密度I 0见表2.由表2可见,交换电流密度随Zr 含量x 的增加而增大,表明合金电极表面的电荷转移速率加快,这也印证了上述高倍率放电性能随Zr 含量增加而改善的结果.
图7为V 2.1TiNi 0.4Zr x (x =0~0.06)合金的充放电循
环曲线.由图7可以看出,随着Zr 含量x 的增加,合金电极的循环稳定性逐渐降低.表2中列出了V 2.1TiNi 0.4Zr x (x =0~0.06)合金经过30次充放电循环后的容量保持率S 30(=C 30/C max ×100%).由图表可见,经过30次充放电循环后,V 2.1TiNi 0.4合金的容量保持率S 30最高,为54.62%;随着Zr 含量x 的增加,S 30逐步降低至x =0.04时的40.30%和x =0.06时的22.34%.由此可见,虽然V 2.1TiNi 0.4合金中添加Zr 后有利于
改善高倍率放电性能、
活化性能和放电容量,但不利于合金的充放电循环稳定性,尤其是合金中Zr 含量x >0.04后循环稳定性下降幅度较大.
3结
论
(1)V 2.1TiNi 0.4Zr x (x =0~0.06)合金由体心立方结构
的V 基固溶体主相和第二相组成,且第二相沿主相晶界形成三维网状分布;其中,当Zr 含量x 臆0.02时合金的第二相为TiNi 基相,而当Zr 含量x 达0.04时,其第二相变为C14型Laves 相;合金主相和第二相的晶胞体积均随着x 的增加而增大.
(2)添加Zr 元素可改善V 2.1TiNi 0.4Zr x (x =0~0.06)合金的活化性能,而其最大放电容量随Zr 含量的增加先降后增,当x =0.06时最高值可达468.5mAh ·g -1.
(3)随着Zr 含量x 的增加,合金的高倍率放电能力明显提高,但充放电循环稳定性逐渐降低,尤其是合金中Zr 的含量x >0.04后,循环稳定性下降幅度较大.
(4)在所研究的合金样品中,V 2.1TiNi 0.4Zr 0.04合金具有相对较好的综合性能:经过2次充放电循环活化达到最大放电容量460.6mAh ·g -1,在300mA ·g
-1
图5V 2.1TiNi 0.4Zr x (x =0~0.06)合金的高倍率放电性能Fig.5The high ?rate dischargeability(HRD)of
the V 2.1TiNi 0.4Zr x (x =0~0.06)
alloys
图6V 2.1TiNi 0.4Zr x (x =0~0.06)合金电极的线性极化曲线Fig.6The linear polarization curves of the
V 2.1TiNi 0.4Zr x (x =0~0.06)
alloys
图7V 2.1TiNi 0.4Zr x (x =0~0.06)合金的循环稳定性曲线Fig.7The cycling stabilities of the V 2.1TiNi 0.4Zr x
(x =0~0.06)alloys
x 00.020.040.06I 0/(mA ·g -1
)
82.8894.83120.65131.01S 30(%)
54.62
44.13
40.30
22.34
表2V 2.1TiNi 0.4Zr x (x =0~0.06)合金电极的交换电流密度和
30次循环容量保持率
Table 2
The exchange current density (I 0)and capacity retention after 30cycles (S 30)of the V 2.1TiNi 0.4Zr x (x =0~0.06)alloys
526
No.5陈立新等:V2.1TiNi0.4Zr x(x=0耀0.06)储氢电极合金的相结构及电化学性能
电流放电条件下的高倍率放电能力HRD300为58.83%,30次充放电循环后的容量保持率S30为40.30%.
References
1Tsukahara,M.;Takahashi,K.;Mishima,T.;Sakai,T.;Miyamura,
H.;Kuriyama,N.;Uehara,I.Journal of Alloys and Compounds,
1995,224:162
2Tsukahara,M.;Takahashi,K.;Mishima,T.;Sakai,T.;Miyamura,
H.;Kuriyama,N.;Uehara,I.Journal of Alloys and Compounds,
1995,226:203
3Tsukahara,M.;Takahashi,K.;Mishima,T.;Isomura,A.;Sakai,T.
Journal of Alloys and Compounds,1996,236:151
4Iwakura,C.;Choi,W.K.;Miyauchi,R.;Inoue,H.Journal of the Electrochemical Society,2000,147(7):2503
5Tsukahara,M.;Takahashi,K.;Mishima,T.;Isomura,A.;Sakai,T.
Journal of Alloys and Compounds,1996,245:59
6Tsukahara,M.;Takahashi,K.;Mishima,T.;Isomura,A.;Sakai,T.
Journal of Alloys and Compounds,1997,253鄄254:583
7Tsukahara,M.;Takahashi,K.;Isomura,A.;Sakai,T.Journal of
Alloys and Compounds,1999,287:215
8Zhang,Q.A.;Lei,Y.Q.;Chen,L.X.;Wang,Q.D.Materials
Chemistry and Physics,2001,71(1):58
9Zhang,Q.A.;Lei,Y.Q.;Yang,X.G.;Du,Y.L.;Wang,Q.D.
International Journal of Hydrogen Energy,2000,25(7):657
10Zhang,Q.A.;Lei,Y.Q.;Yang,X.G.;Du,Y.L.;Wang,Q.D.
Journal of Alloys and Compounds,2000,296:87
11Xiao,X.Z.;Chen,C.P.;Wang,X.H.;Chen,L.X.;Wang,L.;Gao, L.H.Acta Phys.鄄Chim.Sin.,2005,21(5):565[肖学章,陈长聘,王新华,陈立新,王丽,高林辉.物理化学学报(Wuli Huaxue
Xuebao),2005,21(5):565]
12Guo,R.;Chen,L.X.;Lei,Y.Q.;Liao,B.;Ying,T.;Wang,Q.D.
International Journal of Hydrogen Energy,2003,28(8):803
13Dai,F.B.;Chen,L.X.;Liu,J.;Zheng,F.P.;Zhang,Z.H.;Lei,Y.
Q.Rare Metal Materials and Engineering,2005,34(9):1500[代发帮,陈立新,刘剑,郑坊平,张志鸿,雷永泉.稀有金属材料与工程(Xiyou Jinshu Cailiao Yu Gongcheng),2005,34(9):1500]
527
纳米储氢电极材料主要有碳纳米管、镁镍合金和镁钛合金 Mg2 Ni纳米晶储氢材料 性能:它具有储氢容量高,吸放氢平台好,质量轻,资源丰富等优点,但要能达到实用化的目的就必须解决其在室温下吸放氢动力学性能差,表面容易形成氧化膜等缺点。 目前,在镁基储氢合金的开发研究中,现已有Mg2Ni ,Mg2Cu ,Mg2La系储氢合金,还有 一系列的多元MgNi系储氢合金。 制备方法采用机械合金化方法,即使用高能球磨机进行球磨制备 1. 采用机械合金化方法制备了Mg Ni 合金粉末,其晶 粒度在10nm左右。 2. 在较高的速度下球磨可以使生成Mg Ni 合金的时间提 前,完全合金化的过程缩短,还有利于减轻焊合提高球磨效率。 3. 过程控制剂的加入以及循环变速运转可以缓和焊合 现象的发生。 4. 初步的研究结果表明:Mg Ni 纳米晶粉末在室温下即 可吸氢,贮氢性能较之传统方法制备的材料有显著改善。 传统方法制备的Mg Ni 在温度低于250°C时不产生吸 2 氢现象,在经历一个前期活化过程之后,吸放氢实验在250 8 °C~350°C,氢气压力1.5~2.0MPa下完成。 将机械合金化制备的Mg Ni 纳米晶粉末在金属高压系 2 统进行贮氢性能研究。称取一定量样品放入反应室中,真空加热除气后,冷却到室温,放入一定量的氢气(氢气纯度大于99 %),观察粉末在室温下的吸氢情况。 储氢碳纳米管 碳纳米管CNTs,Carbon Nanotubes 是一种主要由碳六 边形弯曲处为碳五边形和碳七边形组成的单层或多层 纳米管状材料。管的内径在几个纳米到几十个纳米之间, 长度可达微米量级。仅有一层石墨片层结构的单层管被 称为单壁碳纳米管SWNTs, Single - Walled carbon nan tubes ,有多层石墨片alled carbon nan tubes 。单壁碳纳米管 是碳纳米管的一层结构的多层管被称为多壁碳纳米 管MWNTs,Multi - W种极限状态,管径较小,直径一般为1~ 6nm,最小的直径大约为014nm,其结构中的缺陷不易存 在,具有较高的均匀性和一致性。多壁碳纳米管的直径一 般为几纳米到几十纳米,长度为几十纳米到微米,层数从 2~50不等,层间距约为0134nm。 (文献参考:Mg_2Ni纳米晶储氢材料的机械合金化制备工艺研究) 物理吸附
第16卷 第5期2009年10月 金属功能材料Metallic Functional Materials Vol 116, No 15 October , 2009 镁基储氢合金的最新研究进展 童燕青,欧阳柳章 (华南理工大学材料科学与工程学院,广州 510640) 摘 要:镁基合金是一类重要的储氢材料。本文综述了Mg 2Ni 系合金、稀土2镁2镍、镁2稀土等3类含镁储氢合金的最新研究进展,探讨了合金化机理,即合金化元素、原子半径、相结构对含镁基储氢合金性能的影响规律。关键词:储氢合金;镁基合金;合金化 中图分类号:T G 13917 文献标识码:A 文章编号:1005-8192(2009)05-0038-04 Latest Progress on H ydrogen Storage Alloys Containing Magnesium TON G Yan 2qing ,OU YAN G Liu 2zhang (College of Materials Science and Engineering ,South China University of Technology , Guangzhou 510640,Guangdong ,China ) Abstract :Magnesium based alloy is an important type of hydrogen storage materials.This paper reviews the latest progress of the alloys containing magnesium ,such as Mg 2Ni based alloys ,earth 2magnesium 2nickel alloys and mag 2nesium 2rare earth alloys.The alloying mechanism is discussed ,namely the effect of the alloying elements ,the atom 2ic radius and phase structure on the hydrogen storage properties of magnesium based alloys is reviewed.K ey w ords :hydrogen storage alloys ;magnesium 2based alloy ;alloying 基金项目:863资助项目(2006AA05Z133) 作者简介:童燕青,男,博士研究生。E 2mail :tongyq @https://www.doczj.com/doc/7e13739281.html, 1 引 言 开发和利用氢能作为二次能源及其相关的能源新技术和新材料已被许多国家列为重点研究内容。高性能和高容量储氢材料的研发对氢能的大规模应用和“氢经济”的实现具有非常关键的作用[1~3]。如对于车用储氢系统,国际能源署(IEA )提出的目标是质量储氢密度大于5%、体积储氢密度大于50kg H 2/m 3,并且放氢温度低于423K ,循环寿命超 过1000次;而美国能源部(DO E )提出的目标是到2010年不低于615%和62kg H 2/m 3,车用储氢系 统的实际储氢能力大于311kg (相当于小汽车行驶500km 所需的燃料)[2]。与高压压缩、液氢和物理吸附等储氢技术相比,利用储氢材料进行固态储氢具有体积储氢密度高和安全性好的优势,但仍需要 进一步提高质量储氢密度和动力学性能。 镁作为一种高容量(716wt %)的储氢材料,兼具储量丰富、低成本和环境友好的特性,因此一直受到研究人员的特别关注。为了克服其脱氢温度高(>573K )和动力学缓慢的缺点,研究人员采用了纳米化、添加催化剂、制备纳米复合材料、表面改性和合金化等多种手段[4,5],这些方法对改善镁的动力学性能效果显著,但Mg H 2的脱氢温度一直受到高形成焓(-74kJ /mol ?H 2)的限制。通过调整储氢合金的成分和结构,合金化有可能降低Mg H 2的形成焓和改善其动力学性能。本文介绍一些镁基储氢合金的最新研究进展,重点在于讨论合金元素、合金相结构对储氢性能的影响规律。
储氢合金 机电与信息工程学院机械一班迟荣凯201300800174 摘要:近年来,随着科技的快速发展和社会的进步,人类对能源的消耗与依赖越来越明显,改变能源机构已成为迫在眉睫的问题。显然,氢气这种高效绿色能源必将登上历史舞台,但是氢气的储存和运输都需要解决很多的问题才能够得以实现,本文就金属储氢原理以及金属储氢的应用发展前景做了介绍。 关键词:储氢合金研究制备发展前景 一.储氢材料的发展 20世纪60年代,出现了能储存氢的金属和合金,统称为储氢合金,这些金属或合金具有很强的捕捉氢的能力,它可以在一定的温度和压力条件下,氢分子在合金(或金属)中先分解成单个的原子,而这些氢原子进入合金原子之间的缝隙中,并与合金进行化学反应生成金属氢化物,外在表现为大量“吸收”氢气,同时放出大量热量。而当对这些金属氢化物进行加热时,它们又会发生分解反应,氢原子又能结合成氢分子释放出来,而且伴随有明显的吸热效应。20世纪70年代,LaNi5和Mg2Ni在荷兰Philips与美国Brookhaven实验室相继被发现具有可逆的吸放氢能力并伴随的一系列物理化学机理变化。储氢合金的金属原子之间缝隙不大,但储氢本领却比氢气瓶的本领可大多了。具体来说,单位体积储氢的密度,是相同温度、压力条件下气态氢的1000倍,也即相当于储存了1000个大气压的高压氢气。由于储氢合金都是固体,既不用储存高压氢气所需的大而笨重的钢瓶,又不需存放液态氢那样极低的温度条件,需要储氢时使合金与氢反应生成金属氢化物并放出热量,需要用氢时通过加热或减压使储存于其中的氢释放出来,如同蓄电池的充、放电,因此储氢合金不愧是一种极其简便易行的理想储氢方法。 二.储氢合金的分类 储氢合金按组成元素的主要种类分为: 稀土系、钛系、锆系、镁系四大类; 按主要组成元素的原子比分为:AB5型、AB2型、AB型、A2B型, 另外也可按晶态与非晶态, 粉末与薄膜进行分类。 2. 1 稀土系储氢合金 稀土系储氢合金以LaNi5为代表, 可用通式AB5 表示, 具有CaCu5 型六方结构。早在1969年实验室就发现LaNi5合金具有优良的吸氢特性, 较高的吸氢能力(储氢量高达 1. 37 重量% ) , 较易活化, 对杂质不敏感以及吸脱氢不需高温高压(当释放温度高于40℃时放氢就很迅速) 等优良特性。混合稀土储氢合金材料有富铈的和富镧的, 其优点是资源丰富, 成本较低。在混合稀土材料中通常都加入M n, 这样可以扩大储氢材料晶格的吸氢能力, 提高初始容量, 但M n 也比较容易偏析, 生成锰的氧化物, 从而使合金的性质和晶格发生变化,降低吸放氢能力, 缩短寿命。因此, 为了制约M n 的偏析, 以提高储氢合金的性能和寿命, 在混合稀土材料中往往还要添加Co和A l。 2. 2 钛系储氢合金 目前己发展出多种钛系储氢合金, 如钛铁、钛锰、钛铬、钛锆、钛镍、钛铜等, 它们除钛铁为AB 型外,其余都为AB2 型系列合金。钛系储氢合金中以钛铁、钛锰储氢合金最为实用, 正在受到人们的重视。FeT i合金是AB 型储氢合金的典型代表, 具有CsCl 型结构。FeT i 合
A highly sensitive hydrogen peroxide amperometric sensor based onMnO2-modi?ed vertically aligned multiwalled carbon nanotubes,Analytica Chimica Acta,2010 MnO2-多臂碳纳米管 Cu电极 Gold nanoparticles mediate the assembly of manganese dioxide nanoparticles for H2O2 amperometric sensing,Electrochimica Acta,2010 MnO2–AuNP/ GCE H2O2电流传感 器 A novel nonenzymatic hydrogen peroxide sensor based on MnO2/graphene oxide Nanocomposite,Talanta,2010 GO/MnO2/ GCE(氧化 石墨烯) H2O2电流传感 器 Electrochemical investigation of MnO2 electrode material for supercapacitors,ScienceDirect,2011 MnO2泡沫镍电极MnO2电活性物 质作为超级电容 材料 Facile synthesis of novel MnO2 hierarchical nanostructures and their application to nitrite sensing,Sensors and Actuators B: Chemical,2009 MnO2/QPVP-Os/GCE (联吡啶锇取代的聚乙 烯吡啶) 亚硝酸盐传感器 Preparation of MnO2/graphene composite as electrode material for supercapacitors,J Mater Sci ,2011 MnO2/grapheme(石墨 烯) 超级电容器 Hydrogen peroxide sensor based on glassy carbon electrode modified with β-manganese dioxide nanorods,Microchim Acta (2011) β-MnO nanorods/GCE 。 H2O2电化学传 感器 Mn3O4 Graphene Hybrid as a High-Capacity Anode Material for Lithium Ion Batteries,American Chemical Societ,2010 Mn3O4/RGO(还原石墨 电极) 锂离子电池阳极 材料 Non-enzymatic electrochemical CuO nano?owers sensor for hydrogen peroxide detection,Talanta,2010 CuO/Cu箔H2O2电流传感 器(无酶) Synthesis of CuO nanostructures and their application for nonenzymatic glucose sensing,Sensors and Actuators B: Chemical,2010 CuO以碳为基底做成电 极 葡萄糖传感器 (无酶) A highly sensitive nonenzymatic glucose sensor based on CuO nanoparticles-modi?ed carbon nanotube electrode,Biosensors and Bioelectronics,2010 CuO/MWCNTs/Cu电极葡萄糖传感器 (无酶) An improved sensitivity nonenzymatic glucose biosensor based on a CuxO modi?ed electrode,Biosensors and Bioelectronics,2010 CuxO/Cu箔葡萄糖传感器 (无酶) Synthesis of CuO nanoflower and its application as a H2O2 sensor,Bull. Mater. Sci,2010 CuO NFS/Nafion-Au电 极 H2O2电流传感 器(无酶)
第三章 二元合金的相结构与结晶 (一)填空题 1 合金的定义是两种或两种以上的金属(或金属与非金属)熔合而成具有金属特性的物质。 2.合金中的组元是指 组成合金最基本的、独立的物质 。 3.固溶体的定义是 在固态条件下,一种组元“组分”溶解了其它组元而形成的单相晶态固体 4.Cr 、V 在γ-Fe 中将形成 置换 固溶体。C 、N 则形成 间隙 固溶体。 5.和间隙原子相比,置换原子的固溶强化效果要 差 些。 6.当固溶体合金结晶后出现枝晶偏析时,先结晶出的树枝主轴含有较多的高熔点组元。 7.共晶反应的特征是 由一定成分的恶液相同时结晶出成分一定的两个固相 ,其反应式为 L →a+β 8.匀晶反应的特征是 ,其反应式为 9.共析反应的特征是 ,其反应式为 10.合金固溶体按溶质原子溶入方式可以分为置换固溶体和间隙固溶体,按原子溶入量可以分为 有限固溶体 和 无限固溶体 11.合金的相结构有 固溶体 和 金属化合物 两种,前者具有较高的 塑性变形 性能,适合于做 基体 相;后者有较高的 高硬度 性能,适合于做 增强 相 12.看图4—1,请写出反应式和相区: ABC 包晶反应 B A C L γα?+ ;DEF 共晶反应 F D C L βγ+? ;GHI 共析反应 I G H βαγ+? ; ① L +α ;② γα+ ;③βα+ ;④ βγ+ ;⑤ L +γ ;⑥ β+L ; 13.相的定义是 ,组织的定义是 14.间隙固溶体的晶体结构与溶剂的晶格类型 相同,而间隙相的晶体结构与 溶剂组元晶体结构 不同。 15.根据图4—2填出: 水平线反应式 E C D βαγ+? ;有限固溶体 βα、 、 无限固溶体 γ 。 液相线 ,固相线 , 固溶线 CF 、 EG
Mg基储氢材料的进展 一、课题国内外现状 氢能作为一种资源丰富,能量高,干净无污染的二次能源已经引起了人们的极大兴趣[1],随着“氢经济”(以氢为能源而驱动的政治和经济)时代即将来临,氢能成为新世纪的重要二次能源已为科学界所广泛认同。 氢能的发展涉及到很多方面,如氢能技术、工程、生产、运输、储存、经济及利用等,其中储存问题是制约整个氢能系统应用的关键步骤,在已经探明的储存方法中,金属氢化物储氢具有储氢体积密度大、安全性好的优势,比较容易操作,运行成本较低,因此,金属氢化物技术的开发与研究近年来在世界各国掀起极大的热潮。其中,由于Mg密度小(1.74 g/cm3)、储氢能力高(理论上可达到7.6 wt.%)、价格低、储量丰富而使之成为一种很有前途的储氢合金材料。在众多储氢合金中,Mg基储氢合金因其储氢量大且资源丰富,价格低廉,成为最具潜力的储氢材料[2]。 然而,镁及其合金作为储氢材料也存在吸放氢速度慢、温度高及反应动力学性能差等缺点,因而严重阻碍了其实用化的进程。研究表明,将Mg基合金与具有催化活性的添加剂(过渡金属、过渡金属化合物、AB5型储氢合金等)混合球磨制备Mg基合金复合材料是提高Mg基合金吸/放氢性能的有效途径之一。针对上述Mg基储氢复合材料的研究,科研工作人员围绕以下几个方面展开工作: (1) 镁与单质金属复合 在球磨过程中添加其它单质金属元素,特别是过渡金属元素对镁的吸放氢性能有明显的改善作用。用于镁基材料复合的单质金属元素主要包括Pd、Fe、Ni、V、Ti、Co、Mo等。 Milanese等[3]研究了Al、Cu、Fe、Mn、Mo、Sn、Ti、Zn、Zr对镁吸放氢性能的影响,发现A1、Cu、Zn有助于镁的吸放氢,只有Cu能降低MgH2的稳定性,从而使其放氢温度降至270 ℃。Kwon等[4]球磨Mgl0%Ni5%Fe5%Ti混合材料,复合后其在300 ℃、1.2 MPa H2条件下吸收氢,吸氢时间分别为5 min和1 h,吸氢量分别为5.31%(质量分数,下同)和5.51%。初始吸氢速率从200 ℃升到300 ℃时增长较快,但在350 ℃时开始下降,放氢速率从200 ℃升到350 ℃时速度快速增长。他们认为添加的Ni、Fe和Ti元素能够产生活性点,并降低颗粒粒度,从而减少氢原子的扩散距离,形成新的高活性表面。同时,Ni、Fe、Ti也起到活性基点的作用,并能在球磨过程中创造缺陷,这些缺陷可以起到活性基点的作用,产生裂缝并能降低颗粒粒度。Varin等[5]在镁中添加0.5%~2.0%的纳米镍粉进行球磨储氢,结果表明,球磨70 h后,MgH2的粒径只有11~12 nm,当镍的添加量增加到2%时,储氢速率明显加快,球磨15 h,储氢密度就可达到6.0%以上;与MgH2相比,放
锂离子电池纳米电极材料 摘要:纳米材料因为其具有尺寸小、比表面积大等特点,在锂离子电池电极材料的研究中倍受人民关注。使用纳米电极材料之后锂离子电池容量明显比传统的块体材料提高很多,然而纳米材料的使用也带来了相应的问题。本文主要讨论纳米材料在锂离子电池电极材料上的应用,分析其优缺点和改进方法,并对未来锂离子电池电极材料做出了展望。 关键词:纳米材料,锂离子电池, 1.锂离子电池原理和结构 作电压与重量能量密度优于常用的镍镉电池(Ni/Cd)与Ni/MH电池,又无记忆效应及环保问题(锂离子电池的金属含量最低),因此成为目前商业开发二次电池的主流;还以其薄形化及形状有高度的可塑性等特点,因此符合电子产品轻、薄、短、小的要求,所以备受各国科学家及电池业的重视,发展极快。 锂离子电池被人们称为“绿色环保能源”和“跨世纪的能源革命”。锂离子电池是照相机、电子手表、计算器、各种具有储存功能的电子器件或装置的理想电源。其结构如下图所示: 图1. 锂离子电池的结构
锂离子电池由正负电极、电解质、隔膜和外部控制电路组成。所以研究锂离子电池材料包括:电极材料、电解质材料和隔膜材料。 锂离子电池工作原理如下[1]: 图2. 锂离子电池工作原理 正极反应:LiCoO2→CoO2+Li++e 负极反应:Li++e+C6→LiC6 电池反应:LiCoO2+C6→CoO2+ LiC6 放电时:锂离子由负极中脱嵌,通过电解质和隔膜,重新嵌入到正极中。充电时:锂离子从正极中脱嵌,通过电解质和隔膜,嵌入到负极中。 2.纳米电极材料的优缺点 锂离子电池纳米电极存在一些潜在的优缺点。 优点:(i)更好地释放锂嵌入和脱嵌过程中的应力,提高循环寿命;(ii)可发生在块体材料中不可能出现的反应;(iii)更高的电极/电解液接触面积提高了充/放电速率;(iv)短的电子输运路径(允许在低电导或高功率下使用);(v)短的锂离子传输路径(允许在低锂离子传导介质或高功率下使用)。 缺点:(i)高比表面积带来的不可预期的电极/电解液反应增加,导致自放电现象,差的循环性能及寿命;(ii)劣等的颗粒包装技术使其体积能量密度很低,除非开发出一种特殊的压缩工艺,否则会限制它的应用;(iii)电极合成过程可能会更加复杂。
第三章 二元合金的相结构与结晶 (一)填空题 1 合金的定义是两种或两种以上的金属(或金属与非金属)熔合而成具有金属特性的物质。 2.合金中的组元是指 组成合金最基本的、独立的物质 。 3.固溶体的定义是 在固态条件下,一种组元“组分”溶解了其它组元而形成的单相晶态固体 4.Cr 、V 在γ-Fe 中将形成 置换 固溶体。C 、N 则形成 间隙 固溶体。 5.和间隙原子相比,置换原子的固溶强化效果要 差 些。 6.当固溶体合金结晶后出现枝晶偏析时,先结晶出的树枝主轴含有较多的高熔点组元。 7.共晶反应的特征是 由一定成分的恶液相同时结晶出成分一定的两个固相 ,其反应式为 L →a+β 8.匀晶反应的特征是 ,其反应式为 9.共析反应的特征是 ,其反应式为 10.合金固溶体按溶质原子溶入方式可以分为置换固溶体和间隙固溶体,按原子溶入量可以分为 有限固溶体 和 无限固溶体 11.合金的相结构有 固溶体 和 金属化合物 两种,前者具有较高的 塑性变形 性能,适合于做 基体 相;后者有较高的 高硬度 性能,适合于做 增强 相 12.看图4—1,请写出反应式和相区: ABC 包晶反应 B A C L γα?+ ;DEF 共晶反应 F D C L βγ+? ;GHI 共析反应 I G H βαγ+? ; ① L +α ;② γα+ ;③βα+ ;④ βγ+ ;⑤ L +γ ;⑥ β+L ; 13.相的定义是 ,组织的定义是 14.间隙固溶体的晶体结构与溶剂的晶格类型 相同,而间隙相的晶体结构与 溶剂组元晶体结构 不同。 15.根据图4—2填出: 水平线反应式 E C D βαγ+? ;有限固溶体 βα、 、 无限固溶体 γ 。 液相线 ,固相线 , 固溶线 CF 、 EG
镁基储氢材料的性能改进 材料1103 班 摘要:镁基储氢材料具有其吸氢量大、成本低、产生氢气纯度高的优点,是很有发展前途的固体储氢材料。但是镁基储氢材料又有吸放氢速度慢、温度高、反应动力学差、易被氧化等缺点,使其在实际应用中受到限制。本文从材料的纳米化、添加催化剂、热处理等方面对提高镁基储氢材料吸放氢性能做了简要的介绍。关键词:镁基储氢材料纳米化催化剂热处理 The Performance Improvement of Magnesium Based Hydrogen Storage Materials Abstract:Mg-based hydrogen storage material is promising for the large amount of hydrogen absorption, the advantages of low cost and highly purified hydrogen . However, the applications of magnesium-based hydrogen storage materials are limited by virtue of its slow absorption, high temperature,poor reaction kinetics, and susceptible to oxidation.In this paper, some brief introductions are made on the performance improvements, such as nano materials, adding catalyst and heat treatment. Key words: Mg-based hydrogen storage; catalyst; nanorized; heat treatment 1、引言 随着工业化进程的发展,能源和环境问题已经成为21世纪面对的重大问题。氢能作为一种新能源,因其资源丰富、无污染等优点而备受关注。近年来使用比较频繁的金属氢化物储氢材料有锆系、镁系、稀土系、钙系、钛系等,其中镁系储氢材料的储氢含量较大,因为金属镁来源广泛且轻便易于运输、储存,价格便宜,但其具有储放氢速度慢工作温度较高不易操作,储放氢的动力学特性较差等问题,改进储氢性能迫在眉睫。本文将从材料的纳米化、添加催化剂、热处理等方面对提高镁基储氢材料吸放氢性能做简要的介绍。 2、材料的纳米化储氢 纳米材料由于具有表面效应、小尺寸效应、量子尺寸效应以及特殊的热、光学性质, 从而产生了一系列新奇的、许多大颗粒所不具有的物理、化学性质。纳米化后的储氢材料具有许多新的热力学、动力学特征, 如活化性能明显提高,具有更高的氢扩散系统和优良的吸放氢动力学性能]1[。
储氢合金 无机1002班汪沅201039110213 化石能源的有限性与人类需求的无限性-石油、煤炭等主要能源将在未来数十年至数百年内枯竭.化石能源的使用正在给地球造成巨大的生态灾难-温室效应、酸雨等严重威胁地球动植物的生存.氢是一种非常重要的二次能源。它的资源丰富;发热值高,燃烧1kg氢可产生142120kJ的热量,比任何一种化学燃料的发热值都高;氢燃烧后生成水,不污染环境。因此,氢能是未来能源最佳选择之一。氢的利用主要包括氢的生产、储存和运输、应用三个方面。而氢的储存是其中的关键。氢气储存技术的滞后,限制了氢的大规模应用,特别是交通工具上的应用。 储氢合金是一种新型合金,一定条件下能吸收氢气,一定条件能放出氢气。虽然可将氢气存贮于钢瓶中,但这种方法有一定危险,而且贮氢量小(15MPa,氢气重量尚不到钢瓶重量的1/100),使用也不方便。液态氢比气态氢的密度高许多倍,固然少占容器空间,但是氢气的液化温度是-253℃,为了使氢保持液态,还必须有极好的绝热保护,绝热层的体积和重量往往与贮箱相当。储氢合金能以金属氢化物的形式吸收氢,是一种安全、经济而有效的储氢方法。 1 金属储氢原理 许多金属(或合金)可固溶氢气形成含氢的固溶体(MHx),固溶体的溶解度[H]M与其平衡氢压pH2的平方根成正比。在一定温度和压力条件下,固溶相(MHx)与氢反应生成金属氢化物。 金属与氢的反应,是一个可逆过程。正向反应,吸氢、放热;逆
向反应,释氢、吸热;改变温度与压力条件可使反应按正向、逆向反复进行,实现材料的吸释氢功能。换言之,是金属吸氢生成金属氢化物还是金属氢化物分解释放氢,受温度、压力与合金成分的控制。 2 储氢合金分类 并不是所有与氢作用能生成金属氢化物的金属(或合金)都可以作为储氢材料。实用的储氢材料应具备如下条件:(1)吸氢能力大,即单位质量或单位体积储氢量大。(2)金属氢化物的生成热要适当,如果生成热太高,生成的金属氢化物过于稳定,释氢时就需要较高温度;反之,如果用作热贮藏,则希望生成热高。(3)平衡氢压适当。最好在室温附近只有几个大气压,便于储氢和释放氢气。且其p-C-T 曲线有良好的平坦区,平坦区域要宽,倾斜程度小,这样,在这个区域内稍稍改变压力,就能吸收或释放较多的氢气。(4)吸氢、释氢速度快。(5)传热性能好。(6)对氧、水和二氧化碳等杂质敏感性小,反复吸氢、释氢时,材料性能不致恶化。(7)在储存与运输中性能可靠、安全、无害。(8)化学性质稳定,经久耐用。(9)价格便宜。 能够基本上满足上述要求的主要合金成分有:Mg,Ti,Nb,V,Zr和稀土类金属、添加成分有Cr,Fe,Mn,Co,Ni,Cu等。目前研究和已投入使用的储氢合金主要有稀土系、钛系、镁系几类。另外,可用于核反应堆中的金属氢化物及非晶态储氢合金,复合储氢材料已引起人们极大兴趣。 镁与镁基合金储氢量大(MgH2约7.6w%)、重量轻、资源丰富、价格低廉。主要缺点是分解温度过高(250℃),吸放氢速度慢,使镁
元素取代法改善镁基储氢合金性能的研究进展 袁华堂冯艳宋赫男王一菁 (南开大学新能源材料化学研究所南开-天津大学联合研究院天津 300071) 摘要镁基储氢合金的优点是储氢能力高储量丰富 所以需要对其进行性能的改善 关键词镁基合金储氢元素取代 The Development of Improving on the Characteristics of Magnesium Hydrogen Storage Alloys by Means of Elements Substitution Yuan Huatang, Feng Yan, Song Henan, Wang Yijing (Institute of New Energy Material Chemistry, Nankai University, Unite Institute of Nankai-Tianjin University,Tianjin 300071) Abstract The advantage of magnesium-based hydrogen storage alloys is that they have high hydrogen storage density, low cost and abundant resources. But since these are some drawbacks for use in the aspects of dynamics, thermodynamics and anti-corrupt, it is necessary to improve their propesties. In this paper, the developments of improving on the propesties of Magnesium-based hydrogen storage alloys by means of elements substitution have been reviewed briefly. Key words Magnesium-based hydrogen storage alloys, Hydrogen storage, Elements substitution 在环境问题日益突出的今天氢能是最好的选择[1] óéóúMg密度小(1.74g/cm3) 价格低其典型代表为Mg 2Ni 理论容量为999mAhg-1?a?üμè??????ì1ê?ò??ˉ×°??é? àí??μ?′¢?ao??e ???ùo??eμ??÷òaè±μ?ê?吸放氢速度较慢 (2)镁及其合金的性质活泼在水溶液中易被氧化成Mg(OH) 2?aD?è±μ???3é?a??êμó??ˉμ???°- ?ùò????ˉ′|àíê±Dèòaoü3¤μ?ó?μ??ú 1 镁基合金的合成方法 袁华堂男教授 国家重点研究开发规划项目(G2000026405)国家863计划(2001AA5150) 2003-01-24修回
稀土-镁-镍系储氢电极材料的研究进展 Ξ 闫慧忠,孔繁清,韩 莉,熊 玮,孙晓华 (包头稀土研究院,内蒙古 包头 014010) 摘 要:介绍了国内外对各种多元及多相稀土-镁-镍系储氢电极材料的研究进展,主要包括材料的组成、制备方法、组织结构以及吸放氢动力学行为和电化学性能方面的研究。 关键词:稀土-镁-镍系;贮氢合金;复合贮氢材料;储氢电极材料 中图分类号:O 614133;T G 139+17 文献标识码:A 文章编号:100420277(2005)0120060207 贮氢合金是20世纪60年代末发现的一类具有高储氢密度的功能材料,从组成上大致可分为四类:稀土系如L aN i 5;镁系如M g 2N i 、M gN i 、L a 2M g 17;钛系如T i N i 、T iFe ;锆系如ZrN i 2。L aN i 5型贮氢合金已实现了产业化,主要用于制作M H N i 电池的负极材料,其理论容量为370mA ?h ?g -1,实际开发的最大容量为320mA ? h ?g -1。由于容量限制,M H N i 电池的应用范围及市场竞争力受到挑战。镁及某些镁基贮氢合金如M g 2N i 、M gN i 、L a 2M g 17等, 由于其储氢量大、重量轻、资源丰富、价格便宜,在开发新型高容量储氢电极材料的过程中引起了广泛的关注,成为该领域的研究热点[1],纯镁及几种镁基贮氢合金与L aN i 5的理论电化学容量如图1所示。 图1 几种贮氢合金理论电化学容量的比较 F ig 11 Co m par ison of idea l electroche m istry capac ities of hydrogen storage a lloys 镁基贮氢合金作为电极材料应用时存在的主要问题是动力学性能较差以及充放电循环中容量衰减快。通过添加改性元素(多元合金体系)、改进制备工艺、表面处理、热处理、机械球磨改性等措施,可在一定程度上解决这些问题。此外,大量的研究表明,通过适当的制备工艺与动力学性能良好的贮氢合金如L aN i 5复合,可明显改善镁基储氢材料的动力学性能,由此获得一类新型稀土-镁-镍系高容量复合储氢电极材料。 1 稀土-镁-镍系多元合金体系 111 三元体系 对三元系合金L a 2M gN i 9,L a 5M g 2N i 23,L a 3M gN i 14储氢特性的研究结果表明,L a 5M g 2N i 23合金负极的放电容量高达410mA ?h ?g -1,比AB 5型合金大113倍。这些三元系合金主要是由超点阵结构中叠层的AB 5和AB 2结构亚单位构成[2]。 速凝M g 2N i 2R E (R E =Y 或富Ce ,富L a 的混合稀土金属M m )合金淬火后呈非晶态或纳米晶 非晶态,即平均尺寸3nm 的纳米晶置于大量非晶相中,M g 76N i 19Y 5和M g 78N i 18Y 4合金与M g 75N i 20M m 5比较,M m 比Y 对储氢容量产生更有利的影响,这些合金的结晶化经过亚稳态的面心立方M g 6N i 相转变成纳米晶材料[3]。T anaka 等[4]测定了速凝法制备的非晶态和纳米晶结构的晶态M g 2N i 2R E (R E = 第26卷第1期2005年2月 稀 土Ch inese R are Earth s V o l .26,N o.1 Feb ruary 2005 Ξ收稿日期:2004204208 基金项目:国家自然科学基金资助项目(20363001);内蒙古自然科学基金资助项目(200308020215) 作者简介:闫慧忠(19622),男,内蒙古乌拉特前旗人,在读博士,高级工程师,研究方向为储氢材料的制备和研究。
镁系储氢合金综述 08材控薛凯琳 摘要:镁与镁基合金具有储氢量大,质量小,资源丰富,价格低廉等优点,受到人们的广泛关注。本文介绍了镁系储氢合金的工艺、性能、应用及发展。 关键词:储氢材料,镁基合金,储氢性能,材料复合,镁基化合物 前言氢能是最清洁且储量丰富的能源,储氢材料的发展及应用对环境保护和能源开发有着重要的意义。镁基储氢合金是最有潜力的金属氢化物储氢材料,近年来已引起世界各国的广泛关注。镁及其合金作为储氢材料,具有以下几个特点:(1)储氢容量很高,MgH2的含氢量达到7.6(wt)% ,而Mg2NiH4的含氢量也达到3.6(wt)%;(2)镁是地壳中含量为第六位的金属元素,价格低廉,资源丰富;(3)吸放氢平台好;(4)无污这些缺点严重阻碍了镁染。但镁及其合金作为储氢材料也存在三个缺点:(1)吸放氢速度较慢,反应动力学性能差;(2)氢化物较稳定,释氢需要较高的温度;(3)镁及其合金的表面容易形成一层致密的氧化膜。以上基储氢合金的实用化进程。近年来,镁基复合储氢材料的研究取得了明显突破,本文简要介绍镁基复合储氢材料吸放氢性能的改善。 1 镁基储氢材料体系 最早开始研究镁基储氢材料的是美国布鲁克-海文国家实验室, Reilly和Wiswall在1968年首先以镁和镍混合熔炼而成Mg2Ni合金。后来随着机械合金化制备方法的出现,揭开了大规模研究镁基储氢材料的序幕。据不完全统计,到目前为止人们研究了近1 000多种重要的镁基储氢材料,几乎包括了元素周期表中所有稳定金属元素和一些放射性元素与镁组成的储氢材料。通过研究,发现这些镁基储氢材料可以分为单质镁储氢材料、镁基储氢合金和镁基储氢复合材料三大类。 1.1 单质镁储氢材料 镁可直接与氢反应,在300~400℃和较高的氢压下,反应生成MgH2: Mg+H2=MgH2 , △H=-74.6 kJ/mol 。 MgH2理论氢含量可达7.6%,具有金红石结构,性能较稳定,在287℃时的分解压为101. 3 kPa。因为纯镁的吸放氢反应动力学性能差,吸放氢温度高,所以纯镁很少被用来储存氢气。随着材料合成手段的不断发展,特别是机械合金化制备工艺的日益成熟,研究人员对单质镁储氢材料进行了新的研究。 1.2 镁基储氢合金 到目前为止,人们已对300多种重要的镁基储氢合金材料进行了研究。其中最具有代表性的是Mg-Ni系储氢合金,许多研究者围绕这一系列合金开展了大量的研究工作。在制备方法上,主要研究了熔炼法、粉末烧结法、扩散法、机械合金化法和氢化燃烧合成法等,并且对镁基储氢合金采用表面处理和热处理来进一步提高其动力学性能和循环寿命。 1.2.1 Mg-Ni系储氢合金 在Mg与Ni形成的合金体系中存在2种金属间化合物Mg2Ni和MgNi2,其中MgNi2不与氢气发生反应。Mg2Ni在一定条件下(1.4MPa、约200℃)与氢反应生成Mg2NiH4,反应方程式如下: Mg2Ni+2H2=Mg2NiH4,△H=-64.5 kJ/mol 。 反应生成的氢化物中氢含量为3.6%,其离解压为0.1MPa、离解温度为253℃。Mg2Ni理论电化学容量为999 mA·h·g- 1,但其形成的氢化物在室温下较稳定而不易脱氢。且与强碱性电解液(6 mol·L-1的KOH)接触后,合金表面易形成Mg(OH)2,阻止了电解液与合金表面的氢交换、氢转移和氢向合金体内扩散,致使Mg2Ni的实际电化学容量、循环寿命差。 1.2.2 镁与其它元素组成的镁基储氢合金 除了Mg-Ni系储氢合金以外,研究者们研究得比较多的还有Mg-Al系以及Mg-La系储氢合
Air-stable magnesium nanocomposites provide rapid and high-capacity hydrogen storage without using heavy-metal catalysts Ki-Joon Jeon 1?,Hoi Ri Moon 2??,Anne M.Ruminski 2,Bin Jiang 3,Christian Kisielowski 4,Rizia Bardhan 2and Jeffrey J.Urban 2* Hydrogen is a promising alternative energy carrier that can potentially facilitate the transition from fossil fuels to sources of clean energy because of its prominent advantages such as high energy density (142MJ kg ?1;ref.1),great variety of potential sources (for example water,biomass,organic matter),light weight,and low environmental impact (water is the sole combustion product).However,there remains a challenge to produce a material capable of simultaneously op-timizing two con?icting criteria—absorbing hydrogen strongly enough to form a stable thermodynamic state,but weakly enough to release it on-demand with a small temperature rise.Many materials under development,including metal–organic frameworks 2,nanoporous polymers 3,and other carbon-based materials 4,physisorb only a small amount of hydrogen (typ-ically 1–2wt%)at room temperature.Metal hydrides were traditionally thought to be unsuitable materials because of their high bond formation enthalpies (for example MgH 2has a H f ~75kJ mol ?1),thus requiring unacceptably high release temperatures 5resulting in low energy ef?ciency.However,recent theoretical calculations 6,7and metal-catalysed thin-?lm studies 8have shown that microstructuring of these materials can enhance the kinetics by decreasing diffusion path lengths for hydrogen and decreasing the required thickness of the poorly permeable hydride layer that forms during absorption.Here,we report the synthesis of an air-stable composite ma-terial that consists of metallic Mg nanocrystals (NCs)in a gas-barrier polymer matrix that enables both the storage of a high density of hydrogen (up to 6wt%of Mg,4wt%for the composite)and rapid kinetics (loading in <30min at 200?C).Moreover,nanostructuring of the Mg provides rapid storage kinetics without using expensive heavy-metal catalysts. There have been various efforts to synthesize nanosized magnesium,such as ball-milling 9,sonoelectrochemistry 10,gas-phase condensation 11and infiltration of nanoporous carbon with molten magnesium 12.However,these approaches remain limited by inhomogeneous size distributions and high reactivity toward oxygen.Our synthesis for air-stable alkaline earth metal NC/polymer composites consists of a one-pot reduction reaction of an organometallic Mg 2+precursor in the presence of a soluble organic polymer chosen for its hydrogen gas selectivity (Fig.1).The Mg NCs/PMMA nanocomposites were synthesized at room 1Environmental Energy T echnologies Division,Lawrence Berkeley National Laboratory,Berkeley,California 94720,USA,2The Molecular Foundry,Material Science Division,Lawrence Berkeley National Laboratory,Berkeley,California 94720,USA,3FEI Company,NE Dawson Creek Dr.,Hillsboro,Oregon,97124,USA,4National Center for Electron Microscopy and Helios SERC,Lawrence Berkeley National Laboratory,Berkeley,California 94720,USA.?These authors contributed equally to this work.?Present address:Interdisciplinary School of Green Energy,Ulsan National Institute of Science and T echnology (UNIST),Ulsan 689-798,Korea.*e-mail:jjurban@https://www.doczj.com/doc/7e13739281.html,. Mg 2+ + Li Lithium naphthalide Bis(cyclopentadienyl)- magnesium Mg/PMMA nanocomposites b a H 2 Mg nanoparticle Organic polymer with selective gas permeability PMMA THF H 2 H 2O O 2 Formation of MgH 2 Figure 1|Mg NCs in a gas-barrier polymer matrix.a ,Schematic of hydrogen storage composite material:high-capacity Mg NCs are encapsulated by a selectively gas-permeable polymer.b ,Synthetic approach to formation of Mg NCs/PMMA nanocomposites. temperature from a homogeneous tetrahydrofuran (THF)solution containing the following dissolved components:the organometallic precursor bis(cyclopentadienyl)magnesium (Cp 2Mg),the reduc-ing agent lithium naphthalide,and the gas-selective polymer poly(methyl methacrylate)(PMMA).Mg nanocrystals are then nucleated and grown in this solution by means of a burst-nucleation and growth mechanism 13in which lithium naphthalide reduces the organometallic precursor in the presence of a capping ligand (the soluble PMMA (M w =120,000)acts as a capping ligand for the Mg nanocrystals)14.Transmission electron microscopy (TEM)analysis of our reaction mixture before addition of reductant,immediately thereafter,and at later stages of the growth (Supplementary Fig.S1)further support this model.