
实验动物给药途径和方法
在动物实验中,为了观察药物对机能功能、代谢及形态引起的变化,常需将药物注入动物体内。给药的途径和方法是多种多样的,可根据实验目的、实验动物种类和药物剂型等情况确定。
(一)皮下注射
注射时以左手拇指和食指提起皮肤,将连有5(1/2)号针头的注射器刺入皮下。皮下注射部位一般狗、猫多在大腿外侧,豚鼠在后大腿的内侧或小腹部;大白鼠可在侧下腹部。兔在背部或耳根部注射。蛙可在脊背部淋巴腔注射。
(二)皮内注射
皮内注射时需将注射的局部脱去被毛,消毒后,用左手拇指和食指按住皮肤并使之绷紧,在两指之间,用结核菌素注射器连4(1/2)细针头,紧贴皮肤表层刺入皮内,然后再向上挑起并再稍刺入,即可注射药液,此时可见皮肤表面鼓起一白色小皮丘。
(三)肌肉注射
肌肉注射应选肌肉发达,无大血管通过的部位,一般多选臀部。注射时垂直迅速刺入肌肉,回抽针栓如无回血,即可进行注射。给小白鼠、大白鼠等小动物作肌肉注射时,用左手抓住鼠两耳和头部皮肤,右手取连有5(1/2)针头的注射器,将针头刺入大腿外侧肌肉,将药液注入。
(四)腹腔注射
用大、小白鼠做实验时,以左手抓住动物,使腹部向上,右手将注射针头于左(或右)下腹部刺入皮下,使针头向前推 0.5~1.0cm,再以45度角穿过腹肌,固定针头,缓缓注入药液(图1),为避免伤及内脏,可使动物处于头低位,使内脏移向上腹。若实验动物为家兔,进针部位为下腹部的腹白线离开1cm处。
图1小鼠腹腔注射方法
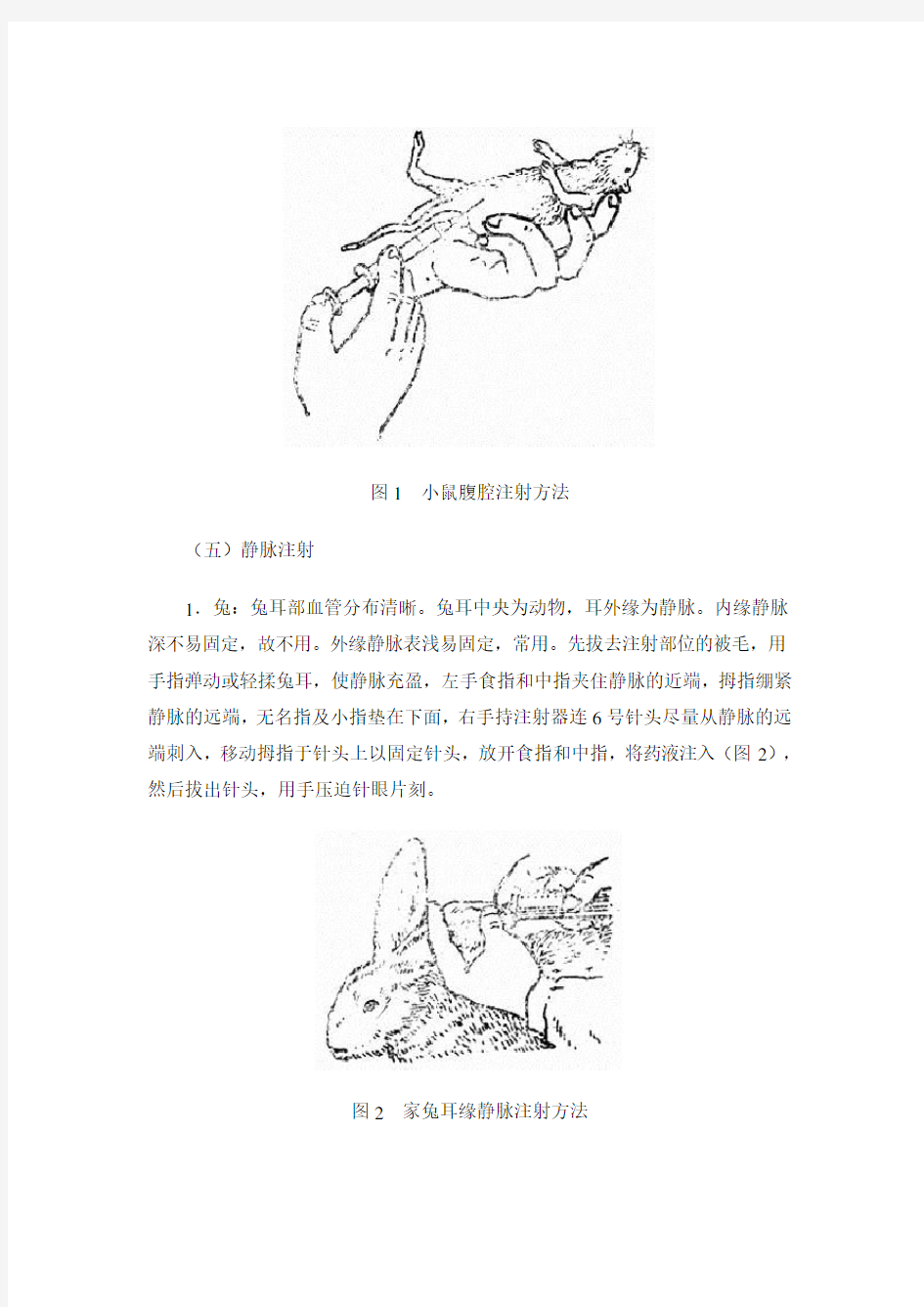
(五)静脉注射
1.兔:兔耳部血管分布清晰。兔耳中央为动物,耳外缘为静脉。内缘静脉深不易固定,故不用。外缘静脉表浅易固定,常用。先拔去注射部位的被毛,用手指弹动或轻揉兔耳,使静脉充盈,左手食指和中指夹住静脉的近端,拇指绷紧静脉的远端,无名指及小指垫在下面,右手持注射器连6号针头尽量从静脉的远端刺入,移动拇指于针头上以固定针头,放开食指和中指,将药液注入(图2),然后拔出针头,用手压迫针眼片刻。
图2家兔耳缘静脉注射方法
2.小白鼠和大白鼠:一般采用尾静脉注射,鼠尾静脉有三根,左右两侧及背侧各一根,左右两侧尾静脉比较容易固定,多采用,背侧一根也可采用,但位置容易固定。操作时先将动物固定在鼠筒内或扣在烧杯中,使尾巴露出,尾部用45~50℃的温水浸润半分钟或用酒精擦拭使血管扩张,并可使表皮角质软化,以左手拇指和食指捏住鼠尾两侧,使静脉充盈,用中指从下面托起尾巴,以无名指和小指夹住尾巴的末梢,右手持注射器连4(1/2)号细针头,使针头与静脉平行(小于30℃),从尾下四分之一处(约距尾尖2-3厘米)处进针,此处皮薄易于刺入,先缓注少量药液,如无阻力,表示针头已进入静脉,可继续注入。注射完毕后把尾部向注射侧弯曲以止血。如需反复注射,应尽可能从末端开始,以后向尾根部方向移动注射(图3)。
图3小鼠尾静脉注射方法
3.狗:狗静脉注射多选前肢内侧皮下头静脉(图4)或后肢小隐静脉(图5)注射。注射前由助手将动物侧卧,剪去注射部位的被毛,用胶皮带扎紧(或用手抓紧)静脉近端,使血管充盈,从静脉的远端将注射针头平行刺入血管,待有回血后,松开绑带(或两手),缓缓注入药液。
图4狗前肢头静脉注射
图5狗后肢小隐静脉注射
4.蛙(或蟾蜍):将蛙或蟾蜍脑脊髓破坏后,仰卧固定于蛙板上,沿腹中线稍左剪开腹肌,可见到腹静脉贴着腹壁肌肉下行,将注射针头沿血管平行方向刺入即可(图6)。
图6 蛙腹壁静静注射
几种常用的动物不同给药途径的注射量可参考表1。
表1几种动物不同给药途径的常用注射量(毫升)
注射途径小鼠大鼠豚鼠兔狗
腹腔0.2-1.0 1-3 2-5 5-10 5-15
肌肉0.1-0.2 0.2-0.5 0.2-0.5 0.5-1.0 2-5
静脉0.2-0.5 1-2 1-5 3-10 5-15
皮下0.1-0.5 0.5-1.0 0.5-2 1.0-3.0 3-10 (六)淋巴囊注射
蛙类常采用此法,因其皮下有数个淋巴囊,注入药物甚易吸收。腹部淋巴囊和头背淋巴囊常作为蛙类给药途径。一般多选用腹部淋巴囊给药。注射时将针头
从蛙大腿上端刺入,经大腿肌层入腹壁肌层,再进入腹壁皮下,即进入淋巴囊,然后注入药液。有时也可采用胸淋巴囊给药。方法是将针头刺入口腔,使穿过下颌肌层入胸淋巴囊内注入药液,一次最大注射量为1毫升。蛙全身分布为咽、胸、背、腹侧、腹、大腿和脚等七个淋巴囊(图7)。
图7蛙全身淋巴囊分布
(七)经口给药
在急性试验中,经口给药多用灌胃法,此法剂量准确,适用于小白鼠、大白鼠、家兔等动物。
1.小鼠、大鼠(或豚鼠)用输血针头或小号腰穿针头,将其尖端斜面磨剂,用焊锡在针尖周围焊一圆头,注意勿堵塞针孔,即成灌胃针;亦可用烧成圆头的硬质玻璃毛细管或特制的塑料毛细秋,作为导管。灌胃时将针按在注射器上,吸入药液。左手抓住鼠背部及颈部皮肤将动物固定,右手持注射器,将灌胃针插入动物口中,沿咽后壁徐徐插入食道。动物应固定成垂直体位,针插入时应无阻力。若感到阻力或动物挣扎时,应立即停止进针或将针拔出,以兔损伤或穿破食道以及误入气管。
一般当灌胃针插入小鼠3-4cm,大鼠或豚鼠4-6cm后可将药物注入。常用的灌胃量小鼠为0.2-1ml,大鼠1-4ml,豚鼠为1-5ml。
2.狗、兔、猫、猴灌胃时,先将动物固定,再将特制的扩口器放入动物口中,扩口器之宽度可视动物口腔大小而定,如狗的扩口器可用木料制成长方形,长约10-15cm,粗细应适合狗嘴,约2-3cm,中间粘一小孔,孔的直途为5-10cm。灌胃时将扩口器放于上述动物上下门牙之后,并用绳将它固定于嘴部,将带有弹性的橡皮导管(如导尿管),经扩口器上的小圆孔插入,沿咽后壁而进入食道,此时应检查导管是否正确插入食道,可将导管外口置于一盛水的烧杯中,如不发生气泡,即认为此导管是在食道中,未误入气管,即可将药液灌入。
图8狗灌胃方法
经我们大量实验,给狗、兔等动物灌胃时,可不用扩口器也能顺利将药液灌入胃内,狗灌胃时,用12号灌胃管,左手抓住狗嘴,右手中指由右嘴角插入,摸到最后一对臼齿后的天然空隙,胃管由此空隙顺食管方向不断插入约20cm,可达胃内,将胃管另一端插入水中,如不出气泡,表示确已进入胃,而没误入气管内,即可灌入。兔灌胃时,将兔固定在木制固定盒内左手虎口卡住并固定好兔嘴,右手取14号细导尿管,由右侧唇裂避开门齿,将导管慢慢插入,如插管顺利,动物不挣扎,插入约15cm时,即表示插入胃内,将药液注入。
各种动物一次灌胃能耐受的最大容积小鼠为0.5-1.0ml,大鼠4-7ml,豚鼠为4-7ml,家兔为80-150ml,狗为200-500ml。
(八)其它途径给药
1.呼吸道给药呈粉尘、气体及蒸气或雾等症状存在药物或毒气,均需要通过动物呼吸道给药。如一般实验时给动物乙醚作吸入麻醉,给动物吸一定量的氨气、二氧化碳等观察呼吸、循环等变化;给动物定期吸入一定量的SO2。锯末烟雾等可造成慢性气管炎动物模型等;特别在毒物学实验中应用更为广泛。
2.皮肤给药为了鉴定药物或毒物经皮肤的吸收作用、局部作用、致敏作用和光感作用等,均需采用经皮肤给药方法。如家兔和豚鼠常采用背部一定面积的皮肤脱毛后,将一定药液涂在皮肤上,药液经皮肤吸收。
3.脊髓腔内给药此法主要用于椎管麻醉或抽取脑脊液。
家兔椎管内注射方法:将家兔作自然俯卧式,尽量使其尾向腹侧屈曲,用粗剪将第七腰椎周围背毛剪去,用3%碘酊消毒,干后再用79%酒精将碘酒擦去。在兔背部髌骨脊连线之中点稍下方摸动第七腰椎间隙(第七腰椎与第一骶骨椎之间),插入腰椎穿刺针头。当针到达椎管内时(珠网膜下腔),可见到兔的后肢跳动,即证明穿刺针头已进入椎管。这时不要再向下刺,以兔损伤脊髓。固定好针头,即可将药物注入。
4.小脑延髓池给药此种给药都是在动物麻醉情况下进行的。而且常采用大动物如狗等,小动物很少采用。将狗麻醉后,使狗头尽量向胸部屈曲,用左手摸到其第一颈椎上方的凹陷(枕骨大孔),固定位置,右手取7号钝针头(将针头尖端麻钝),由此凹陷的正中线上,顺平行狗的方向,小心地刺入小脑延髓池。当针头正确刺入小脑延髓池时,注射者会感到针头再向前穿时无阻力,同时可以听到很轻的“咔嚓”一声,即表示针头已穿过硬脑膜进入小脑延髓池,而且可抽出清亮的脑脊液,注射药物前,先抽出一些脑脊液,抽取量根据实验需要注入多少药液决定,即注入多少抽取多少,以保持原来脑脊髓腔里的压力(图9)。
图9狗小脑延髓池给药
5.脑内给药此法常用于微生物学动物实验,将病原体等接种于被检动物脑内,然后观察接种后的各种变化。小鼠脑内给药时,选套有塑料管、针尖露出2mm深的5(1/2)针头,由鼠正中额部刺入脑内,注入药物或接种物。给豚鼠、兔、狗等进行脑内注射时,须先用穿颅钢针穿透颅骨,再用注射器针头刺入脑部,再徐徐注入被检物。注射速度一定要慢,避免引起颅内压急骤升高。
6.直肠内给药此种给药方法常用于动物麻醉。家兔直肠内给药时,取灌肠用的胶皮管或用14号导尿管代替。在胶皮管或导尿管头上涂上凡士林,由助手使兔蹲卧于桌上,以左臂及左腋轻轻按住兔头及前肢,以左手拉住兔尾,露出肛门,并用右手轻握后肢,实验者将橡皮管插入家兔肛门内,浓度约7~9cm,如为雌性动物,注意勿误插入阴道(肛门紧接尾根)。橡皮管插好后,将注射器与橡皮管套紧,即可灌注药液。
7.关节腔内给药此种方法常用于关节炎的动物模型复制。兔给药时,将兔仰卧固定于兔固定台上,剪去关节部被毛,用碘酒或酒精消毒,然后用手从下方和两旁将关节固定,把皮肤稍移向一侧,在膑韧带附着点处上方约0.5厘米处进针。针头从上前方向下后方倾斜刺进,直至针头遇阻力变小,然后针头稍后退,以垂直方向推到关节腔中。针头进入关节腔时,通常可有好象刺破薄膜的感觉,表示针头已进入膝关节腔内,即可注入药液。动物最大给药量可参考表2。
表2常用实验动物的最大给药量和使用针头规格
动物名称项目灌胃皮下注
射肌肉注
射
腹腔注射静脉注
射
小白鼠最大给药量
使用针头1ml
9(钝头)
0.4ml
5(1/2)
0.4ml
5(1/2)
1ml
5(1/2)
0.8ml
4
大白鼠最大给药量
使用针头2ml
静脉切
开针
1ml
6
0.4ml
6
2ml
6
4ml
5
豚鼠最大给药量
使用针头3ml
静脉切
开针
1ml
6(1/2)
0.5ml
6(1/2)
4ml
7
5ml
5
兔最大给药量
使用针头20ml
10号
导尿管
2ml
6(1/2)
2ml
6(1/2)
5ml
7
10ml
6
猫最大给药量使用
针头
20ml
10号
导尿管20ml
7
2ml
7
5ml
7
10ml
6
蛙淋巴囊注射最大注射量1ml/只
摘自《医用实验动物学》
实验动物的给药途径和方法及药量计算方法
一.经口给药法
(一)灌胃法
此法给药剂量准确,是借灌胃器将药物直接灌到动物胃内的·种常用给药法。
1.鼠类:鼠类的灌胃器由特殊的灌胃针构成。左手固定鼠,右手持灌胃器,将灌胃针从鼠的右U角中,插入口中,沿咽后壁慢慢插入食道,使其前端到达膈肌位置,灌胃針插入时应无阻力,如有阻力或动物挣扎则应退针或将针拔出,以免损伤、穿破食道或误入气管。
2.兔、犬等:灌胃一般要借助于开口器、灌胃管进行。先将动物固定,再将开口器固定于上下门齿之间。然后将灌胃管(常用导尿管代替)从开口器的小孔插入动物口中,沿咽后壁而进入食道。插入后应检查灌胃管是否确实插入食道。可将灌胃管外开口放入盛水的烧杯中,若无气泡产生,表明灌胃管被正确插入胃中,未误入气管。此时将注射器与灌胃管相连,注入药液。
(二)口服法
口服给药是把药物混入饲料或溶干饮水中让动物自由摄取。此法优点是简单方便,缺点是剂量不能保证准确,且动物个体间服药量差异较大。大动物在给予片剂、丸剂、胶囊剂时,可将药物用镊子或手指送到舌根部,迅速关闭口腔,将头部稍稍抬高,使其自然吞咽。
二、注射给药法
(一)皮下注射
皮卜注射一般选取皮下组织疏松的部位,大鼠、小鼠和豚鼠可在颈后肩胛问、腹部两侧作皮下注射;家兔可在背部或耳根部作皮卜注射;猫、犬则在大腿外侧作皮下注射。皮下注射用左手拇指和食指轻轻提起动物皮肤,右手持注射器,使针
头水平刺入皮下。推送药液时注射部位隆起。拨针时,以手指捏住针刺部位,可防止药液外漏。
(二)肌肉注射
肌肉注射一般选肌肉发达,无大血管通过的部位。大鼠、小鼠、豚鼠可注射大腿外侧肌肉;家兔可在腰椎旁的肌肉、臀部或股部肌肉注射;犬等大型动物选臀部注射。注射时针头宜斜刺迅速人肌肉,回抽针栓如无回血,即可注射。
(三)腹腔注射
给大鼠、小鼠进行腹腔注射时,以左手固定动物,使腹部向上,为避免伤及内脏,应尽量使动物头处于低位,使内脏移向上腹,右手持注射器从下腹两侧向头方刺入皮下,针头稍向前,再将注射器沿45角斜向穿过腹肌进入腹腔,此时有落空感,回抽无回血或尿液,即可注入药液。免、犬等动物腹腔注射时,可由助手固定动物,使其腹部朝上,实验者即可进行操作。注射位置为:家兔下腹部近腹白线左右两侧1cm处,犬脐后腹白线两侧边1—2cm处进行腹腔注射。
(四)静脉注射
1、大鼠和小鼠:常采用尾静脉注射。注射时,先将动物固定在暴露尾部的固定器内,尾部用45—50℃的温水浸润几分钟或用75%酒精棉球反复擦拭使血管扩张,并使表皮角质软化。以左手拇指和食指捏住鼠尾两侧,用中指从下面托起鼠,右手持注射器,使针头尽量采取与尾部平行的角度进针,从尾末端处刺入,注入药液,如无阻力,表示针头已进入静脉,注射后把尾部向注射侧弯曲,或拔针后随即以干棉球按住注射部位以止血。
2、豚鼠:可采用前肢皮下头静脉、后肢小隐静脉注射或耳缘静脉注射。
3、家兔:一般采用耳缘静脉注射。注射时先将家兔用固定盒固定,拔去注射部位的毛,用酒精棉球涂擦耳缘静脉,并用手指弹动或轻轻揉擦兔耳,使静脉充血,然后用左手食指和中指压住耳根端,拇指和小指夹住耳边缘部,以无名指放在耳
下作垫,右手持注射器从静脉末端刺入血管,注入药液。注射后,用纱布或脱脂棉压迫止血。
四、给药剂量
不同种类的实验动物一次给药能耐受的最大剂量不同,灌胃太多时易导致胃扩张,静脉给药剂量过多时易导致心力衰竭和肺水肿。现将不同种类实验动物一次给药最大耐受量列出,以供参考。
为观察某种药物对动物的作用时,给药剂量的准确与否是个很重要的問题。剂量太小,作用不明显,剂量太大,又可能导致动物中毒死亡。
表二不同种类实验动物一次给药能耐受的最大剂量(ml)
推荐使用厂述方法确定剂量:
1、先用少量小鼠粗略的摸索山毒剂量或致死剂量,然后用中毒剂量或致死剂量的若干分之作为应用剂量,一般可取1/10-1/5。
2、确定剂量后,如第一次实验的作用不明显,动物也没有中毒的表现(体重下降、精神不振、活动减少或其它症状),可以加大剂量再次实验。如出现中毒现象,作用也明显,则应减少剂量再次实验。在一般情况下,在适宜剂量范围内,药物的作用常随剂量的加大而增强。所以有条件:时,最好同时用儿个剂量做实验,
以便迅速获得关于药物作用的较完整的资料。如实验结果出现剂量与作用强度毫无规律时,则更应慎重分析。
3、用人动物进行实验时,开始的剂量可采用给鼠类剂量的十五分之一至二分之一,以后可根据动物的反应调整剂量。
4、确定动物的给药剂量时,要考虑给药动物的年龄大小和体质强弱。—般说,确定的给药剂量是指成年动物的,如果幼小动物,剂量应减小。服量为100,灌胃量应为100-200,皮下注射量为30—50,肌肉注射量为25—30,静脉注射量为25。
二、实验动物给药量的计算方法
动物实验所用的药物剂量一般按毫克/公斤体重或克/公斤体重计算,应用时须从已知药液的浓度换算㈩相当于每公斤体重应注射的药液量(毫升数),以便给药。
三、人与动物的给药量换算方法
人与动物对同药物的耐受性相差很大。一般说来,动物的耐受性比人大,也就是单位体重动物的用药量比人要人,近几年来新药药效研究中多以下列公式计算:
D2=D1×K2/K1×W1/W2
D为药物剂量,K为常数,W为动物体重(kg)(1指人;2指动物。人及不同种类动物的K值不同,人1.6、猴11.2、兔10.1、大鼠9.1、小鼠9.1、鼠9.8、猫9.8。如一例体重为70kg的人,某药剂量为20ug.kg-1.D-1,—只5kg重的猴为53.6 ug.kg-1.D-1,一只10kg重的犬为40.4ug.kg-1.D-1,而一只20g重的小鼠为260.6 ug.kg-1.D-1(见表三)人用剂量与不同种类动物间剂量的关系。
表三人用剂量与不同种类动物间剂量的关系
注;*表示人与动物的不同体重,以kg表示,第三行以下数据单位为ug.kg-1.d-1。
药理学实验
实验基本操作训练
(一) 小鼠的捉持和给药方法
【目的】学习小鼠的捉持和各种给药方法。
【原理】小鼠是药理实验最常用的一种动物,常用于药物筛选、急性毒性试验。
常用体重18~22g。本实验学习小鼠捉持方法和各种给药方法。
【器材】鼠笼、天平、注射器、针头、灌胃针头、小鼠尾静脉注射用固定器。【药品】生理盐水。
【动物】小鼠。
【方法】1.捉拿方法右手提起鼠尾,将小鼠放在粗糙物(如鼠笼)上面,将鼠尾向后轻拉。以左手的拇指和屈成“V”状的示指(食指)捏住其头部及颈
部皮肤,环指(无名指)、小指和掌心捏住其背部皮肤和尾部,将小鼠完全固定于掌中(见图1)。
图1 小鼠的捉持和灌胃法
2.灌胃法(ig)以左手捉持小鼠,使头部朝上,保持头颈部平直。右手持装有灌胃针头的注射器,自口角插人口腔,从上腭进人食管(见图1)。如遇阻力,应退出后重插,不能强力插,以免穿破食管或误人气管。灌胃量一般为0.1~0.3ml/10g体重。
3.皮下注射(Sc)如两人合作,一人抓住小鼠头部皮肤和拉住鼠尾;另一人左手捏起背部皮肤,背部皮下注射。如一人操作,则左手捉持小鼠,右手持注射器,针尖从右侧肋缘上穿入皮下,向前推至右前肢腋下部位。注射量一般为0.05~0.3ml/10g体重。
4.肌内注射(im)如两人合作,一人左手抓住小鼠头部皮肤,右手拉住鼠尾;另一人持注射器,将针头刺入后肢外侧肌肉。如一人单独操作,以左手拇指和食指抓住小鼠头部皮肤,小指、无名指和掌部夹住鼠尾及一侧后肢,右手持注射器刺入后肢肌内给药。注射量一般为0.1ml/10g体重。
5.腹腔注射(ip)左手固定小鼠,使腹部在上,头部下倾,右手持注射器,取
45°角刺入一侧下腹部向头端刺入腹腔(见图2)。进针部位不宜太高,刺入不能太深,以免伤及内脏。注射量一般为0.1~0.2 ml/10g体重。
6.静脉注射(iv)将小鼠置于特制的固定筒内(或倒置的大漏斗、乳钵下),使鼠尾在外。用70%~75%乙醇棉
球涂擦尾部,或将鼠尾在50℃热水中浸图2 小鼠腹腔注射法
泡30s,使血管扩张。左手拉尾尖,以右手持针。从鼠尾左右两侧尾静脉中,选择一条扩张最明显的尾静脉、将针尖刺入血管,推入药液(见图3)。推注时如有阻力,且尾部肿胀变白,表明针头没有刺入血管,应拔针后重新穿刺。穿刺血管时宜从鼠尾未端开始,以便失败后可以在更近心端重新进行。注射量应不超过0.5ml/只。
图3 小鼠的尾静脉注射法
(二)家兔的捉持和给药方法
【目的】学习家兔的捉持和给药法。
【原理】家兔常作为观察药物对呼吸、心脏、血管、肠肌运动的影响,或用作热源检查及解热药试验雌兔常用作避孕药研究及观察药物对子宫的影响。常用体重为1.5~2.5kg。本实验学习家兔的捉持和给药法。
【器材】兔固定箱、兔开口器、磅秤、导尿管、注射器。
【药品】生理盐水。
【动物】家兔。
【方法】1.捉持法用一只手抓家兔颈背部皮肤,将兔提起;另一手托其臀部,使兔呈坐位姿势。
2.耳缘静脉注射将家兔置于固定箱内(或由一人固定),用乙醇棉球涂擦兔耳,使血管扩张显露(见图4)。再以手捏在耳根部压住静脉,使其充血,然后注入药液。推注时如有阻力,局部肿胀变白,表明针头不在血管内,须重新穿刺。注射量一般为0.2~2ml/kg体重,不超过2ml/kg体重,等渗液可达10ml/kg体重。
3.灌胃将免置于固定箱内。或由两人合作,一人坐好,将兔紧夹于两股(或固定于腋下)用一只手固定兔头,另一只手开口器插入兔口,而后翻转几下,使兔舌伸直并固定之。另一人将导尿管从开口器中央孔插入口内,再慢慢插入食管和胃,深15~18cm。插管时感觉顺利,动物不挣扎也无呼吸困难出现,表示导尿管在胃内。为慎重起见,将导尿管外端插入水中,如有气泡吹出,表示已误入气管内,应拔出重插。如未见气泡出现即证实在胃内。然后将药液注入(见图5)。灌注量一般为10ml/kg体重
图4 家兔耳缘静脉注射法图5 家兔的灌胃法
4.皮下、肌内、腹腔注射方法上基本上同小鼠,唯针头可稍大,给药可稍多(皮下与肌内0.5~1ml/kg体重,腹腔1~5ml/kg体重)。
【附注】其他动物的给药方法
1.大鼠的捉持和给药方法用途与小鼠相似,常用作抗关节炎药物试验、血压测定、利胆实验、子宫试验和长期毒性试验等。常用体重150~200g。
(1)捉持方法:基本上同小鼠相似。将其放在粗糙物上,右手轻拉其尾,左手中指和拇指放到大鼠左右前腋下,食指放入颈部,使大鼠伸开两前肢,便能将其握住。
(2)给药途径:灌胃、腹腔注射、皮下注射、静脉注射均同小鼠,给药量为小鼠的2~3倍。大鼠尚可舌下静脉给药的方法。
2.豚鼠的捉持和给药法豚鼠对组胺很敏感,研究平喘药和抗组胺药时常选用。常用体重300~500g。
(1)捉拿力法:豚鼠性温和,捉拿时以一手拇指和中指从豚鼠背部伸到腋下,另一只手放在臂部,托起即可。
(2)给药途径:皮下、肌内及腹腔注射,方法基本同小鼠,给药量分别为
0.5~lml、0.3~0.5ml、2~4ml。静脉注射,可选用后脚掌外侧的静脉或颈外静脉进行注射。采用前法,可由一人捉持豚鼠并固定一条后腿,另一人剪去注射部位的毛,乙醇棉球涂擦使血管扩张。以小儿头皮针刺入血管推注药物。采用外颈静脉注射时,先将局部皮肤切一小口,暴露血管,然后以小儿头皮针刺入血管推注药物。注射量通常为2~4ml。
3.犬的捉持和给药法犬常川于慢性实验,如高血压实验治疗胃瘘、肠瘘,用于观察药物对冠脉血流的影响、利尿药实验以及长期毒性实验等。常用体重为5~15kg。
(1)捉拿方法:一人用长柄钳式捕狗夹夹住犬颈,另一人将犬嘴绑住。绑嘴方法是将绳带从嘴下面绕上来,在鼻子上面打一结,再将绳带绕到嘴下面打一结,然后将绳带拉到耳后颈部打结固定(见图6)
图6 犬嘴捆绑法及犬前肢内侧皮下头静脉注射法
(2)功给药途径:①腹腔注射:将犬夹住,用力将其头、颈部压在地上。一人提起一侧后肢并将药液注入腹腔。②静脉注射:多从后肢外侧小隐静脉或前肢皮下头静脉注射。以手或橡皮管把静脉向心端扎紧,使血管充盈,剪毛,乙醇消毒,针向近心端刺入静脉。回抽针栓,如见回血,表示针头在静脉内,即可推注药物(见图7)。
实验四、不同给药途径对药物作用的影响 授课教师郭育慧授课序次4授课类型实验课授课学时2 授课题目(章节)第4次实验实验四 不同给药途径对药物作用的影响教学目的与要求1、观察给药途径不同对药物作用的影响;2、掌握小白鼠的捉拿及给药(灌胃、腹腔注射等)方法。教学重点与难点重点验证不同给药途径对药物作用的影响(途径)。难点动物的给药方法及实验结果的讨论教学方法与手段讲授、示教、实验操作。使用教材及参考书 1、使用教材:(1)药理学,第四军医大学出版社,魏庆华、滕淑静主编,第1版xx年7月;(2)药理学实验与学习指导,金虹、令红艳主编,第2版xx年1月。 2、参考书:朱岫芳、鱼江主编,药理学,吉林出版集团,第3版,1997年9月教案续页教学内容辅助手段时间分配实验四 不同给药途径对药物作用的影响 【目的要求】 1、观察不同给药途径对药物作用的影响。 2、练习小白鼠的捉拿及给药方法。 【实验原理】
给药途径不同,药物首先到达的器官和组织不同,致使药物的吸收和分布也不同,药物效应因而呈现差异。静脉吸收最快,产生作用最强,其他给药途径的吸收速度依次是:呼吸道>腹腔注射>肌肉注射>皮下注射>皮内注射>口服>贴皮。主要包括“量差异”(即同一效应,出现作用强度不同)和“质差异”(即出现不同的药理效应)。硫酸镁为导泻、利胆、降压和抗惊厥药。口服不易吸收,并使肠内容物渗透压升高,水分吸收减少,肠容积增大,刺激肠壁,促进肠道蠕动而泻下。镁盐还能引起二指肠分泌胆囊素,此激素能刺激肠液分泌和肠道蠕动。注射给药可使血中Mg2+增加,Mg2+ 和Ga2+化学性质相似,可以特异地竞争Ga2+受点,拮抗Ga2+的作用,阻止运动神经末梢释放递质乙酰胆碱,使骨骼肌松弛。与此同时,也作用于中枢神经系统,引起感觉和意识消失。过量时,引起呼吸抑制、血压骤降以至死亡。静脉缓慢注射氯化钙,可立即消除Mg2+ 的作用。尼可刹米属于中枢兴奋药,可直接或反射性地兴奋延髓呼吸中枢,但若剂量过大,则可引起中枢神经系统各个部位广泛兴奋,导致惊厥发生,甚至死亡。本实验对小白鼠给过量的尼可刹米,以观察不同给药途径对药物作用的影响。 【实验条件】 实验动物小白鼠4 只实验器材天平、烧杯(1000ml)注射器(1ml)、针头、小鼠灌胃器药品2%的尼可刹米、10%硫酸镁溶液
实验1 实验动物的捉持法和给药法 一、常用实验动物的捉持法 1.蛙和蟾蜍 通常以左手握持,用食指和中指夹住左前肢,拇指压住右前肢,右手将下肢拉直,左手用无名指及小指夹住(图1)。 图1 蟾蜍捉持法 2.小鼠 (1)双手法:右手提鼠尾,放在鼠笼盖或其他粗糙面上,向后方轻拉鼠尾,使小鼠前肢固定在粗糙面上。迅速用左手拇指和食指捏其双耳间颈背部皮肤,无名指、小指和掌心夹其背部皮肤和尾部,便可将小鼠牢固捉持(图2)。 图2 小鼠双手捉持法 (2)单手法:小鼠置于笼盖上,先用左手食指和拇指抓住鼠尾,后手掌尺侧和小指夹住鼠尾,然后左手拇指与食指捏住颈部皮肤(图3)。 图3 小鼠单手捉持法 3. 大鼠 大鼠容易激怒咬人,捉持时应戴防护手套。先用右手抓住鼠尾,再用左手拇指和食指握住头部,其余手指与掌部握住背部和腹部。注意不要捏其颈部,以防用力过大、过久,窒息死亡。 4.家兔 一只手抓住兔颈背部皮肤,将兔轻轻提起,另一只手托住臀部,使兔呈蹲坐姿势(图4)。切不可用手握持双耳提起兔子。 图4 家兔捉持法 5.豚鼠
豚鼠性情温和,不咬人,用手轻轻握住身体即可抓起。 6. 猫 应戴好防护手套。轻声呼唤,慢慢将手伸入猫笼,轻抚猫头、颈和背部,一只手抓住颈背部皮肤,另一只手抓住腰背部。性情凶暴的猫可用布袋或网套捉持,操作中应防其利爪和牙齿伤人。 7. 狗 驯服的狗可戴上特制嘴套,用绳带固定于耳后颈部;凶暴的狗可用长柄捕狗夹钳住狗的颈部,然后套上嘴套。狗嘴也可用绳带固定,操作时先将绳带绕过狗嘴的下颌打结,再绕到颈后部打结,以防绳带滑落。狗麻醉后四肢固定于手术台上,取下嘴套或绳带,将一金属棒经两侧嘴角,穿过口腔压于舌上,再用绳带绕过金属棒绑缚狗嘴,并固定于手术台上。应将狗舌拉出口腔,以防窒息。 二、常用实验动物给药法 1. 经口给药法 此法有口服与灌胃两种方法。适用于小鼠、大鼠、豚鼠、兔、犬等动物。口服法可将药物放入饲料或溶于饮水中令动物自由摄取。若为保证剂量准确,可应用灌胃法。 (1)灌胃法 小鼠:左手捉持小鼠,腹部朝上,右手持灌胃管经口角插入口腔,使灌胃管与食管成一直线,再沿上颚壁缓慢插入食管,稍感有阻力时(大约灌胃管插入1/2),如动物安静,呼吸无异常,即可注入药液。如遇阻力应抽出灌胃管重新插入,若药液误注气管,小鼠可立即死亡。一次灌注药量0.1-0.3ml/10g体重。操作宜轻柔,防止损伤食管(图5)。灌胃管可用粗大的注射针头制作,磨钝针尖制成,管长4-5cm,直径1mm,连接于1-2ml 注射器上即成。 图5 小鼠灌胃法 大鼠:左手捉持大鼠,右手持灌胃器,灌胃方法与小鼠相同。若两人合作时,可由助手协助固定后肢与尾巴。但灌胃管必须长6-8cm,直径1.2mm,尖端呈球状,并安装在5 -10ml的注射器上。注药前应回抽注射器,证明未插入气管(无空气逆流)方可注入药液。一次投药量1—2ml/100g体重。 家兔:需两人合作,一人坐好将兔躯体夹于两腿之间,左手紧握双耳固定头部,右手抓住两前肢固定前身,使兔头稍向后仰;另一人将木或竹制开口器横放于兔口中,将兔舌压住,以8号导尿管经开口器中央小孔,沿上颚壁慢慢插入食管15-18cm。为避免误入气管,可将导尿管外口端放入清水杯中,无气泡逸出方可注入药液,并应再注入少量清
3.4 实验动物的给药方法 3.4.1 经口投药法 (1) 口服法. 口服法是将能溶于水并且在水溶液中较稳定的药物放入动物饮水中,不溶于水的药物混于动物饲料内,由动物自行摄入。该方法技术简单,给药时动物接近自然状态,不会引起动物应激反应,适用于多数动物慢性药物干预实验,如抗高血压药物的药效、药物毒性测试等。其缺点是动物饮水和进食过程中,总有部分药物损失,药物摄入量计算不准确,而且由于动物本身状态、饮水量和摄食不同,药物摄入量不易保证,影响药物作用分析的准确性。 (2) 灌服法 灌服法是将动物适当固定,强迫动物摄入药物。这种方法能准确把握给药时间和剂量,及时观察动物的反应,适合于急性和慢性动物实验,但经常强制性操作易引起动物不良生理反应,甚至操作不当引起动物死亡。故应熟练掌握该项技术。强制性给药方法主要有两种: ①固体药物口服 一人操作时用左手从背部抓住动物头部,同时以拇、食指压迫动物口角部位使其张口,右手用镊子夹住药片放于动物舌根部位,然后让动物闭口吞咽下药物。 ②液体药物灌服 小白鼠与大白鼠一般由一人操作,左手捏持小白鼠头、颈、背部皮肤,或握住大白鼠以固定动物,使动物腹部朝向术者,右手将连接注射器的硬质胃管由口角处插入口腔,用胃管将动物头部稍向背侧压迫,使口腔与食管成一直线,将胃管沿上颚壁轻轻插入食道,小白鼠一般用3 cm,大白鼠一般用5 cm的胃管(图3.4-1)。插管时应注意动物反应,如插入顺利,动物安静,呼吸正常,可注入药物;如动物剧烈挣扎或插入有阻力,应拔出胃管重插,如将药物灌入气管,可致动物立即死亡。 给家兔灌服时宜用兔固定箱或由两人操作。助手取坐位,用两腿夹住动物腰腹部,左手抓免双耳,右手握持前肢,以固定动物;术者将木制开口器横插入兔口内并压住舌头,将胃管经开口器中央小孔沿上腭壁插入食道约15 cm,将胃管外口置一杯水中,看是否有气泡冒出,检测是否插入气管,确定胃管不在气管后,即可注入药物(图3.4-2)。 3.4.2 注射给药
动物实验给药剂量换算
————————————————————————————————作者: ————————————————————————————————日期: ?
动物实验给药剂量换算 关于不同实验动物之间或者实验动物与人之间的剂量如何作“等效”换算的问题。分以下几点来探讨这个问题。 第一、等效剂量系数折算法换算 第二、体表面积法换算 第三、系数折算法与体表面积法的比较 第四、系数折算法的相对误差 第五、小孩与成人的剂量换算 第六、少常用实验动物剂量间的换算 第七、不同给药途径间的剂量换算 第八、LD50与药效学剂量间的换算 我们在实验中估算一种药物或化合物的使用剂量的时候,差不多是来源于两条途径:一是查文献,参考别人使用的剂量。有时有现成的,可直接用。有时没有我们所用动物的剂量,但有其它实验动物的。也有的是有临床用量的,但没有实验动物的。这样,我们就得进行换算。这是我们今天要谈的这种方法。 另一种方法就是根据自己或文献上有关急性毒性的数据来进行估算,以期采用合适的剂量。一般参考数据是LD50。至于该选择LD50的多少分之一来作为参考剂量,众说纷纭。这个我们再另题讨论。 下面我来说一说用第一种方法进行如何换算。 目前我们大多数人用的方法,是参考徐叔云教授主编的《药理实验方法学》。在其附录中有一个表,列出了人和动物间按体表面积折算的等效剂量比值。这个表,几乎被药理专业的人们奉为经典,一直在科研中沿用。 表如下所示: 请注意最后一行,这个就是我们通常用到的。把人的临床剂量转换为实验动物的剂量。 试着换算一个。 如:人的临床剂量为X mg/kg ,换算成大鼠的剂量: 大鼠的剂量=X mg/kg×70kg×0.018/200g=X mg/kg×70kg×0.018/0.2kg=6.3 X mg/kg.
常见实验动物的捉持和给药方法 一、小白鼠的捉持和给药方法 1、捉持方法 右手提起鼠尾,放在粗糙物(如鼠笼)上面,轻向后拉其尾;此时小鼠前肢抓住粗糙面不动;用左手拇指和食指捏住双耳及头部皮肤,无名指、小指和掌心夹其背部皮肤及尾部,便可将小鼠完全固定。腾出右手,可以给药。 此外,也可单手捉持,难度较大,但速度快。先用拇指和食指抓住小鼠尾巴,用小指、无名指和手掌压住尾根部,再用腾出的拇指、食指及中指抓住鼠双耳及头部皮肤而固定。 2、给药方法 a.灌胃法 小鼠固定后,使腹部朝上,颈部拉直,右手用带灌胃针头的注射器吸取药液(或事先将药液吸好),将针头从口交插入口腔,再从舌背进沿上腭进入食道。若遇阻力,应退出后再插,切不可用力过猛,防止损伤或误入气管导致动物死亡。灌胃量一般不超过0.25ml/10g。
b.腹腔注射法 抓鼠方法同上,右手持注射器(5~6号针头),从耻骨联合上一侧向头端以30度角刺入腹腔(应避开膀胱)。可先刺入皮下2~3mm,再刺入腹腔,以防药液外漏。针头刺入部位不宜太高太深,以免刺破内脏。注射量一般为0.1~0.25ml/10g。 c.皮下注射法 一般两人合作。一人左手抓住小鼠头部皮肤,右手拉住鼠尾;另一人左手提高背部皮肤,右手持住注射器(针头号同上),将针头刺入提起的皮下。若一人操作,左手小指和手掌夹住鼠尾,拇指和食指提起背部皮肤,右手持注射器给药。一般用量为0.05~0.25ml/10g。 d.肌肉注射法 两人合作时,一人抓鼠方法同上,另一人左手拉直一侧后肢,右手持注射器,注射部位多选后腿上部外
侧(针头号同上)。如一人操作,抓鼠方法类似腹腔注射,只是药液注射在肌肉内。每腿的注射量不宜超过0.1ml。 e.尾静脉注射法 将小鼠置于待置的固定筒内,使鼠尾外露,并用酒精或二甲苯棉球涂擦,或插入40℃~50℃温水中浸泡片刻,使尾部血管扩张。左手拉尾,选择扩张最明显的血管;右手持注射器(4~5号针头),将针头刺入血管,缓慢给药。如推注有阻力而且局部变白,说明针头不在血管内,应重新插入。穿刺时宜从近为尖部1/3处静脉开始,以便重复向上移位注射。一般用药量为0.1~0.2ml/10g,不宜超过0.5ml/10g。 二、家兔的捉持和给药方法 1、捉持方法 一般左手抓住兔颈背部皮肤,将其提起,右手托住臀部称坐位姿态。不要抓两耳,以防兔挣扎。 2、给药方法 a.耳缘静脉注射法 一人操作时,将兔放入固定箱或试验台上,选好耳缘静脉(在耳背的下缘),拔除局部的毛,用酒精棉球涂擦,并用食指轻弹耳壳,使血管扩张。用左手的食指和中指夹住耳根部,拇指和无名指夹住耳尖部拉直;右手将抽好药液的注射器(6~7号针头)刺入血管,用拇指和食指使针头和兔耳固定,将药液推入。如针头在血管内,推注轻松,并可见血液被药液冲走;如不在血管内,则推注有阻力,耳局部变白或肿胀,应立即拔除重新注射。注射完毕,则用手指或棉球压在针眼上,再拔出针头,并继续按压片刻,防止出血。如两人操作,一人夹住兔子,右手暴露血管,压住耳根部使血管充盈,另一人注射给药。
实验动物的给药途径和方法及药量计算方法 一、经口给药法 (一)灌胃法 此法给药剂量准确,是借灌胃器将药物直接灌到动物胃内的一种常用给药法。 1、鼠类:鼠类的灌胃器由特殊的灌胃针构成。左手固定鼠,右手持灌胃器,将灌胃针从鼠的右U角中,插入口中,沿咽后壁慢慢插入食道,使其前端到达膈肌位置,灌胃針插入时应无阻力,如有阻力或动物挣扎则应退针或将针拔出,以免损伤、穿破食道或误入气管。 2、兔、犬等:灌胃一般要借助于开口器、灌胃管进行。先将动物固定,再将开口器固定于上下门齿之间。然后将灌胃管(常用导尿管代替)从开口器的小孔插入动物口中,沿咽后壁而进入食道。插入后应检查灌胃管是否确实插入食道。可将灌胃管外开口放入盛水的烧杯中,若无气泡产生,表明灌胃管被正确插入胃中,未误入气管。此时将注射器与灌胃管相连,注入药液。 (二)口服法 口服给药是把药物混入饲料或溶干饮水中让动物自由摄取。此法优点是简单方便,缺点是剂量不能保证准确,且动物个体间服药量差异较大。大动物在给予片剂、丸剂、胶囊剂时,可将药物用镊子或手指送到舌根部,迅速关闭口腔,将头部稍稍抬高,使其自然吞咽。 二、注射给药法 (一)皮下注射 皮卜注射一般选取皮下组织疏松的部位,大鼠、小鼠和豚鼠可在颈后肩胛问、腹部两侧作皮下注射;家兔可在背部或耳根部作皮卜注射;猫、犬则在大腿外侧作皮下注射。皮下注射用左手拇指和食指轻轻提起动物皮肤,右手持注射器,使针头水平刺入皮下。推送药液时注射部位隆起。拨针时,以手指捏住针刺部位,可防止药液外漏。 (二)肌肉注射
肌肉注射一般选肌肉发达,无大血管通过的部位。大鼠、小鼠、豚鼠可注射大腿外侧肌肉;家兔可在腰椎旁的肌肉、臀部或股部肌肉注射;犬等大型动物选臀部注射。注射时针头宜斜刺迅速人肌肉,回抽针栓如无回血,即可注射。(三)腹腔注射 给大鼠、小鼠进行腹腔注射时,以左手固定动物,使腹部向上,为避免伤及内脏,应尽量使动物头处于低位,使内脏移向上腹,右手持注射器从下腹两侧向头方刺入皮下,针头稍向前,再将注射器沿45角斜向穿过腹肌进入腹腔,此时有落空感,回抽无回血或尿液,即可注入药液。免、犬等动物腹腔注射时,可由助手固定动物,使其腹部朝上,实验者即可进行操作。注射位置为:家兔下腹部近腹白线左右两侧1cm处,犬脐后腹白线两侧边1—2cm处进行腹腔注射。 (四)静脉注射 1、大鼠和小鼠:常采用尾静脉注射。注射时,先将动物固定在暴露尾部的固定器内,尾部用45—50℃的温水浸润几分钟或用75%酒精棉球反复擦拭使血管扩张,并使表皮角质软化。以左手拇指和食指捏住鼠尾两侧,用中指从下面托起鼠,右手持注射器,使针头尽量采取与尾部平行的角度进针,从尾末端处刺入,注入药液,如无阻力,表示针头已进入静脉,注射后把尾部向注射侧弯曲,或拔针后随即以干棉球按住注射部位以止血。 2、豚鼠:可采用前肢皮下头静脉、后肢小隐静脉注射或耳缘静脉注射。 3、家兔:一般采用耳缘静脉注射。注射时先将家兔用固定盒固定,拔去注射部位的毛,用酒精棉球涂擦耳缘静脉,并用手指弹动或轻轻揉擦兔耳,使静脉充血,然后用左手食指和中指压住耳根端,拇指和小指夹住耳边缘部,以无名指放在耳下作垫,右手持注射器从静脉末端刺入血管,注入药液。注射后,用纱布或脱脂棉压迫止血。 三、给药剂量 不同种类的实验动物一次给药能耐受的最大剂量不同,灌胃太多时易导致胃扩张,静脉给药剂量过多时易导致心力衰竭和肺水肿。现将不同种类实验动物一次给药最大耐受量列出,以供参考。 为观察某种药物对动物的作用时,给药剂量的准确与否是个很重要的問题。剂量太小,作用不明显,剂量太大,又可能导致动物中毒死亡。
常用实验动物的给药途径和方法 在动物实验中,为了观察药物对机体功能、代谢及形态的变化,常需将药物注入动物体内。由于实验目的、动物种类、药物剂型不同,给药途径和方法也多种多样。 一经口给药法 (一)灌胃法 此法给药剂量准确,是借灌胃器将药物直接灌到动物胃内的一种常用给药方法。 1、白鼠灌胃法:抓起小鼠,以左手拇指、食指固定头部,小指、无名指和掌心夹注尾巴,使腹部朝上,颈部拉直,右手持灌胃器,将灌胃针从鼠的口角插入口腔,从舌背沿上腭插入食道。灌胃量0.2~0.5ml/10g。 胃管可用适宜口径的硬质塑料管或磨去针头的8号注射针头弯成适当的弧度制成。 注意,操作时不要用力猛插,以免插破食道或误插入器官造成动物死亡。 2、白鼠灌胃法:左手戴上棉手套,用左手拇指和食指将大鼠头部固定,将大鼠 灌胃器沿腭后壁慢慢插入食道。灌胃针插入时应无阻力,如有阻力或动物挣扎则应退针或将针拔出,重新再插。灌胃器由注射器和特殊的灌胃针构成。灌胃量10~20ml/kg 3 兔、犬等:灌胃一般要借助于开口器、灌胃管进行。先将动物固定,再将开口器固定于上下门齿之间,然后将灌胃管(常用导尿管代替)从开口器的小孔插入动物口中,沿咽后壁而进入食道。插入后应检查灌胃管是否确实插入食道。可将灌胃管外开口放入盛水的烧杯中,若无气泡产生,表明灌胃管被正确插入胃中,未误入气管。此时将注射器与灌胃管相连,注入药液。 4、猪的胃内灌注法:给猪下鼻饲管较困难,因猪的鼻翼与上唇联合形成吻突,鼻腔内上下鼻夹与鼻中隔通道极窄,只能通过F10-12号的导尿管,F14号以上的导尿管不能插入,故一般均给猪采用经口入胃的灌胃方法。具体方法是,预先做好一矩形小木块,中间有一洞,让小猪咬住,将其固定,然后再由此洞下胃管。此种操作较为简便。 5、鸟类:包括鸽、鸡等,经口灌胃给药,可由助手将其身体用毛巾裹住固定好。实验者用左手将动物向后拉,使其颈部倾斜,用左拇指和食指将动物嘴撬开,其他三只手指固定好动物头部,右手取带有灌胃针头的注射器,将灌胃针头由动物舌后插入食管。不要象其它动物灌胃时插的太深,如动物不挣扎,插针头又很顺利,即可将药液经口或食管上端罐入胃内。罐入速度要慢。
实验动物的给药途径和方法及药量计算方法标准化管理部编码-[99968T-6889628-J68568-1689N]
一.经口给药法 (一)灌胃法 此法给药剂量准确,是借灌胃器将直接灌到动物胃内的·种常用给药法。1.鼠类:鼠类的灌胃器由特殊的灌胃针构成。左手固定鼠,右手持灌胃器,将灌胃针从鼠的右U角中,插入口中,沿咽后壁慢慢插入食道,使其前端到达膈肌位置,灌胃针插入时应无阻力,如有阻力或动物挣扎则应退针或将针拔出,以免损伤、穿破食道或误入气管。 2.兔、犬等:灌胃一般要借助于开口器、灌胃管进行。先将动物固定,再将开口器固定于上下门齿之间。然后将灌胃管(常用导尿管代替)从开口器的小孔插入动物口中,沿咽后壁而进入食道。插入后应检查灌胃管是否确实插入食道。可将灌胃管外开口放入盛水的烧杯中,若无气泡产生,表明灌胃管被正确插入胃中,未误入气管。此时将注射器与灌胃管相连,注入药液。 (二)口服法 口服给药是把混入饲料或溶干饮水中让动物自由摄取。此法优点是简单方便,缺点是剂量不能保证准确,且动物个体间服药量差异较大。大动物在给予片剂、丸剂、胶囊剂时,可将用镊子或手指送到舌根部,迅速关闭口腔,将头部稍稍抬高,使其自然吞咽。 二、注射给药法
(一)皮下注射 皮卜注射一般选取皮下组织疏松的部位,大鼠、小鼠和豚鼠可在颈后肩胛问、腹部两侧作皮下注射;家兔可在背部或耳根部作皮卜注射;猫、犬则在大腿外侧作皮下注射。皮下注射用左手拇指和食指轻轻提起动物皮肤,右手持注射器,使针头水平刺入皮下。推送药液时注射部位隆起。拨针时,以手指捏住针刺部位,可防止药液外漏。 (二)肌肉注射 肌肉注射一般选肌肉发达,无大血管通过的部位。大鼠、小鼠、豚鼠可注射大腿外侧肌肉;家兔可在腰椎旁的肌肉、臀部或股部肌肉注射;犬等大型动物选臀部注射。注射时针头宜斜刺迅速人肌肉,回抽针栓如无回血,即可注射。(三)腹腔注射 给大鼠、小鼠进行腹腔注射时,以左手固定动物,使腹部向上,为避免伤及内脏,应尽量使动物头处于低位,使内脏移向上腹,右手持注射器从下腹两侧向头方刺入皮下,针头稍向前,再将注射器沿45角斜向穿过腹肌进入腹腔,此时有落空感,回抽无回血或尿液,即可注入药液。免、犬等动物腹腔注射时,可由助手固定动物,使其腹部朝上,者即可进行操作。注射位置为:家兔下腹部近腹白线左右两侧1cm处,犬脐后腹白线两侧边1—2cm处进行腹腔注射。(四)静脉注射
药理实验中对动物的给药体积与采血体积控制 本文由wyj摘要翻译 本文是2001年由欧洲制药工业协会联合会 (The European Federation of Pharmaceutical Industries and Associations ,EFPIA)和欧洲替代方法验证中心(European Centre for the Validation of Alternative Methods,ECV AM)联合发布的关于对动物不同途径给药或采血时所能充许的给药体积和采血体积指导原则。动物包括小鼠、大鼠、兔、狗、猴、豚鼠,给药方法包括po、ip、im、sc、一次性iv、缓慢静注、静脉点滴等的一般给药体积、最大充许给药体积、给药速度等,采血包括各种动物的最大充许采血量和恢复时间等。是一部实用、全面而又难得的指导原则,相信对从事药理、毒理研究者及其他动物实验工作者有一定的帮助。 下面的节选由wyj摘要翻译,原文见欧洲联盟欧洲制药工业协会联合会,A Good Practice Guide to the Administration of Substances and Removal of Blood, Including Routes and Volumes(2000). J. Appl. Toxicol. 21, 15–23 (2001) 第一部分:动物实验中的给药体积与给药速度 一、一般给药体积与速度 对于各种给药途径的最大给药体积,取决实验动物种属和制剂性质。一般推荐给药最大容积为见附表((欧洲联盟欧洲制药工业协会联合会,2000)。 特殊给药途径每次的给药体积(英国药业会,1995):每眼0.01 ml;⑥直肠0.5 ml/kg;⑦阴道:大鼠0.2 ml,兔1 ml;⑧吸入2 mg/L;⑨鼻:猴或犬每鼻孔0.1 ml。 表1各种给药途径的给药体积及可能的最大给药体积a (欧洲联盟欧洲制药工业协会联合会,2000) 给药途径与体积 (ml/kg, except b ml/site)d 动物种属 Oral sc ip im iv (单次) iv (缓慢注射) 小鼠10 (50) 10 (40) 20 (80) 0.05b (0.1)b 5 (25) 大鼠10 (40) 5 (10) 10 (20) 0.1b (0.2)b 5 (20) 兔10 (15) 1 (2) 5 (20) 0.25 (0.5) 2 (10) 犬 5 (15) 1 (2) 1 (20) 0.25 (0.5) 2.5 (5) 猴 5 (15) 2 (5) C (10) 0.25 (0.5) 2 c 狨猴10 (15) 2 (5) C (20) 0.25 (0.5) 2.5 (10) 小型猪10 (15) 1 (2) 1 (20) 0.25 (0.5) 2.5 (5) 说明: a:给非水溶液后,确定再次给药时间时应考虑前次药物是否已被吸收。肌肉内注射每天不能 超过2次。皮下注射每天限制在2~3个部位,前述皮下注射部位,不包括弗氏佐剂的使用。
动物实验基础知识系列之一:剂量换算 关于剂量换算的问题 最近不少战友询问关于不同实验动物之间或者实验动物与人之间的剂量如何作“等效”换算的问题。 这个问题对学习药理的战友来讲,可能是非常熟悉了。但对于非药理专业但又需做药理实验的战友来说,仍然是令人困扰的问题。 下面我们分以下几点来探讨这个问题。 第一、等效剂量系数折算法换算 第二、体表面积法换算 第三、系数折算法与体表面积法的比较 第四、系数折算法的相对误差 第五、小孩与成人的剂量换算 第六、少常用实验动物剂量间的换算 第七、不同给药途径间的剂量换算 第八、LD50与药效学剂量间的换算 下面我来简单说一下这个问题。 我们在实验中估算一种药物或化合物的使用剂量的时候,差不多是来源于两条途径: 一是查文献,参考别人使用的剂量。有时有现成的,可直接用。有
时没有我们所用动物的剂量,但有其它实验动物的。也有的是有临床用量的,但没有实验动物的。这样,我们就得进行换算。这是我们今天要谈的这种方法。 另一种方法就是根据自己或文献上有关急性毒性的数据来进行估算,以期采用合适的剂量。一般参考数据是LD50。至于该选择LD50的多少分之一来作为参考剂量,众说纷纭。这个我们再另题讨论。 下面我来说一说用第一种方法进行如何换算。 目前我们大多数人用的方法,是参考徐叔云教授主编的《药理实验方法学》。在其附录中有一个表,列出了人和动物间按体表面积折算的等效剂量比值。这个表,几乎被药理专业的人们奉为经典,一直在科研中沿用。 表如下所示: 请注意最后一行,这个就是我们通常用到的。把人的临床剂量转换为实验动物的剂量。
试着换算一个。 如:人的临床剂量为X mg/kg , 换算成大鼠的剂量: 大鼠的剂量=X mg/kg×70kg×0.018/200g=X mg/kg×70kg×0.018/0.2kg=6.3 X mg/kg. 这也就是说,按单位体重的剂量来算,大鼠的等效剂量相当于人的6.3倍。 在这里,我们要看到每种动物的体重(包括人),在上表中以蓝色显示的。还要注意到折算系数,也就是表中以红色所示的。将人的剂量转换成哪种动物的,就在相应的动物那一列下找到与人的相交的地方的折算系数,将剂量乘以折算系数,再乘上人的体重与那种动物体重的比值。注意体重的单位要化成一致。这个折算系数是以上表中蓝色所示的标准体重计算得来的。 依此类推,我们可以算出小鼠、豚鼠等其它动物剂量与人的比值。小鼠的剂量=X mg/kg×70kg×0.0026/20g=X mg/kg×70kg×0.0026/0.02kg=9.1X mg/kg. 豚鼠的剂量=X mg/kg×70kg×0.031/400g=X mg/kg×70kg×0.031/0.4kg=5.42 X mg/kg. 兔的剂量=X mg/kg×70kg×0.07/1.5kg =3.27 X mg/kg. 猫的剂量=X mg/kg×70kg×0.078/2.0kg=2.73 X mg/kg. 猴的剂量=X mg/kg×70kg×0.06/4.0kg=1.05 X mg/kg. 狗的剂量=X mg/kg×70kg×0.32/12kg =1.87 X mg/kg.
第三节实验动物给药途径和方法 在动物实验中,为了观察药物对机能功能、代谢及形态引起的变化,常需将药物注入动物体内。给药的途径和方法是多种多样的,可根据实验目的、实验动物种类和药物剂型等情况确定。 一、皮下注射 注射时以左手拇指和食指提起皮肤,将连有5(1/2)号针头的注射器刺入皮下。皮下注射部位一般狗、猫多在大腿外侧,豚鼠在后大腿的内侧或小腹部;大白鼠可在侧下腹部。兔在背部或耳根部注射。蛙可在脊背部淋巴腔注射。 二、皮内注射 皮内注射时需将注射的局部脱去被毛,消毒后,用左手拇指和食指按住皮肤并使之绷紧,在两指之间,用结核菌素注射器连4(1/2)细针头,紧贴皮肤表层刺入皮内,然后再向上挑起并再稍刺入,即可注射药液,此时可见皮肤表面鼓起一白色小皮丘。 三、肌肉注射 肌肉注射应选肌肉发达,无大血管通过的部位,一般多选臀部。注射时垂直迅速刺入肌肉,回抽针栓如无回血,即可进行注射。给小白鼠、大白鼠等小动物作肌肉注射时,用左手抓住鼠两耳和头部皮肤,右手取连有5(1/2)针头的注射器,将针头刺入大腿外侧肌肉,将药液注入。 四、腹腔注射 用大、小白鼠做实验时,以左手抓住动物,使腹部向上,右手将注射针头于左(或右)下腹部刺入皮下,使针头向前推 0.5~1.0cm,再以45度角穿过腹肌,固定针头,缓缓注入药液(图2-5),为避免伤及内脏,可使动物处于头低位,使内脏移向上腹。若实验动物为家兔,进针部位为下腹部的腹白线离开1cm处。 图2-5小鼠腹腔注射方法 五、静脉注射 (一)兔兔耳部血管分布清晰。兔耳中央为动脉,耳外缘为静脉。内缘静脉深不易固定,故不用。外缘静脉表浅易固定,常用。先拔去注射部位的被毛,用手指弹动或轻揉兔耳,使静脉充盈,左手食指和中指夹住静脉的近端,拇指绷紧静脉的远端,无名指及小指垫在下面,右手持注射器连6号针头尽量从静脉的远端刺入,移动拇指于针头上以固定针头,放开食指
A Good Practice Guide to the Administration of Substances and Removal of Blood,Including Routes and Volumes 良好的实验动物给药和采血(包括途径和体积)规范指南 Karl-Heinz Diehl1, Robin Hull2, David Morton3, Rudolf Pfister4, Yvon Rabemampianina5, David Smith6,*, Jean-Marc Vidal7 and Cor van de Vorstenbosch 8 1Aventis, PO Box 1140, D35001 Marburg, Germany 德国马尔堡市35001区1140信箱安万特公司 2N I B S C, Blanch Lane, South Miimms, Potters Bar, Hertfordshire EN6 3QG 英国赫特福德郡EN6 3QG波特斯巴镇South Miimms布兰奇道英国国家生物制品检定所 3The University of Birmingham, Medical School, Edgbaston, Birmingham B15 2TT 英国伯明翰市B15 2TT艾吉马斯顿伯明翰大学医学院 4Novartis Pharma AG, CH-4002 Basel, Switzerland 瑞士巴塞尔CH-4002诺华制药公司 5Centre de Recherche Pfizer, Etablissement d’Amboise, Z1 Poce′-sur-Cisse-BP 159 37401 Amboise Cedex, France 法国Amboise Cedex Z1 Poce′-sur-Cisse-BP 159 37401 Etablissement d’Amboise 辉瑞研究中心 6AstraZeneca R&D Charnwood, Bakewell Road, Loughborough, Leics LE11 5RH 英国莱斯特郡LE11 5RH拉夫堡市贝克韦尔路Charnwood阿斯利康研究中心 7Aventis, 102 Route de Noisy, 95235 Romainville Ce′dex, France 法国Romainville Ce′dex 95235 Noisy路102号安万特公司 8N V Organon, PO Box 20, 5340 BH Oss, Netherlands 荷兰BH Oss5340 20号信箱欧加农公司 Key words: blood volumes; blood removal; administration substances; laboratory animals; refinement. 关键词:血容量;采血;给药;实验动物;简化 This article is the result of an initiative between the European Federation of Pharmaceutical Industries Associations (EFPIA) and the European Centre for the Validation of Alternative Methods (ECVAM).Its objectives are to provide the researcher in the safety evaluation laboratory with an up-to-date, easyto-use set of data sheets to aid in the study design process whilst at the same time affording maximum welfare considerations to the experimental animals. 该文章为欧盟制药工业协会(EFPIA)和欧洲替代动物实验方法验证中心(ECVAM)之间的初步结果。其目的在于为安全性评价实验室的研究者提供最新的易于使用的数据库以帮助研究设计过程,同时最大可能地考虑到实验动物的福利。
给药途径对药物作用的影响 一、实验目的 1.观察不同给药途径对药物作用的快慢和强弱的影响; 2.学习小白鼠不同途径的给药方法。 二、实验原理 采用不同的给药途径,会使药物发挥不同的作用,口服硫酸镁可导泻和利胆,注射则产生止痉、镇静和降低颅内压。 三、实验动物 小白鼠 四、实验药品及器材 1.器材:1ML注射器四副,灌胃针头一个,天枰一台,250ML烧杯4个。 2.药物:10%硫酸镁。 五、实验方法 1.取体重相近的小白鼠2只,甲鼠腹腔注射10%硫酸镁溶液0.6ML。 2.乙鼠口服(灌胃)10%硫酸镁溶液0.6ML。 3.观察并比较两只鼠的不同现象。 六、实验结果 七、结果分析 硫酸镁可因给药途径不同而产生不同的药理作用,硫酸镁腹腔注射给药时,会抑制中枢及外周神经系统,使骨骼肌、心肌、血管平滑肌松弛,从而发挥肌松作用和降压作用;而硫酸镁灌胃时,肠道很少吸收增加肠容积而促进肠道推进性蠕动,产生泻下作用,故甲鼠出现肌张力明显减弱,处于安静状态,乙鼠则出现轻微腹泻的现象。 八、实验结论
给药途径不同所产生药物作用的快慢和强弱不同,硫酸镁腹腔注射使肌松弛,灌胃则出现轻微腹泻。 九、思考题 1.给药途径不同,一般情况下对药物的作用产生什么影响?在哪些情况下可使药物的作用产生质的差异? 不同给药途径的药物吸收速度不同,一般规律是静脉注射>(快于)吸入>肌肉注射>皮下注射>口服>直肠>贴皮。如静脉注射,药物直接入血可立即生效,用于急救、昏迷病人;剂量易控制;刺激性药物可稀释后静注;大量注射时可静滴。缺点为较易产生不良反应;要求技术熟练。不同给药途径因吸收、分布方面产生的差异,影响药物的作用强度,甚至产生质的差异,如硫酸镁口服导泻,而肌注可产生中枢神经系统的抑制作用,用于抗惊厥。为此,临床应按照病情、治疗需求和药物特性,选用合适的给药途径。 口服有首过消除效应,注射没有,所以生物利用率有区别,会有量的差异。 而体内再分布或作用有明显靶向性的药物,使药物体内分布不均,不同受体,作用不同,会有质的差异。 2.给药途径不同时,药物的作用为什么有的会出现质的差异,有的会出现量的不同。 有的药物口服有首关消除效应,注射则没有所以生物利用率有所区别,因此出现量的不同;而体内再分布或作用有明显靶向性的药物,使药物体内分布不均,不同受体,作用不同,故会有质的差异。
K2MG-E《专业技术人员绩效管理与业务能力提升》练习与答案 一.经口给药法 (一)灌胃法 此法给药剂量准确,是借灌胃器将药物直接灌到动物胃内的·种常用给药法。 1.鼠类:鼠类的灌胃器由特殊的灌胃针构成。左手固定鼠,右手持灌胃器,将灌胃针从鼠的右U角中,插入口中,沿咽后壁慢慢插入食道,使其前端到达膈肌位置,灌胃針插入时应无阻力,如有阻力或动物挣扎则应退针或将针拔出,以免损伤、穿破食道或误入气管。 2.兔、犬等:灌胃一般要借助于开口器、灌胃管进行。先将动物固定,再将开口器固定于上下门齿之间。然后将灌胃管(常用导尿管代替)从开口器的小孔插入动物口中,沿咽后壁而进入食道。插入后应检查灌胃管是否确实插入食道。可将灌胃管外开口放入盛水的烧杯中,若无气泡产生,表明灌胃管被正确插入胃中,未误入气管。此时将注射器与灌胃管相连,注入药液。 (二)口服法 口服给药是把药物混入饲料或溶干饮水中让动物自由摄取。此法优点是简单方便,缺点是剂量不能保证准确,且动物个体间服药量差异较大。大动物在给予片剂、丸剂、胶囊剂时,可将药物用镊子或手指送到舌根部,迅速关闭口腔,将头部稍稍抬高,使其自然吞咽。 二、注射给药法 (一)皮下注射 皮卜注射一般选取皮下组织疏松的部位,大鼠、小鼠和豚鼠可在颈后肩胛问、腹部两侧作皮下注射;家兔可在背部或耳根部作皮卜注射;猫、犬则在大腿外侧作皮下注射。皮下注射用左手拇指和食指轻轻提起动物皮肤,
右手持注射器,使针头水平刺入皮下。推送药液时注射部位隆起。拨针时,以手指捏住针刺部位,可防止药液外漏。 (二)肌肉注射 肌肉注射一般选肌肉发达,无大血管通过的部位。大鼠、小鼠、豚鼠可注射大腿外侧肌肉;家兔可在腰椎旁的肌肉、臀部或股部肌肉注射;犬等大型动物选臀部注射。注射时针头宜斜刺迅速人肌肉,回抽针栓如无回血,即可注射。 (三)腹腔注射 给大鼠、小鼠进行腹腔注射时,以左手固定动物,使腹部向上,为避免伤及内脏,应尽量使动物头处于低位,使内脏移向上腹,右手持注射器从下腹两侧向头方刺入皮下,针头稍向前,再将注射器沿45角斜向穿过腹肌进入腹腔,此时有落空感,回抽无回血或尿液,即可注入药液。免、犬等动物腹腔注射时,可由助手固定动物,使其腹部朝上,实验者即可进行操作。注射位置为:家兔下腹部近腹白线左右两侧1cm处,犬脐后腹白线两侧边1—2cm处进行腹腔注射。 (四)静脉注射 1、大鼠和小鼠:常采用尾静脉注射。注射时,先将动物固定在暴露尾部的固定器内,尾部用45—50℃的温水浸润几分钟或用75%酒精棉球反复擦拭使血管扩张,并使表皮角质软化。以左手拇指和食指捏住鼠尾两侧,用中指从下面托起鼠,右手持注射器,使针头尽量采取与尾部平行的角度进针,从尾末端处刺入,注入药液,如无阻力,表示针头已进入静脉,注射后把尾部向注射侧弯曲,或拔针后随即以干棉球按住注射部位以止血。 2、豚鼠:可采用前肢皮下头静脉、后肢小隐静脉注射或耳缘静脉注射。
实验动物给药量的确定 观察一种药物对实验动物的作用时,一个重要的问题就是给动物用多大的剂量较合适。剂量太小,作用不明显,剂量太大,又可能引起动物中毒致死。可以按下述方法确定剂量: 1. 先用少量小鼠粗略地探索中毒剂量或致死剂量,然后用小于中毒量的剂量,或取致死量的若干分之一作为应用剂量,一般可取1/10~1/5。 2. 植物药粗制剂的剂量多按生药折算。 3. 化学药品可参考化学结构相似的已知药物,特别是化学结构和作用都相似的剂量。 4. 确定剂量后,如第一次用药的作用不明显,动物也没有中毒的表现,可以加大剂量再次实验。如出现中毒现象,作用也明显,则应降低剂量再次实验。在一般情况下,在适宜的剂量范围内,药物的作用常随剂量的加大而增强。所以有条件时,最好同时用几个剂量作实验,以便迅速获得关于药物作用的较完整的资料。如实验结果出现剂量与作用强度之间毫无规律时,则更应慎重分析。 5. 用大动物进行实验时,防止动物中毒死亡,开始的剂量可采用鼠类的1/15~1/2,以后可根据动物的反应调整剂量。 6. 确定动物给药剂量时,要考虑给药动物的年龄大小和体质强弱。一般说确定的给药剂量是指成年动物的,如是幼龄动物,剂量应减小。如以狗为例:6 个月以上的狗给药剂量为 1 份时,3~6 个月的给1/2 份,45~89 日的给1/4 份,20~44 日的给1/8 份,10~19日的给1/16份。 7. 确定动物给药剂量时,要考虑因给药途径不同,所用剂量也不同。以口服量为100时,皮下注射量为30~50,肌肉注射量为20~30,静脉注射量为25。 二、人与动物的用药量换算方法 人与动物对同一药物耐受性不同,一般动物的耐受性要比人大,单位体重的用药量动物比人要高。必须将人的用药量换算成动物的用药量。一般可按下列比例换算: 人用药量: 1 小鼠、大鼠:50~100 兔、豚鼠:15~20 狗、猫:5~10 以上系按单位体重口服用药量换算。如给药途径为静脉、皮下、腹腔注射,换算比例应适 当减小些。
实验动物的给药方法 在动物实验中,为了观察药物对机体功能、代谢及形态引起的变化,常需要将药物注入动物体内。给药的途径和方法多种多样,可根据实验目的、实验动物种类和药物剂型、剂量等情况确定。 (一)注射给药法 1. 皮下注射 注射时用左手拇指及食指轻轻捏起皮肤,右手持注射器将针头刺入,固定后即可进行注射。 ①小鼠在背部或前肢腋下,大鼠在背部或侧下腹部; ②豚鼠在后大腿内侧、背部等脂肪少的部位; ③兔在背部或耳根部注射; ④蛙可在脊背部淋巴囊注射; ⑤狗多在大腿外侧注射,拔针时,轻按针孔片刻,防药液逸出。 2. 皮内注射 此法用于观察皮肤血管的通透性变化或观察皮内反应。如将一定量的放射性同位素溶液、颜料或致炎物质、药物等注入皮内,观察其消失速度和局部血液循环变化,作为皮肤血管通透性观察指标之一。 方法是:将动物注射部位的毛剪去,消毒后,用皮试针头紧贴皮肤皮层刺入皮内,然后使针头向上挑起并再稍刺入,即可注射药液。注射后可见皮肤表面鼓起一白色小皮丘。 3. 肌肉注射 当给动物注射不溶于水而混悬于油或其他溶剂中的药物时,常采用肌肉注射。肌肉注射一般选用肌肉发达、无大血管经过的部位,多选臀部。 注射时针头要垂直快速刺入肌肉,如无回血现象即可注射。给大、小鼠作肌肉注射时,选大腿外侧肌肉进行注射。 4. 腹腔注射 先将动物固定,腹部用酒精棉球擦试消毒,然后在左或右侧腹部将针头刺入皮下,沿皮下向前推进约0.5厘米,再使针头与皮肤呈45 度角方向穿过腹肌刺入腹腔,此时有落空感,回抽无肠液、尿液后,缓缓推入药液。此法大小鼠用的较多。 5. 静脉注射
是将药液直接注射于静脉管内,使其随着血液分布全身,迅速奏效。但排泄较快,作用时间较短。 ①小鼠、大鼠的静脉注射: 常采用尾静脉注射。鼠尾静脉共有3根,左右两侧和背侧各1根,两侧尾静脉比较容易固定,故常被采用。操作时,先将动物固定在暴露尾部的固定器内(可用烧杯、铁丝罩或粗试管等物代替),用75%酒精棉球反复擦试使血管扩张,并可使表皮角质软化,以左手拇指和食指捏住鼠尾两侧,使静脉充盈,注射时针头尽量采取与尾部平行的角度进针。开始注射时宜少量缓注,如无阻力,表示针头已进入静脉,这时用左手指将针和尾一起固定起来,解除对尾根部的压迫后,便可进行注射。如有白色皮丘出现,说明未穿刺入血管,应重新向尾部方向移动针头再次穿刺。注射完毕后把尾部向注射侧弯曲以止血。如需反复注射,尽量从尾的末端开始。一次的注射量为每10g体重0.1~0.2ml。 ②豚鼠的静脉注射: 一般采用前肢皮下头静脉。鼠的静脉管壁较脆,注射时应特别注意。 ③兔的静脉注射: 一般采用外耳缘静脉,因其表浅易固定。注射部位除毛,用75%的酒精消毒,手指轻弹兔耳,使静脉充盈,左手食指和中指夹住静脉的近心端,拇指绷紧静脉的远心端,无名指及小指垫在下面,右手持注射器,尽量从静脉的远端刺入血管,移动拇指于针头上以固定,放开食、中指,将药液注入,然后拔出针头,用手压迫针眼片刻以止血。 ④狗的静脉注射: 狗的静脉注射多采用前肢外侧静脉或后肢外侧的小隐静脉。注射部位除毛后,在静脉血管的近心端用橡皮带扎紧,使血管充盈,从静脉的远心端将注射针头平行血管刺入,回抽注射器针栓,如有回血,即可放开像皮带,将药液缓缓注入。 6. 淋巴囊注射 蛙类常采用此法,其皮下有数个淋巴囊,注入药物甚易吸收。腹部淋巴囊和头部淋巴囊常作为蛙类给药途径。一般多选用腹部淋巴囊给药。注射时将针头从蛙大腿上端刺入,经大腿肌层入腹壁肌层,再进入腹壁皮下,即进入淋巴囊,然后注入药液。 (二)经口给药法 1. 口服法: