
晶体结构立体模型建构软件(Diamond)教程
中国海洋大学材料科学与工程研究院
晶体结构立体模型建构软件-Diamond的使用
在使用Diamond软件构造晶体模型时,需要知道晶体的结构数据,即晶体的空间群、晶胞参数和原子坐标。晶体结构数据可以手动输入,也可以直接从晶体信息文件中获得。我们将通过几个例子来说明软件的使用方法。
一、NaCl晶体结构模型的构造
下面我们以NaCl为例手动输入晶体结构数据。NaCl晶体的结构数据为:空间群Fm-3m(225);晶胞参数a=5.64?;原子坐标Na:4a, Cl:4b。我们将通过这个例子学会如下操作:
1、学会手动输入晶体结构数据;
2、学会晶体模型的构造;
3、学会旋转晶体模型,从不同的角度观察;
4、学会改变背景和原子及晶胞的颜色等参数;
5、学会以一种原子为中心,另一种原子为配位原子构造配位多面体;
6、学会多面体外观的设计。
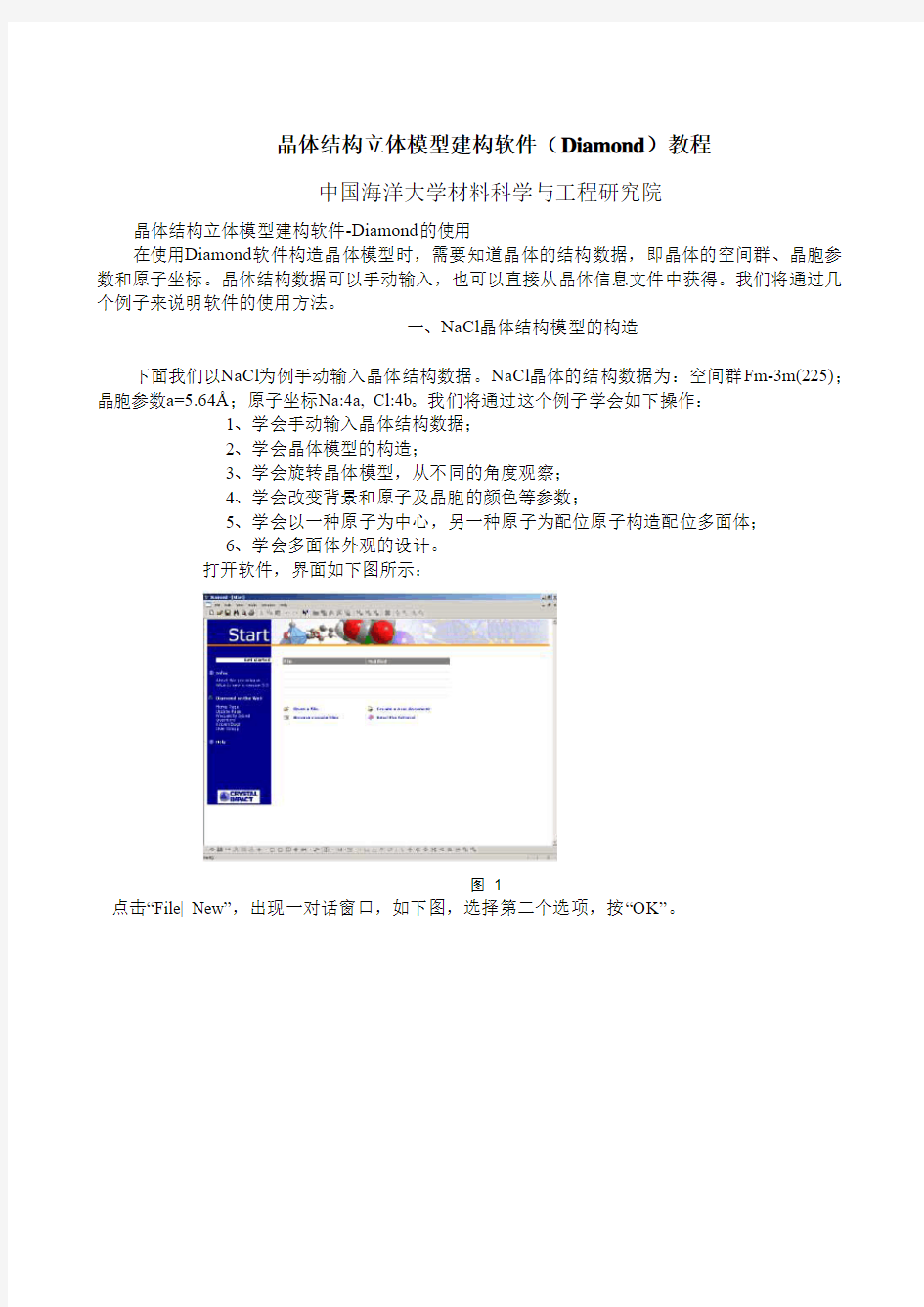
打开软件,界面如下图所示:
图1
点击“File| New”,出现一对话窗口,如下图,选择第二个选项,按“OK”。
图 2
结果生成一个名字为Diamond1的空白的页面,同时弹出一个名字为New Structure的对话窗口,点“下一步”,在新弹出的窗口中确认Crystal Structure with cell and Spacegroup被选中,在Cell length中输入5.64,如下图:
图 3
注意Space group(空间群)后是否我们需要的NaCl晶体的空间群Fm-3m(225),如果不是,点击Browse 按钮,在弹出的对话窗口中选中Fm-3m(225),即在Fm-3m(225)上点击使其变蓝色,如下图。点“OK”回到前面的对话窗口。
中心对称
图4
点“下一步”(在出现的如下图的对话框中可以输入原子坐标,即在“Atomic parameters“中输入相应的元素符号和原子坐标值,但我们将在其他的地方做这个工作)
图5
点“下一步”,在出现的Completing the new structure Assistant窗口中有三个选项:Start structure picture; Launch the structure picture creation assistant; Create structure picture automaticly。选中Start structure picture,点击“完成”。出现一个名字为Diamond1>Structure1>Picture1的窗口,我们准备建造的NaCl晶体模型将在这个窗口中显示。接下来输入原子坐标。点“Structure | Atomic Parameters”,在弹出的对话窗口中点“Insert”,在“Element”后的下拉选项中选中Na,(Symbol后输入元素符号,Oxidation后输入元素的价数,S.O.F是原子的位置占有分数,对NaCl晶体中的Na和Cl原子来说都是1,因为都是1,所以也可以不输入),在Position后的下拉选项中选中4a;按“Append”,在“Element”后的下拉选项中
选中Cl,在Position后的下拉选项中选中4b,如下图。点“确定”。
图6
点“Build | Fill | unit cell”,将出现NaCl晶体一个晶胞的模型。点“Move | Rotate along x/y axis”,就可以将模型旋转,从不同的角度观察。
但也许你不喜欢背景和原子及晶胞的颜色,Diamond可以让你设置你自己最喜欢的颜色。
图7
改变背景设置:点“Picture | Layout”,在弹出的窗口中点“Background”,在Background后的下拉选项中选你喜欢的背景颜色,点“确定”退出对话窗口回到Picture1,可以看到背景已经变成了黑色(如果点“Apply now”则不退出对话窗口但可以看到背景已经变成了黑色)。
改变原字颜色等设置:点“Picture | Atom Designs”,在弹出的“Atom Group Designs”窗口中选择相应的原子,点“Style and colors”,在“Style”后的下拉选项中可以选不同的原子类型,这里我们选“Solid/Empty/Boundary ellipse”,即实心球,在“Fix”下的“Color”后选你喜欢的颜色,这里我们
选择Na 为红色,Cl 为绿色。点“Model and Radii ”,可以改变所选原子的模型“Global/Individual ”或“Standard(Ball and Stick ,即球-棍模型”或其他类型,可以选择不同的模型看看有什么变化。在“Radii ”下的Radius[?] for the “Standard”后输入原子半径的值,点“确定”。
改变晶胞颜色等设置:点“Picture | Cell Edges Design ”,在弹出的“Cell Edges Design ”对话窗口中可以设置晶胞的颜色、线形和粗细,还可以通过选中或不选中“Show the unit cell axis a, b, c ”可以显示不不显示晶胞中的a, b, c 轴。如果此时并不知道轴的对应关系,点“Objects | Coordinate System ”,在弹出的“Coordinate System ”对话窗口中选中“Display Coordinate System ”,改变颜色和字体,这里我们选择黑色,字体选择默认值。点“OK ”。
对于NaCl 晶体,我们常看到的描述为:Cl -离子形成立方最紧密堆积,Na +离子占据Cl -
离子所形成的立方最紧密堆积中所有的八面体空位,每个八面体所有棱都被其他八面体共用。下面我们将建造这样的八面体模型。
在前面已经建造的NaCl 晶体一个晶胞的模型的基础上,点“Build | Polyhedra | Add Polyhedra ”,出现“Add Polyhedra ”对话窗口,在“Central atom groups ”下选中“Na ”,即以Na +离子作为配位多面体的中心原子;在“Ligand atom groups ”下选中“Cl ”,即以Cl -离子作为配位多面体的配位原子。确认“Fixed ”已经被选中,其后面的“Rmin[?]”和“Rmax[?]”分别是形成配位多面体时离中心原子周围最近和最远的配位原子的距离(因为配位多面体不总是正多边形),这里取默认值即可。设置这个距离还有另外一种办法,我们将在后面的例子中使用。
图 8
点“Design”,出现“Polyhedra Design”对话窗口,点“Style and colors”可以设置多面体面的颜色、边的颜色、透明度等;点“Others”,“Ligand atom reducing”后面的数值可以使配位原子的半径比形成多面体前设置的值缩小(<1)、不变(=1)或增大(>1)。点“OK”就得到了我们需要的配位
多面体。
图9
如果我们想只画出一个Na +
离子周围的配位离子形成的多面体,点“Move | No tracking”,移动鼠
标在目标Na +
离子上单击左键,使得该离子被选中,即该离子周围出现一个方框。点“Build |
Polyhedra | Add Polyhedra”,出现“Add Polyhedra”对话窗口,此时“Central atom groups”下不可选,因为已经选中了中心原子;在“Ligand atom groups”下选中“Cl”,如下图。
图10
点“OK”,就会发现只有一个多面体被做出来。但此时该中心离子仍处于选中状态,可以按“Esc”键或在“Move | No tracking”状态下在任何空白的地方单击鼠标左键即可。点“File| Save as | Save Document as”或“File| Save as | Save Structure as”可以将建造的晶体结构模型保存成Diamond 3 document (*.diamdoc)文件或其他形式的文件,但对Demo版(即演示版)不能保存成此形式。点“File| Save as | Save Graphics as”可以将所做的模型以数种图片文件格式保存,如.bmp、.jpg等格式
二、c60晶体结构模型和分子模型的构造
通过这个例子我们将学会如下操作:
1、从“.CIF”格式文件(晶体信息文件)中获得晶体结构数据;
2、利用c60晶体结构数据构造一个c60分子模型;
3、“Add atoms”工具的应用;
4、通过插入“dummy”原子辅助构造多面体;
5、原子间距离的测定;
6、学会设置键的线型、颜色和粗细。
打开软件,点“File | Open”,找到安装软件的目录,比如“C:\Program Files\Diamond”,打开“Tutorial”文件夹,保证文件类型为“All Files(*.*)”或“CIF(*.CIF)”,双击名为“c60”的文件。弹出名为“File Import Assistant”的窗口,点击“下一步”,在弹出的“File Format”窗口中保证File后面为“Crystallographic Information File(CIF)”,点击“下一步”,在弹出的“Picture Creation”窗口中If the dataset is a crystal后面下拉选项中选中“Create a blank picture”,点击“下一步”,在弹出的窗口中点“完成”。出现一个“c60>S1252286>picture1”空白窗口,此时观察右边的“Data brief”窗口,c60的晶体结构数据已经存在了。点“Build | Fill | unit cell”,将出现c60晶体一个晶胞的模型。
我们知道,c60是一个由60个c原子形成的分子,下面我们利用c60晶体结构数据得到c60分子。点“Build | Connect Atoms”,可以看到相邻的c原子都被连接起来,但并没有一个完整的c60分子,点名为“Complete Fragments”的按钮,可以看到晶胞外也出现了原子而且都被连接起来形成了完整的c60分子。从中我们可以看到c60分子堆积成了立方面心结构。(如果看不到连接原子的键,可以点“Picture | Bond Design”,在出现的“Bond Group Designs”窗口中可以选择“c-c”键的线型、颜色和粗细,如下图)
图11
我们也可以只建立一个c60分子,方法如下:
首先将已经得到的晶体模型删除,得到一个空白图片,或新建一个空白图片。点“Build | Add atoms”,出现名为“Add atoms”的窗口,选中其中任意一个c原子,点“OK”。注意到在空白图片中出现了一个c原子,
点名为“Complete Fragments”的按钮,就可以看到c原子都被连接起来的完整的c60分子(也可以在出现一个c原子后,点“Build | Coordination Spheres”,在出现的“Coordination Spheres”窗口中点“Apply now”数次,直到完整的c60分子完成)。
c60分子是笼形分子,所以我们得到的模型中的键很多,相互交叉,给看清楚原子的位置关系以及各个面之间的关系带来麻烦,如果把每个六边形和五边形封闭起来,对看清楚位置关系非常有帮助,下面我们将把c60笼中的每个六边形和五边形封闭起来。要达到这个目的,我们要做的实际上是构造多面体,但构造多面体需要有中心原子,而在c60笼形分子中并没有中心原子,所以需要我们给加一个。
选中c60分子中所有的原子(在“No Tracking”状态下按下鼠标左键拖动即可出现虚线框,松开鼠标后虚线框中的原子即被选中)。点“Structure | Insert Atom”,在出现的“Insert Atom”窗口中显示的是将要被加入原子的名称(默认为“dummy”)和坐标(在所有被选c原子的中心),点“OK”。在c60分子的中心将出现一个原子(可以用已经学过的方法改变它的颜色、大小等)。此时可以用已经学过的方法构造多面体,但你会发现什么模型也没有构造出来,这是因为“Rmax[?]”的默认值是3,太小了。那么设置成多大才合适呢?可以通过测量来知道。点“Tools | Measure Distances”,指针将变成带有尺子图案的形状,在“dummy”原子上点击,然后在任一原子上点击,将测得他们的距离为3.6119?,所以把“Rmax[?]”的值设得比3.6119大一些就可以了,比如设为4。但是,如果你设计的多面体的“Border”的颜色和面的颜色不同,而且“Weight”不为0,你也许会发现得到的多面体的面上有一些线条,这些线可以通过调整“Add Polyhedra”窗口中“Angle epsilon[deg], used to extend triangles to higher polygons”后的值来除去(我们取10,您也可以自己尝试设置不同的值看有什么不同的结果),就可以得到所有的面都是封闭的c60笼形分子。您可以把多面体设置成一定程度透明的情况以便更好的观察c60分子中各原子的位置和连接情况。
利用插入“dummy”原子构造模型的一个小技巧:利用插入“dummy”原子只对五边形进行封闭。构造一个c60笼形分子,选择其中五边形顶点的五个原子,点“Structure | Insert Atom”插入一个“dummy”原子(将出
现在所选五个原子的中心),点名为“Complete Fragments”的按钮,则整个c60笼形分子中所有的五边形中心都将有一个“dummy”原子出现。用测量工具测“dummy”原子和最近原子之间的距离,但这次我们将改变“Rmin[?]”和“Rmax[?]”的设置方式。点“Build | Connectivity”,弹出一名为“Connectivity”的窗口,在“Select atom group pair(s) to be connected”下选中“c”和“?(即dummy原子)”,保证“Statistic”处于被选中状态。在“Connectivity”窗口的下半部分有两条红线,左边红线对应“Rmin[?]”,右边红线对应于“Rmax[?]”,将鼠标移到红线上按下左键可以拖动红线以改变“Dmin[?]”和“Dmax[?]”的设置,我们在这里将红线拖动到对应于“Dmin[?]”为0.5和“Dmax[?]”为1.5的位置(不要求很精确),如下图。点“OK”。
图12
点“Build | Polyhedra | Add Polyhedra”,在“Add Polyhedra”对话窗口中选中“Generic(spheres from connectivity list)”,在“Central atom groups”下选“?(即dummy原子)”,在“Ligand atom groups”下选中“C”,如下图。
图13
点“OK”,就会发现所有的五边形都被封闭起来。此时可以把dummy原子的半径设为最小值以便它们不在五边形的面上被看到。
图14
在此基础上,还可以把六边形也封闭起来,但要先对已经存在的dummy原子进行处理。点“Structure | Atomic Parameters”,在弹出的点“Atomic Parameters”窗口中可以看到已经有一个“?dummy”原子。在“Element”后选任意原子,比如“Ac”,替换“?”,点“确定”。如前面方法在任一六边形中心插入一dummy原子,按“Complete Fragments”按钮,则有部分六边形中心出现新的dummy原子(其余的六边形中没有出现新dummy原子是因为它们和选中的六边形并不等同,即不能通过c60晶体所具有的对称操作使它们重合)。同样将新得到的dummy原子处理为其他元素,比如“B”,按前面的方法将这些六边形封闭(注意设计多面体时颜色要和前面五边形不同以便区分)。再将剩余的六边形做同样的封闭处理,就可以得到由不同颜色封闭的c60笼形分子。
图15
三、八面沸石笼形结构模型的构造
通过这个例子我们将学会如下操作:
1、“Filter”工具的应用;
2、“Fixed Spheres”工具的应用。
打开Diamond软件,点“File | Open”,找到安装软件的目录,比如“C:\Program Files\Diamond”,
打开“Tutorial”文件夹,选择文件类型为“CIF(*.CIF)”,双击名为“faujasite”(即八面沸石)的文件,建一个空白Picture。
在建立晶体结构模型之前,我们先要解决一个小问题:因为对于空间群Fd-3m(227)来说,坐标原点的选取有两种方案供选择:1,非中心对称;2,中心对称。从给出的CIF 文件中,Diamond 软件并能知道坐标原点应该如何选择。但CIF文件的作者在文件中告诉我们应该选2,即中心对称,因此我们要先对空间群进行设置:点“Structure | Space-group”,在出现的“Space-group”窗口中点Fd-3m(227)前面的加号“+”,将会发现Fd-3m(227)下面有五种选择,此处选择第一个,即Fd-3m(22701),该符号即对应坐标原点为中心对称的选择。
图16 选择Fd-3m空间群图17 直接填充晶胞的效果
此时填充一个晶胞,会发现原子很多,不容易看清楚沸石的骨架结构,如图17。而对于沸石结构,我们更关心其硅、铝等原子形成的骨架,并不关心其他原子在晶体中的情况,所以希望只有参与形成骨架的原子出现,Diamond软件提供了一种被称为“Filter”(过滤)的工具可以帮助我们很容易做到这一点。
点“Build | Filter”,在出现的“Filter”窗口中:Atom groups下只选中“SiAl”(则其他的原子将被过滤掉,不在模型中出现);在“Bravais translations”下只选中“1:+(0,0,0)”,如下图。
图18 Filter参数设置
点“OK”。此时Picture
窗口左下角将出现一个黄颜色、带方框的“F”来提醒你“Filter”功能处
中心对称
于开启状态。点“Add Atoms”,选择“SiAl”,点“OK”。点“Complete Fragments”,将出现一个笼形模型(如果没有足够原子出现,如图19;请检查“Connectivity 设置是否正确,如图20;使“Dmax”等于3.2;如果只有新的原子出现而没有显示键,在“Picture | Bond Designs”中设置“SiAl -SiAl”键的线型、颜色、粗细等)。点“Picture | Viewing direction”,在“Viewing direction”窗口中“h k l”后的三栏中均填入1,按”set”,将会发现笼形模型已经改变了方向。
图 19点击Complete Fragments 没有出现其他原子
图 20由于DMax[A 。]值太小不能得到所有等效点 图 21将DMax[A 。
]值改为3.2 点击Complete Fragments
没有发生变化
点击complete f ragments 图22点击complete f ragm ents后的效果
下面,我们将把各面封闭起来。选择所有的原子,插入“dummy”原子(如图24),将“Connectivity”中“SiAl”和“?”(即“dummy”原子)的“Dmax”设为4.95(如图25),以“dummy”原子为中心,“SiAl”为配位原子做多面体如图26(此时所做多面体只把中心笼的面封闭起来,如图27)。
图23全选(Ctrl+A)并加入Dummy原子
图24 设置Al-?的DMax值
图25 以dummy为中心原子、SiAl为配位原子构建多面体
图26
选择任一六棱柱多面体的12个顶点原子(可以旋转模型,使得其中任一六棱柱多面体的棱平行于屏幕平面以方便选择),插入“dummy”原子(如图28),将“Connectivity”中“SiAl”和新插入的“dummy”原子的“Dmax”设为合适的值(如图32),以新插入的“dummy”原子为中心,“SiAl”为配位原子做多面体。这时只做出了一个多面体(如图33),下面把其余的三个配位多面体也做出来。当然,可以重复插入“dummy”原子做多面体,但这样要做很多重复劳动。此时也不能像在前面c60的例子中那样按“Complete Fragments”钮来把其余三个六棱柱多面体的中心插入“dummy”原子。但Diamond软件提供了一种方法可以帮助我们很容易做到这一点。
用“Filter”把除“dummy”原子外的所有原子都过滤掉,然后点“Build | Fixed Spheres”,在弹出的“Fixed Spheres”窗口中“Rmax”输入4,“Apply this function to”后选“All atoms in structure picture”,如下图。
点“OK”钮,在其余的三个六棱柱多面体的中心将都有“dummy”原子被插入。然后以新插入的“dummy”原子为中心做多面体。
图27 得到的配位多面体图图28 选中六棱柱的十二个顶点并插入一个Dummy原子
图29 RMax=2.5的效果图30 不撤销直接更改RMax的效果(图29、30是错误的,它们少了一步——没有建立六面体,就直接补全其他Dummy原子是不对)正确操作如下
图31 在Filter中选中SiAl和?
此步尤为关键,否则无法显示多面体
图32 适当大一点就行
图33 新建立的六棱柱多面体
图34 取消勾选
四项都得选
否则只会出一个
图
35
图 36 剩余dummy 全部出现
只出现一个
图37 显示SiAl原子和dummy原子
直接点击该按钮即可产生六
棱柱多面体
图38 选中dummy原子点击Add polyhedra按钮建立另一个多面体
氯化钠晶体 离子晶体 (1)NaCI晶胞中每个Na+等距离且最近的Cl-(即Na+配位数)为6个 (2) (3)NaCI晶胞中每个CI-等距离且最近的Na+(即CI-配位数)一个晶胞内由均摊法计算出一个晶胞内占有的Na+4个; 占有的CI-4个。 在该晶体中每个Na+周围与之最接近且距离相等的Na+ 与每个Na+等距离且最近的CI-所围成的空间几何构型为 CsCI晶体(注意:右侧小立方体为CsCI晶胞;左侧为8个晶胞) (1)CsCI晶胞中每个Cs+等距离且最近的C「(即Cs+配位 数)为8个 CsCI晶胞中每个CI-等距离且最近的Cs+(即CI-配位数)为 8个,这几个Cs+在空间构成的几何构型为正方体。 (2)在每个Cs+周围与它最近的且距离相等的Cs+有6个这 几个Cs+在空间构成的几何构型为正八面体。 ? Cs* OCI- (3)一个晶胞内由均摊法计算出一个晶胞内占有的Cs+ 1个;占有的CI- 1个CaF2晶体 (1))Ca2+立方最密堆积,F-填充在全部四面体空隙中。 (2)CaF2晶胞中每个Ca2+等距离且最近的F-(即Ca2+配位数)为8个CaF2晶胞中每个F-等距离且最近的Ca2+(即F-配位数)为4个 (3)一个晶胞内由均摊法计算出一个晶胞内占有的Ca2+4个; 占有的F-8个。 ZnS晶体: (1)1个ZnS晶胞中,有4 个S2「,有4个 Zn2+ (2)Zn2+的配位数为4个, S2_的配位数为4个 O£n?,?
原子晶体 (1) 金刚石晶体 a 每个金刚石晶胞中含有 8个碳原子,最小的碳环为 6元环,并且不在同一平面(实际为椅 式结 构),碳原子为sp 3杂化,每个C 以共价键跟相邻的_4_个 C 结合,形成正四面体。键角109° 28' b 、 每个碳原子被12个六元环共用,每个共价键被6个六元环共用 c 、 12g 金刚石中有2mol 共价键,碳原子与共价键之比为 (2) Si 晶体 由于Si 与碳同主族,晶体Si 的结构同金刚石的结构。将金刚石晶胞中的 C 原子全部换成Si 原 子,健长稍长些便可得到晶体硅的晶胞。 (3) 某些非金属化合物【SiO 2、SiC (金刚砂)、BN (氮化硼)、Si 3N 4等】 例如SiC 将金刚石晶胞中的一个C 原子周围与之连接的4个C 原子全部换成Si 原子, 键长稍长些便可得到SiC 的晶胞。(其中晶胞的8个顶点和6个面心为Si 原子,4个互不相邻的立方 体体心的为C 原子,反之亦可) a 每个SiC 晶胞中含有 4个硅原子,含有 A 个碳原子 b 、1mol SiC 晶体中有4mol Si —C 共价键 (4)SiO 2晶体:在晶体硅的晶胞中,在每2个Si 之间插入1个O 原子, 便可 得到SiO 2晶胞。 a 每个硅原子都采取sp 3杂化,与它周围的4个氧原子所形成的空间 结构为正四面体型,SiO 2 晶体中最小的环为 _J2_ 元环 b 、每个Si 原子被 亚个十二元环共用,每个 O 原子被_6_个 十二元环共用 c 、每个SiO 2晶胞中含有_8_个Si 原子,含有J6_个O 原子 d 、1mol Si O 2晶体中有_4 mol 共价键 (5)晶体硼 已知晶体硼的基本结构单元是由 B 原子构成的正二十面体,其中有 20个等边三角形的面和一定 数目的顶点,每个顶点各有一个 B 原子。通过观察图形及推算,可知此结构单元是由 12个B 原子构成,其中B —B 键间的夹角是 60 ° 。假设将晶体硼结构单元中每个顶角均削去,余下 部分 的结构与G 。相同,贝U Go 由_12_个正五边形和 20个正六边形构成。 金刚石 金刚石晶胞 金刚石晶胞分位置注释 Si O
几种常见晶体结构分析文档编制序号:[KK8UY-LL9IO69-TTO6M3-MTOL89-FTT688]
几种常见晶体结构分析 河北省宣化县第一中学 栾春武 邮编 075131 栾春武:中学高级教师,张家口市中级职称评委会委员。河北省化学学会会员。市骨干教师、市优秀班主任、模范教师、优秀共产党员、劳动模范、县十佳班主任。 联系电话: E-mail : 一、氯化钠、氯化铯晶体——离子晶体 由于离子键无饱和性与方向性,所以离子晶体中无单个分子存在。阴阳离子在晶体中按一定的规则排列,使整个晶体不显电性且能量最低。离子的配位数分析如下: 离子数目的计算:在每一个结构单元(晶胞)中,处于不同位置的微粒在该单元中所占的份额也有所不同,一般的规律是:顶点上的微粒属于该 单元中所占的份额为18,棱上的微粒属于该单元中所占的份额为1 4,面上 的微粒属于该单元中所占的份额为1 2,中心位置上(嚷里边)的微粒才完 全属于该单元,即所占的份额为1。 1.氯化钠晶体中每个Na +周围有6个Cl -,每个Cl -周围有6个Na +,与一个Na +距离最近且相等的Cl -围成的空间构型为正八面体。每个Na +周围与其最近且距离相等的Na +有12个。见图1。 图1 图2 NaCl
晶胞中平均Cl-个数:8×1 8 + 6× 1 2 = 4;晶胞中平均Na+个数:1 + 12×1 4 = 4 因此NaCl的一个晶胞中含有4个NaCl(4个Na+和4个Cl-)。 2.氯化铯晶体中每个Cs+周围有8个Cl-,每个Cl-周围有8个Cs+,与一个Cs+距离最近且相等的Cs+有6个。 晶胞中平均Cs+个数:1;晶胞中平均Cl-个数:8×1 8 = 1。 因此CsCl的一个晶胞中含有1个CsCl(1个Cs+和1个Cl-)。 二、金刚石、二氧化硅——原子晶体 1.金刚石是一种正四面体的空间网状结构。每个C 原子以共价键与4个C原子紧邻,因而整个晶体中无单 个分子存在。由共价键构成的最小环结构中有6个碳原 子,不在同一个平面上,每个C原子被12个六元环共用,每C—C键共6 个环,因此六元环中的平均C原子数为6× 1 12 = 1 2 ,平均C—C键数为 6×1 6 = 1。 C原子数: C—C键键数= 1:2; C原子数: 六元环数= 1:2。 2.二氧化硅晶体结构与金刚石相似,C被Si代替,C与C之间插 氧,即为SiO 2晶体,则SiO 2 晶体中最小环为12环(6个Si,6个O), 图3 CsCl 晶 图4 金刚石晶
第二章作业 2-1 常见的金属晶体结构有哪几种它们的原子排列和晶格常数有什么特点 V、Mg、Zn 各属何种结构答:常见晶体结构有 3 种:⑴体心立方:-Fe、Cr、V ⑵面心立方:-Fe、Al、Cu、Ni ⑶密排六方:Mg、Zn -Fe、-Fe、Al、Cu、Ni、Cr、 2---7 为何单晶体具有各向异性,而多晶体在一般情况下不显示出各向异性答:因为单晶体内各个方向上原子排列密度不同,造成原子间结合力不同,因而表现出各向异性;而多晶体是由很多个单晶体所组成,它在各个方向上的力相互抵消平衡,因而表现各向同性。第三章作业3-2 如果其它条件相同,试比较在下列铸造条件下,所得铸件晶粒的大小;⑴金属模浇注与砂模浇注;⑵高温浇注与低温浇注;⑶铸成薄壁件与铸成厚壁件;⑷浇注时采用振动与不采用振动;⑸厚大铸件的表面部分与中心部分。答:晶粒大小:⑴金属模浇注的晶粒小⑵低温浇注的晶粒小⑶铸成薄壁件的晶粒小⑷采用振动的晶粒小⑸厚大铸件表面部分的晶粒小第四章作业 4-4 在常温下为什么细晶粒金属强度高,且塑性、韧性也好试用多晶体塑性变形的特点予以解释。答:晶粒细小而均匀,不仅常温下强度较高,而且塑性和韧性也较好,即强韧性好。原因是:(1)强度高:Hall-Petch 公式。晶界越多,越难滑移。(2)塑性好:晶粒越多,变形均匀而分散,减少应力集中。(3)韧性好:晶粒越细,晶界越曲折,裂纹越不易传播。 4-6 生产中加工长的精密细杠(或轴)时,常在半精加工后,将将丝杠吊挂起来并用木锤沿全长轻击几遍在吊挂 7~15 天,然后再精加工。试解释这样做的目的及其原因答:这叫时效处理一般是在工件热处理之后进行原因用木锤轻击是为了尽快消除工件内部应力减少成品形变应力吊起来,是细长工件的一种存放形式吊个7 天,让工件释放应力的时间,轴越粗放的时间越长。 4-8 钨在1000℃变形加工,锡在室温下变形加工,请说明它们是热加工还是冷加工(钨熔点是3410℃,锡熔点是232℃)答:W、Sn 的最低再结晶温度分别为: TR(W) =(~×(3410+273)-273 =(1200~1568)(℃)>1000℃ TR(Sn) =(~×(232+273)-273 =(-71~-20)(℃) <25℃ 所以 W 在1000℃时为冷加工,Sn 在室温下为热加工 4-9 用下列三种方法制造齿轮,哪一种比较理想为什么(1)用厚钢板切出圆饼,再加工成齿轮;(2)由粗钢棒切下圆饼,再加工成齿轮;(3)由圆棒锻成圆饼,再加工成齿轮。答:齿轮的材料、加工与加工工艺有一定的原则,同时也要根据实际情况具体而定,总的原则是满足使用要求;加工便当;性价比最佳。对齿轮而言,要看是干什么用的齿轮,对于精度要求不高的,使用频率不高,强度也没什么要求的,方法 1、2 都可以,用方法 3 反倒是画蛇添足了。对于精密传动齿轮和高速运转齿轮及对强度和可靠性要求高的齿轮,方法 3 就是合理的。经过锻造的齿坯,金属内部晶粒更加细化,内应力均匀,材料的杂质更少,相对材料的强度也有所提高,经过锻造的毛坯加工的齿轮精度稳定,强度更好。 4-10 用一冷拔钢丝绳吊装一大型工件入炉,并随工件一起加热到1000℃,保温后再次吊装工件时钢丝绳发生断裂,试分析原因答:由于冷拔钢丝在生产过程中受到挤压作用产生了加工硬化使钢丝本身具有一定的强度和硬度,那么再吊重物时才有足够的强度,当将钢丝绳和工件放置在1000℃炉内进行加热和保温后,等于对钢丝绳进行了回复和再结晶处理,所以使钢丝绳的性能大大下降,所以再吊重物时发生断裂。 4-11 在室温下对铅板进行弯折,越弯越硬,而稍隔一段时间再行弯折,铅板又像最初一样柔软这是什么原因答:铅板在室温下的加工属于热加工,加工硬化的同时伴随回复和再结晶过程。越弯越硬是由于位错大量增加而引起的加工硬化造成,而过一段时间又会变软是因为室温对于铅已经是再结晶温度以上,所以伴随着回复和再结晶过程,等轴的没有变形晶粒取代了变形晶粒,硬度和塑性又恢复到了未变形之前。第五章作业 5-3 一次渗碳体、二次渗碳体、三次渗碳体、共晶渗碳体、共析渗碳体异同答:一次渗碳体:由液相中直接析出来的渗碳体称为一次渗碳体。二次渗碳体:从 A 中析出的渗碳体称为二次渗碳体。三次渗碳体:从 F 中析出的渗碳体称为三次渗碳体共晶渗碳体:经共晶反应生成的渗碳体即莱氏体中的渗碳体称为共晶渗碳体共析渗碳体:经共析反应生成的渗碳体即珠光体中的渗
典型晶体晶胞结构1.原子晶体 (金刚石 ) 2.分子晶体
3.离子晶体 + Na - Cl
4.金属晶体 堆积模型简单立方钾型镁型铜型典型代表Po Na K Fe Mg Zn Ti Cu Ag Au 配位数 6 8 12 12 晶胞 5.混合型晶体——石墨 1.元素是Cu 的一种氯化物晶体的晶胞结构如图 13 所示,该氯化物的化学 式,它可与浓盐酸发生非氧化还原反应,生成配合物H n WCl 3,反应的化 学方程式为。 2.( 2011 山东高考)CaO 与NaCl 的晶胞同为面心立方结构,已知CaO 晶体密度为ag·cm-3,N A表示阿伏加德罗常数,则CaO 晶胞体积为cm3。 2.( 2011 新课标全国)六方氮化硼BN 在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚 石相当,晶苞边长为361.5pm ,立方氮化硼晶胞中含有______各氮原子、 ________各硼原子,立方氮化硼的密度是_______g ·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为N A)。
解析:描述晶体结构的基本单元叫做晶胞,金刚石晶胞是立方体,其中8 个顶点有8 个碳原子, 6 个面各有 6 个碳 原子,立方体内部还有 4 个碳原子,如图所示。所以金刚石的一个晶胞中含有的碳原子数= 8×1/8+6 ×1/2+4=8 ,因此立方氮化硼晶胞中应该含有 4 个 N 和 4 个 B 原子。由于立方氮化硼的一个晶胞中含有 4 个 4 25g 是,立方体的体积是(361.5cm)3,因此立方氮化硼的密度是 N 和 4 个 B 原子,其质量是 1023 6.02 g·cm-3。 3.( 4)元素金( Au )处于周期表中的第六周期,与Cu 同族, Au 原子最外层电子排布式为______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu 原子处于面心, Au 原子处于顶点位置,则该合金中Cu 原子与 Au 原子数量之比为 _______;该晶体中,原子之间的作用力是________; ( 5)上述晶体具有储氢功能,氢原子可进入到由Cu 原子与 Au 原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为_____。 4.( 2010 山东卷)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心, O2-处于晶胞棱边中心,该化合物化学式为,每个 Ba2+与个 O2-配位。 5.(4) CaC2晶体的晶胞结构与NaCl晶体的相似(如右图所示),但 CaC2晶体中含有的中哑 铃形 C 22 的存在,使晶胞沿一个方向拉长。CaC 2晶体中1个 Ca 2 周围距离最近的 C 22 数目 为。 6.( 09 江苏卷 21 A )③在 1 个 Cu2O 晶胞中(结构如图所示),所包含的Cu 原子数目 为。
学生版:典型晶体模型 晶体晶体结构晶体详解 原子晶体 金 刚石 (1)每个碳与相邻个碳以共价键 结合, 形成体结构 (2)键角均为 (3)最小碳环由个C组成且六个原子不 在同一个平面内 (4)每个C参与条C—C键的形成,C 原子数与C—C键数之比为 S iO 2 (1)每个Si与个O以共价键结合,形成正 四面体结构 (2)每个正四面体占有1个Si,4个“ 1 2 O”,n(Si)∶n(O)= (3)最小环上有个原子,即个O,个 Si 分子晶体 干 冰 (1)8个CO 2 分子构成立方体且在6个面心 又各占据1个CO 2 分子 (2)每个CO 2 分子周围等距紧邻的 CO 2 分子 有个 冰 每个水分子与相邻的个水分子,以 相连接,含1 mol H 2 O的冰中,最多可形成 mol“氢键”。 N aCl(型) 离 子晶 体 (1)每个Na+(Cl-)周围等距且紧邻的 Cl-(Na+)有个。每个Na+周围等距且紧邻 的 Na+有个 (2)每个晶胞中含个Na+和个Cl-
C sCl (型) (1)每个Cs+周围等距且紧邻的Cl-有个,每个Cs+(Cl-)周围等距且紧邻的Cs+(Cl-) 有个 (2)如图为个晶胞,每个晶胞中含 个Cs+、个Cl- 金属晶体 简 单六 方堆 积 典型代表Po,配位数为,空间利用率 52% 面 心立 方 最 密堆 积 又称为A 1 型或铜型,典型代表, 配位数为,空间利用率74% 体 心立 方 堆 积 又称为A 2 型或钾型,典型代表, 配位数为,空间利用率68% 六 方最 密 堆 积 又称为A 3 型或镁型,典型代表, 配位数为,空间利用率74% 混合晶体石墨 (1)石墨层状晶体中, 层与层之间的作用是 (2)平均每个正六边形 拥有的碳原子个数是,C
氯化钠晶体 (1)NaCl晶胞中每个Na+等距离且最近的Cl-(即Na+配位数)为6个 NaCl晶胞中每个Cl-等距离且最近的Na+(即Cl-配位数)为6个 (2)一个晶胞内由均摊法计算出一个晶胞内占有的Na+4_个; 占有的Cl-4个。 (3)在该晶体中每个Na+周围与之最接近且距离相等的Na+共有12个; 与每个Na+等距离且最近的Cl-所围成的空间几何构型为正八面体 CsCl晶体(注意:右侧小立方体为CsCl晶胞;左侧为8个晶胞) (1)CsCl晶胞中每个Cs+等距离且最近的Cl-(即Cs+配位数) 为8个 CsCl晶胞中每个Cl-等距离且最近的Cs+(即Cl-配位数) 为8个,这几个Cs+在空间构成的几何构型为正方体。 (2)在每个Cs+周围与它最近的且距离相等的Cs+有6个 这几个Cs+在空间构成的几何构型为正八面体。 (3)一个晶胞内由均摊法计算出一个晶胞内占有的Cs+ 1个;占有的Cl- 1个。 CaF2晶体 (1))Ca2+立方最密堆积,F-填充在全部四面体空隙中。 (2)CaF2晶胞中每个Ca2+等距离且最近的F-(即Ca2+配位数)为8个CaF2晶胞中每个F-等距离且最近的Ca2+(即F-配位数)为4个 (3)一个晶胞内由均摊法计算出一个晶胞内占有的Ca2+4个; 占有的F-8个。 ZnS晶体: (1)1个ZnS晶胞中,有4个S2-,有4个Zn2+。 (2)Zn2+的配位数为4个,S2-的配位数为 4个。
Si O 金刚石 金刚石晶胞 金刚石晶胞分位置注释 (1)金刚石晶体 a 、每个金刚石晶胞中含有8个碳原子,最小的碳环为6元环,并且不在同一平面(实际为椅 式结构),碳原子为sp 3杂化,每个C 以共价键跟相邻的_4_个C 结合,形成正四面体。键角109°28’ b 、每个碳原子被12个六元环共用,每个共价键被6个六元环共用 c 、12g 金刚石中有2mol 共价键,碳原子与共价键之比为 1:2 (2)Si 晶体 由于Si 与碳同主族,晶体Si 的结构同金刚石的结构。将金刚石晶胞中的C 原子全部换成Si 原子,健长稍长些便可得到晶体硅的晶胞。 (3)某些非金属化合物【SiO 2、SiC (金刚砂)、BN (氮化硼)、Si 3N 4等】 例如SiC 将金刚石晶胞中的一个C 原子周围与之连接的4个C 原子全部换成Si 原子, 键长稍长些便可得到SiC 的晶胞。(其中晶胞的8个顶点和6个面心为Si 原子,4个互不相邻的立方体体心的为C 原子,反之亦可) a 、每个SiC 晶胞中含有 4 个硅原子,含有 4 个碳原子 b 、1mol SiC 晶体中有4 mol Si —C 共价键 (4)SiO 2 晶体:在晶体硅的晶胞中,在每2个Si 之间插入1个O 原子, 便可得到SiO 2晶胞。 a 、每个硅原子都采取sp 3杂化,与它周围的4个氧原子所形成的空间 结构为__正四面体_型,S iO 2晶体中最小的环为 12 元环 b 、每个Si 原子被 12 个十二元环共用,每个O 原子被 6 个 十二元环共用 c 、每个SiO 2晶胞中含有 8 个Si 原子,含有 16 个O 原子 d 、1mol Si O 2晶体中有 4 mol 共价键 (5)晶体硼 已知晶体硼的基本结构单元是由B 原子构成的正二十面体,其中有20个等边三角形的面和一定数目的顶点,每个顶点各有一个B 原子。通过观察图形及推算,可知此结构单元是由__12_个B 原子构成,其中B —B 键间的夹角是__60°__。假设将晶体硼结构单元中每个顶角均削去,余下部分的结构与C 60相同,则C 60由_12_个正五边形和_20个正六边形构成。
常见晶胞模型
氯化钠晶体 (1)NaCl晶胞中每个Na+等距离且最近的Cl-(即Na+配位数)为6个 NaCl晶胞中每个Cl-等距离且最近的Na+(即Cl-配位数)为6个 (2)一个晶胞内由均摊法计算出一个晶胞内占有的Na+4_个; 占有的Cl-4个。 (3)在该晶体中每个Na+周围与之最接近且距离相等的Na+共有12个; 与每个Na+等距离且最近的Cl-所围成的空间几何构型为正八面体 CsCl晶体(注意:右侧小立方体为CsCl晶胞;左侧为8个晶胞) (1)CsCl晶胞中每个Cs+等距离且最近的Cl-(即Cs+配位数) 为8个 CsCl晶胞中每个Cl-等距离且最近的Cs+(即Cl-配位数) 为8个,这几个Cs+在空间构成的几何构型为正方体。 (2)在每个Cs+周围与它最近的且距离相等的Cs+有6个 这几个Cs+在空间构成的几何构型为正八面体。 (3)一个晶胞内由均摊法计算出一个晶胞内占有的Cs+ 1个;占有的Cl- 1个。CaF2晶体 (1))Ca2+立方最密堆积,F-填充在全部四面体空隙中。 (2)CaF2晶胞中每个Ca2+等距离且最近的F-(即Ca2+配位数)为8个CaF2晶胞中每个F-等距离且最近的Ca2+(即F-配位数)为4个 (3)一个晶胞内由均摊法计算出一个晶胞内占有的Ca2+4个; 占有的F-8个。 ZnS晶体: (1)1个ZnS晶胞中,有4个S2-,有4个Zn2+。 (2)Zn2+的配位数为4个,S2-的配位数为 4个。
金刚石 金刚石晶胞 金刚石晶胞分位置注释 (1)金刚石晶体 a 、每个金刚石晶胞中含有8个碳原子,最小的碳环为6元环,并且不在同一平面(实 际为椅式结构),碳原子为sp 3杂化,每个C 以共价键跟相邻的_4_个C 结合,形成 正四面体。键角 109°28’ b 、每个碳原子被12个六元环共用,每个共价键被6个六元环共用 c 、12g 金刚石中有2mol 共价键,碳原子与共价键之比为 1:2 (2)Si 晶体 由于Si 与碳同主族,晶体Si 的结构同金刚石的结构。将金刚石晶胞中的C 原子全部换成Si 原子,健长稍长些便可得到晶体硅的晶胞。 (3)某些非金属化合物【SiO 2、SiC (金刚砂)、BN (氮化硼)、Si 3N 4等】 例如SiC 将金刚石晶胞中的一个C 原子周围与之连接的4个C 原子全部换成Si 原 子, 键长稍长些便可得到SiC 的晶胞。(其中晶胞的8个顶点和6个面心为Si 原子,4个互 不相邻的立方体体心的为C 原子,反之亦可) a 、每个SiC 晶胞中含有 4 个硅原子,含有 4 个碳原子 b 、1mol SiC 晶体中有4 mol Si —C 共价键 (4)SiO 2 晶体:在晶体硅的晶胞中,在每2个Si 之间插入1个O 原子, 便可得到SiO 2晶胞。 a 、每个硅原子都采取sp 3杂化,与它周围的4个氧原子所形成的空间 结构为__正四面体_型,SiO 2晶体中最小的环为 12 b 、每个Si 原子被 12 个十二元环共用,每个O 原子被 6 个 十二元环共用 c 、每个SiO 2晶胞中含有 8 个Si 原子,含有 16 个O 原子 d 、1mol Si O 2晶体中有 4 mol 共价键 ( 5)晶体硼
§1-2 常见的晶体结构及其原胞、晶胞 1) 简单晶体的简单立方(simple cubic, sc) 它所构成的晶格为布喇菲格子。例如氧、硫固体。基元为单一原子结构的晶体叫简单晶体。其特点有: 三个基矢互相垂直( ),重复间距相等,为a,亦称晶格常数。其晶胞=原胞;体积= ;配位数(第一近邻数) =6。(见图1-7) 图1-7简单立方堆积与简单立方结构单元 2) 简单晶体的体心立方 ( body-centered cubic, bcc ) , 例如,Li,K,Na,Rb,Cs,αFe,Cr,Mo,W,Ta,Ba等。其特点有:晶胞基矢 , 并且 ,其惯用原胞基矢由从一顶点指向另外三个体心点的矢量构成:(见图1-9 b) (1-2) 其体积为
;配位数=8; (见图1-8) 图1-8体心立方堆积与体心立方结构单元 图1-9简单立方晶胞(a)与体心立方晶胞、惯用原胞(b) 3) 简单晶体的面心立方 ( face-centered cubic, fcc ) , 例如,Cu,Ag,Au,Ni,Pd,Pt,Ne, Ar, Xe, Rn, Ca, Sr, Al等。晶胞基矢 ,并且 每面中心有一格点, 其原胞基矢由从一顶点指向另外三个面心点的矢量构成(见图1-10 b):
(1-3) 其体积= ;配位数=12。 ,(见图1-10) 图1-10面心立方结构(晶胞)(a)与面心立方惯用原胞(b) 4) NaCl结构(Sodium Chloride structure),复式面心立方(互为fcc),配位数=6(图1-11 a)。 表1-1 NaCl结构晶体的常数 5) CsCl结构(Cesuim Chloride structure),复式简单立方(互为sc),配位数=8(图1-11 b)。 表1-2 CsCl结构晶体的常数
认识晶体第二课时 三、晶体结构堆积模型 (金属键、离子键、范德华力均没有方向性,所以组成金属晶体、离子晶体、分子晶体的微粒服从紧密堆积堆积原理,降低体系能量,使晶体变得比较稳定) 1、等径圆球的密堆积 ①等径圆球在一列上紧密堆积的方式只有一种,所有的圆球都在一条直线上排列 ②等径圆球在一个平面上最紧密堆积的方式只有一种,每个等径圆球与周围其它6个球接触,形成层称为密置层 ③类型:金属晶体结构为等径原子密堆积 A3型最密堆积(六方最密堆积)ABAB A1型最密堆积(面心立方最密堆积)ABCABC A2型密堆积(体心立方密堆积) 配位数:在密堆积中,一个原子或离子周围所邻接的原子或离子的数目 A3型最密堆积配位数12 同层6 上下层各3 A1型最密堆积配位数12 同层6 上下层各3 2、非等径圆球的密堆积 ①离子晶体可视作非等径圆球密堆积,大球先按一定方式做等径圆球密堆积,小球再填充在大球所形成的空隙中。NaCl、ZnS是A1型最密堆积 ②分子晶体,原子以共价键形成分子,分子再以分子间作用力形成晶体,由于范德华力没有方向性和饱和性,故此分子尽可能采取紧密堆积,但分子的排列方式与分子的形状有关 ③原子晶体堆积方式:不服从紧密堆积方式 原因:共价键具有方向性和饱和性,因此就决定了一个原子周围的其它原子数目不仅是有限的而且堆积方向是一定的,所有不是密堆积 晶体的特性和晶体结构的堆积模型 1.下列关于晶体和非晶体的本质区别的叙述中正确的是( )
A.是否具有规则几何外形的固体 B.是否具有固定组成的物质 C.是否具有美观对称的外形 D.内部基本构成微粒是否按一定规律做周期性重复排列 2.下列说法错误的是( ) A.同一物质有时可以是晶体,有时可以是非晶体 B.区分晶体和非晶体最可靠的科学方法是确定有没有固定熔点 C.雪花是水蒸气凝华得到的晶体 D.溶质从溶液中析出可以得到晶体 3.关于晶体的自范性,下列叙述正确的是( ) A.破损的晶体能够在固态时自动变成规则的多面体 B.缺角的氯化钠晶体在饱和NaCl溶液中慢慢变为完美的立方体块 C.圆形容器中结出的冰是圆形的体现了晶体的自范性 D.由玻璃制成规则的玻璃球体现了晶体的自范性 4.下列途径不能得到晶体的是( ) A.熔融态SiO2快速冷却 B.熔融态SiO2热液缓慢冷却 C.FeCl3蒸气冷凝 D.CuSO4饱和溶液蒸发浓缩后冷却 5.将晶体分为离子晶体、金属晶体、原子晶体和分子晶体的本质标准是( ) A.基本构成的微粒种类 B.晶体中最小重复结构单元的种类 C.微观粒子的密堆积种类 D.晶体内部微粒的种类及微粒间相互作用的种类 6.下列叙述正确的是( ) A.任何晶体中,若含有阳离子也一定含有阴离子 B.离子晶体中可能含有共价键 C.离子晶体中只含有离子键不含有共价键 D.分子晶体中只存在分子间作用力,不含有其他化学键7.金属原子在二维空间里的放置有下图所示的两种方式,下列说法不正确的是( ) A.图a为密置 B.图b为非密置层 C.图a配位数为6 D.图b配位数为6 8.(2019·邢台一中月考)(1)在下列物质中,__________(填序号,下同)是晶体,______________是非晶体。 ①塑料②明矾③松香④玻璃⑤CuSO4·5H2O⑥冰糖⑦石蜡⑧单晶硅⑨铝块⑩橡胶 (2)晶体和非晶体在外形上有差别,晶体一般都具有____________________,而非晶体__________________;另外非晶体具有物理性质______________的特点,而晶体具有物理性质__________________的特点。9.(1)根据下图回答问题。
第一节认识晶体 第2课时晶体结构的堆积模型 【教学目标】 1.了解最基本的两种类型(A1 A3)的等径圆球的密堆积型式 2.知道离子晶体的可视为不等径圆球的密堆积 【教学重难点】 了解最基本的两种类型(A1 A3)的等径圆球的密堆积型式 【教学方法】探究法 【教学过程】 【新课引入】 【问题】晶体具有规则的几何外形是有什么决定的? 【回答】晶体的内部微粒按一定的规律周期性重复排列。 【联想质疑】晶体具有的规则几何外形源于组成晶体的微粒按一定规律周期性地重复排列。 那么晶体中的微粒是如何排列的?如何认识晶体内部微粒排列的规律性? 【板书】二、晶体结构的堆积模型 我们先来探讨金属晶体的内部结构 【讲述】密堆积:由无方向性的金属键、离子键和范德华力等结合的晶体中,原子、离子或分子等微观粒子总是趋向于相互配位数高,能充分利用空间的堆积密度最大的那些结构。 密堆积方式因充分利用了空间,而使体系的势能尽可能降低,而结构稳定。 1.等径圆球的密堆积 【活动探究】把乒乓球装入盒中,盒中的乒乓球怎样排列才能使装入的乒乓球数目最多? 【活动提示】 (1)将小球先排成列,然后排成一层,认真观察每一个小球周围最多排几个小球,有几个空隙。(2)将球扩展到两层有几种方式,认真观察两层球形成的空隙种类。 (3)扩展到三层,有几种排列方式,并寻找重复性排列的规律。 【思考】 1. 将等径圆球在一列上的最紧密排列有几种?如何排列? 2.等径圆球在同一平面上的堆积方式是唯一的吗?最紧密堆积有几种排列?在最紧密堆积方式中每个等径圆球与周围几个球相接触?
【板书】密置层:在同一平面上,每个等径圆球与周围其它六个球相接触形成最紧密堆积方式 【思考】取A、B两个密置层,将B层放在A层的上面,有几种堆积方式?最紧密的堆积方式是哪种?它有何特点? 【讲述】 1.在第一层上堆积第二层时,要形成最密堆积,必须把球放在第二层的空隙上。这样,仅有半数的三角形空隙放进了球,而另一半空隙上方是第二层的空隙。 2.第一层上放了球的一半三角形空隙,被4个球包围,形成四面体空隙;另一半其上方是第二层球的空隙,被6个球包围,形成八面体空隙。 【板书】密置双层:将B层放在A层上面时,两层平行地错开,使B层每个球的球心恰好对应于A层中相邻三个球所围成的空隙中心,并使两层紧密接触 【思考】如果将密置层C放在刚才堆成的密置双层的上面,有几种最密堆积方式?如何堆积? 【讲述】第二层堆积时形成了两种空隙:四面体空隙和八面体空隙。那么,在堆积第三层时就会产生两种方式: 1.第三层等径圆球的突出部分落在正四面体空隙上,其排列方式与第一层相同,但与第二层错开,形成ABAB…堆积。这种堆积方式可以从中划出一个六方单位来,所以称为六方最密堆积(A3)。 2.另一种堆积方式是第三层球的突出部分落在第二层的八面体空隙上。这样,第三层与第一、第二层都不同而形成ABCABC…的结构。这种堆积方式可以从中划出一个立方面心单位来,所以称为面心立方最密堆积(A1)。 【讲述】一个原子或离子周围所邻接的原子或离子数目叫配位数。 【小结】 由于金属键没有方向性和饱和性,每个金属原子周围总是尽可能多的与邻近金属原子密堆积在一起,以使能量达到最低。 金属晶体的结构型式可以归结为等径圆球密堆积。 事实上,大部分金属采用最密堆积方式,例如金属镁就属于A3型密堆积,金属铜就属于A1型密堆积。只有少数金属采用非密堆积的方式。金属采取哪种堆积方式可以通过X射线衍射实验证实。 【过渡】构成离子晶体的微粒是什么?它们的作用力是什么? 离子键的特点? 【回答】阳离子和阴离子,通过离子键(静电引力)结合。没有方向性和饱和性。 【启发】对比金属晶体的结构,阳离子和阴离子之间怎样排列最稳定? 【讲解】阳、阴离子也是球对称的。但阳、阴离子半径不同,一般情况下阴离子的半径比阳离子的半径大。因此,离子晶体的结构可以看做不等径圆球密堆积。
二、剪纸晶体模型 剪纸晶体模型材料最为便宜,制作最为简便,如果设计得当,依然可以收到良好效果。根据模型的大小,剪纸晶体模型即可作为演示教具,又可作为学生学习自用,若将多个小晶胞模型规则堆砌,还可构成晶体的整体结构模型。所以剪纸晶体模型的制作应是一种大加提倡的制作。剪纸模型的不足是立体感稍差,表示晶体内部结构较困难。 制作用纸要注意尽可能选择坚韧、平滑、挺括、薄厚适宜,自用的小模型用纸较薄,大个的演示模型要足够厚(如2mm)。可废物利用,旧挂历、纸盒等都可作为制作用纸。 剪纸晶体模型制作步骤大致如下: 设计和制图根据使用方式设计尺寸。在一张白纸上精确绘出欲制作模型的平面展示图,对于晶胞中不同种的原子或离子可根据半径的相对大小画出半径不等的圆,并涂上不同的颜色或剪贴上不同颜色的电光纸,以使模型更加醒目和美观。此外设计时还要尽可能地使模型能够反映出晶胞内部的结构。要注意留出贴接部分。下面给出常见晶胞剪板模型的平面展开图,可供选用或设计参考。 剪裁将平面展示图粘在选好的厚纸上,用剪刀或刻刀将图形沿着外围线剪好,需折叠的线用剃须刀片沿折痕线在纸上轻刻,深度要适宜,不可超过纸的厚度的1/2处,刻线时要用直尺比着准确刻划。 折叠沿折痕线将展开图按需要折叠。要注意折叠的方向,不可在一条折痕线上向两个方面反复折叠。 粘接用普通胶水或乳胶粘接均可,粘接的顺序是先内部后外部,有些展开图上的英文字母表示哪些部分间相互粘接,粘接内部时方向不要粘反,待各个部分确实粘牢后再封口,对于有内部结构的剪纸模型要留出一面不要粘接以便观察。 整理和修饰粘接完毕后经适当的修整即可使用。
现行的高中教材(必修·必修加选修共三册)中有家庭小实验17个,其中制作分子模型、晶体模型共3个。通过制作这些模型,对学生加深理解物质的分子结构、晶体结构,特别是对同分异构体、同素异形体的理解大有裨益。但书本上所提供的制作材料捏出的球的大小、球体表面光滑程度均不好掌握。而一种弹性球能很好地解决上述问题。弹性球有透明、不透明和半透明三种,有的球内还镶有小装饰物。球的直径从25~35mm不等,它弹性好、色彩艳丽、加工容易,制作出来的模型逼真。具体操作如下:材料准备不同直径、不同颜色弹球;两头削尖的且长短不一、颜色各异的牙签或两头磨尖的铁丝;万能胶胶水或502胶水;小刀。制作过程1球棍模型以甲烷为例,取直径为35mm的红色球一枚,把4根牙签分别插入红色球体内,牙签之间的夹角约109,°再把4个直径为25mm的蓝球分别插进牙签的另一端。在牙签与球的连接处均滴上2~3滴502胶水,几分钟后,它们就会牢牢的粘在一起,漂亮的甲烷分子模型就大功告成了。