
第十四章d区元素(二)
14.1 金属羰基配合物 (1)
14.2 分子氮配合物 (5)
14.3 烯、炔烃π-配合物 (7)
14.5 过渡金属原子簇化合物简介 (9)
14.1 金属羰基配合物
14.1.1 概述
d区元素(二)
一、金属羰基配合物
1.概述
金属羰基配合物是由过渡金属与配位体一氧化碳所形成的一类配合物。金属羰基配合物有三个特点:
①一氧化碳并不是一个很强的路易斯碱,但它却能够跟金属形成很强的化学键。例如,在Fe(CO)5中,Fe-C键长分别为181.0pm(轴向)和183.3pm(赤道方向),平均键能为118kJ/mol。
②在这类配合物中,中心原子总是呈现出较低的氧化态,通常氧化态为0,也有时呈现出较低的正氧化态甚至负氧化态。
③这些配合物大多数(99%)服从有效原子序数规则。
最早发现的羰基配合物是四羰基合镍Ni(CO)4。
1891年,A.Mond还发现一氧化碳在500K和20Mpa*(200大气压)压力下通过还原铁粉也能较容易地得到五羰基合铁。
Fe + CO →Fe(CO)5
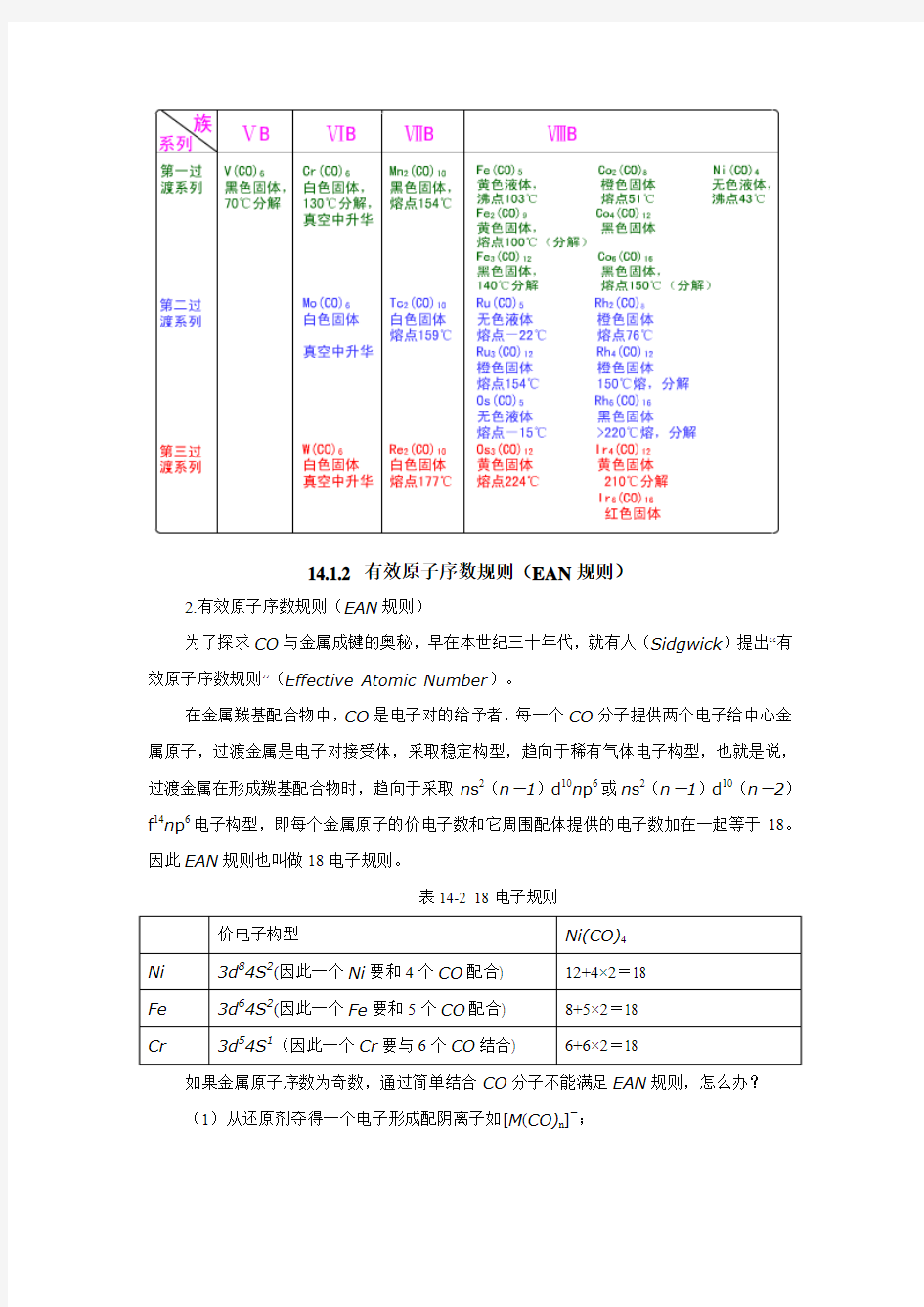
继羰基镍及羰基铁被发现以后又陆续制得了许多其它过渡金属羰基化合物。某些典型实例列于下表14-1中:
表14-1 某些稳定的二元羰基化合物
14.1.2 有效原子序数规则(EAN规则)
2.有效原子序数规则(EAN规则)
为了探求CO与金属成键的奥秘,早在本世纪三十年代,就有人(Sidgwick)提出“有效原子序数规则”(Effective Atomic Number)。
在金属羰基配合物中,CO是电子对的给予者,每一个CO分子提供两个电子给中心金属原子,过渡金属是电子对接受体,采取稳定构型,趋向于稀有气体电子构型,也就是说,过渡金属在形成羰基配合物时,趋向于采取n s2(n-1)d10n p6或n s2(n-1)d10(n-2)f14n p6电子构型,即每个金属原子的价电子数和它周围配体提供的电子数加在一起等于18。因此EAN规则也叫做18电子规则。
表14-2 18电子规则
如果金属原子序数为奇数,通过简单结合CO分子不能满足EAN规则,怎么办?
(1)从还原剂夺得一个电子形成配阴离子如[M(CO)n]-;
(2)含有奇数电子的金属配合物中间体跟其它含有一个未成对电子的原子或基团以共价键结合。例如生成HM(CO)n和M(CO)n Cl。
(3)如果没有其它的奇电子组分可以结合,含有奇数电子的配合物中间体可以彼此结合形成二聚体。例如Co原子序数是27,它跟4个CO分子彼此结合后,核外的电子总数为35,未能满足EAN规则要求,但它形成二聚体后,由于与另一Co原子共用一对电子,形成Co-Co金属键,这时Co原子核外的电子总数便为36,符合EAN规则。
然而,EAN规则只是对金属羰基配合物符合得比较好,对其它有机金属化合物和高度聚合的羰基配合物,符合得比较差。如V(CO)6就是一个特例,V(CO)6是顺磁性化合物,V 原子一共拥有35个电子,预料应形成稳定的V2(CO)12。实际上V2(CO)12还不如V(CO)6稳定。当形成V2(CO)12时,V的配位数为7,配位体分布过于拥紧,配位体之间的排斥作用超过二聚体中的V-V弱成键作用。然而,V(CO)6还是比一般符合18电子规则的羰基化合物不稳定。例如,容易从还原剂夺取一个电子变成[(CO)6]-离子:
Na+V(CO)6--→Na++[V(CO)6]-
14.1.3 羰基配合物中的化学键
(1).单核羰基配合物
以Ni(CO)4为例:
当CO与金属原子键合时,其σ2p上的电子对与中心原子的空的SP3杂化轨道形成σ键。而空的π2p*又可以和金属原子充满电子的d轨道重叠形成反馈π键,所以,在Ni(CO)4中化学键为σ-π配键。
一方面,CO把一对电子填入Ni的sp3杂化轨道中形成σ键,一方面又以空的π2p*轨道接受来自Ni的d轨道的电子,形成π键,从而增加配合物的稳定性,但削弱了CO内部成键,活化CO分子。
(2)多核羰基配合物
前面提到,对于原子序数为奇数的金属,在形成羰基配合物时,为了满足EAN规则,金属与金属相互结合形成二聚体。例如Mn2(CO)10和Co2(CO)8。分子中含有多于一个金属原子的羰基配合物叫做多核羰基配合物。在多核羰基配合物的结构中,有两点值得注意:
a、CO可以有两种不同的方式与金属相结合。
第一种:CO分子以其碳原子一端与金属配位,这与单核羰基配合物的情况相同,以这种方式结合的CO分子成为端基分子。第二种:CO以桥基方式与两个或更多个金属相联。
b、在多核羰基配合物中,金属与金属原子之间有共价键形成。
例如,在Fe2(CO)9中,实验证明两个铁原子被3个桥联式羰基联结起来。此外,每个铁原子又分别与三个端式羰基相连,两个铁原子的距离相当近,说明他们之间有共价键形成。
14.1.4 金属羰基配合物的性质和应用
4.金属羰基配合物的性质
单核羰基配合物多为无色物质,而多核配合物为带色物质,而且他们的颜色随着分子中金属原子的数目增加而逐渐加深。例如: Fe(CO)5是浅黄色液体,Fe2(CO)9是金黄色的固体。而Fe3(CO)12便呈现很深的墨绿色。
铁系元素的单核羰基配合物常温下为液体,其余均为固体。固体的羰基配合物熔点低,易升华,它们都是典型的共价化合物。易溶于非极性溶剂中[Fe2(CO)9例外],并易分解为金属和CO。
羰基配合物具有各种各样的反应,其主要类型的反应有:
(1)形成羰合酸阴离子的反应
羰基配合物与碱的反应:
(2)氧化-还原反应:
Mn2(CO)10 + Cl2→2Mn(CO)5Cl
(3)取代反应
这是最重要的一类反应,取代基可以是PF3、PCl3、SbCl3、PPh3、AsPh3和NO、Cl -等。
Fe(CO)5 + PPh3→(Ph3P)Fe(CO)4 + CO
5、金属羰基配合物的应用
(1)利用羰基配合物制备纯金属
如制备纯铁,首先使铁生成挥发性的五羰基合铁,与杂质分离,然后把五羰基合铁蒸气喷入用辐射加热至200多度的容器内进行分解,以制得纯铁,这种铁适合于制作磁铁芯和催化剂。
(2)羰基配合物可以做抗爆剂
(3)可以做为活性高,选择性好的新型催化剂,在工业生产中发挥很大作用
如甲醇合成醋酸,在过去生产中,需要6.5-7.0*104kPa进行,用铑的配合物
RhCl(CO)(PPh3)2为催化并加入HI作助催化剂,使CO“插入”到甲醇分子中去,反应可在低压条件下进行。
14.2 分子氮配合物
分子氮配合物对推进化学模拟生物固氮,寻找合成氨的新型催化剂,实现在温和条件下合成氨,具有重要意义,所以引起了化学家和生物学家们的普遍注意,成为当今无机化学中非常活跃的一个研究领域。
1、分子氮配合物的合成
第一个分子氮(N2)配合物是1965年由Allen和Senoff在水溶液中用水合肼还原三氯化钌而制得的。随后很快就研究出用氮气直接合成分子氮配合物的方法。
2[(C6H11)3P]3 + N2 --25℃--> [(C6H11)3P]2 + Ni(N2)Ni[(C6H11)3P]2 + 2(C6H11)3P 该配合物就是以N2为桥的双核配合物,类似的双核配合物还可以通过下述反应制得:
[Ru(NH3)5N2]2+ + [Ru(NH3)5H2O]2+ ----> [Ru(NH3)5N2Ru(NH3)5]4+ + H2O 在强还原剂的条件下,有叔膦或双叔膦存在时,用N2处理某些过渡金属化合物,可以得到分子氮配合物。
MoCl4[P(CH3)2(C6H5)]2+N2 --Na/Hg--(甲苯)--> Mo(N2)[P(CH3)2(C6H5)]4目前已能制得ⅣB-Ⅷ族的几乎所有过渡金属元素的分子氮配合物。其中能获得稳定的分子氮配合物的元素有:Ti、Mo、W、Mn、Re、Fe、Co、Ni、Ru、Rh、Os、Ir和Pt。这些元素多为后过渡元素,它们在分子氮配合物中都处于低氧化态,因而含d电子较多。
2、分子氮配合物中的化学键
N2与CO是等电子体,分子氮与过渡金属离子(原子)生成配合物时的成键情况也与一氧化碳相似。
氮原子上的孤对电子进入过渡金属离子(原子)的空轨道,形成σ配键,同时过渡金属离子(原子)的d电子进入N2分子的反键π*空轨道,形成反馈π键,构成σ-π双键结构。
M-N2构成σ-π双键结构
〖问题〗:N2是π-酸配体,在形成分子氮配合物对金属离子(原子)有何要求?
答案:要求中心离子(原子)一方面要有空的d轨道,另一方面又要有足够数量的d 电子,后过渡金属的低价离子或原子正好满足这些要求。
〖问题〗:N2与CO配位性谁更强?哪一种更稳定?
答案:N2分子由于键级为3,键长很短(109.8pm),键能特别大(942KJ·mol-1),是一个较差的σ电子给予体,形成σ配键的能力远比CO弱;另一方面,N2分子的空π*轨道的能级又比CO高,所以N2接受金属离子(原子)的d电子形成反馈π键的能力也不如CO强。因而分子氮配合物的稳定性比金属羰基化合物差。
N2分子除了以端基方式形成配合物外,还可以给出成键π电子形成侧基配合物。
侧基配合物
此外,N2还可与金属离子形成双核配合物,如[(NH3)5RuN2Ru(NH3)5]4+。
3、配位氮分子的活化
与金属羰基配合物的情况相似,在N2分子与金属M以σ-π键配位后,由于形成σ键时N≡N之间成键电子密度减小,而在形成反馈π键时,N2分子的反键轨道中又加入了电子,这就降低了N2分子的键级,增加了键长,分子氮配合物中的氮分子得到了一定程度的活化。氮分子的活化是N2进一步还原NH3的先决条件。因此,氮分子的活化为从空气中直接固氮打开了一扇大门,而这正是长久以来人们梦寐以求的目标。
14.3 烯、炔烃π-配合物
π-配合物是由过渡金属和烯烃形成的配合物。烯烃和炔烃作为配位体,是以π键的电子云来和金属配位的。属于这类的配位体除了直链烯烃和炔烃外,还有环戊二烯基、环辛四烯基和苯等。
1、蔡斯盐(Zeise Salt)
蔡斯盐K[Pt(C2H4)Cl3]是人们最早(1827)制得的过渡金属烯烃配合物。
蔡斯盐阴离子[Pt(C2H4)Cl3]-的结构
乙烯分子与金属离子之间的化学键包含着一个σ配键和一个反馈的π配键,这些化学键的形成过程可表述如下:
乙烯分子中的双键是由一个σ键和一个π键组成的,有空的反键π*轨道。
Pt(Ⅱ)dsp2杂化轨道与三个Cl形成σ键。当Pt(Ⅱ)与乙烯分子结合时,乙烯给出成键的π电子,形成三中心σ配键;与此同时,Pt(Ⅱ)中d轨道上的电子则和乙烯分子中空的反键π*轨道形成另一个三中心反馈π键。如下图:
[Pt(C2H4)Cl3]-成键示意图 Pt(Ⅱ)-C2H4间的σ-π配键σ配键与π反馈键形成,使Pt和C2H4键加强,但C2H4内部键削弱。因此乙烯易打开双键发生发应。
2、乙炔配合物
乙炔有两套相互垂直的π与π*轨道,两套轨道均可以和对称性匹配的金属d轨道重叠。
乙炔即可做2电子给予体,又可以作为4电子给予体,可以单核,双核也可以形成三核簇合物。
乙炔配合物(1)乙炔配合物(2)π-配合物在工业上有重要作用,如不饱和烃的氧化、氢化、聚合等。
14.4 夹心配合物
另外一类重要的π-配合物是金属夹心型配合物。1951年人们首次合成了二环戊二烯基铁,或称二茂铁(C2H5)2Fe。对二茂铁结构研究证明,它具有夹心型结构,金属原子位于两个C5H5环之间,与十个碳原子等距离,在气相中属于重迭构象,但在晶体中呈交错式结构。
二茂铁是橙黄色的化合物,易溶于有机试剂,具有芳香性,可发生芳环的典型反应。
随后于1955年又发现了二苯铬Cr(C6H6)2与二茂铁相似也具有夹心型结构。
二茂铁的重迭构象和交错式结构二苯铬
一般来说,金属夹心配合物应该满足:(1)至少含有一个C n H n环;(2)金属原子处在环的n重对称轴上,因而等价地与环中所有碳原子结合。
目前,二茂铁及其衍生物被广泛地用作火箭燃料的添加剂,汽油的抗震剂,硅树脂和橡胶的熟化剂,紫外光吸收剂等。
14.5 过渡金属原子簇化合物简介
原子簇化合物(atom cluster compounds)也叫簇壮化合物,是目前化学学科中非常活跃的领域之一。金属原子簇,尤其是过渡金属原子簇化合物则是该领域的主体。
1、定义与分类
1966年,F.A.Cotten的定义,原子簇是“含有直接而明显键和的两个或两个以上金属原子的化合物”。近年来,美国化学文摘对原子簇化合物的说明是“含有三个或三个以上互相键和或大部分互相键和的金属原子配位化合物”。我过化学家徐光宪1982年提出广义原子簇定义:“原子簇为若干有限原子(三个或三个以上)直接键和组成多面体或缺顶多面体骨架的特征的分子或离子”,这样将硼烷及杂硼烷包括到原子簇化合物中。
过渡金属原子簇化合物与研究金属的表面催化有关,有的还具有特殊的导电性及生物活性,引起人们的极大兴趣,近年来,该领域发展迅速。
过渡金属簇合物有很多类型:
按配体种类分:羰基簇、卤素簇…… ;
按金属原子个数分:三核簇、四核簇、五核簇…… 直至十五或更多核。
3、金属-金属键
按照原子簇的定义,在簇合物中,金属原子之间是直接键合的。即含M-M金属键是簇合物的重要标志。为了讨论方便,我们举几个双核配合物的例子。
①Mn2(CO)10
每个锰原子有五个空的d2sp3杂化轨道,可容纳来自五个羰基的孤对电子,含有成单电子的第六个轨道则与另一个锰原子的同样的轨道重叠形成Mn-Mn键,结构图如下所示:
②Co2(CO)8
两个CO分别桥接两个钴原子,除此之外,每个钴原子还和三个端羰基相连。由于两个钴原子之间还形成Co-Co金属键,所以钴的配位数也是6。显然,钴与钴是以d2sp3杂化轨道不寻常的方式重迭,故Co-Co键呈弯曲形,具体结构图如下图所示:
③(Re2Cl8)2-
含金属-金属多重键的双核卤素簇中,最典型的实例是[Re2Cl8]2-:
该离子具有两个重要特点:①Re-Re键特别短,约224pm,而在金属铼中Re-Re键长为271.4pm;②两组氯原子为重叠型,这种排列使Re-Cl键处于排斥最大的位置,从能量上讲显然不利,但Re-Re键的缩短使金属-金属键增强,可以补偿Cl这样的排列所引起的能量损失。对Re-Re键的解释如下:Re的d x2-y2轨道用来同Cl形成金属-配体σ键,d x2-y2与s、p x、p y轨道杂化,产生四条dsp2杂化轨道,用来接受四个Cl-配体的孤对电子,形成四条正常的σ键。其余的d轨道相互重叠形成Re-Re金属键,分别为一个σ键,两个π键,一个δ键。
3、过渡金属羰基簇化合物
三核羰基簇中金属骨架常为三角形。四核羰基簇中金属骨架多为四面体。下面是一些羰基原子簇结构图:
4、过渡金属的卤素簇
过渡金属卤素簇在数量上不及羰基簇那么多,研究较多的是三核和六核卤素簇:
5、原子簇化合物应用
(1)可作为抗癌药物
(2)可作为模拟生物固氮的模拟物
(3)作为无机固体新材料
[Re2Cl8]2-在可见光区δ→δ*跃迁,很有希望利用它们光敏性来制造太阳能电池。(4)许多原子簇化合物可以作为活性高,选择性好的新型催化剂
例如:钌簇化合物是使水煤气变换反应进行更好的催化剂:
又如铑簇化合物做催化剂,可由CO2、H2直接制备乙二醇。
F列电子的量子数(n, I, m和ms)不合理的是 收藏 A. 3,0,0,+1/2 B. 3,1,0,-1/2 C. 3,0,0,-1/2 D. 3,3,0,+1/2 回答错误!正确答案:D NaH2PO4 的共轭酸是收藏 A. Na2HPO4 B. Na3PO4 C. NaHCO3 D. H3PO4 回答错误!正确答案:D 一种元素的相对原子质量,是该元 素的一定质量与核素一质量是 收藏 A. 原子质量 B. 各核素原子质量的平均质量 C. 平均质量 D. 1moI 原子平均质量回答错误!正确答案:D 下列说法错误的是 收藏 A. 基元反应都是多分子反应。 B. 一步完成的反应是基元反应。 C. 由一个基元反应构成的化学反应称简单反应 D. 由两个或两个以上基元反应构成的化学反应称复杂反应。12 12 6C 的摩尔质量的1/12 的比值,这
回答错误!正确答案:A 需配制Ph=5 的缓冲溶液,选用收藏 A. HAc-NaAc ( pKa=4.75 ) B. NaH2PO4-Na2HPO4 ( pKa2=7.2 ) C. Na2CO3-NaHCO3 ( pKa2=10.25 ) D. NH3.H2O-NH4Cl ( pKb=4.75 ) 回答错误!正确答案:A 某元素的电子构型为[ Ar ] 3d64s0 的离子是收藏 A. Fe3+ B. Ni2+ C. Mn2+ D. Co3+ 回答错误!正确答案:D 配合离子[CuCl5]3- 的中心离子收藏 A. sp2 B. dsp3 C. sp3 D. dsp2 回答错误!正确答案:B 以下平衡不属于化学平衡的是收藏 A. 沉淀溶解平衡和配位平衡 B. 常温下水的蒸发与凝结平衡 C. 酸碱电离平衡和氧化还原平衡 D. N2 + 3H2 == 2NH3
药学院无机化学试题及参考答案 (无机化学试题部分) 一、填空题(每空1分,共20分) 1.NH3分子的空间构型是,中心原子N原子采取杂化。 2.原子轨道以方式重叠,轨道重叠部分是沿着键轴呈圆柱形对称而分布的共价键叫键。 3.BeCl2分子为型分子,中心原子采取杂化,分子的固有偶极矩μ(>0,=0)。 4.某反应的△H和△S皆为负值,当温度升高时,△G(增大,减小)。 5.具有ns2np1~6电子构型的是区元素,具有(n-1)d5ns2电子构型的是族元素。 6.酸碱质子理论认为, 是酸,是碱。 7.在含有AgCl固体的饱和溶液中加入盐酸,则AgCl的溶解度;如加入氨水,则其溶解度;若加入KNO3,则其溶解 度。 8.298K时,Mg(OH)2的K sp为1.2×10-11;Ag2CrO4的K sp为9×10-12,则溶解度较大的是 者。 9.产生渗透现象必须具备两个条件,一是,二 是。 10.将0.115g奎宁(M=329.12克/摩)溶解在1.36g樟脑中,其凝固点为442.6K(T f=452.8K,K f=39.70)则凝固点降低为,m 为。 二、选择题(请在备选答案中选择一个正确的答案,并用“√”符号表示。每小题1分,共 20分) 1.下列各组物质中,属于等电子体系的是:( ) A.NO和CN— B.CO和N2 C.O2和NO D.NO和O2 2.第二主族元素的+2价阳离子的碳酸盐(MCO3)中最稳定的是:( )
A.MgCO3 B.CaCO3 C.SrCO3 D.BaCO3 3.下列各分子或离子的稳定性按递增顺序排列的是:( ) A.NO+< NO < NO— B.NO—< NO < NO+ C.NO< NO—< NO+ D.NO< NO+ < NO— 4.下列各组量子数中,不合理的一组是:( ) A.3,0,0,+1/2 B.3,2,3,1/2 C.2,1,0,-1/2 D.4,2,0,1/2 5.298K和101.3kPa下,下列化学方程式所表示的化学反应中属于熵减少的是:( ) A.C(s)+ O2(g) = CO2(g) B.S(s)+ O2(g) = SO2(g) C.2Na(s)+ O2(g) = Na2O2(s) D.N2(g)+ O2(g) = 2NO(g) 6.已知NH3(g)的标准生成热,则反应N2(g)+3H2(g)=2NH3 (g)的热效应为(): A.-46.2; B.46.2 C.-92.4 D.92.4 7.a,b,c三个电子具有的量子数(n,l,m)为a:3,2,0;b:3,1,0;c:3,1,-1。 三个电子的能量大小顺序为:( ) A.a>b>c; B.a> c > b; C.a>b=>c; D. c> a>b; 8.稀溶液依数性的本质是() A、渗透压 B、沸点升高 C、蒸气压降低 D、凝固点降低 9.现有蔗糖(C12H22O11)、氯化钠、氯化钙三种溶液,它们的浓度均为0.1mol?L-1,则渗透压由低到高的顺序是() A、CaCl2 过渡元素(二) 1.试回答和解释下列事实: (1)PdCl 2·2PF 3比PdCl 2·2NH 3稳定?而BF 3·NH 3却比BF 3·PF 3稳定得多?这是为什么? (2)相应的化学式为PtCl 2(NH 3)2的固体有两种异构体(顺、反),它们的颜色不同,一种 是棕黄色,另一种是淡黄色;它们在水中的溶解度也有差别,其中溶解度较大的应是哪一种?为什么? (3)钌和锇的四氧化物都是低熔点的固体(RuO 4为298K 、OsO 4为314K ),试加以解释。 (4)ZrO 2的碱性比TiO 2强,为什么? (5)Nb 和Ta 的原子半径几乎相同,为什么? 2.Pt(NH 3)2(NO 3)2有α和β两种构形。α形与草酸反应生成Pt(NH 3)2C 2O 4,但β形与草酸反应得到的反应产物却是Pt(NH 3)2(C 2O 4H)2。为什么会出现不同的反应产物?用什么物理方法来区分α形和β形。请画出这两种配合物的结构式。 3.完成下列方程式 (1)Pt +HNO 3+HCl → (2)PdCl 2+CO +H 2O → (3)K 2PtCl 6+K 2C 2O 4 → (4)MoO 42-+Zn 2++H + → (5)Mo 3+ +NCS - → (6)(NH 4)2PtCl 6 → (7)K 2PtCl 6+N 2H 2·2HCl → (8)ZrCl 4+H 2O → (9)PtF 6+Xe → (10)Ru +KClO 3+KOH → (11)MoO 3+NaOH → (12)WO 3+NaOH → (13)WO 3·nH 2O → (14)(NH 4)2ZrF 6 → 4.Zr 和Hf 有何宝贵的特征?基于这些特性有哪些主要用途? 5.锌汞齐能将钒酸盐中的钒(V )还原至钒(II ),将铌酸盐中的铌(V )还原至铌(IV ),但 △ △ △ △ 第十二章ds区元素 12.1 铜族元素 (1) 12.2 锌族元素 (10) 12.1 铜族元素 12.1.1 铜族元素通性 铜族元素 1.铜族元素通性 铜族元素的氧化态有+1,+2,+3三种,这是由于铜族元素最外层ns电子和次外层(n-1)d电子能量相差不大。有人认为在本族元素中,元素第二电离能与第一电离能的差值越小,它的常见氧化值就越高。 对于Cu、Ag、Au,Δ(I2-I1)Au < Δ(I2-I1)Cu < Δ(I2-I1)Ag 所以常见氧化态物+3,+2,+1。 铜、银、金的标准电势图如下所示: 12.1.2 铜族元素金属单质 2.铜族元素金属单质 (1).物理性质 铜和金是所有金属中仅有的呈现特殊颜色的二种金属,铜族元素的熔点、沸点、硬度均比相应的碱金属高。这可能与d电子也参与形成金属键有关。由于铜族金属均是面心立方晶体(如下图),它们不仅堆积最密而且存在较多可以滑动的高密度原子层,因而比相应的 碱金属(多为体心立方晶体)密度高得多,且有很好的延展性,其中以金最佳。铜族元素的导电性和传热性在所有金属中都是最好的,银占首位,铜次之。 (2).化学性质 铜族元素的化学活性远较碱金属低,并按Cu--Ag--Au的顺序递减。 在潮湿的空气中放久后,铜表面会慢慢生成一层铜绿。铜绿可防止金属进一步腐蚀,其组成是可变的。银和金不会发生该反应。 空气中如含有H2S气体与银接触后,银的表面上很快生成一层Ag2S的黑色薄膜而使银失去银白色光泽。() 在电位序中,铜族元素都在氢以后,所以不能置换稀酸中的氢。但当有空气存在时,铜可缓慢溶解于这些稀酸中: 浓盐酸在加热时也能与铜反应,这是因为Cl-和Cu+形成了较稳定的配离子[CuCl4]3-,使Cu == Cu++e-的平衡向右移动: 铜易为HNO3、热浓硫酸等氧化性酸氧化而溶解 银与酸的反应与铜相似,但更困难一些;而金只能溶解在王水中: 下列电子的量子数(n, l, m和m s)不合理的是 收藏 A. 3, 0, 0, +1/2 B. 3, 1 , 0, -1/2 C. 3, 0, 0, -1/2 D. 3, 3, 0, +1/2 回答错误!正确答案:D NaH2PO4的共轴酸是 收藏 A. Na2HPO4 B. Na3PO4 C. NaHCO3 D. H3PO4 回答错误!正确答案:D ■?…一 . . 、?…、...... 12 . . 一■.一.... 、一种元素的相对原子质量,是该元素的一定质量与核素6C的摩尔质量的1/12的比值,这 一质量是 收藏 A. 原子质量 B. 各核素原子质量的平均质量 C. 平均质量 D. 1mol原子平均质量 回答错误!正确答案:D 下列说法错误的是 收藏 A. 基元反应都是多分子反应。 B. 一步完成的反应是基元反应。 C. 由一个基元反应构成的化学反应称简单反应 D. 由两个或两个以上基元反应构成的化学反应称复杂反应。 回答错误!正确答案:A 需配制Ph=5的缓冲溶液,选用收藏 A. HAc-NaAc (pKa=4.75) B. NaH2PO4-Na2HPO4 (pKa2=7.2 ) C. Na2CO3-NaHCO3 ( pKa2=10.25 ) D. NH3.H2O-NH4Cl (pKb=4.75 ) 回答错误!正确答案:A 某元素的电子构型为[A门3d64s0的离子是收藏 A. Fe3+ B. Ni2+ C. Mn2+ D. Co3+ 回答错误!正确答案:D 配合离子[CuCl5]3-的中心离子收藏 A. sp2 B. dsp3 C. sp3 D. dsp2 回答错误!正确答案:B 以下平衡不属于化学平衡的是收藏 A. 沉淀溶解平衡和配位平衡 B. 常温下水的蒸发与凝结平衡 C. 酸碱电离平衡和氧化还原平衡 D. N2 + 3H2 == 2NH3 回答错误!正确答案:B 催化剂是通过改变反应进行的历程来加速反应速率,这一历程影响收藏 班级 姓名 分数 一、选择题 ( 共18题 35分 ) 1. 2 分 InCl 2为逆磁性化合物,其中In 的化合价为…………………………………………( ) (A) +1 (B) +2 (C) +3 (D) +1和+3 2. 2 分 下列氢化物中,在室温下与水反应不产生氢气的是…………………………………( ) (A) LiAlH 4 (B) CaH 2 (C) SiH 4 (D) NH 3 3. 2 分 和水反应得不到H 2O 2的是……………………………………………………………( ) (A) K 2O 2 (B) Na 2O 2 (C) KO 2 (D) KO 3 4. 2 分 下列物质的水解产物中既有酸又有碱的是………………………………………… ( ) (A) Mg 3N 2 (B) SbCl 5 (C) POCl 3 (D) NCl 3 5. 2 分 有关H 3PO 4、H 3PO 3、H 3PO 2不正确的论述是…………………………………( ) (A) 氧化态分别是+5,+3,+1 (B) P 原子是四面体几何构型的中心 (C) 三种酸在水中的离解度相近 (D) 都是三元酸 6. 2 分 下列各组化合物中,都有颜色的一组化合物是…………………………………… ( ) (A) SiCl 4,SnCl 4,PbO (B) CCl 4,NO 2,HgI 2 (C) SiC ,B 2H 6,N 2O 4 (D) PbO 2,PbI 2,SnS 7. 2 分 下列化合物中最稳定的是…………………………………………………………… ( ) (A) Li 2O 2 (B) Na 2O 2 (C) K 2O 2 (D) Rb 2O 2 8. 2 分 1 mol 下列各物质溶于1 dm 3水中,生成的溶液 中H + 浓度最高的是……………( ) (A) SO 3 (B) P 4O 10 (C) HF (D) MgH 2 厦门大学“无机化学(二)”课程试卷 化学化工学院化学、材料系2004年级化学各专业 试卷类型:(A 卷) 《无机化学》教学大纲 课程编号:2009031028 课程名称:无机化学 课程名称:Inorganic Chemistry 开课单位:药学院化学学科 学分:6 总学时:120 理论学时:72 实验学时:48 先开课程:无 授课对象:药学、药物制剂本科专业考核方式:考试 执笔人:杨怀霞编写日期:2009年8月28日 前言 【开设目的】 《无机化学》是药学类专业一门重要的基础课,它对学生的知识结构和能力培训有着及其重要的作用。基本化学理论知识和基本实验操作技能的学习,不仅能够培养独立思考、独立解决问题的能力,也为后续课程的学习和今后从事专业工作打下基础。 【教学要求】 本课程要求学生掌握化学热力学、化学平衡及化学反应速率理论的基本知识,掌握酸碱平衡、沉淀平衡、氧化还原平衡和配位平衡的基本规律,熟悉原子结构和分子结构的基本理论,理解s区、p区、d区、ds区主要元素及其重要化合物的性质与应用。同时通过实验教学培养学生严谨的科学态度和正确、规范的化学实验基本操作技能。 教学目的要求、内容和方法 绪论 【目的要求】 了解该课程发展史,发展方向,内容安排,与药学的关系。掌握有效数字的运算规则。 【教学内容】 无机化学的发展和研究内容,化学与药学的关系,无机化学的学习方法,有效数字及运算规则。【教学方式】 课堂讲授、自学。 第一章溶液 【目的要求】 掌握溶液浓度的五种表示法:质量分数,摩尔分数,质量摩尔浓度,质量浓度,物质的量浓度。熟悉稀溶液的依数性的四个性质,了解离子强度,活度,活度系数的概念。 【教学内容】 溶液的浓度,稀溶液的依数性,电解质在水中的存在状态。 【教学方式】 课堂讲授、自学。 。 第二章化学反应的方向 【目的要求】 掌握状态函数的特点;标准生成焓、标准生成吉布斯能的定义,会用盖斯定律计算化学反应的热效应,吉布斯能变,标准吉布斯能变。熟悉反应过程的熵变计算,利用吉布斯公式能进行有关计算。了解热力学常用术语和基本概念。 【教学内容】 热力学常用术语:体系、环境、过程、途径、状态函数、热、功。热力学第一定律;化学反应的热效应;盖斯定律;焓、熵、吉布斯自由能及反应的自发性。 【教学方式】 课堂讲授、自学。 第三章化学反应速率 厦大无机化学考研经验 现在说说我的考研复习时间安排吧,我是从2011年4月份开始复习无机化学上册,整个四月份都只看无机化学上册,只看书,每天花半天时间(3小时)去图书馆。我看书比较注重效率,也感觉自己那段时间效率比较高,所以就抓紧时间看(考研复习都有疲劳期,所以趁状态好的时候多复习点)。每次看书的时候只带课本和笔,本人不习惯用笔记本,看书期间遇到的问题或是重点我喜欢直接标注在书本上,我那本无机化学课本在最后反正是找不到一页没有注解的空白地方。我还有个习惯就是喜欢将书本上的重要公式或是非常重要的定义写在那一页的顶端或是下端,这样有助于复习时加深印象,翻到那一页就知道主要讲了什么内容。整个四月份我将无机化学上册看了一遍,当然有些难以理解的地方就多花了时间。我找的考研资料、考题考点解析、知识框架图及历年真题及答案解析等内容都是在百度文库找的,价格便宜,用起来很方便。我看书也是主要是以章节为单位,争取看一章能将那一章的知识有个了解,争取看懂。 看完这本书就给自己放了一个五一长假,然后就开始复习物理化学了,物理化学也注重看书,最好是复习厦大孙世刚那两本书,很全面,跟考试结合很紧密。物理化学是一项艰苦的工程,不仅难懂,还很难记住,感觉就是看不懂,看了后面就忘了前面,做题几乎没把握。不过这时不要灰心,始终要坚信难是对于所有人的,只要自己努力了,结果肯定不会差。物理化学需要一章节一章节的复习,然后做课后习题,这样有助于理解,重复看书,重复做题,吃透每章节的内容,只有这样才会在看后续章节时不会不知所云。复习物理化学花的时间就多了,两本物理化学书我是从5月份看到了八月底,当然这期间也有一些耽误,比如复习期末考试,暑假休息半个月,总的算来花了三个月把书本拉通看了一遍。最重要的是在这期间无机化学不能丢下,虽然不像四月份那样每天看,但是需要时常翻翻书,看一看比较难理解的章节,如原子结构和元素周期律,化学键理论和配位化学那几章,顺带做做题。这样到九月开学时几乎就把无机化学上册搞定了,物理化学也有了个大概的了解。对于这期间花在专业课上的时间应该每天不少于三小时吧,而且是连续的三小时,这样有助于系统复习。 九月开学后就要安排全程复习了,无论是公共课还是专业课,具体时间安排因人而异,自己感觉难的科目可以多安排点时间,复习顺利的科目少花点时间, 卤素 1. 为什么氟的电子亲合能比氯小?为什么氟与氯比较仍然是强的氧化剂? 2.从下列几方面考虑氟在卤素中有哪些特殊性? (1)氟呈现的氧化态与其他卤素是否相同? (2)F2与水和碱溶液的反应与其他卤素有什么不同? (3)制备F2时能否采用一般氧化剂将F-离子氧化?为什么? (4)氢氟酸同硅酸作用的产物是什么? (5)氟与氧的化合物与其他卤素与氧的化合物有何不同? 3. 电解制氟中,为什么不用KF的水溶液,也不用熔融的KF?为什么不采用无水液态HF 电解? 4.如何从海水提取溴和溴酸?写出有关的化学反应方程式? 5.讨论I2O5的制备方法,结构和它在分析化学上的应用? 6.写出Cl2、Br2、I2、(CN)2、(SCN)2在碱性溶液中的歧化反应式。比较Cl2、Br2、I2在不 同温度下歧化产物有什么不同? 7.卤化氢中HF极性很强,熔沸点最高,但其水溶液的酸性却最小,试分析其原因。 8.写出BrCl、BrF3、ICl3、IF5、IF7的水解反应方程式。 9.在卤素互化物中,较轻卤原子的数目为什么总是奇数? 10.实验观察到多卤化铷没有相应的多卤化铯的热稳定性高,试加以说明。 11.利用电极电势解释下列现象:在淀粉碘化钾溶液中加入少量NaClO时,得到蓝色溶液A, 加入过量NaClO时,得到无色溶液B,然后酸化之,并加少量固体Na2SO3于B溶液,则A的蓝色复现,当Na2SO3过量时蓝色又褪去成为无色溶液C,再加入NaIO3溶液蓝色的A溶液又出现。指出A、B、C各为何种物质,并写出各步的反应方程式。 12.写出以NaCl为基本原料制备下列试剂的反应方程式(可加其他试剂)。 Cl2、NaClO3、NaClO4、HClO4、KClO3、KClO4、HClO 、漂白粉 13.确定下列分子或离子的结构 [ICl2]-、H5IO6、[IF4]+、Cl2O7、[ICl4]-、SCl3+、IF7、ClO2、 ClO3-、I3-、ClF3、BrF5 14.完成和配平下列反应式: (1)Cl2+KI+KOH → 厦门大学2004级无机化学二期中考试试题 厦门大学“无机化学(二)”课程试卷 化学化工学院化学、材料系2004年级化学各专业 试卷类型:(A卷) 班级姓名分数 一、选择题 ( 共18题 35分 ) 1. 2 分 InCl2为逆磁性化合物,其中In的化合价为…………………………………………() (A) +1 (B) +2 (C) +3 (D) +1和+3 2. 2 分 下列氢化物中,在室温下与水反应不产生氢气的是…………………………………() (A) LiAlH4 (B) CaH2 (C) SiH4 (D) NH3 3. 2 分 和水反应得不到H2O2的是……………………………………………………………() (A) K2O2 (B) Na2O2 (C) KO2 (D) KO3 4. 2 分 下列物质的水解产物中既有酸又有碱的是…………………………………………() (A) Mg3N2 (B) SbCl5 (C) POCl3 (D) NCl3 5. 2 分 有关H3PO4、H3PO3、H3PO2不正确的论述是…………………………………() (A) 氧化态分别是+5,+3,+1 (B) P原子是四面体几何构型的中心 (C) 三种酸在水中的离解度相近 (D) 都是三元酸 6. 2 分 下列各组化合物中,都有颜色的一组化合物是……………………………………() (A) SiCl4,SnCl4,PbO (B) CCl4,NO2,HgI2 (C) SiC,B2H6,N2O4 (D) PbO2,PbI2,SnS 7. 2 分 下列化合物中最稳定的是……………………………………………………………() (A) Li2O2 (B) Na2O2 (C) K2O2 (D) Rb2O2 8. 2 分 1 mol 下列各物质溶于1 dm3水中,生成的溶液中H+ 浓度最高的是……………() (A) SO3 (B) P4O10 (C) HF (D) MgH2 9. 2 分 对于H2O2和N2H4,下列叙述正确的是………………………………………………() (A) 都是二元弱酸 (B) 都是二元弱碱 (C) 都具有氧化性和还原性 (D) 都可与氧气作用 10. 2 分 碱金属和碱土金属 1.试说明为什么Be2+、Mg2+、Ca2+、Sr2+、Ba2+的水合热依次减弱? 2.某酸性BaCl2溶液中含少量FeCl3杂质。用Ba(OH)2或BaCO3调节溶液的pH值,均可把Fe3+沉淀为Fe(OH)3而除去。为什么?利用平衡移动原理进行讨论。 3.试解释为什么碱金属的液氨溶液,(1)有高的导电性;(2)是顺磁性的;(3)稀溶液呈兰色。 4.Rb2SO4的晶格能是-1729kJ·mol-1,溶解热是+24kJ·mol-1,利用这些数据求SO42-的水合热(已知Rb+的水合热为-289.5kJ·mol-1). 5.根据下图,可以由重晶石(BaSO4)作为原料,来制造金属钡及一些钡的化合物。试回答下列一些问题: C Na2CO3 C BaSO4BaS BaCO3 加热 BaO2 HCl HNO3H2O Al Ba Na2NO3 加热 BaCl2·2H2O Ba(NO3)2Ba(OH)2 (1)现拟从重晶石制备BaCl2·2H2O。问应该采用哪些步骤,写出其化学方程式,并说明完成反应的理由。 (2)为何不能从BaS与硝酸作用直接制备Ba(NO3)2? (3)为何工业上不采用BaCO3直接加热分解方法来制备BaO? 6.利用下列数据计算KF和KI的晶格能。(单位kJ·mol-1) K+(g)F-(g)I-(g) 水合能(kJ·mol-1)-360.2 -486.2 -268.6 KF KI 溶解热(kJ·mol-1)-17.6 20.5 由计算结果再联系有关理论加以讨论。 7.讨论Li+、Na+、K+、Rb+、Cs+系列在水溶液的迁移率大小顺序?若在熔融盐中是否具有相同的顺序? 8.Na2O2可作为潜水密闭舱中的供氧剂,这是根据它的什么特点?写出有关反应式。 9.写出M2O、M2O2、MO2与水反应的方程式,并加以比较。 10.如何用离子势概念说明碱金属、碱土金属氢氧化物的碱性是随M+、M2+离子半径的增大增强。 11.如何证明碱金属氢化物中的氢是带负电的组分?预测CaH2、LiH与水反应的产物? 12.什么叫对角线规则?引起Li~Mg、Be~Al、B~Si三对元素性质上相似的原因是什么? 13.下列每对化合物中,哪一个在水中的溶解度可能更大些? (1)SrSO4与MgSO4(2)NaF与NaBF4 14.试从热力学观点定性说明,为什么碱土金属碳酸盐随着金属元素原子序数的增加,分解温度升高。 15.求MgCO3与NH4Cl水溶液反应的K=?由此说明MgCO3能否溶于NH4Cl溶液? 16.解释下列事实: (1)尽管锂的电离能比铯大,但E?Li+/Li却比E?Cs+/Cs的小。 (2)LiCl能溶于有机溶剂,而NaCl则不溶。 (3)为什么Li+与Cs+相比,前者在水中有低的迁移率和低的电导性?这与Li的半径特别小是否矛盾? (4)电解熔融的NaCl为什么常加入CaCl2?试从热力学观点出发加以解释。 (5)在+1价阳离子中Li+有最大的水合能。 (6)CsI3的稳定性高于NaI3。 (7)碱土金属熔点比相应碱金属高,硬度大? (8)当悬浮于水中的草酸钙溶液中,加入EDTA的钠盐时,草酸钙便发生溶解? 17.用最简便的方法鉴别下列各组物质? (1)LiCl与NaCl (2)CaH2与CaCl2 (3)NaOH与Ba(OH)2 (4)CaCO3与Ca(HSO3)2 (5)NaNO3与Na2S2O3 药学专业无机化学的教育革新 药学事业作为一种特殊的行业,从业者素质的高低直接关系到药品质量的好坏,更密切联系着病人的用药安全。2009年,海南省被批准建设国际旅游岛,在此背景下,更需要在培养药学专业人才时,不仅注重专业技能培养,更要培养其高度的社会责任感、崇高的职业道德。无机化学的基本原理可应用于药学各个专业,生物无机化学、酶化学等边缘学科的快速发展加强了无机化学在医药学科中的地位。寻找有效的教学方法,让学生尽快适应大学的生活和学习,对于学生的整个大学生活和今后的工作道路至关重要。笔者从无机化学课堂和实验教学改革入手,提高学生的素质,实施“优化、培养、提高”的教学方法改革,可称为SRE(Superior、Raises、Enhancement)模式,即优选讲授内容,优化讲授方法,优质讲授效果,培养学生自学、动手、获取知识的能力,培养学生初步科研能力,提高学生思想道德、心理素质、劳动技能、科学文化素质教育,根本转变教育观念。 一、调查研究及分析 本项目选择本校2010级药学、中药学本科学生共90人作为调查对象,从调查内容及结果可知,大一学生都可以认识到学习化学对所学专业的重要性,正是由于这点,学生对学习化学较感兴趣,但是由于学生的基础和学习态度不同,对学好化学的信心不同,有37.5%的 学生是因为喜欢化学、25%的学生认为化学非常容易对学好化学很有信心,还有25%的认为非常难、12.5%的学生不喜欢化学对学习化学没有信心或信心不足。有86.5%的学生认为教师有必要让学生写小论文并扩展知识专题。而且认为学生写小论文有助于提高课堂注意力,提高学习效率,易于知识的理解掌握;有助于促进师生和组员间的沟通,提高人际交往能力与沟通能力;有助于提高综合、理解能力和获取信息的能力,提高学习自觉能力。调查结果显示,90后学生喜欢教师在理论课的讲授过程中采用学生自主式教学模式,喜欢有责任心、严格要求学生而又不失幽默感的教师。 二、改革方案 在对国内外同类教育以及社会需求、历届药学专业学生反馈进行调查研究的基础上,笔者对本课程的现状、问题、发展与改革方向作比较分析,从而提出课程改革的SRE模式方向、建设要求与任务。 1.优化 (1)优选讲授内容 优选课堂讲授内容。讲授内容需具有针对性,并且需适应社会对学生素质教育的要求,因此在教学过程中需严格制定教学大纲,选择 《无机化学》理论教学大纲 英文名称:Inorganic Chemistry 课程编号:090201 学时数: 54 学分:3.5 课程类型:必修课 适用专业:药学、医学检验 先修课程:无 考核方式:闭卷考试 一、课程的性质、地位和作用 无机化学是药学、医学检验专业的重要基础课,也是第一门化学课。它是培养专业技术人才的整体知识结构和能力结构的重要组成部分,同时也是后继化学课程打下牢固的基础。 通过本课程的学习,使学生获得物质结构的基础理论、化学反应的基本原理、元素化学的基本知识和实验的基本技能。培养学生具有分析处理一般无机化学问题的初步能力,独立进行无机化学试验和自学一般无机化学书刊,以获取新知识的能力。 本课程的教学应该运用辩论唯物主义观点和科学方法,阐明化学的基本原理和元素及化合物性质的变化规律,以促进学生辩证唯物主义世界观的形成。根据我院教学中实际特制订本大纲,供药学、医学检验专业使用。 二、教学基本内容及基本要求 一绪论1课时 【教学内容】 无机化学与药学、无机化学与医学检验关系。无机化学课程的性质、地位和作用。无机化学的主要内容和学习方法。 【基本要求】 明确什么是无机化学。了解无机化学与药学、无机化学与医学检验的关系。了解无机化学课程主要内容和学习方法。 二溶液3课时 【教学内容】 溶液的浓度:质量分数、摩尔分数、质量摩尔浓度、质量浓度、物质的量浓度。稀溶液的依数性:溶液的蒸汽压下降、溶液的沸点上升、溶液的凝固点降低、溶液的渗透压。电解质在水溶液中的存在状况。活度、活度系数、离子强度。 【基本要求】 掌握溶液浓度的含义。掌握质量分数、摩尔分数、质量摩尔浓度、质量浓度、物质的量浓度的含义及有关计算。 理解稀溶液的依数性。熟悉渗透压及在医学上的应用。 了解强电解质在水溶液中的状况。了解活度、活度系数、离子强度的概念。 三化学反应速率4课时 【教学内容】 化学热力学初步 1、热力学第一定律ΔU=Q -W ,由于U 为状态函数,所以Q 和W 也是状态函数,对吗?为什么? 2、解释下列名词 (1)体系与环境 (2)热(Q ) (3)功(W ) (4)焓(H )和焓变(ΔH ) (5)热力学能U (6)恒容反应热(Q v )和恒压反应热(Q p ) 3、什么叫状态函数?它具有何特性? 4、何谓热效应?测量方法有哪两种? 5、什么叫热化学方程式?书写热化学方程式要注意哪几点? 6、①无机化学中常用的反应热有哪几种:反应热的实质是什么?什么类型的化学反应Q ρ=Q ν?等摩尔的NaOH 与NH 3·H 2O 溶液分别与过量的HCl 溶液中和所放热量是否相等?为什么? ②反应2N 2(g )+ O 2(g)=2N 2O (g )在298K 时,? m rH ?=164KJ ·mol -1求反应的ΔU ? 7、什么叫标准生成热?m f H ??什么是标准燃烧热? m cH ?? 8、何谓盖斯定律? 9、什么是自发过程?自发过程有何特征? 10、用焓变判断反应的自发性为什么是不全面的? 11、什么是熵?什么是绝对熵和标准熵?其符号、单位是什么? 12、影响熵值的因素有哪些?举例说明。 13、化学反应自发性的标准是什么,举例说明。 14、什么叫Gibbs 自由能?怎样用自由能的变化(ΔG )来判断反应的方向? 15、在标准状态下Gibbs 方程如何书写? 16、什么叫标准生成自由能?m f G ?? 17、判断下列说法是否正确?为什么? (1) ΔS 为正值的反应均是自发反应? (2) 物质的量增加的反应ΔS 为正值; (3) 若ΔH 和ΔS 均为正值,则温度上升ΔG 将下降; (4) 某反应的? m rG ?>0,表明该反应在任何条件下都是不自发进行的; (5) 放热反应均是自发反应; (6) 纯单质的? m f H ?,? m f G ?,? m S 皆为零; 氮族元素 1. 从N2分子的结构如何看出它的稳定性?哪些数据可以说明N2分子的稳定性? 2. NF3的沸点低(-129℃),且不显碱性,而NH3沸点高(-33℃)却是众所周知的路易斯碱。请说明它们挥发性差别如此之大及碱性不同的原因? 3. 为什么在化合物分类中往往把铵盐和碱金属盐列在一起? 4. 加热固体的碳酸氢铵,氯化铵,硝酸铵和硫酸铵将发生什么反应?写出有关反应方程式。 5. 写出联氨、羟氨、氨基化钠和亚氨基化锂的分子式,指出它们在常温下存在的状态及其特征化学性质。将联氨选作火箭燃剂的根据是什么? 6. 为什么亚硝酸和亚硝酸盐既有还原性,又有氧化性?试举例说明。 7. 比较亚硝酸在不同介质中的氧化还原性。 8. 为什么硝酸在不同浓度时被还原的程度大小,并不是和氧化性的强弱一致的?比如,浓HNO3通常被还原为NO2只得一个电子,而氧化性较差的稀HNO3却被还原为NO得3个电子。 9. 提供实验室制取氮气的二种方法,并写出相应的反应方程式。 10. 写出钠、铅、银等金属硝酸盐热分解反应方程式。 11. 在P4分子中P-P-P键的键角约为多少?说明P4分子在常温下具有高反应活性的原因? 12. 通常如何存放金属钠和白磷,为什么? 13. 试讨论为什么PCl3的水解产物是H3PO3和HCl,而NCl3的水解产物却是HOCl和NH3? 14. 讨论H3PO4的分子结构,挥发性和酸性强弱。从结构上判断下列酸的强弱: H3PO4 H4P2O7 HNO3 15. 固体五氯化磷是由阴、阳离子组成的能导电的离子型化合物,但其蒸 气却是分子型化合物。试画图确定固态离子和气态分子的结构及杂化类型。 16. 写出由PO43-形成P4O124-聚合物的平衡方程式。 17. 为什么磷酸在分析化学中可用掩蔽Fe3+离子? 18. 在Na2HPO4和NaH2PO4溶液中加入AgNO3溶液均析出黄色沉淀?而在PCl5完全水解后的产物中,加入AgNO3只有白色沉淀,而无黄色沉淀,试对上述事实加以说明。 19. 在地球电离层中,可能存在下列五种离子,你认为哪一个最稳定?为什么? N2+ NO+ O2+ Li2+ Be2+ 20. 砒霜的分子式是什么?比较As2O3、Sb2O3、Bi2O3及它们的水化物酸碱性,自As2O3到Bi2O3递变规律如何? 21. 讨论SbCl3和BiCl3的水解反应的产物。 22. 为什么铋酸钠是一种很强的氧化剂?As、Sb、Bi三元素的+3、+5氧化态化合物氧化还原性变化规律如何? 23. As、Sb、Bi三元素的硫化物分别在浓HCl、NaOH或Na2S溶液里的溶解度如何?它们的硫代酸盐生成与分解情况如何? 24. 画出PF5、PF6-的几何构型。 25. 分别往Na3PO4溶液中加过量HCl,H3PO4,CH3COOH,问这些反应将生成磷酸还是酸式盐? 26. Sb2S3能溶于Na2S或Na2S2,而Bi2S3既不能溶于Na2S,也不能溶于Na2S2。请根据以上事实比较Sb2S3,Bi2S3的酸碱性和还原性。 27. 用电极电势说明:在酸性介质中Bi(Ⅴ)氧化Cl-为Cl2,在碱性介质中Cl2可将Bi(Ⅲ)氧化成Bi(Ⅴ)。 28. 如何鉴定NO2-和NO3-?NO3-和PO45-? 30.(1)计算0.1mol·L-1 K2HPO4,KH2PO4,K3PO4溶液的pH值。(2)计算KH2PO4和等体积、等摩尔K3PO4混合液的pH值。 31. 试说明H4P2O7的酸性比H3PO3强? 高职药学专业《无机化学》练习题 [第01章 物质的量] 一、名词解释 1、气体摩尔体积 2、阿伏伽德罗定律 二、单项选择题 1、摩尔是( ) A 、物质的量的单位 B 、摩尔质量的单位 C 、体积的单位 D 、物质微粒的单位 2、SO 42- 的摩尔质量是( ) A 、96g B 、48g/mol C 、96g/mol D 、98g/mol 3、H 2SO 4 的摩尔质量是( ) A 、98g B 、49g/mol C 、96g/mol D 、98g/mol 4、NaOH 的摩尔质量是( ) A 、40g B 、40g/mol C 、40 mol D 、40 L 5、Na + 的摩尔质量是( ) A 、23 g/mol B 、22 g /mol C 、24g/mol D 、11g/mol 6、1 mol 水蒸汽、1 mol 液态水、1 mol 冰各自所含的分子个数( ) A 、一定相等 B 、水蒸汽含水分子多 C 、液态水含水分子多 D 、冰含水分子多 7、下列叙述中,错误的是( ) A 、90 g H 2O 中,含有的水分子数为 5N A B 、90 g H 2O 中,含有的氢原子数为 10N A C 、90 g H 2O 中,含有的氧原子数为 5N A D 、90 g H 2O 中,含有的水分子数为 N A 8、下列叙述中不正确的是( ) A 、摩尔是物质的量的单位 B 、氢气的摩尔质量是2g/mol C 、物质的摩尔质量如果用克做单位,数值上就等于它的相对分子质量 D 、物质的摩尔质量如果用g/mol 做单位,在数值上就等于该物质的化学式量 9、下列物质中,物质的量最大的是( ) A 、4℃时10mL 水 B 、0.8 mol H 2SO 4 C 、54 g 的铝 D 、3.01×1022个的氧分子 10、2 mol MgCl 2 和1mol AlCl 3 中,Cl - 的物质的量之比为( ) A 、3:2 B 、2:3 C 、4:3 D 、3:4 11、相同质量的下列物质,所含分子数最多的是( ) A 、H 2SO 4 B 、O 2 C 、CO 2 D 、H 2 12、相同质量的下列物质,所含分子数最少的是( ) 第十二章ds区元素 12.1 铜族元素.................................................................................................. 错误!未定义书签。 12.2 锌族元素.................................................................................................. 错误!未定义书签。 12.1 铜族元素 12.1.1 铜族元素通性 铜族元素 1.铜族元素通性 铜族元素的氧化态有+1,+2,+3三种,这是由于铜族元素最外层ns电子和次外层(n-1)d电子能量相差不大。有人认为在本族元素中,元素第二电离能与第一电离能的差值越小,它的常见氧化值就越高。 对于Cu、Ag、Au,Δ(I2-I1)Au < Δ(I2-I1)Cu < Δ(I2-I1)Ag 所以常见氧化态物+3,+2,+1。 铜、银、金的标准电势图如下所示: 12.1.2 铜族元素金属单质 2.铜族元素金属单质 (1).物理性质 铜和金是所有金属中仅有的呈现特殊颜色的二种金属,铜族元素的熔点、沸点、硬度均比相应的碱金属高。这可能与d电子也参与形成金属键有关。由于铜族金属均是面心立方晶体(如下图),它们不仅堆积最密而且存在较多可以滑动的高密度原子层,因而比相应的碱金属(多为体心立方晶体)密度高得多,且有很好的延展性,其中以金最佳。铜族元素的导电性和传热性在所有金属中都是最好的,银占首位,铜次之。 (2).化学性质 铜族元素的化学活性远较碱金属低,并按Cu--Ag--Au的顺序递减。 在潮湿的空气中放久后,铜表面会慢慢生成一层铜绿。铜绿可防止金属进一步腐蚀,其组成是可变的。银和金不会发生该反应。 空气中如含有H2S气体与银接触后,银的表面上很快生成一层Ag2S的黑色薄膜而使银失去银白色光泽。() 在电位序中,铜族元素都在氢以后,所以不能置换稀酸中的氢。但当有空气存在时,铜可缓慢溶解于这些稀酸中: 第十五章f区元素 15.1 镧系锕系元素概述 (1) 15.2 镧系收缩及后果 (3) 15.3 镧系元素化合物 (5) 15.1 镧系锕系元素概述 15.1.1 名称、符号和电子层构性 1.名称和符号 周期表中有两个系列的内过渡元素,即第六周期的镧系和第七周期的锕系。镧系包括从镧(原子序数57)到镥(原子序数为71)的15种元素;锕系包括从锕(原子序数89)到铹(原子序数103)的15种元素。 2.电子层构型 镧系、锕系电子层构型比较复杂,第三层4f、5f轨道上。 表15-1 镧系元素原子的电子层结构 从表15-1可知,除镧原子外,其余镧系元素原子的基态电子层结构中都有f电子。镧虽然没有f电子,但它与其余镧系元素在化学性质上十分相似。镧系元素最外两个电子层对4f轨道有较强的屏蔽作用,尽管4f能级中电子数不同,它们的化学性质受4f电子数的影响很小,所以它们的化学性质很相似。 【问题】为什么La最外层电子构型不是4f16s2,而是4f05d16s2; Gd最外层电子构型不是4f86s2,而是4f75d16s2? 根据洪特规则,电子处于半满、全空时较为稳定。 15.1.2 电子层结构与氧化态 表15-2 锕系元素原子的电子层结构 3.氧化态 镧系元素前三级电离势之和是比较低的,比某些过渡元素要低。如: 而且无论在酸性还是碱性介质中,值的比较小,因此镧系金属在水溶液中容易形成+3价离子。+3是镧系元素特征氧化态。 镧系中有些元素还存在除+3价以外的稳定氧化态。Ce、Pr、Tb、Dy常呈现+4氧化态,而Sm、Eu、Tm、Yb则呈现+2价氧化态。(为什么?) 这是因为它们的离子电子结构保持或接近半充满或饱满状态。 15.2 镧系收缩及后果 1.镧系收缩现象 镧系元素的原子(离子)半径,随着原子序数的增大而缩小,这种现象称为镧系收缩。 南方医科大学成人教育 药学专科《无机化学》作业题 年级姓名学号 注意:本作业必须手写,在考试之前上交才有分数! 可能用到的原子序数:21 Sc,22 Ti,23 V,24 Cr,25 Mn 26 Fe,27 Co,28 Ni,29 Cu,30 Zn 一、是非题(在题前括号内对者打“√”,错者打“×”。) ( ) 1.一定温度下,同一弱电解质溶液,浓度越大,其电离度越大。 ( ) 2.一定总浓度的缓冲溶液,在缓冲组分浓度比为1:1时,缓冲容量最大。( ) 3.NH4Ac水溶液呈中性,说明NH4Ac没有发生水解。 ( ) 4.Ag2CrO4的Ksp = 1.1×10-12,AgCl的Ksp = 1.8×10-10,因此在纯水中AgCl 的溶解度较大。 ( ) 5.盐效应通常使难溶电解质的溶解度稍有增大。 ( ) 6.氢电极的电极电位永远为零。 ( ) 7.在Na2S4O6中S的氧化数为+2.5。 ( ) 8.一般来说,金属越活泼,其标准电极电位值越高。 ( )9.电子云是核外电子几率密度分布的形象化表示。 ( )10.屏蔽效应使多电子原子的外层电子能量升高了。 ( )11.离子键的本质是正负离子间的静电引力。 ( )12.按照分子轨道理论,Be2分子实际上是不存在的。 ( )13.氢键有饱和性和方向性,因此也属于化学键。 ( )14.在正方形静电场中,中心离子的d轨道分裂为四组。 ( )15.对于金属电对M n+/M,形成配离子通常会增强M n+的氧化能力。 ( )16.无水CaCl2作干燥剂时,可用来干燥H2、CO2、NH3。 ( )17.H2O2是平面型分子。 ( )18.离子半径越大,离子间作用力越大。 ( )19.Mg2+与S2-均属于8电子构型。 ( )20.共价键的饱和性是指原子有几个电子,便可以形成几根共价键。 ( )21.共价键一般可分为σ 键和 π 键两种。 ( )22.H2O分子中有两根O-H键,因此O是采取sp杂化的。 ( )23.中心离子周围配体数就是中心离子的配位数。 ( )24.所有配合物都有内界、外界之分。 ( )25.[FeF6] 3-是外轨型配离子,因而是顺磁性的。 ( )26.配合物的K不稳越大,表示配合物越易离解,不稳定。 ( )27.多基配体都可以作螯合剂。 ( )28.根据酸碱电子理论,X -(卤素离子)属于碱。 ( )29.氢氟酸能腐蚀玻璃,因此不能用玻璃器皿贮存。 ( )30.HClO4是无机酸中的最强酸。 ( ) 31.若溶液的pH > pOH,则呈酸性。 ( )32. K a值大小可用于比较同类型弱酸酸性相对强弱。 ( )33.一元弱酸HA溶液中,δA-随pH增大而增大。 ( )34.Na2CO3 ~ NaHCO3缓冲体系中,抗酸成分是NaHCO3。 ( )35.酸碱反应的实质是质子的转移。 ( )36.盐效应通常使难溶电解质的溶解度明显减小。 ( )37.原电池中,电子流出的一极为负极。 ( )38.通常同离子效应使难溶电解质的溶解度降低。 ( )39.原子轨道就是电子在核外运动的轨迹。 ( )40.对于同一种元素原子,各级电离能大小的顺序总是第一电离能<第二电离< 第三电离能……。厦门大学无机化学习题16 过渡元素(二)
厦门大学无机化学知识第12章ds区元素.doc
无机化学(药学专)——考试题库及答案.docx
厦门大学无机化学试卷
药学、药物制剂-《无机化学》大纲
厦大无机化学考研经验
厦门大学无机化学习题12 卤素
厦门大学2004级无机化学二期中考试试题
厦门大学无机化学习题07 碱金属和碱土金属
药学专业无机化学的教育革新
无机化学理论教学大纲(药学新修)
厦门大学无机化学习题01 化学热力学初步
厦门大学无机化学习题10 氮族元素
高职药学专业无机化学练习题
厦门大学无机化学第12章ds区元素
厦门大学无机化学第15章 f区元素
药学专科《无机化学》作业