
最新九年级化学化学计算题技巧和方法完整版及练习题
一、中考化学计算题
1.某混合溶液中含有硫酸和盐酸,取该混合溶液20g 于烧杯中,不断滴加氢氧化钡溶液,反应过程中烧杯中产生沉淀的质量、溶液pH 的变化如图所示(BaCl 2溶液呈中性)。求:
(1)完全反应后生成沉淀的质量为_____g ; (2)氢氧化钡溶液的质量分数为_____;
(3)计算20g 混合溶液中HCl 的质量为多少?_____ 【答案】4.66 17.1% 2.92g 【解析】 【分析】
根据图可知,生成4.66g 沉淀消耗的氢氧化钡溶液的质量为20g ,而总消耗的氢氧化钡的溶液的质量为60g ,则与盐酸反应的氢氧化钡溶液的质量为60g ﹣20g =40g ,据此结合对应的化学方程式求算。 【详解】
由图可知生成沉淀的质量为4.66g ,与硫酸反应的氢氧化钡溶液的质量为20g 设氢氧化钡溶液的质量分数为x
2
2442Ba(OH)+H SO BaSO +2H O
171233
20gx
4.66g
↓=
171233
=20g 4.66g
x x =17.1%
与盐酸反应的氢氧化钡溶液的质量为60g ﹣20g =40g 设20g 混合溶液中HCl 的质量为y
22
2()1717317.1%40g y
Ba OH +2HCl BaCl +2H O
?=
17173
=17.1%40g y
?
y=2.92g
故填:(1)4.66;(2)17.1%;(3)2.92g
【点睛】
根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
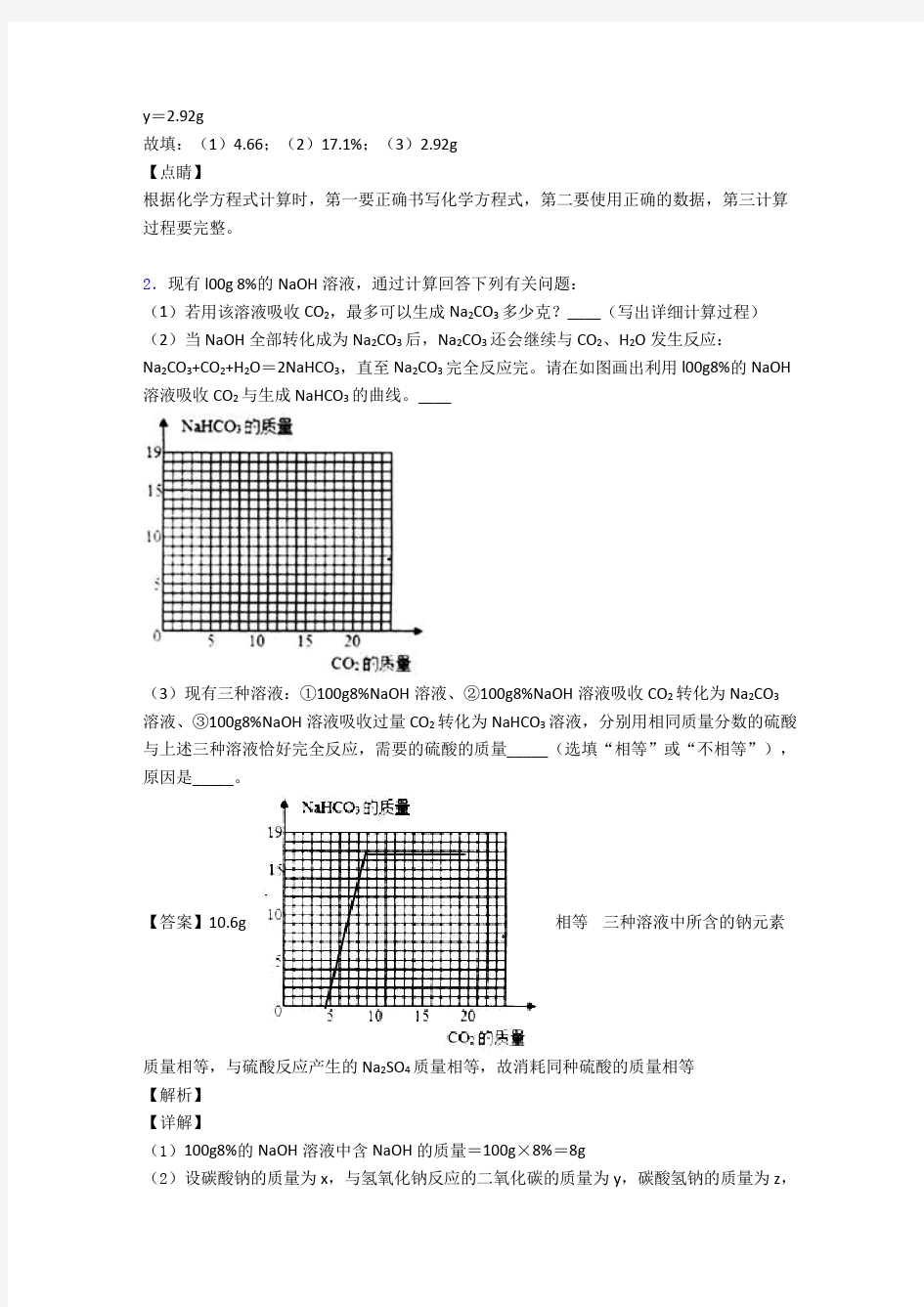
2.现有l00g 8%的NaOH溶液,通过计算回答下列有关问题:
(1)若用该溶液吸收CO2,最多可以生成Na2CO3多少克?____(写出详细计算过程)(2)当NaOH全部转化成为Na2CO3后,Na2CO3还会继续与CO2、H2O发生反应:
Na2CO3+CO2+H2O=2NaHCO3,直至Na2CO3完全反应完。请在如图画出利用l00g8%的NaOH 溶液吸收CO2与生成NaHCO3的曲线。____
(3)现有三种溶液:①100g8%NaOH溶液、②100g8%NaOH溶液吸收CO2转化为Na2CO3溶液、③100g8%NaOH溶液吸收过量CO2转化为NaHCO3溶液,分别用相同质量分数的硫酸与上述三种溶液恰好完全反应,需要的硫酸的质量_____(选填“相等”或“不相等”),原因是_____。
【答案】10.6g 相等三种溶液中所含的钠元素
质量相等,与硫酸反应产生的Na2SO4质量相等,故消耗同种硫酸的质量相等
【解析】
【详解】
(1)100g8%的NaOH溶液中含NaOH的质量=100g×8%=8g
(2)设碳酸钠的质量为x,与氢氧化钠反应的二氧化碳的质量为y,碳酸氢钠的质量为z,
和碳酸钠反应的二氧化碳的质量为a
根据2NaOH+CO2=Na2CO3+H2O和 Na2CO3+CO2+H2O=2NaHCO3,可得关系式为:22323
2NaOH~CO~Na CO CO~2NaHCO
804410644168
8g y x a z
804410644168
====
8g y x a z
x=10.6g
y=4.4g
z =16.8g
a=4.4g
利用l00g8%的NaOH溶液吸收CO2与生成NaHCO3的曲线,起点4.4、拐点(8.8,16.8)。如图:
(3)三种溶液中所含的钠元素质量相等,根据钠元素守恒和硫元素守恒,可知与硫酸反应产生的Na2SO4质量相等,故消耗同种硫酸的质量相等。
故答案为
(1)10.6g;(2);(3)相等;三种溶液中所含
的钠元素质量相等,与硫酸反应产生的Na2SO4质量相等,故消耗同种硫酸的质量相等。。
3.取某碳酸钠样品放入烧杯中,加入95.8g水充分溶解,再向其中加入稀硫酸,反应放出气体的总质量与所加入稀硫酸的质量关系曲线如下图所示,请根据题意解答问题:
(1)当加入196g 稀硫酸时,放出气体的质量为___________g 。 (2)计算加入的稀硫酸溶液溶质的质量分数为____________。
(3)试通过计算求出加入98g 稀硫酸(即A 点)时烧杯中溶液溶质的质量分数。(写出计算过程)_____________ 【答案】4.4 10% 7.1% 【解析】 【分析】 【详解】
(1)从题中图像可知,当加入稀硫酸98g 时,生成的气体质量达到最大值4.4g ,此时碳酸钠和稀硫酸完全反应,因此继续加入稀硫酸至196g ,气体质量不会增加,因此反应中放出气体的质量为4.4g ;
(2)因为加入稀硫酸98g 时,生成的气体质量达到最大值4.4g ,所以此时碳酸钠和稀硫酸完全反应。
设加入的98g 稀硫酸中溶质硫酸的质量为x ,恰好反应时生成的硫酸钠质量为y ,参加反应的碳酸钠的质量为z 。
2324
2422Na CO Na SO +H SO =++10698142
44z
x
y
H C g
O O 4.4↑
98x =44 4.4g
解得x=9.8g
稀硫酸中溶质的质量分数为:
9.8g
100%=10%98g
? 142y
=44 4.4g
解得y=14.2g
106z
=44 4.4g
解得z=10.6g
(3)加入98g 稀硫酸溶液时的溶液为碳酸钠和稀硫酸恰好完全反应时的溶液,溶液中溶质
的质量分数为:
14.2g
100%=7.1% 10.6g+95.8g+98g-4.4g
?
答:稀硫酸的溶质质量分数为10%;A点时烧杯中溶液的溶质质量分数为7.1%。
4.小明称取用侯氏制碱法制得的纯碱样品(杂质仅为氯化钠)12.4g,加入到100g溶质质量分数为7.3%的稀盐酸中,恰好完全反应。求所得溶液的溶质质量分数为__________。【答案】12.5%
【解析】
【详解】
由题意得:100g溶质质量分数为7.3%的稀盐酸中氯化钠的质量为100g×7.3%=7.3g。
设参加反应的Na2CO3质量为x,生成的NaCl的质量为y,生成二氧化碳的质量为z。
2322
Na CO+2HCl=2NaCl+CO+H O
1067311744
x7.3g y z
1067311744
===
x7.3g y z
↑
解之得x=10.6g,y=11.7g,z=4.4g。
纯碱样品中NaCl的质量=12.4g-10.6=1.8g
反应后溶液中NaCl的质量为=11.7g+1.8g=13.5g。
反应后溶液中NaCl的质量分数=
12.4100 4.4
13.5g
g g g
+-
×100%=12.5%
故答案为:所得溶液中溶质的质量分数为12.5%。
5.为测定某一样品中含杂质的含量,并配制一定溶质质量分数的氯化镁溶液。进行如下实验:把100g的稀盐酸加入到20g含杂质的MgCO3和MgCl2的样品粉末中(杂质即不溶于水,也不和盐酸反应),完全反应后得到中性溶液,其操作过程如图。回答下列问题:
(1)写出发生反应的化学方程___;
(2)求解混合物中发生反应物质的质量(X)的比例式为___;
(3)样品中杂质的含量为___;
(4)所得溶液中溶质的质量分数为___;
(5)用36.5%的浓盐酸配制100g上述稀盐酸时,需要此浓盐酸的质量为___。
【答案】MgCO3+2HCl═MgCl2+H2O+CO2↑
84x
=
44 4.4g
10.5%; 9.5% 20g
【解析】 【分析】
碳酸镁和盐酸反应生成氯化镁和水以及二氧化碳。 【详解】
根据质量守恒定律可得,生成的二氧化碳的质量为20g+100g 115.6g 4.4g ﹣
= 设碳酸镁的质量为X ,HCl 的质量为y ,生成的氯化镁的质量为z
3222MgCO 2HCl MgCl H O +=++CO 847395 44x
g
y
z
4.4↑
84739544==
=x y z 4.4g
x 8.4g
y 7.3g z 9.5g
=== 样品中杂质的含量为
2.1g
100%=10.5%20g
? 所得溶液中溶质的质量分数为
20g-2.1g-8.4g+9.5g
100%=9.5%20g-2.1g+100g-4.4g+86.5g
?
用36.5%的浓盐酸配制100g 上述稀盐酸时,需要此浓盐酸的质量为
7.3g
=20g 36.5%
6.某校化学实验室要测定过氧化氢溶液的溶质质量分数。设计实验如下图所示。
请计算:
(1)生成氧气的质量。
(2)过氧化氢溶液的溶质质量分数。 【答案】(1) 0.8g (2)3.4% 【解析】
试题分析:依据质量守恒定律化学反应前后物质的总质量不变,那么减少的质量为生成的氧气的质量;再利用化学方程式,根据氧气的质量可求出过氧化氢中溶质的质量; 解:⑴氧气的质量为:3g+50g-52.2g=0.8g ⑵设过氧化氢溶液中溶质质量为x 。
2H2O2 2H2O + O2↑
68 32
x 0.8g
x=1.7g
则过氧化氢溶液的溶质质量分数=
答:略。
考点:
7.将1.17g氯化钠固体放入烧杯中,加入51.7g水充分溶解后得到常温下氯化钠的不饱和溶液,再向所得溶液中逐滴滴入100g一定溶质质量分数的硝酸银溶液。实验过程中生成沉淀的质量与滴入硝酸银溶液的质量关系如图所示:
(1)B点时,溶液中所含硝酸银的质量为______。
(2)A点时,所得溶液中溶质质量分数为____。(计算结果精确到0.1%)
【答案】3.4g 1.7%
【解析】
【分析】
根据题意和题中图像变化可知,氯化钠不饱和溶液加入硝酸银,氯化钠与硝酸银反应生成
NaCl+AgNO=NaNO+AgCl ;随着硝酸银溶硝酸钠和氯化银沉淀,反应方程式为:
33
液的加入,沉淀不断增加,当原溶液中氯化钠恰好反应完时,沉淀的质量达到最大,即图像中的A点,此时加入的硝酸银溶液为50g;继续加入硝酸银溶液,不再发生化学反应,至B点时,加入硝酸银溶液的总质量为100g,即反应完毕后又加入了相同的硝酸银溶液
50g,因此B点时,溶液中硝酸银的质量即前50g反应过程中消耗的硝酸银质量,已知氯化钠质量,可以根据氯化钠和硝酸银反应的方程式设未知数求解;A点时,溶液的成分是硝酸钠溶液,可以根据氯化钠和硝酸银反应的方程式设未知数求出硝酸钠质量,再根据质量守恒定律,用反应前的总质量减去沉淀质量得出反应后溶液的总质量。
【详解】
解:设生成的氯化银的质量为x,生成的硝酸钠的质量为y,所消耗的硝酸银的质量为z NaCl+AgNO3=NaNO3+AgCl↓
58.5 170 85 143.5
1.17g z y x
58.517085143.5
===
1.17g z y x
x=2.87g
y=1.7g
z=3.4g
(1)、由于到B点,实际又加入了50g 硝酸银溶液,所以硝酸银的质量为3.4g
(2)、A点时,所得溶液中溶质质量分数为
1.7g
1.17g+50g+51.7g-
2.87g
×100%=1.7%
【点睛】
本题考查分析化学反应过程及图像变化过程,再利用化学方程式、质量守恒定律和溶液溶质质量分数计算公式进行综合计算;分析过程中要注意结合图像去理解化学反应的过程,注意图像中的拐点的意义,注意所求未知量在反应过程中的出现点;计算过程中按照计算的基本步骤,设未知数,列方程式与质量关系,列式求解,对于多个未知量,一个方程式的计算可以同时计算,最后再分开计算;还要注意题目中对计算结果的精确值即保留小数位数的要求。
8.侯氏制碱法生产的碳酸钠中常含有少量的氯化钠。现有碳酸钠和氯化钠的混合物样品12.5 g,将其放入干净的烧杯中,加入 100 g 水,使其完全溶解。向所得溶液中加入溶质质量分数为 7.3%的稀盐酸,烧杯中溶液的质量与加入稀盐酸的质量关系曲线如图所示。请回答下列问题。
(1)B 点时,烧杯中溶液里存在的阳离子为_____(填写离子符号)。
(2)在碳酸钠和氯化钠的混合物样品中,含碳酸钠的质量为_____(结果精确至 0.1 g)。
(3)A 点时,求此温度下所得不饱和溶液中溶质质量分数_______(写出具体计算过程,计算结果精确至0.1%)。
【答案】Na+、H+; 10.6g; 6.5%
【解析】
根据B点时盐酸过量分析解答;根据反应的化学方程式计算解答。(1)由图可知,当滴入稀盐酸至B点时,加入的稀盐酸过量。烧杯中溶液里的溶质为NaCl、HCl,故存在的阳离子为Na+、H+;(2)由图可知,当滴入稀盐酸至A点时,加入的稀盐酸恰好与碳酸钠完
全反应。设样品中碳酸钠的质量为x ,生成氯化钠的质量为y ,二氧化碳的质量为z 。 Na 2CO 3 + 2HCl =2NaCl + H 2O + CO 2↑ 106 73 117 44 x 100g ×7.3% y z
1067311744
01007.30
x y z g ===
? x=10.6g y=11.7g z=4.4g
(3)当滴入稀盐酸至A 点时,所得不饱和溶液中溶质质量为12.5g+11.7g-10.6g=13.6g ;所得不饱和溶液中溶质质量为100g+12.5g+100g-4.4g=208.1g ;所得不饱和溶液中溶质质量分数为
13.6g
208.1g
×100%=6.5%。
答:(2)在碳酸钠和氯化钠的混合物样品中,含碳酸钠的质量为10.6g ; (3)A 点时,求此温度下所得不饱和溶液中溶质质量分数为6.5%。
9.(6 分)一定质量的碳酸钠和氯化钠固体混合物,加入101 克水完全溶解后,再往其中加入100g 氯化钙溶液,恰好完全反应。过滤,将滤渣干燥,称得其质量为10g ,测得滤液中溶质的质量分数为10%。试计算: (1)100g 氯化钙溶液中溶质的质量。 (2)原固体混合物中碳酸钠的质量分数。 【答案】(1)11.1g (2)53% 【解析】
试题分析:氯化钙与碳酸钠反应生成的是碳酸钙沉淀和氯化钠。根据题意可知碳酸钙沉淀的质量为10g 。利用化学方程式根据反应的质量比即可计算出各物质的质量。 设氯化钙溶液中溶质的质量为x ,碳酸钠的质量为y ,生成的氯化钠的质量为z ,那么: Na 2CO 3 + CaCl 2 ="=" 2NaCl + CaCO 3↓ 106 111 117 100 y x z 10g
100/10g=111/x 100/10g=106/y 100/10g=117/z x=11.1g y=10.6g z=11.7g 设混合物中氯化钠的质量为a ,那么: 反应后溶质的质量=a+11.7g
反应后溶液的质量=10.6g+a+101g+100g-10g
氯化钠溶液的溶质质量分数= (a+11.7g )/(10.6g+a+101g+100g-10g ) ×100% =10% a=9.4g
混合物中碳酸钠的质量分数=9.4g /(9.4g+10.6g )×100% =53% 答:略
考点:有关化学方程式的计算
10.侯德榜是我国化学工业的奠基人,纯碱工业的创始人。他发明的“侯氏制碱法”,缩短了生产流程,减少了对环境的污染,在人类化学工业史上写下了光辉的一页。侯氏制碱法的主要反应为:
NH3 + CO2 + H2O + NaCl = NaHCO3 + NH4Cl ,
他利用生成物中的NaHCO3溶解度较小,一经生成便会大量析出,能够很容易的分离出NaHCO3。
化学小组同学模拟“侯氏制碱法”完成以下实验:10℃时,向92.6g饱和NaCl溶液中先通入足量NH3共3.4g,再通入一定量CO2至恰好完全反应。请计算:(不考虑溶解在溶液中的NH3和CO2的质量)。
(1) NH4Cl可作为氮肥使用,其中氮元素的质量分数(只写出计算过程)___________。(2)以上反应中消耗CO2的质量是多少?
(3)反应后称量溶液中析出NaHCO3晶体的质量为14.4g,则剩余溶液的质量是多少?【答案】(1)14/53.5×100%(2)8.8g(3) 90.4g
【解析】
试题分析:(1)根据化学式NH4Cl,氮元素的质量分数=14/53.5×100%
(2)根据化学方程式:NH3 + CO2 + H2O + NaCl = NaHCO3 + NH4Cl中NH3与CO2的质量关系,即可求出消耗CO2的质量
解:设CO2的质量为x
NH3 + CO2 + H2O + NaCl = NaHCO3 + NH4Cl
17 44
3.4g x
17:44=3.4g:x x=8.8g
(3)根据质量守恒定律:化学反应前后,物质的质量不变,故剩余溶液的质量
="8.8g+3.4g+92.6g-14.4g=" 90.4g
考点:根据化学式、化学方程式进行计算
初中化学计算专题 (一)有关化学式计算题类型: 第一种类型:标签型化学式计算题: 1、在现代生活中,人们越来越注重微量元素的摄取。碘元素对人体健康有至关重要的作用。下表是某地市场销售的一种“加碘食盐”包装袋上的部分说明。请回答下列问题: (1)由食用方法和贮藏指南可推测碘酸钾(KIO 3)的化学性质之一是 ; (2)计算碘酸钾(KIO 3)中,钾元素、碘元素、氧元素的质量比 ; (3)计算碘酸钾(KIO 3)中,碘元素的质量分数是多少? ;(计算结果精确到0.01,下同)(4)计算1kg 这样的食盐中,应加入 g 碘酸钾(用最高含碘量计算) 第二种类型:叙述型化学式计算题: 1、蛋白质是由多种氨基酸[丙氨酸:CH 3CH(NH 2)COOH 等]构成的极为复杂的化合物,人体通过食物获得蛋白质,在胃肠道里与水发生反应,生成氨基酸,试计算:(1)丙氨酸分子中氮原子与氧原子的个数比 。(2)丙氨酸的相对分子质量 。 (3)丙氨酸中碳、氢、氧、氮元素的质量比 。 2、抗震救灾,众志成城。用于汶川震后防疫的众多消毒剂中,有一种高效消毒剂的主要成分为三氯异氰尿酸(C 3O 3N 3Cl 3),又称高氯精。下列有关高氯精的说法不正确的是( ) A .高氯精由4种元素组成 B .高氰精中C 、O 、N 、Cl 的原子个数比为1∶1∶1∶1 C .高氯精中C 、N 两种元索的质量比为12∶14 D .高氯精中氯元素的质量分数为25% 第三种类型:综合型化学式计算题: 1、青少年正处于生长发育时期,每天需要摄取足量的蛋白质,蛋白质的代谢产物主要是尿素[CO(NH 2)2]。若从食物中摄取的蛋白质经体内新陈代谢后完全转化为尿素排出体外,每人每天相当于排出尿素30g 。(1)30g 尿素中含氮元素多少克? (2)已知蛋白质中氮元素的平均质量分数为16%,则每人每天至少应从食物里摄取的蛋白质为多少克? (3)请你根据下表中几种常见食物的蛋白质含量,计算出每天至少应摄人多少克下列食物才能满足你对蛋白质的需求(可以只摄取一种食物,也可同时摄取几种食物)。 2.近年来,我市积极探索建设社会主义新农村的服务体系,许多农户获得“测土配方施肥”服务,有效解决了施肥比例不合理问题,提高了产量,减少了环境污染。小明家种了一片麦子,经农科人员测定该片土壤需补充钾元素39kg ,氮元素42kg 。请你帮小明算算,至少需购买硝酸钾、硝酸铵各多少千克? (二)有关化学方程式的计算题: (1)有关反应物和生成物的计算 1、工业上使用一种“渗铬( Cr )技术”可以大大提高钢铁制品的抗腐蚀能力。其中一个主要
焦岱初中 1某工厂排岀的废液中含有AgN0 3、Zn ( NO3) 2、Cu ( NO 3) 2三种物质?为了分离并回收金属银和铜,设计了如 下实验方案: (1 )反应①中与铜粉反应的物质是 (2) 反应②中发生反应的化学方程式是 (3) 从固体丫中得到金属铜的方法有:物理方法: ?化学方法: 2、向一定量NaOH溶液中,滴加稀HCI,所加盐酸的量与溶液pH的变化如图所示 : ⑴当加入稀HCI的体积为 ___________ m l时,稀HCI与NaOH溶液恰好完全反应; ⑵向上述加了12ml稀盐酸后的NaOH溶液滴加紫色石蕊试液,溶液显_______________ 色; ⑶当加入8mL稀盐酸后,溶液中的溶质有 3、把12.5g的大理石放入盛有34.4g稀盐酸的烧杯中,恰好完全反应后,烧杯中物质的总质量比反应前减少了 4.4g ?求大理石中碳酸钙的质量分数是多少? 4、为了探究石灰石与稀盐酸反应制备二氧化碳后的废液中的溶质成分,将废液 过滤,取滤液20克于烧杯中,在不断振荡的条件下,向其中滴加质量分数为 10.6 %的碳酸钠溶液直至过量,有关的变化如右图所示: 根据题中有关信息和图像分析回答下列问题: 0 5 加瞪醴钠清港质量您(1 )原废液中的溶质成分有 _____________________________ (用化学式回答) (2) A点处溶液中溶质的质量?(通过计算回答) 5、50g某稀硫酸中滴加某氯化钡溶液73.3g恰好完全反应,经过滤、洗涤、烘干得到23.3g白色沉淀?试回答:
(1) _________________________________ 在过滤操作中需要的玻璃仪器有 ; (2 )反应后所得溶液中溶质的质量分数. 6、 现有氯酸钾和二氧化锰的混合物共 26.5g ,待反应不再有气体生成后,将试管冷却、称量,得到剩余固体 16.9g 求: ⑴制取氧气的质量;⑵剩余固体中含有的物质各为多少 g ? 7、 将一定质量的金属锌投入到 100g 稀硫酸中恰好完全反应,放岀气体的质量与反应时间的关系如图所示?试求: (2) 所用硫酸溶液中溶质的质量分数. 8、 10g 氯酸钾与二氧化锰的混合物加热,完全反应后,质量减少 3.2g ,则原混合物中二氧化锰的质量是多少? 9、 实验用2.45g 的氯酸钾和0.2g 的二氧化锰最多可制取多少克的氧气? 10、 实验室用含杂质的锌与稀盐酸反应制取氢气, 取8 g 含杂质的锌粒于烧杯中(所含杂质不溶于水, 也不与酸反应), 向其中加入74.2 g 稀硫酸,恰好完全反应后烧杯内剩余物质的质量为 82 g 。计算: ⑴杂质的质量 __________ g 。 (2)反应后所得溶液的溶质质量分数(请写岀计算过程)。 11、 实验室有一瓶久置且瓶盖破损的氢氧化钠固体,现取该固体 10g ,加入50g 一定质量分数的盐酸至完全反应后, 称得剩余溶液质量为 58.9g ,求变质后生成物质的质量分数. 12、 硫酸铜溶液可以作过氧化氢分解的催化剂?现取一定溶质质量分数的过氧化氢溶液 68g 倒入锥形瓶中,向其中 加入11.6g 硫酸铜溶液,使过氧化氢完全分解,得到 78g 硫酸铜溶液. (1 )完全反应后生成 H 2的质量为 ___ g ;
初中化学计算题解题方法 一、质量守恒定律: “质量守恒”指参加化学反应的各物质质量总和等于生成物的各物质质量总和相等(不包括未参加反应的物质的质量,也不包括杂质)。理解质量守恒定律抓住“五个不变”,即: 二、化学方程式计算的解题技巧与方法: 化学计算是中学化学教学的重要内容之一, 它包括化学式的计算、化学方程式的计算、溶液的计算等。是从量的方面帮助学生认识物质及其变化规律的。通过有关混合物发生反应的化学方程式、质量分数和物质溶解度的综合计算题,可以帮助学生加深对有关概念和原理的理解,培养学生的思维判断、分析和综合能力。化学计算题涉及的内容丰富、形式多样,既考查学生的化学基础知识,又考查学生的数学推算能力。学生如果了解掌握了一些解题的技巧或巧解方法,既可以激发他们的解题兴趣,有事半功倍的效果,尤其是刚接触化学,对化学计算存在畏惧心理的初中学生。现将化学竞计算题的解题方法和技巧归纳如下,供参考。 ㈠、差量法:差量法是依据化学反应前后的质量或体积差,与反应物或生成物的变化量成正比而建立比例关系的一种解题方法。将已知差量(实际差量)与化学方程式中的对应差量(理论差量)列成比例,然后根据比例式求解。 例:用含杂质(杂质不与酸作用,也不溶于水)的铁10克与50克稀硫酸完全反应后,滤去杂质,所得液体质量为55.4克,求此铁的纯度。 解:设此铁的纯度为x Fe+H 2SO 4 (稀)=FeSO 4 +H 2 ↑ △m(溶液质量增加) 56 2 56-2=54 10x 55.4g-50g=5.4g 可求出x=56% 答:此铁的纯度为56%。 【习题】1、将盛有12克氧化铜的试管,通一会氢气后加热,当试管内残渣为10克时,这10克残渣中铜元素的质量分数? 2、已知同一状态下,气体分子间的分子个数比等于气体间的体积比。现有CO、 O 2、CO 2 混合气体9ml,点火爆炸后恢复到原来状态时,体积减少1ml,通过氢氧化钠溶液 后,体积又减少3.5 ml,则原混和气体中CO、O 2、CO 2 的体积比? 3、把CO、CO 2 的混合气体3.4克,通过含有足量氧化铜的试管,反应完全后,将导出的气体全部通入盛有足量石灰水的容器,溶液质量增加了4.4克。 求⑴原混合气体中CO的质量?⑵反应后生成的CO 2与原混合气体中CO 2 的质量比? 4、CO和CO 2混合气体18克,通过足量灼热的氧化铜,充分反应后,得到CO 2 的 总质量为22克,求原混合气体中碳元素的质量分数? 5、在等质量的下列固体中,分别加入等质量的稀硫酸(足量)至反应完毕时,溶液质量最大的是() A Fe B Al C Ba(OH)
计算题专题复习(提高篇) 可能用到的相对原子质量:Mn—55;Mg—24;Fe—56;Zn—65;Al—27;Ca—40;Cl —35.5;K—39;Cu—64;H—1;O—16;C—12;Na—23;S—32;N—14;Si—28;Ba—137 一、平均值型计算选择题: 例1:两种金属粉末的混合物30克,与足量的稀硫酸反应,只生成氢气1克,则这种混合物中的两种金属可能是() A.Mg Al B.Zn Fe C.Mg Fe D.Al Fe 【同题链接】 1、一种不纯的铁,已知它含有铜、钙、镁的一种或几种金属杂质,5.6g这样的铁跟足量的稀H2SO4反应时,生成H20.2g,则该铁样品中一定含有的金属杂质是()A.铜 B.镁 C.铝 D.钙 2、把含有某一种氯化物杂质的氯化镁粉末95g溶于水后加入足量的AgNO3溶液,完全反应后生成白色沉淀300g,则氯化镁中的杂质不可能是() A.NaCl B.AlCl3 C.KCl D.CaCl2 3、在某铁的样品中可能含有Zn、Mg、Al、Cu等杂质金属中的2种,取5.6g样品跟足量稀硫酸反应,得到0.20gH2,则此铁的样品中不可能含有的杂质金属组是() A. Cu和Mg B. Zn和Al C. Mg和Al D. Zn和Cu 4、某不纯的氯化铵样品中,测得其中氮元素的质量分数为28%,则混主的一种杂质可能是 ①NH4HCO3②(NH4)2SO4③NH4NO3④CO(NH2)2() A.只有① B.①③ C.②③ D.无法确定 二、估算型选择题 例2:20g20%的NaOH溶液与20g20%的H2SO4溶液充分反应后,滴入紫色石蕊试液是()A.蓝色 B.紫色 C.红 D.无色 【同题链接】 1、相同质量的下列的物质中,铁的质量分数最高的是() A.FeS B.FeCO3 C.Fe2O3 D.Fe3O4 2、由二氧化硫和三氧化硫组成的混合气体中,硫元素与氧元素的质量比可能是() A. 1∶1 B. 1∶1.25 C. 1∶1.5 D. 1∶2 3、由碳和氧两种元素组成的气体,经测定碳与氧两种元素的质量比为3:5,该气体是() A.混合物 B.纯净物 C.化合物 D.有机物 三、特殊规律型选择题 例3:某甲醛(HCHO)溶液中氢元素的质量分数为10%,则碳元素的质量分数正确的是()A.12% B.10% C.8% D.6% 【同题链接】 1、已知NaHS、MgSO4、和NaHSO3由组成的混合物中硫元素的质量分数为20%,则氧元素的质量分数为() A.35% B.25% C.65% D.无法计算 2、将Na、Mg、Al分别放入盐酸溶液中,反应结束后,放出氢气质量相同,其原因是() A.放入Na、Mg、Al的质量相同 B.放入Na、Mg、Al的质量比是23:12:9和足量盐酸反应 C.放入过量的Na、Mg、Al,而盐酸为同质量分数、同体积、同质量。 D.放入Na、Mg、Al的质量比为3:2:1 四、溶质的质量分数计算
最新初三化学化学计算题试题经典 一、中考化学计算题 1.现将100 g溶质质量分数为9.8%的稀硫酸与一定质量的氯化钡溶液恰好完全反应后,过滤得到284.7 g滤液。计算: (1)生成硫酸钡沉淀的质量。 (2)氯化钡溶液中溶质的质量分数。 【答案】(1)生成硫酸钡沉淀的质量为23.3 g。(2)氯化钡溶液中溶质的质量分数为10%。【解析】 试题分析:解:设生成硫酸钡沉淀的质量为x,反应的氯化钡的质量为y。 H2SO4质量为:10 0g×9.8%=9.8 g BaCl2 + H2SO4 = BaSO4↓ + 2HCl 208 98 233 y9.8 g x 233/98 =x/9.8x=23.3 g 208/98 =y/9.8y=20.8 g (2)氯化钡溶液的质量为:284.7 g+23.3 g-100 g=208 g 氯化钡溶液的溶质质量分数为:20.8 g/208 g×100%=10% 考点:根据化学方程式的计算溶质的质量分数 2.氧化亚铜(Cu2O)可用于生产船底防污漆,防止海生物对船舶设备的污损。现将Cu2O 和Cu的固体混合物20g放入烧杯中,加入质量分数为24.5%的稀硫酸50g,恰好完全反应。已知:Cu2O+H2SO4═CuSO4+Cu+H2O.计算: (1)所加稀硫酸中溶质的质量为_____g。 (2)原混合物中Cu2O与Cu的质量比_____(写出计算过程,结果用最简整数比表示)(3)在图中画出向20g Cu2O和Cu的固体混合物中逐滴加入24.5%的稀硫酸至过量,铜的质量变化曲线_____。
【答案】12.25 9: 1 。 【解析】 【分析】 根据加入的硫酸中溶质的质量和对应的化学方程式求算氧化亚铜的质量,进而求算对应的比值以及画图。 【详解】 (1)所加稀硫酸中溶质的质量为24.5%×50g =12.25g ;故填:12.25 (2)设原混合物中Cu 2O 的质量为x ,生成的铜的质量为y 。 224421449864x 12.Cu O+H SO CuSO +C 2u +H 5O g y ═ 1449864 ==x 12.25g y 解得:x =18 g ;y =8g ; 原混合物中Cu 2O 与Cu 的质量比为18 g :(20 g ﹣18 g )=9:1;故填:9:1 (3)没加入硫酸时,铜的质量为2g ,加入到50g 稀硫酸时铜的质量为2g+8g =10g 。如下图所示; 故填: 【点睛】 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。 3.现有铜与另一种金属的混合物粉末,另一种金属可能是镁、铁、锌中的一种,现欲测定其组成. (查阅资料)(1)镁、铁、锌皆能与稀硫酸发生置换反应,且生成+2价的可溶性金属硫酸盐和氢气. (2)相对原子质量:Mg ﹣24、Fe ﹣56、Zn ﹣65 (实验步骤及数据)取该混合物粉末8.0g 放入烧杯中,将140.0g 14.0%的稀硫酸分四次加
初三化学计算题 1.用氯酸钾和二氧化锰的混合物16g,加热制取氧气,待完全反应,冷却后称量,得到11.2g固体物质,计算原混合物中二氧化锰的质量(计算结果保留二位小数)。 2.刘彬同学的姑父从三峡搬迁到我们家乡后,准备兴建一座碳酸钙精粉厂。为检测当地石灰石中碳酸钙的纯度,他在实验室用6g石灰石样品(杂质不参加反应)与19g稀盐酸恰好完全反应,测得残留物为22.8g。求: (1)依椐质量守恒定律,生成二氧化碳g; (2)样品中碳酸钙的质量分数; (3)所用稀盐酸溶液中溶质的质量分数。 3、某工厂的废料中含铁和铜,需回收此废料中的铜.现取铁和铜的混合物样品l0g,向其中加入废弃的稀硫酸50g恰好完全反应,产生0.1gH2。 求:①废料中铜的质量分数。 ②废弃稀硫酸中硫酸的质量分数。 7.取碳酸钠和氯化钠的固体混合物13,6g,与质量为73g的稀盐酸恰好完全反应?产生二氧化碳气体的质量为4.4g,计算: (1)固体混合物中碳酸钠的质量 (2)该稀盐酸中溶质的质量分数 (3)反应所得的溶液中溶质的质量分数(最后结果保留一位小数) 9.(6分) 小华想测定Cu-Zn合金及Cu-Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀盐酸和必要的仪器。 (1)你认为能测出其铜的质量分数的是____________合金; (2)小华取该合金的粉末32.5g,与足量该盐酸充分反应,经测定,产生了0.4g气体请求出该合金中铜的质量分数。 (3)若想测出该盐酸的质量分数,你认为实验时必须提供和测出的数据是_________(选填序号)。 A.参加反应的合金质量B.参加反应的稀盐酸的质量 C.参加反应的稀盐酸的体积和密度D.产生气体的质量 17、(本题要求写出计算过程) 将1.80g不纯的氯化铜样品(杂质不溶于水,也不参加反应)跟一定量的氢氧化钠溶液恰好完全反应,过滤后得到溶质质量分数为20.0%的溶液5.85g。求: (1)样品中氯化铜的质量分数 (2)加入氢氧化钠溶液的质量。 答案: 1.解:设原混合物中KClO3质量为x,依题意可知完全反应后生成氧气的质量为: 16g-11.2g=4.8g(1分) MnO2 由2KClO3=====2KCl+3O2↑(1分) △ 2.44 3.(5分)(1)解:设质量为x的这种稀硫酸可与4.0gCuO恰好完全反应 CuO +H2SO4 =CuSO4 +H2O(2分) 80 98 4.0g 10% x =(1分)
九年级化学专题训练—化学计算 一、有关化学式的计算 1.CO和x组成的混合气体中,氧元素质量分数为55%,则x是下列()物质 A、CO2 B、NO2 C、SO2 D、SO3 2.由MgO和另一种金属氧化物组成的混合物4g,已知含氧元素1.8g,则另一种金属氧化物是() A、CaO B、Fe2O3 C、Al2O3D、CuO 3.化合物X2Y和YZ2中,Y元素质量分数分别为40%和50%,则化合物X2YZ3中Y元素质量分数为() A、45% B、25% C、20% D、16.7% 4.FeSO4和Fe2(SO4)3的混合物中,硫元素质量分数为a%,则铁元素的质量分数为()A、 1—a% B、1—3a% C、2a% D、3a% 5.KCl和MgCl2的混合物中,钾元素与镁元素原子个数比为2:1,则混合物中,MgCl2的质量分数为() A、56% B、38.9% C、30% D、78% 6.有一包Mg和MgO组成的混合物,实验测知氧元素质量分数为32%,则其中镁单质占()A、20% B、40% C、48% D、80% 7.在O2和SO2的混合气体中,氧元素的质量分数为60%,则该混合气体中O2与SO2的质量比为()A、1∶1 B、2∶1 C、1∶4 D、1∶2 8.元素x、Y组成两种化合物A和B,A中x元素占14 17 ,B中x元素占 7 8 则x、Y组成的A、B 化合物的化学式分别为() A、xY、xY2 B、x2Y、x2Y3C、xY2、x2Y D、xY3、x2Y4 9.减弱“温室效应”有效措施之一是大量植树造林,绿色植物在叶绿素存在下的光合作用是完成二氧化碳循环的重要一环。已知叶绿素的相对分子质量小于900,其分子含C73.8%(以下均指质量分数)、H8.3%、N6.3%、Mg2.7%,其余为O.试确定叶绿素的化学式。 二、有关溶液的计算 1.5g某物质完全溶解在95g水中,所得溶液中溶质的质量分数为() A、等于5% B、小于5% C、大于5% D、无法确定 2.某硫酸钠溶液中,Na+与H2O分子个数比为1:50时,此溶液中硫酸钠质量分数为() A、32.4% B、1.96% C、7.3% D、88.75% 3.用60%酒精溶液甲与25%酒精溶液乙混合,配制成45%酒精,所用甲、乙溶液的质量比为() A、1∶2 B、2∶3 C、4∶3 D、3∶1 4.要使50g某物质溶液含水量由98%增加到99%,应加水() A、1g B、5g C、50g D、100g 5.海水中Na+的质量分数为1.42%,如全部以NaCl计算,则海水中NaCl的质量分数为() A、3.61% B、39.3% C、14.2% D、55.81% 6.25℃恒温条件下,将固体物质A的溶液200g蒸发20g水后,析出10gA;再蒸发20g水,又析出20gA,则蒸发前的溶液中溶质的质量分数是多少? 7.t℃时,将210gKNO3溶液蒸发20g水后析出4g晶体;若将210g溶液蒸发掉24g水后,析出6g晶体,则原KNO3溶液中溶质的质量是多少? 8.t℃时,将某固体物质溶液Mg分成两等份。一份恒温蒸发溶剂达饱和时,质量减轻一半,另一份加入该固体物质达饱和时,所加晶体质量恰好为比溶液质量的 1 4 。求t℃时,该物质的溶解度和原溶液中溶质的质量分数是多少? 9.t℃时,将含有A物质的溶液450g,蒸发掉310g水后,溶液恰好饱和;若另取45g这种溶液加入16g该物质,充分搅拌未完全溶解,再加9g水也恰好饱和,求A物质在t℃的溶解度和饱和溶液中溶质的质量分数。 10.某温度时,若在100g水中最多溶KNO325g,现有该温度下500gKNO3溶液,加热蒸发掉300g 水以后,冷却到原温度下,发现有50gKNO3晶体析出.计算:(1)蒸发并冷却到原温度后,溶液中有多少克KNO3?此时溶液中KNO3的质量分数是多少?(2)蒸发前的溶液中,KNO3的质量分数是多少? 三、无数据计算 1. 现有铁,锌,镁,铝四种金属分别与足量的稀硫酸反应,当生成氢气质量相等时,所消耗金属质量最小的是:() A.铁 B. 锌 C. 镁 D. 铝 2. 质量相同的一氧化碳,甲烷和酒精分别燃烧,消耗氧气最多的是:() A. 一氧化碳 B. 甲烷 C. 酒精 D. 无法判断 3. 一定质量的Fe2O3分别被CO、C和H2三种还原剂完全还原成铁,所生成的纯铁的质量是:()A. 一样多 B. CO多 C. C多 D. H2多 4. 两份质量相同的碳分别生成二氧化碳和一氧化碳,消耗氧气的质量比是:() A.1:1 B. 1:2 C. 2:1 D. 3:2 5. 质量相同,质量分数也相同的硫酸溶液,分别与足量的下列物质完全反应,所得MgSO4溶液的质量分数最大的是:()A.MgCO3 B. MgO C. Mg D. Mg(OH)2 6. Cu和Fe的混合粉末若干克,与足量盐酸反应后,过滤。将滤渣在空气中充分加热,加热后的质量恰好等于原混合物的质量,则原混合物中铁的质量分数:() A. 20% B. 40% C. 50.4% D. 80% 7. 将一定量的铁粉放入盛有硫酸铜溶液的烧杯中,充分搅拌,反应完成后,烧杯底部有固体物质,在烧杯中再加入足量稀硫酸,充分搅拌,能看到固体物质部分溶解,并有气泡产生。反应结
1 / 7 ①某纯净物的质量分数= ×100% 初中化学计算题 一、根据化学式的计算 1、计算相对分子质量 相对分子质量=化学式中各原子的相对原子质量的总和。 点拨:①计算物质的相对分子质量时,同种元素的相对原子质量与其原子个数是相乘的关系,不同种元素相对质量是相加的关系。②计算结晶水合物的相对分子质量时,化学式中的“·”表示相加,而不表示相乘。 ③化学式中原子团(或根)右下角的数字表示的是原子团(或根)的个数。计算时先求一个原子团或根的总相对原子质量,再乘以原子团(或根)的个数,即得出几个原子团的总相对原子质量。2、计算物质中各元素的质量比 组成化合物的各元素的质量比=化合物中各元素的相对原子质量总和(即相对原子质量与原子个数乘积)之比。点拨:①计算时一定要写清楚各元素质量比顺序,因顺序不同,比值也不同。 ②计算时的结果约成最简整数比。 3、计算物质中某元素的质量分数 4、已知某化合物的质量,求某元素的质量 化合物里某元素的质量=化合物的质量×化合物中某元素的质量分数 化合物的质量=化合物中已知元素的质量÷化合物中已知元素的质量分数 5、求化学式 点拨:求物质化学式的主要类型: ①由元素的相对原子质量和化合物的相对分子质量,确定化学式。 ②根据化合物中某元素质量分数确定化合物的化学式。 ③已知化合物中元素的质量比和相对原子质量,确定化学式。 原子个数比=元素的质量比:相对原子质量比 ④根据质量守恒定律确定化学式。 6、计算不纯物中某元素(或某纯净物)的质量分数 计算公式: ②不纯物中某元素的质量分数=不纯物中纯净物的质量分数×该纯净物中某元素的 化合物中某元素的质量×100%
【化学】九年级化学化学计算题专题训练答案及解析 一、中考化学计算题 1.为测定某大理石样品中碳酸钙(杂质不溶于水也不参与反应)的质量分数,某小组的同学进行了如下实验(水和氯化氢的挥发忽略不计):取12.5g样品研碎放入烧杯中,每次加入20.8 g稀盐酸后并用电子天平称量,记录实验数据如下。 请计算: ⑴大理石样品中碳酸钙的质量分数;____________ ⑵恰好完全反应时烧杯内溶液的溶质质量分数。_____________ 【答案】80% 12.5% 【解析】 【详解】 分析表中数据可知,前四次加入盐酸后,共产生二氧化碳:1.1g×4=4.4g 设大理石中CaCO3的质量为x,完全反应时,生成CaCl2的质量为y 3222 CaCO+2HCl=CaCl+H O+CO 10011144 x y 4.4g ↑ 10011144 == x y 4.4g 解得x=10g y=11.1g 大理石样品中碳酸钙的质量分数: 10 100% 12.5 g g ?=80% 恰好完全反应时烧杯内溶液的溶质质量分数 11.1 100% 1020.84 4.4 g g g g ? +?- =12.5% 答:(1)大理石样品中碳酸钙的质量分数为80%; (2)恰好完全反应时烧杯内溶液的溶质质量分数为12.5%。 2.为了测定含有氯化钾和碳酸钾的化肥中氯化钾的含量,取5g混合物和11.1%的氯化钙溶液做如下实验:
(1)写出上述反应的化学方程式_____; (2)请列出能与氯化钙反应的物质的质量(x)的比例式_____; (3)该化肥样品中氯化钾的纯度为_____; (4)过滤后,最终滤液中溶质的质量分数为_____; (5)若按上述过程用此化肥样品100t ,可以生产出纯净的氯化钾_____t 。 【答案】K 2CO 3+CaCl 2=CaCO 3↓+2KCl 138100 =x 1g 72.4% 10% 102.2 【解析】 【详解】 (1)碳酸钾溶液与氯化钙溶液反应生成碳酸钙和氯化钾,反应的化学方程式为:K 2CO 3+CaCl 2=CaCO 3↓+2KCl ; (2)设参与反应的碳酸钾的质量为x ,氯化钙的质量为y ,生成氯化钾的质量为z 。 23 23K CO +CaCl =CaCO +2K 138111100149z Cl x y 1g ↓ 138111100149 ===x y 1g z x=1.38g y=1.11g z=1.49g (3)样品中氯化钾的质量=5g-1.38g=3.62g 该化肥样品中氯化钾的纯度=3.62g 5g ×100%=72.4% (4)氯化钙溶液的质量为:1.11g ÷11.1%=10g 过滤后,最终滤液中溶质的质量分数= 5g-1.38g+1.49g 5g+37.1g+10g-1g ×100%=10% (5)此化肥样品100t 中含氯化钾的质量=100t ×72.4%=72.4t 此化肥样品100t 中含碳酸钾的质量=100t-72.4t=27.6t 设27.6t 碳酸钾完全反应生成氯化钾的质量为m 。 232 3K CO +CaCl =CaCO +21381492m KCl 7.6t ↓ 138149 =27.6t m
初中化学计算题专题复习 (一)有关化学式计算题类型: 第一种类型:标签型化学式计算题: 1、在现代生活中,人们越来越注重微量元素的摄取。 碘元素对人体健康有至关重要的作用。下表是某地市 场销售的一种“加碘食盐”包装袋上的部分说明。 请回答下列问题: (1)由食用方法和贮藏指南可推测碘酸钾(KIO 3)的 化学性质之一是 ; (2)计算碘酸钾(KIO 3)中,钾元素、碘元素、氧元素的质量比 ; (3)计算碘酸钾(KIO 3)中,碘元素的质量分数是多少? ;(计算结果精确到0.01,下同) (4)计算1kg 这样的食盐中,应加入 g 碘酸钾(用最高含碘量计算) 第二种类型:叙述型化学式计算题: 1、蛋白质是由多种氨基酸[丙氨酸:CH 3CH(NH 2)COOH 等]构成的极为复杂的化合物,人体通过食物获得蛋白质,在胃肠道里与水发生反应,生成氨基酸,试计算: (1)丙氨酸分子中氮原子与氧原子的个数比 。(2)丙氨酸的相对分子质量 。 (3)丙氨酸中碳、氢、氧、氮元素的质量比 。 2、抗震救灾,众志成城。用于汶川震后防疫的众多消毒剂中,有一种高效消毒剂的主要成分为三氯异氰尿酸(C 3O 3N 3Cl 3),又称高氯精。下列有关高氯精的说法不正确的是( ) A .高氯精由4种元素组成 B .高氰精中 C 、O 、N 、Cl 的原子个数比为1∶1∶1∶1 C .高氯精中C 、N 两种元索的质量比为12∶14 D .高氯精中氯元素的质量分数为25% 第三种类型:综合型化学式计算题: 1、青少年正处于生长发育时期,每天需要摄取足量的蛋白质,蛋白质的代谢产物主要是尿素[CO(NH 2)2]。若从食物中摄取的蛋白质经体内新陈代谢后完全转化为尿素排出体外,每人每天相当于排出尿素30g 。 (1)30g 尿素中含氮元素多少克? (2)已知蛋白质中氮元素的平均质量分数为16%,则每人每天至少应从食物里摄取的蛋白质为多少克? (3)请你根据下表中几种常见食物的蛋白质含量,计算出每天至少应摄人多少克下列食物才能满足你对蛋白质的需求(可以只摄取一种食物,也可同时摄取几种食物)。 2、 近年来,我市积极探索建设社会主义新农村的服务体系,许多农户获得“测土配方施肥”服务,有效解决了施肥比例不合理问题,提高了产量,减少了环境污染。小明家种了一片麦子,经农科人员测定该片土壤需补充钾元素39kg ,氮元素42kg 。请你帮小明算算,至少需购买硝酸钾、硝酸铵各多少千克? (二)有关化合价的计算: 1、据报道,“第三代”瓷珠圆珠笔问世,该圆珠笔的球珠有氧化锆陶瓷材料制成,这种材料的应用使球珠的耐腐蚀性,耐磨性得到了提高,从而填补了国内空白,氧化锆的化学式为ZrO 2,在氧化锆中锆元素的化合价为: A .+2 B .+3 C .+4 D .+5
九年级化学化学计算题专题训练答案 一、中考化学计算题 1.某粗盐样品仅含NaCl和MgCl2,为探究粗盐中NaCl的质量分数,某研究性小组取了 10g样品,加适量水使其完全溶解后,加入20g 5%的氢氧化钠溶液,测得相关数据如图。 (1)请列式计算该粗盐样品中NaCl的质量分数为____________。 (2)当加入氢氧化钠溶液至ag时,此时所得溶液中溶质的质量是____________? 【答案】90.5% 10.22g 【解析】 (1)根据氯化镁与氢氧化钠反应的化学方程式,由氢氧化镁的质量求出氯化镁的质量即可求出氯化钠的质量,再计算出粗盐样品中NaCl的质量分数;(2)根据图像分析解答。(1)设样品中氯化镁的质量为x,反应生成氯化钠的质量为y。 MgCl2+ 2NaOH=Mg(OH) 2↓+2NaCl 95 58 117 x 0.58g y 9558117 0.58 x g y == x=0.95g y=1.17g 样品中氯化钠的质量为10g-0.95g=9.05g 该粗盐样品中NaCl的质量分数为9.05 10 g g ×100%=90.5% (2)当加入氢氧化钠溶液至ag时,此时所得溶液中溶质的质量为10g-0.95g+1.17g=10.22g 答:(1)该粗盐样品中NaCl的质量分数90.5%;(2)当加入氢氧化钠溶液至ag时,此时所得溶液中溶质的质量10.22g。 2.我国化工专家侯德榜发明了侯氏制碱法,为世界制碱工业作出了突出贡献。 (1)主产品Na2CO3的俗名是_____,副产品氯化铵中阳离子符号为_____。 (2)在实际生产中,产品Na2CO3中常混有少量的NaCl,现有样品11.0g,将其放入干净的烧杯中,向烧杯中逐滴加入溶质质量分数为7.3%的稀盐酸,反应后烧杯中物质的质量与滴入稀盐酸的质量关系如图所示。
初三化学计算 1、已知尿素的化学式为CO(NH2)2,则一个尿素分子中含有个原子;尿素的相对分子质量是;碳、氧、氢、氮四种元素的质量比为;氮元素的质量分数为(填计算式)100kg 尿素中含氮元素的质量为;某农田需2.8kg氮元素,则应施kg尿素。 2、某农田去年用了60 3 ] 3、人体中钙元素主要存在牙齿和骨骼中,以羟基 磷酸钙[Ca10(PO4)6(OH)2]形式存在,其相对分子质 量为1004,右图是小青同学收集的纯牛奶的包装说明 阅读答题: ①一盒牛奶中至少含钙克 ②羟基磷酸钙[Ca10(PO4)6(OH)2]中钙元素的质 量分数为(保留0、1%) ③若人体每天需要0、6克钙,且这些钙有90%来 自牛奶,则一个人每天至少喝盒牛奶。 4、、20 kg含氧化铁80%的赤铁矿,可冶炼含杂质2% 5、已知氯酸钾与二氧化锰的混合物15、5克,加热膨胀完全反应后,剩余固体的质量为10、7克,求①生成氧气多少克,在标准状况下为多少升?②10、7克固体是什么,各多少克?(2KClO3 ==== 2KCl+3O2-↑) 6、把一根铁钉放入到一定质量的硫酸铜溶液中,过一会儿称量,质量增重0、8克,则有多少克铁参加反应?同时有多少克铜生成? 7、某同学用混有二氧化锰的高锰酸钾8克加热制取氧气,完全反应后剩佘固体的质量7、36克,则剩余固体中二氧化锰的质量是多少? M n O2
8、我国规定在食盐中加入碘梭钾KIO3的方法补碘,已知食盐中加碘的量每千克食盐中含碘为0、035克,相当干每千克食盐中含多少克碘酸钾? 9、20克碳和氧化铜的混合物加热完全反应后,称量为15、6克,求原 混合物中碳与氧化铜的质量比。 10、将171克石灰石高温煅烧(杂质不含氧也不参加反应),待反应完全后测得残佘物中氧元素的质量减少了24克,求石灰石中碳酸钙的质量分数。
精品文档计算题专题。页)书本一.有关化学式的计算(87 、计算物质中某元素的质量分数。 3 2、化学式中各元素的质量比。类型1、计算相对分子质量。、化学式中原子总数,原子个数比。54、计算物质中某元素的质量。,长期食用会引起消化道癌变,请回答:O)例题:地沟油中含有一种强烈致癌物黄曲霉素B(CH617214;(1)黄曲霉素B的相对分子质量为2;⑵黄曲霉素B中各元素质量比为2 ;(3)黄曲霉素B中碳、氢、氧三种元素的原子个数比为2 ;(4)黄曲霉素B中氧元素的质量分数为2 氧元素。g ⑸15.7g黄曲霉素B中含有2二、利用化学方程式的简单计算。常见题型 1.题目中直接给出一种反应物(或生成物)的质量,求另一种生成物(或反应物)的质量。 某实验室中需要1.6g氧气进行实验。若用电解水的方法制取这些氧气,需要消耗水多少克?同时可生成氢气多少克? 2.已知反应物(或生成物)的质量(或密度、体积),如何求另一反应物(或生成物)的质量(或体积)。 中国登山协会为纪念我们首次攀登珠穆朗玛峰成功50周年,再次组织攀登珠峰活动。阿旺扎西等一行登山运动员于2003年5月21日13:40成功登顶。假如每位运动员冲顶时消耗自带液氧的质量等于标况下3.36L氧气(标准状况下氧气密度为1.43g/L) 若在实验室用高锰酸钾为原料制取相同质量的氧气,需要多少千克的高锰酸钾? 3、描述性计算题。 钙是人体中含量较高的常量元素之一,缺钙可能导致幼儿及青少年发育不良,严重时还会患佝偻病.李明的父亲为他买回一瓶补钙保健品,他仔细阅读了标签上的说明(如图),为了验证该保健品中碳酸钙的含量,取出5片药品,加入足量的稀盐酸,充分反应后收集到3.3g二氧化 碳(假定除碳酸钙外其他成分不与盐酸反应) 200 2克×。)已知碳酸钙的相对分子质量是100,则钙元素的相对原子质量为(1)通过计算验证:该保健品主要原料含量是否属实(写出计算过程)?(2 30天),理论上吸收了(3)李明按照说明服用一个月(钙元素。 、表格型或者坐标型(从表格中找出规律,或者找出产生气体的质量。从坐标中找出气体(或沉淀)的4 质量,把气体或者沉淀的质量代入化学方程式中,求出所需物质的质量)。,为测定碳酸钙的含量,他做了如下实验:1、小东从海边捡来一些嵌有沙砾的贝壳(主要成分为碳酸钙)实验过程中。的盐酸分5次加入(假设其余杂质均不与盐酸反应)150 mL首先称取50 g贝壳样品,然后将的数据记录如下:
初中化学计算题归纳
初中化学计算题归纳 初中化学计算题的类型有多种,其中包括化学式计算、化合价计算、化学方程式计算、溶液计算、化学方程式和溶液简单综合计算、应用质量守恒定律计算等,下面对中考试题中的计算题进行一下归类: (一)有关化学式计算题类型: 第一种类型:标签型化学式计算题: 1、(2011.鸡西市)右图是某品牌补铁剂的标签。请回答: (1)富马酸亚铁颗粒中的铁属于元素(填“常量” 或“微量”); (2)富马酸亚铁中C、H元素的质量比为; (3)已知富马酸亚铁(C4H2FeO4)中铁元 素的质量分数为33%,若每次服用1包 该补铁剂,摄入铁元素的质量为 mg。 (1)微量(2)24:1 (3)66 2、在现代生活中,人们越来越注重微量元素的摄取。碘元素对人体健康有至关重要的作用。下表是某地市场销售的一种“加碘食盐”包装袋上的部分说明。 2
请回答下列问题: (1)由食用方法和贮藏指南可推测碘酸钾)的化学性质之一是;(KIO 3 (2)计算碘酸钾(KIO )中,钾元素、碘元 3 素、氧元素的质量比; )中,碘元素的质量(3)计算碘酸钾(KIO 3 分数是多少?; (计算结果精确到0.01,下同) (4)计算1kg这样的食盐中,应加入g碘酸钾(用最高含碘量计算) 第二种类型:叙述型化学式计算题: 1、(2011.泰安市)(4分)无土栽培是一种农业高新技术,它可以显著提高农作物的产量和质量。某品种茄子的无土栽培营养液中含有6%的KNO3。 ⑴ KNO3属于(填“钾肥”、“氮肥”或“复合肥料”); 3
⑵KNO3的相对分子质量为; ⑶KNO3中钾、氮、氧元素的质量比为; ⑷要配制150kg该营养液,需要KNO3的质量为 kg。 (1)复合肥料(2)101 (3)39:14:48 (4)9 2、(2011.天津市)铝土矿的主要成分是Al2O3,请按要求进行计算: (1)Al2O3中铝元素与氧元素的原子个数比为。 (2)Al2O3中铝元素与氧元素的质量比为。 (3)求Al2O3中铝元素的质量分数,并写出计算过程。(计算结果保留至0.1%)(1)2:3 (2)9:8 (3) 52.9% 第三种类型:综合型化学式计算题: 1、(2011.南通市)(6分)造纸是我国古代四大发明之一,它有效地推动了人类文明的发展。 4
化学计算题专题训练 1、 已知尿素的化学式为CO (NH 2)2,则一个尿素分子中含有____个原子;尿素的相对分 子质量是______;碳、氧、氢、氮四种元素的质量比为_____________ ;氮元素的质量分数为(填计算式)_________________________ 100kg 尿素中含氮元素的质量为 ________ ;某农田需2.8kg 氮元素,则应施______ kg 尿素。 2、 某农田去年用了60千克尿素,今年要与去年肥分相当,要用_____千克碳酸氢铵 [NH 4HCO 3] . 3、人体中钙元素主要存在牙齿和骨骼中,以羟基磷酸钙 [Ca 10(PO 4)6(OH )2]形式存在,其相对分子质量为1004, 右图是小青同学收集的纯牛奶的包装说明阅读答题: ①一盒牛奶中至少含钙______克; ②羟基磷酸钙[Ca 10(PO 4)6(OH )2]中钙元素的质量分数为_______ (保留0.1%); ③若人体每天需要0.6克钙,且这些钙有90%来自牛奶,则一个人 每天至少喝_______盒牛奶。 4、已知氯酸钾与二氧化锰的混合物15.5 求①生成氧气多少克②10.7克固体是什么,各多少克? 5、碳和氧化铜的混合物17.4克恰好完全,反应后称量为13克,求原混合物中碳与氧化铜的质量比。 6、某化学兴趣小组为了测定某石灰石样品中碳酸钙的质量分数,取用2.0 g 石灰石样品,把25.0g 质量分数为10%的稀盐酸分五次加入样品中(样品中的杂质既不与盐酸反应,也不(1)2.0g 石灰石样品中碳酸钙的质量为 。 (2)石灰石中碳酸钙的质量分数为 。
初三计算题专项训练 1. 把干燥纯净的氯酸钾和二氧化锰的混合物15.5 g装入大试管,给试管加热来制取氧气。在反应不再发生后,等试管冷却、称量,得10.7 g固体物质。问:(1)制得氧气多少克?(2)10.7 g固体物质里含有哪些物质?各多少克? 2.有20 g H2和O2的混合气体,点燃充分反应后,产生18 g水,则原混合气体的成分组成情况是怎样的,通过计算说明。 3.某科技活动小组利用氯酸钾和二氧化锰共热制取一定量的氧气。混合27.6 g氯酸钾和2.0 g二氧化锰加热制取一定量的氧气后,使反应停止,测得剩余固体中二氧化锰质量分数为10.0%。请计算: (1)剩余固体的质量; (2)制得氧气的质量; (3)未分解的氯酸钾的质量。(计算结果保留一位小数) 4.现将石灰石样品15 g与105.4 g稀盐酸放入烧杯中充分反应(杂质不与稀盐酸反应),反应时间与反应前后 (2)反应后所得溶液中溶质的质量分数。 5.实验室用C还原CuO,生成的气体通入足量澄清石灰水,得到10 g白色沉淀,求参加反应的C和CuO的质量?
6.鸡蛋壳的主要成分是碳酸钙。为了测定某鸡蛋壳中碳酸钙的质量分数,某同学进行了如下实验:将鸡蛋壳洗净、干燥并捣碎后,称取10 g 放在烧杯里,然后往烧杯中加入足量的稀盐酸90 g,充分反应后,称得反应剩余物为97.14 g(假设鸡蛋壳中的其它物质不与稀盐酸反应)。请计算: (1)产生二氧化碳气体多少克。(2)计算该鸡蛋壳中碳酸钙的质量分数。 7.今年全国人大和政协会议使用了一种含碳酸钙的“石头纸”:为测定其中碳酸钙的含量,课外活动小组的同学称取50 g碎纸样品。分别在5只烧杯中进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与水反应): (1)表中x的值为 (2)求样品中碳酸钙的质量分数。 8.某化学研究小组对当地的石灰石样品进行了研究。称取石灰石样品8 g,把40 g稀盐酸分四次加入样品中,测得实验数据见下表()。 (1)第4次剩余物质的质量m= g (2)石灰石样品中CaCO3的质量分数为。 (3)计算稀盐酸的溶质质量分数 9.铁粉和氧化铁粉末的混合物21.6 g,在灼热条件下,通入足量一氧化碳后得固体物质16.8 g。求混合物中铁粉的质量分数。
初中化学计算题专题复习 姓名 初中化学计算题的类型有多种,其中包括化学式计算、化合价计算、化学方程式计算、溶液计算、化学方程式和溶液简单综合计算、应用质量守恒定律计算等,下面对计算题进行一下归类: (一)有关化学式计算题类型: 第一种类型:标签型化学式计算题: 1、在现代生活中,人们越来越注重微量元素的 摄取。碘元素对人体健康有至关重要的作用。 下表是某地市场销售的一种“加碘食盐”包装 袋上的部分说明。 请回答下列问题: (1)由食用方法和贮藏指南可推测碘酸钾 (KIO 3 )的化学性质之一是; (2)计算碘酸钾(KIO 3 )中,钾元素、碘元素、氧元素的质量比; (3)计算碘酸钾(KIO 3 )中,碘元素的质量分数是多少?;(计算结果精确到0.01,) 第二种类型:叙述型化学式计算题: 1、蛋白质是由多种氨基酸[丙氨酸:CH 3CH(NH 2 )COOH等]构成的极为复杂的化合物,人体通过 食物获得蛋白质,在胃肠道里与水发生反应,生成氨基酸,试计算: (1)丙氨酸分子中氮原子与氧原子的个数比。(2)丙氨酸的相对分子质量。 (3)丙氨酸中碳、氢、氧、氮元素的质量比。 2、抗震救灾,众志成城。用于汶川震后防疫的众多消毒剂中,有一种高效消毒剂的主要成分 为三氯异氰尿酸(C 3O 3 N 3 Cl 3 ),又称高氯精。下列有关高氯精的说法不正确的是() A.高氯精由4种元素组成 B.高氰精中C、O、N、Cl的原子个数比为1∶1∶1∶1 C.高氯精中C、N两种元索的质量比为12∶14 D.高氯精中氯元素的质量分数为25% 第三种类型:综合型化学式计算题: 1.近年来,我市积极探索建设社会主义新农村的服务体系,许多农户获得“测土配方施肥”服务,有效解决了施肥比例不合理问题,提高了产量,减少了环境污染。小明家种了一片麦子,经农科人员测定该片土壤需补充钾元素39kg,氮元素42kg。请你帮小明算算,至少需购买硝酸钾、硝酸铵各多少千克? (二)有关化合价的计算: