
第二章热力学第二定律2012-10-12~11-7
2.1 自发变化的共同特征
2.2 热力学第二定律
2.3 卡诺循环与卡诺定理
2.4 熵的概念
2.5 克劳修斯不等式与熵增加原理
2.6 熵变的计算
2.7 热力学第二定律的本质和熵的统计意义
2.8 亥姆霍兹自由能和吉布斯自由能
2.9 几个热力学函数间的关系
的计算示例
2.11 克拉贝龙方程
2.12 热力学第三定律与规定熵
2.1 自发变化的共同特征
2.1.1自发变化与非自发变化
自发变化某种变化有自动发生的趋势,一旦发生就无需借助外力,可以自动进行,这种变化称为自发变化。
自发变化的共同特征—不可逆性单向趋于平衡,不能自动逆转。例如:
(1) 焦耳热功当量中功自动转变成热;
(2) 气体向真空膨胀;
(3) 热量从高温物体传入低温物体;
(4) 浓度不等的溶液混合均匀;
(5) 锌片与硫酸铜的置换反应等,
它们的逆过程都不能自动进行。当借助外力,体系恢复原状后,会给环境留下不可磨灭的影响。
2.1.2变化的方向性和过程的可逆性
“变化”指体系状态的改变,变化的方向性取决于体系的始,终态。
“过程”是完成变化的方式,一个变化发生时,可以以可逆方式,也可以以不可逆方式进行,这取决于对过程的具体安排。
2.1.3变化的方向性的共同判据
判断一变化能否自动发生,关键在于该变化进行后,环境最终是否失去一定量的功。若环境没有失去功,变化为自发,若环境最终失去了功,则变化为非自发。
“环境是否失去功”只能指出方向,不能说明变化所能达到的限度。
2.2 热力学第二定律(The Second Law of Thermodynamics)
克劳修斯(Clausius)的说法:“不可能把热从低温物体传到高温物体,而不引起其它变化。”
开尔文(Kelvin)的说法:“不可能从单一热源取出热使之完全变为功,而不发生其它的变化。”后来被表述为:“第二类永动机是不可能造成的”。
第二类永动机:从单一热源吸热使之完全变为功而不留下任何影响。
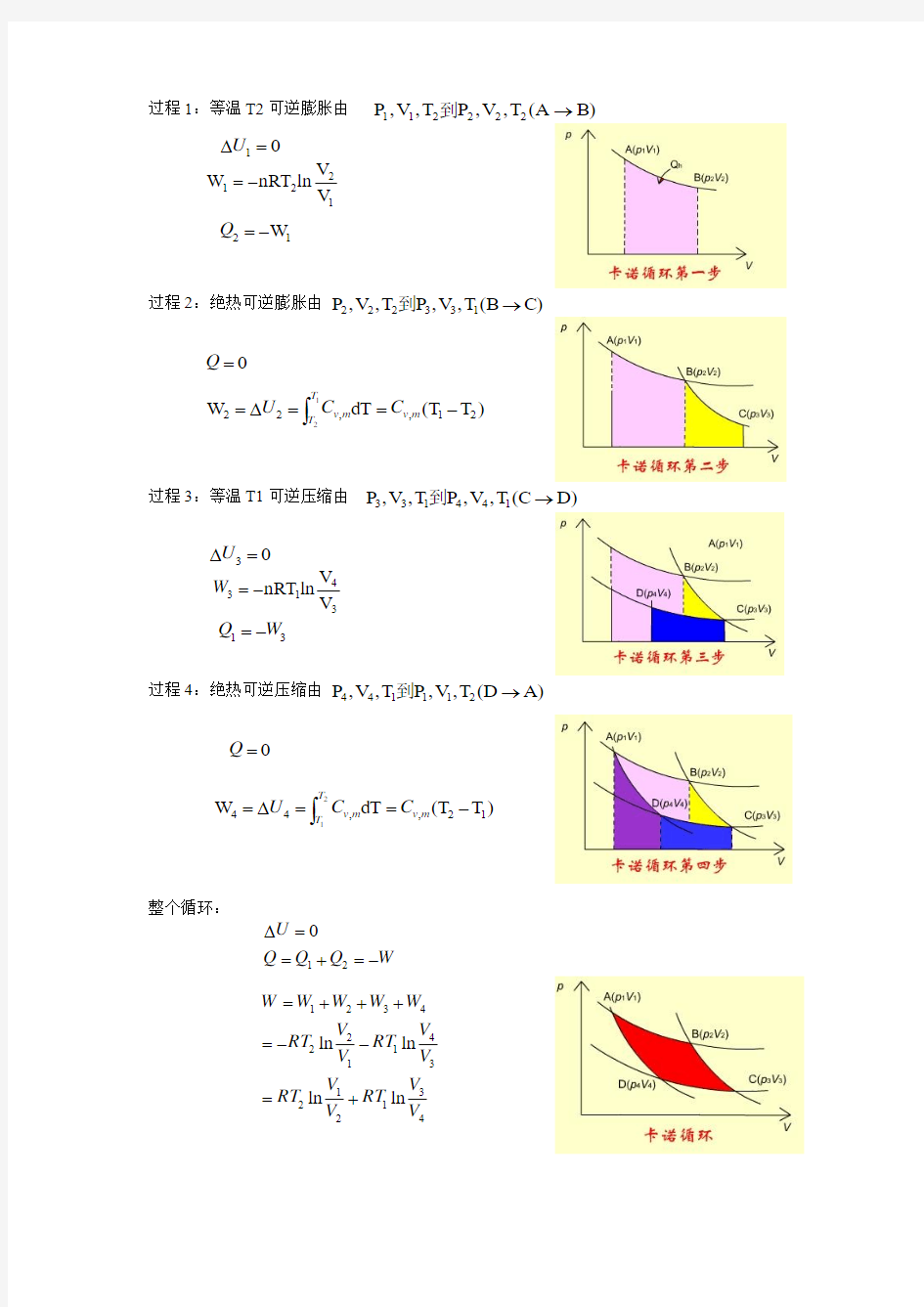
2.3 卡诺循环与卡诺定理
1824 年,法国工程师N.L.S.Carnot (1796-1832)设计了一个循环,以理想气体为工作物质,从高温T2热源吸收Q2的热量,一部分通过理想热机用来对外做功W,另一部分Q1的热量放给低温T1热源。这种循环称为卡诺循环。
1mol 理想气体的卡诺循环在pV图上可以分为四步:
过程1:等温T2可逆膨胀由
过程2:绝热可逆膨胀由
过程3:等温T1可逆压缩由
过程4:绝热可逆压缩由
整个循环:
B)
A (T ,V ,P T ,V ,P 222211→到0
1=?U 1
221V V ln nRT W -=1
2W -=Q C)
B (T ,V ,P T ,V ,P 133222→到)
T T (dT W 21,,221
2
-==?=?m v T T m v C C U 0
=Q 03=?U 3
413V V ln
nRT -=W 3
1W Q -=0
=Q )
T T (dT W 12,,442
1
-==?=?m v T T m v C C U A)
D (T ,V ,P T ,V ,P 211144→到D)
C (T ,V ,P T ,V ,P 144133→到W
Q Q Q U -=+==?2104
3121
23
411224321ln ln
ln ln V V RT V V RT V V RT V V RT W W W W W +=--=+++=
根据绝热可逆过程方程式 过程2: 相除得 过程4:
:表明整个循环是体系从高温热源吸收热后,对环境作功。 热机效率
热机在循环过程中所作的功与所它从高温热源所吸收的热的比值称为热机转换效率,或称为热
机效率,用 表示。
致冻效率
如果将卡诺机倒开,就变成了致冷机.这时环境对体系做功W,体系从低温T1热源吸热 ,而放
给高温T2热源Q2的热量,将所吸的热与所作的功之比值称为冷冻系数,用 表示。
卡诺定理
卡诺定理:所有工作于同温热源和同温冷源之间的热机,其效率都不能超过可逆机,即可逆机的效率最大。
卡诺定理推论:所有工作于同温热源与同温冷源之间的可逆机,其热机效率都相等,即与热机的工作物质无关。
假设任意热机的效率大于可逆机的效率,
即:
因此 低温热源得到热量为: 高温热源得到热量为: 假设不成立,应有 卡诺定理的意义:
引入了一个不等号 ,原则上解决了化学反应的方向问题;解决了热机效率的极限值问题。
2.4 熵的概念
2.4.1 可逆循环与可逆过程的热温熵 从卡诺热机效率得到的结论: 即卡诺循环中,热效应与温度商值之和等于零。
1
31122--=γγV T V T 141112--=γγV T V T 4
3
12V V
V V =24
c h 1313ln ln W W V V nRT nRT V V =--+
所以1212ln )(V V T T R --=0 122 2 12ln ln )(T T T V RT V V T T R Q Q Q Q W -=--=+=-=ηηβ'1Q 1211'T T T W Q -==β2R Q W -=η'2I Q W -=η22R I 'Q W Q W ->->ηη' 22Q Q >0'22<-Q Q 0'22>-Q Q R I ηη≤I R ηη<0 2 2 11=+T Q T Q 任意可逆循环ABA 可看成B(R1)A 和A(R2)B 两个可逆过程构成。 说明任意可逆过程的热温商的值决定于始终状态,而与可逆途径无关,这个热温商具有状态函数的性质。 熵的引出 Clausius 根据可逆过程的热温商值决定于始终态而与可逆过程无关这一事实定义了“熵” (entropy )这个函数,用符号“S ”表示,单位为: 令 , 分别代表A ,B 两状态的熵,则体系从状态A 变到状态B ,体系的熵变: 或 对微小变化 2.4.2 不可逆循环及不可逆过程的热温熵 设温度相同的两个高、低温热源间有一个可逆机和一个不可逆机。 根据卡诺定理: , 则 推广为与多个热源接触的任意不可逆过程得: 设有一不可逆循环,如右图,体系经不可逆过程由 B A ,再经可逆过程 由A B ,整个循环为不可逆循环。 则有 i R i i ( )0Q T δ=∑任意可逆循环热温商之和等于零。 无限多个小卡诺循环的总效率的曲折线与任意可逆循环的封闭曲线相当,即可用无限多个小卡诺循环来代替任意的可逆循环。一个任意可逆循环,热温商总加等于零,或它的环程积分等于零,可表示 为 i R i i ( )0 Q T δ=∑或 0)T δ( R =?Q ?=0 ) T δ(R Q 12B A R R A B ()()0 Q Q T T δδ+=??12B B R R A A ()()Q Q T T δδ=??1 J K -?A S B S B B A R A ()Q S S S T δ-=?=?R ()i i i Q S T δ?=∑ R ()0i i i Q S T δ?-=∑ R d ()Q S T δ=21221IR 1Q Q Q Q Q +=+=η21212R 1T T T T T -=-=ηR I ηη< 01211<+T Q T Q i IR i i ()0 Q T δ<∑ 0)T δ()T δ(A B R,B A IR,<+→→∑ ∑ i i i i i i Q Q B A R i i i S S Q Q -==?∑→A B A B R,)T δ()T δ(B A IR,A B i ()Q S S T →δ->∑A B IR,A B i ()0 Q S T →→δ?->∑ 若对于无限小的变化,则有 2.5 克劳修斯不等式与熵判据 2.5.1 可逆性判据 对于可逆过程, 对于不可逆过程, 两式合并得 Clausius 不等式 (热力学第二定律数学表达式): △S 是实际过程的热效应 Q 是实际过程的热效应 T 是环境温度。 “=”表示可逆过程 “>”表示不可逆过程 若对于无限小的变化,则有: 对于绝热体系或隔离体系, 等号表示绝热可逆过程, △S=0,熵值不变,不等号表示绝热不可逆过程, △S>0 ,熵值增加。 从同一始态出发,经绝热可逆过程和绝热不可逆过程不可能达到同一终态。 2.5.2 方向性判据 对于一个隔离体系,环境与体系间既无热的交换,环境对体系无任何干扰和影响。 “>”表示自发变化 “=”表示达平衡 它表明,在隔离体系中,若发生自发变化,熵一定增加,体系达平衡时,熵值已增到最大,不再改变。 熵增加原理可表述为:一个隔离体系的熵永不减少。 Clausius 不等式的意义 Clsusius 不等式引进的不等号,在热力学上可以作为变化方向与限度的判据。 “>” 号为不可逆过程 “=” 号为可逆过程 “>” 号为自发过程 “=” 号为处于平衡状态 2.5.3 总熵判据 体系状态发生变化时,如果与热源交换了热量, “>” 号为不可逆 “=” 号为可逆 ?什么情况下 √(1)环境只是热源,体系环境之间仅存在热交换 √(2)尚存在体系对环境作功 ×(3)环境不只是热源,除热交换外,同时存在环境对体系作功 2.6 熵变的计算 2.6. 1.单纯状态变化 1. 理想气体等温过程 0)T δ(d IR >-Q S 0 )T δ(R B A =-?∑ Q S 0 )T δ(IR B A >-?∑ Q S 0 T δB A ≥-?∑ Q S T δd Q S ≥ 0Q δ=d 0 S ≥0 ≥?隔离S d Q S T δ≥ d iso ≥S 体 热Q Q -=热热热T Q T Q S i i -=-=?∑ δ0≥-?热 体T Q S 0 ≥?+?=?热体总S S S 隔离 总S S ?=?1 2R B A R ln V V nR T Q T Q S == =??)( 体δT 实热Q S - =? 2. 理想气体恒压过程 3. 理想气体恒容过程 4. 理想气体任意状态变化 理想气体从A 到B 的过程。 设计可逆过程: 1. 先等温后等容(A-C-B) 2. 先等温后等压(A-D-B) 4. 理想气体等温等压混合 理想气体等温等压混合是自发的不可逆过程 多种理想气体等温等压混合过程,混合熵变: 2.6. 2. 相变化 (1) 可逆相变 (2) 不可逆相变(应设计可逆过程) 例:263.5K和P 过冷水凝固成冰。 2.6. 3. 化学变化 等温等压下的化学反应 为了得到可逆热,将反应安排成可逆电池,在电流趋于零的条件下,让反应在电极上可逆进行,由化学反应的等压热及其可逆电功求得可逆热。 2.7 热力学第二定律的本质和熵的统计意义 2.7.1 热力学第二定律的本质 热与功转换的不可逆性 热是分子混乱运动的一种表现,而功是分子有序运动的结果。 功转变成热是从规则运动转化为不规则运动,混乱度增加,是自发的过程; ? =?2 1 d m ,T T p T T nC S ?=?21 d m ,T T V T T nC S 111, ,p V T 222,,p V T 21 ,m 2 1d ln()T V T nC T V S nR V T ?=+? 21 ,m 1 2d ln()T p T nC T p S nR p T ?=+? )ln ln (R ln ln ln ln B B B A A A B B B B B A A A A A B A x n x n S S S x R n V V R n S x R n V V R n S S S S +-=?+?=?-==?-==??+?=?混合0>?+?=?热混合总S S S B B mix B ln S R n x ?=-∑ 相变) 相变) 相变)(((T H S ?=?hH gG bB aA +→+T Q S R =?hH gG bB aA hH gG bB aA P T P T ??→?++?→?+,,'1S ?3S ?dT C S dT T C C S dT T C C S S S S T T P T T H p G p T T B p A p ? ? ??+?=++?++=?+?+?=?' ''',,' ,,3 '1 而要将无序运动的热转化为有序运动的功就不可能自动发生。 热力学第二定律指出,凡是自发的过程都是不可逆的,而一切不可逆过程都可以归结为热转换为功的不可逆性。 一切不可逆过程都是向混乱度增加的方向进行,而熵函数可以作为体系混乱度的一种量度, 这就是热力学第二定律所阐明的不可逆过程的本质。 热力学概率和数学概率 例如:有4个小球分装在两个盒子中,总的分装方式应该有16种。因为这是一个组合问题,有如下几种分配方式,其热力学概率是不等的。 分配方式 分配微观状态数 热力学概率就是实现某种宏观状态的微观状态数,通常用 Ω 表示。数学概率是热力学概率与总的微观状态数之比。 数学概率:数值 0-1之间 热力学概率:可以很大,粒子数目越大,均匀分配的热力学概率与不均匀分布的热力学概率相差越大。 变化的方向性就有统计意义。 自发变化一定是从可能性较小的状态向可能性较大的状态进行,也就是热力学概率增大的方向进行。 Boltzmann 公式 宏观状态实际上是大量微观状态的平均,自发变化的方向总是向热力学概率增大的方向进行。这与熵的变化方向相同。 热力学概率和熵 都是 状态函数,两者之间必定有某种联系,玻耳兹曼认为这一函数是对数关系,即: k 是Boltzmann 常数 因熵是容量性质,具有加和性,而复杂事件的热力学概率应是各个简单、互不相关事件概率的乘积,所以两者之间应是对数关系。 微观角度,熵具有统计意义,它是体系微观状态数(混乱度)的一个量度。 在隔离体系中,从比较有序的状态向比较无序的状态变化就是自发变化的方向,这就是热力学第二定律的本质。 前述关于变化方向和限度的讨论,都是指大量分子构成的体系而言,对于粒子数较少的体系是不适用的,这就是热力学第二定律的统计特征。 2.8 亥姆霍兹自由能和吉布斯自由能 2.8.1亥姆霍兹自由能 为什么要定义新函数? 热力学第二定律导出了熵这个状态函数,但用熵作为判据时,体系必须是孤立体系,也就是说必须同时考虑体系和环境的熵变,这很不方便。 通常反应总是在等温、等压或等温、等容条件下进行,有必要引入新的热力学函数,利用体系自身状态函数的变化,来判断自发变化的方向和限度。 设体系由温度为T 环的热源吸收热量Q ,热力学第二定律数学表达式: 热力学第一定律: 若体系始态终态温度都与环境温度相等,则: 令 ln S k Ω=0T δd ≥-环 Q S W dS T dU W dU Q δδδ-≥---=)(环W TdS dU δ-≥--)(TS U F -≡ F 称为亥姆霍兹自由能(Helmholz free energy),又称功函是状态函数,具有容量性质。 即 “=”表示可逆过程 即 “>”表示不可逆过程 等温可逆过程中,一封闭体系所作的功等于体系亥姆霍兹自由能的减少值,所以把A 称为功函(work function )即: 若是不可逆过程,体系所作的功的绝对值小于功函的减少值,即: 物理意义:等温过程中,一封闭体系功函的减少等于体系所能作的最大功。 若在等温等容过程中,无体积功,则: 即 即 表明一封闭体系功函的减少等于体系所能作的最大非体积功。 若无非体积功,则: 表示等温等容不作非体积功的条件下,△F=0 过程为可逆,若△F<0 ,过程不可逆。 2.8.2吉布斯自由能 即 “=”表示可逆过程 即 “>”表示不可逆过程 等温可逆过程中,一封闭体系所作的非体积功等于体系吉布斯自由能的减少值,即: 若是不可逆过程,体系所作的非体积功小于吉布斯自由能的减少值,即: 物理意义:等温过程中,一封闭体系吉布斯自由能的减少等于体系所能作的最大非体积功。 若在等温等压过程中,无非体积功,则: 表示等温等压不作非体积功的条件下,△G=0 过程为可逆,若△G<0 ,过程不可逆。 2.8.3变化的方向和平衡条件 1.熵判据 熵判据在所有判据中处于特殊地位,因为所有判断反应方向和达到平衡的不等式都是由熵的Clausius 不等式引入的。但由于熵判据用于隔离体系,要考虑环境的熵变,使用不太方便。 在隔离体系中,如果发生一个不可逆变化,则必定是自发的,自发变化总是朝熵增加的方向进行。自发变化的结果使体系处于平衡状态,这时若有反应发生,必定是可逆的,熵值不变。 对于绝热体系 等号表示可逆,不等号表示不可逆,但不能判断其是否自发。因为绝热不可逆压缩过程是个非自发过程,但其熵变值也大于零。 熵判据只能用于隔离体系。 W F W dF -≥?--≥-δW F W dF ≤?≤δR T W F =?IR T W F ->?-' ' W F W dF -≥?--≥-δ''W F W dF ≤?≤δ0 0≤?≥?-F F TS H G W TS H d W TS PV U d W PdV TdS dU P P P W W TdS dU W TdS dU -≡-≥---≥-+--≥--==--≥---≥--' ' '21)()()()()(δδδδδδ外‘ 体''W G W dG -≥?--≥-δ'' W G W dG ≤?≤δ' R W G =?' IR W G ->?-0 0≤?≥?-G G d 0 S ≥""""=>表示可逆,平衡表示不可逆,自发 d (0S ≥绝热)0 ≥?隔离S 2.亥姆霍兹自由能(功函)判据 若在等温等容过程中,无非体积功时, “=”表示可逆过程 “<”表示不可逆过程 体系处于无任何外来作用,任其自然的情况下,若发生不可逆过程则必为自发变化,即在等温等容不作非体积功的条件下,自发变化总是向着功函减少的方向进行,直至功函值不变达到平衡。 判据: “=”表示达到平衡 “<”表示自发变化 3.吉布斯自由能判据 若在等温等压过程中,不作非体积功时, “=”表示可逆过程 “<”表示不可逆过程 体系处于无任何外来作用,任其自然的情况下,若发生不可逆过程则必为自发变化,即在等温等压不作非体积功的条件下,自发变化总是向着自由能减少的方向进行,直至自由能值不变达到平衡。 判据: “=”表示达到平衡 “<”表示自发变化 2.9 几个热力学函数间的关系 2.9.1几个函数的定义式 定义式适用于任何热力学平衡态体系,只是在特定的条件下才有明确的物理意义。 (1)焓的定义式。在等压、 的条件下, (2)Helmholz 自由能定义式。在等温、可逆条件下,它的降低值等于体系所作的最大功。 (3)Gibbs 自由能定义式。在等温、等压、可逆条件下,它的降低值等于体系所作最大非体积功。 函数间关系的图示式 2.9.2封闭体系的四个基本公式 (1) 因为 代入上式即得。 这是热力学第一与第二定律的联合公式,适用于组成恒定、不作非膨胀功的封闭体系。 虽然用到了 的公式,但适用于任何可逆或不可逆过程,因为式中的物理量皆是状态函数,其变化值仅决定于始、终态。但只有在可逆过程中 才代表 , 才代表 。 公式(1)是四个基本公式中最基本的一个。 (2) 因为 所以 ≤?F 0 )(0.,'≤?=W V T F 0 ≤?G 0 )(0.,'≤?=W P T G 0'=W pV U H +=p Q H =?)0,0d (f ==W p TS U F -≡max W F -=?TS H G -=pV F G +=' max W G =?d d d U T S p V =-d d U Q p V =δ-d Q S T δ= d Q T S δ=d p V -R Q δS T d e W δd d d H T S V p =+pV U H +=d d d d H U p V V p =++V p S T U d d d -=p V S T H d d d += (3) 因为 所以 (4) 因为 所以 从基本公式导出的关系式(对应关系式) (1) (3) (2) (4) 从公式(1)导出 从公式(2)导出 从公式(3)导出 从公式(4)导出 特性函数 对于U ,H ,S ,F ,G 等热力学函数,只要其独立变量选择合适,就可以从一个已知的热力学函数求得所有其它热力学函数,从而可以把一个热力学体系的平衡性质完全确定下来。 这个已知函数就称为特性函数,所选择的独立变量就称为该特性函数的特征变量。: 常用的特征变量为: 例,从特性函数G 及其特征变量T ,p ,求H ,U ,F ,S 等函数的表达式。 导出: 2.9.3Maxwell 关系式 全微分的性质 设函数 z 的独立变量为x ,y , z 具有全微分性质 M 和N 也是 x ,y 的函数 所以 热力学函数是状态函数,数学上具有全微分性质,将上述关系式用到四个基本公式中, 就得到Maxwell 关系式: pdV T S F --=d d TS U F -=T S S T U F d d d d --=V p S T U d d d -=pdV T S F --=d d d d d G S T V p =-+TS H G -=T S S T H G d d d d --=p V S T H d d d +=p V T S G d d d +-=V p S T U d d d -=p V S T H d d d +=V p T S F d d d --=p V T S G d d d +-=T S U V =??)(p V U S -=??)(T S H p =??)(V p H s =??)(S T F V -=??)(p V F T -=??)(S T G p -=??)(V p G T =??)(),(V T F (,) U S V d d d G S T V p =-+T p G V )(??=()p G T S ?=-?H G TS =+U H pV =-T p G p G pV G F )(??-=-=d ()d ()d y x z z z x y x y ??=+??(,)z z x y =22(), ()x y M z N z y x y x x y ????==??????()()x y M N y x ??=??()()x y M N y x ??=??V p S T U d d d -=()()V S p T V S ??=-??p V S T H d d d +=( )()p S T V p S ??=??V p T S F d d d --=( )()T V S p V T ??=??p V T S G d d d +-=( )()p T S V p T ??=-?? 利用该关系式可将实验可测偏微商来代替那些不易直接测定的偏微商。 Maxwell 关系式的应用 (1) 热力学状态方程式 已知基本公式 等温对V 求偏微分 不易测定,根据Maxwell 关系式 所以 只要知道气体的状态方程,就可得到 值 例1 证明理想气体的热力学能只是温度的函数。 解:对理想气体, 所以,理想气体的热力学能只是温度的函数。 例2 利用 的关系式,可以求出气体在状态变化时的 值。设某气体从P 1,V 1,T 1至 P 2,V 2,T 2,求 解: 知道气体的状态方程,求出 的值,就可计算 值 (2)求H 随 p 的变化关系 已知基本公式 等温对p 求偏微分 不易测定,据Maxwell 关系式 所以 只要知道气体的状态方程,就可求得 值,即等温时焓随压力的变化值。 (3)求 S 随 P 或V 的变化关系 等压热膨胀系数(isobaric thermal expansirity )定义: 则 根据Maxwell 关系式: V p S T U d d d -=()()T T U S T p V V ??=-??()T S V ??()() T V S p V T ??=??()()T V U p T p V T ??=-??()T U V ?? /pV nRT p nRT V ==()V p nR T V ?=? ()()V T p T p T U V ?=??-? 0nR T p V =?-=()T U V ??U ?U ? =d [()]d V V p C T T p V T ?+-?d [()]d V V p U C T T p V T ??=+-??? ()V p T ??U ?d d d H T S V p =+()()T T H S T V p p ??=+??()T S p ??()()T p S V p T ??=-??()()T p H V V T p T ??=-??()T H p ??1()p V V T α?=?()p V V T α?=?( )( )T p S V V p T α??=-=-??d S V p α?=-? (4)Cp 与CV 的关系 根据热力学第一定律 设 则 保持p 不变,两边各除以 ,得: 将<2>式代入<1>式得 根据应用(1) 代入<3>式得 只要知道气体的状态方程,代入可得 的值。若是理想气体,则 运用偏微分的循环关系式 则 将<5>式代入<4>式得 定义膨胀系数 和压缩系数 分别为: 由<7>式可见: (1)T 趋近于零时, (2)因 总是正值 (3)液态水在 和277.15 K 时, 有极小值,这时 ,则 所以 2.10 等温条件下的计算 根据G 的定义式: 根据具体过程,代入就可求得值。因为G 是状态函数,只要始、终态定了,总是可以设计可逆过程来计算值。 等温的状态变化中的?G (1)等温下,体系从 改变到 ()=[]()p V U pV U T T ?+?-??()()p V p V H U C C T T ??-=-??()()() = <1> p p V U V U p T T T ???+-???(,)U U T V =d ()d ()d V T U U U T V T V ??=+??()()()() <2> p V T p U U U V T T V T ????=+???? <3> [()]() p p V T U V C C p V T ??-=+??()()T V U p T p V T ??=-?? <4>()() p p V V p V C C T T T ??-=??p V C C -p V C C nR -=()()()1V T p p V T T p V ???=-???()()() <5>V p T p V p T T V ???=-???2()() <6> p V T p p V C C T V T ??-=-??11() ()p T V V V T V p αβ??==-??2 <7> p V TV C C αβ-=p V C C =p V C C ≥p $ m V ()0p V T ?=?0α=p V C C =p V T S G d d d +-=2 1 d p p G V p ?=? 对理想气体: 对于凝聚体系: 例:300.2K 时,1mol 理想气体从等温可逆膨胀到,求Q ,W ,△U , △ H , △ F 和△ G ,若向真空膨胀来完成同一变化,结果如何? 相变化 (1)正常相变的(等温、等压下, 可逆相变) 因为相变过程中不作非膨胀功, (2) 非正常相变的(等温、等压下, 不可逆相变) 由设计的可逆过程来求变化的 例:373.2K 和时,把1mol 的水蒸气可逆压缩为液态水,计算Q ,W ,△U , △H ,△F 和△G ,已知该条件下水的蒸发热为40.69KJ·mol-1. 例:水在298.2K 和时进行的相变, 计算该相变的△ G ,判断变化能否自动进行。已知水在25 ℃时的饱和蒸发压为 21 12 ln ln p V G nRT nRT p V ?==)(12P P V G -=?0'=W e W F =?0'=W )P ,O(g,298.2K H )P ,O(l,298.2K H θ2θ2→ 等温化学变化中的 对于化学反应 (1) 将化学反应安排成可逆电池,其电动势为E ,则 (2) (3) 化学反应等温式 例:在298.2K 和下,进行一化学反应,产生1mol 气体,放热40.00×103J 。如通过可逆电池来完成,则吸热4.00×103J 。计算△H,△S,△F 和△G . 与温度和压力的关系 Gibbs-Helmholtz 方程 表示 和 与温度的关系式都称为Gibbs-Helmholtz 方程,用来从一个反应温度的 (或 )求另一反应温度时的 (或 )。它们有多种表示形式,例如: D E F G d e f g +=+nEF G -=?r S T H G ?-?=?G r F m D E ln ln f g p d e p p RT K RT p p G ?=-+ln ln p p RT K RT Q =-+r G ?r A ?r 1()G T ?r 1()A T ?r 2()G T ?r 2()A T ? 2.11 与压力的关系 例:在298.2K 和下,相变C(石墨)→C(金刚石)。△﹒mol-1已知石墨和金刚石的密度分别为2260和3515kg ﹒m-3.问需要多大压力才能使变化成为自发。 外压与蒸气压的影响 如果液体放在惰性气体(空气)中,并设空气不溶于液体,这时液体的蒸气压将随着外压的改变而作相应的改变,通常是外压增大,液体的蒸气压也升高。 假设气相为理想气体,则有如下的近似关系: 式中 是总压, 是有惰气存在、外压为 时的蒸气压, 是无惰气存在时液体自身的饱和蒸气压。当 时,则 。 2.12 热力学第三定律与规定熵 凝聚体系的 和 与T 的关系 1902年,T.W.Richard 研究了一些低温下电池反应的 和 与T 的关系,发现温度降低时, 和 值有趋于相等的趋势(如图所示)。 g * m e g * g (1)ln ()p V p p RT p =-),T ,(A ),T ,(A ) ,T ,(A ),T ,(A 231**p g p l G G p g p l G G ??→??↑?↓?→???外)() ()()()(ln ln )() ()(0,0** *3* 1312321**g V l V p RT l V dp dp p p RT l V P P p p RT dp g V G p p V dp l V G G G G G G G G G m m m m P p m m P p m ==-===?-==??-=?=?=??+?+?=?? ? 外 外外外 *)()(p p g V l V m m ≈ ?=?-?2 112 1.Nernst 热定理(Nernst heat theorem) 1906年,Nernst 经过系统地研究了低温下凝聚体系的反应,提出了一个假定,即 这就是Nernst 热定理的数学表达式,用文字可表述为:在温度趋近于0K 的等温过程中,体系的熵值不变。 这个假定的根据是:从Richard 得到的 和 与T 的关系图,可以合理地推想在T 趋向于0K 时, 和 有公共的切线,该切线与温度的坐标平行,即: 当 时 2.热力学第三定律 在0 K 时,任何完整晶体(只有一种排列方式)的熵等于零。” 不能用有限的手续把一个物体的温度降低到0 K ,即只能无限接近于0 K 这极限温度。 规定熵值(conventional entropy) 规定在0K 时完整晶体的熵值为零,从0K 到温度T 进行积分,这样求得的熵值称为规定熵。若0K 到T 之间有相变,则积分不连续。 已知 测定不同温度下的Cp,以Cp/T 对作图,或以Cp 对lnT 作图,曲线下的面积就是物质在T 时的规定熵值。 由物质的标准熵计算化学反应的标准反应熵 00lim()lim()0p T T T G S T →→??-=?=?0K T →H G ?≈?()()p p H G T T ????≈??T T C S p d )/(d =00 (/)d T p T S S C T T =+? ? =T p T C 0ln d D E F G d e f g +=+B m B i m i i m i S v S S v S v S ,B ,,)()(θθθθθ∑∑ ∑ =?-=?反应物生成物 第二章 热力学第一定律 一.基本要求 1.掌握热力学的一些基本概念,如:各种系统、环境、热力学状态、系 统性质、功、热、状态函数、可逆过程、过程和途径等。 2.能熟练运用热力学第一定律,掌握功与热的取号,会计算常见过程中 的, , Q W U ?和H ?的值。 3.了解为什么要定义焓,记住公式, V p U Q H Q ?=?=的适用条件。 4.掌握理想气体的热力学能和焓仅是温度的函数,能熟练地运用热力学 第一定律计算理想气体在可逆或不可逆的等温、等压和绝热等过程中, , , , U H W Q ??的计算。 二.把握学习要点的建议 学好热力学第一定律是学好化学热力学的基础。热力学第一定律解决了在恒 定组成的封闭系统中,能量守恒与转换的问题,所以一开始就要掌握热力学的一 些基本概念。这不是一蹴而就的事,要通过听老师讲解、看例题、做选择题和做 习题等反反复复地加深印象,才能建立热力学的概念,并能准确运用这些概念。 例如,功和热,它们都是系统与环境之间被传递的能量,要强调“传递”这 个概念,还要强调是系统与环境之间发生的传递过程。功和热的计算一定要与变 化的过程联系在一起。譬如,什么叫雨?雨就是从天而降的水,水在天上称为云, 降到地上称为雨水,水只有在从天上降落到地面的过程中才被称为雨,也就是说, “雨”是一个与过程联系的名词。在自然界中,还可以列举出其他与过程有关的 名词,如风、瀑布等。功和热都只是能量的一种形式,但是,它们一定要与传递 的过程相联系。在系统与环境之间因温度不同而被传递的能量称为热,除热以外, 其余在系统与环境之间被传递的能量称为功。传递过程必须发生在系统与环境之 间,系统内部传递的能量既不能称为功,也不能称为热,仅仅是热力学能从一种 形式变为另一种形式。同样,在环境内部传递的能量,也是不能称为功(或热) 的。例如在不考虑非膨胀功的前提下,在一个绝热、刚性容器中发生化学反应、 燃烧甚至爆炸等剧烈变化,由于与环境之间没有热的交换,也没有功的交换,所 以0, 0, 0Q W U ==?=。这个变化只是在系统内部,热力学能从一种形式变为 第二章热力学第一定律习题 一、选择题 1. 一定量的理想气体从同一始态出发,分别经(1) 等温压缩,(2) 绝热压缩到具有相同压力的终态,以H1,H2分别表示两个终态的焓值,则有:( ) (A) H1> H2(B) H1= H2 (C) H1< H2(D) 无法比较 2. 下列的过程可应用公式ΔH=Q进行计算的是:( ) (A) 不做非体积功,终态压力相同但中间压力有变化的过程 (B) 不做非体积功,一直保持体积不变的过程 (C) 273.15 K,pθ下液态水结成冰的过程 (D) 恒容下加热实际气体 3. 非理想气体进行绝热自由膨胀时,下述答案中哪一个错误?() (A) Q=0 (B) W=0 (C) ΔU=0 (D) ΔH=0 4. 已知:Zn(s)+(1/2)O2??→ZnO Δr H m=351.5 kJ·mol-1 Hg(l)+(1/2)O2??→HgO Δr H m= 90.8 kJ·mol-1 因此Zn+HgO??→ZnO+Hg 的Δr H m是:( ) (A) 442.2 kJ·mol-1(B) 260.7 kJ·mol-1 (C) -62.3 kJ·mol-1(D) -442.2 kJ·mol-1 5. 在一个密闭绝热的房间里放置一台电冰箱,将冰箱门打开,并接通电源使其工作,过一段时间之后,室内的平均气温将如何变化? ( ) (A) 升高(B) 降低 (C) 不变(D) 不一定 6. 对于理想气体的热力学能有下述四种理解: (1) 状态一定,热力学能也一定 (2) 对应于某一状态的热力学能是可以直接测定的 (3) 对应于某一状态,热力学能只有一个数值,不可能有两个或两个以上的数值 (4) 状态改变时,热力学能一定跟着改变 其中正确的是:( ) (A) (1),(2) (B) (3),(4) (C) (2),(4) (D) (1),(3) 7. 按下列路线循环一周,哪种情况是系统对环境做功:( ) 8. 在一定T,p下,汽化焓Δvap H,熔化焓Δfus H和升华焓Δsub H的关系为:( ) (A) Δsub H>Δvap H(B) Δsub H>Δfus H (C) Δsub H=Δvap H+Δfus H(D) Δvap H>Δsub H 上述各式中,哪一个错误? 1. 2mol 298K ,5dm 3的He(g),经过下列可逆变化: (1) 等温压缩到体积为原来的一半; (2) 再等容冷却到初始的压力。 求此过程的Q W U H S ???、、、和。已知=),(,g He C m p ?K -1?mol -1。 解:体系变化过程可表示为 W=W 1+W 2=nRTln 1 2V V +0=2××298×=-3435(J) Q=Q 1+Q 2=W 1+ΔU 2=-3435+n m v C ,ΔT=-3435+n m v C ,(298-298/2) ; =-3435+(-3716)=-7151(J) ΔU=ΔU 1+ΔU 2=ΔU 2=-3716(J) 2. ΔS=ΔS 1+ΔS 2=nRln 12V V +? 21,T T m v T dT nC =2××+2××1-?K J 理想气体从40℃冷却到20℃, 同时体积从250dm 3 变化到50dm 3。已知该气体的m p C ,=?K -1?mol -1,求S ?。 解:假设体系发生如下两个可逆变化过程 250dm 3 等温 50dm 3 等容 50dm 3 40℃ ΔS 1 40℃ ΔS 2 20℃ ΔS=ΔS 1+ΔS 2=nRln 12V V +? 21,T T m v T dT nC =10Rln 250 50 +10×4015.2732015.273++ =(1-?K J ) 》 3. 2mol 某理想气体(m p C ,= J ?K -1?mol -1)在绝热条件下由,膨胀到,求该过程的 Q W U H S ???、、、和。 解: 绝热 膨胀 ∵m p C ,=11--??mol K J ∴ m v C ,=1 -?K J 且Q=0 ΔU= ? 2 1 ,T T m v dT nC =2×× W=-ΔU=2930(J) 等温压缩 等容冷却 物理化学心得体会 经过对物理化学的学习,感觉很系统,很科学,我对这门课程有了进一步的了解与熟悉。物理化学的研究内容是:热力学、动力学、和电化学等,它是化学中的数学、哲学,学好它必须用心、用脑,无论是用眼睛看,用口读,或者用手抄写,都是作为辅助用脑的手段,关键还在于用脑子去想。 学习物理化学应该有自己的方法:一、勤于思考,十分重视教科书,把其原理、公式、概念、应用一一认真思考,不粗枝大叶,且眼手并用,不放过细节,如数学运算。对抽象的概念如熵领悟其物理意义,不妨采用形象化的理解。适当地与同学老师交流、讨论,在交流中摒弃错误。二、勤于应用,在学习阶段要有意识地应用原理去解释客观事物,去做好每一道习题,与做物化实验一样,“应用”对加深对原理的理解有神奇的功效,有许多难点是通过解题才真正明白的。做习题不在于多,而在于精。对于典型的题做完后一定要总结和讨论,力求多一点“觉悟”。三、勤于对比与总结,这里有纵横二个方面,就纵向来说,一个概念原理总是经历提出、论证、应用、扩展等过程,并在课程中多次出现,进行总结定会给你豁然开朗的感觉。就横向来说,一定存在相关的原理,其间一定有内在的联系,如熵增原理、Gibbs自由能减少原理、平衡态稳定性等,通过对比对其相互关系、应用条件等定会有更深的理解,又如把许多相似的公式列出对比也能从相似与差别中感受其意义与功能。在课堂上做笔记,课下进行总结,并随时记下自己学习中的问题及感悟,书本上的、课堂上的物化都不属于自己,只有经历刻苦学习转化为自己的“觉悟”才是终身有用的。 第二、三章是热力学部分的核心与精华,在学习和领会本章内容中,有几个问题要作些说明以下几点:1. 热力学方法在由实践归纳得出的普遍规律的基础上进行演绎推论的一种方法。热力学中的归纳,是从特殊到一般的过程,也是从现象到本质的过程。拿第二定律来说,人们用各种方法制造第二类永动机,但都失败了,因而归纳出一般结论,第二类永动机是造不出来的,换句话说,功变为热是不可逆过程。第二定律抓住了所有宏观过程的本质,即不可逆性。热力学的整个体系,就是在几个基本定律的基础上,通过循环和可逆过程的帮助,由演绎得出的大量推论所构成。有些推论与基本定律一样具有普遍性,有些则结合了一定的条件,因而带有特殊性。例如从第二定律出发,根据可逆过程的特性,证明了卡诺定理,并得出热力学温标,然后导出了克劳修斯不等式,最终得出了熵和普遍的可逆性判据。以后又导出一些特殊条件下的可逆性判据。这个漫长的演绎推理过程,具有极强的逻辑性,是热力学 物理化学第二章热力学第二定律练习题及答案 -CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN 第二章 热力学第二定律练习题 一、判断题(说法正确否): 1.自然界发生的过程一定是不可逆过程。 2.不可逆过程一定是自发过程。 3.熵增加的过程一定是自发过程。 4.绝热可逆过程的?S = 0,绝热不可逆膨胀过程的?S > 0,绝热不可逆压缩过程的?S < 0。 5.为了计算绝热不可逆过程的熵变,可以在始末态之间设计一条绝热可逆途径来计算。 6.由于系统经循环过程后回到始态,?S = 0,所以一定是一个可逆循环过程。 7.平衡态熵最大。 8.在任意一可逆过程中?S = 0,不可逆过程中?S > 0。 9.理想气体经等温膨胀后,由于?U = 0,所以吸的热全部转化为功,这与热力学第二定律矛盾吗 10.自发过程的熵变?S > 0。 11.相变过程的熵变可由 T H S ?= ?计算。 12.当系统向环境传热时(Q < 0),系统的熵一定减少。 13.一切物质蒸发时,摩尔熵都增大。 14.冰在0℃,p 下转变为液态水,其熵变 T H S ?= ?>0,所以该过程为自发过程。 15.自发过程的方向就是系统混乱度增加的方向。 16.吉布斯函数减小的过程一定是自发过程。 17.在等温、等压下,吉布斯函数变化大于零的化学变化都不能进行。 18.系统由V 1膨胀到V 2,其中经过可逆途径时做的功最多。 19.过冷水结冰的过程是在恒温、恒压、不做其他功的条件下进行的,由基本方程可得?G = 0。 20.理想气体等温自由膨胀时,对环境没有做功,所以 -p d V = 0,此过程温度不变,?U = 0,代入热力学基本方程d U = T d S - p d V ,因而可得d S = 0,为恒熵过程。 21.是非题: ⑴“某体系处于不同的状态,可以具有相同的熵值”,此话对否? ⑵“体系状态变化了,所有的状态函数都要变化”,此话对否? ⑶ 绝热可逆线与绝热不可逆线能否有两个交点? ⑷ 自然界可否存在温度降低,熵值增加的过程?举一例。 ⑸ 1mol 理想气体进行绝热自由膨胀,体积由V 1变到V 2,能否用公式: ???? ??=?12 ln V V R S 计算该过程的熵变? 22.在100℃、p 时,1mol 水与100℃的大热源接触,使其向真空容器中蒸发成 100℃、p 的水蒸气,试计算此过程的?S 、?S (环)。 23. ? ??? ??=?12ln V V R S 的适用条件是什么? 24.指出下列各过程中,物系的?U 、?H 、?S 、?A 、?G 中何者为零? 第二章 热力学第二定律练习题 一、判断题(说法正确否): 1.自然界发生的过程一定是不可逆过程。 2.不可逆过程一定是自发过程。 3.熵增加的过程一定是自发过程。 4.绝热可逆过程的?S = 0,绝热不可逆膨胀过程的?S > 0,绝热不可逆压缩过程的?S < 0。 5.为了计算绝热不可逆过程的熵变,可以在始末态之间设计一条绝热可逆途径来计算。 6.由于系统经循环过程后回到始态,?S = 0,所以一定是一个可逆循环过程。 7.平衡态熵最大。 8.在任意一可逆过程中?S = 0,不可逆过程中?S > 0。 9.理想气体经等温膨胀后,由于?U = 0,所以吸的热全部转化为功,这与热力学第二定律矛盾吗? 10.自发过程的熵变?S > 0。 11.相变过程的熵变可由 T H S ?= ?计算。 12.当系统向环境传热时(Q < 0),系统的熵一定减少。 13.一切物质蒸发时,摩尔熵都增大。 14.冰在0℃,p 下转变为液态水,其熵变 T H S ?= ?>0,所以该过程为自发过程。 15.自发过程的方向就是系统混乱度增加的方向。 16.吉布斯函数减小的过程一定是自发过程。 17.在等温、等压下,吉布斯函数变化大于零的化学变化都不能进行。 18.系统由V 1膨胀到V 2,其中经过可逆途径时做的功最多。 19.过冷水结冰的过程是在恒温、恒压、不做其他功的条件下进行的,由基本方程可得?G = 0。 20.理想气体等温自由膨胀时,对环境没有做功,所以 -p d V = 0,此过程温度不变,?U = 0,代入热力学基本方程d U = T d S - p d V ,因而可得d S = 0,为恒熵过程。 21.是非题: ⑴“某体系处于不同的状态,可以具有相同的熵值”,此话对否? ⑵“体系状态变化了,所有的状态函数都要变化”,此话对否? ⑶ 绝热可逆线与绝热不可逆线能否有两个交点? ⑷ 自然界可否存在温度降低,熵值增加的过程?举一例。 ⑸ 1mol 理想气体进行绝热自由膨胀,体积由V 1变到V 2,能否用公式: ???? ??=?12 ln V V R S 计算该过程的熵变? 22.在100℃、p 时,1mol 水与100℃的大热源接触,使其向真空容器中蒸发成 100℃、p 的水蒸气,试计算此过程的?S 、?S (环)。 23. ? ??? ??=?12ln V V R S 的适用条件是什么? 24.指出下列各过程中,物系的?U 、?H 、?S 、?A 、?G 中何者为零? ⑴ 理想气体自由膨胀过程; ⑵ 实际气体节流膨胀过程; ⑶ 理想气体由(p 1,T 1)状态绝热可逆变化到(p 2,T 2)状态; ⑷ H 2和Cl 2在刚性绝热的容器中反应生成HCl ; ⑸ 0℃、p 时,水结成冰的相变过程; ⑹ 理想气体卡诺循环。 25.a mol A 与b mol B 的理想气体,分别处于(T ,V ,p A )与(T ,V ,p B )的状态,等温等容混合为 (T ,V ,p )状态,那么?U 、?H 、?S 、?A 、?G 何者大于零,小于零,等于零? 26.一个刚性密闭绝热箱中,装有H 2与Cl 2混合气体,温度为298K ,今用光引发,使其 《物理化学》(下) (南京大学第五版)总结 第八章 电解质溶液 一、基本概念与定义 1. 离子迁移数t 电解质溶液导电时,溶液中的i 离子运载的电流I i 与总电流之比(即i 离子所承担的导电任务的分数)。 1i i i i i i i i Q I u t t Q I u = ===∑∑ 2. 离子电迁移率(离子淌度)u i :单位电位梯度时离子的运动速率。 3. 电导与电导率 电导G(Ω-1 ):电阻R 的倒数。a 电导率κ(Ω-1 ·m -1 ):电阻率ρ的倒数。 电导池常数K cell :K cell = L/A L: 电极之间的距离;A:电极的面积 4. 摩尔电导率Λm (S ·m 2 ·mol -1 ) 含1mol 电解质的溶液置于相距单位距离的2个平行电极之间的电导池所具有的电导。 m c κ Λ= 5.电解质的平均活度和平均活度因子 对于任意价型的强电解质M ν+B ν- 平均活度因子 γ± =[ (γ+)ν+ (γ-)ν-] 1/(ν + + ν- ) a ± = m ±γ± m ± =[ (m +)ν+ (m -)ν-] 1/(ν + + ν- ) m + = ν+m ;m - = ν-m 电解质活度a = (a ±)( ν+ + ν- ) 6. 离子强度I 21 2i i i I m z = ∑ 7. 离子氛 电解质溶液中环绕在某一离子B 周围电荷与B 相反、电荷数量与B 相等的异号离子构成的球体。 8. 基本摩尔单元 发生1mol 电子转移电极反应的物质的量1/zM n+ + e → 1/z M 二、基本公式 1. Faraday 电解定律 往电解池通电,在电极上发生化学反应的物质的量与通入的电量成正比。 Q = It = znF z :电极反应M n+ + ze → M 中电子转移的计量数。 1. 2mol 298K,5dm3的He (g ),经过下列可逆变化: (1) 等温压缩到体积为原来的一半; (2) 再等容冷却到初始的压力。 求此过程的Q W U H S ???、、、和。已知=),(,g He C m p 20.8J?K-1?mol -1。 解:体系变化过程可表示为 W =W 1+W 2=n RT ln 1 2V V +0=2×8.314×298×l n0.5=-3435(J ) Q=Q 1+Q 2=W 1+ΔU 2=-3435+nm v C ,ΔT=-3435+n m v C ,(298-298/2) =-3435+(-3716)=-7151(J) ΔU=ΔU 1+ΔU2=ΔU2=-3716(J) ΔS=ΔS 1+ΔS2=nRln 12V V +? 21,T T m v T dT nC =2×8.314×ln0.5+2×1.5×8.314ln 0.5 =-2818(1-?K J ) 2. 10mol 理想气体从40℃冷却到20℃,同时体积从250dm 3 变化到50dm 3。已知该气体的 m p C ,=29.20J?K-1?mol -1,求S ?。 解:假设体系发生如下两个可逆变化过程 250dm 3 等温 50dm 3 等容 50d m3 40℃ ΔS1 40℃ ΔS 2 20℃ ΔS=ΔS 1+ΔS 2=n Rln 12V V +? 21,T T m v T dT nC =10Rln 250 50+10×(29.20-8.314)×ln 4015.2732015.273++ =-147.6(1-?K J ) 3. 2mol 某理想气体(m p C ,=29.36 J ?K -1?mol -1)在绝热条件下由273.2K,1.0MPa 膨胀到 203.6K,0.1MPa 求该过程的Q W U H S ???、、、和。 解:273.2K 绝热 203.6K 1.0MPa 膨胀 0.1MPa 等温压缩 等容冷却 2.15 容积为0.1m3的恒容密闭容器中有一绝热隔板,其两侧分别为0℃,4mol的Ar(g)及150℃,2mol的Cu(s)。现将隔板撤掉,整个系统达到热平衡,求末态温度t及过程的ΔH 。 已知:Ar(g)和Cu(s)的摩尔定压热容C p,m分别为20.786J·mol-1·K-1及24.435 J·mol-1·K-1,且假设均不随温度而变。 解: 恒容绝热混合过程Q = 0 W = 0 ∴由热力学第一定律得过程ΔU=ΔU(Ar,g)+ΔU(Cu,s)= 0 ΔU(Ar,g) = n(Ar,g) C V,m (Ar,g)×(t2-0) ΔU(Cu,S) ≈ΔH (Cu,s) = n(Cu,s)C p,m(Cu,s)×(t2-150) 解得末态温度t2 = 74.23℃ 又得过程 ΔH =ΔH(Ar,g) + ΔH(Cu,s) =n(Ar,g)C p,m(Ar,g)×(t2-0) + n(Cu,s)C p,m(Cu,s)×(t2-150) = 2.47kJ 或ΔH =ΔU+Δ(pV) =n(Ar,g)RΔT=4×8314×(74.23-0)= 2.47kJ 2.17 单原子理想气体A与双原子理想气体B的混合物共5mol,摩尔分数y =0.4, B 始态温度T1=400K,压力P1=200kPa,今该混合气体绝热反抗恒外压p=100kPa 膨胀到平衡态,求末态温度T2及过程的W,ΔU及ΔH。 2.21 已知水(H2O,l)在100℃的饱和蒸气压p s=101.325kPa,在此温度、压力下 水的摩尔蒸发焓。求在100℃,101.325kPa下使1kg水蒸气全部凝结成液体水时的W,Q,ΔU,ΔH和ΔH。设水蒸气适用理想气体状态方程式。 解: 题给过程的始末态和过程特性如下: n = m/M = 1kg/18.015g·mol-1 = 55.509mol 第二章 热力学第一定律 思考题.:1. 一封闭系统,当始终态确定后:(a )当经历一个绝热过程,则功为定值;(b )若经历一个等容过程,则Q 有定值:(c )若经历一个等温过程,则热力学能有定值:(d )若经历一个多方过程,则热和功的和有定值。 解释:始终态确定时,则状态函数的变化值可以确定,非状态函数则不是确定的。但是热力学能U 和焓没有绝对值,只有相对值,比较的主要是变化量。 2. 从同一始态A 出发,经历三种不同途径到达不同的终态: (1)经等温可逆过程从A→B;(2)经绝热可逆过程从A→C;(3)经绝热不可逆过程从A→D。 试问: (a )若使终态的体积相同,D 点应位于BC 虚线的什么位置,为什么? (b )若使终态的压力相同,D 点应位于BC 虚线的什么位置,为什么,参见图 12p p (a) (b) 图 2.16 解释: 从同一始态出发经一绝热可逆膨胀过程和一经绝热不可逆膨胀过程,当到达相同的 终态体积V 2或相同的终态压力p 2时,绝热可逆过程比绝热不可逆过程作功大,又因为W (绝热)=C V (T 2-T 1),所以T 2(绝热不可逆)大于T 2(绝热可逆),在V 2相同时,p=nRT/V,则p 2(绝热不可逆)大于 p 2(绝热可逆)。在终态p 2相同时,V =nRT/p ,V 2(绝热不可逆)大于 V 2(绝热可逆)。 不可逆过程与等温可逆过程相比较:由于等温可逆过程温度不变,绝热膨胀温度下降,所以T 2(等温可逆)大于T 2(绝热不可逆);在V 2相同时, p 2(等温可逆)大于 p 2(绝热不可逆)。在p 2相同时,V 2(等温可逆)大于 V 2(绝热不可逆)。 综上所述,从同一始态出发经三种不同过程, 当V 2相同时,D 点在B 、C 之间,p 2(等温可逆)>p 2(绝热不可逆)> p 2(绝热可逆)当p 2相同时,D 点在B 、C 之间,V 2(等温可逆)> V 2(绝热不可逆)>V 2(绝热可逆)。 总结可知:主要切入点在温度T 上,绝热不可逆做功最小。 第二章热力学第一定律 1mol 理想气体在恒定压力下温度升高1℃,求过程中系统与环境交换的功。 解:理想气体n = 1mol 对于理想气体恒压过程,应用式( 2.2.3) W =- p amb V -=p(V2-V1) =-(nRT2-nRT1) =- 1mol 水蒸气 (H2O,g)在 100℃,下全部凝结成液态水。求过程的功。假设:相对于水蒸气的体 积,液态水的体积可以忽略不计。 解: n = 1mol 恒温恒压相变过程 ,水蒸气可看作理想气体 , 应用式( 2.2.3) W =- p amb V =-p(V l -V g ) ≈ pVg = nRT = 在25℃及恒定压力下,电解 1mol 水(H2O,l),求过程的体积功。 H2O(l)= H2(g) + 1/2O2(g) 解: n = 1mol 恒温恒压化学变化过程, 应用式( 2.2.3) W=-p amb V =- (p2V2-p1V1)≈- p2V2 =-n2RT=- 若途径 a 的 Q a=,Wa=-;而途径 b 的Q b=系统由相同的始态经过不同途径达到相同的末态。 -。求 W b. 解 :热力学能变只与始末态有关,与具体途径无关 ,故ΔU a=ΔU b 由热力学第一定律可得Qa + Wa = Q b + W b ∴ W b = Q a + W a-Q b = - 始态为 25℃,200 kPa 的 5 mol 某理想气体,经途径 a ,b 两不同途径到达相同的末态。途 经 a 先经绝热膨胀到 -28.47℃, 100 kPa ,步骤的功 ;再恒容加热到压力 200 kPa 的末态,步骤的热 。途径 b 为恒压加热过程。求途径 b 的 及 。 解:先确定系统的始、末态 V 1 = nRT 1 =5 ×8.314 ×298.15 3 P 1 = 0.0619 m 200000 V 2 = V = nRT = 5 ×8.314 ×244.58 = 0.1016 m 3 P 100000 U = W a + Q a = (-5.57 + 25.42 )kJ = 19.85kJ 对于途径 b ,其功为 W b = - p 1 V = -200000(0.1016-0.0619) J = -7.932kJ 根据热力学第一定律 4mol 某理想气体,温度升高 20℃ , 求 ΔH-ΔU 的值。 解:根据焓的定义 -3 水 (H 2 在 ℃ 下:( )压力从 增 已知水在 25℃ 的密度 ρ =997.04kg ·m。求 1mol 100kPa O,l) 25 1 加至 200kPa 时的 H;(2)压力从 100kPa 增加至 1Mpa 时的 ΔH。假设水的密度不随压力改 变,在此压力范围内水的摩尔热力学能近似认为与压力无关。 -3 -3 -1 解 : 已知 ρ= 997.04kg ·m H2O = × 10 kg mol · M 第二章热力学第一定律 一.基本要求 1.掌握热力学的一些基本概念,如:各种系统、环境、热力学状态、系统性质、功、热、状态函数、可逆过程、过程和途径等。 2.能熟练运用热力学第一定律,掌握功与热的取号,会计算常见过程中的Q,W, U和 H的值。 3.了解为什么要定义焓,记住公式U Q V , H Q p的适用条件。 4.掌握理想气体的热力学能和焓仅是温度的函数,能熟练地运用热力学第一定律计算理想气体在可逆或不可逆的等温、等压和绝热等过程中, U, H, W, Q的计算。 二.把握学习要点的建议 学好热力学第一定律是学好化学热力学的基础。热力学第一定律解决了在恒 定组成的封闭系统中,能量守恒与转换的问题,所以一开始就要掌握热力学的一 些基本概念。这不是一蹴而就的事,要通过听老师讲解、看例题、做选择题和做习 题等反反复复地加深印象,才能建立热力学的概念,并能准确运用这些概念。 例如,功和热,它们都是系统与环境之间被传递的能量,要强调“传递”这个概念,还要强调是系统与环境之间发生的传递过程。功和热的计算一定要与变化的过 程联系在一起。譬如,什么叫雨?雨就是从天而降的水,水在天上称为云,降到地 上称为雨水,水只有在从天上降落到地面的过程中才被称为雨,也就是说,“雨” 是一个与过程联系的名词。在自然界中,还可以列举出其他与过程有关的名词,如风、瀑布等。功和热都只是能量的一种形式,但是,它们一定要与传递 的过程相联系。在系统与环境之间因温度不同而被传递的能量称为热,除热以外, 其余在系统与环境之间被传递的能量称为功。传递过程必须发生在系统与环境之间,系统内部传递的能量既不能称为功,也不能称为热,仅仅是热力学能从一种形式变 为另一种形式。同样,在环境内部传递的能量,也是不能称为功(或热)的。例如在 不考虑非膨胀功的前提下,在一个绝热、刚性容器中发生化学反应、 燃烧甚至爆炸等剧烈变化,由于与环境之间没有热的交换,也没有功的交换,所 以 Q 0, W 0, U 0 。这个变化只是在系统内部,热力学能从一种形式变为 第二章热力学第一定律 1mol理想气体在恒定压力下温度升高1℃,求过程中系统与环境交换的功。解:理想气体n = 1mol 对于理想气体恒压过程,应用式(2.2.3) W =-p ambΔV =-p(V2-V1) =-(nRT2-nRT1) =- 1mol水蒸气(H2O,g)在100℃,下全部凝结成液态水。求过程的功。假设:相对于水蒸气的体积,液态水的体积可以忽略不计。 解: n = 1mol 恒温恒压相变过程,水蒸气可看作理想气体, 应用式(2.2.3) W =-p ambΔV =-p(V l-V g ) ≈ pVg = nRT = 在25℃及恒定压力下,电解1mol水(H2O,l),求过程的体积功。 H2O(l) = H2(g) + 1/2O2(g)解: n = 1mol 恒温恒压化学变化过程, 应用式(2.2.3) W=-p ambΔV =-(p2V2-p1V1)≈-p2V2 =-n2RT=- 系统由相同的始态经过不同途径达到相同的末态。若途径a的Q a=,Wa=-;而途径b的Q b=-。求W b. 解: 热力学能变只与始末态有关,与具体途径无关,故ΔU a= ΔU b 由热力学第一定律可得Qa + Wa = Q b + W b ∴ W b = Q a + W a-Q b = - 始态为25℃,200 kPa的5 mol某理想气体,经途径a,b两不同途径到达相同的末态。途经a先经绝热膨胀到 -28.47℃,100 kPa,步骤的功;再恒容加热到压力200 kPa的末态,步骤的热。途径b为恒压加热过程。求途径b的及。 解:先确定系统的始、末 态 311106190200000 1529831485m ...P nRT V =××== 3210160100000 58 24431485m ...P nRT V V =××== = kJ .kJ )..(Q W U Δa a 85194225575=+=+=- 对于途径b ,其功为 kJ .J ..V Δp W b 932706190101602000001-)-(--=== 根据热力学第一定律 4mol 某理想气体,温度升高20℃, 求ΔH-ΔU 的值。 解:根据焓的定义 物理化学期末总结 在这一学期的学习中,我们主要学习到了物理化学中的电化学,量子力学,统计热力学,界面现象与化学动力学的一些基础知识,这其中我个人还有许多地方存在问题,包括一些基础概念,公式,还有解题思路,都有些欠缺。这更能说明这是一门需要我们用心才能学好的课程,在这里请允许我自我检讨一下: 在这一学期的学习生活中,我并没有尽到一个好学生应尽的义务去认真负责的完成本学期的学习任务,导致在临近期末的时候脑海中实在搜刮不出一些讲得出口,拿得出手,上得了台面的知识与技巧,又实际上没有没什么可说的,没什么能说的出口的,可以说是虚度好一段大好时光。学习本如逆水行舟,不进则退。但学期末的总结也只能说是反省一下自我过失,谈不上后悔,和如果当初了......为了期末考试对于我来说我还是要好好复习。以弥补我在这个学期中对物理化学学习的不用功。 但是,这学期的课程中有很多我感兴趣的部分知识点,仍然学了些可以总结的东西,比如电化学。 电化学学习伊始,老师就提点了我们几点基本的学习要求:①理解原电池与电解池的异同点;理解电导‘电导率’摩尔电导率的定义及其应用。②掌握电解质的活度‘离子平均活度和离子平均活动系数的定义及计算。③掌握离子迁移数,离子电迁移率的定义了解迁移数的测定方法。掌握离子独立运动定律和德拜休克尔极限定律。④掌握电池反应和电极反应的能斯特方程,会利用能斯特方程计算电池电动势和电极电动势。⑤了解浓差电池的原理,了解液接电势的计算。⑥了解分解电压和极化的概念以及极化的结果。 学习中我了解到电化学是研究化学能和电能相之间相互转化规律的科学。其中电解质的导电任务是由正,负离子共同承担,向阴,阳两极迁移的正负离子物质的量总和恰好等于通入溶液的总电量,等类似的基本概念。还学会了希托夫法测量离子迁移数的测定方法,电导定义,德拜休克极限公式和有关电池热力学方面的计算与测定。当然不能不提的还有电池的原设计,其中有氧化还原反应的,中和反应的,沉淀反应的以及浓差电池——扩散过程。 窥一斑而见全豹,从本学期的电电化学的学习中,我更加深了了解物理化学这门课的含义:即物理化学是在物理和化学两大学科基础上发展起来的。它以丰富的化学现象和体系为对象,大量采纳物理学的理论成就与实验技术,探索、归纳和研究化学的基本规律和理论,构成化学科学的理论基础。也更加明白了问什么说“物理化学的水平在相当大程度上反映了化学发展的深度”。 最后我想说的是物理化学是一门值得我们学生努力学习的一门课,它相对而言更难,更精,是我们化学专业领域的一块好工具,傻傻的我一开始并不清楚,只有失去才懂得追悔莫及。 第二章 多相多组分系统热力学 2007-4-24 §2.1 均相多组分系统热力学 练习 1 水溶液(1代表溶剂水,2代表溶质)的体积V 是质量摩尔浓度b 2的函数,若 V = A +B b 2+C (b 2) 2 (1)试列式表示V 1和V 2与b 的关系; 答: b2: 1kg 溶剂中含溶质的物质的量, b 2=n 2, 11 2222,,,,2T P n T P n V V V B cb n b ???? ??===+ ? ? ?????? ∵ V=n 1V 1+n 2V 2( 偏摩尔量的集合公式) ∴ V 1=(1/n 1)(V -n 2V 2)= (1/n 1)( V -b 2V 2)= (1/n 1)(A+Bb 2+c(b 2)2-Bb 2-2cb 2)= (1/n 1)[A-c(b 2)2] (2)说明A ,B , A/n 1 的物理意义; 由V = A +B b 2+C (b 2)2 , V=A; A: b 2→0, 纯溶剂的体积,即1kg 溶剂的体积 B; V 2=B+2cb 2, b 2→0, 无限稀释溶液中溶质的偏摩尔体积 A/n 1:V 1= (1/n 1)[A-c(b 2)2],∵b 2→0,V = A +B b 2+C (b 2)2, 纯溶剂的体积为A, ∴A/n 1 为溶剂的摩尔体积。 (3)溶液浓度增大时V 1和V 2将如何变化? 由V 1,V 2 的表达式可知, b 2 增大,V 2 也增加,V 1降低。 2 哪个偏微商既是化学势又是偏摩尔量?哪些偏微商称为化学势但不是偏摩尔量? 答: 偏摩尔量定义为 ,,c B B T P n Z Z n ???= ????所以,,c B B T P n G G n ???= ???? ,,c B B T P n H H n ???= ???? ,,c B B T P n F F n ?? ?= ???? ,,c B B T P n U U n ?? ?= ? ??? 化学势定义为: ,,c B B T P n G n μ???= ????= ,,c B T V n F n ??? ????= ,,c B S V n U n ??? ????= ,,c B S P n H n ?? ? ? ??? 可见,偏摩尔Gibbs 自由能既是偏摩尔量又是化学势。,,c B T V n F n ??? ????= ,,c B S V n U n ??? ????= ,,c B S P n H n ?? ? ? ???是化学势,但不是偏摩尔量。 3 25℃时 物质的量分数为0.4的甲醇水溶液,如果往大量此溶液中加1mol H 2O ,溶液体积增加17.35cm 3,如果往大量此溶液中加1mol CH 3OH 溶液体积增加39.01cm 3。试计算(1)将0.4mol CH 3OH 和0.6mol H 2O 混合时,混合溶液的体积。(2)此混合过程中体积的变化。已知25℃时甲醇密度为0.7911g cm -3,水的密度为0.9971g cm -3。 答:χB =0.4 V H2O =17.35cm 3, V 甲醇=39.01cm 3 (1) V=n 1V 1+n 2V 2=0.4×39.01+0.6×17.35= 26,01cm 3 (2) 混合前:V=(0.4×32/ρ甲醇)+ (0.6×18/ρ水)=(0.4×32/0.7911)+(0.6×18/0.9971)=27.01cm 3 ΔV=26.01-27.01=-1.0cm 3 第七章 1. 法拉第定律:Q =zFξ 2. 迁移数计算++++-+- = = ++I Q t I I Q Q 【例】用铜电极电解CuSO 4溶液,通电一定时间后测得银电量计中析出0.7512g 银,并测得阳极区溶液中CuSO 4质量增加0.3948g 。试求CuSO 4溶液中离子的迁移数t(Cu 2+)和t(SO 42- )。 (已知摩尔质量M (Ag) = 107.868 g·mol -1,M (CuSO 4) =159.604 g·mol -1。) 解:电量计中析出银的物质的量即为通过总电量:n (电) =0.7512g/M(Ag)= 6.964×10-3 mol 阳极区对Cu 2+ 进行物料衡算:n (原) + n (电)-n (迁出) = n (后) n (迁出) = n (原) -n (后) + n (电) n (迁出) =-+0394812 07512.().()g C u S O g A g 4M M =-?+?-(...)0394821596046964103mol =2.017× 10- 3 mol t (Cu 2+ ) = ()() n n 迁出电=??--201710 6 9641033 .. =0.2896 t (SO 42- ) =1-t (Cu 2+) = 0.7164 3. 电导(G ):=1G /R ,电导率1l G A R =?=?cell s κK ,摩尔电导率:/m m V c κκΛ== 【例】已知25℃时 KCl 溶液的电导率为0.2768 S·m -1。一电导池中充以此溶 液,在25 ℃时测得其电阻为453Ω。在同一电导池中装入同样体积的质量浓度为0.555g.dm -3的CaCl 2溶液,测得电阻为1050Ω。计算(1)电导池系数;(2)CaCl 2溶液的电导率;(3)CaCl 2溶液的摩尔电导率。 解:(1)电导池系数为 (2)CaCl 2溶液的电导率 (3)CaCl 2溶液的摩尔电导 4. 离子独立运动定律∞ ∞ ∞ ++--=+m m m ,,ΛνΛνΛ 【例】已知25℃时0.05mol.dm -3CH 3COOH 溶液的电导率为3.8?10-2S.m -1。计算CH 3COOH 的解离度α及解离常数K θ。4 2 1 ()349.8210..,m H S m mol ∞ + --Λ=? 4213-(CH COO )40.910..m S m mol ∞--Λ=? 第二章热力学第二定律练习题 一、判断题(说法正确否): 1.自然界发生的过程一定是不可逆过程。 2.不可逆过程一定是自发过程。 3.熵增加的过程一定是自发过程。 4.绝热可逆过程的?S= 0,绝热不可逆膨胀过程的?S> 0,绝热不可逆压缩过程的?S< 0。5.为了计算绝热不可逆过程的熵变,可以在始末态之间设计一条绝热可逆途径来计算。6.由于系统经循环过程后回到始态,?S = 0,所以一定是一个可逆循环过程。 7.平衡态熵最大。 8.在任意一可逆过程中?S = 0,不可逆过程中?S > 0。 9.理想气体经等温膨胀后,由于?U = 0,所以吸的热全部转化为功,这与热力学第二定律矛盾吗 10.自发过程的熵变?S > 0。 11.相变过程的熵变可由计算。 12.当系统向环境传热时(Q < 0),系统的熵一定减少。 13.一切物质蒸发时,摩尔熵都增大。 14.冰在0℃,p下转变为液态水,其熵变>0,所以该过程为自发过程。 15.自发过程的方向就是系统混乱度增加的方向。 16.吉布斯函数减小的过程一定是自发过程。 17.在等温、等压下,吉布斯函数变化大于零的化学变化都不能进行。 18.系统由V1膨胀到V2,其中经过可逆途径时做的功最多。 19.过冷水结冰的过程是在恒温、恒压、不做其他功的条件下进行的,由基本方程可得?G = 0。 20.理想气体等温自由膨胀时,对环境没有做功,所以 -p d V= 0,此过程温度不变,?U= 0,代入热力学基本方程d U = T d S - p d V,因而可得d S = 0,为恒熵过程。 21.是非题: ⑴“某体系处于不同的状态,可以具有相同的熵值”,此话对否 ⑵“体系状态变化了,所有的状态函数都要变化”,此话对否 ⑶绝热可逆线与绝热不可逆线能否有两个交点 ⑷自然界可否存在温度降低,熵值增加的过程举一例。 ⑸ 1mol理想气体进行绝热自由膨胀,体积由V1变到V2,能否用公式: 计算该过程的熵变 22.在100℃、p时,1mol水与100℃的大热源接触,使其向真空容器中蒸发成 100℃、p的水蒸气,试计算此过程的?S、?S(环)。 23.的适用条件是什么 24.指出下列各过程中,物系的?U、?H、?S、?A、?G中何者为零 ⑴理想气体自由膨胀过程;⑵实际气体节流膨胀过程; ⑶理想气体由(p1,T1)状态绝热可逆变化到(p2,T2)状态; ⑷ H2和Cl2在刚性绝热的容器中反应生成HCl; ⑸ 0℃、p时,水结成冰的相变过程;⑹理想气体卡诺循环。 25.a mol A与b mol B的理想气体,分别处于(T,V,p A)与(T,V,p B)的状态,等温等容混合为 (T,V,p)状态,那么?U、?H、?S、?A、?G何者大于零,小于零,等于零 26.一个刚性密闭绝热箱中,装有H2与Cl2混合气体,温度为298K,今用光引发,使其化合为HCl(g),光能忽略,气体为理想气体,巳知(HCl) = ·mol-1,试判断该过程中?U、?H、?S、?A、?G是大于零,小于零,还是等于零 27.在一绝热恒容箱内,有一绝热板将其分成两部分,隔板两边各有1mol N2,其状态分别为298K、p0与298K、10p0,若以全部气体为体系,抽去隔板后,则Q、W、?U、?H、?S中,哪些为零 第二章练习题 一、填空题 1、根据体系和环境之间能量和物质的交换情况,可将体系分成、、 。 2、强度性质表现体系的特征,与物质的数量无关。容量性质表现 体系的特征,与物质的数量有关,具有性。 3、热力学平衡状态同时达到四种平衡,分别是、、 、。 4、体系状态发生变化的称为过程。常见的过程有、 、、、。 5、从统计热力学观点看,功的微观本质是,热的微观本质是 。 6、气体各真空膨胀膨胀功W= 0 7、在绝热钢瓶中化学反应△U= 0 8、焓的定义式为。 二、判断题(说法对否): 1、当体系的状态一定时,所有的状态函数都有一定的数值。(√) 2、当体系的状态发生变化时,所有的状态函数的数值也随之发生变化。(χ)3.因= ΔH, = ΔU,所以与都是状态函数。(χ) 4、封闭系统在压力恒定的过程中吸收的热等于该系统的焓。(χ) 错。只有封闭系统不做非膨胀功等压过程ΔH=Q P 5、状态给定后,状态函数就有定值;状态函数确定后,状态也就确定了。(√) 6、热力学过程中W的值应由具体过程决定( √ ) 7、1mol理想气体从同一始态经过不同的循环途径后回到初始状态,其热力学能 不变。( √ ) 三、单选题 1、体系的下列各组物理量中都是状态函数的是( C ) A 、T、P、V、Q B 、m、W、P、H C、T、P、V、n、 D、T、P、U、W 2、对于内能是体系的单值函数概念,错误理解是( C ) A体系处于一定的状态,具有一定的内能 B对应于某一状态,内能只能有一数值不能有两个以上的数值 C状态发生变化,内能也一定跟着变化 D对应于一个内能值,可以有多个状态 3下列叙述中不具有状态函数特征的是(D ) A体系状态确定后,状态函数的值也确定 B体系变化时,状态函数的改变值只由体系的始终态决定 C经循环过程,状态函数的值不变 D状态函数均有加和性 4、下列叙述中正确的是( A ) A物体温度越高,说明其内能越大B物体温度越高,说明其所含热量越多C凡体系温度升高,就肯定是它吸收了热 D凡体系温度不变,说明它既不吸热也不放热 5、下列哪一种说法错误( D ) A焓是定义的一种具有能量量纲的热力学量 B只有在某些特定条件下,焓变△H才与体系吸热相等 C焓是状态函数 D焓是体系能与环境能进行热交换的能量物理化学第二章 热力学第一定律
物理化学第二章习题
《简明物理化学》第二章答案
物理化学的心得体会
物理化学第二章热力学第二定律练习题及答案
物理化学第二章热力学第二定律练习题及答案
物理化学(下)总结
《简明物理化学》第二章答案
物理化学课后习题第二章答案
物理化学傅献彩上册习题答案
物理化学第二章课后答案完整版.docx
物理化学第二章热力学第一定律
第五版物理化学第二章习题答案
物理化学课程总结
物理化学第二章作业及答案
物理化学下册总结
物理化学第二章热力学第二定律练习题及答案
《物理化学》第二章热力学第一定律练习题(含答案)