
实验:缓冲溶液
一、实验目的
1、加深对缓冲作用原理及性质的理解;
2、掌握缓冲溶液的配制方法及吸量管的使用方法;
3、学会使用pH 试纸测定溶液pH 值的方法。
二、实验原理
缓冲溶液的配制,主要是根据缓冲溶液pH 值的计算公式:
[][]
HA A pK pH a
-
+=lg
(1) 由于 []
V
V c A A A -
-?=
- []
V
V c HA HA
HA ?=
代入(1)式,得 HA HA A A V c V c pKa pH ??+=--lg
(2)
当c A-=c HA 时,则得 HA
A V V pKa pH -+=lg
(3)
利用(2)或(3)式可配制具有一定pH 值的缓冲溶液,也可以计算一定浓度和体积的共轭酸及其共轭碱溶液配制成的缓冲溶液的pH 值。
由(1)式可知,缓冲溶液的pH 值由[A -]/[HA](即缓冲比)决定,因此稀释时几乎不影响缓冲溶液的pH 值,但稀释也是有一定限度的,过度稀释也会使缓冲溶液的pH 值升高。
由于缓冲溶液中有抗酸成分和抗碱成分,故加入少量强酸或强碱,其pH 值几乎不变。但所有缓冲溶液的缓冲能力都有一定限度,即各具有一定的缓冲容量,如果加入强酸或强碱的量超过了缓冲溶液的缓冲能力时,则将引起溶液pH 值的急剧改变,失去了缓冲作用。
三、实验方法和实验注意事项
1、缓冲溶液的配制
取洁净大试管三支,标上号数,放在试管架上,然后用10ml 刻度吸量管按下表中所示的数量,吸取0.06mol·L -1Na 2HPO 4及0.06mol·L -
1KH 2PO 4加入试管中。
计算所配制缓冲溶液的pH 值,记入实验报告中。同时,用洁净的玻璃棒分别蘸取上面配好的三种缓冲溶液与精密pH 试纸接触,把显有一定颜色的pH 试纸与标准色列比较,粗测三种缓冲溶液的pH 值(注意与汁算结果是否相同)。
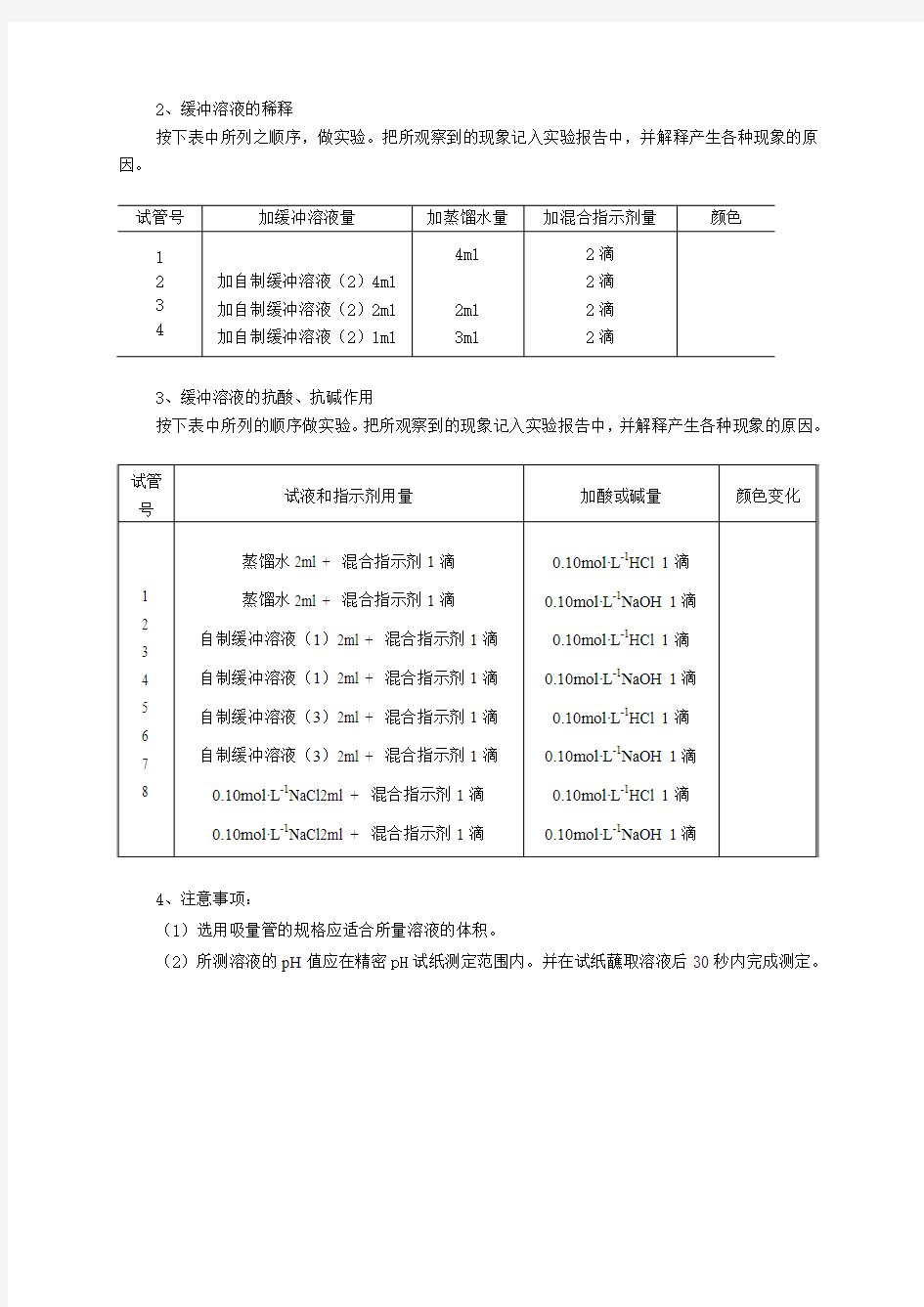
2、缓冲溶液的稀释
按下表中所列之顺序,做实验。把所观察到的现象记入实验报告中,并解释产生各种现象的原因。
3、缓冲溶液的抗酸、抗碱作用
按下表中所列的顺序做实验。把所观察到的现象记入实验报告中,并解释产生各种现象的原因。
4、注意事项:
(1)选用吸量管的规格应适合所量溶液的体积。
(2)所测溶液的pH值应在精密pH试纸测定范围内。并在试纸蘸取溶液后30秒内完成测定。