
第二章热力学第二定律
1、2.0mol理想气体在27℃、20.0dm3下等温膨胀到50.0dm3,试计算下述各过程的Q、W、ΔU、ΔH、ΔS。
(1)可逆膨胀;(2)自由膨胀;(3)对抗恒外压101kPa膨胀。
解:(1)ΔU=ΔH=0;
Q=-W==2.0×8.314×300×=4571(J);
ΔS===15.24(J·K-1)
(2)Q=0;W=0;ΔU=0;ΔH=0;ΔS===15.24(J·K-1)
(3)ΔU=ΔH=0;
Q=-W=101×(50-20) =3030(J);ΔS===15.24(J·K-1)
2、1.0molα-Fe由25℃加热到850℃,求ΔS。已知C p,m=30.30J·mol-1·K-1
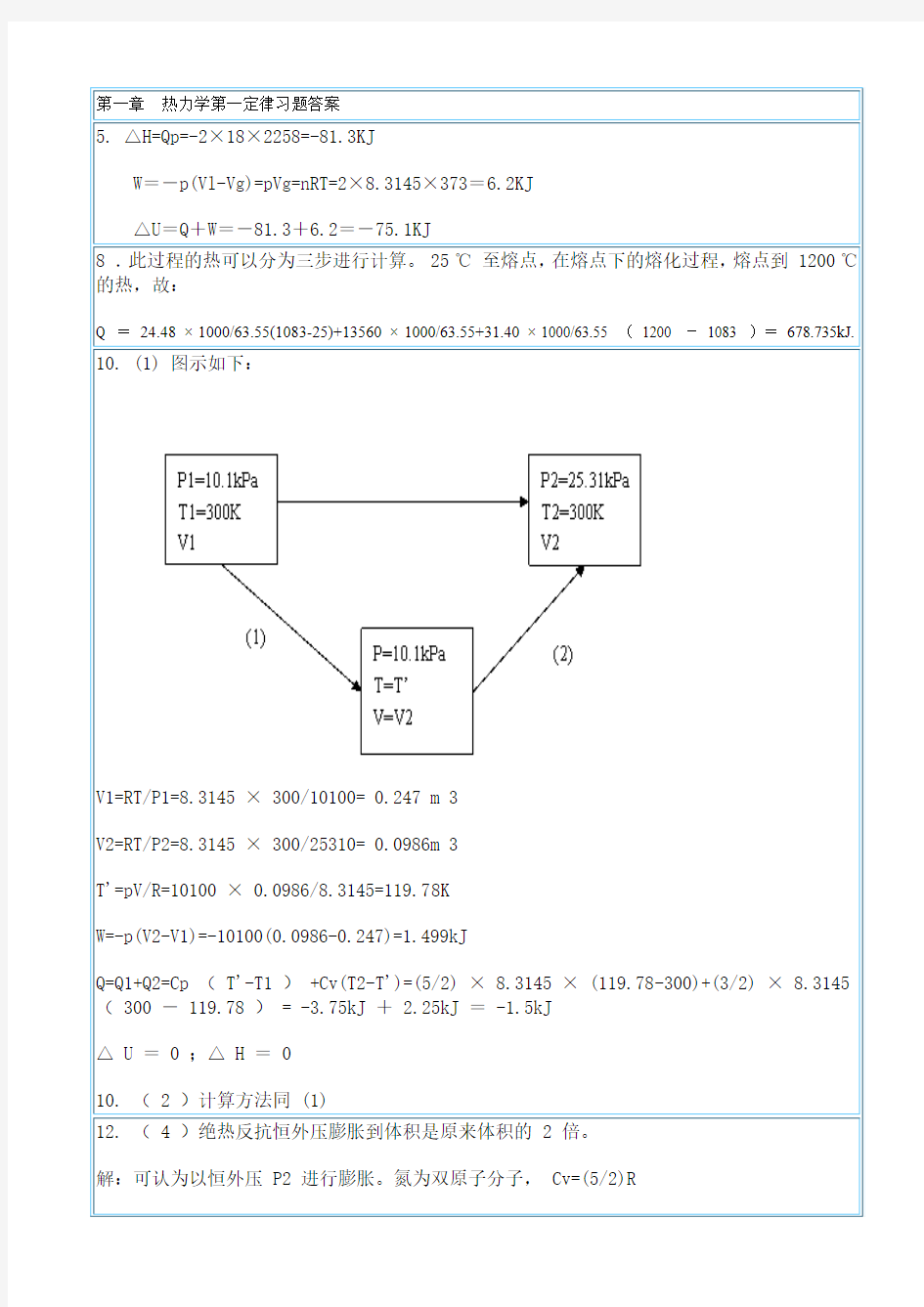
解:ΔS==30.30×=40.20(J·K-1)
3、2.0mol理想气体由5.00MPa、50℃加热至10.00MPa、100℃,试计算该过程的ΔS。已知C p,m=29.10 J·mol-1·K-1。
解:属于pTV都改变的过程。
ΔS=
=8.38-11.53=-3.15(J·K-1)
4、N2从20.0dm3、2.00MPa、474K恒外压1.00MPa绝热膨胀到平衡,试计算过程的ΔS。已知N2可看成理想气体。
解:Q=0; ΔU=W,即nC p,m(T2-T1)=-p e(V2-V1)
将n==10.15(mol); C p,m=3.5R; V2==84.39×10-6T2代入上式
得:10.15×3.5R×(T2-474)=-1.0×106×(84.39×10-6T2-20×10-3)
解得T2=421.3K
该过程属于pTV都改变的过程,所以错错
ΔS=
=-34.81+58.49=23.68(J·K-1)
5、计算下列各物质在不同状态时熵的差值。
(1)1.00g水(273K,101325Pa)与1.00g冰(273K,101325Pa)。已知冰的熔化焓为335J/g。
(2)1.00mol水蒸气(373K,101325Pa)与1.00mol水(373K,101325Pa)。已知水的蒸发焓为2258J/g。(3)1.00mol水(373K,0.10MPa)与1.00mol水(298K,0.10MPa)。已知水的质量热容为4.184J/(gK)。(4)1.00mol水蒸气(373K,0.10MPa)与1.00mol水蒸气(373K,1.00MPa)。假定水蒸气看作理想气体。解:(1)可逆相变;ΔS=Qr/T=335/273=1.23 (J·K-1)
(2)可逆相变;ΔS=Qr/T=2258/373=6.05 (J·K-1)
(3)等压加热;ΔS=ΔS==4.184×18×=16.91(J·K-1)
(4)等温膨胀;ΔS====19.14(J·K-1)
6、将1.00g、273K的冰加入到10.0g沸腾的水中,求最后温度及此过程的ΔS。已知冰的质量熔化焓是335J/g,水的质量热容是4.184J/(gK)。
解:1.0×335+1.0×4.184×(T-273)=10.0×4.184×(373-T) ;T=357K
ΔS==1.23+1.12-1.83=0.52(J·K-1)
7、铁制铸件质量为75g,温度为700K,浸入293K的300g油中。已知铁制铸件的质量热容C p=0.502J·K-1·g-1, 油的质量热容C p=2.51J·K-1·g-1,设无热量传给环境,求铸件、油及整个隔离系统的熵变。
解:75×0.502×(700-T)=300×2.51×(T-293) ; T=312.4K
ΔS(铸件)= 75×0.502×=-30.38(J·K-1)
ΔS(油)=300×2.51×=48.28(J·K-1)
ΔS(隔离)=-30.38+48.28=17.9(J·K-1) (若T=312K,结果与答案一致)
8、利用热力学数据表求反应
(1)FeO(s)+CO(g)==CO2(g)+Fe(s)的=?
(2)CH4(g)+2O2(g)==CO2(g)+2H2O(l) 的=?
解:(1)查表FeO(s) + CO(g)== CO2(g) + Fe(s)
53.97 197.9 213.64 27.15 J·mol-1·K-1
=213.64+27.15-197.9-53.97=-11.08( J·K-1·mol-1)
(2)查表CH4(g) + 2O2(g) == CO2(g) + 2H2O(l)
186.19 205.02 213.64 69.96 J·mol-1·K-1
=213.64+2×69.96-186.19-2×205.02=-242.67( J·K-1·mol-1)
9、某车床刀具需进行高温回火,加热到833K,求刀具在此温度下的熵值。(刀具以铁制品计算,C p,m=30.30 (J·mol-1·K-1)。
解:(Fe,298K)=27.15 J·mol-1·K-1
(Fe,833K)=27.15+30.30×=58.30(J·mol-1·K-1)
10、证明
(1);
(2)
(3)已知等压下,某化学反应的与T无关,试证明该反应的亦与T无关。
证:(1)dU=TdS-pdV ,恒温下,两边同除dV,得
,带入麦克斯威关系式: ,得证。
(2)
(3)根据基尔霍夫公式:
=0 ,所以
=0
11、1.00mol 理想气体,在298K 时,经
(1)等温可逆膨胀,体积从24.4dm 3变为244dm 3;
(2)克服恒定的外压10.1kPa 从24.4dm 3等温膨胀到244dm 3,求两过程的ΔS 、ΔG 、ΔA; (3)判断上述两过程的方向和限度以什么函数为判据较方便,试加以说明。
解:(1)ΔS===1.0×8.314×ln10=19.14(J ·K -1) ΔG=ΔA=-T ΔS=-298×19.14=-570.4(J) (2)始终态相同,结果不变。 (3)分别以ΔS (ΔS 环=0)、ΔG 判断较为方便。
12、1.00mol 氧在30℃下从0.10MPa 等温可逆压缩至0.50MPa ,求W 、ΔU 、ΔH 、ΔA 、ΔG 。假定氧为理想气体。
解:ΔU=ΔH=0
W==1.0×8.314×303×ln5=4054(J) ΔA=ΔG= -T ΔS= -Q=W=4054(J)
13、1.00molH 2(假定为理想气体)由100℃、404kPa 膨胀到25℃、101kPa ,求ΔU 、ΔH 、ΔA 、ΔG 。 解:设计可逆过程:先等压可逆降温,再等温可逆膨胀:
100℃、404kPa 25℃、404kPa 25℃、101kPa
ΔU=ΔU 1=1.0×2.5R ×(25-100)=-1559(J) ΔH=ΔH 1=1.0×3.5R ×(25-100)=-2182(J)
25℃时,H 2的熵值为130.6 J ·mol -1·K -1,100℃时,H 2的熵值为
S(373K)= S(298K)+1.00×3.5R ×298373
ln
=130.6 +6.5=137.1( J ·mol -1·K -1) ΔA 1=ΔU-Δ(TS)=-1559-(298×130.6-373×137.1)=10661(J) ΔG 1=ΔH-Δ(TS)=-2182-(298×130.6-373×137.1)=10038(J) ΔA 2=ΔG 2=-T ΔS 2=-1.00×R ×298×101
404
ln
=-3435(J) ΔA=10661-3435=7226(J) ΔG=10038-3435=6603(J)
14、1000g 的铜在其熔点1083℃101325Pa 下变为液体,温度、压力不变,求ΔH 、Q 、ΔS 、ΔG 。已知Δfus H m (Cu)=13560J/mol 。 解:ΔG=0
ΔH=Q=×Δfus H m =15.6×13560=211875J/mol ΔS=ΔH/T=211875/1356=156( J ·K -1)
15、1.00mol 的水在100℃、101325Pa 下蒸发为水蒸气,求ΔS 、ΔA 、ΔG 。已知水的蒸发焓为2258J/g 。水蒸气看作理想气体,液体水的体积可以忽略。
解:ΔG=0
ΔH=Q=18×2258=40644(J) ;ΔS=ΔH/T=40644/373=109( J·K-1)
ΔA=ΔU-TΔS=W=-pV=-nRT=-373R=-3101(J)
16、1.00mol的水在100℃、101325Pa下蒸发为水蒸气并等温可逆膨胀至50dm3求W和ΔG。
解:W1=-pV=-nRT=-373R=-3101(J);ΔG1=0
ΔG2=W2=1.00×R×373×=-1523(J)
W=-3101-1523=-4624J; ΔG=-1523J
17、求1.00mol水在100℃、202kPa下变为同温同压的水蒸气之过程的ΔS、ΔU、ΔH、ΔA、ΔG。已知水在100℃、101325Pa下的Δvap H m=40.64kJ/mol。
解:设计可逆过程:
100℃、202kPa,水100℃、202kPa,汽
(1) (3)
100℃、101kPa,水(2) 100℃、101kPa,汽
(1)液态变压过程,状态函数改变量可忽略不计;
(2) 可逆相变,ΔG2=0;
ΔH2=40644(J) ;ΔS2=ΔH2/T=40644/373=109( J·K-1)
W2=-pV=-nRT=-373R=-3101(J);ΔU2=ΔH2+W2=40644-3101=37543(J)
ΔA2=ΔU2-TΔS2=W2=-3101(J)
(3)等温压缩,ΔH3=ΔU3=0
ΔS3=1.00×R×=-5.76( J·K-1)
W3=1.00×R×373×=-2148(J)
ΔA3=ΔG3= W3=-2148(J)
ΔS=109-5.76=103.2( J·K-1);ΔU=37543(J);ΔH2=40644(J);ΔA=-3101-2148=-5249(J);ΔG=-2148(J)
18、利用附录物质的标准摩尔生成焓和标准摩尔熵求下列反应的ΔG(298K)。
(1) 3Fe2O3(s)+CO(g)==2Fe3O4(s)+CO2(g)
(2) C2H4(g)+3O2(g)==2CO2(g)+2H2O(g)
解:(1) 3Fe2O3(s) + CO(g) == 2Fe3O4(s) + CO2(g)
-822.2 -110.5 -1117 -393.5
90 198 146.4 213.6
=2×(-1117)-393.5+3×822.2+110.5=-50.4( kJ·mol-1)
=2×(146.4)+213.6-3×90-198=38.4( J·mol-1·K-1)
=-50.4-298×38.4/1000=-61.84( kJ·mol-1)
(2) C2H4(g) + 3O2(g) == 2CO2(g) + 2H2O(g)
52.3 0 -393.5 -241.8
219.4 205 213.6 188.7
=2×(-241.8)+ 2×(-393.5)-52.3=-1322.9( kJ·mol-1)
=2×188.7+2×213.6-3×205-219.4=-29.8( J·mol-1·K-1)
=-1322.9-298×(-29.8)/1000=-1314( kJ·mol-1)
19、已知渗碳反应
3Fe(g)+2CO(g)==Fe3C(s)+CO2(g)的ΔH(1000K)= -154.4kJ·mol-1;
ΔS(1000K)=-152.6J·mol-1·K-1
试求ΔG(1000K)= ?
解:ΔG(1000K)=-154.4-1000×(-152.6)/1000=-1.8( kJ·mol-1)
20、混合理想气体组分B的化学势可用μB=μ+RTln(p B/p)表示。这里,μ是组分B的标准化学势,p B 是其分压。(1)求在恒温、恒压下混合这些组份气体成理想混合气体的热力学能、焓、熵、吉布斯函数及体积变化;(2)求理想混合气体的状态方程。
解:混合前各气体的压力为p,混合后总压仍为p,分压为X B p
(1)ΔG=()后-()前
=[]-[]
=
由[]p=-ΔS,得ΔS=-
ΔH=ΔG+TΔS=0
ΔU=ΔH-Δ(pV)= ΔH-nRT=0
ΔV=[]T=0
(2) 因为μB=μ+RTln(p B/p),所以n BμB=n Bμ+n B RTln(p B/p),即
G B=+ n B RTln(p B/p),T恒定下两边对p求导,得
=V B=n B RT/p B,即p B V B=n B RT
第三章 化学平衡
1、 气相反应:2SO 3(g)=2SO 2(g)+O 2(g)在1000K 时的平衡常数=3.54×103,求该反应的(1000K)和
(1000K)。 解答略。
2、氧化钴(CoO)能被氢或CO 还原为Co ,在721℃、101325Pa 时,以H 2还原,测得平衡气相中H 2的体积
分数
=0.025;以CO 还原,测得平衡气相中CO 的体积分数
=0.0192。求此温度下反应
CO(g)+H 2O(g)=CO 2(g)+H 2(g) 的平衡常数。 解:CoO(s) + H 2(g) = Co(s) + H 2O (1)
0.025
(1-0.025)
CoO(s) + CO(g) = Co(s) + CO 2 (2)
0.0192
(1-0.0192)
(2)-(1)= CO(g)+H 2O(g)=CO 2(g)+H 2(g) ,所以
=51/39=1.31
3、计算加热纯Ag 2O 开始分解的温度和分解温度。(1)在101325Pa 的纯氧中;(2)在101325Pa 且=0.21
的空气中。已知反应2Ag 2O(s)=4Ag(s)+O 2(g)的=(58576-122T/K)J ·mol -1。
解:分解温度即标态下分解的温度。令
=(58576-122T/K)<0,得T >480K
开始分解温度即非标态下分解的温度。令=(58576-122T/K)+8.314×Tln0.21<0,得T >434K
4、已知Ag 2O 及ZnO 在温度1000K 时的分解压分别为240及15.7kPa 。问在此温度下(1)哪一种氧化物容易分解?(2)若把纯Zn 及纯Ag 置于大气中是否都易被氧化?(3)若把纯Zn 、Ag 、ZnO 、Ag 2O 放在一起,反应如何进行?(4)反应ZnO(s)+2Ag(s)=Zn(s)+Ag 2O(s)的=242.09kJ ·mol -1,问增加温度时,有利于那种氧化物的分解? 解:(1)氧化银易分解;(2)银不易被氧化;(3)Zn + Ag 2O = Ag + ZnO ;(4)ZnO
5、已知下列反应的
-T 关系为:
Si(s)+O 2(g)=SiO 2(s);
=(-8.715×105+181.09T /K)J ·mol -1
2C(s)+O 2(g)=2CO(g); =(-2.234×105-175.41T /K)J ·mol -1
试通过计算判断在1300K 时,100kPa 下,硅能否使CO 还原为C ?硅使CO 还原的反应为:
Si(s)+2CO(g)=SiO 2(s)+2C(s)
解:(1)-(2)=(3),则
=(-6.481×105+356.5T /K)J ·mol -1
1300K 时,
=(-6.481×105+356.5×1300)=-1.847×105J ·mol -1<0,可以
6、将含水蒸气和氢气的体积分数分别为0.97和0.03的气体混合物加热到1000K ,这个平衡气体混合物能否与镍反应生成氧化物?已知
Ni(s)+0.5O2=NiO(s); θ
m r G ?=-146.11 kJ ·mol -1
H 2(g)+0.5O 2(g)=H 2O(g); θ
m r G ?=-191.08 kJ ·mol -1
解:(1)-(2)得 Ni(s)+ H 2O(g)= NiO(s)+ H 2(g)
=-146.11+191.08 =44.97kJ ·mol -1
m r G ?=θ
m
r G ?+RT ln J =44970+8.314×1000×ln (0.03/0.97)=16.07 kJ ·mol -1 反应不能正向进行。
7、已知反应 PbS(s)+1.5O 2(g)=PbO(s,红)+SO 2(g),试计算在762K 下的平衡常数,并证明此温度下反应可进行得很完全(可作近似计算)。
解:查表得 PbS(s) + 1.5O 2(g) = PbO(s,红) + SO 2(g)
-94.3 0 -218.99 -296.9 kJ ·mol -1
91.2 205.02 67.8 248.53 J ·K -1·mol -1
= -296.9-218.99+94.3= -421.59( kJ ·mol -1)
= 248.53+67.8-91.2-1.5×205.02= -82.4 (J ·K -1·mol -1)
= -421590+762×82.4= -358801( J ·mol -1)
ln =358801/(8.314×762)=56.63 ; =3.95×1024 ;数值很大,应可进行得很完全。
8、通过计算说明磁铁矿(Fe 3O 4)和赤铁矿(Fe 2O 3)在25℃的空气中哪个更稳定? 解:查表可知,磁铁矿(Fe 3O 4)和赤铁矿(Fe 2O 3)的
分别为-1014.2和-740.99 kJ ·mol -1
9、试用标准摩尔熵法计算25℃时制氢反应CO(g)+H 2O(g)=CO 2(g)+H 2(g)的、
。
解:查表得 CO(g) + H 2O(g) = CO 2(g) + H 2(g)
-110.54 -241.84 -393.5 0 kJ ·mol -1
197.9 188.74 213.64 130.58 J ·K -1·mol -1
= -393.5+110.54+241.84= -41.12( kJ ·mol -1)
= 130.58+213.64-197.9-188.74= -42.42 (J ·K -1·mol -1)
= -41120+298×42.42= -28479( J ·mol -1)
ln =28479/(8.314×298)=11.49 ;
=9.82×104
10、设上题的、与温度无关,计算200℃时的。和前提结果比较,那个温度更有利于
CO 的转化?工业上实际的温度在200-400℃,这是为什么?
解:= -41120+473×42.42= -21055( J ·mol -1);可见,从热力学上考虑低温有利于反应。 但从动力学上考虑,温度高有利于反应。
11、试用标准生成吉布斯函数法求在25℃时反应3Fe(s)+2CO(g)=Fe 3C(s)+CO 2(g)的、
。
解:查表得 3Fe(s) + 2CO(g) = Fe 3C(s) + CO 2(g)
0 -137.28 14.64 -394.38 kJ ·mol -1
= -394.38+14.64+2×137.28= -105.21 kJ·mol-1
ln=105210/(8.314×298)=42.46 ;=2.77×1018
12、为除去氮气中的杂质氧气,将氮气在101325Pa下通过600℃的铜粉进行脱氧,反应为:2Cu(s)+0.5O2=Cu2O(s),若气流缓慢通过可使反应达到平衡,求经过纯化后在氮气中残余氧的体积分数。
已知298K的(Cu2O)=-166.5 kJ·mol-1, (Cu2O)=93.7,(Cu)=33.5, (O2)=205 J·K-1·mol-1,反应的=2.09 J·K-1·mol-1并假定不随温度变化。
解:(298K)=-166.5 kJ·mol-1, =93.7-2×33.5-0.5×205=-75.8 J·K-1·mol-1
(873K)= (298K)+= -166500+2.09×(873-298)=-165298 J·mol-1
(873K)= (298K)+=-75.8+2.09×ln(873/298)=-73.55 J·K-1·mol-1
(873K)=-165298+873×73.55=-101089 J·mol-1
ln=101089/(8.314×873)=13.93 ;=1.119×106=101325/p
p=0.09055(pa) ; φ(O2)=0.0906/101325=8.93×10-7 书上答案似有问题。
13、已知反应H2(g)+0.5O2(g)=H2O(g)的(298K)=-228.6 kJ·mol-1,又知(H2O,l,298K)= -237 kJ·mol-1,求水在25℃时的饱和蒸气压(可将水蒸气视为理想气体)。
解:H2O(l)= H2O(g)
=-228.6+237=8.4 kJ·mol-1
ln=-8400/(8.314×298)=-3.39 ;=0.03369= p/101325 ;p =3414(pa)
14、已知反应Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)的如下:
t/℃100 250 1000
1100 100 0.0721
在1120℃时反应2CO2=2CO+O2的=1.4×10-12,今将Fe2O3(s)置于1120℃的容器内,问容器内氧的分压应该维持多大才可防止Fe2O3还原成铁?
解:此题的关键是求出反应:2Fe2O3 = 4Fe + 3O2的K 即可.可以用反应相加减的方法由另外的反应得到。而反应的△H可由所给数据利用Vant Hoff公式求出。
15、设物质A按下列反应分解成B和C:3A=B+C,A、B、C均为理想气体。在压力为101325Pa,温度为300K时测得有40%解离,在等压下将温度升高10K,结果A解离41%,试求反应焓变。
解:设开始时A物质的量为1mol
3A = B + C
平衡时各物质的mol数为1-0.4 0.4/3 0.4/3 总mol数为2.6/3
平衡时各物质的分压为
;同理求得=0.07851
,解得=7415(J·mol-1)
与书上答案稍有差别。
16、已知ZnO(s)+CO(g)=Zn(s)+CO2(g)为用蒸汽法炼锌的主要反应,并知反应的为:
={199.85×103+7.322T/K·[ln(T/K)]+5.90×10-3(T/K)2-27.195×10-7(T/K)3-179.8T/K}J·mol-1
求(1)1600K时的平衡常数;
(2)如压力保持在101325Pa的条件下进行上述反应,求平衡时气体的组成。
解:(1)=199.85×103+7.322×1600·ln1600+5.90×10-3×(1600)2-27.195×10-7×(1600)3-179.8×1600 = 2566.8 J·mol-1
= 0.825
(2)== 0.825;解得p(CO) = 55.55kPaθ
17、425℃时,HI的离解度(达平衡时分解的百分数)是0.213,(1)问该温度下HI离解反应的平衡常数为多少?(2)2.00mol碘和3.00mol氢在此温度下反应,生成多少HI?
18、银可能受到H2S(g)的腐蚀而发生下面的反应:H2S(g)+2Ag(s)=Ag2S(s)+H2(g),在25℃及101325Pa下,将Ag放在等体积的氢和硫化氢组成的混合气体中,问(1)是否可能发生腐蚀而生成硫化银?(2)在混合气体中硫化氢的体积分数低于多少才不致发生腐蚀?已知25℃时Ag2S(s)和H2S(g)的标准摩尔生成吉布斯函数分别为-40.25和-32.90 kJ·mol-1。
解:=-40.25+32.90= -7.35 kJ·mol-1
(1)=+RT ln Q==-7.35 kJ·mol-1;可以腐蚀。
(2)设硫化氢的体积分数为x,则
=-7350+8.314×298×ln>0
解得x=0.049=4.9%
19、已知下列热力学数据金刚石石墨
(298K)/ kJ·mol-1-395.3 -393.4
(298K)/ J·K-1·mol-1 2.43 5.69
密度ρ/kg·dm-3 3.513 2.260
求(1)在298K时,由石墨转化为金刚石的标准摩尔反应吉布斯函数。(2)根据热力学计算说明单凭加热得不到金刚石,而加压则可以的道理(假定密度和熵不遂温度和压力变化)。(3)298K时石墨转化为金刚石的平衡压力。
解:(1)= -393.5+395.3= -1.9(kJ·mol-1)
= 2.43-5.69= -3.26 (J·K-1·mol-1)
= 1900+298×3.26= 2871( J·mol-1)
= -1.896×10-6(m3·mol-1)
(2)=-
恒压下两边对T求导,得
=3.26
可见,随温度升高增大,即单凭加热不会转变。
恒温下两边对p求导,得
=-1.896×10-6
可见,随压力升高减小,压力足够大时变为负值,可以转变。
(3)对上式进行积分
令(p)=2871-1.896×10-6 (p-pθ)<0
解得p=1.51×109(Pa)
20、(1)某铁矿含钛,以TiO2形式存在,试求用碳直接还原TiO2的最低温度。若高炉内的温度为1700℃,TiO2能否被还原?(2)若钛矿为FeTiO3(s),试求用碳直接还原的最低温度。在上述高炉中FeTiO3(s)能否被还原?
已知Ti(s)+1.5O2(g)+Fe(s)=FeTiO3(s)的(T)=(-12.37×105+219T/K) J·mol-1
Fe(s)=Fe(l)的(T)=(1.55×104-8.5T/K) J·mol-1
答:(1)T=1976K>1973K不能;(2)T=1873K<1973K能。
第四章液态混合物和溶液
1、25℃时,w B=0.0947的硫酸水溶液,密度为1.0603g/cm-3,求硫酸的摩尔分数,质量摩尔浓度和物质的量浓度以及质量浓度。
解:1L 溶液中,硫酸的质量为1000×1.0603×0.0947=100.4g,n B=100.4/98=1.025mol
水的质量为1000×1.0603×(1-0.0947)=959.89g,n A=959.89/18=53.33mol x B=1.025/(1.025+53.33)=0.01885;m B=1.025×1000/959.89=1.068mol/kg;
c B=1.025mol/L;ρB=100.4g/L
2、25℃时水的蒸气压为3.17kPa,若一甘油水溶液中甘油的质量分数w=0.0100,问溶液的蒸气压为多少?(甘油即丙三醇,摩尔质量为93.1g/mol,是不挥发性溶质)。
解:=0.998;p=3.17×0.998=3.16kPa
3、20℃时乙醚的蒸气压为59.00kPa,今有100.0g乙醚中溶入某挥发性有机物质10.0g,蒸汽压下降到56.80kPa,试求该有机物的摩尔质量。
解:
4、0℃时,101325Pa的氧气在水中的溶解度为344.90cm3,同温下,101325Pa的氮气在水中的溶解度为23.50cm3,求0℃时与常压空气呈平衡的水中所溶解的氧气和氮气的摩尔比。
解:k(O2)=101325/344.9;k(N2)=101325/23.5
c(O2)=0.21×101325/k(O2)=72.43 cm3;c(N2)=0.78×101325/k(N2)=18.33 cm3
显然二者之比为3.95
5、40℃时苯及二氯乙烷的蒸气压分别为24.33及20.66kPa,求40℃时与x(苯)=0.250的苯-二氯乙烷溶液呈平衡的蒸气组成及苯的分压。设系统可视为理想液态混合物。
解:p=p1+p2=24.33×0.25+20.66×0.75=21.58kPa;y1=24.33×0.25/21.58=0.282
P2=20.66×0.75=15.50
6、100℃时,己烷的蒸气压是2.45×105Pa,辛烷的是4.72×104Pa,这两种液体的某一混合物的正常沸点是100℃,求(1)己烷在液体里的摩尔分数;(2)蒸气里己烷的摩尔分数。(假定系统可作为理想液态混合物)
解:p=2.45×105x(己)+ 4.72×104 (1-x)=101325,解得x(己)=0.2736
Y(己)= 2.45×105×0.2736/101325=0.6616
7、已知纯Zn、Pb、Cd的蒸气压与温度的关系如下:
设粗锌中含有Pb和Cd的摩尔分数分别为0.0097和0.013。求在950℃,粗锌蒸馏时最初蒸馏产物中Pb 和Cd的质量分数。设系统可视为理想液态混合物。
解:求最初蒸馏产物中Pb和Cd的质量分数即求平衡气象组成。
将1223K代入前三式,求得p*(Zn)=156190Pa,p*(Pb)=80.76Pa,p*(Cd)=492072Pa
P(Pb)=80.76×0.0097=0.78Pa,
p(Cd)= 492072×0.013=6397Pa,
p(Zn)=156190×(1-0.0097-0.013)=152644Pa
y(Pb)=0.78/(0.78+6397+152644)=4.9×10-6
y(Cd)=6397/(0.78+6397+152644)=0.0402
与书上答案稍有差别。
8、计算含Pb和Sn质量分数各为0.5的焊锡在1200℃时的蒸气压及此合金的正常沸点。已知
解:将1473K代入前二式,求得p*(Pb)=2132Pa,p*(Sn)=1.48Pa
X(Pb)==0.365
P=2132×0.365+1.48×0.635=779(Pa)
×0.365+×0.635=101325
试解法求得T=2223K
9、已知AgCl-PbCl2在800℃时可作为理想液态混合物,求300g PbCl2和150g AgCl混合成混合物时系统的摩尔熵变和摩尔吉布斯函数变以及AgCl和PbCl2在混合物中的相对偏摩尔吉布斯函数。
10、在1073℃时曾测定了氧在100g液态Ag中的溶解度数据如下:
p(O2)/Pa 17.06 65.05 101.31 160.36
V(O2标况下) /cm3 81.5 156.9 193.6 247.8
(1)试判断,氧在Ag中溶解是否遵守西弗特定律;
(2)在常压空气中将100g Ag加热至1073℃,最多能从空气中吸收多少氧?
解:(1)若基本为常数,则遵守西弗特定律
=81.5/(17.06/101325)0.5=6281;同理=6192;=6123;=6229。尊守
平均值为=(6281+6192+6123+6229)/4=6206
(2)V=×0.210.5=2844(cm3)
11、利用表4-7计算与空气平衡的1600℃铁液中溶解的氮与氧之比(分子比)。
解:=1.079×104+20.89×1873=49917
[N%]=0.0405×0.780.5=0.036
=-1.1715×105-3×1873=-122769
[O%]=2654×0.210.5=1216(结果合理吗?!)
溶解的氮与氧之比(分子比)==3.38×10-5
12、纯金的结晶温度等于1335.5K。金从含Pb的质量分数0.055的Au-Pb溶液中开始结晶的温度等于1272.5K。求金的熔化焓。
解:x(Pb)==0.05248
=11770(J·mol-1)
13、Pb的熔点为327.3℃,熔化焓为5.12kJ/mol。
(1)求Pb的摩尔凝固点下降常数K f。
(2)100g Pb中含1.08g Ag的溶液,其凝固点为315℃,判断Ag在Pb中是否以单原子形式存在。
解:(1)K f=8.314×600.32×207/5120=121129(K·g·mol-1)
(2)m(Ag)=0.1mol/kg
K f=(327.3-315)/0.1=123(K·kg·mol-1),与(1)相同,是以单原子形式存在
14、在50.0g CCl4中溶入0.5126g萘(M=128.16g/mol),测得沸点升高0.402K,若在等量溶剂中溶入0.6216g 某未知物,测得沸点升高0.647K,求此未知物的摩尔质量。
解:K b=0.402/()=5.025
0.647=5.025×,解得M=96.55(g·mol-1)
15、25℃时某有机酸在水和醚中的分配系数为0.4。
(1)若100cm3水中含有机酸5g,用60cm3的醚一次倒入含酸水中,留在水中的有机酸最少有几克?(2)若每次用20cm3醚倒入含酸水中,连续抽取三次,最后水中剩有几克有机酸?
解:(1)设留在水中的有机酸为xg,则
,解得x=2
(2) 类似计算连算三次,可求得留在水中的有机酸为1.48g
16、钢液中存在如下反应:[C] + [O] = CO(g)
已知CO2(g)+[C]=2CO(g) ; =1.3933×105-127.3T/K J/mol
CO(g)+[O]=CO2(g) ; =-1.6192×105+87.3T/K J/mol
(浓度[%B]=1又服从理想稀溶液定律的假想状态为标准态)。试求:
(1)1600℃时的平衡常数;
(2)当1600℃,p(CO)=101325Pa时,[%C]=0.02的钢液中氧的平衡含量[%O]
解:(1)(1)+(2)=所求
=[1.3933×105-127.3×1873]+[ -1.6192×105+87.3×1873]= -97510J/mol
ln=97510/(8.314×1873)=6.2618 ;=524
(2),解得[O%]=0.095
17、由丙酮(1)和甲醇(2)组成溶液,在101325Pa下测得下列数据:x1=0.400,y1=0.516,沸点为57.20℃,已知该温度下p1*=104.8kPa,p2*=73.5kPa。以纯液态为标准态,应用拉乌尔定律分别求溶液中丙酮及甲醇的活度因子及活度。
解:p1=101325×0.516=104800a1,a1=0.4989
p2=101325×(1-0.516)=73500a2,a2=0.6672
a1=0.4989=0.400f1,f1=1.247
a2=0.6672=(1-0.516)f2,f2=1.379
18、液态锌的蒸气压与温度的关系为
实验测出含锌原子分数为0.3的Cu-Zn合金熔体800℃时的蒸气压是2.93kPa,求此时锌的活度因子,指出所用的标准态。
解:1073K时,p*=30845
2930=30845a,a=0.095,0.095=0.3f,f=0.317
所用的标准态为800℃时的纯液态锌。
试按不同惯例计算x B =0.385溶液的γB。
解:(1)以纯液态为标准态
75130×0.400=98900×0.385γB,γB=0.789
(2)以[B%]=1且符合亨利定律的状态为标准态
80390×0.091=k×0.118,k=61996
75130×0.400=61996×0.385γ’B,γ’B=1.259
20、Fe-C溶液中碳的活度因子与碳的组成有如下关系:γC=(以x C=1的假想状态为标准态)。求在101325Pa、1873K时与含CO和CO2的体积分数分别为0.80和0.20的气相平衡的Fe-C溶液中碳的质量分数。反应[C]+CO2=2CO在给定温度下的平衡常数=1.19×103。
解:=1.19×103,a c=2.69×10-3
a c=2.69×10-3=γC x C=x C,解得x C=2.65×10-3
又x C=2.65×10-3=,[C%]=0.0568
第四章液态混合物和溶液
1、25℃时,w B=0.0947的硫酸水溶液,密度为1.0603g/cm-3,求硫酸的摩尔分数,质量摩尔浓度和物质的量浓度以及质量浓度。
解:1L 溶液中,硫酸的质量为1000×1.0603×0.0947=100.4g,n B=100.4/98=1.025mol
水的质量为1000×1.0603×(1-0.0947)=959.89g,n A=959.89/18=53.33mol x B=1.025/(1.025+53.33)=0.01885;m B=1.025×1000/959.89=1.068mol/kg;
c B=1.025mol/L;ρB=100.4g/L
2、25℃时水的蒸气压为3.17kPa,若一甘油水溶液中甘油的质量分数w=0.0100,问溶液的蒸气压为多少?(甘油即丙三醇,摩尔质量为93.1g/mol,是不挥发性溶质)。
解:=0.998;p=3.17×0.998=3.16kPa
3、20℃时乙醚的蒸气压为59.00kPa,今有100.0g乙醚中溶入某挥发性有机物质10.0g,蒸汽压下降到56.80kPa,试求该有机物的摩尔质量。
解:
4、0℃时,101325Pa的氧气在水中的溶解度为344.90cm3,同温下,101325Pa的氮气在水中的溶解度为23.50cm3,求0℃时与常压空气呈平衡的水中所溶解的氧气和氮气的摩尔比。
解:k(O2)=101325/344.9;k(N2)=101325/23.5
c(O2)=0.21×101325/k(O2)=72.43 cm3;c(N2)=0.78×101325/k(N2)=18.33 cm3
显然二者之比为3.95
5、40℃时苯及二氯乙烷的蒸气压分别为24.33及20.66kPa,求40℃时与x(苯)=0.250的苯-二氯乙烷溶液呈平衡的蒸气组成及苯的分压。设系统可视为理想液态混合物。
解:p=p1+p2=24.33×0.25+20.66×0.75=21.58kPa;y1=24.33×0.25/21.58=0.282
P2=20.66×0.75=15.50
6、100℃时,己烷的蒸气压是2.45×105Pa,辛烷的是4.72×104Pa,这两种液体的某一混合物的正常沸点是100℃,求(1)己烷在液体里的摩尔分数;(2)蒸气里己烷的摩尔分数。(假定系统可作为理想液态混合物)
解:p=2.45×105x(己)+ 4.72×104 (1-x)=101325,解得x(己)=0.2736
Y(己)= 2.45×105×0.2736/101325=0.6616
7、已知纯Zn、Pb、Cd的蒸气压与温度的关系如下:
设粗锌中含有Pb和Cd的摩尔分数分别为0.0097和0.013。求在950℃,粗锌蒸馏时最初蒸馏产物中Pb 和Cd的质量分数。设系统可视为理想液态混合物。
解:求最初蒸馏产物中Pb和Cd的质量分数即求平衡气象组成。
将1223K代入前三式,求得p*(Zn)=156190Pa,p*(Pb)=80.76Pa,p*(Cd)=492072Pa
P(Pb)=80.76×0.0097=0.78Pa,
p(Cd)= 492072×0.013=6397Pa,
p(Zn)=156190×(1-0.0097-0.013)=152644Pa
y(Pb)=0.78/(0.78+6397+152644)=4.9×10-6
y(Cd)=6397/(0.78+6397+152644)=0.0402
与书上答案稍有差别。
8、计算含Pb和Sn质量分数各为0.5的焊锡在1200℃时的蒸气压及此合金的正常沸点。已知
解:将1473K代入前二式,求得p*(Pb)=2132Pa,p*(Sn)=1.48Pa
X(Pb)==0.365
P=2132×0.365+1.48×0.635=779(Pa)
×0.365+×0.635=101325
试解法求得T=2223K
9、已知AgCl-PbCl2在800℃时可作为理想液态混合物,求300g PbCl2和150g AgCl混合成混合物时系统的摩尔熵变和摩尔吉布斯函数变以及AgCl和PbCl2在混合物中的相对偏摩尔吉布斯函数。
10、在1073℃时曾测定了氧在100g液态Ag中的溶解度数据如下:
p(O2)/Pa 17.06 65.05 101.31 160.36
V(O2标况下) /cm3 81.5 156.9 193.6 247.8
(1)试判断,氧在Ag中溶解是否遵守西弗特定律;
(2)在常压空气中将100g Ag加热至1073℃,最多能从空气中吸收多少氧?
解:(1)若基本为常数,则遵守西弗特定律
=81.5/(17.06/101325)0.5=6281;同理=6192;=6123;=6229。尊守
平均值为=(6281+6192+6123+6229)/4=6206
(2)V=×0.210.5=2844(cm3)
11、利用表4-7计算与空气平衡的1600℃铁液中溶解的氮与氧之比(分子比)。
解:=1.079×104+20.89×1873=49917
[N%]=0.0405×0.780.5=0.036
=-1.1715×105-3×1873=-122769
[O%]=2654×0.210.5=1216(结果合理吗?!)
溶解的氮与氧之比(分子比)==3.38×10-5
12、纯金的结晶温度等于1335.5K。金从含Pb的质量分数0.055的Au-Pb溶液中开始结晶的温度等于1272.5K。求金的熔化焓。
解:x(Pb)==0.05248
=11770(J·mol-1)
13、Pb的熔点为327.3℃,熔化焓为5.12kJ/mol。
(1)求Pb的摩尔凝固点下降常数K f。
(2)100g Pb中含1.08g Ag的溶液,其凝固点为315℃,判断Ag在Pb中是否以单原子形式存在。
解:(1)K f=8.314×600.32×207/5120=121129(K·g·mol-1)
(2)m(Ag)=0.1mol/kg
K f=(327.3-315)/0.1=123(K·kg·mol-1),与(1)相同,是以单原子形式存在
14、在50.0g CCl4中溶入0.5126g萘(M=128.16g/mol),测得沸点升高0.402K,若在等量溶剂中溶入0.6216g 某未知物,测得沸点升高0.647K,求此未知物的摩尔质量。
解:K b=0.402/()=5.025
0.647=5.025×,解得M=96.55(g·mol-1)
15、25℃时某有机酸在水和醚中的分配系数为0.4。
(1)若100cm3水中含有机酸5g,用60cm3的醚一次倒入含酸水中,留在水中的有机酸最少有几克?(2)若每次用20cm3醚倒入含酸水中,连续抽取三次,最后水中剩有几克有机酸?
解:(1)设留在水中的有机酸为xg,则
,解得x=2
(2) 类似计算连算三次,可求得留在水中的有机酸为1.48g
16、钢液中存在如下反应:[C] + [O] = CO(g)
已知CO2(g)+[C]=2CO(g) ; =1.3933×105-127.3T/K J/mol
CO(g)+[O]=CO2(g) ; =-1.6192×105+87.3T/K J/mol
(浓度[%B]=1又服从理想稀溶液定律的假想状态为标准态)。试求:
(1)1600℃时的平衡常数;
(2)当1600℃,p(CO)=101325Pa时,[%C]=0.02的钢液中氧的平衡含量[%O]
解:(1)(1)+(2)=所求
=[1.3933×105-127.3×1873]+[ -1.6192×105+87.3×1873]= -97510J/mol
ln=97510/(8.314×1873)=6.2618 ;=524
(2),解得[O%]=0.095
17、由丙酮(1)和甲醇(2)组成溶液,在101325Pa下测得下列数据:x1=0.400,y1=0.516,沸点为57.20℃,已知该温度下p1*=104.8kPa,p2*=73.5kPa。以纯液态为标准态,应用拉乌尔定律分别求溶液中丙酮及甲醇的活度因子及活度。
解:p1=101325×0.516=104800a1,a1=0.4989
P2=101325×(1-0.516)=73500a2,a2=0.6672
a1=0.4989=0.400f1,f1=1.247
a2=0.6672=(1-0.516)f2,f2=1.379(书上答案不对)
18、液态锌的蒸气压与温度的关系为
实验测出含锌原子分数为0.3的Cu-Zn合金熔体800℃时的蒸气压是2.93kPa,求此时锌的活度因子,指出所用的标准态。
解:1073K时,p*=30845
2930=30845a,a=0.095,0.095=0.3f,f=0.317
所用的标准态为800℃时的纯液态锌。
试按不同惯例计算x B =0.385溶液的γB。
解:(1)以纯液态为标准态
75130×0.400=98900×0.385γB,γB=0.789
(2)以[B%]=1且符合亨利定律的状态为标准态
80390×0.091=k×0.118,k=61996
75130×0.400=61996×0.385γ’B,γ’B=1.259
20、Fe-C溶液中碳的活度因子与碳的组成有如下关系:γC=(以x C=1的假想状态为标准态)。求在101325Pa、1873K时与含CO和CO2的体积分数分别为0.80和0.20的气相平衡的Fe-C溶液中碳的质量分数。反应[C]+CO2=2CO在给定温度下的平衡常数=1.19×103。
解:=1.19×103,a c=2.69×10-3
a c=2.69×10-3=γC x C=x C,解得x C=2.65×10-3
又x C=2.65×10-3=,[C%]=0.0568
物理化学试题之一 一、选择题(每题2分,共50分,将唯一的答案填进括号内) 1. 下列公式中只适用于理想气体的是1 A. ΔU=Q V B. W=nRTln(p 2/p 1)(用到了pv=nRT) C. ΔU=dT C m ,V T T 2 1? D. ΔH=ΔU+p ΔV 2. ΔH 是体系的什么 A. 反应热 B. 吸收的热量 C. 焓的变化 D. 生成热 3. 2000K 时反应CO(g)+1/2O 2(g)=CO 2(g)的K p 为 6.443,则在同温度下反应为2CO 2(g)=2CO(g)+O 2(g)的K p 应为 A. 1/6.443 B. (6.443)1/2 C. (1/6.443)2 D. 1/(6.443)1/2 4. 固态的NH 4HS 放入一抽空的容器中,并达到化学平衡,其组分数、独立组分数、相数及自由度分别是 A. 1,1,1,2 B. 1,1,3,0 C. 3,1,2,1 D. 3,2,2,2 5. 下列各量称做化学势的是 A. i j n ,V ,S i )n ( ≠?μ? B. i j n ,V ,T i )n p (≠?? C. i j n ,p ,T i )n (≠?μ? D. i j n ,V ,S i )n U (≠?? 6. A 和B 能形成理想溶液。已知在100℃时纯液体A 的饱和蒸汽压为133.3kPa, 纯液体B 的饱和蒸汽压为66.7 kPa, 当A 和B 的二元溶液中A 的摩尔分数为0.5时,与溶液平衡的蒸气中A 的摩尔分数是 A. 1 B. 0.75 C. 0.667 D. 0.5 7. 理想气体的真空自由膨胀,哪个函数不变? A. ΔS=0 B. V=0 C. ΔG=0 D. ΔH=0 7. D ( ) 8. A 、B 两组分的气液平衡T-x 图上,有一最低恒沸点,恒沸物组成为x A =0.7。现有一组成为x A =0.5的AB 液体混合物,将其精馏可得到 A. 纯A 和恒沸混合物 B. 纯B 和恒沸混合物 C. 只得恒沸混合物 D. 得纯A 和纯B 8. B
第七章 电化学 7、1 用铂电极电解CuCl 2溶液。通过的电流为20A,经过15min 后,问:(1)在阴极上能析出多少质量的Cu?(2)在的27℃,100kPa 下阳极上能析出多少体积的的Cl 2(g)? 解:电极反应为:阴极:Cu 2+ + 2e - → Cu 阳极: 2Cl - -2e - → Cl 2(g) 则:z= 2 根据:Q = nzF =It ()22015Cu 9.32610mol 296500 It n zF -?= ==?? 因此:m (Cu)=n (Cu)× M (Cu)= 9、326×10-2×63、546 =5、927g 又因为:n (Cu)= n (Cl 2) pV (Cl 2)= n (Cl 2)RT 因此:3223Cl 0.093268.314300Cl 2.326dm 10010 n RT V p ??===?()() 7、2 用Pb(s)电极电解PbNO 3溶液。已知溶液浓度为1g 水中含有PbNO 3 1、66×10-2g 。通电一定时间后,测得与电解池串联的银库仑计中有0、1658g 的银沉积。阳极区的溶液质量为62、50g,其中含有PbNO 31、151g,计算Pb 2+的迁移数。 解法1:解该类问题主要依据电极区的物料守恒(溶液就是电中性的)。显然阳极区溶液中Pb 2+的总量的改变如下: n 电解后(12Pb 2+)= n 电解前(12Pb 2+)+ n 电解(12Pb 2+)- n 迁移(12 Pb 2+) 则:n 迁移(12Pb 2+)= n 电解前(12Pb 2+)+ n 电解(12Pb 2+)- n 电解后(12 Pb 2+) n 电解(1 2Pb 2+)= n 电解(Ag ) = ()()3Ag 0.1658 1.53710mol Ag 107.9 m M -==? 223162.501.1511.6610(Pb ) 6.15010mol 12331.22 n -+--??==??解前()电 2311.151(Pb ) 6.95010mol 12331.22 n +-==??解后电 n 迁移(12 Pb 2+)=6、150×10-3+1、537×10-3-6、950×10-3=7、358×10-4mol () 242321Pb 7.358102Pb 0.4791 1.53710(Pb )2n t n +-+-+?==?移解()=迁电
第八章 电化学 选择题 1.离子独立运动定律适用于 (A) 强电解质溶液 (B) 弱电解质溶液 (C) 无限稀电解质溶液 (D) 理想稀溶液 答案:C 3. 在电导测量实验中, 应该采用的电源是 (A) 直流电源 (B) 交流电源 (C) 直流电源或交流电源 (D) 测固体电导用直流电源, 测溶液电导用交流电源 答案:D 4. CaCl 2摩尔电导率与其离子的摩尔电导率的关系是 (A))()()(22-∞+∞∞Λ+Λ=ΛCl Ca CaCl m m m (B))(2)()(22-∞ + ∞∞Λ+Λ=ΛCl Ca CaCl m m m (C))()(2 1)(22-∞+∞∞Λ+Λ=ΛCl Ca CaCl m m m (D))}()({2 1)(22-∞+∞∞Λ+Λ=ΛCl Ca CaCl m m m 答案:B 5.电池Cu ∣Cu +‖Cu 2+,Cu +∣Pt 和Cu ∣Cu 2+‖Cu +,Cu 2+∣Pt 的反应均可简写作Cu+Cu 2+=2Cu +此电池的 (A) θm r G ?、θE 相同 (B)θm r G ?相同、θE 不同 (C)θm r G ?不同、θE 相同 (D)θm r G ?、θ E 均不同 答案:B 6. 恒温、恒压下可逆电池放电过程 (A) ΔH=Q (B)ΔHQ (D)ΔH 、Q 关系不定 答案:B 7.298K 时,当H 2SO 4溶液的浓度从0.01mol/kg 增加到0.1mol/kg 时,其电导率κ和摩尔电导率Λm 将 (A) κ减小,Λm 增加 (B) κ增加,Λm 增加 (C) κ减小,Λm 减小 (D) κ增加,Λm 减小 答案:D 8.下列电解质中,离子平均活度系数最大的是 A. 0.01 mol/kg NaCl B. 0.01 mol/kg CaCl 2 C .0.01 mol/kg LaCl 3 D. 0.01 mol/kg CuSO 4 答案:A
期末练习题 1. 当某溶质溶于某溶剂中形成浓度一定的溶液时,若采用不同的标准浓度, 则下列说法中正确的是: ( ) (A) 溶质的标准态化学势相同 (B) 溶质的化学势相同 (C) 溶质的活度系数相同 (D) 溶质的活度相同 2. 在298K 时,设液体A 和B 能形成理想的液态混合物,它们的蒸气形成理想的气态混合物。 已知纯A 和纯B 的饱和蒸汽压分别为kPa p A 50=*,kPa p B 60=* ,如液相中 40.0=A x ,则平衡的气相中B 的摩尔分数B y 的值为 ( ) (A )0.25 (B) 0.40 (C) 0.50 (D) 0.64 3. 在一定温度和压力下,设纯的A(l)的化学势为*μ,其标准态化学势为θμ。如在A 中加入另一液相B(l),形成理想的液态混合物,这时A(l)的化学势为A μ,标准态化学势为θμA ,则两种化学势之间的关系为 ( ) (A )*μ=A μ,θμ=θμA (B )*μ>A μ,θμ<θ μA (C )*μ=A μ θμ>θμA (D )*μ>A μ,θμ=θμA 4. 在298K 时,已知①H 2(g)和②O 2(g)在水中的Henry 系数分别为 91,1012.7?=x k Pa, 92,1044.4?=x k Pa. 在相同的温度和压力下,两者在水中的饱和溶解的量用摩尔分数表示分别为x 1和x 2,两者的关系为 ( ) (A )x 1>x 2 (B) 无法比较 (C) x 1=x 2 (D )x 1<x 2 5. 在恒温抽空的玻璃罩中,封入两杯液面相同的糖水(A )和纯水(B )。经 历若干时间后,两杯液面的高度将是: ( ) (A )A 杯高于B 杯 (B )A 杯等于B 杯 (C )A 杯低于B 杯 (D )视温度而定 6. 物质B 固体在298K 、101.325kPa 下升华,这意味着 ( )
第十章界面现象 10-1 请回答下列问题: (1) 常见的亚稳定状态有哪些?为什么产生亚稳态?如何防止亚稳态的产生? (2) 在一个封闭的钟罩内,有大小不等的两个球形液滴,问长时间放置后,会出现什么现象? (3) 下雨时,液滴落在水面上形成一个大气泡,试说明气泡的形状和理由? (4) 物理吸附与化学吸附最本质的区别是什么? (5) 在一定温度、压力下,为什么物理吸附都是放热过程? 答:(1) 常见的亚稳态有:过饱和蒸汽、过热液体、过冷液体、过饱和溶液。产生这些状态的原因就是新相难以生成,要想防止这些亚稳状态的产生,只需向体系中预先加入新相的种子。 (2) 一断时间后,大液滴会越来越大,小液滴会越来越小,最终大液滴将小液滴“吃掉”,根据开尔文公式,对于半径大于零的小液滴而言,半径愈小,相对应的饱和蒸汽压愈大,反之亦然,所以当大液滴蒸发达到饱和时,小液滴仍未达到饱和,继续蒸发,所以液滴会愈来愈小,而蒸汽会在大液滴上凝结,最终出现“大的愈大,小的愈小”的情况。 (3) 气泡为半球形,因为雨滴在降落的过程中,可以看作是恒温恒压过程,为了达到稳定状态而存在,小气泡就会使表面吉布斯函数处于最低,而此时只有通过减小表面积达到,球形的表面积最小,所以最终呈现为球形。 (4) 最本质区别是分子之间的作用力不同。物理吸附是固体表面分子与气体分子间的作用力为范德华力,而化学吸附是固体表面分子与气体分子的作用力为化学键。 (5) 由于物理吸附过程是自发进行的,所以ΔG<0,而ΔS<0,由ΔG=ΔH-TΔS,得 ΔH<0,即反应为放热反应。
10-2 在293.15K 及101.325kPa 下,把半径为1×10-3m 的汞滴分散成半径为1×10-9m 的汞滴,试求此过程系统表面吉布斯函数变(ΔG )为多少?已知293.15K 时汞的表面张力为0.4865 N ·m -1。 解: 3143r π=N×3243r π N =3 132 r r ΔG =2 1 A A dA γ?= (A 2-A 1)=4·( N 2 2 r -21 r )=4 ·(3 12 r r -21r ) =4× ×(339 (110)110 --??-10-6) =5.9062 J 10-3 计算时373.15K 时,下列情况下弯曲液面承受的附加压力。已知时水的表面张力为58.91×10-3 N ·m -1 (1) 水中存在的半径为0.1μm 的小气泡;kPa (2) 空气中存在的半径为0.1μm 的小液滴; (3) 空气中存在的半径为0.1μm 的小气泡; 解:(1) Δp =2r γ=36 258.91100.110--???=1.178×103 kPa (2) Δp =2r γ =36 258.91100.110--???=1.178×103 kPa (3) Δp =4r γ=36 458.91100.110--???=2.356×103 kPa 10-4 在293.15K 时,将直径为0.1nm 的玻璃毛细管插入乙醇中。问需要在管内加多大的压力才能防止液面上升?若不加压力,平衡后毛细管内液面的高度为多少?已知该温度下乙醇的表面张力为22.3×10-3 N ·m -1,密度为789.4 kg ·m -3,重力加速度为9.8 m ·s -2。设乙醇能很好地润湿玻璃。
OO六一二og 学年第一学期期末考试 物理化学试题A卷 注意:学号、姓名和所在年级班级不写、不写全或写在密封线外者,试卷作废—*.计算题。(本大题6分) 将某电导池盛以0.02 mol dm3 KC l溶液(25C时其电导率为0.277 S m1), 在25C 时测得其电阻为82.4 Q,再换用0.005 mol dm 3K2SO溶液,测得其电阻为326.0 Q。求: (1) 电导池常数K(l/A); (2) KSO溶液的电导率; (3) KSO溶液的摩尔电导率 二. 问答题。请回答下列各题。(本大题4分) 在进行重量分析实验时,为了尽可能使沉淀完全,通常加入大量电解质 (非沉淀剂),或将溶胶适当加热,为什么?试从胶体化学观点加以解释。 三. 计算题。请计算下列各题。(本大题10分) 均相反应2A+B3Y+Z在一定温度体积下进行,测得动力学数据如下: 其中C A,0及C B,0分别表示A及B的初始浓度;A,0表示A的初始消耗速率,即,假定反应速率方程的形式为 (1) 确定分级数,的值和总反应级数; (2) 计算反应的活化能。 四. 计算题。请计算下列各题。(本大题6分) CH 4气相热分解反应2CHGR +H2的反应机理及各元反应的活化能如下:
已知该总反应的动力学方程式为: 试求总反应的表观活化能。 五. 计算题。请计算下列各题。 (本大题8分) 下列电池的电动势在 25C 时为1.448 V : Pt | H 2 ( p ) | HCl ( b=0.1 mol - kg -1, =0.796 ) |Cl < p ) | Pt (1) 写出电极反应和电池反应; (2) 计算氯电极的标准电极电势 E (Cl |Cl 2 |Pt )。 六. 推导题。(本大题6分) 气相反应2A(g) Y(g), 是二级反应,反应开始时只有A ,压力为p”, 试推导反应系统的总压力p 与时间t 的函数关系式。 七. 选择题。在题后括号内,填上正确答案代号。(本大题共 22小题,总计60分) 1、 (3分)在等温等压下影响物质的表面吉布斯函数的因素:( ) (1) 是表面积A; (2)是表面张力 ; (3) 是表面积A 和表面张力 ;(4)没有确定的函数关 系。 2、 (3分)弯曲液面的饱和蒸气压总大于同温度下平液面的蒸气压。是不是 ? 3、 (2分)微小颗粒物质的熔点 与同组成大块物质的熔点 的关系是:( ) (1) ; (2) = ; (3) ; (4)不能确定。 4、 (4分)朗缪尔等温吸附理论的基本假设为: (2) CH CH 3- +H- E I =423 kJ -mol CH + CH4GH +H- 日=201 kJ -mol -+ CH 4 CH 3- +H E 3=29 kJ -mol -+ CH 3- CH 4 E -i =0 kJ -mol (D
第8章 表面和胶体化学 习题解答 1. 若一球形液膜的直径为2×10-3 m ,比表面自由能为0.7 J ·m -2 ,则其所受的附加压力是多少? 解:球形液膜 3440.7 kPa 2.8 kPa 210/2 p r γ-??= ==? 2. 若水在293 K 时的表面力为72.75×10-3 N ·m -1 ,则当把水分散成半径为10-5 m 的小液滴时,曲 面下的附加压力为多少? 解:34 52272.7510 Pa 1.4510 Pa 10 p r γ--???===? 3. 在293 K 时把半径1 mm 的水滴分散成半径为1 μm 的小水滴,问比表面增加了多少倍?表面吉 布斯函数增加了多少?完成该变化时,环境至少需做多少功?已知水的表面力为72.75×10-3 N ·m -1 。 解:设半径1 mm 水滴的表面积为A 1,体积为:V 1,半径为:R 1;半径1 μm 水滴的表面积为A 2,体积为:V 2,半径为:R 2;N 为小水滴的个数。 33 1212 44 , 33 V NV R N R ππ== 3 3 912 1 mm 101 μm R N R ????=== ? ????? 2 2 922211 4 1 μm 1010004 1 mm A N R A R ππ???=== ??? 12 22144 0.07288 N m 4() =9.14510 N m 9.14510 J A G dA NR R γπ---?==??-??=? 49.14510 J A W G -=-?=-? 4. 在298 K ,101.325 kPa 下,将直径为1 μm 的毛细管插入水中,问管需加多大压力才能防止水面上升?若不加额外压力,让水面上升达平衡后,管液面上升多高?已知:该温度下水的表面力为 0.072 N ·m -1,水的密度为1000 kg ·m -3,设接触角为0o ,重力加速度为9.8 m ·s -2 。 解:cos cos01θ==o 6 220.072 kPa 288 kPa 11102 s p R γ-?= =='?? 3 28810 m 29.38 m 10009.8 s p h g ρ?===? 5. 已知毛细管半径R = 1×10-4 m ,水的表面力γ = 0.072 N ·m -1 ,水的密度ρ = 103 kg ·m -3 ,接触角θ = 60o,求毛细管中水面上升的高度h 。 解:34 2cos 20.072cos 60 m 0.0735 m 109.810 h gR γθρ-?===??o 6. 303 K 时,乙醇的密度为780 kg ·m -3 ,乙醇与其蒸气平衡的表面力为2.189×10-2 N ·m -1 ,试计 算在径为0.2 mm 的毛细管中它能上升的高度?
2015物理化学复习题 下册
选择题: 1.对于一个一级反应,如其半衰期t1/2在0.01s以下,即为快速反应,此时它的速率常数 k值在:( A ) A. 69.32s-1以上; B. 6.932s-1以上; C. 0.06932s-1以上; D. 6.932s-1以下 2. 反应A→产物为一级反应,2B→产物为二级反应,t1/2(A)和t1/2(B)分别表示两反应的半衰期,设A和B的初始浓度相等,当反应分别进行的时间为t=2t1/2(A)和t=2t1/2(B)时,A、B物质的浓度c A、c B大小关系为: ( C ) A.c A﹥c B; B. c A=c B; C. c A﹤c B; D.两者无一定关系 3. 两个活化能不相同的反应,如E2﹥E1,且都在相同的升温区间内升温,则( A ) A.dlnk2/dT﹥dlnk1/dT; B. dlnk1/dT﹥dlnk2/dT; C. dlnk1/dT=dlnk2/dT; D. dk2/dT﹥dk1/dT 4. 电池在下面三种情况下放电:(1)电流趋于零;(2)有一定大小的工作电流;(3)短路。 则电池的电动势: A. 相同;B.不相同( A ) 电池的端电压: C. 相同;D.不相同( D ) 5. 半径为r,表面张力为σ,则肥皂泡内、外压力差为( C ) A. △p= 0; B. △p=2σ/r; C. △p=4σ/r; D. 无法确定 6. 在相同温度下,同一液体被分散成具有不同曲率半径的物系时,将具有不同的饱和蒸汽压,以p平、p凹、p凸分别表示平面、凹面和凸面液体上的饱和蒸汽压,则三者之间的关系是 ( C ) A. p 平﹥p凹﹥p凸; B. p凹﹥p平﹥p凸;C. p凸﹥p平﹥p凹;D. p凸﹥p凹﹥p平
关于物理化学课后习题 答案 文件排版存档编号:[UYTR-OUPT28-KBNTL98-UYNN208]
第一章两个容积均为V的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。若将其中的一个球加热到 100 C,另一个球则维持 0 C,忽略连接细管中气体体积,试求该容器内空气的压力。 解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。 标准状态: 因此, 如图所示,一带隔板的容器中,两侧分别有同温、不同压的H2与N2,P(H2)=20kpa,P(N2)=10kpa,二者均可视为理想气体。 H2 3dm3 P(H2) T N2 1dm3 P(N2) T (1) 两种气体混合后的压力; (2)计算混合气体中H2和N2的分压力; (3)计算混合气体中H2和N2的分体积。 第二章 1mol水蒸气(H2O,g)在100℃,下全部凝结成液态水,求过程的功。假 设:相对水蒸气的体积,液态水的体积可以忽略不计。 1mol某理想气体与27℃,的始态下,先受某恒定外压恒温压缩至平衡态, 在恒容升温至℃,。求过程的W,Q, ΔU, ΔH。已知气体的体积Cv,m=*mol-1 *K-1。 容积为 m3的恒容密闭容器中有一绝热隔板,其两侧分别为0 C,4 mol的Ar(g)及150 C,2 mol的Cu(s)。现将隔板撤掉,整个系统达到热平衡,求末态温度
t及过程的。已知:Ar(g)和Cu(s)的摩尔定压热容分别为 及,且假设均不随温度而变。 解:图示如下 假设:绝热壁与铜块紧密接触,且铜块的体积随温度的变化可忽略不计 则该过程可看作恒容过程,因此 假设气体可看作理想气体,,则 冰(H2O,S)在100kpa下的熔点为0℃,此条件下的摩尔熔化焓 ΔfusHm=*mol-1 *K-1。已知在-10~0℃范围内过冷水(H2O,l)和冰的摩尔定压热容分别为Cpm(H2O,l)=*mol-1 *K-1和Cpm(H2O,S)=*mol-1 *K-1。求在常压及-10℃下过冷水结冰的摩尔凝固焓。 O, l)在100 C的摩尔蒸发焓。水和水蒸气已知水(H 2 在25~100℃间的平均摩尔定压热容分别为Cpm(H2O,l)=*mol-1 *K-1和Cpm (H2O,g)=*mol-1 *K-1。求在25C时水的摩尔蒸发焓。 应用附录中有关物资的热化学数据,计算 25 C时反应 的标准摩尔反应焓,要求:(1)应用25 C的标准摩尔生成焓数据;
第七章 电化学 7.1 用铂电极电解CuCl 2溶液。通过的电流为20A ,经过15min 后,问:(1)在阴极上能析出多少质量的Cu?(2)在的27℃,100kPa 下阳极上能析出多少体积的的Cl 2(g )? 解:电极反应为:阴极:Cu 2+ + 2e - → Cu 阳极: 2Cl - -2e - → Cl 2(g ) 则:z= 2 根据:Q = nzF =It ()22015 Cu 9.32610mol 296500 It n zF -?= ==?? 因此:m (Cu )=n (Cu )× M (Cu )= 9.326×10-2×63.546 =5.927g 又因为:n (Cu )= n (Cl 2) pV (Cl 2)= n (Cl 2)RT 因此:3 223 Cl 0.093268.314300Cl 2.326dm 10010 n RT V p ??===?()() 7.2 用Pb (s )电极电解PbNO 3溶液。已知溶液浓度为1g 水中含有PbNO 3 1.66×10-2g 。通电一定时间后,测得与电解池串联的银库仑计中有0.1658g 的银沉积。阳极区的溶液质量为62.50g ,其中含有PbNO 31.151g ,计算Pb 2+的迁移数。 解法1:解该类问题主要依据电极区的物料守恒(溶液是电中性的)。显然阳极区溶液中Pb 2+的总量的改变如下: n 电解后(12Pb 2+)= n 电解前(12Pb 2+)+ n 电解(12Pb 2+)- n 迁移(1 2Pb 2+) 则:n 迁移(12Pb 2+)= n 电解前(12Pb 2+)+ n 电解(12Pb 2+)- n 电解后(1 2 Pb 2+) n 电解(12 Pb 2+)= n 电解(Ag ) = ()()3Ag 0.1658 1.53710mol Ag 107.9 m M -==? 2 23162.501.1511.6610(Pb ) 6.15010mol 1 2331.22 n -+--??==??解前()电 2311.151(Pb ) 6.95010mol 1 2331.22 n +-==??解后电 n 迁移(1 2 Pb 2+)=6.150×10-3+1.537×10-3-6.950×10-3=7.358×10-4mol () 242321Pb 7.358102Pb 0.4791 1.53710 (Pb )2 n t n + -+ -+?==?移解()=迁电
物理化学(下)样卷 一、填空题(每小题2分,共20分) 1、298K ,当H 2SO 4溶液浓度从0.01mol kg -1增加到0.1mol kg -1时,其电导率 和摩尔电导率 m 将: ( ) (A ) 减小,m 增加 (B ) 增加,m 增加 (C ) 减小,m 减小 (D ) 增加,m 减小 2、下列对原电池的描述哪个是不准确的? ( ) (A )在阳极上发生氧化反应 (B )电池内部由离子输送电荷 (C )在电池外线路上电子从阴极流向阳极 (D )当电动势为正值时电池反应是自发的 3、在用对消法测定电池的电动势时,通常必须用到: ( ) (A )标准氢电极 (B )甘汞电极 (C )标准电池 (D )活度为1的电解质溶液 4、一个电池反应确定的电池,电动势E 值的正负可以用来说明: ( ) (A )电池是否可逆 (B )电池反应是否已达平衡 (C )电池反应自发进行的方向 (D )电池反应的限度 5、某燃料电池的反应为:H 2(g) + 1/2O 2(g) = H 2O(g),在400K 时的m r H ?和m r S ?分别为- 251.6 kJ mol -1和- 50 J K -1 mol -1,则该电池的电动势为 ( ) (A )1.2V (B )2.4V (C )1.4V (D )2.8V 6、已知 o ( Fe 2+ / Fe ) = - 0.4402V , o ( Cd 2+ / Cd ) = - 0.4029V , 将金属铁粉和镉粉丢入含Fe 2+ ( 0.1mol kg -1 )和Cd 2+ ( 0.001mol kg -1 )的溶液中,铁粉和镉粉是否会溶解:( ) (A )铁粉和镉粉皆会溶解 (B )铁粉和镉粉皆不会溶解 (C )铁粉溶解、镉粉不溶 (D )镉粉溶解、铁粉不溶 7、常用的甘汞电极的电极反应:Hg 2Cl 2(s) + 2e - = 2Hg(l) + 2Cl -(aq),设饱和甘汞电极、摩尔甘汞电极和0.1mol dm -3 甘汞电极的电极电势相应地为 1、 2、 3,则298K 时,三者之相对大小是 ( ) (A ) 1 > 2 > 3 (B ) 1 < 2 < 3 (C ) 2 > 1 > 3 (D ) 3 > 1 = 2 8、两半电池之间使用盐桥测得电动势为0.059V ,当盐桥拿走,使两溶液接触,这时测得电动势为0.048V ,则液接电势值为: ( )
一、填空题(每小题2分,共20分) 1、热力学第零定律是指: 。 2、熵与热力学概率之间的函数关系式是。 3、补全热力学函数关系式:C P= (?S/?T)P 4、一定量的单原子理想气体定压下从T1变化到T2的熵变与定容下从T1变化到T2的熵变之比为: 5、化学势的表示式中,是偏摩尔量。 6、稀溶液的依数性包括、、和。 7、反应NH4HS(s)=NH3(g)+H2S(g),在298K时测得分解压为66.66Pa,则该温度下该反应的K pΘ= ;K p= 。 8、1atm压力下水和乙醇系统的最低恒沸混合物含乙醇质量分数为0.9557,现将含乙醇50%的乙醇水溶液进行分馏,最终得到的物质为。 9、水在101.3kPa时沸点为373K,汽化热为40.67 kJ/mol(设汽化热不随温度变化);毕节学院的大气压约为85.5 kPa,则在毕节学院水的沸点为 K。 10、反应NH4HS(s)=NH3(g)+H2S(g)已达平衡;保持总压不变,往系统中充入一定量的惰性气体,平衡移动方向为。 二、选择题(每小题2分,共30分) 1、下列属于化学热力学范畴的是() (A)物质结构与性能的关系(B)化学反应速率 (C)化学变化的方向和限度(D)反应机理 2、下列关于热力学方法叙述正确的是() (A)热力学研究所得的结论不适用于分子的个体行为 (B)热力学可以解决某条件下怎样把一个变化的可能性变为现实性的问题 (C)经典热力学详细讨论了物质的微观结构 (D)经典热力学常需计算一个变化所需要的时间 3、下列函数中为强度性质的是:() (A) S (B) (?G/?p)T(C) (?U/?V)T (D) C V 4、一定量的纯理想气体,下列哪组量确定后,其他状态函数方有定值。() (A)T (B)V (C)T、U (D)T、p
第七章 电化学 7-1.用铂电极电解CuCl 2溶液。通过的电流为20 A ,经过15 min 后,问:(1)在阴极上能析出多少质量的Cu ? (2) 在阳阴极上能析出多少体积的27℃, 100 kPa 下的Cl 2(g )? 解:(1) m Cu = 201560635462.F ???=5.527 g n Cu =201560 2F ??=0.09328 mol (2) 2Cl n =2015602F ??=0.09328 mol 2Cl V =00932830015 100 .R .??=2.328 dm 3 7-2.用Pb (s )电极电解Pb (NO 3) 2溶液,已知溶液浓度为1g 水中含有Pb (NO 3) 21.66×10-2g 。通电一段时间,测得与电解池串联的银库仑计中有0.1658g 的银沉积。阳极区溶液质量为62.50g ,其中含有Pb (NO 3) 21.151g ,计算Pb 2+的迁移数。 解: M [Pb (NO 3) 2]=331.2098 考虑Pb 2+:n 迁=n 前-n 后+n e =262501151166103312098(..)..--??-11513312098..+01658 21078682 ..? =3.0748×10-3-3.4751×10-3+7.6853×10-4 =3.6823×10-4 mol t +(Pb 2+ )=4 4 36823107685310..--??=0.4791 考虑3NO -: n 迁=n 后-n 前 =1151 3312098 ..-262501151166103312098(..)..--??=4.0030×10-3 mol t -(3 NO -)=4 4 40030107658310..--??=0.5209 7-3.用银电极电解AgNO 3溶液。通电一段时间后,阴极上有0.078 g 的Ag 析出,阳极区溶液溶液质量为23.376g ,其中含AgNO 3 0.236 g 。已知通电前溶液浓度为1kg 水中溶有7.39g 的AgNO 3。求Ag +和3NO -的迁移数。 解: 考虑Ag +: n 迁=n 前-n 后+n e =3233760236739101698731(..)..--??-023********..+00781078682 .. =1.007×10- 3-1.3893×10- 3+7.231×10- 4
第十一章化学动力学 1. 反应为一级气相反应,320 oC时。问在320 oC加热90 min的分解分数为若干? 解:根据一级反应速率方程的积分式 答:的分解分数为11.2% 2. 某一级反应的半衰期为10 min。求1h后剩余A的分数。 解:同上题, 答:还剩余A 1.56%。 3.某一级反应,反应进行10 min后,反应物反应掉30%。问反应掉50%需多少时间? 解:根据一级反应速率方程的积分式 答:反应掉50%需时19.4 min。 4. 25 oC时,酸催化蔗糖转化反应 的动力学数据如下(蔗糖的初始浓度c0为1.0023 mol·dm-3,时刻t的浓度为c) 0 30 60 90 130 180 0 0.1001 0.1946 0.2770 0.3726 0.4676 解:数据标为 0 30 60 90 130 180 1.0023 0.9022 0.8077 0.7253 0.6297 0.5347 0 -0.1052 -0.2159 -0.3235 -0.4648 -0.6283
拟合公式 蔗糖转化95%需时 5. N -氯代乙酰苯胺异构化为乙酰对氯苯胺 为一级反应。反应进程由加KI溶液,并用标准硫代硫酸钠溶液滴定游离碘来测定。KI只与 A反应。数据如下: 0 1 2 3 4 6 8 49.3 35.6 25.75 18.5 14.0 7.3 4.6 解:反应方程如下 根据反应式,N -氯代乙酰苯胺的物质的量应为所消耗硫代硫酸钠的物质的量的二分之一, 0 1 2 3 4 6 8
4.930 3.560 2.575 1.850 1.400 0.730 0.460 0 -0.3256 -0.6495 -0.9802 -1.2589 -1.9100 -2.3719 。 6.对于一级反应,使证明转化率达到87.5%所需时间为转化率达到50%所需时间的3倍。对 于二级反应又应为多少? 解:转化率定义为,对于一级反应, 对于二级反应, 7.偶氮甲烷分解反应 为一级反应。287 oC时,一密闭容器中初始压力为21.332 kPa,1000 s后总压为 22.732 kPa,求。 解:设在t时刻的分压为p, 1000 s后,对密闭容器中的 气相反应,可以用分压表示组成:
一 化学热力学基础 1-1 判断题 1、可逆的化学反应就是可逆过程。(×) 2、Q 和W 不是体系的性质,与过程有关,所以Q+W 也由过程决定。(×) 3、焓的定义式H=U+pV 是在定压条件下推导出来的,所以只有定压过程才有焓变。(×) 4、焓的增加量ΔH 等于该过程中体系从环境吸收的热量。(×) 5、一个绝热过程Q=0,但体系的ΔT 不一定为零。(√) 6、对于一个定量的理想气体,温度一定,热力学能和焓也随之确定。(√) 7、某理想气体从始态经定温和定容两个过程达终态,这两个过程Q 、W 、ΔU 及ΔH 是相等的。(×) 8、任何物质的熵值是不可能为负值或零的。(×) 9、功可以全部转化为热,但热不能全部转化为功。(×) 10、不可逆过程的熵变是不可求的。(×) 11、任意过程中的热效应与温度相除,可以得到该过程的熵变。(×) 12、在孤立体系中,一自发过程由A B,但体系永远回不到原来状态。(√) 13、绝热过程Q=0,而T Q dS δ= ,所以dS=0。(×) 14、可以用一过程的熵变与热温商的大小关系判断其自发性。(√)
15、绝热过程Q=0,而ΔH=Q ,因此ΔH=0。(×) 16、按克劳修斯不等式,热是不可能从低温热源传给高温热源的。(×) 17、在一绝热体系中,水向真空蒸发为水蒸气(以水和水蒸气为体系),该过程W>0,ΔU>0。(×) 18、体系经过一不可逆循环过程,其体S ?>0。(×) 19、对于气态物质,C p -C V =nR 。(×) 20、在一绝热体系中有一隔板,两边分别是空气和真空,抽去隔板,空气向真空膨胀,此时Q=0,所以ΔS=0。(×) 21、高温物体所含的热量比低温物体的多,因此热从高温物体自动流向低温物体。(×) 22、处于两相平衡的1molH 2O (l )和1molH 2O (g ),由于两相物质的温度和压力相等,因此在相变过程中ΔU=0,ΔH=0。(×) 23、在标准压力下加热某物质,温度由T 1上升到T 2,则该物质吸收的 热量为?=21 T T p dT C Q ,在此条件下应存在ΔH=Q 的关系。 (√) 24、带有绝热活塞(无摩擦、无质量)的一个绝热气缸装有理想气体,内壁有电炉丝,将电阻丝通电后,气体慢慢膨胀。因为是一个恒压过程Q p =ΔH ,又因为是绝热体系Q p =0,所以ΔH=0。(×) 25、体系从状态I 变化到状态Ⅱ,若ΔT=0,则Q=0,无热量交换。(×) 26、公式Vdp SdT dG +-=只适用于可逆过程。 ( × ) 27、某一体系达到平衡时,熵最大,自由能最小。
江南大学 2006-2007学年度上期物理化学试题(B ) 考试(考查) 审题: 开(闭)卷 笔试时间:120分钟 满分:100分 (可带计算器) 一、判断题。判断下列说法的正误,在正确的说法后面打“√”,错误的说法后面打“×”。(每小题1分,共10分) 1、温度一定的时候,气体的体积与压力的乘积等于常数。( ) 2、热力学过程中W 的值应由具体过程决定 ( ) 3、系统的混乱度增加,则其熵值减小。( ) 4、处于标准状态的CO (g),其标准燃烧热为零。( ) 5、1mol 理想气体从同一始态经过不同的循环途径后回到初始状态,其热力学能不变。( ) 6、吉布斯判据适用于理想气体的任意过程。( ) 7、四个热力学基本方程适用于所有封闭体系的可逆过程。( ) 8、在纯溶剂中加入少量不挥发的溶质后形成的稀溶液沸点将升高。( ) 9、惰性组分的加入将使反应的平衡转化率降低。( ) 10、只受温度影响的平衡系统自由度F=C-P+1。( ) 二、选择题。以下各题,只有一个正确选项,请将正确的选项填在相应位置。(每小题3分,共45分) 1. 一定压力下,当2 L 理想气体从0℃升温到273℃时,其体积变为( )。 A. 5 L B. 4 L C. 6 L D. 1 L 2、A 、B 两种理想气体的混合物总压力为100kPa ,其中气体A 的摩尔分数0.6,则气体B 的分压为( )。 A. 100kPa B. 60kPa C. 40kPa D. 不确定 3、当实际气体的压缩因子Z 大于1的时候表明该气体( )。 A. 易于压缩 B. 不易压缩 C. 易于液化 D. 不易液化 4、如图,将CuSO 4水溶液置于绝热箱中,插入两个铜电极,以蓄电池为电源进行 电解,可以看作封闭体系的是( )。 A. 绝热箱中所有物质 B. 两个铜电极 C. 蓄电池和铜电极 D. CuSO 4水溶液 5、在体系温度恒定的变化中,体系与环境之间( )。 A. 一定产生热交换 B. 一定不产生热交换 C. 不一定产生热交换 D. 温度恒定与热交换无关 6、下列定义式中,表达正确的是( )。 A. G=H +TS B. G=A +PV C. A=U +TS C. H=U —PV 7、在一个绝热钢瓶中,发生一个放热的分子数增加的化学反应,那么( )。 A. Q > 0,W > 0,ΔU > 0 B. ΔQ = 0,W = 0,ΔU < 0 C. Q = 0,W = 0,ΔU = 0 D. Q < 0,W > 0,ΔU < 0 8、ΔH =Q p , 此式适用于下列哪个过程: ( )。 A. 理想气体从106 Pa 反抗恒外压105 Pa 膨胀到105 Pa B. 0℃ , 105 Pa 下冰融化成水 C. 电解 CuSO 4水溶液 D. 气体从 (298 K, 105 Pa) 可逆变化到 (373 K, 104 Pa) 9、下述说法中,哪一种不正确:( )。 A. 焓是体系能与环境进行交换的能量 B. 焓是人为定义的一种具有能量量纲的热力学量
目录 Ⅰ.练习题 (1) 一、填空题 (1) 二、判断题 (5) 三、选择题 (9) 四、计算题 (46) 五、简答题 (53) Ⅱ.参考答案 (55) 一、填空题 (55) 二、判断题 (57) 三、选择题 (61) 四、计算题 (63) 五、简答题 (80)
I 练习题 一、填空题 电解质溶液 1. Pt|Cu 2+,Cu + 电极上的反应为Cu 2+ + e -→Cu +,当有1F 的电量通过电池时,发生反应的 Cu 2+ 的物质的量为________。 2. 同一电导池测得浓度为0、01mol·dm -3的A 溶液与浓度为0、1 mol·dm -3的B 溶液的 电阻分别为1000Ω与500Ω,则它们的摩尔电导率之比Λm (A)/Λm (B)等于________。 3. 已知m Λ∞(Na +)=50、11×10-4S·m 2·mol -1,m Λ∞ (OH -)=198、0×10-4S·m 2·mol -1,在无限稀释的 NaOH 溶液中t ∞(Na +)等于________,t ∞(OH -)等于________。 4. 25℃时,在0、002mol·kg -1CaCl 水溶液中离子平均活度系数为γ±1,在0、002mol·kg -1 CuSO 4水溶液中离子平均活度系数为γ±2,则γ±1_______γ±2。 5. 已知NaAc 、NaCl 、HCl 水溶液无限稀释时的摩尔电导率分别为Λ1,Λ2,Λ3,则HAc 的摩 尔电导率为________________。 6. 25℃时,1mol·kg -1的BaCl 2水溶液的γ±=0、399,则a ±= 。 7. 相同温度、相同浓度的NaCl,MgCl 2,MgSO 4的稀水溶液,其离子平均活度因子的大小就 是:γ±(NaCl) γ±(MgCl 2) γ±(MgSO 4)(选填<,=,>)。 8. 电解质的离子强度定义为I = ,1 mol·kg -1的CaCl 2水溶液的I = mol·kg -1。 9. 等量的0、05 mol·kg -1的LaCl 3水溶液及0、05 mol·kg -1的NaCl 水溶液混合后,溶液的 离子强度I = 。 10. 25℃时,AgCl 饱与水溶液的电导率为3、41×10-4S ·m -1,所用水的电导率为1、60× 10-4S ·m -1。则AgCl 的电导率为 。 11. 用银电极电解AgNO 3溶液,通电一段时间后,测知在阴极上析出1、15g 的Ag,并知阴 极区溶液中Ag +的总量减少了0、6g,则该硝酸银溶液中离子的迁移数 t (Ag +)=_______ ,3(NO )t -=________。已知Ag 的相对原子质量为107、9。 12. 强电解质MX 、MY 与HY 的摩尔极限电导分别为Λ1、Λ2、Λ3,则HX 的摩尔极限电 导为______________。 可逆电池的电动势及其应用
物理化学试题A 一、选择题(每题2分,共50分,将唯一的答案填进括号内) @( b )1. 下列公式中只适用于理想气体的是1. B A. ΔU=Q V B. W=nRTln(p 2/p 1) C. ΔU=dT C m ,V T T 21? D. ΔH=ΔU+p ΔV @( c )2. ΔH 是体系的什么 2. C A. 反应热 B. 吸收的热量 C. 焓的变化 D. 生成热 ( )3. 2000K 时反应CO(g)+1/2O 2(g)=CO 2(g)的K p 为 6.443,则在同温度下反应为2CO 2(g)=2CO(g)+O 2(g)的K p 应为3. C A. 1/6.443 B. (6.443)1/2 C. (1/6.443)2 D. 1/(6.443)1/2 ( ) 4. 固态的NH 4HS 放入一抽空的容器中,并达到化学平衡,其组分数、独立组分数、相数及自由度分别是 4. C A. 1,1,1,2 B. 1,1,3,0 C. 3,1,2,1 D. 3,2,2,2 @( c) 5. 下列各量称做化学势的是 5.D A. i j n ,V ,S i )n ( ≠?μ? B. i j n ,V ,T i )n p (≠?? C. i j n ,p ,T i )n (≠?μ? D. i j n ,V ,S i )n U (≠?? ( ) 6. A 和B 能形成理想溶液。已知在100℃时纯液体A 的饱和蒸汽压为133.3kPa, 纯液体B 的饱和蒸汽压为66.7 kPa, 当A 和B 的二元溶液中A 的摩尔分数为0.5时,与溶液平衡的蒸气中A 的摩尔分数是6.C A. 1 B. 0.75 C. 0.667 D. 0.5 @( ) 7. 理想气体的真空自由膨胀,哪个函数不变? A. ΔS=0 B. V=0 C. ΔG=0 D. ΔH=0 7. D ( ) 8. A 、B 两组分的气液平衡T-x 图上,有一最低恒沸点,恒沸物组成为x A =0.7。现有一组成为x A =0.5的AB 液体混合物,将其精馏可得到 A. 纯A 和恒沸混合物 B. 纯B 和恒沸混合物 C. 只得恒沸混合物 D. 得纯A 和纯B 8. B