
高一化学教学案 编制: 审核: 班级: 姓名: 执教人:
第 1 页 第 2页
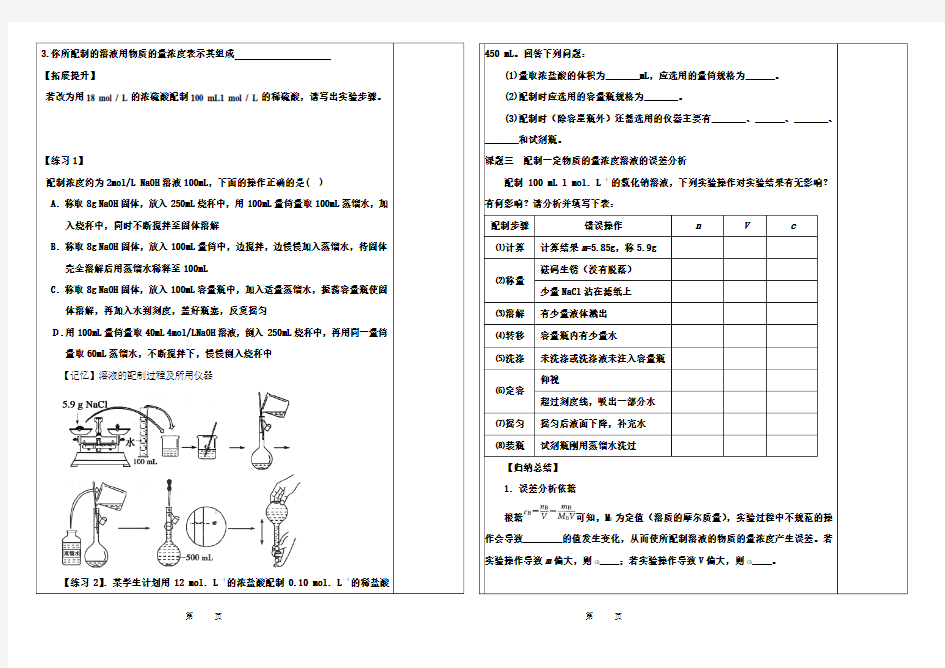
总第 课时】 【 课型: 】 【时间】2016.9. 【学习目标】.学会容量瓶的使用方法,物质的量浓度溶液配制的实验操作和误差分析。 【重点难点】一定物质的量浓度溶液的配制方法。
学 习 过 程
课堂笔记/讲评设计
【 课 前 预 习 】
1. 容量瓶的外观特征是什么?它的具体用途有哪些?规格有哪些?
2.使用容量瓶应注意事项: ⑴使用前要检验容量瓶是否漏水; ⑵容量瓶不能用来存放试剂;
⑶溶质应该首先在烧杯中溶解或稀释并冷却至室温后再转移容量瓶中,原因是什么?
3.配制一定体积溶液应遵循哪些原则?
【合 作 探 究】
课题一.容量瓶的构造与使用 (1)容量瓶的构造
(2)容量瓶的使用
课题二:如何配制100 mL 含溶质的物质的量为0.04mol 的NaCl 溶液? 1.所需仪器:
2.实验步骤:
(1) 通过计算,应该称取_________gNaCl 固体。
(2) 将准确称量后的固体放在___________中溶解,并冷却至室温。 (3) 将所得的溶液用玻璃棒引流,转移到容量瓶中。
(4) 洗涤用过的烧杯和玻璃棒_______次,并将洗涤液全部转移到容量瓶中。 (5) 向容量瓶中加水至离刻度线____时,改用胶头滴管加蒸馏水至溶液的凹液面与
刻度线相切。
(6) 盖好瓶塞,反复上下颠倒,摇匀。
(7) 将配制好的溶液转移到试剂瓶中,贴好标签并注明:药品名称、浓度、配制的日期。
3.你所配制的溶液用物质的量浓度表示其组成
【拓展提升】
若改为用18 mol / L的浓硫酸配制100 mL1 mol / L的稀硫酸,请写出实验步骤。
【练习1】
配制浓度约为2mol/L NaOH溶液100mL,下面的操作正确的是( )
A.称取8g NaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取8g NaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
C.称取8g NaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
D.用100mL量筒量取40mL 4mol/LNaOH溶液,倒入250mL烧杯中,再用同一量筒量取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
【记忆】溶液的配制过程及所用仪器
【练习2】.某学生计划用12 mol.L—1的浓盐酸配制0.10 mol.L—1的稀盐酸450 mL。回答下列问题:
(1)量取浓盐酸的体积为_______mL,应选用的量筒规格为______。
(2)配制时应选用的容量瓶规格为_______。
(3)配制时(除容星瓶外)还需选用的仪器主要有_______、______、_______、_______和试剂瓶。
课题三配制一定物质的量浓度溶液的误差分析
配制100 mL l mol.L—1的氯化钠溶液,下列实验操作对实验结果有无影响?有何影响?请分析并填写下表:
配制步骤错误操作n V c
⑴计算计算结果m=5.85g,称5.9g
⑵称量
砝码生锈(没有脱落)
少量NaCl沾在滤纸上
⑶溶解有少量液体溅出
⑷转移容量瓶内有少量水
⑸洗涤未洗涤或洗涤液未注入容量瓶
⑹定容
仰视
超过刻度线,吸出一部分水
⑺摇匀摇匀后液面下降,补充水
⑻装瓶试剂瓶刚用蒸馏水洗过
【归纳总结】
1.误差分析依据
根据可知,M B为定值(溶质的摩尔质量),实验过程中不规范的操作会导致________的值发生变化,从而使所配制溶液的物质的量浓度产生误差。若实验操作导致m B偏大,则CB____;若实验操作导致V偏大,则CB____。
第页第页
2.仰视或俯视刻度线图解
(1)仰视刻度线(图1)
由于操作时是以刻度线为基准加水,从下向上看,最先看见的是刻度线,刻度线低于液体凹液面最低处,故溶液实际体积比读数偏大。
(2)俯视刻度线(图2)
从上向下看,最先看到的是刻度线,刻度线高于溶液凹液面最低处,故溶液实际体积比读数偏小。
【练习3】下列配制的溶液浓度偏高的是 ( )
A.配制盐酸用量筒量取盐酸时俯视刻度线
B.配制盐酸定容时,仰视容量瓶刻度线
C.称量4.0 g NaOH配制0.1 mol.L—1 NaOH溶液1000 mL时,砝码错放在左盘
D.NaOH溶解后未经冷却即注入容量瓶至刻度线
【练习4】用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是 ( ) A.干燥的 B.瓶塞不漏水
C.用与所配溶液同浓度的溶液润洗过的 D.以上三项都符合的
【练习5】实验室用氢氧化钠固体配制1.00 mol.L—1的NaOH溶液500 mL,回答下列问题。
(1)请补充完整实验的简要步骤:
①计算;②称量NaOH固体________g;③溶解;④冷却并移液;⑤洗涤并转移;
⑥________;⑦摇匀。
(2)本实验用到的基本仪器已有烧杯、天平(带砝码)、镊子、量筒、玻璃棒,还缺少的仪器是________、________。(3)上述实验操作②、③都要用到小烧杯,其作用分别是___________________________和________________________________________。
(4)如图是该同学转移溶液的示意图,图中有两处错误,请写出:
①___________________________________________________________;
②___________________________________________________________。
(5)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是________(填字母)。
A.转移溶液时不慎有少量液体洒到容量瓶外面
B.定容时俯视刻度线
C.未冷却到室温就将溶液转移到容量瓶并定容
D.定容后塞上瓶塞反复摇匀,静置后,发现液面低于刻度线,再加水至刻度线5.用经过准确称量的NaOH固体配制250 mL 0.2 mol.L—l的NaOH溶液。
(1)在下列实验仪器中,不必使用的是_______(填字母)。
A.托盘天平 B.500 mL试剂瓶
C.500 mL容量瓶 D.250 mL烧标E.胶头滴管
(2)除上述仪器中可使用的以外,还缺少的仪器是______________;在该实验中的用途是______________________________________________________________。
第页第页
第 页 第 页
第 页 第 页
第 页 第 页
第 页 第 页
一定物质的量浓度溶液的配制 知识复习: 配置50g质量分数为6%的氯化钠溶液所需要的仪器有托盘天平、药匙、烧杯、量筒、胶头滴管、玻棒。步骤为①计算②称量③溶解。 2.物质的量浓度的概念和计算公式。 3.10%的NaCl溶液是指什么?每100克NaCl溶液含溶质10g 1mol/L的NaCl 溶液是指什么?1LNaCl溶液含溶质1mol 知识学习: 一.一定物质的量浓度溶液的配制(配制100mL1.00mol/LNaCl溶液) 【1】原理:由物质的量浓度的表达式可知,配制一定物质的量浓度溶液所需确定的量为溶质和溶剂。 思考:我们根据题中条件能否算出水的量(质量或体积)。如何确定溶液的体积? 【2】所用的仪器:托盘天平、药匙、烧杯、玻璃棒、容量瓶、胶头滴管 专用仪器:容量瓶 容量瓶的体积固定,有不同规格(100 mL、250 mL、500 mL、1000 mL等 (1)构造:梨形、平底、细颈玻璃瓶,瓶口配有磨口玻璃塞或塑料塞 (有一个塞子,且用绳子钓着,说明每个都有自己的原配) (2). 特点:①容量瓶上标有温度和容积 ②容量瓶上有刻线而无刻度 (3). 使用范围:用来配制一定体积、浓度准确的溶液 (4). 容量瓶的使用注意事项: ①溶解或稀释的操作不能在容量瓶中进行 ②溶液温度与容量瓶上标定温度一致时,所取液体的体积最标准 ③不能长期存放溶液或进行化学反应 ④使用前须检验容量瓶是否漏水。 【3】容量瓶的使用:容量瓶是用来的仪器,常用的规格有 。上面标有:、、。容量瓶在使用前要先查漏。其方法是加入适量水,盖好玻璃塞,倒转180°,查看是否漏水;再旋转塞子,再重复。【4】步骤: ①计算:计算所需NaCl固体的质量g。 ②称量:用称量NaCl固体。(固体称量用天平,液体则用量筒) 称量的注意事项: ①使用前要调零 ②两个托盘上各放一张大小相同的称量纸 ③称量时遵循左物右码的原则 ④镊子夹取砝码应按照从大到小的顺序 ⑤称量完毕应将砝码放回盒中,游码归零 ③溶解:将称好的NaCl固体放入烧杯中,加适量蒸馏水溶解,用玻璃棒搅拌,目的是加快溶解。 溶解中应注意事项:(固体要先溶解,液体要先稀释;都要却至室温再移液) a)在烧杯中溶解,不能在容量瓶中溶解,溶解时加水不要太多 b)应当注意搅拌时沿着一定的方向 c)玻璃棒不要碰烧杯底和烧杯壁 d)不要把玻璃棒放在实验台上,以免引入其他杂质 ④转移:(溶液冷却后,用玻璃棒引流)
一定物质的量浓度溶液配制的误差分析(转载) 配制一定物质的量浓度溶液的实验是中学化学中一个重要的定量实验,实验过程中引起溶液浓度存在误差的因素有很多。从大的方面讲,一是由实验过程中的不规范操作引起的;二是由仪器或药品等系统原因引起的。由于引起误差的原因复杂,所以误差分析就成为高考化学实验中的一个难点。 在高考命题时,有关误差分析的内容既可以以选择题的形式进行考查,也可以以填空题的形式进行考查,既可以考查判断误差导致的结果,也可以考查引起误差的可能原因。一、误差分析的理论依据 根据cB=nB/V 可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V 引起的。误差分析时,关键要看配制过程中引起n和V 怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V 比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V 比理论值小时,都会使所配溶液浓度偏大。 二、误差原因实例归纳 为了便于同学们理解,我们对产生误差的原因归纳分析如下: (一)由概念不清引起的误差 1.容量瓶的容量与溶液体积不一致。 例:用500mL容量瓶配制450mL moL/L的氢氧化钠溶液,用托盘天平称取氢氧化钠固体g。分析:偏小。容量瓶只有一个刻度线,且实验室常用容量瓶的规格是固定的(50mL、100mL、250mL、500mL、1000mL),用500mL容量瓶只能配制500mL一定物质的量浓度的溶液。所以所需氢氧化钠固体的质量应以500mL溶液计算,要称取g氢氧化钠固体配制500mL溶液,再取出450mL溶液即可。 2.溶液中的溶质与其结晶水合物的不一致。 例:配制500mL的硫酸铜溶液,需称取胆矾g。分析:偏小。胆矾为CuSO45H2O,而硫酸铜溶液的溶质是CuSO4。配制上述溶液所需硫酸铜晶体的质量应为,由于所称量的溶质质量偏小,所以溶液浓度偏小。 (二)由试剂纯度引起的误差 3.结晶水合物风化或失水。 例:用生石膏配制硫酸钙溶液时,所用生石膏已经部分失水。分析:偏大。失水的生石膏中结晶水含量减少,但仍用生石膏的相对分子质量计算,使溶质硫酸钙的质量偏大,导致所配硫酸钙溶液的物质的量浓度偏大。 4.溶质中含有其他杂质。 例:配制氢氧化钠溶液时,氢氧化钠固体中含有氧化钠杂质。分析:偏大。氧化钠固体在配制过程中遇水转变成氢氧化钠,g氧化钠可与水反应生成g氢氧化钠,相当于氢氧化钠的质量偏大,使结果偏大。 (三)由称量不正确引起的误差 5.称量过程中溶质吸收空气中成分。 例:配制氢氧化钠溶液时,氢氧化钠固体放在烧杯中称量时间过长。分析:偏小。氢氧化钠固体具有吸水性,使所称量的溶质氢氧化钠的质量偏小,导致其物质的量浓度偏小。所以称量氢氧化钠固体时速度要快或放在称量瓶中称量最好。 6.称量错误操作。 例:配制氢氧化钠溶液时,天平的两个托盘上放两张质量相等的纸片。分析:偏小。在纸片上称量氢氧化钠,吸湿后的氢氧化钠会沾在纸片上,使溶质损失,浓度偏小。 7.天平砝码本身不标准。
《配制一定物质的量浓度的溶液》教案教学目的: 知识目标 1、使学生初步学会配制一定物质的量浓度溶液的方法。 2、进一步学会容量瓶的使用。 能力目标: 培养学生以事实为依据,分析解决实际问题的能力。 态度目标: 1、培养学生实事求是的精神。 2、培养学生精诚合作的态度。 教学重难点: 1、一定物质的量浓度溶液的配制方法。 2、误差分析 教学方法: 对比教学法,演示实验法,多媒体教学 仪器药品: 容量瓶(150毫升)烧杯(100毫升)玻璃棒胶头滴管药匙滤纸托盘天平 NaCl(固体)蒸馏水 教学过程: 一、复习提问: 如何配制100g质量分数为5%的NaCl溶液?计算溶质的质量和量取水的体积。用天平称量5gNaCl。用量筒量取95mL水。在烧杯中溶解(把水的密度近似看作1g/cm3)。 [引言]如何配制一定物质的量浓度的溶液? [复习思考]
物质的量浓度计算公式是: C B = n B / V 二、一定物质的量浓度溶液的配制 在实验室用NaCl固体配制250mL0.1mol/L NaCl溶液 ∵n(NaCl)=c(NaCl) ×V(NaCl) =0.1mol/L×0.25L=0.025mol ∴m(NaCl)=n(NaCl) ×M(NaCl) =0.025mol×58.5g/mol=1.46g [学生活动]计算氯化钠质量,熟悉演示实验[3-1] [详细讲解] 配制一定物质的量浓度的溶液步骤 ?计算: NaCl的质量 ?称量:(复习天平的使用) ?溶解:在烧杯中用100毫升蒸馏水使之完全溶解(注意:应冷却,不可在容量瓶中溶解,为什么?) ?转移:移入250mL容量瓶。(需要使用到什么仪器?) ?洗涤:洗涤烧杯和玻璃棒两至三次。(思考:为什么?)?定容:加水到接近刻度1-2厘米时,改用胶头滴管加水到刻度。(为什么?) ?摇匀、贮存:存放于试剂瓶。(溶液能否保持在容量瓶中?)[模拟实验] [学生选择实验所需仪器]
配制一定物质的量浓度的溶液实验报告 实验目的 1、练习配制一定物质的量浓度的溶液。 2、加深对物质的量浓度概念的理解。 3、练习容量瓶、胶头滴管的使用方法。 实验原理 n=C V,配制标准浓度的溶液 实验用品 烧杯、容量瓶(100mL)、胶头滴管、量筒、玻璃棒、药匙、滤纸、托盘天平、NaCl(s)、蒸馏水。 实验步骤 (1)计算所需溶质的量 (2)称量:固体用托盘天平,液体用量筒(或滴定管/移液管)移取。 (3)溶解或稀释(用玻璃棒搅拌) (4)移液:把烧杯液体引流入容量瓶(用玻璃棒引流)。 (5)洗涤:洗涤烧杯和玻璃棒2~3次,洗涤液一并移入容量瓶,振荡摇匀。 (6)定容:向容量瓶中注入蒸馏水至距离刻度线2~3 cm处改用胶头滴管滴蒸馏水至溶液凹液面与刻度线正好相切。(要求平视) (7)盖好瓶塞,反复上下颠倒,摇匀。 实验结果 计算出溶质的质量 实验结论 (1)配制一定物质的量浓度的溶液是将一定质量或体积的溶质按所配溶液的体积在选定的容量瓶中定容,因而不需要计算水的用量。 (2)不能配制任意体积的一定物质的量浓度的溶液。这是因为在配制的过程中是用容量瓶来定容的,而容量瓶的规格又是有限的,常用的有50 mL、100 mL、250 mL、500 mL、和1000 mL等。所以只能配制体积与容量瓶容积相同的一定物质的量浓度的溶液。 备注 重点注意事项: (1)容量瓶使用之前一定要检查瓶塞是否漏水; (2)配制一定体积的溶液时,容量瓶的规格必须与要配制的溶液的体积相同; (3)不能把溶质直接放入容量瓶中溶解或稀释; (4)溶解时放热的必须冷却至室温后才能移液; (5)定容后,经反复颠倒,摇匀后会出现容量瓶中的液面低于容量瓶刻度线的情况,这时不能再向容量瓶中加入蒸馏水。因为定容后液体的体积刚好为容量瓶标定容积。上述情况的出现主要是部分溶液在润湿容量瓶磨口时有所损失; (6)如果加水定容时超过了刻度线,不能将
课时作业(二) 物质的量浓度计算及溶液配制 1.(2019山东泰安期中)室温时,甲、乙两同学在实验室配制氯化钠溶液。甲同学配制5%的NaCl 溶液100 g ,乙同学配制0.5 mol·L -1的NaCl 溶液100 mL(20 ℃时,氯化钠在水中的溶解度为36 g/100 g 水)。下列说法正确的是( ) A .两同学所需溶质的质量相同 B .两同学所需实验仪器种类相同 C .两同学所配溶液均为不饱和溶液 D .两同学所配溶液的质量相同 答案:C 解析:甲同学所配溶液中溶质的质量为100 g ×5%=5 g ,乙同学所配溶液中溶质的质量为0.5 mol·L -1×0.1 L ×58.5 g·mol -1=2.925 g ,A 项错误;乙同学配制溶液过程中需要用到容量瓶,而甲同学不需要,B 项错误;由A 项中的计算结果及题目所给氯化钠溶液的溶解度可知,两同学配制的溶液均为不饱和溶液,C 项正确;100 mL 氯化钠溶液的质量大于100 g ,D 项错误。 2.(2019陕西西安一中二模)把200 mL NH 4HCO 3和Na 2CO 3的混合溶液分成两等份,取一份加入含a mol NaOH 的溶液,恰好反应完全;取另一份加入含b mol HCl 的盐酸,也恰好反应完全。该混合溶液中c (Na +)为 ( ) A .(10b -5a )mol·L -1 B .(2b -a )mol·L -1 C.? ????b 10-a 20mol·L -1 D .? ?? ??5b -5a 2mol·L -1 答案:A 解析:200 mL 的混合溶液分成两等份,每份溶液的体积为100 mL ,其中一份溶液中的NH 4HCO 3和a mol NaOH 恰好完全反应,则溶液中NH 4HCO 3的物质的量为0.5a mol ,取另一份溶液加入含b mol HCl 的盐酸,也恰好反应完全,其中NH 4HCO 3反应掉的HCl 的物质的量为0.5a mol ,则由Na 2CO 3反应掉 的HCl 的物质的量为(b -0.5a )mol ,可得Na 2CO 3的物质的量为12×(b -0.5a )mol ,
第6讲物质的量浓度及其溶液的配制 学习目标: 1、理解溶液、溶解度、物质的量浓度的概念 2、了解配制一定物质的量浓度溶液的方法及会进行误差分析 3、能进行物质的量浓度的相关计算 【思维导图】 溶解度质量分数物质的量浓度 c B=n B V基本概念原理 (c、w)计算配制仪器: (c、Vg) 步骤: 溶液稀释与混合误差分析: 活动一:关于物质的量浓度的溶液 1.N A代表阿伏加德罗常数。判断下列各项是否正确。 (1)1 mol·L-1 NaCl溶液含有N A个Na+() (2)将0.1 mol氯化铁溶于1 L水中,所得溶液含有0.1N A个Fe3+() (3)1 L 2 mol·L-1的MgCl2溶液中含Mg2+数为2N A () (4)1 mol 硫酸钾中阴离子所带电荷数为N A () (5)1 L 0.1 mol·L-1 Na2SO4溶液中有0.1N A个Na+() (6)常温下,1 L 0.1 mol·L-1的NH4NO3溶液中氮原子数为0.2N A () 2、某温度下,向100 g澄清的饱和石灰水中加入5.6 g生石灰,充分反应后恢复到原来的温度。下列叙述正确的是 ( ) A.沉淀物的质量为5.6 g B.沉淀物的质量为7.4 g C.饱和石灰水的质量大于98.2 g D.饱和石灰水的质量小于98.2 g 活动二:关于物质的量浓度的计算 1.将10.6 g Na2CO3溶于水配成1 L溶液该溶液中Na2CO3的物质的量浓度为__________,溶液中Na+的物质的量浓度为__________。 2、在一定温度下,某饱和氢氧化钠溶液体积为V mL,溶液密度为d g·cm-3,质量分数为w, 物质的量浓度为c mol·L-1,溶液中含氢氧化钠的质量为m g。 (1)用w来表示该温度下氢氧化钠的溶解度(S)为_______________________________。 (2)用m、V表示溶液中溶质的物质的量浓度(c)为______________________________。 (3)用w、d表示溶液中溶质的物质的量浓度(c)为______________________________。 (4)用c、d表示溶液中溶质的质量分数为____________________________________。 3、在标准状况下,将V L A气体(摩尔质量为M g·mol-1)溶于0.1 L水中,所得溶液的密度 为ρ g·cm-3,则此溶液的物质的量浓度(mol·L-1)为()
配制一定物质的量浓度的溶液练习题及答案 【典型例题】 类型一、一定物质的量浓度溶液配制的注意事项 例1.欲配制250mL 1mol/L 稀硫酸,用量筒量取______mL 98%密度为1.84g/cm3的浓硫酸,再用______取适量蒸馏水,将______缓慢注入到______中,并用______不断搅拌,待溶液______后,将溶液沿玻璃棒移入______中,用少量蒸馏水洗涤______和______ 2-3次,将洗涤液移入______中。向容量瓶中注入蒸馏水至距刻度线______ 时,改用______小心加水至溶液液面最低处与刻度线相切。最后盖好瓶塞,将配好的溶液转移到______中并贴好贴签。 【答案】13.6烧杯浓硫酸水玻璃棒冷至室温容量瓶烧杯玻璃棒 容量瓶1-2 cm 胶头滴管试剂瓶 【解析】V =0. 25L×1mol/L× 98g /mol÷98% ÷1.84g /cm3 =13.6 mL 【总结升华】掌握配制溶液的注意事项 举一反三: 【变式1】实验室中需要配制2 mol/L的NaCl溶液950 mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是() A.950 mL 111.2 g B.500 mL 117 g C.1000 mL 117 g D.任意规格111.2 g 【答案】C 类型二:一定物质的量浓度的溶液配制方法 例2.(2015 广东培正期中考)实验室用NaOH固体配制250mL 1.25mol/L的NaOH溶液,填空并请回答下列问题: (1)配制时必须的玻璃仪器有:烧杯、玻璃棒、、。 (2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次); A、用30mL水洗涤烧杯2﹣3次,洗涤液均注入容量瓶,振荡 B、用天平准确称取所需的NaOH的质量,加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解 C、将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中 D、将容量瓶盖紧,颠倒摇匀 E、改用胶头滴管加水,使溶液凹面恰好与刻度相切 F、继续往容量瓶内小心加水,直到液面接近刻度1﹣2cm处 (3)下列配制的溶液浓度偏低的是; A、称量NaOH时,砝码错放在左盘 B、向容量瓶中转移溶液时(实验步骤C)不慎有液滴洒在容量瓶外面 C、加蒸馏水时不慎超过了刻度线 D、定容时俯视刻度线
溶液的配制及分析(第二课时) 一、教学目标 ①知识与技能: (1)初步学会配制一定物质的量浓度溶液的方法和技能,了解容量瓶的的 使用方法。 (2)学会根据实验现象,对实验误差的分析。 ②过程与方法: (1)通过设计出适合的定容仪器,学会根据实验需要选择实验仪器的方法。 (2)通过设计实验步骤、选用仪器和分析误差,培养学生的逻辑思维和抽 象概括的能力。 (3)通过实现保障实验的关键出发,掌握优化实验操作步骤的科学方法。 ③情感态度价值观: (1)通过设计适合仪器解决实验问题,感知从实际出发解决问题的科学态 度。 (2)重视实验态度和实验习惯的形成,培养学生严谨、求实的科学作风。 二、教学重、难点 容量瓶的使用、一定物质的量浓度溶液的配制方法、误差的分析 三、 教学方法 本课主要采用讲述观察法、分析法等教学方法,用实验促进学生对知识的掌 握。 四、 教学用具 100ml 容量瓶、玻璃棒、烧杯、Na 2CO 3 固体、滴管、天平、称量纸、药匙、 蒸馏水 五、教学过程 【导入】1、农药的稀释(比较模糊的浓度)2、非典 SARA 时期的消毒药 水有一定的浓度(比较精确的配制)比较引出如何精确配制浓度。 大家请看我手里的这个试剂瓶,仔细看上面的标签,0.1mol/L 的 Na CO 溶液。 2 3 这个 0.1mol/L 就代表着物质的量浓度。如这类一定量物质浓度的溶液,在我们 实验室里,都是实验员配制好的。那他们是如何配制的?我想请大家根据自己的 经验讨论下。 【交流与讨论】如何配制的 100ml 的 0.100mol/L 的 Na CO 溶液? 2 3 1、将 Na CO 固体放入烧杯,再加入水到 100ml 的刻度线,所配得的溶液的 2 3 物质的量浓度为 0.100mol/L 。 2、将 Na CO 固体放入量筒中,再加入水达到 100ml 的刻度线,所配得的溶 2 3 液的物质的量浓度为 0.100mol/L…… 【分析】以上方案都不能准确配制溶液,烧杯无法准确量取溶液体积,量筒 不可以用来配制溶液。配制一定物质的量浓度的溶液时,最重要的是需要准确控 制溶液的最终体积,那么我们应该选用什么样的仪器来配制该溶液(烧杯?量 筒?)由于关键问题是体积的标定,所以,我们就重新得到了这样一种可以定容
物质的量浓度及其溶液的配制 1.用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是( ) [解析] A 项,托盘天平使用时应“左物右码”,图为“左码右物”,错误;C 项,移液时不能将烧杯中的溶液直接倒入容量瓶,应用玻璃棒引流,错误;D 项,胶头滴管应在容量瓶口垂直正上方,不能伸入瓶口,错误。 [答案] B 2.下列溶液中,溶质的物质的量浓度不是1 mol·L -1的是( ) A .10 g NaOH 固体溶解在水中配成250mL 溶液 B .将80 g SO 3溶于水并配成1 L 的溶液 C .将0.5 mol·L -1的NaNO 3溶液100 mL 加热蒸发掉50 g 水的溶液 D .标况下,将22.4 L 氯化氢气体溶于水配成1 L 溶液 [解析] A 项:c (NaOH)=10 g 40 g·mol -10.25 L =1 mol·L -1;B 项:c (H 2SO 4)=80 g 80 g·mol -11 L =1 mol·L -1;C 项:蒸发50 g 水后,溶液的体积并不是50 mL ,NaNO 3的物质 的量浓度也不是1 mol·L -1;D 项:c (HCl)=22.4 L 22.4 L·mol -11 L =1 mol·L -1。 [答案] C 3.4℃时,在100 mL 水中溶解22.4 L HCl 气体(标准状况下)形成溶液。下列说法正确的是( ) A .该溶液的物质的量浓度为10 mol·L -1 B .由于溶液的密度未知,故该溶液的物质的量浓度无法求得 C .由于溶液的密度未知,故该溶液中溶质的质量分数无法求得 D .所得溶液的体积为22.5 L [解析] 溶液的物质的量浓度c B 等于溶质的物质的量除以溶液的体积,而不
2021届一轮复习训练一 物质的量浓度及其配制 1.[2019·河北模拟] 用固体样品配制一定物质的量浓度的溶液,需经过计算、称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是() 答案:B 解析:称量固体物质的质量时,砝码放在右盘,物质放在左盘,A错误;溶解固体时用玻璃棒进行搅拌,可加速溶解,B正确;转移液体时应用玻璃棒引流,C错误;定容时,不能将胶头滴管伸入容量瓶内,D错误。 2.将5 mol·L-1盐酸10 mL稀释到200 mL,再取出5 mL,这5 mL溶液的物质的量浓度是() A.0.05 mol·L-1B.0.25 mol·L-1 C.0.1 mol·L-1D.0.5 mol·L-1 答案:B 解析:设稀释后盐酸的物质的量浓度为c,则:10 mL×5 mol·L-1=200 mL×c,解得c=0.25 mol·L-1。由于溶液是均匀的,所以取出的5 mL盐酸的浓度等于稀释后盐酸的浓度为0.25 mol·L-1,故选B。 3.需要配制500 mL 0.5 mol·L-1氢氧化钠溶液,经测定实际所配氢氧化钠溶液的浓度为0.45 mol·L-1。可能原因是() A.定容时溶液没有冷却至室温 B.容量瓶没有烘干 C.称量氢氧化钠固体时砝码放反了 D.定容时仰视读数 答案:D 解析:溶液未冷却至室温导致所配溶液体积偏小,则浓度偏高,A错误;容量瓶没有烘干,对所配溶液的浓度没有影响,B错误;本实验需称量10.0 g氢氧化钠固体,不用游码,砝码放反对结果没有影响,C错误;定容时仰视读数,读数小于实际体积,即配制的溶液浓度偏小,D正确。 4.[2019·陕西西安中学模拟]为了配制100 mL 1mol·L-1NaOH溶液,下列操作错误的是() ①选刚用蒸馏水洗净的100 mL容量瓶进行配制 ②NaOH固体在烧杯里刚好完全溶解,立即把溶液转移到容量瓶中 ③用蒸馏水洗涤烧杯内壁两次,洗涤液都移入容量瓶中 ④使蒸馏水沿着玻璃棒注入容量瓶,直到溶液的凹液面恰好与刻度线相切 ⑤由于不慎,液面超过了容量瓶的刻度线,这时采取的措施是使用胶头滴管吸出液体超过的一部分 A.②④⑤B.①⑤ C.②③⑤D.①② 答案:A 解析:①配制100 mL 1 mol·L-1的NaOH溶液,应选择100 mL容量瓶,因为容量瓶定容时仍需要加蒸馏水,所以使用前不需要干燥,正确;②NaOH溶于水时放热,所以在配制溶液时不能立即把溶液转移到容量瓶中,错误;③用蒸馏水洗涤
初中化学配制一定物质的量浓度溶液练习 题 【巩固练习】 一.选择题(每小题有1-2个选项符合题意) 1.下列说法中,正确的是( )。 A .1 L 水中溶解了40 g NaOH 后,所得溶液浓度为1 mol/L B .从1 L 2 mol/L 的NaCl 溶液中取出0.5 L ,该溶液的浓度为1 mol/L C .将标准状况下的HCl 气体2.24 L 通入水中制成100 mL 溶液,所得溶液的物质的量浓度为1 mol/L D .配制1 L 0.2 mol/L 的CuSO 4溶液,需用25 g 胆矾 2.(2017秋?启东市校级月考)下列实验操作中,所用仪器合理的是( ) A .在蒸发皿中放入NaCl 溶液,加热、蒸发得到NaCl 晶体 B .用10 mL 的量筒量取5.2 mL 的盐酸 C .用托盘天平称取25.20 g NaCl D .用1 000 mL 容量瓶配制450 mL 0.1 mol?L ﹣1的盐酸 3.(2016 广西南宁八中期末考)实验室中需要配制2mol/L 的NaCl 溶液950mL ,配制时应选用的容量瓶的规格和称取的NaCl 质量分别是( )。 A . 950 mL ,111.2 g B . 500 mL ,117 g C . 1 000 mL ,117 g D . 任意规格,111.2 g 4.用已准确称量过的氯化钠固体配制1.00mol ?L ﹣1 的氯化钠溶液0.5L ,要用到的仪器是( )。 ①500mL 容量瓶 ②试管 ③烧瓶 ④胶头滴管 ⑤烧杯 ⑥玻璃棒 ⑦托盘天平 ⑧药匙. A . ①④⑤⑥⑦⑧ B . ①②④⑤ C . ①④⑤⑥ D .全部 5.等质量的CuO 和MgO 粉末分别溶于相同体积的硝酸中,得到的Cu(NO 3)2和Mg(NO 3)2溶液的浓度分别为a mol·L —1和 b mol·L —1,则a 与b 的关系为( )。 A .a =b B. a =2b C. 2a =b D. a =5b 6.某温度下100 g 饱和氯化钠溶液中含有氯化钠26.5 g 。若向此溶液中添加3.5 g 氯化钠和 6.5 g 水,则所得溶液的溶质质量分数是( )。 A. 30% B. 5.61005.35.26++×100% C. 26.5% D. 5.35.61005.35.26+++×100% 7.(2016 河南省信阳市第一职业高中期中考)某温度下向100g 澄清的饱和石灰水中加入 5.6g 生石灰,充分反应后恢复到原来的温度。下列叙述正确的是 ( )。 A .沉淀物的质量为5.6g B .沉淀物的质量为7.4g
物质的量浓度的有关计算 1.0.3 mol NaCl 固体溶于水配成200 mL 溶液,溶液浓度为 ( ) A .0.3 mol·L -1 B .0.15 mol·L -1 C .1.5 mol·L -1 D .0.015 mol·L -1 答案 C 解析 c (NaCl)=0.3 mol 0.2 L =1.5 mol·L -1。 2.50 mL 0.6 mol·L -1 NaOH 溶液,含NaOH 的物质的量为 ( ) A .0.03 mol B .0.04 mol C .0.05 mol D .0.06 mol 答案 A 解析 n (NaOH)=0.05 L×0.6 mol·L -1 =0.03 mol 。 3.下列溶液中Cl - 的物质的量浓度与100 mL 1 mol·L -1 MgCl 2溶液中Cl - 的物质的量浓度相同的是( ) A .50 mL 2 mol·L -1 CaCl 2溶液 B .100 mL 2 mol·L -1 NaCl 溶液 C .50 mL 4 mol·L -1 CaCl 2溶液 D .100 mL 4 mol·L -1 NaCl 溶液 答案 B 解析 题干中溶液中Cl - 的物质的量浓度为2 mol·L -1 。各选项中Cl - 的物质的量浓度分别为A 中4 mol·L -1 ;B 中2 mol·L -1 ;C 中8 mol·L -1 ;D 中4 mol·L -1 ,故选B 。 4.在0.5 L 某浓度的NaCl 溶液中含有0.5 mol Na + ,下列对该溶液的说法中不正确的是( ) A .该溶液的物质的量浓度为1 mol·L -1 B .该溶液中含有58.5 g NaCl C .配制100 mL 该溶液需用5.85 g NaCl D .量取100 mL 该溶液倒入烧杯中,烧杯中Na + 的物质的量为0.1 mol 答案 B 解析 c (NaCl)=0.5 mol 0.5 L =1 mol·L -1,A 项正确;m (NaCl)=0.5 mol×58.5 g·mol -1=29.25 g , B 项错误;100 mL 溶液中含NaCl 的质量为5.85 g ,物质的量为0.1 mol , C 、 D 项正确。 5.300 mL 某浓度的NaOH 溶液中含有60 g 溶质。现欲配制成1 mol·L -1 的NaOH 溶液,应取原溶液与蒸馏水的体积比约为( ) A .1∶4 B .1∶5 C .2∶1 D .2∶3
物质的量浓度、物质的量浓度溶液的配制、 物质的量浓度和质量分数之间及溶液中的的计算 1、将4gNaOH溶解在10mL水中,再稀释在1L,从中取出10mL这10mL溶 液的物质的量浓度是() A.1mol/L B. 0.1mol/L C. 0.01mol/L D. 10mol/L 2、下列各溶液中,Na+浓度最大的是 A.0.8L0.4mol/L 的NaOH溶液 B. 0.2L0.15mol/L 的NaPO溶液 C. 1L0.3mol/L 的NaCI 溶液 D. 4L0.5mol/L 的NaCI 溶液 3、下列溶液中Cl-离子浓度与50mL 1mol/L AlCl 3溶液中的Cl-离子浓度相等 的是() A.150mL 1mol/L 的NaCI 溶液. B.75mL 2mol/L 的NHCI 溶液. C.150mL 3mol/L 的KCI 溶液. D.75mL 1mol/L 的FeCb溶液. 4、在5L NaSO溶液中含有NeO■离子4.6g,则溶液中SO?离子的物质的量浓度 为 -1 -1 -1 -1 A.0. 2mol ?L B.0. 04 mol ?L C.0. 08 mol ?L D.0. 02mol ?L 5、由NaSO和NaN卸成的混合物88g溶于水配制成1L溶液,此溶液中Na 的浓 度为1.2moI/L,则原混合物中NaNO勺质量为 A.17g B. 34g C. 25.5g D. 51g & 30mL1moI/L NaCI溶液和40mL 0.5moI/L CaCI 2溶液混合后,混合液中Cl-浓度为() A.0.5mol/L B.0.6mol/L C.1.00mol/L D.2mol/L 7、关于浓度2mol ? L-1的MgC2溶液,下列叙述正确的是() A.1L水中溶解了2moIMgC2固体 B.1L 溶液中含有2X 6.02 X 1023CI- C.取0.5L该溶液,则Mg+的物质的量浓度为1mol ? L-1 D.0.5L溶液中,Mg和CI-的离子总数为3X 6.02 X 1023个 8、N K为阿伏加德罗常数,下列对0.3moI/L硫酸钾溶液的说法中,正确的是 A.1L溶液中含0.3N A个K+ B.1L 溶液中含0.9N A个离子 C.2L溶液中K浓度是1.2moI/L D.2L 溶液中含0.6N A个离子 9、8g无水硫酸铜配成0.1moI/L的水溶液,下列说法正确的是(
一定物质的量浓度溶液 的配置实验 Revised as of 23 November 2020
一定物质的量浓度溶液的配制 目的:让学生学会配制一定物质的量的浓度的溶液,熟悉操作步骤,及学会误差分析。重点难点:操作步骤及误差分析。 教学过程: 一、配制500ml, mol/l碳酸钠溶液所需的仪器: Φ烧杯、容量瓶、玻璃棒、胶头滴管、托盘天平、药匙、量筒。 步骤: 第一步:计算:所需碳酸钠的质量=**106=克。 第二步:称量:在天平上称量克碳酸钠固体,并将它倒入小烧杯中。 第三步:溶解:在盛有碳酸钠固体的小烧杯中加入适量蒸馏水,用玻璃棒搅拌,使其溶解。 第四步:移液:将溶液沿玻璃棒注入500ml容量瓶中。 第五步:洗涤:用蒸馏水洗烧杯2—3次,并倒入容量瓶中。 第六步:定容:倒水至刻度线1—2cm处改用胶头滴管滴到与凹液面平直。 第七步:摇匀:盖好瓶塞,上下颠倒、摇匀。 第八步:装瓶、贴签 二、讨论:在配制溶液中哪些操作可能引起溶液浓度的误差 Φ误差分析: Φ固体药品的称量与液体药品的量取是否准确; Φ把溶液向容量瓶中转移,溶液洒了; Φ未洗涤烧杯和玻璃棒; Φ用待配液润洗了容量瓶; Φ定容时水加多了或加少了; Φ定容时未平视刻度线。 讨论:仰视、俯视对溶液浓度有何影响 Φ俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大;Φ仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。三、容量瓶的使用六忌:Φ一忌用容量瓶进行溶解(体积不准确)Φ二忌直接往容量瓶倒液(洒到外面)Φ三忌加水超过刻度线(浓度偏低)Φ四忌读数仰视或俯视(仰视浓度偏低,俯视浓度偏高)Φ五忌不洗涤玻璃棒和烧杯(浓度偏低)Φ六忌标准液存放于容量瓶(容量瓶是量器,不是容器)四、练习:欲配制1mol/L的氢氧化钠溶液250mL,完成下列步骤:①用天平称取氢氧化钠固体克。②将称好的氢氧化钠固体放入烧杯中加少量蒸馏水将其溶解,待后将溶液沿移入mL的容量瓶中。③用少量蒸馏水冲洗次,将冲洗液移入中,在操作过程中不能损失点滴液体,否则会使溶液的浓度偏(高或低)。④向容量瓶内加水至刻度线时,改用小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成
配制一定物质的量浓度的溶液的方法 仪器:容量瓶、烧杯、胶头滴管、玻璃棒、天平、量筒 一:认识容量瓶 1. 容量瓶是一种细颈梨形平底的容量器,带有磨口玻塞,颈上有标线,表示在所指 温度下液体液体凹液面与容量瓶颈部的标线相切时,溶液体积恰好与瓶上标注的 体积相等。容量瓶上标有:温度、容量、刻度线。常用的容量瓶有100、250、 500毫升等多种规格。 2. 使用前检查瓶塞处是否漏水。具体操作方法是:在容量瓶内装入半瓶水,塞紧瓶 塞,用右手食指顶住瓶塞,另一只手五指托住容量瓶底,将其倒立(瓶口朝下), 观察容量瓶是否漏水。若不漏水,将瓶正立且将瓶塞旋转180°后,再次倒立,检 查是否漏水,若两次操作,容量瓶瓶塞周围皆无水漏出,即表明容量瓶不漏水。经 检查不漏水的容量瓶才能使用。 二:配制步骤:计算→称量→溶解或稀释→冷却→转移→洗涤→定容→摇匀→倒入试剂瓶、贴标签 (1)计算:所称固体的质量或所量液体的体积。 (2)称量或量取:用托盘天平称取所需溶质或用量筒量取浓溶液。 (3)溶液(稀释):在烧杯中溶解或稀释。溶解一般在小烧杯中进行。 (4)冷却:溶液静置至室温,防止出现误差。 (5)转移:转移时要用玻璃棒引流,且其下端应靠在容量瓶内壁上。 (6)洗涤:用蒸馏水洗涤小烧杯和玻璃棒2~3,目的是使溶质尽可能地转移到容量瓶中,以防止产生误差。 (7)定容:向容量瓶中加入水至刻度线1~2cm处,再改用胶头滴管定容至刻度。 (8)摇匀:塞好瓶塞,反复上下颠倒摇匀。 注意: ①溶液所用的水不能太多,若溶液用水和洗涤用水超过溶液总体积,则实验失败。 ②不能配制任意体积的一定物质的量浓度的溶液,因为在配置的过程中所配溶液的体积是 用容量瓶来定容的,而容量瓶的规格又是有限的。 ③因溶解过程大都伴随着吸热或放热过程的发生,会导致溶液温度低于或高于常温,所以 必须待烧杯中溶液温度恢复到室温时,才能将溶液移入容量瓶中。 ④使用容量瓶前必须先检查容量瓶是否漏水。 ⑤不能将溶质直接放入容量瓶中进行溶解,而要在烧杯中溶解。因为容量瓶的容积是在 20℃时标定的,溶解过程的吸热或放热导致溶液温度的变化会影响到溶液的体积,使配制的溶液的物质的量浓度不准确。 ⑥洗涤液必须移入容量瓶,之后还必须轻轻振荡容量瓶,使容量瓶中的溶液。充分混合均 匀 ⑦定容时,当缓缓加入蒸馏水到容量瓶中液面接近刻度1~2cm处时,改用胶头滴管滴加蒸 馏水至溶液的凹液面正好与刻度相切,视线应与刻度相平。 ⑧定容后的容量瓶在反复颠倒震荡后,会出现容量瓶中的液面低于刻度线的情况,这时不 能再向容量瓶中加入蒸馏水。
高一化学教学案 编制: 审核: 班级: 姓名: 执教人: 第 1 页 第 2页 总第 课时】 【 课型: 】 【时间】2016.9. 【学习目标】.学会容量瓶的使用方法,物质的量浓度溶液配制的实验操作和误差分析。 【重点难点】一定物质的量浓度溶液的配制方法。 学 习 过 程 课堂笔记/讲评设计 【 课 前 预 习 】 1. 容量瓶的外观特征是什么?它的具体用途有哪些?规格有哪些? 2.使用容量瓶应注意事项: ⑴使用前要检验容量瓶是否漏水; ⑵容量瓶不能用来存放试剂; ⑶溶质应该首先在烧杯中溶解或稀释并冷却至室温后再转移容量瓶中,原因是什么? 3.配制一定体积溶液应遵循哪些原则? 【合 作 探 究】 课题一.容量瓶的构造与使用 (1)容量瓶的构造 (2)容量瓶的使用 课题二:如何配制100 mL 含溶质的物质的量为0.04mol 的NaCl 溶液? 1.所需仪器: 2.实验步骤: (1) 通过计算,应该称取_________gNaCl 固体。 (2) 将准确称量后的固体放在___________中溶解,并冷却至室温。 (3) 将所得的溶液用玻璃棒引流,转移到容量瓶中。 (4) 洗涤用过的烧杯和玻璃棒_______次,并将洗涤液全部转移到容量瓶中。 (5) 向容量瓶中加水至离刻度线____时,改用胶头滴管加蒸馏水至溶液的凹液面与 刻度线相切。 (6) 盖好瓶塞,反复上下颠倒,摇匀。 (7) 将配制好的溶液转移到试剂瓶中,贴好标签并注明:药品名称、浓度、配制的日期。
3.你所配制的溶液用物质的量浓度表示其组成 【拓展提升】 若改为用18 mol / L的浓硫酸配制100 mL1 mol / L的稀硫酸,请写出实验步骤。 【练习1】 配制浓度约为2mol/L NaOH溶液100mL,下面的操作正确的是( ) A.称取8g NaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解 B.称取8g NaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL C.称取8g NaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 D.用100mL量筒量取40mL 4mol/LNaOH溶液,倒入250mL烧杯中,再用同一量筒量取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中 【记忆】溶液的配制过程及所用仪器 【练习2】.某学生计划用12 mol.L—1的浓盐酸配制0.10 mol.L—1的稀盐酸450 mL。回答下列问题: (1)量取浓盐酸的体积为_______mL,应选用的量筒规格为______。 (2)配制时应选用的容量瓶规格为_______。 (3)配制时(除容星瓶外)还需选用的仪器主要有_______、______、_______、_______和试剂瓶。 课题三配制一定物质的量浓度溶液的误差分析 配制100 mL l mol.L—1的氯化钠溶液,下列实验操作对实验结果有无影响?有何影响?请分析并填写下表: 配制步骤错误操作n V c ⑴计算计算结果m=5.85g,称5.9g ⑵称量 砝码生锈(没有脱落) 少量NaCl沾在滤纸上 ⑶溶解有少量液体溅出 ⑷转移容量瓶内有少量水 ⑸洗涤未洗涤或洗涤液未注入容量瓶 ⑹定容 仰视 超过刻度线,吸出一部分水 ⑺摇匀摇匀后液面下降,补充水 ⑻装瓶试剂瓶刚用蒸馏水洗过 【归纳总结】 1.误差分析依据 根据可知,M B为定值(溶质的摩尔质量),实验过程中不规范的操作会导致________的值发生变化,从而使所配制溶液的物质的量浓度产生误差。若实验操作导致m B偏大,则CB____;若实验操作导致V偏大,则CB____。 第页第页
第4讲物质的量浓度及一定物质的量浓度溶液的配制 [考纲解读] 1.能说出物质的量浓度的含义。2.能按要求配制一定物质的量浓度的溶液,会进行有关误差分析。3.会根据物质的量与溶液的体积、溶液的物质的量浓度之间的相互关系进行有关计算。 考点一 内容 物质的量浓度质量分数 定义以单位体积溶液里含有多 少摩尔溶质来表示溶液组 成的物理量 用溶质质量与溶液质量之 比来表示溶液组成的物理 量 溶质的单 位 溶液的单 位 计算公式 特别提醒这里V是溶液的体积,它不是溶剂的体积,也不是溶剂和溶质的体积之和。1.观察两个试剂瓶上的标签,回答下列问题。 (1)“5%硫酸铜溶液”中的5%是什么含义? (2)0.4 mol·L-1 NaCl溶液中的0.4 mol·L-1表示的含义是什么? (3)从上述两种溶液中分别取出5 mL,它们的浓度分别是、。2.在一定温度下,某饱和氢氧化钠溶液体积为V mL,溶液密度为d g·cm-3,质量分数为w,物质的量浓度为c mol·L-1,溶液中含氢氧化钠的质量为m g。 (1)用w来表示该温度下氢氧化钠的溶解度(S)为_________________________________。 (2)用m、V表示溶液中溶质的物质的量浓度(c)为_________________________________。 (3)用w、d表示溶液中溶质的物质的量浓度(c)为__________________________________。 (4)用c、d表示溶液中溶质的质量分数为_________________________________________。3.有硫酸镁溶液500 mL,它的密度是1.20 g·cm-3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是( ) A.溶质的质量分数是24.0% B.溶液的物质的量浓度是2.4 mol·L-1
第四课时物质的量浓度配制(实验及误差分析) 【实验(阅读教材P16[实验1-5]内容,完成下列填空】 一、重要仪器 1、容量瓶的使用 (1)容量瓶上标注有:。 (2)常见规格有: (3)容量瓶是配制物质的量浓度溶液的专用仪器,选择容量瓶应遵循“大而近”的原则: (4)使用容量瓶注意“五不”:①;②;③;④;⑤。 (5)使用前要检验容量瓶是否漏水。检验程序: 二、配制一定物质的量浓度的溶液的实验步骤:(阅读教材P16[实验1-5]内容,完成下列填空) 1、计算: 2、称量:若用托盘天平称取NaCl固体_______g 3、溶解:将称好的NaCl固体放入_______中,加入适量的蒸馏水溶解,用______搅拌,并冷却至室温。 4、移液:将烧杯中的溶液用_________小心地引流到指定容量瓶中, 5、洗涤:用蒸馏水洗涤烧杯内壁________次,并将洗涤液都要注入__________,轻轻摇动,使溶液混合均匀。 6、定容:缓缓地将蒸馏水注入到容量瓶中,直到容量瓶中的液面接近容量瓶颈刻度线下_______处,改用________滴加蒸馏水至__________。 7、摇匀:盖好瓶活塞,反复上下颠倒,摇匀。 三、配制100 mL 1 mol·L-1的氯化钠溶液,下列实验操作对实验结果有无影响?有何影响?请分 强化训练: 1、用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是( ) A.干燥的 B.瓶塞不漏水 C.用与所配溶液同浓度的溶液润洗过的 D.以上三项都符合的
2、在0.5L某浓度的NaCl溶液中含有0.5mol NaCl,下列对该溶液的说法中,不正确的是( ) A.该溶液溶质的物质的量浓度为1mol/L B.该溶液中含有58.5g NaCl C.配制100mL该溶液需用5.85g NaCl D.量取100mL该溶液倒入烧杯中,烧杯中NaCl物质的量为0.1mol 3、下列配制的溶液浓度偏高的是( ) A.配制盐酸用量筒量取盐酸时俯视刻度线 B.配制盐酸定容时,仰视容量瓶刻度线 C.称量4.0 g NaOH配制0.1 mol·L-1 NaOH溶液 1 000 mL 时,砝码错放在左盘 D.NaOH溶解后未经冷却即注入容量瓶至刻度线 4、实验室里需用480mL 0.1mol/L的硫酸铜溶液,现配制该溶液,以下操作正确的是()A.称取7.68g硫酸铜,加入500mL水 B.称取12.0g胆矾配成500mL溶液 C.称取8.0g硫酸铜,加入500mL水 D.称取12.5g胆矾,配成500mL溶液 5、实验室用氢氧化钠固体配制1.00 mol·L-1的NaOH溶液500 mL,回答下列问题。 (1)请补充完整实验的简要步骤: ①计算;②称量NaOH固体_____ g;③溶解;④冷却并移液;⑤洗涤并转移;⑥_____;⑦摇匀。 (2)本实验用到的基本仪器已有烧杯、天平(带砝码)、镊子、量筒、玻璃棒,还缺少的仪器是________、________。 (3)上述实验操作②③都要用到小烧杯,其作用分别是__________和_________。 (4)如图是该同学转移溶液的示意图,图中有两处错误,请写出: ①______________________;②______________________________。 (5)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是________。 A.转移溶液时不慎有少量液体洒到容量瓶外面 B.定容时俯视刻度线 C.未冷却到室温就将溶液转移到容量瓶并定容 D.定容后塞上瓶塞反复摇匀,静置后,发现液面低于刻度线,再加水至刻度线 6、实验室用18mol·L-1浓H2SO4配制1.5mol·L-1稀H2SO4溶液250mL。 实验步骤如下:①容量瓶使用前,必须________________________; ②计算所需浓H2SO4体积为________; ③用量筒量取所需浓H2SO4; ④稀释浓H2SO4的方法(简要操作)是_________________________________________________; ⑤释释后的浓H2SO4应________再转移至容量瓶中; ⑥向容量瓶中继续加水至刻度1~2cm处,改用胶头滴管逐滴加水,使溶液的凹面与刻度线恰好相切,然后倒转摇匀。 请回答下列问题: (1)完成上述实验步骤中的填空内容。 (2)该实验中尚缺少的一步操作是________,如果缺少这一步操作,将会导致所配制的硫酸浓度________(填“偏小”、“偏大”、“无影响”) (3)下列操作将会导致所配制的硫酸浓度偏低的是________; A.第③步时仰视读数 B.第⑥步时仰视读数 C.第⑥步倒转摇匀后发现液面低于刻度线,又加水至刻度线