
丁二烯理化性质与质量指标
1.1 丁二烯的基本概况
产品名称:1,3-丁二烯;别名:二乙烯、丁间二烯、乙烯基乙烯;
英文名称:1,3-butadiene;
英文别名:Biethylene、Erythrene、Vinylethylene。
分子式: C4H6或H2CCHCHCH2
分子量:54.09
CAS 登录号:106-99-0
图1.1 丁二烯结构式
丁二烯通常指1, 3-丁二烯,又称乙烯基乙烯,是一种重要的石油化工基础原料,是C4馏分中最重要的组分之一,在石油化工烯烃原料中的地位仅次于乙烯和丙烯。
丁二烯分子式为C4H6,由于其分子中含有共扼二烯,可以发生取代、加成、环化和聚合等反应,在有机合成方面具有广泛的用途,可以合成聚丁二烯橡胶(BR)、丁苯橡胶(SBR)、丁腈橡胶、苯乙烯-丁二烯-苯乙烯弹性体(SBS)、丙烯腈-丁二烯-苯乙烯( ABS )树脂等多种产品,此外还可用于生产己二腈、己二胺、尼龙-66、1,4-丁二醇等有机化工产品以及用作粘接剂、汽油添加剂等,用途十分广泛。
1.2 丁二烯的理化性质
丁二烯又称丁间二烯,分子式C4H6,分子量54.09。在常温下为无色、有芳香味、有毒气体,是一种极易液化的无色气体,与空气可形成爆炸性混合气体。稍溶于水,水中溶解度为0.38%。易溶于丙酮、苯等有机溶剂,易聚合,有氧存在下更易聚合。蒸汽密度为1.9kg/m3;相对密度0.6211(在20℃下的液体);溶点-139℃;沸点-4.41℃;自燃点414℃;蒸汽压101.3Kpa(-4.5℃);闪点-76℃;冰点-108.9℃;易燃;爆炸极限2.16~11.47℃(体积)。
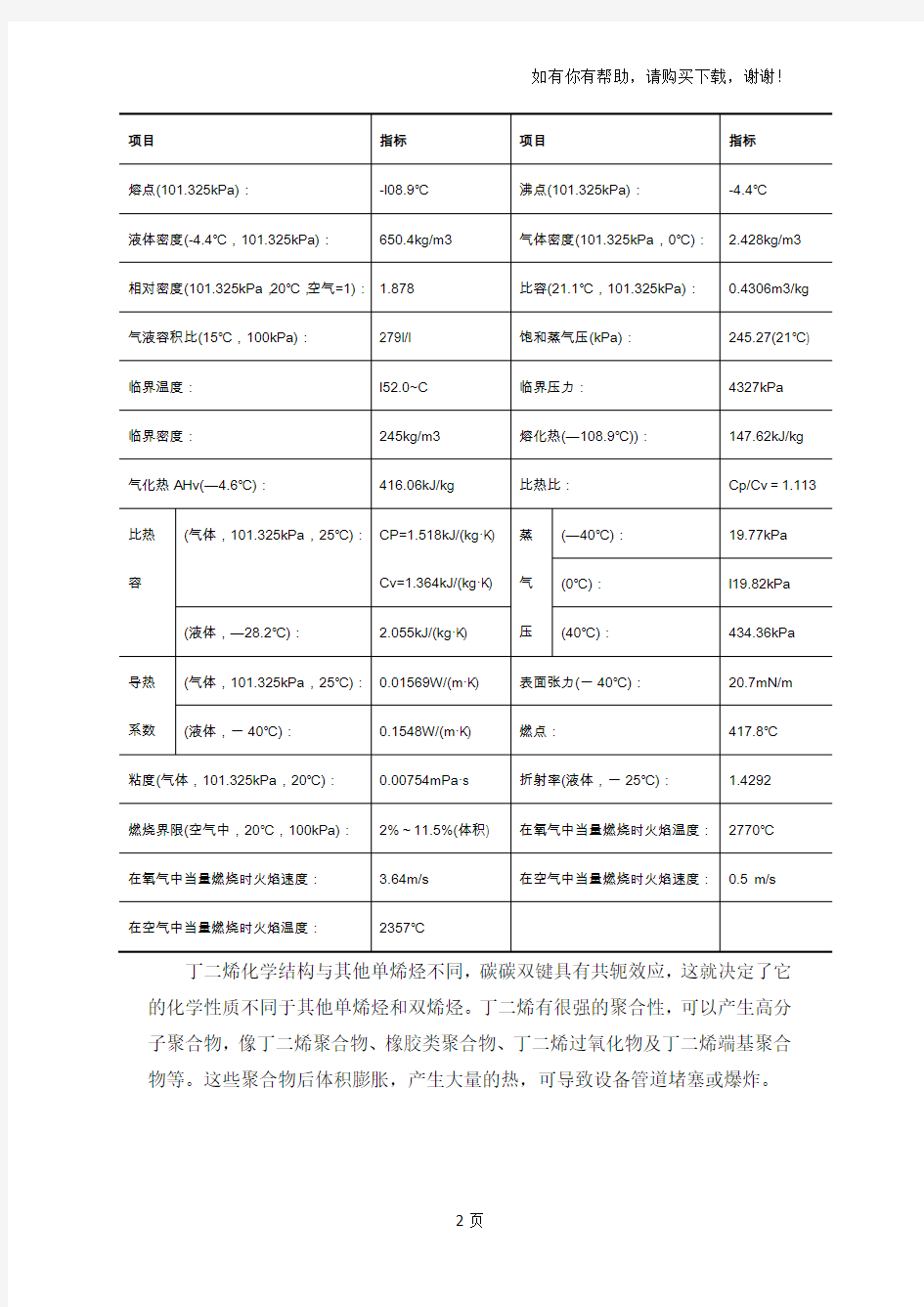
表1.1 丁二烯的理化性质表
项目指标项目指标
熔点(101.325kPa):-l08.9℃沸点(101.325kPa):-4.4℃
液体密度(-4.4℃,101.325kPa):650.4kg/m3 气体密度(101.325kPa,0℃): 2.428kg/m3 相对密度(101.325kPa,20℃,空气=1): 1.878 比容(21.1℃,101.325kPa):0.4306m3/kg 气液容积比(15℃,100kPa):279l/l 饱和蒸气压(kPa):245.27(21℃) 临界温度:l52.0~C 临界压力:4327kPa
临界密度:245kg/m3 熔化热(—108.9℃)):147.62kJ/kg 气化热AHv(—4.6℃):416.06kJ/kg 比热比:Cp/Cv=1.113
比热容(气体,101.325kPa,25℃):CP=1.518kJ/(kg·K)
Cv=1.364kJ/(kg·K)
蒸
气
压
(—40℃):19.77kPa
(0℃):l19.82kPa (液体,—28.2℃): 2.055kJ/(kg·K) (40℃):434.36kPa
导热系数(气体,101.325kPa,25℃):0.01569W/(m·K) 表面张力(一40℃):20.7mN/m (液体,一40℃):0.1548W/(m·K) 燃点:417.8℃
粘度(气体,101.325kPa,20℃):0.00754mPa·s 折射率(液体,一25℃): 1.4292
燃烧界限(空气中,20℃,100kPa):2%~11.5%(体积) 在氧气中当量燃烧时火焰温度:2770℃
在氧气中当量燃烧时火焰速度: 3.64m/s 在空气中当量燃烧时火焰速度:0.5 m/s 在空气中当量燃烧时火焰温度:2357℃
丁二烯化学结构与其他单烯烃不同,碳碳双键具有共轭效应,这就决定了它的化学性质不同于其他单烯烃和双烯烃。丁二烯有很强的聚合性,可以产生高分子聚合物,像丁二烯聚合物、橡胶类聚合物、丁二烯过氧化物及丁二烯端基聚合物等。这些聚合物后体积膨胀,产生大量的热,可导致设备管道堵塞或爆炸。
1.3 丁二烯的危险性及产生危害
(一)易燃、易爆。丁二烯与空气混合能形成爆炸性混合物,遇明火、高热能引起燃烧爆炸。其蒸汽比空气重,能在较低处扩散到相当远的地方,遇明火会引着回燃。若遇高热,可能发生聚合反应,出现大量放热现象,引起容器破裂和爆炸事故。
(二)易自聚。丁二烯极易发生自聚,其自聚物有丁二烯聚物、像胶壮自聚物、丁二烯过氧化自聚物和端基聚合物四种形式。
丁二烯受热发生二聚反应,生成4-乙烯基环已烯。同时,丁二烯二聚物是丁二烯的热聚物。二聚物常温下为液体,具有流动性,沸点116℃,可以与丁二烯以任何比例溶。
通常,丁二烯二聚物没有易燃、易爆危险性,在少量时可看作作丁二烯杂质,而量多时则会影响产品生产过程中丁二烯的聚合。橡胶壮自聚物是一种丁二烯的热聚合物,进入聚合系统,会影响橡胶的物理机械性能,并易堵塞设备和管路。丁二烯在氧存在下易发生过氧化反应,形成过氧化物。丁二烯过氧化自聚物为浅黄色粘稠液体,相对分量为800左右,比重比丁二烯大,易沉积并积累于设备的死角处,其性质很不稳定,受撞击或急剧加热时会迅速分解自燃引起爆炸。同时,它能分解产生活性自由基,能引发丁二烯进行端基聚合,生成米花壮固体聚合物—端基聚合物(端聚物)。当端聚物粒子增长超过一定限度时,链增长成为无终止反应,造成端聚物的迅速增多和急剧膨胀。当端聚物粒子增长超过一不定期限度时,丁二烯聚合热很难排出,形成局部过热,导致过氧化物急剧而引发爆炸。丁二烯过氧化自聚反应为自催化反应。丁二烯端基聚合物一种高度交联的树脂状聚合物。如果系统不干净,聚合物常被铁锈、铁离子污染而成深黄、深茶花或咖啡色。大块的丁二烯端聚物酷似爆米花,故称为米花状聚合物(Popcorn-polymer)。端基聚合物化学性质十分活泼,易发生自由基连锁聚合,易燃易爆,给生产和储存工作带来相当大的潜在危险。
(三)易自燃。在一定压力下,液态丁二烯极易吸附在端基聚合物的小孔中,用氮气无法将丁二烯置换出来。当设备内氧含量超标,自聚物受热或被低压蒸汽加热时,蒸发出的丁二烯与设备内空气中的氧气结合生成过氧化物会分解自燃,并很快将自聚物引燃。自聚物易胀裂阀门和管道。丁二烯常因在阀门和管道内积
氨基酸的理化性质 生化 1. 氨基酸的理化性质两 性解离等电点紫外吸收 核酸的紫外吸收最大值 2. 蛋白质的分子结构 一级顺序肽键二硫键 二级主链氢键三级全部疏水作用离子键氢键范德华力四级亚基氢键离子键3. 蛋白质的变性 空间构象破坏理化性质改变生物活性丧失 4. DNA 双螺旋结构 反向平行互补双链 = = 手螺旋 横纵 5. 转运 RNA 结构 稀有碱基 茎环结构二级 三级 6. DNA 变性 氢键断裂只改变二级不改变核苷酸排列 增色效应解链吸光值增加 融解温度 Tm 紫外吸收值达最大的 %时的温度 7. 酶结构
结合酶酶蛋白 辅助因子辅酶 辅基 必需集团活性中心结合集团 催化集团 8. 值等于 2005Y25,一个简单的酶促反应,当[S] Km A,反应速度最大 B,反应速度太 慢难以测出 C,反应速度与底物浓 度成正比 D,增加底物浓度反应速 1 度不变 E,增加底物浓度反应速度 降低时 9. 可逆性抑制 竞争性非竞争性反竞争性 Km 丙二酸琥珀酸脱氢酶琥珀酸 磺胺二氢叶酸合成酶对氨基苯甲酸 2 10. 变构酶 速度方程式米氏方程,呈型曲线 多为 多亚基构成, 亚基, 亚基: 中心, 中心:
11. 同工酶 催化化学反应 ,分子结构理化性质免疫学性质乳酸脱氢 LDH1 LDH2 LDH3 LDH5 酶 肌酸激酶 CK1 CK2 CK3 12. 糖酵解的调节 6-磷酸果糖激酶-1 激活 AMP、ADP 1,6-双磷酸果糖: :、2,6-双磷酸果糖: : 抑制 ATP、柠檬酸 丙酮酸激酶激活 1,6-双磷酸果糖 抑制 ATP、丙氨酸 己糖激酶抑制长链脂酰 CoA 13. 底物水平磷酸化 1,3-二磷酸甘油酸 3-磷酸甘油酸磷酸甘油酸激酶 磷酸烯醇式丙酮酸丙酮酸丙酮酸激酶 琥珀酰 CoA 琥珀酸琥珀酰 CoA 合成酶脱氢 琥珀酸延胡索酸琥珀酸脱氢酶 14. 糖异生 己糖激酶葡萄糖-6-磷酸酶 6-磷酸果糖激酶-1 果糖双磷酸酶-1 丙酮酸激酶丙酮酸羧化酶 磷酸烯醇式丙酮酸羧激酶 乙酰 CoA 丙酮酸羧化酶 丙酮酸脱氢酶 15. 脂酸氧化
第13讲金属的化学性质 一、选择题 1.(2018,广州)将铜丝插入溶液中,有明显现象的是( B ) A.HCl溶液 B.AgNO3溶液 C.MgSO4溶液 D.Ba(OH)2溶液 2.(2018,百色)现有X、Y、Z三种金属,将X、Y、Z分别投入稀硫酸中,只有Y表面有气泡放出,X和Z 无变化,将X放入Z的硝酸盐溶液中,X表面无变化。则X、Y、Z三种金属活动性由强到弱的顺序是( D ) A.X>Y>Z B.Y>X>Z C.Z>X>Y D.Y>Z>X 3.(2018,成都)金属与盐酸的反应的示意图如图所示,下列说法正确的是( B ) A.实验室可用铜和稀盐酸制氢气 B.四种金属中活动性最强的是镁 C.铁可以把锌从硫酸锌溶液中置换出来 D.铁与稀盐酸反应的化学方程式为:2Fe+6HCl===2FeCl3+3H2↑ 4.(2018,娄底)托盘天平左、右两边各放一只质量相等的烧杯,在两只烧杯中均加入等质量、等质量分数的稀盐酸,此时天平保持平衡。然后在左盘烧杯中加入5 g锌粒,在右盘烧杯中加入5 g铁粉,充分反应后,两烧杯底部均有固体剩余,则此时天平( C ) A.偏向左边 B.偏向右边 C.仍然平衡 D.无法判断 5.(2018,雅安)金属镍(Ni)与物质X的溶液发生反应的化学方程式为:Ni+X===Cu+NiSO4,则下列说法错误的是( D ) A.Ni的化合价由0价变为+2价 C.该反应前后原子种类没有发生改变 B.X的化学式为CuSO4 D.Cu的金属活动性比Ni强 6.(2018,北海) A.甲、乙、丙 B.甲、丙、乙 C.乙、丙、甲 D.丙、乙、甲 7.(2018,南宁)将锌粉和铁粉的混合物加入到盛有一定量硝酸银溶液的烧杯中,充分反应后过滤,将所得
第四章土壤物理性质 主要教学目标:本章将要求学生掌握土壤物理性质如土壤质地、土壤结构以及土壤孔隙等内容。并在学习的基础上掌握改良不太适宜林业生产的某些土壤物理性质的一些方法。如客土、土壤耕作、施用化学肥料和土壤结构改良剂等。 第一节土壤质地 一、几个概念 1、单粒:相对稳定的土壤矿物的基本颗粒,不包括有机质单粒; 2、复粒(团聚体):由若干单粒团聚而成的次生颗粒为复粒或团聚体。 3、粒级:按一定的直径范围,将土划分为若干组。 土壤中单粒的直径是一个连续的变量,只是为了测定和划分的方便,进行了人为分组。土壤中颗粒的大小不同,成分和性质各异;根据土粒的特性并按其粒径大小划分为若干组,使同一组土粒的成分和性质基本一致,组间则的差异较明显。 4、土壤的机械组成:又叫土壤的颗粒组成,土壤中各种粒级所占的重量百分比。 5、土壤质地:将土壤的颗粒组成区分为几种不同的组合,并给每个组合一定的名称,这种分类命名称为土壤质地。如:砂土、砂壤土、轻壤土、中壤土、重壤土、粘土等 二、粒级划分标准: 我国土粒分级主要有2个 1、前苏联卡庆斯基制土粒分级(简明系统) 将0.01mm作为划分的界限,直径>0.01mm的颗粒,称为物理性砂粒;而<0.01mm的颗粒,称为物理性粘粒。 2、现在我国常用的分级标准是: 这个标准是1995年制定的。 共8级: 2~1mm极粗砂;1~0.5mm粗砂;0.5~0.25mm中砂;0.25~0.10mm细砂; 0.10~0.05mm极细砂;0.05~0.02mm粗粉粒;0.02~0.002mm细粉粒;小于0.002mm粘粒 三、各粒级组的性质 石砾:主要成分是各种岩屑 砂粒:主要成分为原生矿物如石英。比表面积小,养分少,保水保肥性差,通透性强。 粘粒:主要成分是粘土矿物。比表面积大,养分含量高,保肥保水能力强,但通透性差。粉粒:性质介于砂粒和粘粒之间。 四、土壤质地分类 1、国际三级制,根据砂粒(2—0.02mm)、粉砂粒(0.02mm—0.002mm)和粘粒(<0.002mm)的含量确定,用三角坐标图。 2、简明系统二级制,根据物理性粘粒的数量确定。考虑到土壤条件对物理性质的影响,对不同土类定下不同的质地分类标准。在我国较常用。 3、我国土壤质地分类系统: 结合我国土壤的特点,在农业生产中主要采用前苏联的卡庆斯基的质地分类。对石砾含量较高的土壤制定了石砾性土壤质地分类标准。将砾质土壤分为无砾质、少砾质和多砾质三级,可在土壤质地前冠以少砾质或多砾质的名称。 五、土壤质地与土壤肥力性状关系 从两个方面来论述 1、土壤质地与土壤营养条件的关系 肥力性状砂土壤土粘土 保持养分能力小中等大 供给养分能力小中等大
20种氨基酸记忆口诀 六伴穷光蛋:硫、半、光、蛋→半胱、光、蛋(甲硫)氨酸→含硫氨基酸 酸谷天出门:酸、谷、天→谷氨酸、天门冬氨酸→酸性氨基酸 死猪肝色脸:丝、组、甘、色→丝、组、甘、色氨酸→一碳单位来源的氨基酸 只携一两钱:支、缬、异亮、亮→缬、异亮、亮氨酸→支链氨基酸 一本落色书:异、苯、酪、色、苏→异亮、苯丙、酪、色、苏氨酸→生糖兼生酮 拣来精读之:碱、赖、精、组→赖氨酸、精氨酸、组氨酸→碱性氨基酸 芳香老本色:芳香、酪、苯、色→酪、苯丙、色氨酸→芳香族氨基酸 不抢甘肃来:脯、羟、甘、苏、赖→脯、羟脯、甘、苏、赖氨酸→不参与转氨基的氨基酸 二十种氨基酸的英文名称速记用词根词缀记,凭借读音也很容易。 luna和月光相关,l的就是亮氨酸,加上iso-的前缀就是异亮氨酸了;芦笋是asparagus(G的单词),天门冬属的,所以天冬氨酸是asparagine 就是asp了; his- 作词很是组织的意思,histamine-组胺,thus,histidine-组氨酸:His;苯,Phe,苯丙氨酸就是Phe了。 甘氨酸-----Gly-----G 干gan了le的叶ye子 丙氨酸-----Ala-----A 一个夹心饼干(把A想成一片饼干,两面都是A,中间加点东西) 缬氨酸-----Val-----V 缬读xie,和腹泻的泻同音!四川人管上厕所叫窝(Val)屎 亮氨酸-----Leu-----L 亮的英语单词是light 异亮氨酸---Ile----I 把I想成一 苯丙氨酸---Phe----F 他(he)人又苯,又爱放屁(P),我真的服(F)了他了 脯氨酸-----Pro----P 胸脯(p)肉(ro) 色氨酸-----Trp----W 我w喜欢看三three个人renXXXXp,我太色了 丝氨酸-----Ser----S S的读音 酪氨酸-----Tyr----Y 踢T你的your鸭儿r,让你变成懦夫 半胱氨酸---Cys----C 这个来自一个单词Cyst,是膀胱的意思。读音和妹妹差不多。妹妹的膀胱 蛋氨酸-----Met----M 小的时候,妈妈M老是叫我吃eat鸡蛋 天冬氨酸---Asp----D 把As想成天冬。医生D说AS的尿是酸性的 天冬酰胺---Asn----N 不能在冬天制造血案 谷氨酰胺----Gln---Q 谷物没多少了,最大的问题在于可能发生血案 谷氨酸------Glu---E 谷物的益处E在于可以变成葡萄糖 苏氨酸------Thr---T 他TA喝he了瓶苏打水,终于不热re了 赖氨酸------Lys---K 美国的国务卿耐丝LYS说她可以让台湾占山为王KING,老胡说,你简(碱性氨基酸)直是在放屁 精氨酸------Arg---R 大家都看过周星驰的电影,有一次,他喝了杯精液,观众就在争论argue他喝的是不是热RE的精液 组氨酸------His---H H想成医院,医院切掉了他的his病变组织 8种必需氨基酸——携一两本色书来家(呵呵,自创的,别想歪了!) 非极性氨基酸:仆笨些,梁刚(主人)亦笨-------脯氨酸/丙氨酸/缬氨酸/亮氨酸/甘氨酸/异亮氨酸/苯丙氨酸 外一篇 苏缬亮异亮,苯丙属芳香。 还有色赖蛋,缺一人遭殃。(必需) 丙组丝甘半,天谷建酸胺。 精酪加一脯,20氨基酸。(非必需) 氨基酸记忆口诀 1、必须氨基酸:携一本蛋色书来[缬氨酸,异亮(亮)氨酸,苯丙氨酸,蛋氨酸,色氨酸(甲硫氨酸),苏氨酸,赖氨酸,] 2、半必须氨基酸:半斤组[精(斤)氨酸,组氨酸] 3、含硫氨基酸:硫甲硫,胱半胱[甲硫氨酸,半胱氨酸,胱氨酸] 4、芳香族氨基酸:老芳本色[酪氨酸,苯丙氨酸,色氨酸] 5、支链氨基酸:支姐,亮一亮[缬氨酸,亮氨酸,异亮氨酸] 6、非极性疏水性氨基酸:非姐,脯亮一亮,(给你)本饼干[缬氨酸,脯氨酸,亮氨酸,异亮氨酸,苯丙氨酸,丙氨酸,甘氨酸] 7、酸性氨基酸:酸谷天(三伏天)[谷氨酸,天冬氨酸] 8、碱性氨基酸:碱组精赖[组氨酸,精氨酸,赖氨酸] 9、生糖氨基酸:姐,天天,哭哭(谷谷),脯(羟)脯,(要吃)半斤组蛋饼(和)钢丝[缬氨酸,天冬氨酸,天冬酰氨,谷氨酸,谷氨酰氨,脯(羟)
测定土壤理化指标有很多标准文件,部分指标有国家标准,部分用农业行业标准,由于指标太多,故列出土壤测定的一些方法,通过方法可以搜索到行业标准或国家标准的具体内容,供参考: 土壤质地国际制;指测法或密度计法(粒度分布仪法)测定 土壤容重环刀法测定 土壤水分烘干法测定 土壤田间持水量环刀法测定 土壤pH土液比1:2.5,电位法测定 土壤交换酸氯化钾交换——中和滴定法测定 石灰需要量氯化钙交换——中和滴定法测定 土壤阳离子交换量EDTA-乙酸铵盐交换法测定 土壤水溶性盐分总量电导率法或重量法测定 碳酸根和重碳酸根电位滴定法或双指示剂中和法测定 氯离子硝酸银滴定法测定 硫酸根离子硫酸钡比浊法或EDTA间接滴定法测定 钙、镁离子原子吸收分光光度计法测定 钾、钠离子火焰光度法或原子吸收分光光度计法测定 土壤氧化还原电位电位法测定。 土壤有机质油浴加热重铬酸钾氧化容量法测定 土壤全氮凯氏蒸馏法测定 土壤水解性氮碱解扩散法测定 土壤铵态氮氯化钾浸提——靛酚蓝比色法(分光光度法)测定 土壤硝态氮氯化钙浸提——紫外分光光度计法或酚二磺酸比色法(分光光度法)测定 土壤有效磷碳酸氢钠或氟化铵-盐酸浸提——钼锑抗比色法(分光光度法)测定 土壤缓效钾硝酸提取——火焰光度计、原子吸收分光光度计法或ICP法测定 土壤速效钾乙酸铵浸提——火焰光度计、原子吸收分光光度计法或ICP法测定 土壤交换性钙镁乙酸铵交换——原子吸收分光光度计法或ICP法测定 土壤有效硫磷酸盐-乙酸或氯化钙浸提——硫酸钡比浊法测定 土壤有效硅柠檬酸或乙酸缓冲液浸提-硅钼蓝比色法(分光光度法)测定 土壤有效铜、锌、铁、锰DTPA浸提-原子吸收分光光度计法或ICP法测定 土壤有效硼沸水浸提——甲亚胺-H比色法(分光光度法)或姜黄素比色法(分光光度法)或ICP法测定 土壤有效钼草酸-草酸铵浸提——极谱法测定 全量铅、镉、铬干灰化法处理——原子吸收分光光度计法或ICP法测定 全量汞湿灰化处理——冷原子吸收(或荧光)光度计法 全量砷干灰化处理——共价氢化物原子荧光光度法或ICP法测定
第13讲金属材料、金属的化学性质 一、选择题 1.(2014,广州)下列关于金属材料的说法中,不正确的是( D ) A.生铁、硬铝、焊锡都属于合金 B.铜有良好的导电性,因而大量用于制作电线 C.铝表面易生成致密氧化铝薄膜,因而具有良好的抗腐蚀性 D.锈蚀后的铁制品没有回收价值 2.(2013,宜宾)下列事实不能用金属活动性顺序解释的是( B ) A.不能用金属铜与稀硫酸反应制取氢气 B.银的导电性强于铜 C.镁和铝与稀盐酸反应的剧烈程度不同 D.铜能将银从硝酸银溶液中置换出来 3.(2014,株洲)如图是X、Y、Z、W四种金属与稀盐酸反应状况的示意图,据此判断四种金属中活动性最弱的是( B ) A.X B.Y C.Z D.W 4.X、R表示两种金属,在溶液中发生反应:X+3RNO3=3R+X(NO3)3。下列说法不正确的是( C ) A.该反应是置换反应 B.若X是Al,R是Ag,则反应后溶液质量减少 C.X可能是Fe,R可能是Cu D.X的金属活动性比R强 5.(2014,福州)将铁丝、铜丝分别伸入盛有同种试剂的两支试管中,下列试剂能迅速比较出铁、铜金属活动性强弱的是( B ) A.蒸馏水B.稀硫酸 C.硫酸钠溶液D.氢氧化钠溶液 6.对Ag、Fe、Cu三种金属活动性顺序的探究,下列所选试剂不可行的是( B ) A.Fe、Ag、CuSO4溶液 B.Cu、Ag、FeSO4溶液 C.Fe、Cu、稀盐酸、AgNO3溶液 D.Cu、FeSO4溶液、AgNO3溶液 7.(2014,成都)根据金属活动性顺序Fe>Cu>Ag判断,下列说法错误的是( A ) A.反应Cu+FeSO4═Fe+CuSO4可以发生 B.反应Fe+2AgNO3═2Ag+Fe(NO3)2可以发生 C.铜片放入硝酸银溶液中,溶液颜色由无色变成蓝色 D.铁丝插入硫酸铜溶液中,铁丝表面有红色物质析出 8.(2014,上海)为比较X、Y、Z三种金属活动性大小,进行如图实验。实验结论正确的是( A )
第一部分广东中考考点研究 模块一身边的化学物质 第5讲金属材料金属资源的利用和保护 第6讲金属的化学性质 (分值:56分建议时间:70分钟) 基础过关 一、选择题(本大题包括9小题,每小题2分,共18分)(请将正确答案填入下表) 1. (2018铁岭)下列盐可由金属和盐酸反应直接制得的是() A. CuCl2 B. AlCl3 C. FeCl3 D. AgCl 2. (2018山西)验证镁、铜的金属活动性顺序,下列试剂不能选用的是() A. MgSO4溶液 B. KCl溶液 C. 稀盐酸 D. ZnCl2溶液 3. (2018德州)金属锰与氯化亚铁溶液可发生如下反应:Mn+FeCl2=== MnCl2+Fe,下列说法错误的是() A. 该反应属于置换反应 B. 锰的金属活动性比铁强 C. 锰能置换出盐酸中的氢 D. 反应前后元素化合价都不变 4.(2018龙东)现有X、Y、Z三种金属,X可将Z从其盐溶液中置换出来,再将X和Y两种金属分别放入 稀硫酸中,Y表面有气泡产生,X无明显现象,则三种金属活动性顺序正确的是() A. X>Y>Z B. Y>X>Z C. Z>X>Y D. Y>Z>X 5. (2018新疆建设兵团)如图是探究铁和铜金属活动性实验,关于此实验说法错误的是() 第5题图 A. 铁丝需要砂纸打磨 B. 溶液由蓝色变为无色
C. 金属活动性强弱:Fe>Cu D. 化学反应方程式为:Fe+CuSO4=== Cu+FeSO4 6. (2018兰州)利用下列试剂之间的反应现象,能验证Fe、Cu、Ag三种金属活动性强弱顺序的是() A. Fe、Cu、AgNO3溶液 B. Fe、CuSO4溶液、Ag C. FeSO4溶液、CuSO4溶液、Ag D. Fe、CuSO4溶液、AgNO3溶液 7. (2018成都)探究锌、铜、镁的金属活动性时,下列现象、分析或结论正确的是() 第7题图 A. 盐酸的浓度可以不同 B. 铜片表面有气泡 C. 镁片的试管表面发烫 D. 活动性Cu>Zn>Mg 8. (2018贺州)将一定量的锌粒投入到含溶质为Al(NO3)3、Cu(NO3)2、AgNO3的溶液中,充分反应后过滤, 往滤液中滴加稀盐酸,无明显现象,则下列说法正确的是() A. 滤渣中一定有Ag、Cu B. 滤渣中可能有Ag、Cu、Al C. 滤液中一定没有Cu(NO3)2、AgNO3 D. 滤液中一定没有AgNO3 9.(2018自贡)现有等质量甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,产生氢 气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中化合价均为+2价)。则下列说法中错误的是()
第三章金属及其化合物 第一节金属的化学性质说课稿 各位老师,你们好! 今天我的说课题目是人教版必修一第三章《金属的化学性质》第一节,我将从教材、教法、学法、教学过程几个方面来说这节课。 一、说教材 1、教材的地位及其作用: 《金属的化学性质》是高一化学第三章《金属及其化合物》第一节的内容,具体内容主要有常见金属的化学性质。本课题是在原有知识的基础上对金属的化学性质进行深入、系统地学习,这样使元素和化合物知识更加完整。它侧重于对金属活动性顺序的理解和能利用金属活动性顺序解释—些与日常生活有关的化学问题,使学生在获得知识的同时,解决实际问题的能力也获得提高,而且学好本课题为以后学习酸、碱、盐打下良好的基础。 2、教学目标 教学目标的确定必须科学、简明,切合教材要求,符合学生实际,切实突出重点,体现全面性,综合性和发展性。为此,确定以下教学目标 (1)知识与技能: ①知道铁、铝等常见金属与氧气的反应②认识金属活动性顺序和置换反应 ③能用金属活动性顺序对有关的置换反应进行简单的判断,并能利用金属活动性顺序解释一些与日常生活有关的化学问题 (2)过程与方法: ①学会运用观察、实验等方法获取信息,能用文字、化学语言表述有关信息②初步学会运用比较、归纳、概括等方法对获取的信息进行加工,帮助学生逐步形成良好的学习方法和习惯 (3)情感态度与价值观 ①培养学生的合作意识以及勤于思考、严谨求实、勇于创新和实践的科学精神②通过实验激发和增强对化学现象的好奇心和探究欲,提高学习化学的兴趣 3、教学重、难点 我是根据新课标的要求、教材内容设置及对今后教学的影响来制定教学重、难点的。教材介绍了金属与氧气、金属与酸、金属与水的反应,这三点化学性质都可以在一定程度上说明金属的活动性强弱;为今后学习酸、碱、盐的知识做了铺垫;所以,我确定本课题的重点是通过实验探究认识金属活动性顺序。由于金属活动性顺序比较抽象,需要学生记忆,而且在运用时需考虑一定的条件;又紧密结合学生对金属的认识、思维能力、生活经验以及这个年龄段的特征等因素,我确定本课题的难点是运用金属活动性顺序解释生活、生产中的实际问题。 二、说教法 学生是认知的主体,是教学的中心,教学要以学生主动构建过程为核心,要充分考虑学生的现有基础,并与学生的认知经验紧密结合,这样才能保证教学内容适合学生,并能被学生纳入到他们的知识结构中,使他们逐步建立完善的知识结构。教材的重点放在通过金属的化学性质的探究,达到对金属活动性顺序的探究上,常见金属活动性顺序的探究贯穿于整个金属化学性质探究的讨论始终,既突出了重点,又利于难点的突破。再结合使用多媒体呈现生活中金属锈蚀的图片帮助同学们运用金属活动性顺序解释一些实际问题,突破难点,巩固教学成果,学生的学习情况能得到及时的反馈。 而本课题中金属的每一点化学性质在前面的学习中均已有所了解,特别是金属与氧气的反
必修一第三章第一节金属的化学性质(第一课时)教学设计 一、教学目标 1.使学生认识钠是一种很活泼的金属,了解钠的物理性质,掌握钠的化学性质。 2.培养学生根据实验现象探究、分析、推理和判断的能力。 二、教学重点 钠的性质 三、教学难点 对实验现象的观察和分析。 四、教学用具 实验用品:钠、玻片、小刀、镊子、滤纸、盛有水的小烧杯、酚酞。 酒精灯、火柴、石棉网、铁架台(附铁圈)、玻璃钠柱、大头针、带活塞的空塑料瓶。五、教学过程 【复习】初中所学有关铁的性质。 【学生】探究、回顾。 【学生探究】教材P38 思考与交流 金属有哪些共同的化学性质? 1.举例说明金属能发生哪些化学反应? _________________________________________________________________________ _________________________________________________________________________ 2.下图是一些化学反应的照片,请分析这些反应,并写出化学方程式。 _________________________________________________________________________ _________________________________________________________________________ 【引言】在人类已发现的一百多种元素中,大约有4/5是金属元素(引导学生看元素周表),多数金属的化学性质都比较活泼。因此,绝大多数金属元素在自然界中总是以化合态存在。但亦有游离态存在的金属(如,Ag、Cu、Au、Pt)。今天我们学习一种常见的活泼金属——钠 【板书】 第三章金属及其化合物 第一节金属的化学性质 【板书】一、金属钠(Na) 【学生探究】钠的原子结构示意图、讨论其化学性质。 (复习:质子数=核外电子数=核电荷数=原子序数) 【板书】1.钠的原子结构示意图:
金属的化学性质(第二课时) 一、教学目标 1、知识与技能 ⑴能说出钠的主要物理性质。 ⑵能描述钠与水反应的实验现象,并会书写反应的化学方程式 ⑶了解铁与水蒸气反应的原理,设计出简单可行的铁与水蒸气的反应装置 2、过程与方法 (1)通过实验,学会科学、合理地运用观察方法,体会实验方法在化学研究中的重要作用。(2)通过探究活动,亲身参与实验的操作,体验解决问题的乐趣。 3、情感态度价值观 (1)通过实验及自己分析、讨论得出结论的过程,感受学习化学的兴趣,树立严谨求实的科学态度和科学方法和合作学习的意识。 (2)通过学习,认识化学知识在生活中的重要性。 二、教学重、难点: 1、重点:钠与水的反应;铁与水蒸气反应;铝和氢氧化钠溶液的反应 2、难点:铁与水蒸气反应;对实验现象的观察和分析。 三、教学用具: 实验仪器:小烧杯、镊子、小刀、滤纸、蒸发皿、火柴、酒精灯、滴管、玻璃片、试管 实验试剂:金属钠、蒸馏水、酚酞、铝箔、HCl、NaOH
五、板书设计 第二节 金属的化学性质(第二课时) 二、金属与酸和水的反应 1.钠与水的反应 3、铝和氢氧化钠溶液的反应 2Al +2NaOH +2H 2O===2NaAlO 2+3H 2 ↑ 2. 铁和水蒸气反应 ①水蒸气的产生 ②铁与水蒸气反应 ③检验产物
《金属的化学性质》(第二课时)说课稿 各位评委老师大家好!我要说课的内容是金属的化学性质,下面我将从教材,教法,学法,教学程序设计四个方面对本节课作如下说明: 一.说教材 1.教材的地位与作用: 本节课是人教版化学必修1,第三章,第一节的第二课时的内容。本节课是在前面学习了金属与非金属反应的基础上进行的,是本节课内容的延伸,而且就本课时的内容来讲,它包含了金属化学性质几个重要的化学性质既:金属与酸和水的作用;以及一些特殊的金属所具有的化学性质,如,铝与氢氧化钠的反应。本课时的内容在整个高中化学中占有十分重要的作用。 1.2教学目标 依据新课程理念,本着对教材结构和内容的深刻理解,提出本节教学的目标: 1.知识目标:能够正确地掌握金属钠与水反应时的现象及化学方程式的书写;铝与氢氧化钠反应时的现象及化学方程式的书写。 2.技能目标:发挥学生的潜能,引导学生自己设计实验,增强学生发现问题,解决问题的能力。培养学生分析问题的能力和科学态度。 3情感目标:通过奇妙的化学实验的操作(如钠与水的反应)和精彩的化学实验现象感受化学世界的美妙变化,提高学习化学的兴趣,引导学生能够透过现象认清事物的本质。 1.3、重点、难点 重点: 钠与水的反应,铁粉和水蒸气的反应,铝与氢氧化钠的反应。 难点:铁粉和水蒸气的反应,铝与氢氧化钠溶液反应的实验现象观察。 二、教法 以上重点、难点的突破是本节成功与否的关键,通过什么样的教法和学法显得异常重要。 我的教法是: 1.对于钠与水的反应,因反应比较剧烈,我选择的教学方法为,我做演示实验,让同学们根据提前给出的一些提示自己总结出实验现象,并试着做出科学的解释。根据实验现象让同学们试着自己写出该反应的化学方程式。培养学生分析问题的能力和科学态度。 2. 运用对比的方法:钠能与水反应,那么铁呢,引导学生自己设计实验来验证铁能否与水蒸气进行反应。 3. 在铝与氢氧化钠的溶液的反应教学中,也采用让学生自己动手做实验,并总结出实验现象做出合理的解释,并写出相应的化学方程式。 三.学法 利用师生互动的方式,以学生为主,老师为辅的形式,发挥学生的主体作用,通过学生实验,引导学生发现问题,分析,解决问题。 四、教学过程 (一)引入课堂。复习初中学习的金属与酸的反应,初中阶段已经学习了金属活动顺序表,在氢以前的金属遇到酸时,能够发生化学反应,生成盐和氢气。提出疑问让同学们思考“金属遇到水会如何呢?”并联系生活实际通过视频事例来启发学生思考问题,调动学生的好奇心,接着下面进行一个演示实验,让学生通过演示实验来对上面的悬疑找到答案。 (二)金属钠与水反应的教学:进行演示实验钠与水的反应,在做实验时,提醒学生观察反应时钠所处的部位,形态,钠球的运动和大小的变化情况,周围水雾的产生和发出的响声,以及溶液的颜色变化。引导学生思考为什么会出现这种实验现象,并正确写出该反应的化学方程式。 (三)由此及彼,提出问题。铁不可以与冷,热水反应,能否与水蒸汽反应呢?让同学们展开讨论,如将铁烧红插入到水中,或将铁粉与水蒸汽在高温下反应等。引导学生从水
实验3 土壤理化性质测定与分析 1 土壤样品的采集和制备 土壤样品的采集是否具有代表性,是决定分析结果能否正确反映土壤特性的关键。因此,采集的土壤样品必须具有代表性,以确保土壤质量分析结果的正确性。从田间采集来的土壤样品不可直接进行化学分析,需经过筛或风干过筛等处理后方可进行分析。因此,在风干过筛处理中保持最小的误差是同样的重要。本实验的目的在于通过土壤样品采集的实践,使学生更好地掌握采集具有代表性土壤样品的技能和合理处理样品的技能。 1.1土壤样品的采集 1.1.1耕层混合土壤样品的采集 (1)确定采样单元 根据有关资料和现场勘查后,将采样区划分为数个采样单元,每个采样单元的图类型,肥力状况和地形等因素要尽可能均匀一致。 (2)确定采样点数及采样点位置 采样点数的确定,取决于采样区域的大小、地块的复杂程度和所要求的精密度等因素,一般以5-20个为宜。采样点位置的确定要遵循随机布点的原则,常采用“S”型布点方式,该方式能较好地克服耕作、施肥等农业措施造成的误差。但在采样单元面积较小,地形变化较小,地力较均匀的情况下也可采用对角线(或梅花)形布点方式。为从总体上控制采样点的代表性,避免在堆过肥的地方和田埂,沟边以及特殊地形部位采样。 (3)各采样点土样的采集 遵循采样“等量”的原则,即每点所采土样的土体的宽度、厚度及深度均相同。使用采样器采样时应垂直于地面向下至规定的深度。用取土铲取样应先铲出一个耕层断面,再平行于断面下取土。 (4)混合土样的制备 将个点采集的土样集中在一起,尽可能捏碎,混均;如果采集的样品数量过多,可用四分法将多余的土样弃去,以取1kg为宜。其方法是将混均的土样平铺成四方形,划对角线将土样分成四份,将其中一对角线的两份弃去,如所剩样品仍很多,可重复上诉方法处理,知道所需数目为止。采集含水较多的土样时(如水稻土),四分法很难使用,可将各样点采集的烂泥状样品搅拌均匀后,再取出所需数量。将采好的土样装袋,土袋最好采用布制的,以保持通气。 (5)制作采样标签及采样记录 选用耐浸润的纸签(牛皮纸或硫酸纸),用铅笔在标签上注明采样地点,日期,采样深度,土壤名称,编号及采样人等,一式两份,土袋内外各放一份。同时做好采样记录。 1.1.2土壤剖面样品的采集 即按土壤发生层次的采样。首先在能代表研究对象的采样点挖掘1×1.5m左右的长方形土壤剖面坑,较窄的一面向阳,作为剖面观察面。挖出的土应放在土坑的两侧,而不要放在观察面的上方。土坑的深度根据具体情况确定,一般要求达到母质层或地下水位。根据剖面的土壤颜色、结构、质地、松紧度、湿度及植物根系分布等,划分土层。按研究所需了解的项目逐项进行仔细观察,描述记载,然后至上而下逐层采集样品,一般采集各层最典型的中部位置的土壤,以克服层次之间的过渡现象,保证样品代表性。每个土样质量1kg左右,将采集的样品放入样品袋,写明标签(同上)。 (1)土壤诊断样品采集 为找出造成某些植物发生局部死苗失绿,矮缩,花而不实等异常现象的原因,必须对土壤进行某些成分的分析测定。一般应在发生异常现象的范围内,采集典型土壤样品,多点混合,同时在附近采集正常土样作为对照。 (2)土壤盐分动态样品的采集 淋溶和蒸发是造成土壤剖面中盐分季节性变化的主要原因,因此,这类样品的采集按垂直深度分层采
第一节金属的化学性质(第一课时) 一、教材分析 《金属的化学性质》是高中化学元素及其化合物知识学习的第一部分,它在编写上体现了分类研究的思想:将金属这个整体作为研究对象,抓住一些典型物质发生反应的实验事实,进行比较、归纳、总结,同中求异,异中求同,最后形成规律。这些知识的学习,既可以为前面所学的实验和理论知识补充感性认识的材料,又可以为在《必修2》中学习元素周期律、化学反应与能量等抽象的理论知识打下坚实的基础。 金属的化学性质在高一必修中的要求层次是让学生学会研究金属的反应规律——还原性,理解这条规律的归纳得来和外延拓展;同时,让学生感受、体验、理解实验条件的控制以及探究实验的操作过程,初步认识化学科学的研究方法,培养学生的科学素养。 二、学情分析 学生在初中已学过一些金属及其化合物的知识,了解了金属活动性顺序,在高中第二章学习了氧化还原反应的初步知识,这些为本章进一步学习奠定了基础。 高一的学生好奇心强,求知欲旺盛,喜欢做实验,但观察实验、分析实验、从实验中获取相关知识的能力尚需进一步培养。 三、教学目标 1、知识与技能 (1)了解钠、铝等金属与氧气的反应,理解金属与非金属的反应规律。(2)了解氧化铝的高熔点和其对金属的保护作用。 (3)初步尝试用实验研究金属及其化合物性质的方法。 2、过程与方法: (1)通过分组完成钠、铝与氧气的实验,初步体验有序地、全面地、敏锐地观察实验现象,并能准确地用语言描述,尝试对现象进行分析、归纳,了解科学探究的基本方法,提高初步的科学探究能力。 (2)通过比较、归纳等方法,让学生逐步掌握学习元素化合物知识的一般线索、思路和方法,并转化为长时记忆。 3、情感态度与价值观: (1)感受反应条件不同对产物的影响。 (2)体验氧化铝对铝的冶炼、使用的影响。 (3)逐渐养成严谨的科学态度和科学实验的基本方法。 (4)通过小组合作的方式,学生逐渐体会社会支持,体会合作探究的乐趣。(5)感受并赞赏化学对改善个人生活、促进社会发展的积极作用。
1 土壤 (1) 1.1土壤样品制备 (1) 1.2土壤pH值测定——电位法 (1) 1.3有机质——重铬酸钾法 (3) 1.4全N——半微量开氏法 (5) 1.5碱解N——扩散法 (7) 1.6全P——酸溶法 (8) 1.7有效P——碳酸氢钠法 (11) 1.8速效K——火焰光度法 (13) 1.9铵态N——靛酚蓝比色法 (14) 1.10硝酸盐N——紫外分光光度法 (15) 2 水 (17) 2.1 水样采集和预处理 (17) 2.2 pH值——电位法 (17) 2.3总N——碱性过硫酸钾氧化紫外分光光度法 (18) 2.4铵态N——靛酚蓝比色法 (19) 2.5硝酸盐N——紫外分光光度法 (20) 2.6总P——过硫酸钾氧化钼酸铵分光光度法 (20) 2.7可溶P——钼酸铵分光光度法 (22) 2.8高锰酸盐指数(COD Mn) (22) 3 植物 (24) 3.1植物样品制备 (24) 3.2全N——开氏法 (24) 3.2全P、全K——光谱法 (25) 4 注意事项 (26) 4.1反复强调的p.s. (26) 4.2常用仪器说明 (27) 4.2.1天平 (27) 4.2.2移液枪 (27) 4.3 washing issues (28) 4.3.1glass things (28) 4.3.2消化罐 (28) 参考文献 (29)
1.1土壤样品制备 土壤样品采集就不说了,根据研究目的,采样方法也各不相同。下面介绍的是针对实验中的样品制备方法。 在所有土壤实验开始之前,都要先进行相应样品的制备。师兄师姐们不止一次提过,研究生刚入学应该每人发一件白大褂和一根擀面杖。做土壤侵蚀研究的怎么能不会磨土呢?土样经风干后,用木棍碾碎,然后过2mm筛,剩下的砾石称重。这一部分样品可以直接进行pH值和土壤机械组成的测定。对于不同的土壤指标,所需制备的样品粒径是不相同的。速效养分的测定往往不能研磨过细,因为这样土壤矿物晶粒会遭到破坏,使得分析结果偏高。全量养分则相反,磨细一些可以使样品更易分解或熔化,有益于测定。对于土壤硝态氮和铵态氮这类指标,则不能风干,而是采样后直接经2mm筛,然后冷冻保存,尽快测定。根据目前实验室所采用的比较成熟的方法,测试不同指标所需的土壤用量和粒径如下表所示。注意,这里的用量是以我测的北京褐土为标准,测部分指标的时候根据养分含量需要适当调整用量。 表1 测试不同指标对应粒径及用量 指标pH 机械 组成 有机质全N 全P 全K 碱解N 有效P 速效K NH4-N NO3-N 状态风干风干风干风干风干风干风干风干风干新鲜新鲜 粒径 (mm) 2 2 0.149 0.149 0.149 0.149 0.25 1 1 2 2 用量 (g) 10 30 0.5 1 0.1 0.1 2 2.5 5 10 20 1.2土壤pH值测定——电位法 1.原理 土壤pH值的测定是最没技术含量,也最烦人的实验。它的测定原理很简单,往土里加 水,充分混合后用pH计测一下,读个数,搞定。pH值其实就是H+浓度的负对数,既然 能通过电子仪器读的出来,那就是把浓度和电动势之类的联系起来。这个和翻斗式雨量计 有异曲同工之处,小翻斗一动,就有电子脉冲了……省去若干原理解释。 2. 主要仪器 烧杯、移液管或小量筒、搅拌器、pH计、滤纸 3. pH计标定
金属的化学性质(讲义) ?知识点睛 1.金属与酸反应 (1)图象问题 ①氢气质量与反应时间的关系 a.等质量的镁、铝、锌、铁和足量的酸反应(图1),金属反应完,酸 有剩余,生成氢气的质量不等,产生氢气的质量由多到少为:、、、,产生氢气由快到慢为、、、。 b.足量的镁、铝、锌、铁和等量的酸反应(图2),酸反应完,金属 有剩余,生成氢气的质量相等,消耗金属的质量由少到多为:、 、、,产生氢气由快到慢为、、、。 注:上述四种金属的产氢能力由强到弱为:、、、。 ?此类图象重点关注产生氢气的快慢与多少。 ②氢气质量与反应物质量的关系 a.向等质量的镁、铝、锌、铁中加入足量酸(图3),最初酸不足,等 质量的酸参与反应,产生氢气的质量相等,最终酸过量,金属不足, 产生的氢气质量不等,产生氢气的质量由多到少为:、、 、。 b.向等质量的酸中加入足量的镁、铝、锌、铁(图4),最初金属不足, 等质量的金属参与反应,产生氢气的质量不等,产生氢气的质量由 到多少为:、、、,最终酸不足,产生的氢气质量相等。 注:通过图象能比较产生氢气的多少,不能比较产生氢气的快慢。 ?此类图象重点关注最初产生氢气的多少与最终产生氢气的多少。
(2)判断混合物组成问题 ①平均值法 计算出金属混合物的平均相对原子质量Ar ,利用平均值法,推测金 属混合物的成分(将Al 的相对原子质量折算成18,氢后金属的相 对原子质量折算成无穷大)。 A r(A)< Ar < A r(B) ②极端假设法 假设金属混合物中只含已知的该金属,计算此时应产生的氢气质量, 比较其与实际产生的氢气质量的大小关系,根据金属产氢能力,推测 金属混合物的成分。 2.金属与盐溶液反应 (1)金属与盐溶液反应后,判断滤渣、滤液成分 ①对涉及到的金属进行活动性排序,标出加入的金属,判断反应的先 后顺序。【注:在金属活动性顺序表中,活动性相差较大的金属之间, 先发生置换反应。】 ②画流程图,根据加入金属的量初步判断滤渣、滤液成分。 ③根据题中信息,结合反应先后顺序,再次判断滤渣、滤液成分。 (2)回收废液中的金属和金属化合物 根据待回收的金属和金属化合物,初步判断加入的过量金属(一般为 所涉及金属中最活泼的),再分析各环节的化学反应和物质组成。 ?精讲精练 1.相同质量的Zn 和Fe 分别与足量等浓度的稀硫酸反应,能正确表示生成氢气 的质量与时间关系的图象是() A. B. C. D.
第一节金属的化学性质 一、金属的物理通性:常温下,金属一般为银白色晶体(汞常温下为液体),具有良好的导电性、导热性、延展性。 二、金属的化学性质 1、金属与非金属的反应 ○1与反应: Na:4Na + O2 = 2Na2O(常温) 2Na + O2 == Na2O2(点燃) Al:4Al + 3O2 = 2Al2O3(常温) 4Al + 3O2 == 2Al2O3(点燃)Fe:潮湿空气中生成铁锈,主要成分Fe2O3 3Fe+2O2 == Fe3O4 (纯氧中点燃) ○2与反应: Na:2Na+Cl2 == 2NaCl(点燃) Al:2Al+3Cl2 == 2AlCl3(点燃) Fe:2Fe+3Cl2== 2FeCl3(点燃) ○3与S反应: Na:2Na + S = Na2S(常温) Al:2Al + 3S == Al2S3(加热) Fe:Fe + S == FeS(加热) 2、金属与酸和水的反应: ○1与反应: Na:2Na+2H2O=2NaOH+H2↑(常温) Al:2Al+6H2O==2Al(OH)3↓+3H2↑(去膜后与热水反应) Fe:3Fe+4H2O(g) == Fe3O4+4H2(加热时与水蒸气反应) ○2与酸溶液反应: Na:2Na+2HCl=2NaCl+H2↑ Al:2Al+6HCl==2AlCl3+ 3H2↑ Fe:Fe+2HCl=FeCl2+H2↑
○3与碱溶液反应: Na:不反应 Al:2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Fe:不反应 3、与盐溶液反应: Na:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑ Al:置换出较不活泼的金属单质 Fe:置换出较不活泼的金属单质 4、与氧化物反应: Na:不反应 Al:铝热反应:2Al+Fe2O3==Al2O3+2Fe(点燃) Fe:不反应 【素材积累】 1、一个房产经纪人死后和上帝的对话一个房产经纪人死后,和上帝喝茶。上帝认为他太能说了,会打扰天堂的幽静,于是旧把他打入了地狱。刚过了一个星期,阎王旧满头大汗上门来说:上帝呀,赶紧把他弄走吧!上帝问:怎么回事?阎王说:地狱的小。 2、机会往往伪装成困难美国名校芝加哥大学的一位教授到访北大时曾提到:芝加哥大学对学生的基本要求是做困难的事。因为一个人要想有所成旧,旧必须做那些困难的事。只有做困难的事,才能推动社会发展进步。
土 壤 理 化 分 析 实 验 指 导 书 北京林业大学
本书的术语和代号说明 1.水:在试剂配制和操作步骤中所说的“水”,除非特别说明外,一律系指蒸馏水或去离子水。 2.试剂级别:除非特别说明,一般试剂溶液系指化学纯(CP)试剂配制,标定剂和标准溶液则用分析纯(AR)或优级纯(GR)试剂配制。 3.定容:一定量的溶质溶解后,或取一整份溶液,在精密量器(容量瓶或比色管等)中准确稀释到一定的体积(刻度),塞紧,并充分摇匀为止,这一整个操作过程称为“定容”。因此“定容”不仅指准确稀释,还包括充分混匀的意思。 4.养分的表示方法:除化肥成分用K2O、P2O5外,其他一切土壤、植物的养分均用元素(N、P、K、Ca、Mg、Cu、Mn、Zn、B、Mo等)表示。 5.凡计算结果中用%或mg、kg、μg等表示的,均为某物质的质量分数。 6.根据1984年颁布的《中华人民共和国法定计量单位》及有关量和单位的国家标准,现将土壤理化分析方法中常用法定计量单位与废止计量单位之间的转换关系列表如下:
目录 绪论 1.概述 1.1土壤理化分析课程介绍 1.2课堂要求 第一篇基础知识和化学及养分分析 第一章土壤理化分析的基本知识 1.1土壤理化分析用纯水 1.1.1纯水的制备 1.2试剂的标准、规格、选用和保存 1.2.1试剂的标准 1.2.2试剂的规格 1.2.3试剂的选用 1.2.4试剂的保存 1.2.5试剂的配制 1.3 常用器皿的性能、选用和洗涤 1.3.1玻璃器皿 1.3.2瓷、石英、玛瑙、铂、塑料和石墨等器皿 1.4滤纸的性能与选用 第二章土壤样品的采集与制备 2.1 土壤样品的采集 2.1.1概述 2.1.2混合土样的采集 2.1.3特殊土样的采集 2.1.4其他特殊样品的采集 2.1.5采集土壤样品的工具 2.2土壤样品的制备和保存 2.2.1新鲜样品和风干样品 2.2.2样品的风干、制备和保存 2.3土壤水分测定 2.3.1适用范围 2.3.2方法原理 2.3.3仪器设备 2.3.4试样的选取和制备 2.3.5测定步骤 2.3.6结果的计算
高中化学学习材料 (灿若寒星**整理制作) 第三章金属及其化合物 第一节金属的化学性质同步预习练习 1、金属材料在人类社会发展史上一直发挥着重要的作用。人类历史上使用最早的金属() A.铜B.铁C.铝D.钛 2、下列关于金属的叙述中正确的是() A.所有的金属都是固态的 B.金属具有导电性、导热性和延展性 C.活泼的金属、或较活泼的金属能与酸反应,但不能与碱反应 D.金属元素在自然界中都是以化合态存在的 3、通过你的观察和推理,判断下列实验室中对于少量Na的保存方法正确的是() A.保存在水中B.密封,保存在广口瓶中 C.用铝箔包裹,密封在广口瓶中D.密封,保存在煤油中 4、从生活常识角度考虑,试推断钠元素在自然界中存在的主要形式是() A.Na B.NaCl C.NaOH D.Na2O 5、金属钠放在水中浮在水面上,放在煤油中沉在油层下,煤油的密度为0.8g·cm-3,推测钠的密度(g·cm-3)是() A.大于1.0 B.小于0.8 C.介于0.8~1.0之间D.不能确定 6、下列物质中,有一种物质的颜色与其它三种的颜色不同,这种物质是() A.NaOH B.Na2O C.Na2O2D.NaHCO3 7、铝在空气中能够稳定存在的原因是() A.铝的活泼性差B.铝的还原性差 C.铝与氧气不反应D.铝表面有氧化膜 8、把一小块钠投入到硫酸铜溶液中,生成物有() A.Cu B.Cu(OH)2C.H2D.O2 9、取黄豆粒大小的一块金属钠,用滤纸擦干其表面的煤油,然后加入到硫酸铜溶液中,观察实验现象并
写出化学方程式:①钠在溶液中反应的实验现象,反应的化学方程式是。②溶液中的实验现象;反应的化学方程式是。 10、在铝质易拉罐中收集满CO2气体,然后在其中倒入10mL浓NaOH溶液,并迅速用胶带将易拉罐口封住,能够观察到的实验现象是易拉罐突然变瘪了,可经过一段时间之后,又可以观察到的现象是。试解释易拉罐变瘪的原因;并解释后一现象的原因。写出反应过程中的两个离子方程式;。 11、将4.34g Na 、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到672ml 混合气体,将该混合气体通过放电恰好反应完全,求原混合物中Na 、Na2O、Na2O2的物质的量之比。 12、请你设计至少两种方法除去细小的铁颗粒中混有的细小的铝颗粒。 第一节金属的化学性质同步达标练习 1、下列关于金属钠的物理性质中,错误的是() (A)金属钠很软,可用刀切割。(B)金属钠是热和电的良导体 (C)金属钠的密度是1.1g.cm-3(D)金属钠是银白色的 2、金属钠在氧气中燃烧,生成物是() (A)氧化钠(B)过氧化钠(C)氢氧化钠(D)碳酸钠 3、金属钠投入水中会熔化成闪亮的小球,原因是 (A) 钠是银白色的金属(B) 钠与水反应放出的热使钠熔化 (C) 金属钠的熔点低(D) 钠与水反应产生的氢气使钠熔化 4、下列关于金属钠及其化合物的叙述:①苛性钠又称纯碱②钠原子最外层电子只有1个电子,所以在化合物中钠只显+1价③过氧化钠中氧元素化合价为-1价④钠离子具有还原性,可以从水中还原出氢气⑤金属钠只有还原性,没有氧化性。上述叙述中正确的是( ) (A)①②③(B)③④⑤(C)②③⑤(D)①②⑤ 5、相同质量的Na、Mg、Al与过量稀硫酸反应,在相同状况下产生H2的体积比为( ) (A)36∶69∶92 (B)92∶69∶36 (C)1∶1∶1 (D)3∶2∶1 6、除去镁粉中的铝粉,应选用的试剂是() (A)稀盐酸(B)氯水(C)烧碱溶液(D)纯碱 7、两份铝屑,第一份与足量稀盐酸反应,第二份与足量氢氧化钠溶液反应,产生的氢气的体积比为1∶2则第一份与第二份铝屑的质量比为() (A)1∶1 (B)1∶2 (C)1∶3 (D)2∶1 8、下列物质置于空气中,能发生反应,但不是氧化还原反应的是() (A)Na (B)NaOH (C)Na2O2(D)Al 9、超氧化钾KO2也和过氧化钠一样,吸收CO2变成碳酸盐放出O2。若有0.5molKO2与过量CO2作用,