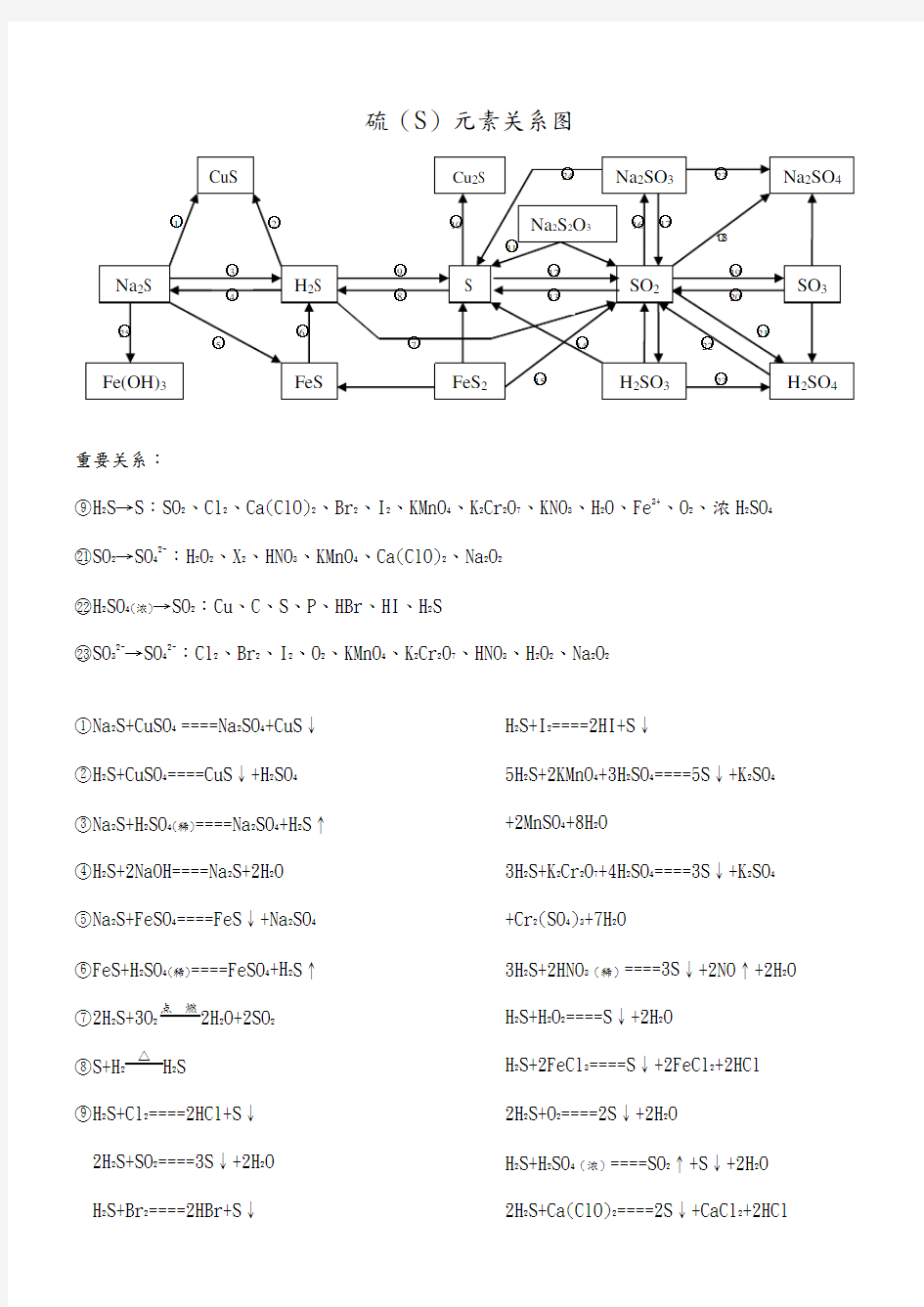

硫(S)元素关系图
重要关系:
○9H2S→S:SO2、Cl2、Ca(ClO)2、Br2、I2、KMnO4、K2Cr2O7、KNO3、H2O、Fe3+、O2、浓H2SO4 ○21SO2→SO42-:H2O2、X2、HNO3、KMnO4、Ca(ClO)2、Na2O2
○22H2SO4(浓)→SO2:Cu、C、S、P、HBr、HI、H2S
○23SO32-→SO42-:Cl2、Br2、I2、O2、KMnO4、K2Cr2O7、HNO3、H2O2、Na2O2
○1Na2S+CuSO4====Na2SO4+CuS↓○2H2S+CuSO4====CuS↓+H2SO4
○3Na2S+H2SO4(稀)====Na2SO4+H2S↑○4H2S+2NaOH====Na2S+2H2O
○5Na2S+FeSO4====FeS↓+Na2SO4○6FeS+H2SO4(稀)====FeSO4+H2S↑○72H2S+3O点燃2H2O+2SO2
○8S+H2△ H2S
○9H2S+Cl2====2HCl+S↓
2H2S+SO2====3S↓+2H2O
H2S+Br2====2HBr+S↓ H2S+I2====2HI+S↓
5H2S+2KMnO4+3H2SO4====5S↓+K2SO4
+2MnSO4+8H2O
3H2S+K2Cr2O7+4H2SO4====3S↓+K2SO4
+Cr2(SO4)3+7H2O
3H2S+2HNO3(稀)====3S↓+2NO↑+2H2O H2S+H2O2====S↓+2H2O
H2S+2FeCl3====S↓+2FeCl2+2HCl
2H2S+O2====2S↓+2H2O
H2S+H2SO4(浓)====SO2↑+S↓+2H2O
2H2S+Ca(ClO)2====2S↓+CaCl2+2HCl
○10S+2Cu△Cu2S
○11Na2S2O3+2HCl====2NaCl+S↓+SO2↑+H2O ○12S+O2点燃SO2
○133SO2+2Na2S====3S↓+2Na2SO3
○14H2SO3+2H2S====3H2O+3S↓
○154FeS2+11O高温2Fe2O3+8SO2
○16SO2+2NaOH====Na2SO3+H2O
H2O+2Na2CO3+SO2(少量)====Na2SO3
+2NaHCO3
Na2CO3+SO2(适量)====Ma2SO3+CO2
○17Na2SO3(s)+H2SO4(浓)====Na2SO4+SO2↑+H2O ○18SO2+Na2O2====Na2SO4
SO2+2NaClO+H2O====Na2SO4+2HCl
○192SO2+O催化剂450℃2SO3
○205SO3+2P△P2O5+5SO2
○21SO2+H2O2====H2SO4
SO2+X2+2H2O====H2SO4+2HX
(X=Cl、Br、I) 2SO2+O2+2H2O====2H2SO4
3SO2+2HNO3(稀)+2H2O====2NO+3H2SO4
5SO2+2KMnO4+2H2O====K2SO4+2MnSO4
+2H2SO4
○222H2SO4(浓)+Cu====CuSO4+SO2↑+2H2O
2P+5H2SO4(浓)△2H3PO4+5SO2↑+2H2O C+2H2SO4(浓)△CO2↑+2SO2↑+2H2O S+2H2SO4(浓)△3SO2↑+2H2O
2HBr+H2SO4(浓)====Br2+SO2+2H2O
2HI+H2SO4(浓)====I2+SO2+2H2O
○23SO32-+Cl2+H2O====SO42-+2Cl-+2H+
2H2SO3+O2====2H2SO4
2Na2SO3+O2====2Na2SO4
○24Na2SO3+2Na2S+3H2SO4====3S↓+3Na2SO4 +3H2O
○253Na2S+2FeCl3+H2O====6NaCl+3H2S↑
+2Fe(OH)3↓
氯(Cl)元素关系图
重要关系:
○12HCl→Cl2:MnO2、KMnO4、K2Cr2O7、KClO3、Ca(ClO)2 Cl2→Cl-:H2S、SO2、SO42-、Br-、I-、Fe2+
○1Cl2+2FeCl2====2FeCl3
2Fe+3Cl点燃2FeCl3(冒棕褐色烟)○2Cl2+Cu点燃CuCl2(冒棕黄色烟)
○3Cl2+2I-====I2+2Cl-
○4Cl2+2Br-====Br2+2Cl-
○5Cl2+SO2+2H2O====2HCl+H2SO4
○63Cl2+6KOH△KClO3+5KCl+H2O
○7Cl2+2NaOH====NaCl+NaClO+H2O
○8NaClO+HCl(浓)====Cl2↑+NaOH
NaClO+NaCl+H2SO4====Na2SO4+Cl2↑+H2O ○9Cl2+H2O====HCl+HClO
○102NaCl+2H2O电解Cl2↑+H2↑+2NaOH
2NaCl+MnO2+3H2SO4△2NaHSO4+MnSO4
+Cl2↑+2H2O ○112Na+Cl2点燃2NaCl (冒白烟)
H2O+Cl2+Na2CO3(足量)====NaCl+NaClO+
2NaHCO3
Na2CO3+H2O+2Cl2(足量)====2NaCl+2HClO
+CO2↑
○124HCl(浓)+MnO2△MnCl2+2H2O+Cl2↑
2KMnO4+16HCl(浓)====2KCl+2MnCl2
+5Cl2↑+8H2O
KCr2O7+14HCl(浓)====2KCl+2CrCl3
+3Cl2↑+2H2O
KClO3+6HCl(浓)====KCl+3Cl2↑+3H2O
Ca(ClO)2+4HCl(浓)====CaCl2+2Cl2↑+2H2O ○13Cl2+H2点燃2HCl
H2S+Cl2====2HCl+S
H2+Cl光照2HCl
Na2SO3+Cl2+H2O====Na2SO4+2HCl 2FeCl2+Cl2====2FeCl3
○14HCl+NH3====NH4Cl (冒白烟)○15NH4Cl△NH3↑+HCl↑
○16HCl+AgNO3====HNO3+AgCl↓
○17HCl+NaOH====NaCl+H2O
HCl+NaHCO3====NaCl+CO2↑+H2O
○182HClO光照2HCl↑+O2↑
○19Ca(ClO)2+2HCl====CaCl2+2HClO
Ca(ClO)2+CO2+H2O====CaCO3+2HClO
○20NaOH+HClO====NaClO+H2O
HClO+Na2CO3====NaClO+2NaHCO3
○212Cl2+2Ca(OH)2====CaCl2+Ca(ClO)2+2H2O
5Cl2+I2+6H2O====2HIO3+10HCl
○223Cl2+8NH3====N2+6NH4Cl
氧(O)元素关系图
○12O3====3O2
O3+2KI+H2O====2KOH+I2+O2
○23O放电2O3
○3O3+H2S====H2O+O2+S↓
○42H2O通电2H2↑+O2↑
2H2O+2F2====4HF+O2
○5O2+2H2点燃2H2O
O2+2Cu+2H2SO4====2CuSO4+2H2O O2+2H2S====2S↓+2H2O
○62H2O2MnO2 2H2O+O2↑
5H2O2+2KMnO4+3H2SO4====K2SO4
+2MnSO4+5O2↑+8H2O
○72H2O2MnO22H2O+O2↑
H2O2+H2S====S↓+2H2O
H2O2+2KI+H2SO4====K2SO4+I2+2H2O H2O2+Na2SO3====Na2SO4+H2O
重要关系:
○4H2O→O2:F2、电解
○6H2O2→O2:KMnO4、MnO2
○7H2O2→H2O:I-、S2-、SO42-、Fe2+ 8
H2O2+2FeSO4+H2SO4====Fe2(SO4)3+2H2O ○82H2O+Na2O2====2NaOH+H2O2
BaO2+H2SO4(稀)低温H2O2+BaSO4↓
○9O2+2Na点燃Na2O2
○102Na2O2+2CO2====2Na2CO3+O2↑ 2Na2O2+2H2O====4NaOH+O2↑○11Na2O2+H2SO4(稀)====Na2SO4+H2O2 Na2O2+2H2O低温2NaOH+H2O2
○12H2O2+SO2====H2SO4
○13Na2O2+SO2====Na2SO4
氮(N)元素关系图
重要关系:
○20HNO3(稀)→NO:HBr、HI、H2S、SO2、SO32-、Fe2+、Fe、Cu、Ag
○26HNO3(浓)→NO2:HBr、HI、H2S、SO2、SO32-、Fe2+、S、C、P、Cu、Ag
○1Mg3N2+8HCl====3MgCl2+2NH4Cl
○22NH4Cl+Ca(OH)2△2NH3↑+CaCl2+2H2O NH4Cl△NH3↑+HCl↑
2NH4Cl+CaO△CaCl2+2NH3↑+H2O
○3NH3+HCl====NH4Cl
○4NH3·H2O+HCl====NH4Cl+H2O
3NH3·H2O+FeCl3====Fe(OH)3↓+3NH4Cl ○5NH4Cl+H2O====NH3·H2O+H2O
NH4Cl+NaOH====NH3·H2O+NaCl ○6NH3+H2O====NH3·H2O
○7NH3·H2O△NH3↑+H2O
○8N2+3H高温高压催化剂2NH3
○94NH3+3O2(纯)点燃2N2+6H2O
2NH3+3CuO△N2+3Cu+3H2O
○10Mg3N2+6H2O====2NH3↑+3Mg(OH)2
○113Mg+N2点燃Mg3N2
○12NaNO2+NH4Cl△N2↑+NaCl+2H2O
○13N2+O放电NO
○146NO+4NH3△5N2+6H2O
○156NO2+8NH△7N2+12H2O
○16NO+NO2+2NaOH====2NaNO2+H2O
○172NaNO2+2NaI+2H2SO4====2NO↑+I2+2H2O
+2Na2SO4
2NaNO2+2HCl====2NaCl+NO↑+NO2↑+H2O ○182NO+O2====2NO2
○193NO2+H2O====2HNO3+NO
NO2+2KI+H2O====I2+NO+2KOH
○208HNO3(稀)+3Cu====3Cu(NO3)2+2NO↑+4H2O Fe+2HNO3(稀)====Fe(NO3)3+NO↑+4H2O
2HNO3(稀)+3H2S====3S↓+2NO↑+4H2O
3Na2SO3+2HNO3(稀)====3NaSO4+2NO↑
+4H2O
2H2O+3SO2+2HNO3(稀)====3H2SO4+2NO
6KI+8HNO3(稀)====6KNO3+3I2+2NO↑+4H2O 3FeCl2+4HNO3====2FeCl3+NO↑+Fe(NO3)2 +2H2O
○212HNO2====H2O+NO↑+NO2↑
○225NaNO2+2KMnO4+3H2SO4====5NaNO3
+K2SO4+2MnSO4+3H2O
○232NaNO△2NaNO2+O2↑
○242NO2+2NaOH====NaNO3+NaNO2+H2O
○253NO2+H2O====2HNO3+NO
○264HNO3(浓)+Cu====Cu(NO3)2+2NO2+2H2O C+4HNO3(浓)△CO2↑+4NO2↑+2H2O
S+6HNO3(浓)△H2SO4+6NO2↑+2H2O
P+5HNO3(浓)△H3PO4+5NO2↑+H2O
4HNO3见光或受热2H2O+4NO2↑+O2↑
○272Cu(NO3)2△2CuO+4NO2↑+O2↑
○28HNO3+NaOH====NaNO3+H2O
○29NaNO3+H2SO4(浓)微热NaHSO4+HNO3↑
○302HNO3+Cu(OH)2====Cu(NO3)2+2H2O
○312HNO3(浓)+Ag====AgNO3+NO2↑+H2O
3Ag+4HNO3(稀)====3AgNO3+NO↑+2H2O ○322AgNO3+Cu====Cu(NO3)2+2Ag
磷(P)元素关系图
○
14P+5O 2点 燃
2P 2O 5 ○
22P+3Cl 点 燃
2PCl 3
○
3PCl 3+Cl 2====PCl 5 ○
4PCl 3+3H 2O====H 3PO 3+3HCl ○52P+3Ca △
Ca 3P 2
○
62P+3H 2 △
2PH 3
○
7Ca 3P 2+6H 2O====3Ca(OH)2+3PH 3↑ ○
8PCl 5+4H 2O====H 3PO 4+5HCl ○
9P 2O 5+3H 2O====2H 3PO 4 ○
10Ca(H 2PO 4)2+H 2SO 4====2H 3PO 4+CaSO 4 ○
112H 3PO 4+Ca(OH)2====Ca(H 2PO 4)2+2H 2O ○
12Ca(H 2PO 4)2+Ca(OH)2====2CaHPO 4+2H 2O ○
132CaHPO 4+H 3PO 4====Ca(H 2PO 4)2 ○
142CaHPO 4+Ca(OH)2====Ca 3(PO 4)2+2H 2O ○
15Ca 3(PO 4)2+H 3PO 4====3CaHPO 4 ○
16Ca 3(PO 4)2+3H 2SO 4====3CaSO 4+2H 3PO 4 ○
172H 3PO 4+3Ca(OH)2====Ca 3(PO 4)2+3H 2O
○
1C+2H 2高 温
CH 4 ○2CH 4高 温
C+2H 2
○3CH4+2O点燃CO2+2H2O
○42C+O2点燃2CO
C+CO2高温2CO
2C+SiO高温Si+2CO↑
3C+CaO3000℃CaC2+CO↑
C+H2O高温H2↑+CO↑
C+ZnO高温Zn+CO↑
○5C+O2点燃CO2
C+2CuO△2Cu+CO2↑
○6CO2+2Mg点燃2MgO+C
○72C+SiO高温Si+2CO↑
○82CO+O2点燃2CO2
CO+CuO△Cu+CO2
CO+H2O催化剂、△CO2+H2
2CO+Fe2O3高温2Fe+3CO2
○9CO2+C高温2CO
○10CO2+Ca(OH)2====CaCO3↓+H2O
○11CaCO3煅烧CaO+CO2↑
CaCO3+2HCl====CaCl2+CO2↑+H2O ○12CO2+2NaOH====Na2CO3+H2O
○13Na2CO3+2H+====2Na++CO2↑○14Na2CO3+Ca(OH)2====CaCO3↓+2NaOH
○15CaCO3+CO2+H2O====Ca(HCO3)2
○16Ca(HCO3)2△CaCO3↓+CO2↑+H2O
Ca(HCO3)2+Ca(OH)2====2CaCO3↓+2H2O ○17Ca(HCO3)2+2NaOH====CaCO3↓+Na2CO3 +2H2O
○18Na2CO3+H2O+CO2====2NaHCO3
Na2CO3+HCl====NaHCO3+NaCl
○192NaHCO3△Na2CO3+H2O+CO2↑
○20Na2CO3+SiO2高温Na2SiO3+CO2↑
○21Si+2NaOH+H2O====Na2SiO3+2H2↑
○22Si+O2△SiO2
○23SiO2+2C高温Si+2CO↑
○24Si+2F2====SiF4
Si+4HF====SiF4+2H2↑
○25SiO2+2NaOH====Na2SiO3+H2O
○26H2SiO△H2O+SiO2
○27Na2SiO3+6HF====2NaF+SiF4+3H2O
○28Na2SiO3+2HCl+H2O====2NaCl+H4SiO4↓○29H4SiO4====H2SiO3+H2O
○30SiO2+4HF====SiF4↑+2H2O
硫(S)元素关系图 重要关系: ○9H2S→S:SO2、Cl2、Ca(ClO)2、Br2、I2、KMnO4、K2Cr2O7、KNO3、H2O、Fe3+、O2、浓H2SO4 ○21SO2→SO42-:H2O2、X2、HNO3、KMnO4、Ca(ClO)2、Na2O2 ○22H2SO4(浓)→SO2:Cu、C、S、P、HBr、HI、H2S ○23SO32-→SO42-:Cl2、Br2、I2、O2、KMnO4、K2Cr2O7、HNO3、H2O2、Na2O2 ○1Na2S+CuSO4====Na2SO4+CuS↓○2H2S+CuSO4====CuS↓+H2SO4 ○3Na2S+H2SO4(稀)====Na2SO4+H2S↑○4H2S+2NaOH====Na2S+2H2O ○5Na2S+FeSO4====FeS↓+Na2SO4○6FeS+H2SO4(稀)====FeSO4+H2S↑○72H2S+3O点燃2H2O+2SO2 ○8S+H2△H2S ○9H2S+Cl2====2HCl+S↓ 2H2S+SO2====3S↓+2H2O H2S+Br2====2HBr+S↓ H2S+I2====2HI+S↓ 5H2S+2KMnO4+3H2SO4====5S↓+K2SO4 +2MnSO4+8H2O 3H2S+K2Cr2O7+4H2SO4====3S↓+K2SO4 +Cr2(SO4)3+7H2O 3H2S+2HNO3(稀)====3S↓+2NO↑+2H2O H2S+H2O2====S↓+2H2O H2S+2FeCl3====S↓+2FeCl2+2HCl 2H2S+O2====2S↓+2H2O H2S+H2SO4(浓)====SO2↑+S↓+2H2O 2H2S+Ca(ClO)2====2S↓+CaCl2+2HCl ○10S+2Cu△Cu2S ○11Na2S2O3+2HCl====2NaCl+S↓+SO2↑+H2O ○12S+O SO2 ○133SO2+2Na2S====3S↓+2Na2SO3 ○14H2SO3+2H2S====3H2O+3S↓
元素的性质呈现周期性变化的根本原因-碱金属元素的性质-卤 族元素的性质及递变规律 卤族元素的性质及递变规律 (1)相似性: ①卤素原子最外层都有七个电子,易得到一个电子形成稀有气体元素的稳定结构,因此卤素的负价均为-1价。氯、溴、碘的最高正价为+7价,有的还有+1、+3、+5价,其最高价氧化物及水化物的化学式通式分别为X2O7和HXO4(F除外) ②卤族元素的单质均为双原子分子(X2);均能与H2化合: H 2+X2=2HX;均能与水不同程度反应,其通式(除F2外)为:H2O+X2 HX+HXO;均能与碱溶液反应;Cl2、Br2、I2在水中的溶解度较小(逐渐减小,但在有机溶剂中溶解度较大,相似相溶)。 (2)递变性: ①原子序数增大,原子的电子层数增加,原子半径增大,元素的非金属性减弱。 ②单质的颜色逐渐加深从淡黄绿色→黄绿色→深红棕色→紫黑色,状态从气→气→液→固,溶沸点逐渐升高;得电子能力逐渐减弱,单质的氧化性逐渐减弱,与氢气化合由易到难,与水反应的程度逐渐减弱。 ③阴离子的还原性逐渐增强。 ④氢化物的稳定性逐渐减弱。 ⑤最高正价含氧酸的酸性逐渐减弱(氟没有含氧酸)。
元素的性质: 由于核外电子排布的周期性变化,使元素表现出不同的性质。元素性质与原子结构密切相关,主要与原子核外电子排布,特别是最外层电子数有关。 碱金属元素的性质: (1)元素性质同:均为活泼金属元素,最高正价均为+1价异:失电子能力依次增强,金属性依次增强 (2)单质性质同:均为强还原性(均与O2、X2等非金属反应,均能与水反应生成碱和氢气。),银白色,均具轻、软、易熔的特点异:与水(或酸)反应置换出氢依次变易,还原性依次增强,密度趋向增大,熔沸点依次降低,硬度趋向减小 (3)化合物性质 同:氢氧化物都是强碱。过氧化物M2O2具有漂白性,均与水反应产生O2;异:氢氧化物的碱性依次增强。 注:①Li比煤油轻,故不能保存在煤油中,而封存在石蜡中。②Rb,Cs比水重,故与水反应时,应沉在水底。③与O2反应时,Li为 Li2O;Na可为Na2O,Na2O2;K,Rb,Cs的反应生成物更复杂。
化学元素符号详细符号 (元素) (符号) (原子序号) Actinium 锕Ac 89 Aluminum铝Al 13 Americium 镅Am 95 Antimony 锑Sb 51 Argon氩Ar 18 Arsenic砷As 33 Astatine 砹At 85 Barium 钡Ba 56 Berkelium锫Bk 97 Beryllium铍Be 4 Bismuth铋Bi 83 Boron硼B 5 Bromine 溴Br 35 Cadmium镉Cd 48 Calcium 钙Ca 20 Californium 锎Cf 98 Carbon 碳C 6 Cerium铈Ce 58 Cesium铯Cs 55
Chlorine氯Cl 17 Chromium铬Cr 24 Cobalt 钴Co 27 Copper 铜Cu 29 Curium 锔Cm 96 Dysprosium 镝Dy 66 Einsteinium 锿Es 99 Element 104元素Rf 104 Element105元素Db 105 Erbium铒Er 68 Europium 铕Eu 63 Fermium 镄Fm 100 Fluorine 氟F 9 Francium 钫Fr 87 Gadolinium 钆Gd 64 Gallium 镓Ga 31 Germanium锗Ge 32 Gold金Au 79 Hafnium铪Hf 72 Helium氦He 2 Holmium钬Ho 67 Hydrogen氢H 1
Indium铟In 49 Iodine碘I 53 Iridium铱Ir 77 Iron铁Fe 26 Krypton氪Kr 36 Lanthanum镧La 57 Lawrencium铹Lr 103 Lead铅Pb 82 Lithium锂Li 3 Lutetium镥Lu 71 Magnesium镁Mg 12 Manganese锰Mn 25 Mendelevium钔Md 101 Mercury汞Hg 80 Molybdenum钼Mo 42 Neodymium钕Nd 60 Neon氖Ne 10 Neptunium镎Np 93 Nickel镍Ni 28 Niobium铌Nb 41 Nitrogen氮N 7 Nobelium锘No 102
高中化学元素周期表 教案 Revised on November 25, 2020
通过学生亲自编排元素周期表培养学生的求实、严谨和创新的优良品质;提高学生的学习兴趣 教学方法:通过元素周期表是元素周期律的具体表现形式的教学,进行“抽象和具体”这一科学方法的指导。 教学重难点:同周期、同主族性质的递变规律;元素原子的结构、性质、位置之间的关系。 教学过程: [新课引入] 初中我们学过了元素周期律,谁还记得元素周期律是如何叙述的吗[学生活动] 回答元素周期律的内容即:元素的性质随着元素原子序数的递增而呈周期性的变化。 [过渡]对!这样的叙述虽然很概括,但太抽象。我们知道元素周期律是自然界物质的结构和性质变化的规律。既然是规律,我们只能去发现它,应用它,而不能违反它。但是,我们能否找到一种表现形式,将元素周期律具体化呢经过多年的探索,人们找到了元素周期表这种好的表现形式。元素周期表就是元素周期表的具体表现形式,它反映了元素之间的相互联系的规律。它是人们的设计,所以可以这样设计,也可以那样设计。历史上本来有“表”的雏形,经过漫长的过程,现在有了比较成熟,得到大家公认的表的形式。根据不同的用途可以设计不同的周期表,不同的周期表有不同的编排原则,大家可以根据以下原则将前18号元素自己编排一个周期表。 [多媒体展示]元素周期表的编排原则: 1.按原子序数递增顺序从左到右排列; 2.将电子层数相同的元素排列成一个横行;
3.把最外层电子数相同的元素排列成一列(按电子层递增顺序)。 [过渡]如果按上述原则将现在所知道的元素都编排在同一个表中,就是我们现在所说的元素周期表,现在我们一同研究周期表的结构。 [指导阅读]大家对照元素周期表阅读课本后,回答下列问题。 1.周期的概念是什么 2.周期是如何分类的每一周期中包含有多少元素。 3.每一周期有什么特点 4.族的概念是什么 5.族是如何分类的主族和副族的概念是什么,包括哪些列,如何表示 6.各族有何特点 [教师归纳小结] [板书] 一、元素周期表的结构 1、横行--周期 ①概念 ②周期分类及各周期包含元素的个数。 ③特点 a.周期序数和电子层数相同;
高中化学元素的性质总结 元素 白色固体:Na2O、MgO、Al2O3、ZnO 淡黄色粉末:Na2O 红色固体:Fe2O3、Cu2O、HgO 黑色粉末:FeO、Fe3O4、CuO、Ag2O 【提问】分析一下这些金属氧化物的化学性质有何规 律?可从下面几点去考虑: (1)加热是否分解 (2)与水反应 (3)与强酸(H+)反应 (4)与强碱(OH-)反应 (5)与氨水反应 (6)与H2或CO反应 并写出相应反应的化学方程式。 (1)热稳定性 2Ag2O 4Ag+O2↑ 2HgO 2Hg+O2↑ 4Cu 2Cu2O+O2↑ 规律:只有HgO、Ag2O、CuO等不活泼的金属氧化物加热易分解。(2)与水反应
Na2O+H2O=2NaOH MgO+H2O Mg(OH)2 2Na2O2+2H2O=4NaOH+O2↑ 规律:只有活泼金属(ⅠA、ⅡA)氧化物能与水反应。 (3)与酸反应 MgO+2H+=Mg2++H2O Al2O3+6H+=2Al3++3H2O CuO+2H+=Cu2++H2O 规律:碱性氧化物或两性氧化物能与酸溶液反应生成盐和水。 (4)与强碱溶液反应 Al2O3+2OH-=2AlO2-+H2O ZnO+2OH-=ZnO22-+H2O 规律:只有两性氧化物能与强碱反应生成盐和水。 (5)与氨水反应 Ag2O+4NH3·H2O=2Ag(NH3)2++2OH-+3H2O ZnO+4NH3· H2O=Zn(NH3)42++2OH-+3H2O 规律:易形成氨合离子的金属氧化物能与氨水反应。 (6)与还原剂的反应 CuO+H2Cu+H2O Fe2O3+3CO 2Fe+3CO2 ZnO+C Zn+CO↑ 规律:“Al”以后的金属的氧化物能与H2、C、CO等还原剂高温下发生氧化还原反应。 【小结】金属氧化物所发生的这些反应,总结起来,主要是金属氧
常见的元素符号: 氢氦锂铍硼,碳氮氧氟氖,钠镁铝硅磷,H He Li Be B C N O F He Na Mg Al Si P 硫氯氩钾钙, 锰铁铜锌银,钡铂金汞碘S Cl Ar K Ca Mn Fe Cu Zn Ag Ba Pt Au Hg I 常见元素的化合价: 钾钠银氢+1价, 氟氯溴碘-1价, 钙镁钡锌汞+2价, 正一亚铜,正二铜,正二亚铁,正三铁,+3铝来+4硅, 单质零价永不变,氧硫负二要记住。 碳酸根、硫酸根负二价,硝酸根、氢氧根负一价,只有铵根正一价。 单质的化学式: 化合物的化学式: 氧化物:一氧化碳CO , 二氧化碳CO2, 五氧化二磷P2O5 二氧化硫SO2, 二氧化锰MnO2 , 三氧化二铁Fe2O3 , 氧化亚铁FeO ,四氧化三铁Fe3O4 , 氧化镁MgO , 氧化钙CaO , 三氧化二铝Al2O3氧化汞HgO , 氧化铜CuO 酸:盐酸HCl 硫酸H2SO4硝酸HNO3碳酸H2CO3 磷酸H3PO4 碱:氢氧化钠NaOH , 氢氧化钙Ca(OH)2, 氢氧化钡Ba(OH)2氢氧化钾KOH , 氢氧化铁(红褐色)Fe(OH)3 氢氧化铜(蓝色)Cu(OH)2, 氢氧化镁(白色)Mg(OH)2盐:盐酸盐:氯化钠NaCl , 氯化镁MgCl2, 氯化铝AlCl3氯化钾KCl , 氯化铁FeCl3, 氯化亚铁FeCl2, 氯化锌ZnCl2 氯化钡BaCl2, 氯化铜CuCl2, 氯化银AgCl
碳酸盐:碳酸钙CaCO3, 碳酸钠Na2CO3, 碳酸钾K2CO3碳酸钡BaCO3 硫酸盐: 硫酸亚铁FeSO4, 硫酸铁Fe2(SO4)3, 硫酸钠Na2SO4 硫酸镁MgSO4, 硫酸铝Al2(SO4)3, 硫酸铜CuSO4 硫酸锌ZnSO4, 硫酸钡BaSO4 硝酸盐:硝酸银AgNO3硝酸汞Hg(NO3)2硝酸锌Zn(NO3)2 硝酸钡Ba(NO3)2硝酸铝Al(NO3)3硝酸铁Fe(NO3)3 硝酸铜Cu(NO3)2硝酸钙Ca(NO3)2 常见的离子: 钾离子K+,钠离子Na+,银离子Ag+,氢离子H+ , 氟离子F-,氯离子Cl-,钙离子Ca2+,镁离子Mg2+,钡离子Ba2+ , 锌离子Zn2+,汞离子Hg2+,铜离子Cu2+,亚铁离子Fe2+ , 铁离子Fe3+,铝离子Al3+,氧离子O2-, 硫离子S2-, 碳酸跟离子CO32-, 硫酸根离子SO42- , 硝酸根离子NO3- 氢氧根离子OH- , 铵根离子NH4+, 磷酸根离子PO43- 化学方程式 一、化合反应 1、镁在空气中燃烧:2Mg+ O2点燃2MgO 2、铁在氧气中燃烧:3Fe +2O2点燃Fe3O4 3、铝在空气中燃烧:4Al+ 3O2点燃2Al2O3 4、铜在空气中受热:2Cu+ O2加热2CuO 5、氢气在空气中燃烧:2H2 +O2点燃2H2O 6、红磷在空气中燃烧:4P +5O2点燃2P2O5 7、硫粉在空气中燃烧:S+ O2点燃SO2 8、碳在氧气中充分燃烧:C +O点燃CO2 二、分解反应 1、实验室用双氧水制氧气:2H2O2 MnO2 2H2O +O2↑ 2、加热高锰酸钾:2KMnO加热K2MnO4 + MnO2+O2↑
初三化学教案元素,元素符号 初三化学教案元素,元素符号 教学目标 知识目标: 了解元素概念的涵义及元素符号的表示意义;学会元素符号的正确写法;了解并记忆常见的24种元素符号。 理解单质和化合物的概念。 理解氧化物的概念。 能力目标: 培养学生归纳概括能力及查阅资料的能力。 情感目标: 树立量变引起质变的辩证唯物主义观点。 教学建议 教学重难点 重点:元素概念的形成及理解。 难点:概念之间的区别与联系。 教材分析: 本节要求学生学习的概念有元素、单质、化合物、氧化物等,而且概念比较抽象,需要学生记忆常见的元素符号及元素名称也比较多,学生对这些知识的掌握程度将是初中化学的学习一个分化点。这节课是学生学好化学的基础课,所以在教学中要多结合实例,多做练习,使学生在反复实践中去加深理解和巩固,是所学
的化学用语、概念得到比较清晰的对比、区分和归类。 化学用语的教学: 元素符号是化学学科重要的基本的化学用语,必须将大纲中规定要求记住的常见元素符号记牢,为以后的学习打下坚实的基础。元素符号的读法、写法和用法,它需要学生直接记忆并在以后的运用中直接再现的知识和技能。教学中应最好采用分散记忆法,在此过程中,进行元素符号发展简史的探究活动,课上小组汇报。这样既增加了学生的兴趣、丰富了知识面,又培养了学生的查阅资料及表达能力。 关于元素概念的教学 元素的概念比较抽象,在教学时应从具体的物质着手,使他们知道不同物质里可以含有相同种类的原子,然后再指出这些原子之所以相同:是因为它们具有相同的核电荷数,并由此引出元素的概念。 例如:说明以下物质是怎样构成的? 氧气氧分子氧原子 水水分子氧原子和氢原子 二氧化碳二氧化碳分子氧原子和碳原子 五氧化二磷五氧化二磷氧原子和磷原子 这些物质分子的微粒中都含有氧原子,这些氧原子的核电荷数都是8,凡是核电荷数是8的原子都归为同一类,称氧元素。此外,把核电荷数为6的同一类原子称为碳元素;将核电荷数为15的同
2017年01月18日阿甘的高中化学组卷 一.选择题(共15小题) 1.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是() A.原子半径:W>Z>Y>X B.最高价氧化物对应水化物的酸性:X>W>Z C.最简单气态氢化物的热稳定性:Y>X>W>Z D.元素X、Z、W的最高化合价分别与其主族序数相等 2.如表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素原子的核电荷数为X元素的2倍.下列说法正确的是() X Y Z W T A.X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增 C.YX2晶体熔化、液态WX3气化均需克服分子间作用力 D.根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性 3.短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13.X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素.下列说法正确的是() A.原子半径的大小顺序:r(Y)>r(Z)>r(W) B.元素Z、W 的简单离子的电子层结构不同 C.元素Y 的简单气态氢化物的热稳定性比Z 的强
D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物4.下列物质的电子式书写正确的是() A . B . C . D . 5.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法正确的是() A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大 B.元素X不能与元素Y形成化合物X2Y2 C.元素Y、R分别与元素X形成的化合物的热稳定性:X m Y>X m R D.元素W、R的最高价氧化物的水化物都是强酸 6.下表是元素周期表的一部分,有关说法正确的是() ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 族 周期 2a b 3d e f g h i ①a、b、e、f四种元素的元素的原子半径:e>f>b>a ②h、i两种元素阴离子的还原性:h>i ③a、g两种元素氢化物的稳定性:a>g ④d、e、f三种元素最高价氧化物对应的水化物的碱性依次增强 ⑤八种元素中d元素的单质还原性最强,i元素的单质氧化性最强. A.①③④B.②③⑤C.②④⑤D.①③⑤ 7.X、Y、Z、W、R均是短周期元素,它们在元素周期表中的相对位置如图所示,其中W的最高正化合价与最低负化合价绝对值相等.下列说法正确的是() X Y Z W R A.X、Y形成的某种化合物可作为呼吸面具中X2的来源 B.Z、W、R分别与X形成的化合物的水化物都是强酸 C.气态氢化物的热稳定性:H m X>H m R>WH n
常见的元素符号: 氢氦锂铍硼,碳氮氧氟氖, 钠镁铝硅磷,硫氯氩钾钙。锰钡碘 H He Li Be B , C N O F Ne , Na Mg Al Si P , S Cl Ar K Ca 。Mn Ba I 常见元素的化合价:金正,非负,单质零,氢+1,氧-2,正负总价与为零。 钾钠银氢+1价,钙镁钡锌+2价;氟氯溴碘-1价,通常氧就是-2价; 铜+1,+2铝+3; 铁有+2,+3 硅+4; 2,4,6硫 2,4碳; 氮磷-3,+5最常见;2,4,6,7锰变价;单质中元素零价要记清。 化学式:单质:氢气H2氧气O2氮气N2氯气Cl2氖气Ne碳 C 铜Cu铁Fe 化合物:氧化物一氧化碳CO二氧化碳CO2五氧化二磷P2O5二氧化硫SO2二氧化锰MnO2三氧化二铁Fe2O3四氧化三铁Fe3O4氧化亚铁FeO氧化镁MgO氧化钙CaO三氧化二铝Al2O3氧化汞HgO氧化铜CuO 盐酸HCl硫酸H2SO4硝酸HNO3碳酸H2CO3磷酸H3PO4 氢氧化钠NaOH氢氧化钙Ca(OH)2氢氧化钡Ba(OH)2氢氧化钾KOH氢氧化铁Fe(OH)3氢氧化铜Cu(OH)2氯化钠NaCl氯化镁MgCl2氯化铝AlCl3 氯化钾 KCl氯化铁FeCl3氯化亚铁FeCl2氯化锌ZnCl2 氯化钡BaCl2氯化铜CuCl2氯化银AgCl(盐酸盐) 碳酸钙CaCO3碳酸钠Na2CO3碳酸钾K2CO3碳酸钡BaCO3 硫酸亚铁FeSO4硫酸铁Fe2(SO4)3硫酸钠Na2SO4硫酸镁MgSO4 硫酸铝Al2(SO4)3硫酸铜CuSO4硫酸锌ZnSO4硫酸钡BaSO4 硝酸银AgNO3硝酸汞Hg(NO3)2硝酸锌Zn(NO3)2硝酸钡Ba(NO3)2 硝酸铝Al(NO3)3硝酸铁Fe(NO3)3硝酸铜Cu(NO3)2硝酸钙Ca(NO3)2 硝酸根氢氧 根 碳酸 根 硫酸 根 磷酸 根 铵根 高锰酸 根 锰酸 根 符号NO 3OH CO 3 SO 4 PO 4 NH 4 MnO 4 MnO 4 离子符号NO 3-OH-CO 3 2-SO 4 2-PO 4 3-NH 4 +MnO 4 -MnO 4 2- 化合价表示法 -1 NO3 -1 OH -2 CO 3 -2 SO 4 -3 PO 4 +1 NH 4 -1 MnO 4 -2 MnO 4 -1硝酸、氢氧根,-2碳酸、硫酸根,-3记住磷酸根,+1价的就是铵根。 常见的离子:钾离子 K+ ,钙离子 Ca2+ ,钠离子 Na+ ,镁离子 Mg2+铝离子 Al3+ ,锌离子 Zn2+ ,铁离子 Fe3+ ,氢离子 H+ 铜离子 Cu2+ ,汞离子 Hg2+ ,银离子 Ag+ ,氧离子 O2- 氟离子 F- ,硫离子 S2- ,氯离子 Cl- ,亚铁离子 Fe2+ 1-20号元素的原子结构示意图: 质子:一个质子带一个单位的正电荷。 原子核(带正电) 原子中子:不带电。 核外电子:一个电子带一个单位的负电荷。 原子中:核电荷数=质子数=核外电子数相对原子质量= 质子数+ 中子数 6、相对原子质量= 某一原子的实际质量 一种碳原子质量的1/12 (无单位)化学用语 一、记住27种元素的名称与符号。 H He C N O F Ne Na Mg Al Si P S Cl 氢氦碳氮氧氟氖钠镁铝硅磷硫氯
高中化学方程式
一、非金属单质(F2,Cl2,O2,S,N2,P,C,Si,H) 1、氧化性: ①氟F2+H2===2HF (阴暗处爆炸) 2F2+2H2O===4HF+O2 (水是还原剂) 2F2+2NaOH===2NaF+OF2+H2O 熔融条件下:F
氟气与稀有气体反应:F2+Xe(过量)==XeF22F2(过量)+Xe==XeF4(XeF4是强氧化剂,能将Mn2+氧化为MnO4–) 氟气与金属反应:nF2+2M===2MFn(M表示大部分金属) 氟气与其他卤素元素反应:7F2(过量)+I2===2IF7F2+Cl2(等体积)===2ClF (ClF属于类卤素:ClF+H2O==HF+HClO ) 3F2(过量)+Cl2===2ClF3 (ClF3+3H2O==3HF+HClO3 ) ②氯气Cl2+H22HCl (将H2在Cl2点燃;混合点燃、加热、光照发生爆炸) 3Cl2+2P2PCl3Cl2+PCl3PCl5Cl2+2Na2NaCl 3Cl2+2Fe2FeCl3Cl2+Cu CuCl2 ③氧气2O2+3Fe Fe3O4O2+K===KO2 ④硫S+H2H2S 2S+C CS2S+Zn ZnS S+Fe FeS (既能由单质制取,又能由离子制取) S+2Cu Cu2S (只能由单质制取,不能由离子制取) 3S+2Al Al2S3 (只能由单质制取,不能由离子制取) ⑤氮气N2+3H2催化剂 高温高压 2NH3N2+3Mg Mg3N2N2+3Ca Ca3N2 N2+3Ba Ba3N2N2+6Na2Na3N N2+6K2K3N N2+6Rb2Rb3N N2+2Al2AlN ⑥磷P4+6H24PH3P+3Na Na3P 2P+3Zn Zn3P2H2+2Li2LiH 2、还原性 ①硫S+O2SO2S+H2SO4(浓)3SO2↑+2H2O S+6HNO3(浓)H2SO4+6NO2↑+2H2O S+4H++6==6NO2↑+2H2O+-2 4 SO 3S+4HNO3(稀)3SO2+4NO↑+2H2O 3S+4H++4- 3 NO3SO2+4NO↑+2H2O ②氮N2+O2 2NO ③磷4P+5O2P4O10(常写成P2O5) 2P+3X22PX3(X表示F2,Cl2,Br2)PX3+X2 PX5 P4+20HNO3(浓)4H3PO4+20NO2↑+4H2O ④碳C+2F2CF4C+2Cl2CCl4 C+O2(足量)CO2 2C+O2(少量)2CO C+CO22CO C+H2O CO+H2(生成水煤气) 2C+SiO2Si+2CO(制得粗硅) ⑤硅Si(粗)+2Cl2SiCl4(SiCl4+2H2===Si(纯)+4HCl) Si(粉)+O2SiO2Si+C SiC(金刚砂) Si+2NaOH+H2O==Na2SiO3+2H2↑(Si+2OH-+H2O=-2 3 SiO+2H2↑) 3、歧化反应 Cl 2+H2O==HCl+HClO(加碱或光照促进歧 化: (Cl2+H2O H++Cl–+HClO) Cl2+2NaOH==NaCl+NaClO+H2O (Cl2+2OH–=Cl–+ClO–+H2O) Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O (Cl2+2OH–=Cl–+ClO–+H2O) 3Cl2+6KOH(浓)5KCl+KClO3+3H2O ( 3Cl2+6OH–5Cl–+ClO3–+3H2O) 3S+6NaOH2Na2S+Na2SO3+3H2O(3S+6OH–2S2–+SO32–+3H2O) 4P+3KOH(浓)+3H2O==PH3↑+3KH2PO2(4P+3OH–+3H2O==PH3↑+3H2PO2–)
元素周期律和元素周期表习题 知识网络 中子N 原子核 质子Z 原子结构 : 电子数(Z 个)核外电子 排布规律 → 电子层数 周期序数及原子半径 表示方法 → 原子(离子)的电子式、原子结构示意图 随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化 ①、原子最外层电子的周期性变化(元素周期律的本质) 元素周期律 ②、原子半径的周期性变化 ③、元素主要化合价的周期性变化 ④、元素的金属性与非金属性的周期性变化 ①、按原子序数递增的顺序从左到右排列; 元素周期律和 排列原则 ②、将电子层数相同的元素排成一个横行; 元素周期表 ③、把最外层电子数相同的元素(个别除外)排成一个纵行。 ①、短周期(一、二、三周期) 周期(7个横行) ②、长周期(四、五、六周期) 周期表结构 ③、不完全周期(第七周期) ①、主族(ⅠA ~ⅦA 共7个) 族(18个纵行) ②、副族(ⅠB ~ⅦB 共7个) ③、Ⅷ族(8、9、10纵行) ④、零族(稀有气体) 同周期同主族元素性质的递变规律 ①、核外电子排布 ②、原子半径 性质递变 ③、主要化合价 ④、金属性与非金属性 ⑤、气态氢化物的稳定性 ⑥、最高价氧化物的水化物酸碱性 电子层数 相同条件下,电子层越多,半径越大。 判断的依据 核电荷数 相同条件下,核电荷数越多,半径越小。 最外层电子数 相同条件下,最外层电子数越多,半径越大。 微粒半径的比较 1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外) 如:Na>Mg>Al>Si>P>S>Cl. 2、同主族元素的原子半径随核电荷数的增大而增大。如:Li
化学元素周期表性质 1元素周期表中元素及其化合物的递变性规律 1.1原子半径 (1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小; (2)同一族的元素从上到下,随电子层数增多,原子半径增大。 1.2元素化合价 (1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外); (2)同一主族的元素的最高正价、负价均相同 1.3单质的熔点 (1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增 1.4元素的金属性与非金属性 (1)同一周期的元素从左到右金属性递减,非金属性递增; (2)同一主族元素从上到下金属性递增,非金属性递减。 1.5最高价氧化物和水化物的酸碱性 元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。 1.6非金属气态氢化物 元素非金属性越强,气态氢化物越稳定。同周期非金属元素的非金属性越强,其气态氢化物水溶液一般酸性越强;同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱。 1.7单质的氧化性、还原性 一般元素的金属性越强,其单质的还原性越强,其氧化物的氧离子氧化性越弱;元素的非金属性越强,其单质的氧化性越强,其简单阴离子的还原性越弱。 2.推断元素位置的规律 判断元素在周期表中位置应牢记的规律: (1)元素周期数等于核外电子层数; (2)主族元素的序数等于最外层电子数; (3)确定族数应先确定是主族还是副族,其方法是采用原子序数逐步减去各周期的元素种数,即可由最后的差数来确定。最后的差数就是族序数,差为8、9、10时为VIII族,差数大于10时,则再减去10,最后结果为族序数。
化学文档中常见符号集锦 目录 一、数字顺序 二、罗马数字 三、希腊字母 四、常见符号 五、常见物理量 六、上、下标 七、转移电子 八、反应符号 九、其他符号 十、常见元素符号 十一、物理量及单位符号 十二、常见物质名称及化学式 十三常见有机物化学式 十四、常见的离子 十五、常见晶胞 十六、电子式 十七、原子结构示意图
化学文档中常见符号集锦 说明:将符号复制、粘贴到需要得文档就可。 一、数字顺序: ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ? ? ? ? ? ? ? ? ? ? 二、罗马数字: I II III IV V VI VII VIII IX IX 三、希腊字母 φ σ ρ π v μ λ ε ? δ γ β α 四、常见符号 黑点 ● " ′ ° 加热 △ ℃ ≥ ≤ > < 比号 : ÷ × 单键 — 双键= 三键 ≡ 五、常见物理量: 焓 ?H 平均值 -M 平均摩尔质量 -r M 平均相对分子质量 -r A 摩尔质量 M () 相对分子质量 M r 相对原子质量 A r 速率v 计量系数ν 密度 ρ 转化率 α 体积分数 ? 物质的量分数 x 质量分数 w () 六、上、下标 5+ 4+ 3+ 2+ 72 - 44 - 43 - 42 - 32 - 4- 3- 2- SO 2-4 SO 2-3 S 2O 2-3 NO - 3 NO - 2 PO 3-4 SiO 2- 3 CO 2-3 NH + 4 HSO - 3 H 2PO - 4 AlO -2 ClO -3 MnO -4 Cr 2O 2-7 HCO -3 IO -3 七、转移电子 2 = MnCl 2+Cl 2↑+2H 2O - 22+Cl 2↑+2H 2O - 2↑+2H 2O -
人教部编版高中化学常见元素的性质特征或结构特征 常见元素的性质特征或结构特征 (1)氢元素 a.核外电子数等于电子层数的原子; b.没有中子的原子; c.失去一个电子即为质子的原子; d.得一个电子就与氦原子核外电子排布相同的原子; e.质量最轻的原子;相对原子质量最小的原子;形成单质最难液化的元素; f.原子半径最小的原子; g.形成的单质为相同条件下相对密度最小的元素; h.形成的单质为最理想的气体燃料; i.形成酸不可缺少的元素; (2)氧元素 a.核外电子数是电子层数4倍的原子; b.最外层电子数是次外层电子数3倍的原子; c.得到两个电子就与氖原子核外电子排布相同的原子; d.得到与次外层电子数相同的电子即达到8电子稳定结构的原子; e.地壳中含量最多的元素;
f.形成的单质是空气中第二多的元素; g.形成的单质中有一种同素异形体是大气平流层中能吸收太阳光紫外线的元素; h.能与氢元素形成三核10电子分子(H2O)的元素; i.能与氢元素形成液态四核18电子分子(H2O2)的元素; j.在所有化合物中,过氧化氢(H2O2)中含氧质量分数最高; k.能与氢元素形成原子个数比为1:1或1:2型共价液态化合物的元素; l.能与钠元素形成阴、阳离子个数比均为1:2的两种离子化合物的元素; (3)碳元素 a.核外电子数是电子层数3倍的原子; b.最外层电子数是次外层电子数2倍的原子; c.最外层电子数是核外电子总数2/3的原子; d.形成化合物种类最多的元素; e.形成的单质中有一种同素异形体是自然界中硬度最大的物质; f.能与硼、氮、硅等形成高熔点、高硬度材料的元素; g.能与氢元素形成正四面体构型10电子分子(CH4)的元素;
高中化学常见化学元素的性质和结构 在高中的化学学习中,我们首先要入门的是对一些常见的化学元素性质和结构有明确的认知和理解,这样在实验的过程中,能更加明白实验过程的原理和化学方程式的书写。下面小编就给大家整理了一份高中化学考试中比较常见的化学元素的性质和结构。 (1)氢元素 a. 核外电子数等于电子层数的原子; b. 没有中子的原子; c. 失去一个电子即为质子的原子; d. 得一个电子就与氦原子核外电子排布相同的原子; e. 质量最轻的原子;相对原子质量最小的原子;形成单质最难液化的元素; f. 原子半径最小的原子; g. 形成的单质为相同条件下相对密度最小的元素; h. 形成的单质为最理想的气体燃料; i. 形成酸不可缺少的元素; (2)氧元素 a. 核外电子数是电子层数4倍的原子; b. 最外层电子数是次外层电子数3倍的原子; c. 得到两个电子就与氖原子核外电子排布相同的原子; d. 得到与次外层电子数相同的电子即达到8电子稳定结构的原
子; e. 地壳中含量最多的元素; f. 形成的单质是空气中第二多的元素; g. 形成的单质中有一种同素异形体是大气平流层中能吸收太阳光紫外线的元素; h. 能与氢元素形成三核10电子分子(H2O)的元素; i. 能与氢元素形成液态四核18电子分子(H2O2)的元素; j. 在所有化合物中,过氧化氢(H2O2)中含氧质量分数最高; k. 能与氢元素形成原子个数比为1:1或1:2型共价液态化合物的元素; l. 能与钠元素形成阴、阳离子个数比均为1:2的两种离子化合物的元素; (3)碳元素 a. 核外电子数是电子层数3倍的原子; b. 最外层电子数是次外层电子数2倍的原子; c. 最外层电子数是核外电子总数2/3的原子; d. 形成化合物种类最多的元素; e. 形成的单质中有一种同素异形体是自然界中硬度最大的物质; f. 能与硼、氮、硅等形成高熔点、高硬度材料的元素; g. 能与氢元素形成正四面体构型10电子分子(CH4)的元素; h. 能与氢元素形成直线型四核分子(C2H2)的元素; i. 能与氧元素形成直线型三核分子(CO2)的元素。
高中化学重要知识点:化学元素符号快 速记忆 一、拼音法 钠、钡、氟、钨、锂:这些元素名称的汉语拼音与该元素的元素符号相似,如钠元素,钠的汉语拼音为n;钡元素,钡的读音由汉语拼音b的发音与英语字母a的发音拼成;氟元素,氟的读音的声母为f,钨元素,钨的汉语拼音的声母为w锂元素,锂的汉语拼音为lǐ。 二、形象法 有些元素的元素符号可采用形象的方法记忆。例如,钨元素,可以联想白炽灯内的钨丝,酷似w硫元素,可以联想起弯弯曲曲的小溪中的流水,形如S氧元素,可以联想圆圆的太阳形状;钾元素,可以联想到剪指甲时张开的剪刀的形状。 三、谐音法 如金元素,可以设想这样的情景:有人突然看到地上有一块金光闪闪的金子,他一定会情不自禁地发出哎哟的惊叹声,这哎哟的发音不正是英文字母Au的发音吗? 四、韵语法 其一:按字母对比记忆法。 如:金银铝氩A开头,B字开头钡和溴,钙铜碳氯先写c,m领头锰和镁。
常用元素符号按英文字母顺序对比记忆:A:Ag、Al、Ar、Au。 B:Be、B、Ba。 c:c、cl、ca、cu。 F:F H:H、He、Hg。 I:I。 k:k。 L:Li。 m:mg、mn。 N:N、Na、Ne。 o:o。 P:P、Pb。 S:S、Si。 w:w。 Z:Zn。 其二:前二十种元素五个一组记忆法。氢氦锂铍硼, 碳氮氧氟氖, 钠镁铝硅磷, 硫氯氩钾钙。 其三:金属活动顺序表。
钾钙钠镁铝, 锌铁锡铅氢, 铜汞银铂金。 五、联想记忆法。 碳元素符号:c英文单词coke是碳酸饮料所以碳---c 铜元素符号:cu人体中如果有大量铜元素对人体有害所以我们要对铜元素说:seeyou谐音cu 硅元素符号:Si龟很长寿所以不死死读作Si 氧元素符号:o人要呼吸氧气才能生存,o就像人张嘴呼吸 硫元素符号:S硫的谐音流,S就像流水 氦元素符号:He氖元素符号:Ne拼音hainai 氮元素符号:N氮气被认为是无用的气体没有英文No所以氮元素是N 氢元素符号:H氢气密度很小,很轻,常做成氢气球往上升符号H就像一个梯子,让你往上爬 钙元素符号:ca联想ca锅钙 钾元素符号:k甲乙丙丁中甲排行老大是king所以是k 锰元素符号:mn猛男 镁元素符号:mg美丽的女孩meigirl 铜元素符号:cu铜生锈变成青绿色感觉酸酸的,象醋 铝元素符号:Al过量铝元素对人体有害可能会导致老年
高中化学:《原子结构与元素的性质》测试卷 一、单选题(共15小题) 1.某原子核外电子排布式为n s2n p7,它违背了() A.泡利不相容原理 B.能量最低原理 C.洪特规则 D.洪特规则特例 2.依据元素周期律及元素周期表知识,下列推断正确的是() A.酸性:H2SiO3>H2CO3 B.热稳定性:H2Se>H2S>H2O C.碱性:CsOH>Ca(OH)2 D.若离子半径:R2->M+,则原子序数:R>M 3.已知三种微粒(原子或离子)的电子排布式如下:11X:1s22s22p619Y:1s22s22p63s23p620Z:1s22s22p63s23p6若将上述三种微粒归为同一类,下列微粒中也可归为此类的是() A.答案A B.答案B C.答案C D.答案D 4.下列四种元素中,第一电离能由大到小的顺序正确的是() ①原子含有未成对电子最多的第2周期元素②电子排布为1s2的元素③周期表中电负性最强的元素④原子最外层电子排布为3s23p4的元素 A.②③①④ B.③①④② C.①③④② D.无法比较 5.如下图为元素周期表的一部分,X、Y、Z、W均为短周期元素,若Z原子最外层电子数是次外层电子数的.则下列说法正确的是()
A. X、Y二种元素都仅能形成一种单质 B. X与O2反应的产物可作为干燥NH3的干燥剂 C. Z的氧化物中有一种是形成酸雨的主要物质 D. W不能形成含氧酸 6.下列选项中所发生的现象与电子的跃迁无关的是() A.平面镜成像 B.霓虹灯广告 C.燃烧蜡烛 D.燃放烟火 7.下列说法中正确的是() A.基态原子是处于最低能量状态的原子 B.基态C原子的电子排布式是1s22s12p3 C.焰色反应是金属原子的电子从基态跃迁到激发态时产生的光谱 D.同一原子处于激发态时的能量一定低于基态时的能量 8.某元素的最高正价与负价的代数和为4,则该元素原子的最外层电子数为()A. 4 B. 5 C. 6 D. 7 9.第三周期元素中,微粒半径最大的是() A. Na B. Na+ C. S2- D. Cl- 10.下列叙述正确的是( ) A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数B. X、Y均为短周期元素,其简单离子m X a+与n Y b-的电子层结构相同,则m+a=n-b C. F、Cl、Br的最外层电子数都是7,次外层电子数都是8
高中化学元素符号的快速记忆方法~~ 怎样让学生尽快记住近三十个元素符号,除了死记硬背外,露珠搜索了一些方法,教给你们,希望你们感到记忆的趣味性,从而快速记忆。 一、拼音法 钠(Na)、钡(Ba)、氟(F)、钨(W)、锂(Li):这些元素名称的汉语拼音与该元素的元素符号相似,如钠元素(Na),“钠”的汉语拼音为nà;钡元素(Ba),“钡”的读音由汉语拼音“b”的发音与英语字母“a”的发音拼成;氟元素(F),“氟”的读音的声母为“f”,钨元素(W),“钨”的汉语拼音的声母为“w”;锂元素(Li),“锂”的汉语拼音为“lǐ”。 二、形象法 有些元素的元素符号可采用形象的方法记忆。例如,钨元素(W),可以联想白炽灯内的钨丝,酷似“W”形;硫元素(S),可以联想起弯弯曲曲的小溪中的流水,形如“S”状;氧元素(O),可以联想圆圆的太阳形状;钾元素(K),可以联想到剪指甲时张开的剪刀的形状。 三、谐音法 如金元素(Au),可以设想这样的情景:有人突然看到地上有一块金光闪闪的金子,他一定会情不自禁地发出“哎哟”的惊叹声,这“哎哟”的发音不正是英文字母“Au”的发音吗? 四、韵语法 其一:按字母对比记忆法。 如:金银铝氩“A”开头,“B”字开头钡和溴,钙铜碳氯先写“C”,“M”领头锰和镁。 常用元素符号按英文字母顺序对比记忆: A:Ag(银)、Al(铝)、Ar(氩)、Au(金)。 B:Be(铍)、B(硼)、Ba(钡)。 C:C(碳)、Cl(氯)、Ca(钙)、Cu(铜)。 F:F(氟) H:H(氢)、He(氦)、Hg(汞)。 I:I(碘)。
K:K(钾)。 L:Li(锂)。 M:Mg(镁)、Mn(锰)。 N:N(氮)、Na(钠)、Ne(氖)。 O:O(氧)。 P:P(磷)、Pb(铅)。 S:S(硫)、Si(硅)。 W:W(钨)。 Z:Zn(锌)。 其二:前二十种元素五个一组记忆法。 氢(H)氦(He)锂(Li)铍(Be)硼(B), 碳(C)氮(N)氧(O)氟(F)氖(Ne), 钠(Na)镁(Mg)铝(Al)硅(Si)磷(P), 硫(S)氯(Cl)氩(Ar)钾(K)钙(Ca)。 其三:金属活动顺序表(也便于以后应用)。 钾(K)钙(Ca)钠(Na)镁(Mg)铝(Al), 锌(Zn)铁(Fe)锡(Sn)铅(Pb)氢(H), 铜(Cu)汞(Hg)银(Ag)铂(Pt)金(Au)。 五、联想记忆法。 碳元素符号:C英文单词Coke(可乐)是碳酸饮料所以碳---C 铜元素符号:Cu人体中如果有大量铜元素对人体有害所以我们要对铜元素说:“seeyou”谐音Cu