
分析化学教案
第六章络合滴定法
要求:1. 理解络合物平衡体系中的形成常数和离解常数,逐级形成常数和逐级离解常数、积累形成常数和积累离解常数、总形成常数和总离解常数的意义。
2. 了解副反应对络合平衡的影响和络合物表观稳定常数的意义。
3. 了解乙二胺四乙酸(即EDTA)滴定过程中,金属离子浓度的变化规律,影响滴定突跃大小的因
素,掌握络合滴定条件。
4. 了解金属指示剂的作用原理。熟悉几种常用金属指示剂的性能和选用条件。
5. 掌握络合滴定的有关计算方法。
重点:副反应的影响;配位滴定条件;配位滴定的有关计算
进程:
§6-1 络合滴定法概述
络合滴定法是以形成络合物的反应为基础的滴定分析方法。络合滴定的反应是金属离子和阴离子(或分子)以配位键结合生成络离子的反应。
能用于络合滴定的反应必须具备以下几个条件:
①形成的络合物(或络离子)要相当稳定;
②在一定的反应条件下,必须生成配位数一定的络合物;
③络合反应速度要快;
④要有适当的指示剂或其它方法,简便、正确地指出反应等量点的到达。
一、络合滴定中的滴定剂
无机配位反应中,除个别反应(如Ag+与CN -,Hg2+与Cl-等反应)外,大多数不能用于络合滴定。
有机配位剂分子中常含有两个以上的可键合的原子,与金属离子配位时形成低配位比的具有环状结构
的螯合物。有机配位反应广泛用于配位滴定分析中。
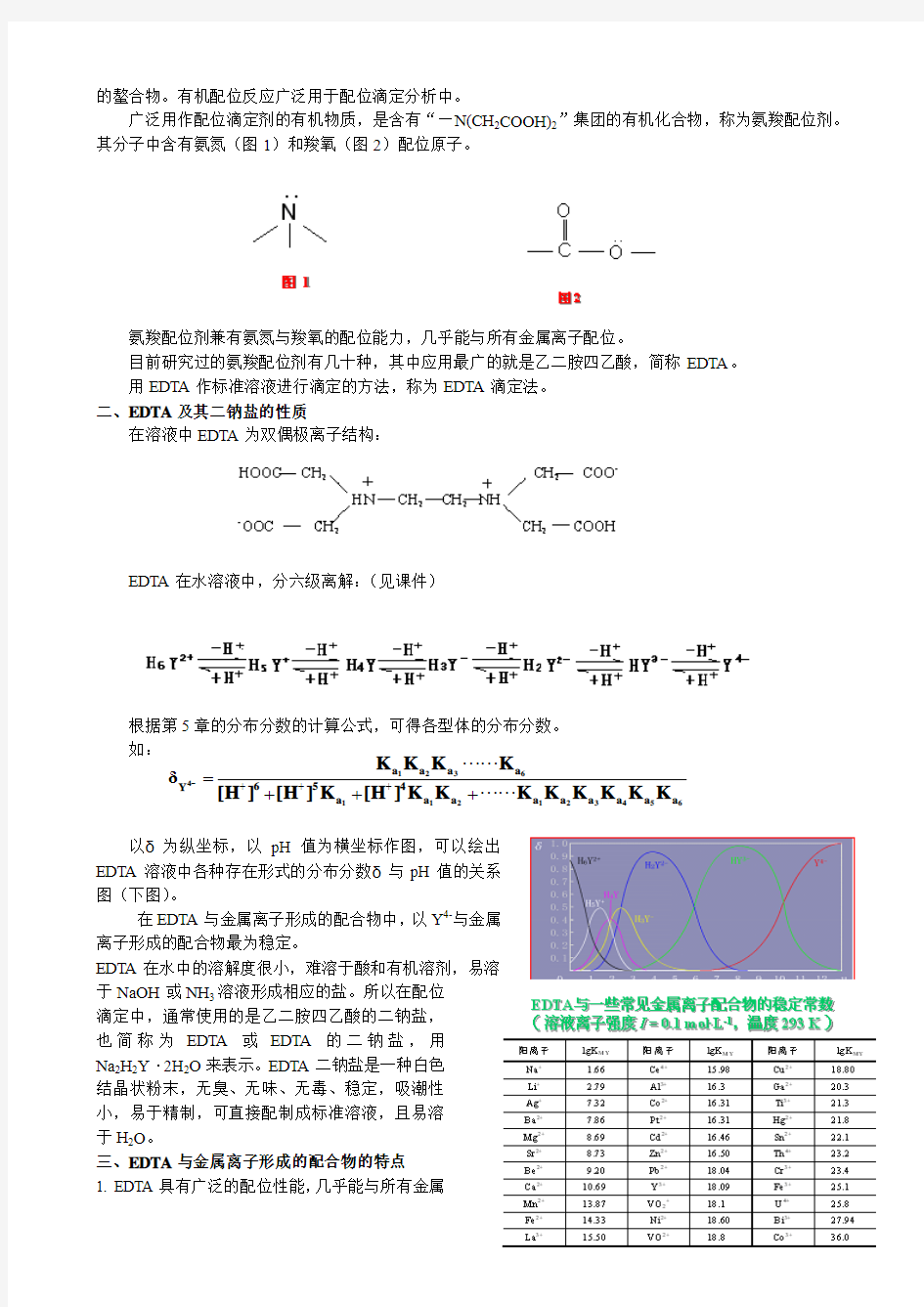
广泛用作配位滴定剂的有机物质,是含有“—N(CH 2COOH)2”集团的有机化合物,称为氨羧配位剂。其分子中含有氨氮(图1)和羧氧(图2)配位原子。
氨羧配位剂兼有氨氮与羧氧的配位能力,几乎能与所有金属离子配位。
目前研究过的氨羧配位剂有几十种,其中应用最广的就是乙二胺四乙酸,简称EDTA 。 用EDTA 作标准溶液进行滴定的方法,称为EDTA 滴定法。 二、EDTA 及其二钠盐的性质
在溶液中EDTA 为双偶极离子结构:
EDTA 在水溶液中,分六级离解:(见课件)
根据第5章的分布分数的计算公式,可得各型体的分布分数。 如:
以δ为纵坐标,以pH 值为横坐标作图,可以绘出EDTA 溶液中各种存在形式的分布分数δ与pH 值的关系图(下图)。
在EDTA 与金属离子形成的配合物中,以Y 4-与金属离子形成的配合物最为稳定。
EDTA 在水中的溶解度很小,难溶于酸和有机溶剂,易溶于NaOH 或NH 3溶液形成相应的盐。所以在配位滴定中,通常使用的是乙二胺四乙酸的二钠盐,也简称为EDTA 或EDTA 的二钠盐,用Na 2H 2Y ·2H 2O 来表示。EDTA 二钠盐是一种白色结晶状粉末,无臭、无味、无毒、稳定,吸潮性小,易于精制,可直接配制成标准溶液,且易溶于H 2O 。
三、EDTA 与金属离子形成的配合物的特点 1. EDTA 具有广泛的配位性能,
几乎能与所有金属
6
54321211
6
3214a a a a a a a a 4
a 56
a a a a Y K K K K K K K K ][H K ][H ][H K
K K K δ +++=+++
-
离子
形成配合物,且绝大多数EDTA 配合物相当稳定。
一些金属离子与EDFTA 形成的配合物的稳定常数(见下表)。表中数据有何规律? 稳定常数具有以下规律:
(1)碱金属离子的配合物最不稳定, lg KMY <3; (2)碱土金属离子的 lgK MY = 8~11;
(3)过渡金属、稀土金属离子和Al 3+的 lgK MY =15~19 (4)三价,四价金属离子及Hg 2+的lgK MY >20
在适当条件下,只要lgK 稳>8就可以准确测定(后面要讲),因此,既使碱土金属也可用EDTA 滴定。
注:①表中数据是指无副反应的情况下的数据, 不能反映实际滴定过程中的真实状况。
②配合物的稳定性受两方面的影响:金属离子自身性质和外界条件。
引入:条件稳定常数。
2. EDTA 与金属离子形成配合物的配位比简单,在一般情况下,几乎均为1∶1。
3. EDTA 与金属离子形成的络合物大多带电荷,能溶于H 2O 中,一般络合反应迅速,使滴定能在水溶液中进行。
4. EDTA 与无色金属离子形成的络合物无色,而与有色金属离子则生成颜色更深的络合物。 §6-2 溶液中各级络合物型体的分布 一、络合物的形成常数
(一)ML (1∶1)型络合物
如果以M 代表金属离子,L 代表络合剂。M 和L 以1∶1配位,则生成配位比为1∶1的络合物。 为简便起见,书写时省略离子的电荷符号。
即 M + L
ML 平衡时,
如果考虑ML 的离解,则
ML M + L 平衡时,
(二)MLn (1∶n )型络合物
对于配位比为1∶n 的络合物(四师P.156),由于MLn 的形成和离解都是逐级进行的,所以有逐级(各级)形成常数(k i 形)、逐级离解常数(ki 离解)和积累形成常数(βi )、积累离解常数之分。
如:(见课件)
对于1∶n 的配合物,同一级的K 形与k 离解不是倒数关系,而是第一级形成常数是第n 级离解常数的倒数,第二级形成常数是第n-1级离解常数的倒数。如此类推。这是逐级形成常数与逐级离解常数的关系。
积累形成常数是各级形成常数的乘积。它与逐级形成常数、逐级离解常数之间的关系为:
(第一级积累形成常数=第一级形成常数=第n 级离解常数的倒数)
[M][L]
[ML]
K K ML =
=形[ML]
[M][L]K =
离解离解
形K 1
K ='n 1k 1k ='1
n 2k 1k -=[M][L]
[ML]
k β11==
(第二级积累形成常数=第一级和第二级形成常数的乘积=第n 级和第n-1级离解常数的乘积的倒数)
最后一级积累形成常数(βn )又叫总形成常数(K 形),最后一级积累离解常数(βn ′)又叫总离解常数(K 离解′)
二、溶液中各级络合物型体的分布
根据物料平衡:
CM=[M]+[ML]+[ML 2]+……+[ML n ]
=[M]+β1[M][L]+β2[M][L]2+……+βn [M][L]n =[M](1+β1[L]+β2[L]2+……βn [L]n )
根据分布分数的定义,就可得到配合物各存在形式的分布分数。
例:在1.0×10-2mol/L 的铜铵溶液中,已知游离NH 3的浓度为1.0×10-3mol/L 。计算Cu 2+、Cu(NH 3)32+
的平衡浓度。
解:查表得 β1=104.15 ; β2=107.63 ; β3=1010.53 ; β4=1012.67
4
3433323231][][][][11
2NH NH NH NH Cu ββββδ++++=+4367.123353.102363.7315.4)100.1(10)100.1(10)100.1(10)100.1(1011----?+?+?+?+=
21004.135
.961-?==434333232313
33)(][][][][1][23
3NH NH NH NH NH NH Cu βββββδ++++=+35.035.96)100.1(103353.10=?=-)/(1004.1100.11004.1][4
22222L mol C Cu Cu Cu ---+?=???=?=++δ'
1'1n 'n n 21n k k k 1
k k k β -?=?=2
2212[M][L]]
[ML k k β=?=n n n 21n [M][L]][ML k k k β=?= n
21n k k k βK ?==总形n 21n k k k βK ''?'='= 总离解总离解
总形K 1
K =)[L]β[L]β[L]β[M](1[M]C [M]δn n 221M M ++++== n
n 221[L]β[L]β[L]β11++++= )[L]β[L]β[L]β[M](1[M][L]βC [ML]δn n 2211M ML ++++== n n 2211[L]β[L]β[L]β1[L]β++++= )[L]β[L]β[L]β[M](1[M][L]βC ][ML δn n 221n n M n ML n ++++== n n 221n
n [L]β[L]β[L]β1[L]β++++=
答:略
§6-3 络合滴定中的副反应和条件形成常数
一、副反应系数
1. 络合剂Y 的副反应及副反应系数 ⑴ EDTA 的酸效应与酸效应系数αY (H )
EDTA 在溶液中有7种存在型体。如果用C Y 代表未与M 配位的EDTA 的总浓度,则
C Y =[H 6Y]+[H 5Y]+[H 4Y]+[H 3Y]+[H 2Y]+[HY]+[Y]
考虑酸效应的影响,Y 的分布分数应为:
)
/(105.3100.135.0])([32)(2332233L mol C NH Cu Cu NH Cu --+
?=??=?=++δ
酸效应系数的大小说明什么问题? 配合物的稳定常数是否反映实际情况?
小结:a. 酸效应系数随溶液酸度增加而增大,随溶液 pH 增大而减小; b. αY(H)的数值大,表示酸效应引起的副反应严重;
c. 通常αY(H) >1, [Y ′] > [Y];当αY(H) = 1时,表示总浓度[Y ′] = [Y]; d. 酸效应系数 = 1 / 分布系数。 αY(H) = 1 /δ
EDTA 与金属离子形成配合物的稳定常数由于酸效应的影响,不能反映不同pH 条件下的实际情况,因而需要引入条件稳定常数。
求得了分布分数值,就可求得酸效应系数,从而可以判断酸度对主反应的影响程度。 ⑵ 共存离子效应
如果溶液中除了金属离子M 以外,还存在着起干扰作用的金属离子N ,则N 也要与Y 配位生成配合物NY ,使EDTA 参与主反应的能力降低,这种因干扰离子而引起的副反应叫干扰离子效应或共存离子效应。
从主反应和副反应式可看出:酸效应的影响可以降低Y 参加主反应的能力,同样,干扰离子N 的影响也会降低Y 参与主反应的能力。此时,假设未与M 配位的Y 的总浓度为C Y 。则 C Y =[Y]+[HY]+[H 2Y]+[H 3Y]+[H 4Y]+[H 5Y]+[H 6Y]+[NY] 如果只考虑酸效应的影响,则
C Y (H )=[Y]+[HY]+[H 2Y]+[H 3Y]+[H 4Y]+[H 5Y]+[H 6Y] 如果只考虑干扰离子的影响,则 C Y (N )=[Y]+[NY] ∴ C Y =C Y (H )+C Y (N )-[Y] 等式两端同除以[Y],则
即 αY =αY (H )+αY (N )-1
或 上式反映了酸度和干扰离子两种因素对Y 的影响。 上式中,可由下两式求得δY (H )和δY (N ): 1
δ1δ1δ1Y(N)
Y(H)Y -+=6
2
1
1
6
21a a a a 56a a a Y(H)K
K K K ][H ][H K K K δ +++=++
如果干扰离子有多种,也可同法导出:
2. 金属离子M 的副反应及副反应系数 ⑴ M 的络合效应与络合效应系数
M 与Y 的配位反应是主反应,如果溶液中还存在另一配位剂L ,它也能与M 形成逐级配合物,使主反应受到影响。这种因辅助配位剂L 而引起的副反应,叫做配位效应。
如果用C M 代表未被EDTA 配位的M 的总浓度, ∵ C M =[M]+[ML]+[ML 2]+……+[ML n ]
=[M]+β1[M][L]+β2[M][L]2+……+βn [M][L]n =[M](1+β1[L]+β2[L]2+……+βn [L]n ) ∴
故 配位效应系数: 如果辅助配位剂有多种,则可按上述同法导出: 总副反应系数:
(注:p 为总的影响因素的数目)
⑵ 金属离子的水解效应和水解效应系数
金属离子M 的副反应除了辅助配位剂L 的影响外,还有水解效应,即OH -也要与M 发生副反应。 OH -及L 的总的影响情况可同法导出”
3. 络合物MY 的副反应及副反应系数αMY
酸式络合物或碱式络合物对MY 影响很小,故可不作考虑。 二、络合物的条件形成常数和绝对形成常数
对于 M + Y MY 这样一个配位反应,如果溶液中没有副反应发生,则络合物的形成常数可用下式表示:
①
当有酸度、其它配位剂影响时,
[Y]=δY ·C Y ; [M]=δM ·C M ; [MY]=δMY ·C MY 将[Y]、[M]及[MY]代入①式
[N]
K 11
[N][Y]K [Y][Y][NY][Y][Y]C [Y]δNY NY Y(N)Y(N)+=+=+==p)
(1δ1
δ1δ1δ1αY(Q)Y(N)Y(H)Y Y -++++== n
n 221M M(L)[L]β[L]β[L]β11
C [M]δ++++==
n n 221M(L)
M(L)[L]β[L]β[L]β1δ1
α++++==
p)(1δ1
δ1δ1δ1αM(B)
M(A)M(L)M M -++++== n
n 221M(OH)][OH β][OH β][OH β1α---++++= M(OH)M(L)M(OH)M(L)M αα1ααα+≈-+
=[M][Y]
[MY]
K MY =Y Y C [Y]δ=M M C [M]δ=MY MY C [MY]δ=
MY Y M MY C δδK =
??
Y M MY '
MY δδK K ??
=
上式左方可以以一个新常数来表示(即用K MY ′表示),这个新常数就叫做表观形成常数或条件形成常数
在多数情况下,配合物MY 所产生的酸式配合物MHY 和M(OH)Y 可以忽略(即δMY =1),故上式简化为:
§6-4 EDTA 滴定曲线 一、滴定曲线的绘制
㈠ 金属离子不与辅助配位剂作用的情况
如果以C Y mol/L 的EDTA 滴定C M mol/L 的金属离子M ,用去EDTA V Y mL ,金属离子M 的体积为V M mL ,则溶液中游离金属离子的浓度可计算如下: 1. 滴定前 [M]=C M mol/L 2. 滴定开始至计量点前
3. 计量点时
4. 计量点后
㈡ 金属离子与辅助配位剂起配位作用的情况
整个滴定过程中要考虑配位效应的影响。 1. 滴定前
2. 滴定开始到计量点前
[M]=δM (L )·C M T ( )
3. 计量点时 )C )(δC (δC δK Y Y M M MY
MY MY ???=
MY Y M MY 'MY lg δlg δlg δlgK lgK -++=MY
Y M MY 'MY lg δp δp δlgK lgK ---=Y
M MY 'MY p δp δlgK lgK --=EDTA M EDTA EDTA M M V V V C V C [M]+-=2sp sp M 'MY [M]C K ='MY sp M sp K C [M]=)
lgK (pC 2
1pM '
MY sp M sp +=[M][Y]
[MY]K '
MY =过量
过量[Y]K [MY][Y]K [MY][M]'MY sp 'MY ?=?=过量
[Y]K C [M]'MY sp M
?=M
M(L)C [M]
δ=()M
L M C δ[M]?=Y
M Y Y M M T
M V V V C V C C +-=sp M
sp M sp 'C C [MY]sp M
T C
4. 计量点后
例:以0.01000 mol/L EDTA 溶液滴定20.00mL 0.01000 mol/L Ca 2+溶液(lgK CaY =10.96),计算在pH=12时,滴定过程中溶液pCa 的变化。
解:pH=12时,EDTA 在溶液中主要存在形式是Y 4-,即[Y 4-]=0.01000 mol/L ① 滴定前 [Ca 2+]=C Ca =0.01000mol/L ∴ pCa = - lg[Ca 2+]=2.0 ②滴定开始到计量点前
设加入19.98mL EDTA 溶液
③ 计量点
∴ pCa = - lg[Ca 2+] = 6.6
④ 计量点后
设加入20.02 mL EDTA 溶液,过量EDTA 溶液的浓度是:
T M M(L)sp C δ[M]?=Y
M M
M Y Y T Y V V V C V C C +-=sp M sp C [MY][MY]≈=T
Y
T M sp 'MY C C [MY]K ?=T Y 'MY sp
M T
Y 'MY T M C K C C K [MY]C ?=?=T
M M(L)C δ[M]?=Y
Ca Y
Y Ca Ca 2V V V C V C ][Ca 222+-=
++++(mol/L)105.0019.9820.0019.980.0100020.000.010006-?=+?-?=(mol/L)105.00C 2
1C [CaY]3M sp Ca
sp 2-?==≈+2
2sp
Ca 42sp 'CaY ][Ca C ]][Y [Ca [CaY]K 2+-++
==CaY
Ca CaY sp Ca '
CaY sp Ca sp 2K C 21K C K C ][Ca 222+
+
+===+(mol/L)1010105.00 6.63--=?=MY Y M MY 'C aY K δδK K =??=(mol/L)105.00C 2
1C [CaY][CaY]3
M sp Ca
sp 2-?==≈≈+Y M M M Y Y 4V V V C V C ][Y +-=-20.0020.0220.000.0100020.020.01000+?-?=(mol/L)
105.006-?=C [CaY]K 42sp Ca 42'CaY
2-+-++=
=
∴ pCa = - lg[Ca2+]=8.0
如此逐一计算,可以得到一系列数据,根据这些数据,以pM(即pCa)为纵坐标,EDTA 加入量为横坐标作图,就可得到滴定曲线。
二、影响滴定突跃的主要因素
⑴ 辅助配位剂NH 3的影响 ⑵ pH 的影响
§6-5 络合滴定指示剂 一、金属指示剂的作用原理
金属(显色)指示剂是具有酸、碱指示剂性质的染料,与金属离子生成与染料本身颜色不同的络合物:
M + In
MIn
甲色 乙色
滴定开始时溶液呈现出MIn 的颜色(乙色),随着滴定剂的加入,滴定剂逐渐与游离的金属离子配位,生成ML 络合物,在计量点附近,金属离子浓度很低,滴定剂进而夺取MIn 中的M ,使指示剂游离出来。 MIn + L = ML + In 乙色 甲色 溶液因而呈现In 的颜色(甲色),溶液颜色由乙色变为甲色指示终点到达。这就是金属指示剂的作用原理。
下面以铬黑T (EBT )为例说明金属指示剂的作用原理(见课件)。
'MY M 'MY M K lgC K C ??或.
6K lgC 'MY M 能被准确滴定金属离时,子≥?当Y (H)M(L)MY 'MY p δp δlgK lgK --
=
金属指示剂铬黑T 的结构式为四师P.172 二、金属指示剂必须具备的条件
1. 在滴定的pH 范围内,金属-指示剂络合物(MIn )的颜色与指示剂(In )本身的颜色应有明显的区别;
2. 金属-指示剂络合物(MIn )的稳定性应当比金属-滴定剂络合物(ML )的稳定性低;
3. 指示剂与金属离子形成的配合物应易溶于H 2O ;
4. MIn 与EDTA 的交换反应应迅速,这样才能比较准确地判断终点;
5. 指示剂应具有一定的选择性;
6. 指示剂应比较稳定,以便贮存和使用。 三、金属指示剂变色点的pM (pM t )值
M + In
MIn
如果考虑到H+对指示剂的副反应,那么
选择指示剂时,应使有色配合物的pM t (如果不考虑金属离子的副反应,它就是滴定终点pM 终)与计量点的pM 一致,至少应在计量点附近的pM 突跃范围以内。
四、金属指示剂在使用中存在的问题 (一)指示剂的封闭现象
如果指示剂与某些金属形成的配合物极稳定,以至于加入过量的滴定剂也不能将金属从金属-指示剂配合物中夺取出来,溶液在计量点附近就没有颜色变化,这种现象称为指示剂的封闭。
解决办法是:加入掩蔽剂,使干扰离子与掩蔽剂作用生成更稳定的配合物而不再与指示剂作用。 例:(见课件)
(二)指示剂的僵化现象
有些指示剂本身或金属-指示剂配合物在水中的溶解度太小,使得滴定剂与金属-指示剂配合物交换缓慢,使终点拖长。这种现象称为指示剂的僵化。
解决办法:加入有机溶剂或加热以加快反应速度。 (三)指示剂的氧化变质现象
金属指示剂大多是分子中含有许多双键的有机染料,易被日光、空气及氧化剂所分解;有些多属指示剂在水溶液中不稳定,日久会因氧化或聚合而变质。 四、常用金属指示剂简介
1. 铬黑T(简称EBT)(前已介绍)
铬黑T ,黑色粉末,有金属光泽,适宜pH 范围9~10。
使用时应注意:(1)其水溶液易发生聚合,需加三乙醇胺防止; (2)在碱性溶液中易氧化,加还原剂(抗坏血酸) (3) 不宜长期保存。
2. 钙指示剂(又叫钙红或NN 指示剂或铬蓝黑R )
化学名称:2—羟 基—1—(2—羟 基—4—磺基—1—萘偶氮)—3—萘甲酸。(其余见课件) 3. 二甲酚橙(简称XO )
[M][In]
[MIn]
K MIn
=MIn
K [M]
1
=MIn lgK pM =MIn
t lgK pM ='
MIn
K [M]1=In(H)MIn δK [M]
1?=In(H)MIn lg δlgK pM +='MIn In(H)MIn t lgK p δlgK pM =-=sp '
MIn pM lgK ≈
化学名称:3,3′—双[N ,N —二(羧甲基)—氨甲基]—邻甲酚磺酞。(其余见课件) 4. 1-(2-吡啶偶氮)-2-萘酚(PAN )
稀土分析中常用,水溶性差,易发生指示剂僵化。 5、磺基水杨酸(SSA )
§6-6 终点误差和准确滴定的条件 一、终点误差
滴定终点与计量点不一致所引起的误差称为终点误差。 终点误差公式:
例:在pH=10时,若以0.020 mol/L EDTA 滴定0.020 mol/LCa 2+时,以铬黑T (EBT )为指示剂,计算计量点和终点时Ca 2+的浓度以及终点误差。
已知:K Ca-EBT =105.4(查四师表); K CaY = 1010.96 (查四师) 铬黑T 的K a2 = 10-6.3, K a3 = 10-11.6 解:①求计量点时Ca 2+的浓度
当pH=10时,查表得 p δY (H )=0.45 lgK CaY ′= lgK CaY -p δY (H )
lgK CaY ′=10.96 - 0.45 = 10.51 ; K CaY ′= 1010.51 计量点时Ca 2+的浓度为:
②求终点时Ca 2+的浓度
滴定进行到指示剂变色的那一点,就是滴定终点. Ca 2+与铬黑T(EBT)指示剂的反应为:
Ca2+ + EBT Ca-EBT ∵当[EBT]=[Ca-EBT]时,就是指示剂的变色点(即滴定终点).
∴ 该溶液pH=10,所以应考虑副反应(这里是酸效应)的影响.
pδEBT = -lgδEBT = -lg10-1.6=1.6
lgK Ca-EBT ′=lgK Ca-EBT - p δEBT(H)=5.4-1.6=3.8 K Ca-EBT ′= 103.8 故 终点时Ca 2+的浓度为;
100%
Y E t ?=金属离属离子的物质过量或不足的物质的量
滴定剂100%
C K 1010E sp M 'ML M Δp M Δp t ??-='
-''
CaY
Ca
'CaY sp Ca
sp 2K C 21K C ][Ca ==+][EBT]
[Ca EBT]
[Ca K 2EBT
Ca +--=EBT
Ca ep 2K 1][Ca -+=
EBT Ca ep 2K 1][Ca -+'=
21121a a a 2
a a EBT(H)K K ]K [H ][H K K ?++?=++δ11.6
6.36.31021011.6
6.3101010)(10)(101010-------?+?+?= 1.6
10-=(mol/L)
101.6101K 1][Ca 43.8EBT
Ca ep 2--+?=='=
③求终点误差
△pM=pMep - pMsp = pCa ep - pCa sp = -lg[Ca 2+]ep -(-lg[Ca 2+]sp ) = -lg(1.6×10-4)+lg(5.6×10-7) = -2.5 代入误差公式
误差太大,说明铬黑T(EBT)不适宜作滴定Ca 2+的指示剂. 答:略
二、直接准确滴定金属离子的条件
lgC M ·K MY ′≥6
例:EDTA 滴定Zn 2+可以在pH=5时进行,而滴定Mg 2+却不行,必须在pH=10时滴定,为什么?(假设Zn 2+、Mg 2+的浓度都是0.020 mol/L )。
解:pH=5时,查表得p δY (H )=6.45
故 能准确滴定Zn 2+。
而
故 不能滴定Mg 2+。
而 当pH=10时,查表得 p δY (H )=0.45
故 能准确滴定Mg 2+。
三、络合滴定中酸度的选择与控制 1. 缓冲溶液和辅助络合剂的作用
酸度对络合滴定的影响是多方面的:酸度增高会减小MY 的条件常数,降低滴定反应的完全程度;影响指示剂的变色点和自身的颜色,导致终点误差变大,甚至不能准确滴定;在络合滴定过程中,随着滴定剂与金属离子反应生成相应的络合物,溶液的酸度会逐渐增高,所以,需加入缓冲溶液予以控制。
当溶液的酸度降低到一定程度后,金属离子的水解效应逐渐严重,甚至产生碱式盐或氢氧化物沉淀。这些沉淀在滴定过程中有的不能与EDTA 络合,有的虽然可以逐渐反应但速率很慢,致使滴定终点难以确定。为此,常加入辅助络合剂(如:氨水、酒石酸和柠檬酸等)以防止金属离子的水解。 2. 单一金属离子滴定的最高酸度和最低酸度
滴定任一金属离子(浓度为0.020mol/L )的最高酸度(即最低pH 值)可推导如下: 根据配位滴定的要求,当C M =0.02 mol/L 时,lgK MgY ′≥8 以及只考虑酸效应影响时 得
lgK MY - p δY (H )≥8
移项得 p δY (H )≤lgK MY - 8
100%C K 1010E sp
M 'ML M Δp M Δp t ??-='-' 1.7%0.020002
110101010.51
2.5
2.5-=??-=-Y (H)ZnY '
ZnY p δlgK lgK -=8
10.056.4516.50>=-=Y (H)MgY 'MgY p δlgK lgK -=8
2.256.458.70<=-=Y (H)MgY 'MgY p δlgK lgK -=8
8.250.458.70>=-=Y (H)
Zn Y 'MY p δlgK lgK -=
利用上式可以算出滴定各种金属离子的p δY (H )值。然后再由表中查出其相应的pH 值,就是滴定某一金属离子的粗略的最低pH 值,也就是滴定的最高酸度。
最高酸度(即最低pH 值):就是酸度高于某一限度就不能进行准确滴定,这一限度就是配位滴定的最高允许酸度,简称最高酸度。
例:求用0.020mol/L 的EDTA 滴定2.0×10-2mol/LZn 2+的最低pH 值。
解:查表得 lgK ZnY =16.50, 由p δY =lgK ZnY - 8 得 p δY =16.50 - 8 = 8.5 , 查表得 当p δY =8.5时,pH=4.0 即 最低pH 值应为4.0左右。
用上述方法可以求出滴定各种金属离子时的最低pH 值。如果我们用pH 值对lgK MY 作图,就可得到一条曲线,这条曲线就叫做林邦曲线或酸效应曲线。从这条曲线上可以查出EDTA 滴定一些金属离子所允许的最低pH 值。
§6-7 提高络合滴定选择性的方法 一、分步滴定的可行性判据
配位滴定中的干扰规律:
1. lgK MY ′和lgK NY ′都大于8时(满足滴定条件),滴入EDTA ,M 、N 离子完全被配位,可以滴定M 、N 离子的总量。如果要测定M 、N 两种金属离子的分别含量,需用掩蔽和解蔽措施来消除其干扰,达到分别测定的目的。
2. △lgK=lgK MY ′- lgK NY ′≥5时,可以控制酸度滴定M 离子,N 离子不干扰。
3. lgK MY ′≤3时,滴入EDTA ,则N 离子完全不配位,不干扰M 离子的测定。
4. lgK NY ′=3~8时,由于N 离子干扰M 离子的测定。(即部分配位),此时,N 离子干扰M 离子的测定。但又不能测定M 、N 离子的总量(∵N 离子只部分配位),此时测定M 离子需用掩蔽措施来消除N 离子的干扰。
二、控制酸度进行混合离子的选择滴定
设有浓度相近的Bi 3+、Pb 2+两种离子的混合溶液,由于lgK BiY >8,lgK PbY >8,两种离子都能配位完全,
△lgK=lgK BiY - lgK PbY =27.94 - 18.04 = 9.9 >5 因此可以控制酸度,单独滴定Bi 3+,而Pb 2+不干扰。
滴定Bi 3+的最高酸度: pH ≈0.3,pH >0.3时可以滴定Bi 3+
滴定Pb 2+的最高酸度: pH=3.3,pH ≥3.3时,Pb 2+可定量配位完全;pH <3.3,Pb 2+不配位或部分配位。 △lgK ≥5,就可控制酸度滴定其中一种离子,另一种离子不干扰。 lgK PbY +5=18.04 + 5 = 23.04,对应的pH=1.5 ∴ 当有Pb 2+存在时滴定Bi 3+的最低酸度就是pH1.5。 故 滴定Bi 3+的酸度范围是:pH 0.3~1.5
例:溶液中Fe 3+、Zn 2+、Mg 2+各0.01mol/L,可否控制酸度连续滴定? 解:查表得 lgK FeY =25.1>8 , lgK ZnY =16.5>8 , ? lgK MgY =8.69>8 ? 都能被EDTA 准确滴定。
? 又 △lgK=lgK FeY - lgK ZnY =25.1 - 16.5 = 8.6 >5 ? △lgK=lgK ZnY - lgK MgY
=16.5 - 8.69 = 7.81> 5
6
ΔlgK lgK lgK N Y MY ≥=-
?∴可以控制酸度连续滴定Fe3+、Zn2+、Mg2+。
?①滴定Fe3+的酸度范围:
?查酸效应曲线,lgK FeY=25.1时,最低pH≈1
?lgK ZnY + 5 = 16.5+5=21.5 时,最高pH=2
?故滴定Fe3+的酸度范围:pH 1~2
?②滴定Zn2+的酸度范围
?查酸效应曲线lgK ZnY=16.5时,pH=4(最低pH值)
?lgK MgY+5=8.69+5=13.69时,pH=5.5(最高pH值)
?故滴定Zn2+的酸度范围:pH 4.0~5.5
?③查酸效应曲线,lgK MgY=8.69时,pH=9.6(最低pH值),
?故在pH≥9.6时,滴定Mg2+
例:当溶液中Bi3+、Pb2+浓度皆为0.01mol·L-1时,用EDTA滴定Bi3+有无可能?(见课件)
三、使用掩蔽剂提高络合滴定的选择性
1.掩蔽
若被测金属的络合物与干扰离子的络合物的稳定性相差不够大(甚至lgK ML还比lgK NL小),就不能用控制酸度的方法分步滴定。但若加入一种试剂,它能与干扰离子N反应,则溶液中的[N]会降低,干扰离子N对M测定的干扰作用也就减小以甚至消除。这种方法叫做掩蔽法。
(1)配位掩蔽法
通过加入一种能与干扰离子生成更稳定配合物的掩蔽剂来消除干扰。
?例:石灰石、白云石中CaO与MgO的含量测定。
?用三乙醇胺掩蔽试样中的Fe3+、Al3+和Mn2+。
?例:在Al3+与Zn2+两种离子共存。
?用NH4F掩蔽Al3+,使其生成稳定的AlF63-配离子;在pH=5~6时,用EDTA滴定Zn2+。
(2)氧化还原掩蔽法
例如: Fe3+干扰Zr4+、Th4+的测定,加入盐酸羟胺等还原剂使Fe3+还原生成Fe2+,达到消除干扰的目的。
(3)沉淀掩蔽法
例如: 为消除Mg2+对Ca2+测定的干扰,利用pH≥12时,Mg2+与OH-生成Mg(OH)2沉淀,可消除Mg2+对Ca2+测定的干扰。
2.解蔽
在掩蔽某些离子进行滴定之后,如果还要测定被掩蔽的离子,可以采用适当的方法破坏金属离子与掩蔽剂所生成的配合物,使金属离子从配合物中释放出来,这种方法称为解蔽。
四、选用其它的滴定剂
五、化学分离法
先把被测离子从干扰物质中分离出来,然后再进行测定。分离的方法可以采用沉淀、液—液萃取及离
子交换等。使用分离方法的不利因素,是溶液的性质可能发生变化,所以分离后应再调整到适合滴定的条件。
§6-8 络合滴定的方式和应用 一、直接滴定法
(见课件)
二、返滴定法(即回滴定法或剩余滴定法)
(见课件)
三、置换滴定法(又称释放滴定法或取代滴定法) ㈠ 置换出金属离子的反应 (见课件)
㈡ 置换出EDTA 的反应 (见课件) 四、间接滴定法
(见课件)
例:用浓度为Cmol/L 的EDTA 滴定Fe 3+时,消耗EDTA VmL ,试样中以Fe 、Fe 2O 3表示的百分含量分别为:
讨论题:
1. EDTA 与金属离子的配合物有哪些特点?
2. 配合物的稳定常数与条件稳定常数有什么不同?为什么要引用条件稳定常数?
3. 在配位滴定中控制适当的酸度有什么重要意义?实际应用时应如何全面考虑选择滴定时的pH ?
4. 金属指示剂的作用原理?应该具备哪些条件?
5. 为什么使用金属指示剂时要限定适宜的pH ?
6. 什么是金属指示剂的封闭和僵化?如何避免?
7. M 和N 共存,如何用控制酸度的方法分别滴定?
8. 掩蔽的方法有哪些?各运用于什么场合?
9. EDTA 滴定含少量Fe 3+的Ca 2+、Mg 2+试液时,用三乙醇胺、KCN 都可以掩蔽Fe 3+,抗坏血酸则不能掩蔽;在滴定有少量Fe 3+存在的Bi 3+时,恰恰相反。说明理由。 10. 如何利用掩蔽和解蔽作用测定Ni 2+、Zn 2+、Mg 2+? 11. 如何测定Pb 2+、Al 3+和Mg 2+试液中的Pb 2+含量?
12. 若配制EDTA 溶液时所用的水中含有 Ca 2+,则下列情况对测定结果有何影响?
(1)以CaCO 3为基准物标定EDTA 溶液,用所得EDTA 标准溶液滴定试液中的Zn 2+,以二甲酚橙为指
示剂;
(2)以金属锌为基准物,二甲酚橙为指示剂标定。用所得EDTA 标准溶液滴定试液中Ca 2+的含量; (3)以金属锌为基准物质,铬黑T 为指示剂标定EDTA 溶液。用所得EDTA 标准溶液滴定试液中Ca 2+
的含量。
14. 用返滴定法测定Al3+含量时,先在pH3左右加入过量EDTA 并加热,使Al 3+配位。说明选择此pH 的
理由。
15. 今欲不经分离用配位滴定法测定下列混合溶液中各组分的含量,试设计简要方案(包括滴定剂、酸度、
指示剂, 所需某他试剂以及滴定方式)。 (1)Zn 2+、Mg 2+混合液中两者含量的测定; (2)含有Fe 3+的试液中测定Bi 3+;
100%1000G M CV Fe%Fe ??=100%
1000G 2M CV %O Fe 3
2O Fe 32???=
(3)Fe3+、Cu2+、Ni2+混合液中各含量的测定;
(4)水泥中Fe3+、Al3+、Ca2+和Mg2+的分别测定。
作业:P.198 13、14、15、17、18、22、23、29、33、34、35
第5章配位滴定法习题答案 1.EDTA与金属离子的配位反应有何特点? 答:广泛,EDTA几乎能与所有的金属离子形成络合物;稳定,一般lg K MY> 15; 络合反应速度快,水溶性好;EDTA与无色的金属离子形成无色的络合物,与有色的金属离子形成颜色更深的络合物;络合比简单,一般为1:1。 2. EDTA与金属离子配合物的稳定常数与条件稳定常数有什么不同?影响条件稳定常数大小的因素有哪些? 答:在无副反应存在的情况下用平衡常数来衡量反应进行的程度,在有副反应存在的情况下用条件平衡常数来衡量反应进行的程度;响条件稳定常数大小的因素有:酸效应、配位效应、干扰离子效应等。 3. 影响配位滴定图月范围大小的因素有哪些?是怎样影响的? 答:(1)lg K′的影响:K′增大10倍,lg K′增加1,滴定突跃增加一个单位。 (2)C M的影响:C M增大10倍,滴定突跃增加一个单位。 4. 为什么大多数的配位滴定需要在一定的缓冲溶液中进行? 答:络合滴定中广泛使用pH缓冲溶液来保持酸度相对稳定,因为:(1)滴定过程中的[H+]变化:M + H2Y = MY + 2H+ (2)K′MY与pH有关; (3)指示剂需在一定的酸度介质中使用 5. 金属指示剂的作用原理是什么?应当具备的主要条件是什么? 答:金属指示剂本身是弱的配位剂,在一定条件下,指示剂与金属离子形成有一定稳定性的配合物,该配合物与指示剂本身具有显著不同的颜色。 6. 指示剂为什么会被封闭?如何消除? 答:指示剂的封闭现象是指某些指示剂能与某些金属离子生成极为稳定的络合物,这些络合物较对应的MY络合物更稳定,以致到达化学计量点时滴入过量的EDTA,也不能夺取指示剂络合物(MIn)中的金属离子,指示剂不能释放出来,看不到颜色的变化,这种现象就叫指示剂的封闭现象。 可能原因:(1)MIn(或共存离子N的NIn)的稳定性大于MY。 (2)终点变色反应的可逆性差。 解决方法:(1)若封闭现象是滴定离子本身M引起的,则可采用返滴定法。例二甲酚橙XO,Al3+对其有封闭现象。可加过量EDTA,采用返滴法测定铝。
第6章 络合滴定法 2. 在PH=9.26的氨性缓冲溶液中,除氨络合物外的缓冲剂总浓度为0.20 mol ·L -1,游离C 2O 42-浓度为0.10 mol ·L -1。计算Cu 2+的αCu 。已知Cu(Ⅱ)- C 2O 42-络合物的lg β1=4.5,lg β2=8.9; Cu(Ⅱ)-OH -络合物的lg β1=6.0。 解: 3.铬黑T(EBT)是一种有机弱酸,它的lgK 1H =11.6,lgK 2H =6.3,Mg-EBT 的lgK MgIn =7.0,计算在PH=10.0时的lgK ’MgIn 值。 22433222 124224() 4.58.92 6.96.09.2614 1.26 1()14333()1321[][] 100.1010(0.10)101[]1101010[][]112[]0.10[][]1[][Cu C O Cu OH NH Cu NH C O C O OH C NH H NH mol L NH NH Ka NH N αββαβαββ------++ -=++=?+?==+=+?==+=+=?=??=++又23 24 259.35 3539.36 ()()()][]1010Cu Cu NH Cu C O Cu OH H NH βαααα-- ++=≈++=
4. 已知M(NH 3)42+的lg β1~ lg β4为2.0, 5.0,7.0,10.0,M(OH)42-的lg β1~ lg β4为4.0,8.0,14.0,15.0。在浓度为0.10 mol ·L -1的M 2+溶液中,滴加氨水至溶液中的游离NH 3浓度为0.010 mol ·L -1,PH=9.0试问溶液中的主要存在形式是那一种?浓度为多大?若将M 2+离子溶液用NaOH 和氨水调节至PH ≈13.0且游离氨浓度为0.010 mol ·L -1 ,则上述溶液中的主要存在形式是什麽?浓度又为多少? 解:用氨水调解时: 32()121(0.010)(0.010)122 M NH αββ=+++= 3 2.0 2.0 131()[]10100.0083 122 M NH NH βδα-?=== 32 5.0 4.0 232()[]10100.083 122 M NH NH βδα-?=== 7.0 6.0310100.083122δ-?== 10.08.0 410100.83 122δ-?== 故主要存在形式是M(NH 3)42+ ,其浓度为0.10×0.83=0.083 mol ·L -1 用氨水和NaOH 调节时: 34811 ()()11100.1100.01120210M M NH M OH ααα-=+-=+?+?++=? 49111100.1510210δ-?==?? 86 2 11100.01510210δ-?==?? 14311100.0010.5210δ?==? 15411 100.00010.5210δ?==? 故主要存在形式是M(OH)3-和M(OH)42-,其浓度均为0.050 mol ·L -1 5. 实验测得0.10 mol ·L -1Ag(H 2NCH 2CH 2NH 2)2+溶液中的乙二胺游离浓度为0.010mol ·L -1。计算溶液中C 乙二胺和δAg(H 2NCH 2CH 2NH 2)+ 。Ag +与乙二胺络合物的lg β1=4.7,lg β2=7.7。 解: 2 2 2 2 ()12222222224.77.723.74 1[][]11010(0.010)10Ag H NCH NH H NCH CH NH H NCH CH NH αββ=++=++?= 2 2 2 2 2 22.70 ()() 10 0.091 Ag H NCH NH Ag H NCH NH δα= =
第6章 络合滴定法 2. 在PH=9.26的氨性缓冲溶液中,除氨络合物外的缓冲剂总浓度为0.20 mol ·L -1,游离C 2O 42-浓度为0.10 mol ·L -1。计算Cu 2+的αCu 。已知Cu(Ⅱ)- C 2O 42-络合物的lg β1=4.5,lg β2=8.9; Cu(Ⅱ)-OH - 络合物的lg β1=6.0。 解: 22433222 124224() 4.58.92 6.96.09.2614 1.26 1()1 4333() 1 3 2 1[][] 100.1010(0.10)101[]1101010[][]112[]0.10[][]1[][Cu C O Cu OH NH Cu NH C O C O OH C NH H NH mol L NH NH Ka NH N αββαβαββ------+ +-=++=?+?==+=+?==+=+=?=??=++又2259.35 3 5 3 9.36 ][]1010H NH βαααα- - ++=≈++=K
3.铬黑T(EBT)是一种有机弱酸,它的lgK 1H =11.6,lgK 2H =6.3,Mg-EBT 的lgK MgIn =7.0,计算在PH=10.0时的lgK ’MgIn 值。 4. 已知M(NH 3)42+的lg β1~ lg β4为2.0, 5.0,7.0,10.0,M(OH)42-的lg β1~ lg β4为4.0,8.0,14.0,15.0。在浓度为0.10 mol ·L -1的M 2+溶液中,滴加氨水至溶液中的游离NH 3浓度为0.010 mol ·L -1,PH=9.0试问溶液中的主要存在形式是那一种?浓度为多大?若将M 2+离子溶液用NaOH 和氨水调节至PH ≈13.0且游离氨浓度为0.010 mol ·L -1,则上述溶液中的主要存在形式是什麽?浓度又为多少? 解:用氨水调解时: 32()121(0.010)(0.010)122 M NH αββ=+++=K 3 2.0 2.0 131()[]10100.0083 122 M NH NH βδα-?=== 32 5.0 4.0 232()[]10100.083 122 M NH NH βδα-?=== 7.0 6.0310100.083122δ-?== 10.08.0 410100.83 122δ-?== 故主要存在形式是M(NH 3)42+,其浓度为0.10×0.83=0.083 mol ·L -1 用氨水和NaOH 调节时: 34811 ()()11100.1100.01120210M M NH M OH ααα-=+-=+?+?++=?K 49 111100.1510210δ-?==?? 86 211 100.01510210δ-?==?? 14311100.0010.5210δ?==? 15411 100.00010.5210δ?==? 故主要存在形式是M(OH)3-和M(OH)42-,其浓度均为0.050 mol ·L -1
第6章 络合滴定法 2. 在PH=9.26的氨性缓冲溶液中,除氨络合物外的缓冲剂总浓度为0.20 mol·L -1 ,游离C 2O 42-浓度为0.10 mol·L -1 。计算Cu 2+ 的αCu 。已知Cu(Ⅱ)- C 2O 4 2- 络合物的lgβ1=4.5,lgβ2=8.9; Cu(Ⅱ)-OH -络合物的lgβ1=6.0。 解: 224 33222 124224() 4.58.92 6.96.09.2614 1.261()14333()1321[][] 100.1010(0.10)101[]1101010[][]112[]0.10[][]1[][Cu C O Cu OH NH Cu NH C O C O OH C NH H NH mol L NH NH Ka NH N αββαβαββ------+ +-=++=?+?==+=+?==+=+=?=??=++又23 24 259.35 3539.36 ()()()][]1010Cu Cu NH Cu C O Cu OH H NH βαααα- - ++=≈++=K
3.铬黑T(EBT)是一种有机弱酸,它的lgK 1H =11.6,lgK 2H =6.3,Mg-EBT 的lgK MgIn =7.0,计算在PH=10.0时的lgK ’MgIn 值。 4. 已知M(NH 3)42+ 的lgβ1~ lgβ4为 2.0,5.0,7.0,10.0,M(OH)42-的lgβ1~ lgβ4为4.0,8.0,14.0,15.0。在浓度为0.10 mol·L -1 的M 2+ 溶液中,滴加氨水至溶液中的游离NH 3浓度为0.010 mol·L -1 ,PH=9.0试问溶液中的主要存在形式是那一种?浓度为多大?若将M 2+ 离子溶液用NaOH 和氨水调节至PH≈13.0且游离氨浓度为0.010 mol·L -1,则上述溶液中的主要存在形式是什麽?浓度又为多少? 解:用氨水调解时: 3 2()121(0.010)(0.010)122 M NH αββ=+++=K 3 2.0 2.0 131()[] 10100.0083 122 M NH NH βδα-?=== 3 2 5.0 4.0 232()[]10100.083 122 M NH NH βδα-?=== 7.0 6.0310100.083122δ-?== 10.08.0 410100.83 122δ-?== 故主要存在形式是M(NH 3)42+ ,其浓度为0.10×0.83=0.083 mol·L -1 用氨水和NaOH 调节时: 3 4811 ()()11100.1100.01120210M M NH M OH ααα- =+-=+?+?++=?K 49 111100.1510210δ-?= =?? 8 6211 100.01510210δ-?==??
第六章络合滴定法 一、判断题(对的打√, 错的打×) 1、EDTA 与金属离子形成的配合物都是1:1 型的 ( ) 2、络合滴定中酸度越小,对滴定越有利,因此滴定时,pH 值越大越好( ) 3、络合滴定法可以测定许多金属离子,对于SO 4 2-等阴离子则不能测定( ) 4、EDTA 能与多数金属离子络合, 所以选择性较差。( ) 5、EDTA 滴定法测定自来水中Ca2+、Mg2+时, 用EBT 为指示剂, 若不加pH=10 的缓冲溶液, 终点时不会变色。 ( ) 6、络合滴定要求金属指示剂与金属离子形成的配合物MIn 的稳定常数越大越好( ) 7、若控制酸度使lg C M K′MY≥6,lg C N K′NY≤1, 就可准确滴定M 而N不干扰( ) 二、选择题 1.EDTA与金属离子形成螯合物时,其螯合比一般为() A.1:1 B.1:2 C.1:4 D.1:6 2.EDTA与金属离子络合时,一分子的EDTA可提供的络合原子个数为()A.2 B.4 C.6 D.8 3.在非缓冲溶液中用EDTA滴定金属离子时,溶液的pH值将() A.升高 B.降低 C.不变 D.与金属离子价态有关 4.下列叙述α Y(H) 正确的是() A.α Y(H)随酸度减小而增大 B.α Y(H) 随pH值增大而减小 C.α Y(H)随酸度增大而减小 D.α Y(H) 与pH变化无关 5.以铬黑T为指示剂,用EDTA溶液滴定Mg2+,可选择的缓冲溶液为()
A .KHC 8H 4O 4~HCl B .KH 2PO 4~K 2HPO 4 C .NH 4Cl ~NH 3·H 2O D .NaAc ~HAc 6.用EDTA 直接滴定有色金属离子,终点时所呈现的颜色是( ) A .游离指示剂In 的颜色 B .MY 的颜色 C .MIn 的颜色 D .a 与b 的混合颜色 7.Fe 3+、Al 3+对铬黑T 有( ) A .僵化作用 B .氧化作用 C .沉淀作用 D .封闭作用 8.在络合滴定中,用返滴定法测Al 3+时,以某金属离子标准溶液滴定过量的EDTA ,最适合的金属离子标准溶液是( ) A .Mg 2+ B .Zn 2+ C .Ag + D .Bi 3+ 9.以EDTA 滴定同浓度的金属离子M ,已知检测点时,△pM=, K’MY =,若要求TE=%,则被测离子M 的最低浓度应大于 ( ) A .·L -1 B .·L -1 C .·L -1 D .·L -1 10.在Fe 3+、Al 3+、Ca 2+、Mg 2+混合液中,EDTA 测定Fe 3+、Al 3+含量时,为了消除Ca 2+、Mg 2+的干扰,最简便的方法是( ) A .沉淀分离法 B .控制酸度法 C .络合掩蔽法 D .溶剂萃取法 11.用EDTA 滴定Bi 3+时,消除Fe 3+干扰宜采用( ) A .加入NaOH B .加抗坏血酸 C .加三乙醇胺 D .加氰化钾 12.今有A ,B 相同浓度的Zn 2+ - EDTA 溶液两份:A 为pH=10的NaOH 溶液;B 为 pH=10的氨性缓冲溶液。对叙述两溶液KˊZnY 的大小,哪一种是正确的 ( ) A .A 溶液的KˊZnY 和 B 溶液相等 B .A 溶液的KˊZnY 小于B 溶液的KˊZnY
第四章 配位滴定法 一、选择题 1.直接与金属离子配位的EDTA 型体为( ) (A )H 6Y 2+ (B )H 4Y (C )H 2Y 2- (D )Y 4- 2.一般情况下,EDTA 与金属离子形成的络合物的络合比是( ) (A )1:1 (B )2:1 (C )1:3 (D )1:2 3.铝盐药物的测定常用配位滴定法。加入过量EDTA,加热煮沸片刻后,再用标准锌溶液滴定。该滴定方式是( )。 (A )直接滴定法 (B )置换滴定法 (C )返滴定法 (D )间接滴定法 4.αM(L)=1表示( ) (A )M 与L 没有副反应 (B )M 与L 的副反应相当严重 (C )M 的副反应较小 (D )[M]=[L] 5.以下表达式中正确的是( ) (A )Y M MY MY c c c K =' (B )[][][]Y M MY K MY =' (C )[][][]Y M MY K MY = (D )[][][]MY Y M K MY = 6.用EDTA 直接滴定有色金属离子M ,终点所呈现的颜色是( ) (A )游离指示剂的颜色 (B )EDTA-M 络合物的颜色 (C )指示剂-M 络合物的颜色 (D )上述A+B 的混合色 7.配位滴定中,指示剂的封闭现象是由( )引起的 (A )指示剂与金属离子生成的络合物不稳定 (B )被测溶液的酸度过高 (C )指示剂与金属离子生成的络合物翁定性小于MY 的稳定性 (D )指示剂与金属离子生成的络合物稳定性大于MY 的稳定性 8.下列叙述中错误的是( ) (A )酸效应使络合物的稳定性降低 (B )共存离子使络合物的稳定性降低 (C )配位效应使络合物的稳定性降低 (D )各种副反应均使络合物的稳定性降低 9.用Zn 2+标准溶液标定EDTA 时,体系中加入六次甲基四胺的目的是( ) (A )中和过多的酸 (B )调节pH 值 (C )控制溶液的酸度 (D )起掩蔽作用 10.在配位滴定中,直接滴定法的条件包括( ) (A )MY K c '?lg ≤8 (B )溶液中无干扰离子 (C )有变色敏锐无封闭作用的指示剂 (D )反应在酸性溶液中进行 11.测定水中钙硬时,Mg 2+的干扰用的是( )消除的。 (A )控制酸度法 (B )配位掩蔽法 (C )氧化还原掩蔽法 (D )沉淀掩蔽法 12.配位滴定中加入缓冲溶液的原因是()
分析化学练习题 第6章络合滴定法 一. 选择题 1.下列有关条件稳定常数的正确叙述是() A. 条件稳定常数只与酸效应有关 B. 条件稳定常数表示的是溶液中络合物实际的稳定常数 C. 条件稳定常数与温度无关 D. 条件稳定常数与络合物的稳定性无关 2. 对配位反应中的条件稳定常数,正确的叙述是() A. 条件稳定常数是理想状态下的稳定常数 B. 酸效应系数总是小于配位效应系数 C. 所有的副反应均使条件稳定常数减小 D. 条件稳定常数能更准确地描述配位化合物的稳定性 3. 已知lgK ZnY =16.5,若用0.020mol·L-1EDTA滴定0.020mol·L-1Zn2+溶液,要求△pM=±0.2, TE = 0.1%,已知pH = 4,5,6,7时,对应lgαY(H)分别为8.44,6.45,4.65,3.32,滴定时的最高允许酸度为() A. pH≈4 B. pH≈5 C. pH≈6 D. pH≈7 4. 现用Cmol·L-1EDTA滴定等浓度的Ca2+,Ca2+无副反应。已知此时滴定的突跃范围ΔpM, 若EDTA和Ca2+的浓度增加10倍,则此时滴定的突跃范围为ΔpM' () A.ΔpM'=ΔpM-2 B.ΔpM'=ΔpM+1 C. ΔpM'=ΔpM-1 D. ΔpM'=ΔpM+2 5. 以EDTA滴定Zn2+时,加入的氨性溶液无法起到的作用是() A. 控制溶液酸度 B. 防止Zn2+水解 C. 防止指示剂僵化 D. 保持Zn2+可滴定状态 6. 下列有关金属离子指示剂的不正确描述是() A.理论变色点与溶液的pH值有关 B.没有确定的变色范围 C.与金属离子形成的络合物稳定性要适当 D.能在任意pH值时使用 7. 在配位滴定中,当溶液中存在干扰测定的共存离子时,一般优先使用() A. 沉淀掩蔽法 B.氧化还原掩蔽法 C. 离子交换法分离 D. 配位掩蔽法 8. 用EDTA滴定Bi3+时,消除Fe3+干扰宜采用() A. 加NaOH B.加抗坏血酸 C.加三乙醇胺 D.加氰化钾 9. 某溶液中含有Ca2+、Mg2+及少量Al3+、Fe3+,欲以铬黑T为指示剂,用EDTA滴定Ca2+、 Mg2+的含量,正确的做法是() A.碱性条件下加入KCN和NaF,再测定 B.酸性条件下加入三乙醇胺,再调至碱性测定 C.酸性条件下加入KCN和NaF,再调至碱性测定 D.加入NH3沉淀掩蔽Al3+和Fe3+,再测定 10. 铬黑T(EBT)与Ca2+的配合物的稳定常数K Ca-EBT =105.4,已知EBT的逐级质子化常数 K1H =1011.5,K2H =106.3,在pH=10.0时,EBT作为滴定Ca2+的指示剂,在颜色转变点的pCa值为()
第六章 配位滴定法 思考题与习题 1.简答题: (1)何谓配位滴定法?配位滴定法对滴定反应有何要求? 答:以配位反应为基础的地点分析方法称为配位滴定法。配位滴定法要求配位反应按一定的反应式定量进行,且能进行完全;反应必须迅速;可以用适当的方法确定终点。 (2)EDTA 与其金属离子配合物的特点是什么? 答:EDTA 具有广泛的配位性能;EDTA 与金属离子配位时可生成的螯合物稳定性高,配位反应的完全程度高;EDTA 与金属离子形成配位化合物的配位比几乎均为1:1;EDTA 与金属离子形成的配合物大多能溶于水;配位反应迅速;EDTA 与无色离子形成的配合物也无色,便于用指示剂确定终点。 (3)配位滴定可行性的判断条件是什么? 答:MY M K c lg ≥6 (4)配位滴定中可能发生的副反应有哪些?从理论上看,哪些对滴定分析有利? 答:配位滴定副反应包括:EDTA 的酸效应,金属离子的水解效应,金属离子与其他配位剂的配位反应,干扰离子效应,配合物与氢离子、氢氧根离子的副反应等。配合物与氢离子、氢氧根离子的副反应对滴定分析有利。 (5)何谓指示剂的封闭现象?怎样消除封闭? 答:如果指示剂与某些金属离子形成的配位化合物极其稳定,以至于加入过量的滴定剂也不能将金属离子从金属-指示剂配合物中夺取出来,溶液在化学计量点附近就没有颜色变化,这种现象称为指示剂受到了封闭。可加掩蔽剂消除指示剂的封闭现象。 (6)提高配位滴定选择性的条件与措施有哪些? 答:1)控制酸度;2)分别采用配位掩蔽法、沉淀掩蔽法、氧化还原掩蔽法掩蔽干扰离子;3)分离干扰离子。 2.名词解释 (1)酸效应
答:由于H+的存在使配位剂参加主反应能力降低的现象。 (2)酸效应系数 答:定量表示酸效应进行的程度的系数称为酸效应系数。 (3) 配位效应 答:由于存在其他配位剂L 与金属离子M 配位使金属离子参加主反应能力降低的现象。 (4)配位效应系数 答:定量表示配位效应进行的程度的系数称为配位效应系数。 (5)金属指示剂的变色点 答:]n I []MIn ['=当点。变,此即指示剂的变色时,指示剂发生颜色突 3.计算题: (1)用EDTA 滴定法检验血清中的钙。取血清100μl ,加KOH 溶液2滴和钙红指示剂1~2滴,用0.001042mol/LEDTA 滴定至终点,用去0.2502ml 。计算此检品中Ca 2+含量(Ca 2+mg/100ml )。若健康成人血清中Ca 2+含量指标为 9~11mg/100ml ,此检品中Ca 2+含量是否正常?(尿中钙的测定与此相似,只是要用柠檬酸掩蔽Mg 2+) 解: E D T A C a S Ca ()100Ca%(0.0010420.2502)40.0810010.45(mg /100ml)(40.08g/mol)0.1 cV M V M ??=???=== (2)精密称取葡萄糖酸钙(C 12H 22O 14Ca·H 2O )0.5403g ,溶于水中,加入适量钙指示剂,用0.05000mol/LEDTA 滴定至终点,用去23.92ml 。计算此样品中葡萄糖酸钙含量。(1222142C H O Ca H O M =448.7) 解:
第6章 络合滴定法 一、填空题 1.EDTA 的化学名称为 ,当溶液酸度较高时,可作 元酸,有 种存在形式。 2. 采用EDTA 为滴定剂测定水的硬度时,因水中含有少量的 Fe 3+ , Al 3+ 。应加入 作掩蔽剂; 滴定时控制溶液PH = 。 3. EDTA 络合物的条件形成常数'MY K 随溶液的酸度的变化而改变。酸度越 则' MY K 越 ;络合物越 ,滴定突跃越 。 4.以铬黑T为指示剂,溶液pH 值必须维持 ;滴定到终点时溶液由 色变为 色。 5.EDTA 的酸效应曲线是指 ,当溶液的pH 越大,则 越小。 二、选择题 1. 以EDTA 为滴定剂,下列叙述中哪一种是错误的?( ) A. 在酸度较高的溶液中,可形成MHY 络合物; B. 在碱性较高的溶液中,可形成MOHY 络合物; C. 不论形成MHY 或MOHY ,均有利于滴定反应; D. 不论溶液pH 值的大小,只形成MY 一种形式络合物。 2.在pH=12时,以0.0100mol/LEDTA 滴定20.00mol/LCa2+。等当点时的pCa 值为( ) A.5.3 B.6.6 C.8.0 D.2.0 3. 在pH = 10 的氨性缓冲溶液中, 用EDTA 滴定同浓度的 Zn 2+ 至化学计量点时,下列关系式中哪一个是正确的?( ) A. [ Zn 2+ ] = [ Y 4 - ] ; B.[Zn 2+ ] = [ Y 4 -ˊ ] ; [ZnY 2 -] C. [ Zn 2+ ˊ ] 2 = K ˊ Zn Y [ZnY 2 - ] D. [ Zn 2+ ] 2 = K ˊZn Y ; 4.在pH= 5.7时,EDTA 是以( )形式存在的: A.H 6Y 2+ B.H 3Y - C.H 2Y 2- D.Y 4- 5. 在pH = 10 的氨性缓冲溶液中,以EDTA 滴定Zn 2+ 至化学计量点时,以下关系式中哪 一个是正确的( ) A.pZn sp = pZn ˊsp + lg α Zn ( NH 3 ) ; B. pZn sp = pZn ˊsp – lg αZn ( NH 3 ) ; C.pZn sp = lgZn ˊ sp + p α Zn ( NH 3 ) ; D. pZn sp = lg αZn ( NH 3 ) - pZn ˊsp 。 6.为了测定水中 Ca 2 + , Mg 2+ 的含量,以下消除少量 Fe 3+ , Al 3+ 干扰的方法中,哪一种是正确的?( ) A. 于pH =10 的氨性溶液中直接加入三乙醇胺; B. 于酸性溶液中加入KCN ,然后调至pH =10; C. 于酸性溶液中加入三乙醇胺,然后调至pH =10 的氨性溶液; D. 加入三乙醇胺时,不需要考虑溶液的酸碱性。 7. 今有 A ,B 相同浓度的Zn 2+ — EDTA 溶液两份;A 为PH = 10 的NaOH 溶液;B 为PH = 10 的氨性缓冲溶液。对叙述两溶液 K ˊZn Y 的大 小,哪一种是正确的?( ) A. A 溶液的K ˊZn Y 和B 溶液相等; B. A 溶液的K ˊZn Y 小于B 溶液的K ˊ Zn Y ; C. A 溶液的K ˊZn Y 大于 B 溶液的K ˊZn Y ; D. 无法确定。 8.EDTA 与Zn 2+ 形成的配合物在pH=10时的条件稳定常数' lg ZnY K =( ) A.16.50 B.0.45 C.16.05 D.16.95 三、 计算题
第六章络合滴定法 一、判断题(对的打V,错的打X) 1、E DTA与金属离子形成的配合物都是1:1型的() 2、络合滴定中酸度越小,对滴定越有利,因此滴定时,pH值越大越好() 3、络合滴定法可以测定许多金属离子,对于SO42-等阴离子则不能测定() 4、EDTA能与多数金属离子络合,所以选择性较差。() 5、E DTA滴定法测定自来水中Ca2+、Mg2+时,用EBT为指示剂,若不加pH=10的缓冲溶液,终点时不会变色。() 6、络合滴定要求金属指示剂与金属离子形成的配合物Mln的稳定常数越大越好() 7、若控制酸度使?C M K M Y >6 IgCNK N Y< 1,就可准确滴定M而N不干扰() 二、选择题 1. EDTA与金属离子形成螯合物时,其螯合比一般为() A. 1: 1 B. 1: 2 C. 1: 4 D. 1: 6 2. EDTA与金属离子络合时,一分子的EDTA可提供的络合原子个数为() A. 2 B . 4 C. 6 D . 8 3?在非缓冲溶液中用EDTA滴定金属离子时,溶液的pH值将() A.升高 B .降低C.不变 D .与金属离子价态有关 4. 下列叙述a(H)正确的是() A. a(H)随酸度减小而增大 B. a(H)随pH值增大而减小 C . a(H)随酸度增大而减小 D . a(H)与pH变化无关 5 .以铬黑T为指示剂,用EDTA溶液滴定Mg2+,可选择的缓冲溶液为() A . KHC8H4O4?HCI B . KH 2PO4?K2HPO4 6 .用EDTA直接滴定有色金属离子,终点时所呈现的颜色是() C . NH4CI?NH3 H2O D . NaAc ?HAc A .游离指示剂In的颜色 C . MIn的颜色 7 .Fe3+、Al3+对铬黑T 有() A .僵化作用 B .氧化作用B . MY的颜色 D . a与b的混合颜色 C .沉淀作用 D .封闭作用
第四章配位滴定法练习题及答案 1、在配位滴定中,下列说法何种正确(): A. 酸效应使条件稳定常数增加有利于反应完全; B. 配位效应使条件稳定常数增加不利于反应完全; C. 所有副反应都不利于滴定反应; D. 以上说法都不对。 2、今欲配制pH=5.0, pCa=3.8的溶液,所需EDTA与Ca2+物质的量之比,即n(EDTA):n(Ca)为: A.1:3 B.3:2 C. 2:3 D.3:1 3、15 mL 0.020 mol·L-1 EDTA与10 mL 0.020 mol·L-1 Zn2+溶液相混合,若pH为 4.0,Zn2+浓度为: A.p[Zn2+]=5.6 B.p[Zn2+]=6.6 C.p[Zn2+]=7.6 D.p[Zn2+]=8.6 4、下面两种情况下的lgK’NiY值分别为: =0.2 mol·L-1; (1)pH =9.0 , C NH 3 =0.2 mol·L-1, C CN - =0.01 mol·L-1。 (2)pH =9.0 ,C NH 3 A.13.5, 4.1 B 4.1,13.5 C.5.6,11.5 D.11.5,5.6 5、已知铜氨络合物各级不稳定常数为: , , , 若铜氨络合物水溶液中Cu(NH3)42+的浓度为Cu(NH3)32+的10倍,溶液[NH3]为: A.0.77mol.L-1 B.0.077mol.L-1 C.0.67mol.L-1 D.0.47mol.L-1 6、以EDTA滴定同浓度的溶液,若滴定开始时溶液的pH=10,酒石酸的分析浓度为0.2 mol·L-1,化学计量点时的lgK’PbY,[Pb’]和酒石酸铅络合物的浓度(酒石酸铅络合物的lg K为 3.8)分别为:; A.lgK’PbY=13.5,[PbL]=10-11.3 B.lgK’PbY=14.4,[PbL]=10-8.5 C.lgK’PbY=12.6,[PbL]=10-5.2 D.lgK’PbY=14.4 [PbL]=10-11.3 7、由计算得知pH=5.5时EDTA溶液的lgɑ(H)值为: A.4.6 B.6.6 C.5.6 D.3.6 8、铬黑T(EBT)是一种有机弱酸,它的lgK1H=11.6,lgK2H=6.3,Mg-EBT的lgK MgIn=7.0,在pH=10.0时的lgK’MgIn值为:
第6章络合滴定法习题参考答案 1、从不同资料上查得Cu(Ⅱ)络和物的常数如下 Cu-柠檬酸K不稳=6.3×10-15 Cu-乙酰丙酮β1=1.86×10 8 β=2.19×1016 Cu-乙二胺逐级稳定常数为:K1=4.7×1010,K2=2.1×109 Cu-磺基水杨酸lgβ2=16.45 Cu-酒石酸lgK1=3.2,lgK2=1.9,lgK3=-0.33 lgK4=1.73 Cu-EDTA lgK稳=18.80 Cu-EDTA pK不稳=15.4 试按总稳定常数(lgK稳)从大到小,把它们排列起来。 解:Cu-柠檬酸lgK稳= pK不稳=14.2 Cu-乙酰丙酮lgK稳=lgβ=16.34 Cu-乙二胺lgK稳=lg(K1 K2)=19.99 Cu-磺基水杨酸lgK稳=lgβ2=16.45 Cu-酒石酸lgK稳= lgK1+lgK2+lgK3+lgK4=6.5 Cu-EDTA lgK稳=18.80 Cu-EDTP lgK稳=pK不稳=15.4 ∴按总稳定常数(lgK稳)从大到小,它们的排列顺序是: 乙二胺>EDTA >磺基水杨酸>乙酰丙酮>EDTP >柠檬酸>酒石酸 2. 在pH=9.26的氨性缓冲溶液中,除氨络合物外的缓冲剂总浓度为0.20 mol·L-1,游离C2O42-浓度为0.10 mol·L-1。计算Cu2+的αCu2+。已知Cu(Ⅱ)-C2O42 -络合物的lgβ1=4.5,lgβ2 =8.9;Cu(Ⅱ)-OH-络合物的lgβ1=6.0 解:在此溶液中能与Cu2+ 络合的配位剂有NH3,C2O42-和OH- αCu =αCu(NH3) +αCu(C2O42-) +αCu(OH-) -2 ∵pH=9.26=pK(NH +)[NH3]=δNH3×c =0.5×0.2 =0.10 mol·L-1 4 αCu(NH3) = 1+β [NH3] +β2 [NH3]2+…+βn [NH3]n=109.36 1 αCu(C2O42-) = 1+β [C2O42-] +β2[C2O42-]2= 1+104.5×0.1 + 108.9×0.12 =106.9 1 αCu(OH-) = 1+β [OH-] =1+106×10-4.74=101.26 1 ∴αCu=109.36 +106.9 +101.26 =109.36
第6章配位滴定法(课后习题及答案)
第六章 配位滴定法 思考题与习题 1.简答题: (1)何谓配位滴定法?配位滴定法对滴定反应有何要求? 答:以配位反应为基础的地点分析方法称为配位滴定法。配位滴定法要求配位反应按一定的反应式定量进行,且能进行完全;反应必须迅速;可以用适当的方法确定终点。 (2)EDTA 与其金属离子配合物的特点是什么? 答:EDTA 具有广泛的配位性能;EDTA 与金属离子配位时可生成的螯合物稳定性高,配位反应的完全程度高;EDTA 与金属离子形成配位化合物的配位比几乎均为1:1;EDTA 与金属离子形成的配合物大多能溶于水;配位反应迅速;EDTA 与无色离子形成的配合物也无色,便于用指示剂确定终点。 (3)配位滴定可行性的判断条件是什么? 答:MY M K c lg ≥6 (4)配位滴定中可能发生的副反应有哪些?从理论上看,哪些对滴定分析有利? 答:配位滴定副反应包括:EDTA 的酸效应,金属离子的水解效应,金属离子与其他配位剂的配位反应,干扰离子效应,配合物与氢离子、氢氧根离子的副反应等。配合物与氢离子、氢氧根离子的副反应对滴定分析有利。 (5)何谓指示剂的封闭现象?怎样消除封闭? 答:如果指示剂与某些金属离子形成的配位化合物极其稳定,以至于加入过量的滴定剂也不能将金属离子从金属-指示剂配合物中夺取出来,溶液在化学计量点附近就没有颜色变化,这种现象称为指示剂受到了封闭。可加掩蔽剂消除指示剂的封闭现象。 (6)提高配位滴定选择性的条件与措施有哪些? 答:1)控制酸度;2)分别采用配位掩蔽法、沉淀掩蔽法、氧化还原掩蔽
法掩蔽干扰离子;3)分离干扰离子。 2.名词解释 (1)酸效应 答:由于H+的存在使配位剂参加主反应能力降低的现象。 (2)酸效应系数 答:定量表示酸效应进行的程度的系数称为酸效应系数。 (3) 配位效应 答:由于存在其他配位剂L 与金属离子M 配位使金属离子参加主反应能力降低的现象。 (4)配位效应系数 答:定量表示配位效应进行的程度的系数称为配位效应系数。 (5)金属指示剂的变色点 答:]n I []MIn ['=当点。变,此即指示剂的变色时,指示剂发生颜色突 3.计算题: (1)用EDTA 滴定法检验血清中的钙。取血清100μl ,加KOH 溶液2滴和钙红指示剂1~2滴,用0.001042mol/LEDTA 滴定至终点,用去0.2502ml 。计算此检品中Ca 2+含量(Ca 2+mg/100ml )。若健康成人血清中Ca 2+含量指标为 9~11mg/100ml ,此检品中Ca 2+含量是否正常?(尿中钙的测定与此相似,只是要用柠檬酸掩蔽Mg 2+) 解: EDTA Ca S Ca ()100 Ca%(0.0010420.2502)40.0810010.45(mg /100ml)(40.08g/mol)0.1 cV M V M ??=???=== (2)精密称取葡萄糖酸钙(C 12H 22O 14Ca·H 2O )0.5403g ,溶于水中,加入适量钙指示剂,用0.05000mol/LEDTA 滴定至终点,用去23.92ml 。计算此样品中
第六章络合滴定法 一、判断题(对的打√ , 错的打×) 1、EDTA与金属离子形成的配合物都是 1:1型的() 2、络合滴定中酸度越小 ,对滴定越有利,因此滴定时, pH 值越大越好() 3、络合滴定法可以测定许多金属离子,对于SO42-等阴离子则不能测定() 4、EDTA能与多数金属离子络合 , 所以选择性较差。 () 5、EDTA滴定法测定自来水中 Ca2+、Mg 2+时, 用EBT为指示剂 , 若不加 pH=10 的缓冲溶液 ,终点时不会变色。() 6、络合滴定要求金属指示剂与金属离子形成的配合物MIn 的稳定常数越大越好 ( ) ≥6,lgCNK′NY ≤1,就可准确滴定M而N不干扰() M MY 7、若控制酸度使 lgC K′ 二、选择题 1.EDTA 与金属离子形成螯合物时,其螯合比一般为() A.1:1B.1:2C.1:4D.1:6 2.EDTA 与金属离子络合时,一分子的EDTA 可提供的络合原子个数为()A. 2B.4C. 6D. 8 3.在非缓冲溶液中用 EDTA 滴定金属离子时,溶液的pH 值将() A.升高B.降低C.不变D.与金属离子价态有关 4.下列叙述αY(H)正确的是() A.α随酸度减小而增大B.α随 pH 值增大而减小Y (H)Y (H) C.αY(H)随酸度增大而减小D.αY(H)与 pH 变化无关 5.以铬黑 T 为指示剂,用 EDTA 溶液滴定 Mg 2+,可选择的缓冲溶液为() 8 4 4~HCl B.KH 24~K24 A.KHC H O PO HPO C. NH 4Cl~ NH3·H2O D. NaAc~HAc 6.用 EDTA 直接滴定有色金属离子,终点时所呈现的颜色是() A.游离指示剂 In 的颜色B.MY 的颜色 C. MIn 的颜色D.a 与 b 的混合颜色 7.Fe3+、Al 3+对铬黑 T 有() A.僵化作用B.氧化作用C.沉淀作用D.封闭作用 8.在络合滴定中,用返滴定法测Al 3+时,以某金属离子标准溶液滴定过量的EDTA,
第六章 络合滴定法 习题参考答案 1. 答:(1)乙二胺四乙酸,H 4Y ,NH CH 2CH CH 2NH CH 2CH 2+CH 2COO HOOC OOC COOH 。 Na 2H 2Y·2H 2O ,4.4,54a a ]H [K K = +,0.020 mol/L 。 (2)H 6Y 2+,七,Y 4-,pH>12。1︰1。 (3)条件形成常数,副反应存在下,Y M MY MY lg lg lg lg αα--='K K (4)MY M K c '、。MY K ',越大;M c ,越大。 (5)越高。酸效应、络合效应等,Y(H)α,愈小;M 与L ,M α,MY K ' M p ΔpM 或'?,的正负M p ΔpM 或'? (6)6 216 211a a a a a a a 56Y(H)][H ][H K K K K K K K ΛΛΛ+++=++α 或6H 6H 1Y(H)][H ][H 1+++++=ββΛα 4. 解:Al 3+与乙酰丙酮(L)络合物 lg K 1=8.6;lg K 2=lg β2-lg β1=15.5-8.6=6.9;lg K 3=lg β3-lg β2=21.3-15.5=5.8 (1)AlL 3为主要型体时,[AlL 3]>[AlL 2],β3 [Al 3+] [L]3>β2 [Al 3+] [L]2 [L]>β2/β3=10-5.8,pL <5.8 (2)[AlL]=[AlL 2]时,[Al 3+]β1[L]=[Al 3+]β2[L]2 [L]=β1/β2=10-6.9,pL =6.9 (3)pL =10.0时,Al 3+为主要型体。 10. 答:检验水中是否含有金属离子:可加入金属指示剂(不同指示剂需用缓冲溶液控制不同的酸度),若显红色则存在金属离子。判断存在哪种离子:Al 3+、Fe 3+、Cu 2+可选用二甲酚橙,Ca 2+、Mg 2+可选用铬黒T ;或用EDTA 滴定,若溶液颜色由红色变为蓝色(pH10,铬黒T ),说明存在Ca 2+、Mg 2+,若颜色不变,则可能存在Al 3+、Fe 3+、Cu 2+。 11. 答:(1)CaCO 3为基准物质标定EDTA 时,消耗V EDTA 偏大,故c EDTA 偏低;用此EDTA 溶液测定试液中的Zn 2+,由于使用XO 指示剂,应在pH <6.0溶液中测定,此时Ca 2+不能准确测定,故不影响Zn 2+的测定,由于c EDTA 偏低,因此Zn 2+的结果偏低。 (2)Zn 为基准物质标定EDTA 时,由于使用XO 指示剂,应在pH <6.0溶液中标定,此时Ca 2+不能准确测定,故不影响EDTA 浓度的标定;用此EDTA 溶液测定试液中的Ca 2+、Mg 2+合量,使消耗V EDTA 偏大,故Ca 2+、Mg 2+合量偏高。
第六章络合滴定法 1.填空 (1)EDTA是一种氨羧络合剂,名称,用符号表示,其结构式为。配制标准溶液时一般采用EDTA二钠盐,分子式为,其水溶液pH为,可通过公式进行计算,标准溶液常用浓度为。 (2)一般情况下水溶液中的EDTA总是以等型体存在,其中以与金属离子形成的络合物最稳定,但仅在时EDTA才主要以此种型体存在。除个别金属离子外。EDTA与金属离子形成络合物时,络合比都是。 (3)K/MY称,它表示络合反应进行的程度,其计算式为。 (4)络合滴定曲线滴定突跃的大小取决于。在金属离子浓度一定的条件下,越大,突跃;在条件常数K/MY一定时,越大,突跃 。 (5)K/MY值是判断络合滴定误差大小的重要依据。在pM/一定时,K/MY越大,络合滴定的准确度。影响K/MY的因素有,其中酸度愈高愈大,lg/MY ; 的络合作用常能增大,减小。在K/MY 一定时,终点误差的大小由决定,而误差的正负由决定。 (6)在[H+]一定时,EDTA酸效应系数的计算公式为。 解:(1)EDTA是一种氨羧络合剂,名称乙二胺四乙酸,用符号H4Y 表示,其结构式为。配制标准溶液时一般采用EDTA二钠盐,分子式为,其水溶液pH为,可通过公式进行计算,标准溶液常用浓度为。 (2)一般情况下水溶液中的EDTA总是以和型体存在,其中以与金属离子形成的络合物最稳定,但仅在时EDTA才主要以此种型体存在。除个别金属离子外。EDTA与金属离子形
成络合物时,络合比都是。 (3)K/MY称,它表示络合反应进行的程度,其计算式为。 (4)络合滴定曲线滴定突跃的大小取决。在金属离子浓度一定的条件下,越大,突跃;在条件常数K/MY 一定时,越大,突跃。 (5)K/MY值是判断络合滴定误差大小的重要依据。在△pM/一定时,K/MY 越大,络合滴定的准确度。影响K/MY的因素有,其中酸度愈高,H+浓度愈大,lg/MY ; 的络合作用常能增大,减小。在K/MY一定时,终点误差的大小由决定,而误差的正负由决定。 2.Cu2+、、Zn2+、、Cd2+、Ni2+等离子均能与NH3形成络合物,为什么不能以氨水为滴定剂用络合滴定法来测定这些离子? 3.不经具体计算,如何通过络合物ML N的各βi值和络合剂的浓度[L]来估计溶液中络合物的主要存在型体? 4.已知乙酰丙酮(L)与Al3+络合物的累积常数lgβ1~lgβ3分别为8.6,15.5和21.3,AlL3为主要型体时的pL范围是多少?[AlL]与[AlL2]相等时的pL为多少?pL 为10.0时铝的主要型体又是多少? 5.铬蓝黑R(EBR)指示剂的H2In2-是红色,HIn2-是蓝色,In3-是橙色。它的pK a2=7.3,pK a3=13.5。它与金属离子形成的络合物MIn是红色。试问指示剂在不同的pH的范围各呈什么颜色?变化点的pH是多少?它在什么pH范围内能用作金属离子指示剂? 6.Ca2+与PAN不显色,但在pH=10~12时,加入适量的CuY,却可以用PAN 作为滴定Ca2+的指示剂,为什么? 7.用NaOH 标准溶液滴定FeCl3溶液中游离的HCl时,Fe3+将如何干扰?加入下列哪一种化合物可以消除干扰?EDTA,Ca-EDTA,柠檬酸三钠,三乙醇胺。 8.用EDTA滴定Ca2+、Mg2+时,可以用三乙醇胺、KCN掩蔽Fe3+,但不使用盐酸羟胺和抗坏血酸;在pH=1滴定Bi3+,可采用盐酸羟胺或抗坏血酸掩蔽Fe3+,