
第十九章配位化合物
1.某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3亦不产生沉淀,以强碱
处理并没有NH3放出,写出它的配位化学式。
解 [Pt(NH3)2Cl4]
2.下列化合物中哪些是配合物?哪些是螯合物?哪些是复盐?哪些是简单盐?
(1)CuSO4·5H2O (2)K2PtCl6
(3)Co(NH3)6Cl3(4)Ni(en)2Cl2
(5)(NH4)2SO4·FeSO4·6H2O (6)Cu(NH2CH2COO)2
(7)Cu(OOCCH3)2(8)KCl·MgCl2·6H2O
解配合物: K2PtCl6, Co(NH3)6Cl3, CuSO4·5H2O
螯合物: Ni(en)2Cl2, Cu(NH2CH2COO)2
复盐: (NH4)2SO4·FeSO4·6H2O KCl·MgCl2·6H2O
简单盐: Cu(OOCH3)2
3.命名下列各配合物和配离子:
(1)(NH4)3[SbCl6] (2)Li[AlH4]
(3)[Co(en)3]Cl3(4)[Co(H2O)4Cl2]Cl
(5)[Cr(H2O)4Br2]Br·2H2O (6)[Cr(H2O)(en)(C2O4)(OH)
(7)Co(NO2)6]3-(8)[Co(NH3)4(NO2)C]+
(9)[Cr(Py)2(H2O)Cl3] (10)[Ni(NH3)2(C2O4)]
解(1)六氯合锑(III)酸铵
(2)四氢合铝(III)酸锂
(3)三氯化三(乙二胺)合钴(III)
(4)氯化二氯·四水合钴(III)
(5)二水合溴化二溴·四水合钴(III)
(6)羟·水·草酸根·乙二胺合铬(III)
(7)六硝基合钴(III)配阴离子
(8)氯·硝基·四氨合钴(III)配阳离子
(9)三氯·水·二吡啶合铬(III)
(10)二氨·草酸根合镍(II)
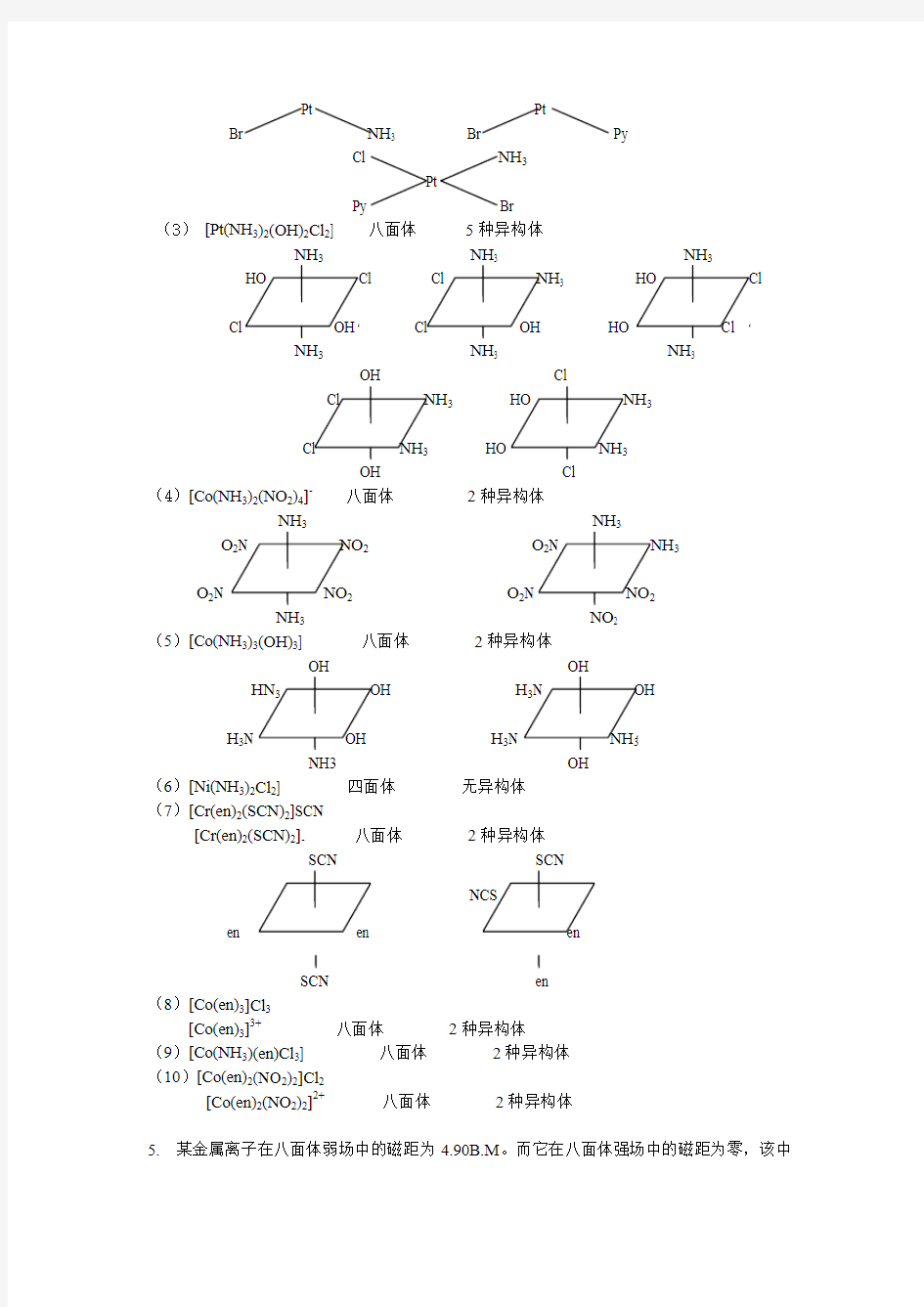
4.指出下列配合物的空间构型并画出它们可能存在的立体异构体:
(1)[Pt(NH3)2(NO2)Cl] (2)Pt(Py)(NH3)ClBr]
(3)Pt(NH3)2(OH)2Cl2] (4)NH4[Co(NH3)2(NO2)4]
(5)[Co(NH3)3(OH)3] (6)[Ni(NH3)2Cl2]
(7)[Cr(en)2(SCN)2]SCN (8)[Co(en)3]Cl3
(9)[Co(NH3)(en)Cl3] (10)[Co(en)2(NO2)2]Cl2
解(1)[Pt(NH3)2(NO2)Cl] 平面正方形2种异构体
H3N NO2H3N NO2
Pt Pt
H3N Cl H3N Cl
(2)[Pt(Py)(NH3)ClBr] 平面正方形3种异构体
Cl Py Cl NH3
Pt Pt
Br NH3 Br Py
Cl 3
Pt
Py Br
(3)[Pt(NH3)2(OH)2Cl2] 八面体5种异构体
3
NH3NH3 NH3
33
OH Cl
(4)[Co(NH3)2(NO2)4]-八面体2种异构体
23
O22O2
NH3NO2
(5)[Co(NH3)3(OH)3] 八面体2种异构体
H3H3
NH3 OH
(6)[Ni(NH3)2Cl2] 四面体无异构体
(7)[Cr(en)2(SCN)2]SCN
[Cr(en)2(SCN)2]-八面体2种异构体
en
SCN en
(8)[Co(en)3]Cl3
[Co(en)3]3+八面体2种异构体
(9)[Co(NH3)(en)Cl3] 八面体2种异构体
(10)[Co(en)2(NO2)2]Cl2
[Co(en)2(NO2)2]2+八面体2种异构体
5.某金属离子在八面体弱场中的磁距为4.90B.M。而它在八面体强场中的磁距为零,该中
心金属离子可能是哪个?
解该中心金属离子可能是Fe2+
n= 4.90 n = 4
n
)2
(+
即在八面体场中有四个成单电子
八面体强场中磁矩为零,即无成单电子
故 Fe2+符合题意
6.根据实验测得的有效磁距,判断下列各种配离子中哪几种是高自旋的?哪几种是低自旋
的?哪几种是内轨型的?哪几种是外轨型的?
(1)Fe(en)+2
5.5B.M
2
6.1BM
(2)Mn(SCN)-4
6
1.8B.M
(3)Mn(CN)-4
6
1.8B.M
(4)Co(NO2)-4
6
4.3B.M.
(5)Co(SCN)-2
4
0B.M.
(6)Pt(CN)-2
4
(7)K3[FeF6] 5.9B.M.
(8)K3[Fe(CN)6] 2.4B.M.
解高自旋的有:(1),(2),(5),(7)
低自旋的有:(3),(4),(6),(8)
内轨型的有:(3),(4),(6),(8)
外轨型的有:(1),(2),(5),(7)
7.已知[Pd(Cl)2(OH)2]有两种不同的结构,成键电子所占据的杂化轨道应该是哪种杂
化轨道?
解dsp2
8.应用软硬酸碱理论解释在稀AgNO3溶液种依次加入NaCl,NH3,KBr,Na2S2O3,KI,
KCN,Ag2S产生沉淀、溶解交替的原因?
解由软硬酸碱规则:“硬亲硬,软亲软,软硬交界就不管”
9.预测下列各组所形成的二组配离子之间的稳定性的大小,并简单说明原因:
(1)Al3+ 与F- 或Cl- 配合;
(2)Pd2+与RSH或ROH配合;
(3)Cu2+与NH3或N配合;
(4)Cu2+与NH3或NH2COOH或CH3COOH配合。
解(1)Al 3+与F -的配合物更加稳定,Al 3+为硬酸;而碱F -的硬度比Cl -大
(2)Pd 2+与RSH 配合后更加稳定,Pd 2+为软酸,而RSH 为软碱,ROH 为硬碱。 (3)Cu 2+与NH 3结合更加稳定。
(4) Cu 2+与NH 2CH 2COOH 结合更加稳定,因为前者的配体中有N ,后者仅有O ,N 的配位能力比O 强。
10. 在0.1mol ·dm -3K[Ag (CN )2]溶液中,加入KCl 固体使Cl - 的浓度为0.10mol ·dm -3,
有何现象发生?
解:设[Ag +]为x mol?dm -3
Ag + + 2CN - Ag(CN)
2- x 2x 0.1-x
21
2
1025.1)
2(1.0?=-x x x 得:x = 2.7×10-8mol?dm -3
Q = [Ag +][Cl -] = 2.7×10-8×0.10 = 2.7×10-9
Q > Ksp H (AgCl ),因而会有AgCl 沉淀析出
11. 在1dm -36mol ·dm -3的NH 3水中加入0.01mol 固体CuSO 4,溶解后,在此溶液再加0.01mol
固体的NaOH ,铜氨配合物能否被破坏? 解 设生成 Cu(NH 3)42+后Cu 2+的浓度为xmol?L -1 +
+
?+24332)(4NH Cu NH Cu
x 6-4(0.01-x) 0.01-x
4
)]
01.0(46[01.0x x x
--- = 2.09 × 1013 得: x = 3.79 × 10-19 mol?dm -3 Q = [Cu 2+] – [OH -]2 = 3.79 × 10-19×0.012
= 3.79 × 10-23
Q 小于Ksp H 故铜氨配合物不能被破坏
12. 当NH 4SCN 及少量Fe 3+同存于溶液中达到平衡时,加入NH 4F 使[F -
]=[SCN -
]=
1 mol ·dm -3,问此时溶液中[FeF 6]
-
3与[Fe (SCN )3]的浓度比为多少?
(K 稳,Fe (SCN )3=2.0×103,K 稳,[FeF6]3-=1×1016) 解 Fe 3+
+6F
-
[FeF 6]
-
3 Fe 3+ + 3SCN
-
[Fe (SCN )3]
a 1 x a 1 y K 稳,[FeF6]3- =
a
x
61= 1×1016 K 稳,Fe (SCN )3 = a y 31=2.0×103
y
x
= 5×1012 所以溶液中[FeF 6]-
3与[Fe (SCN )3]的浓度比为 5×1012
13. 欲使1×10-5mol 的AgI 溶于1cm -3氨水,试从理论上推算,氨水的最低浓度为多少?
(K 稳,Ag (NH3)+2
=1.12×107;K θ
AgI sp ,=9.3×10-17
) 解:Ksp H AgI = [Ag +][I -]
3
317
75533
5233
52
323232
3232331031.0103.91012.1101101][101])([101][][)(]
)([]/[]][[]
[-------+---++++
+
?=?=??????=??=??=?=
-=
cm
m ol cm m ol NH cm m ol NH Ag cm m ol I NH NH Ag K NH Ag I AgI Ksp NH Ag NH Ag NH Ag K 稳稳得:)()(θ
14. 已知Au + + e —
=Au 的θ?=1.691V ,求Au (CN )-2 + e
—
Au+2CN —
的θ?值是
多少?(K 稳,Au (CN )-2
=2×1038
) 解
]lg[059.0/]/[]
[1
]][[][][0.1][][2)(22223
22++
-
+-+-
-----
--+==
=?==+?+Au Au Au E Au CN Au E Au CN Au CN Au CN Au K dm mol CN CN Au CN Au e CN Au )
()()()()(标准状态时:稳
θθθ
=1.691 + 0.059lg1/K 稳H
=1.691+0.059lg1/2×1038
=-0.57V
15. 一个铜电极浸在一种含有1.00 mol ·dm -3氨和1.00Cmol ·dm -3Cu (NH 3)+
24配离子的溶
液里,若用标准氢电极作正极,经实验测得它和铜电极之间得电势差为0.0300V 。试计
算Cu (NH 3)+
24配离子得稳定常数(已知θ
?Cu Cu /2+=0.34V )
。
解:E H = E H (H+/H 2)- E H [Cu (NH3)42+/Cu] = 0.0300V 即 E H [Cu (NH 3)42+/Cu] = -0.0300V
由 E H [Cu (NH 3)42+/Cu] = E H (Cu 2+/Cu ) + 0.059/2lg[Cu 2+]
12
24
322243321049.3lg 2
059.034.00300.0/1lg 2/059.034.0]/[/1][]
[14?=-=-+===
?++
+
++
+θ
θ
θ
θθ
稳
稳稳稳
稳得:)(即得:)(K K K Cu NH Cu E K Cu Cu K NH Cu NH Cu 16. 为什么在水溶液中,Co 3+离子能氧化水,[Co (NH 3)6]3+却不能氧化水?
K 稳,Co (NH3)+26=1.38×105;K 稳Co (NH3)+
36
=1.58×1035;K b ,NH3=1.8×10-5 θ?+
+
23/Co
Co
=1.808V ;θ?O H O 22/=1.229V ;θ
?-OH O /2 =0.401V
解:在水溶液中,
)2/3(++Co Co E θ>)/(22O H O E θ
故Co3+能氧化水
4Co 3++2H 2O=4Co 2+O 2↑+4H +
V OH p O p OH O E OH O E OH e O H O dm m ol OH dm m ol NH V NH Co K NH Co K Co Co E Co Co Co Co
E NH Co NH Co E 45.0)
1024.4(1
lg 4059.0401.0][/)(lg 4059.0)/()/(4441024.4108.10.1][0.1][04.010
58.11038.1lg 059.081.1]
)([])([lg
059.0)2/3(]
[]
[lg
059.0)/(])(/)([4
34222223353335
5
2632632323263363=?+=+==++??=??=?==??+==++=+=---
-
-
------+
+++++
++θθθ
θθθθ则:
设稳稳
])(/)([263363+
+NH Co NH Co E θ<)/(2-OH O E
故 Co (NH 3)63+不能氧化水
17. 在1.0mol ·dm -3得HCl 溶液中加入0.010mol ·dm -3得Fe (NO 3)3后,溶液中有关配离
子中哪种配离子浓度最大?(已知该体系逐级稳定常数为:k 1=4.2,k 2=1.3,k 3=0.040,k 4=0.012)
解:因各级稳定常数都比较小,Cl -
过量很多故可以认为: [Cl -] = 1.0 mol?L -1
[Cl -] + [FeCl 2+] + 2[FeCl 2+] + 3[FeCl 3] + 4[FeCl 4-] =1.0 mol?L -1 [Fe 3+] + [FeCl 2+] + [FeCl 2+] + [FeCl 3] + [FeCl 4-]=0.010 mol?L -1
2.4]
][[][321==-
++Cl Fe FeCl k [FeCl 2+] = 4.2[Fe 3+] 3.1]
][[][222==-
++
Cl FeCl FeCl k [FeCl 2+] = 1.3×4.2[Fe 3+
] =5.5[Fe 3+] 040.0]
][[][233==
-+
Cl FeCl FeCl k [FeCl 3] = 0.040[FeCl 2+]
= 0.04×1.3×4.2[Fe 3+] =0.22[Fe 3+]
012.0]
][[]
[344==-
-
Cl FeCl FeCl k [FeCl 4-]=0.012[FeCl 3] =0.012×0.04×1.3×4.2[Fe 3+] =0.0026[Fe 3+]
则:[Fe 3+] + 4.2[Fe 3+] + 5.5[Fe 3+] +0.22[Fe 3+] + 0.0026[Fe 3+]=0.010mol?L -1
可得:[Fe 3+]=9.2×10-4 mol?L -1
由此可以得到:FeCl 2+的浓度最大
第9章配位化合物习题 1.选择题 9-1下列不能做为配位体的物质是…………………………………………( ) (A) C6H5NH2(B)CH3NH2 (C)NH4+(D)NH3 9-2关于螯合物的叙述,不正确的是……………………………………………( ) (A)螯合物的配位体是多齿配体,与中心原子形成环状结构 (B)螯合物中环愈多愈稳定 (C)螯合剂中有空间位阻时,螯合物稳定性减小 (D)螯合剂中配位原子相隔越远形成的环越大,螯合物稳定性越强 9-3 在配位化合物的内界,若有多种无机配体和有机配体,其命名顺序为……( ) (A)阴离子—阳离子—中性分子—有机配体 (B)阳离子—中性分子—阴离子—有机配体 (C)中性分子—阳离子—阴离子—有机配体 (D)阴离子—中性分子—阳离子—有机配体 9-4 在下列正方形和八面体的几何构型中,CO32-作为螯合剂的是……………( ) (A)[Co(NH3)5CO3]+(B)[Pt(en)CO3] (C)[Pt(en)(NH3)CO3] (D)[Pt(NH3)4(NO2)Cl]CO3 9-5 配位酸或配位碱比相应的普通酸或普通碱的酸性或碱性强,其原因是…( ) (A)配位酸, 碱较稳定(B)配位酸, 碱较不稳定 (C)H+或OH-为配位酸或碱的外界,易解离(D)配位后极性增强 9-6在[AlCl4]-中,Al3+的杂化轨道是……………………………………………( ) (A)sp杂化(B)sp2杂化(C)sp3杂化(D)dsp2杂化 9-7M为中心原子,a, b, d 为单齿配体。下列各配合物中有顺反异构体的是()(A)Ma2bd(平面四方)(B)Ma3b (C)Ma2bd(四面体)(D)Ma2b(平面三角形) 9-8 当1mol CoCl3?4NH3与AgNO3(aq)反应,沉淀出1mol AgCl。请问与钴成键的氯原子数为…………………………………………………………………………………()(A)0 (B)1 (C) 2 (D) 3 9-9在[Ru(NH3)4Br2]+中,Ru的氧化数和配位数分别是…………………()(A)+2和4 (B)+2和6 (C)+3和6 (D)+3和4 9-10 下列配合物的稳定性,从大到小的顺序,正确的是……………………()(A)[HgI4]2- > [HgCl4]2- > [Hg(CN)4]2-
第十一章配位化合物 一、选择题 1. 配位数为6的配离子的空间构型是: A、三角锥形 B、四面体形 C、平面四边形 D、八面体形 2. Fe(Ⅲ)形成的配位数为6 的内轨配合物中,Fe3+离子接受孤对电子的空轨道是: A、d2sp3 B、sp3d2 C、p2d4 D、sd5 3. 在[CoCl(NH3)3(en)]2+中,中心离子Co3+的配位数为: A、3 B、4 C、5 D、6 4. [Cr(en)3]2+离子中铬的配位数及配合物中配体的个数是: A、3,3 B、3,6 C、6,6 D、6,3 5. 根据晶体场理论,在八面体场中,由于场强的不同,有可能产生高自旋或低自旋的电子构型是: A、d2 B、d3 C、d6 D、d9 6. 形成高自旋配合物的原因是: A、分裂能△< 电子成对能P B、分裂能△= 电子成对能P C、分裂能△> 电子成对能P D、不能只根据分裂能△和电子成对能P确定 7. 在[CoCl(NH3)3(en)]2+中,中心离子Co3+的配位数为: A、3 B、4 C、5 D、6 8. 对于配离子[Co(NH3)5H2O]3+,下列命名正确的是: A、一水五氨合钴(Ⅲ)离子 B、五氨一水合钴(Ⅲ)离子 C、氨一水合钴(Ⅲ)离子 D、五氨一水合钴离子 9. Ni(Ⅱ)形成的配位数为4具有四面体形的配合物中,Ni2+离子接受孤对电子的空轨道是: A、sp3 B、sp3d2 C、spd2 D、dsp2 10. 对于配离子[CoCl(NH3)3(en)]2+,下列命名正确的是: A、三氨一氯乙二胺合钴(Ⅲ)离子 B、一氯三氨乙二胺合钴(Ⅲ)离子 C、一氯乙二胺三氨合钴(Ⅲ)离子 D、乙二胺一氯三氨合钴(Ⅲ)离子 11. Co(Ⅱ)形成的配位数为6 的外轨配合物中,Co2+离子接受孤对电子的空轨道是: A、d2sp3 B、p2d4 C、s p2d3 D、sp3d2
第9章配位化合物 一判断题 1 价键理论认为,配合物具有不同的空间构型是由于中心离子(或原子)采用不同杂化轨道与配体成键的结果。() 2 价键理论能够较好地说明配合物的配位数、空间构型、磁性和稳定性,也能解释配合物的颜色。() 3 价键理论认为,在配合物形成时由配体提供孤对电子进入中心离子(或原子)的空的价电子轨道而形成配位键。() 4 同一元素带有不同电荷的离子作为中心离子,与相同配体形成配合物时,中心离子的电荷越多,其配位数一般也越大。() 5 在多数配位化合物中,内界的中心原子与配体之间的结合力总是比内界与外界之间的结合力强。因此配合物溶于水时较容易解离为内界和外界,而较难解离为中心离子(或原子)和配体。() 6 所有八面体构型的配合物比平面四方形的稳定性强。() 7 所有金属离子的氨配合物在水中都能稳定存在。() 8 价键理论认为,所有中心离子(或原子)都既能形成内轨型配合物,又能形成外轨型配合物。() 9 所有内轨型配合物都呈反磁性,所有外轨型配合物都呈顺磁性。() 10 内轨型配合物往往比外轨型配合物稳定,螯合物比简单配合物稳定,则螯合物必定是内轨型配合物。() 11 内轨型配合物的稳定常数一定大于外轨型配合物的稳定常数。() 12 不论配合物的中心离子采取d2sp3或是sp3d2杂化轨道成键,其空间构型均为八面体形。 13 [Fe(CN)6]3-和[FeF6]3-的空间构型都为八面体形,但中心离子的轨道杂化方式不同。() 14 [Fe(CN)6]3-是内轨型配合物,呈反磁性,磁矩为0。() 15 K3[FeF6]和K3[Fe(CN)6]都呈顺磁性。() 16 Fe2+的六配位配合物都是反磁性的。() 17 在配离子[AlCl4]-和[Al(OH)4]-中,Al3+的杂化轨道不同,这两种配离子的空间构型也不同。() 18 已知E(Cu2+/Cu) = 0.337V,E([Cu(NH3)4]2+/Cu) = -0.048V,则E([Cu(CN)4]2-/Cu) < -0.048V。() 19 已知E(Ag+/Ag) = 0.771V,E([Ag(NH3)2]+/Ag) = 0.373V,则E([Ag(CN)2]-/Ag) > 0.373V。() 20 按照价键理论可推知,中心离子的电荷数低时,只能形成外轨型配合物,中心离子电荷数高时,才能形成内轨型配合物。() 21 以CN-为配体的配合物,往往较稳定。() 22 Ni2+的平面四方形构型的配合物,必定是反磁性的。() 23 Ni2+的四面体构型的配合物,必定是顺磁性的。() 24 磁矩大的配合物,其稳定性强。() 25 所有Ni2+的八面体配合物都属于外轨型配合物。() 26 所有Fe3+的八面体配合物都属于外轨型配合物。() 27 已知K2[Ni(CN)4]与Ni(CO)4均呈反磁性,所以这两种配合物的空间构型均为平面正方形。() 28 按照晶体场理论,对给定的任一中心离子而言,强场配体造成d轨道的分裂能大。()。 29 按照晶体场理论可知,强场配体易形成高自旋配合物。()。 30 晶体场理论认为配合物的中心离子与配体之间的作用力是静电引力。() 31 具有d0、d10结构的配离子都没颜色,因为不能产生d-d跃迁。()
第十一章配位化合物 一、判断题: 1. 已知K2 [ Ni (CN)4 ]与Ni (CO)4 均呈反磁性,所以这两种配合物的空间构型均为平面正方形。 2.某配离子的逐级稳定常数分别为K、K、K、K,则该配离子的不稳定常数K= K·K·K·K。 3.HgS 溶解在王水中是由于氧化还原反应和配合反应共同作用的结果。 4.在多数配位化合物中,内界的中心原子与配体之间的结合力总是比内界与外界之间的结合力强。因此配合物溶于水时较容易解离为内界和外界,而较难解离为中心离子(或原子)和配体。 5.Zn2+只能形成外轨型配合物。 6.Fe2+既能形成内轨型配合物又能形成外轨型配合物。 二、选择题: 1.下列配合物中,属于内轨型配合物的是......................................()。 (A) [ V(H2O)6 ]3+,μ = 2.8 B. M.;(B) [ Mn (CN) ]4-,μ = 1.8 B. M.;。 6 (C) [Zn (OH)4]2-,μ = 0 B. M.;(D) [ Co(NH3)6 ]2+,μ = 4.2 B. M.。 2.配合物(NH4 )3[ SbCl6 ]的中心离子氧化值和配离子电荷分别是()。 (A) + 2 和? 3; (B) + 3 和? 3; (C) ? 3 和 + 3; (D) ? 2 和 + 3。 3. 第一过渡系列二价金属离子的水合热对原子序数作图时有两个峰,这是由于( ) (A) 前半系列是6配位,后半系列是4配位 (B) d电子有成对能 (C) 气态离子半径大小也有类似变化规律 (D) 由于晶体场稳定化能存在,使水合热呈现这样的规律 4 Fe(Ⅲ)形成的配位数为 6 的外轨配合物中,Fe3+离子接受孤对电子的空轨道是 ( ) (A) d2sp3 (B) sp3d2 (C) p3d3 (D) sd5 5. [NiCl4]2-是顺磁性分子,则它的几何形状为 ( ) (A) 平面正方形 (B) 四面体形 (C) 正八面体形 (D) 四方锥形 6.下列配离子的形成体采用sp杂化轨道与配体成键且μ = 0 B.M.的是.........()。 (A) [Cu (en)2]2+; (B)[CuCl2]-; (C)[AuCl4]-; (D) [BeCl4]2-。 7. [Ni(en)3]2+离子中镍的价态和配位数是 ( ) (A) +2,3 (B) +3,6 (C) +2,6 (D) +3,3 8. [Co(SCN)4]2-离子中钴的价态和配位数分别是( ) (A) -2,4 (B) +2,4 (C) +3,2 (D) +2,12 9. 0.01mol氯化铬( CrCl3·6H2O )在水溶液中用过量AgNO3处理,产生0.02molAgCl沉淀,此氯 化铬最可能为 ( ) (A) [Cr(H2O)6]Cl3 (B) [Cr(H2O)5Cl]Cl2·H2O (C) [Cr(H2O)4Cl2]Cl·2H2O (D) [Cr(H2O)3Cl3]·3H2O 10. 在[Co(en)(C2O4)2]配离子中,中心离子的配位数为 ( ) (A) 3 (B) 4 (C) 5 (D) 6 11. 在 K[Co(NH3)2Cl4] 中,Co 的氧化数和配位数分别是( ) (A) +2 和4 (B) +4 和6 (C) +3 和6 (D) +3 和 4 12. 在 [Ru(NH3)4Br2]+中,Ru 的氧化数和配位数分别是( ) (A) +2 和4 (B) +2 和6 (C) +3 和6 (D) +3 和 4
课题:配位化合物的基本概念 课型:课时:上课时间: 学习目标: 1、了解配合物的形成原理 2、知道配位键、配合物、配离子等基本概念 3、掌握配合物的组成和命名 重、难点: 1、配合物的组成 2、配合物的命名 学习过程: 课前检测: (一)完成下面方程式: 1、硫酸铜与氨水反应 2、硫酸铜与氯化钡反应 3、硝酸银与氨水反应 (二)溶度积规则Qi与Ksp的关系 学习新课 一、配合物的定义 [实验探究] 1、取一支试管加入5mL 0.1mol/L CuSO4溶液,然后逐滴加入2mol/L NH3·H2O 溶液至过量,观察并记录现象 。 2、将上述溶液分成两份,一份滴加数滴0.1mol/L BaCl2溶液,另一份滴加数滴1mol/L NaOH溶液,观察并记录现象 。 3、分析实验现象,你能得出什么结论: 。 (沉淀-溶解平衡考虑) [自学反馈]预习P130配合物的定义,理解下列几个基本概念 1、配位键 2、配离子 3、配合物 二、配合物的组成 [自学反馈]预习P131配合物的组成,掌握配合物的组成 以[Cu(NH3)4]SO4为例,分析其组成 [Cu(NH3)4]SO4
1、中心原子:通常是, 例如:。 2、配位体:提供的分子和离子叫配位体 例如:。 配位原子:配位体中原子叫配位原子 例如:。 3、配位数:作为直接与结合的的数目,即形成配位键的数目称为配位数。 4、配离子的电荷数:配离子的电荷数等于和电荷数的代数和。 5、内界和外界:配合物分为内界和外界,其中称为内界,与内界发生电性匹配的称为外界。 三、配合物的命名 [自学反馈]预习P132配合物的命名,熟悉配合物的命名规则 1、配离子的命名: 2、配位酸: 3、配位碱: 4、配位盐: 自学检测:命名下列配合物 (1)K2[PtCl6] (2)K4[Fe(CN)6] (3)[Co(NH3)6]Cl3; (4)[CrCl2(H2O)4]Cl (5)[Co(NO3)3(NH3)3] (6)[Fe(CO)5]
《配位化合物》作业参考解析 1. 下列说法正确的是 A. 配合物的内界和外界之间主要以共价键相结合 B. 中心原子与配体之间形成配位键 C. 配合物的中心原子都是阳离子 D. 螯合物中不含有离子键 【B】A、D:一般认为配合物的内界和外界之间主要以离子键相结合,因此螯合物中内界和外界之间是可以存在离子键的;C:中心原子可以是阳离子,也可以是中性原子,例如[Ni(CO)4];B:中心原子与配体化合时,中心原子提供杂化过的空轨道,配体提供孤对电子,而形成配位键。 2. 下列配合物命名不正确的是 A. [Co(H2O)(NH3)3Cl2]Cl 氯化二氯·三氨·一水合钴(Ⅲ) B. [Cr(NH3)6][Co(CN)6] 六氰合钴(Ⅲ)酸六氨合铬(Ⅲ) C. K[Co(NO2)3Cl3] 三硝基·三氯合钴(Ⅲ)酸钾 D. H2[PtCl6] 六氯合铂(Ⅳ)酸 【C】根据配体命名顺序,先无机后有机,先阴离子后中性分子,同类配体根据配位原子在字母表中的先后顺序进行命名。对于C中的配合物而言,NO2-以N原子为配位原子时,命名为硝基,带一个负电荷,氯离子也是阴离子,同类配体,根据配位原子在字母表中的先后顺序,Cl-离子在前,NO2-离子在后,因此该配合物应该命名为“三氯·三硝基合钴(Ⅲ)酸钾”。 3. 下列配离子具有正方形或者八面体形结构,其中CO32-最有可能作为双齿配体的是 A. [Co(NH3)4(CO3)]+ B. [Co(NH3)5(CO3)]+ C. [Pt(en)(NH3)(CO3)] D. [Pt(en)2(NH3)(CO3)]2+ 【A】根据题意,配离子具有正方形结构时,配位数为4,形成四个配位键;具有八面体结构时,配位数为6,形成6个配位键。B:[Co(NH3)5(CO3)]+ 配离子中,已有5个氨作为配体,氨是单齿配体,形成5个配位键,因此该配离子中,CO32-离子只能是单齿配体,这样就形成了6个配位键;C:[Pt(en)(NH3)(CO3)] 配合物中,乙二胺(en)为双齿配体,形成2个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了4个配位键;D:[Pt(en)2(NH3)(CO3)]2+ 配离子中,乙二胺(en)为双齿配体,2个en形成4个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了6个配位键;A:[Co(NH3)4(CO3)]+ 配离子中有4个氨为配体,形成4个配位键,因此CO32-离子必须是双齿配体,这样就形成了4个配位键,如果CO32-离子是单齿配体,那么配离子的配位数为5,这与题意不符。 4. 下列分子或者离子的中心原子发生了dsp2杂化的是 A. BF3 B. [Zn(NH3)4]2+ (μ = 0 ) C. [Ni(CN)4]2-(μ = 0 ) D. 【C】A:BF3分子为正三角形,中心原子B发生sp2杂化;[Zn(NH3)4]2+ (μ = 0 )的配位数为4,中心原子提供4个杂化空轨道,由于Zn2+离子的价层电子排布为3d10,d轨道已经全部排满电子,因此只会发生sp3杂化,形成四个杂化轨道;D:NH4+离子是正面体结构,因此中心原子N原子发生了sp3杂化;C:[Ni(CN)4]2-(μ = 0 )的配位数为4,中心原子提供4个杂
第十一章 配位化合物 一. 是非题: 1. 因[Ni(NH3)6]2+ 的K s=5.5×108, [Ag(NH3)2]+ 的K s=1.1×107, 前者大于后者,故溶液中 [Ni(NH3)6]2+比[Ag(NH3)2]+稳定() 2. H[Ag(CN)2]- 为酸,它的酸性比HCN强() 3. 因CN-为强场配体,故[30Zn(CN)4]2-为内轨型化合物() 二. 选择题: 1. 在[Co(en)(C2O4)2]-中,Co3+的配位数是() A.3 B.4 C.5 D.6 E.8 2. 下列配离子中属于高自旋(单电子数多)的是() A. [24Cr(NH3)6]3+ B. [26FeF6]3- C. [26Fe(CN)6]3- D. [30Zn(NH3)4]2+ E. [47Ag(NH3)2]+ 3. 下列分子或离子能做螯合剂的是() A.H2N-NH2 B.CH3COO- C.HO-OH D.H2N-CH2-NH2 E.H2NCH2CH2NH2 4. 已知[25Mn(SCN)6]4-的μ=6.1×AJ?T-1,该配离子属于() A.外轨 B.外轨 C.内轨 D.内轨 E.无法判断 5. 已知H2O和Cl-作配体时,Ni2+的八面体配合物水溶液难导电,则该配合物的化学式为 () A. [NiCl2(H2O)4] B. [Ni (H2O)6] Cl2 C. [NiCl(H2O)5]Cl D. K[NiCl3(H2O)3] E. H4[NiCl6] 三. 填充题: 1. 配合物[Cr(H2O)(en)(C2O4)(OH)]的名称为,配位数为。 2. 配合物“硝酸氯?硝基?二(乙二胺)合钴(III)”的化学,它的 外层是。 3. 价键理论认为,中心原子与配体间的结合力是。 四. 问答题:
第十一章 配位化合物 首 页 习题解析 本章练习 本章练习答案 章后习题答案 习题解析 [TOP] 例7-1 固体CrCl 3·6H 2O 的化学式可能为〔Cr(H 2O)4Cl 2〕Cl·2H 2O 或〔Cr(H 2O)5Cl 〕Cl·H 2O 或〔Cr(H 2O)6〕Cl 3,今将溶解有0.200gCrCl 3·6H 2O 的溶液流过一酸性阳离子交换柱,在柱上进行离子交换反应: X n+(aq) + n (RSO 3H) (RSO 3)n X + n H +(aq) 配合物正离子 阳离子交换树脂 交换后的交换树脂 交换下来的H + 交换下来的H +用0.100mol·L - 1NaOH 标准溶液滴定,计耗去22.50mL ,通过计算推断上述配合物的正确化学式〔已知Mr(CrCl 3·6H 2O)=266.5〕。 析 根据题中条件可知离子的物质的量与配合物的电荷数有确定的关系,因此只要确定离子的物质的量即可求出配离子的电荷,进而求出配合物的化学式。 解 0.200gCrCl 3?6H 2O 的物质的量为 1mol 1000mmol mol 266.5g 0.200g 1 ??-=0.75mmol 滴定测得 n (H +)=22.50mL×0.100mol·L -1=2.25mmol 由交换反应式知:1mol X n+可交换出n mol H +。因0.75 mmol CrCl 3?6H 2O 交换出2.25 mmol 的H +,由此可得 1 :n = 0.75 :2.25 n = 3 即X n+为X 3+,所以配正离子只能是[Cr(H 2O)6]3+,配合物为[Cr(H 2O)6]Cl 3。 例7-2(1)根据价键理论,画出[Cd(NH 3)4]2+(μ=0μB )和[Co(NH 3)6]2+(μ=3.87μB )的中心原子与配体成键时的电子排布,并判断空间构型。(2)已知[Co(NH 3)6]3+的分裂能Δo 为273.9kJ·mol -1,Co 3+的电子成对能P 为251.2kJ·mol -1;[Fe(H 2O)6]2+分裂能Δo 为124.4kJ·mol -, Fe 2+的电子成对能P 为179.40kJ·mol -1。根据晶 体场理论,判断中心原子的d 电子组态和配离子自旋状态。并计算晶体场稳定化能。 析(1)利用磁矩确定未成对电子数,然后确定内轨或外轨及杂化类型。(2)比较分裂能与电子成对能,确定高自、自旋化合物,计算晶体场稳定化能。 解(1)[Cd(NH 3)4]2+中Cd 2+的电子组态为4d 10,μ=0μB ,无未成对电子,采取sp 3杂化轨道成键,配体NH 3中N 的孤电子对填入sp 3杂化轨道,配离子空间构型为正四面体。
配位化合物 知识点一:基本概念 一、定义和组成 1.配位键 由一个原子提供一对电子与另一个接受电子的原子形成的共价键。 2.配位键的表示方法 如:A →B :A 表示提供孤电子对的原子,B 表示接受共用电子对的原子。 3.配位化合物 (1)定义:金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物。 (2)组成 如[Cu(NH 3)4]SO 4 (3)形成条件 ??? 配位体有孤电子对? ?? ?? 中性分子:如H 2 O 、NH 3 和CO 等。 离子:如F - 、Cl - 、CN - 等。中心原子有空轨道:如Fe 3+、Cu 2+、Zn 2+ 、Ag +等。 【练习1】下列分子或离子中都存在着配位键的是( ) A .NH 3、H 2O B .NH + 4、H 3O + C .N 2、HClO D .[Cu(NH 3)4]2+ 、PCl 3 【练习2】既有离子键又有共价键和配位键的化合物是( ) A .NH 4NO 3 B .NaOH C .H 2SO 4 D .H 2O 【练习3】下列物质:①H 3O + ②[B(OH)4]- ③CH 3COO - ④NH 3 ⑤CH 4中存在配 位键的是( )
A .①② B .①③ C .④⑤ D .②④ 【练习4】下列不属于配合物的是( ) A .[Cu(H 2O)4]SO 4·H 2O B .[Ag(NH 3)2]OH C .KAl(SO 4)2·12H 2O D .Na 3[AlF 6] 【练习5】下列化合物中哪些是配合物( ) ①CuSO 4·5H 2O ②K 2PtCl 6 ③KCl ·CuCl 2 ④Cu(NH 2CH 2COO)2 ⑤KCl ·MgCl 2·6H 2O ⑥Cu(CH 3COO)2 A .①③④⑥ B .②③⑤ C .①② D .①③⑤ 二、配合物的分类和命名 1、 分类: ⑴简单配合物:由形成体和单齿配体直接配位形成的配合物称简单配合物(也称单核配合物)。如()[] 443SO NH Cu 、()[] O H SO O H Cu 2442?等。 其特点是: ① 在中心离子周围按一定空间构型整齐地排列着一定数目的配体。 ② 在水溶液中往往逐级离解,形成一系列中间配离子,并存在着一定的平衡关系。 ③ 大量的水合物,是以H 2O 为配体的简单配合物。 ⑵螯合物:由中心离子和多齿配体结合而成的配合物称为螯合物,俗称内络盐。此类配体也称螯合剂,它与中心离子结合时犹如螃蟹的双螯钳住中心离子似的。 其特点如下: ① 螯合物中有环状结构。 ② 若中心离子相同,且配位原子也相同时,螯合物一般比简单配合物稳定。 ③ 在水溶液中很少发生逐级离解现象。 ④ 一般具有特征颜色。 ⑤ 往往不溶于水,但却溶于有机溶剂中。 在分析化学上,螯合剂被广泛地用作滴定剂、显色剂、沉淀剂、掩蔽剂和萃取剂等进行分离和分析测定。 ⑶特殊配合物:除简单配合物和螯合物外,还有许多其它类型的配合物。 如:多核配合物、多酸配合物、羰基配合物、夹心配合物等。 2、 配合物的化学式 3、 配合物的命名: 配体数→配体名称→合→中心原子(氧化数) 如:[Co(NH 3)6] 3+ 六氨合钴(Ⅲ)离子
1、配位化合物 (1)概念:金属离子或原子与某些分子或离子以配位键结合而形成的化合物称为配位化合物,简称配合物。 作为电子对接受体的金属离子或原子称为中心离子(原子),又称配合物的形成体,作为电子对给予体的分子或离子称为配体。 [Cu(H2O)4]2+的空间结构为平面正方形。 (2)配合物的结构 [Cu(NH3)4]SO4为例说明。 注意:离子型配合物是由内界和外界组成,内界由中心离子和配体组成。 (3)配合物的命名: 例如:[Cu(NH3)4]SO4硫酸四氨合铜 练习:对下列配合物进行命名 [Cu(NH3)4]Cl2K3[Fe(SCN)6] Na3[AlF6] 3、几种常见的配合物 实验:硫酸四氨合铜的制备。 现象:向CuSO4溶液中加入氨水,生成蓝色沉淀,继续加入氨水,沉淀溶解,得到深蓝色溶液。再加入乙醇,析出深蓝色的晶体。 有关反应的离子方程式为:Cu2++2NH3·H2O=Cu(OH)2↓+2OH- Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- 蓝色沉淀深蓝色溶液 在[Cu(NH3)4]2+里,中心离子是Cu2+,配体是NH3,NH3分子的氮原子给出孤电子对,以配位键形成了[Cu(NH3)4]2+: [Cu(NH3)4]2+的空间结构为平面正方形。 实验:硫氰化铁的制备。向氯化铁溶液中滴加硫氰化钾溶液。 现象:形成血红色溶液。有关反应的化学方程式为:FeCl3+3KSCN=Fe(SCN)3+3KCl
Fe(SCN)3呈血红色,它是一种配合物。上述实验可用于鉴定溶液中存在Fe3+。 呈血红色的是一系列配合物:Fe(SCN)2+、Fe(SCN)2+、Fe(SCN)3、Fe(SCN)4-、Fe(SCN)52-、Fe(SCN)63-,配位数从1~6。 注意:配位键的强度有大有小,因而有的配合物很稳定,有的不很稳定。许多过渡金属离子对多种配体具有很强的结合力,因而,过渡金属配合物远比主族金属配合物多。 [随堂练习] 1.铵根离子中存在的化学键类型按离子键、共价键和配位键分类,应含有() A.离子键和共价键B.离子键和配位键 C.配位键和共价键D.离子键答案:C 2.下列属于配合物的是() A.NH4Cl B.Na2CO3·10H2O C.CuSO4·5H2O D.Co(NH3)6Cl3 答案:CD 3.下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是() ①H2O ②NH3③F-④CN-⑤CO A.①②B.①②③ C.①②④D.①②③④⑤答案:D 4.配合物在许多方面有着广泛的应用。下列叙述不正确的是() A.以Mg2+为中心的大环配合物叶绿素能催化光合作用 B.Fe2+的卟啉配合物是输送O2的血红素 C.[Ag(NH3)2]+是化学镀银的有效成分 D.向溶液中逐滴加入氨水,可除去硫酸锌溶液中的Cu2+ 答案:D 5.下列微粒:①H3O+②NH4+③CH3COO-④NH3⑤CH4中含有配位键的是() A.①②B.①③ C.④⑤D.②④答案:A 6.下列不属于配位化合物的是() A.六氟和铝酸钠B.氢氧化二氨合银(银氨溶液)C.六氰合铁酸钾D.十二水硫酸铝钾答案:D 7.指出配合物K2[Cu(CN)4]的配离子、中心离子、配位体、配位数及配位原子。 8.亚硝酸根NO2-作为配体,有两种方式。其一是氮原子提供孤对电子与中心原子配位;另一是氧原子提供孤对电子与中心原子配位。前者称为硝基,后者称为亚硝酸根。 [Co(NH3)5NO2]Cl2就有两种存在形式,试画出这两种形式的配离子的结构式。
第2课时配位键 1.了解简单配位键的概念及形成实质和配位化合物在生物、化学等领域的广泛应用。 2.知道配位键的形成条件及简单配位键的形成表示。 一、配位键的含义 氨分子中,氮原子的三个未成对电子分别与一个氢原子的电子配对形成共价键,氮原子上还存在未成键的①孤对电子,形成铵根离子时,氨分子中的②孤对电子所在的轨道将与H+的1s空轨道重叠,使③孤对电子为氮原子、氢原子所共用,从而形成一种新的化学键叫④配位键。N中,4个N—H键性质⑤相同。 二、配位键的形成条件 形成配位键的一方(如A)是能够提供⑥孤对电子的原子,另一方(如B)是具有⑦能够接受孤对电子的空轨道的原子。配位键通常用符号⑧A→B表示。配位键与共价键的差别是形成配位键的共用电子对是由⑨一方提供而不是⑩双方共同提供的。 三、配位化合物 ①向硝酸银溶液中加入氨水,首先形成白色难溶物,继续加入氨水,难溶物溶解,得到一种称为氢氧化 二氨合银的物质,其化学式为[Ag(NH3)2]OH,其中含有的配位键可表示为H3N → Ag+。 ②向硫酸铜溶液中加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,得到一种称为硫酸四氨合 铜的物质,其化学式为[Cu(NH3)4]SO4,其中含有的配位键可表示为H3N → Cu2+。 1.配位键与共价键有什么区别? 【答案】共价键是成键原子分别提供一个电子成键,配位键是配体提供一对电子,受体提供空轨道成键。 2.配位键是电子云重叠形成的吗? 【答案】不是;配位键是孤对电子的电子云与空轨道重叠形成的。 3.为什么过渡金属容易形成配位键? 【答案】因为过渡金属有空轨道。 1.在N中存在4个N—H共价键,则下列说法正确的是( )。
第七章 配位化合物 一、单项选择题 1. 下列物质中不能作为配体的是 ( B ) A. NH 3 B. NH 4+ C. OH - D. NO 2- 2. 下列离子或化合物中,具有顺磁性的是 ( B ) A. Ni(CN)- 24 B. CoCl - 24 C. Co(NH 3)+ 36 D. Fe(CO)5 3.在配合物[Co(NH 3)4(H 2O)]2(SO 4)3中,中心离子的配位数为 ( B ) A. 4 B. 5 C. 9 D. 12 4. 配离子[Co(NH 3)6]2+的空间构型为 ( A ) A. 八面体 B. 四方锥形 C. 四面体 D. 三角双锥 5. EDTA 是四元弱酸,当其水溶液pH ≥ 12时,EDTA 的主要存在形式为 ( C ) A. H 4Y ; B. H 3Y -; C. Y 4-; D. HY 3- 6.下列关于价键理论对配合物的说法正确的是 ( C ) A. 任何中心离子与任何配体都可形成外轨型化合物; B. 任何中心离子与任何配体都可形成内轨型化合物; C. 中心离子用于形成配位键的原子轨道是经过杂化的等价轨道; D. 以sp 3d 2和d 2sp 3杂化轨道成键的配合物具有不同的空间构型。 7.下列物质中能被氨水溶解的是 ( B ) A. Al(OH)3 B. AgCl C. Fe(OH)3 D. AgI 8. 下面哪一个不属于EDTA 与金属离子形成螯合物的特点 ( B ) A. 具有环状结构 B . 稳定性差 C. 配位比一般为1:1 D. 易溶于水 9. 下列说法欠妥的是: ( C ) A. 配合物的形成体(中心原子)大多是中性原子或带正电荷的离子。 B. 螯合物以六员环、五员环较稳定。 C. 配位数就是配位体的个数。 D. 二乙二胺合铜(Ⅱ)离子比四氨合铜(Ⅱ)离子稳定。 10. AgCl 在11mol L -?氨水中比在纯水中的溶解度大,其原因是 ( B ) A. 盐效应 B. 配位效应 C. 酸效应 D. 同离子效应 11. 离子以dsp 2杂化轨道成键而形成的配合物,其空间构型是 ( A ) A. 平面正方形 B. 四面体形 C. 直线形 D. 八面体形 12. 22Cu(en)+的稳定性比234Cu(NH )+ 大得多,主要原因是前者 ( B ) A. 配体比后者大; B. 具有螯合效应; C. 配位数比后者小; D. en 的分子量比NH 3大。 13. Al 3+与EDTA 形成 ( A ) A. 鳌合物 B. 聚合物 C. 非计量化合物 D. 夹心化合物 14.下列说法中错误的是 ( D ) A. 配体的配位原子必须具有孤电子对。 B. 配离子的配位键愈稳定,其稳定常数愈大。 C. 配合物的颜色最好用晶体场或配位场理论解释。 D. 配合物的颜色最好用价键理论来解释。 15. 下列几种物质中最稳定的是 ( A ) A. [Co(en)3]Cl 3 B. [Co(NH 3)6] (NO 3)3 C. [Co(NH 3)6]Cl 2 D. Co(NO 3)3
配位化合物习题及解析精编W O R D版 IBM system office room 【A0816H-A0912AAAHH-GX8Q8-GNTHHJ8】
《配位化合物》作业参考解析 1. 下列说法正确的是 A. 配合物的内界和外界之间主要以共价键相结合 B. 中心原子与配体之间形成配位键 C. 配合物的中心原子都是阳离子 D. 螯合物中不含有离子键 【B 】A 、D :一般认为配合物的内界和外界之间主要以离子键相结合,因此螯合物中内界和外界之间是可以存在离子键的;C :中心原子可以是阳离子,也可以是中性原子,例如[Ni(CO)4];B :中心原子与配体化合时,中心原子提供杂化过的空轨道,配体提供孤对电子,而形成配位键。 2. 下列配合物命名不正确的是 A. [Co(H 2O)(NH 3)3Cl 2]Cl 氯化二氯·三氨·一水合钴(Ⅲ) B. [Cr(NH 3)6][Co(CN)6] 六氰合钴(Ⅲ)酸六氨合铬(Ⅲ) C. K[Co(NO 2)3Cl 3] 三硝基·三氯合钴(Ⅲ)酸钾 D. H 2[PtCl 6] 六氯合铂(Ⅳ)酸 【C 】根据配体命名顺序,先无机后有机,先阴离子后中性分子,同类配体根据配位原子在字母表中的先后顺序进行命名。对于C 中的配合物而言,NO 2- 以N 原子为配位原子时,命名为硝基,带一个负电荷,氯离子也是阴离子,同类配体,根据配位原子在字母表中的
先后顺序,Cl-离子在前,NO 2 -离子在后,因此该配合物应该命名为“三氯·三硝基合钴(Ⅲ)酸钾”。 3. 下列配离子具有正方形或者八面体形结构,其中CO 3 2-最有可能作为双齿配体的是 A. [Co(NH 3) 4 (CO 3 )]+ B. [Co(NH 3 ) 5 (CO 3 )]+ C. [Pt(en)(NH 3)(CO 3 )] D. [Pt(en) 2 (NH 3 )(CO 3 )]2+ 【A】根据题意,配离子具有正方形结构时,配位数为4,形成四个配位键;具有八面体 结构时,配位数为6,形成6个配位键。B:[Co(NH 3) 5 (CO 3 )]+ 配离子中,已有5个氨作为 配体,氨是单齿配体,形成5个配位键,因此该配离子中,CO 3 2-离子只能是单齿配体,这 样就形成了6个配位键;C:[Pt(en)(NH 3)(CO 3 )] 配合物中,乙二胺(en)为双齿配体,形 成2个配位键,氨为单齿配体,形成1个配位键,因此CO 3 2-离子只能是单齿配体,这样就 形成了4个配位键;D:[Pt(en) 2(NH 3 )(CO 3 )]2+ 配离子中,乙二胺(en)为双齿配体,2个en 形成4个配位键,氨为单齿配体,形成1个配位键,因此CO 3 2-离子只能是单齿配体,这样 就形成了6个配位键;A:[Co(NH 3) 4 (CO 3 )]+ 配离子中有4个氨为配体,形成4个配位键, 因此CO 32-离子必须是双齿配体,这样就形成了4个配位键,如果CO 3 2-离子是单齿配体,那 么配离子的配位数为5,这与题意不符。 4. 下列分子或者离子的中心原子发生了dsp2杂化的是 A. BF 3 B. [Zn(NH 3 ) 4 ]2+ (μ = 0 ) C. [Ni(CN) 4 ]2-(μ = 0 ) D. 【C】A:BF 3分子为正三角形,中心原子B发生sp2杂化;[Zn(NH 3 ) 4 ]2+ (μ = 0 )的配位数 为4,中心原子提供4个杂化空轨道,由于Zn2+离子的价层电子排布为3d10,d轨道已经全
配位键疑难释疑 配位键及配位化合物知识尽管在教材中所占内容不多,但它常常与化学键、轨道杂化及物质性质等内容结合在一起设计问题,因而明晰配位键的本质、存在、形成条件等相关内容具有很重要的意义。 一、配位键与共价键的本质是否相同 原子之间形成共价键时,若共用电子对只是由一方原子提供电子,而非来 自双方原子,这样的共价键就称为配位键,故配位键一定是共价键,也就具有 共价键的特征:方向性与饱和性,所以说配位键与共价键没有本质上的差异。共价键不一定是配位键,关键是看共用电子对的来源是一个成键原子还是两个 成键原子提供的,若是由成键的一个原子单方面提供的则为配位键,若是由成 键双方原子共同提供的则是普通共价键,所以说配位键与共价键只是在形成过 程上有所不同而已。如浓氨水与盐酸反应生成氯化铵,因氨气分子中的 氮原子有一对孤电子,氢离子有空轨道,故H+与氨气通过配位键结合成铵根离 子,尽管铵根离子中4个氮氢键的形成过程不同,但实验证明 这4个氮氢键的性质完全相同,没有任何差异,这也进一步证明配位键与共价 键是没有本质区别的。 二、形成配位键有何条件 配位键是一种特殊的共价键,并不是任意的两个原子相遇就能形成。它要求成键的两个原子中一个原子A有孤对电子,另一个原子B有接受孤对电子的“空轨道”,所以配位键的表示方法为A →B,A称为配体,B称为中心原子或离子。有时为了增强成键能力,中心原子或离子B利用能量相近的空轨道进行杂化后,再来接收以配体原子A的孤电子对。配位键既可以存在于分子中(如H2SO4等),又可以存在于离子之中(如铵根离子、水合氢离子等),如图所示:
、例1:气态氯化铝(Al 2Cl 6 )是具有配位键的化合物,分子中原子之间的关系 如图示,请在图中标出你认为是配位键的斜线加上箭头。 解析:配位键是指成键双方一方提供空轨道一方提供孤对电子。C1元素最外层有7个电子通过1个共用电子对就可以形成8电子稳定结构。所以氯化铝(A12Cl6)中与两个铝形成共价健的氯原子中,有一条是配位键,氯原子提供电子,铝提供空轨道。 答案: 三、含有配位键的化合物就是配位化合物吗 配位化合物一般指由过渡金属的原子或离子(价电子层的部分d轨道和s、p 轨道是空轨道)与含有孤对电子的分子(如CO、NH3、H2O)或离子(如Cl-、CN-、 2 NO等)通过配位键结合形成的化合物。显然含有配位键的化合物就不一定是配位化合物,如上述提到的硫酸及铵盐等化合物中尽管有配位键,但由于没有过渡金属的原子或离子,故它们也就不是配位化合物。当然含有过渡金属离子的化合物也不一定是配位化合物,如氯化铁、硫酸锌等化合物就不是配位化合物。现以配位化合物[Co(NH3)6]Cl3为例说明配位化合物的结构与名称
第八章配位化合物 1.指出下列配离子的形成体、配体、配位原子及中心离子的配位数。 2. 命名下列配合物,并指出配离子的电荷数和形成体的氧化数。 (1) 三氯·一氨合铂(Ⅱ)酸钾 (2) 高氯酸六氨合钴(Ⅱ) (3) 二氯化六氨合镍(Ⅱ) (4) 四异硫氰酸根·二氨合铬(Ⅲ)酸铵 (5) 一羟基·一草酸根·一水·一乙二胺合铬(Ⅲ) (6) 五氰·一羰基合铁(Ⅱ)酸钠
根据上述结果,写出上列三种配合物的化学式。 5. 根据下列配离子中心离子未成对电子数及杂化类型,试绘制中心离子价层d 64 2-6 3-测这两种配离子价层d 电子分布情况及它们的几何构型。 7.在50.0mL0.20mol ·L -1 AgNO 3 溶液中加入等体积的1.00mol ·L -1 的NH 3 ·H 2 O ,计算达平衡时溶液中Ag + ,[Ag(NH 3 )2 ]+ 和NH 3 的浓度。 8.10mLO.10mol ·L -1 CuSO 4 溶液与lOmL6.Omol ·L -1 NH 3 ·H 2 O 混合并达平衡,计算溶液中Cu 2+ 、NH 3 及[Cu(NH 3 )4 ]2+ 的浓度各是多少? 若向此混合溶液中加入0.010molNaOH 固体,问是否有Cu(OH)2沉淀生成? 9.通过计算比较1L 6.0mol ·L -1 氨水与1L 1.0mol ·L -1KCN 溶液,哪一个可溶解较多的AgI? 10.0.10g AgBr 固体能否完全溶解于100mL 1.00mol ·L -1 氨水中? 11.在50.0 mL 0.100mol ·L -1 AgNO 3 溶液中加入密度为0.932g ·cm -3 含NH 3 18.2%的氨水30.0mL 后,再加水冲稀到100mL 。 (1)求算溶液中Ag + 、[Ag(NH 3 )2 ]+ 和NH 3 的浓度。 (2)向此溶液中加入0.0745g 固体KCl ,有无AgCl 沉淀析出? 如欲阻止AgCl 沉淀生成,在原来AgNO 3 和NH 3 水的混合溶液中,NH 3 的最低浓度应是多少? (3)如加入0.120g 固体KBr ,有无AgBr 沉淀生成? 如欲阻止AgBr 沉淀生成,在原来AgNO 3 和NH 3 水的混合溶液中,NH 3 的最低浓度应是多少? 根据(2)、(3)的计算结果,可得出什么结论? 12.计算下列反应的平衡常数,并判断反应进行的方向。 (1) [HgCl 4 ]2- +4I - [Hgl 4 ]2- + 4Cl - 已知:([HgCl 4 ]2-) = 1.17×1015 ;([HgI 4 ]2- = 6.76×1029 (2) [Cu(CN) 2 ]- + 2NH 3 [Cu(NH 3 )2 ]+ + 2CN - 已知: {[Cu(CN)2 ]-}=1.0×1024 {[Cu(NH 3 )2 ]+ } =7.24×1010 (3) [Fe(NCS) 2 ]+ + 6F - [FeF 6 ]3- + 2SCN - 巳知: {[Fe(NCS)2 ]+ }= 2.29×103 [(FeF 6 ]3-= 2.04×1014 13. 已知:E θ(Ni 2+ /Ni)= -0.257V ,E θ(Hg 2+ /Hg)= 0.8538V , 计算下列电极反应的E θ值。 (1) [Ni(CN)4]2- + 2e -Ni + 4CN - (2) [HgI 4 ]2- + 2e - Hg + 4I - *14. 已知: E θ(Cu2+/Cu)=0.340 V, 计算出电对[Cu(NH3)4]2+/Cu 的E θ值。
第七章配位化合物(计划学时数:3) [教学目的]通过本章讲解使学生掌握配合物的一些基本概念,并了解使配离子电离平衡发生移动的因素。 [教学要求] 1.掌握配位化合物的定义、组成、结构特征和系统命名。 2.理解配位化合物稳定常数的意义,理解酸度等因素对配位平衡的影响。 3.掌握螯合物的结构特征和特性。 4.了解配位化合物在生物、医药等方面的应用。 [总学时] 3学时 [学时分配]第一节配合物的基本概念1学时 第三节配位平衡1学时 第四节螯合物0.5学时 第五节配合物在生命科学中的应用0.5学时 [重点内容] 配合物的基本概念和配位平衡 [难点内容] 配位平衡的移动] [使用教具] 挂图 [教学方法] 讲解、启发、提问 [作业] 90页1、2、3、4
第一节配合物的基本概念 (本节是重点内容,从配合物的组成入手,重点介绍配离子的结构特点及其命名) [讲解] CuSO4 + NaOH →↓ CuSO4 + NH3→深兰色溶液→无沉淀 (CuSO4可以电离出Cu2+,与OH-结合生成沉淀;而深兰色溶液中加NaOH无沉淀,说明其中没有Cu2+,其结构非常特殊。) 一、配合物的定义 1.配离子(或配分子):由简单阳离子或中性原子和一定数目的中性分子或负离子以配 位键结合形成的、具有一定特征的的复杂离子或分子叫配离子 或配分子; 2.配位化合物:由配离子或配分子所组成的复杂化合物叫配位化合物。习惯上配离子也叫配合物。 明矾KAl(SO4)2·12H2O、铬钾矾KCr(SO4)2·12H2O的晶体和水溶液都不含 复杂离子,是复盐。 二、配合物的组成 [讲解] 以上述实验中深兰色溶液中的物质为例,介绍配合物的结构组成。 配合物一般由内界和外界两部分组成。配离子是内界,它是配合物的特征部分,其性质、结构与一般离子不同,因此,常将配离子用方括号括起来。方括号内是配合物的内界,不在内界的其它离子是配合物的外界。内界与外界以离子键结合。 [CoCl3(NH3)3]没有外界. [Cu (NH3) 4 ]2+SO42-K2+ [ Hg I 4 ]2- 1. 中心离子(或原子):是配合物的形成体,位于配离子或配分子的中心,是配合物的 核心部分,它们都是具有空的价电子轨道的离子或原子,其半径小电荷多 是较强的配合物的形成体。常见的是过度金属离子或分子如:大、电荷 多不易形成,原子也可形成配合物。 2. 配位体:在配离子或配分子内与中心离子或原子结合的负离子或中性分子叫配位 体。如NH3CN- 配位原子:配位体中具有孤对电子的直接与中心离子结合的原子叫配位原子。常见的配位原子有N、O、S 根据一个配位体中所含配位原子的数目配位体可分为: