
第八章 配位平衡和配位滴定法
8-1 无水CrC13和氨作用能形成两种配合物A 和B ,组成分别为CrC13·6NH 3和CrC13·5NH 3。加入AgNO 3,A 溶液中几乎全部的氯沉淀为AgC1,而B 溶液中只有
3
2
的氯沉淀出来。加入NaOH 并加热,两种溶液均无氨味。试写出这两种配合物的化学式并命名。 解: A [Cr(NH 3)6]Cl 3 三氯化六氨合铬(Ⅲ) B [Cr Cl (NH 3)5]Cl 2 二氯化一氯·五氨合铬(Ⅲ)
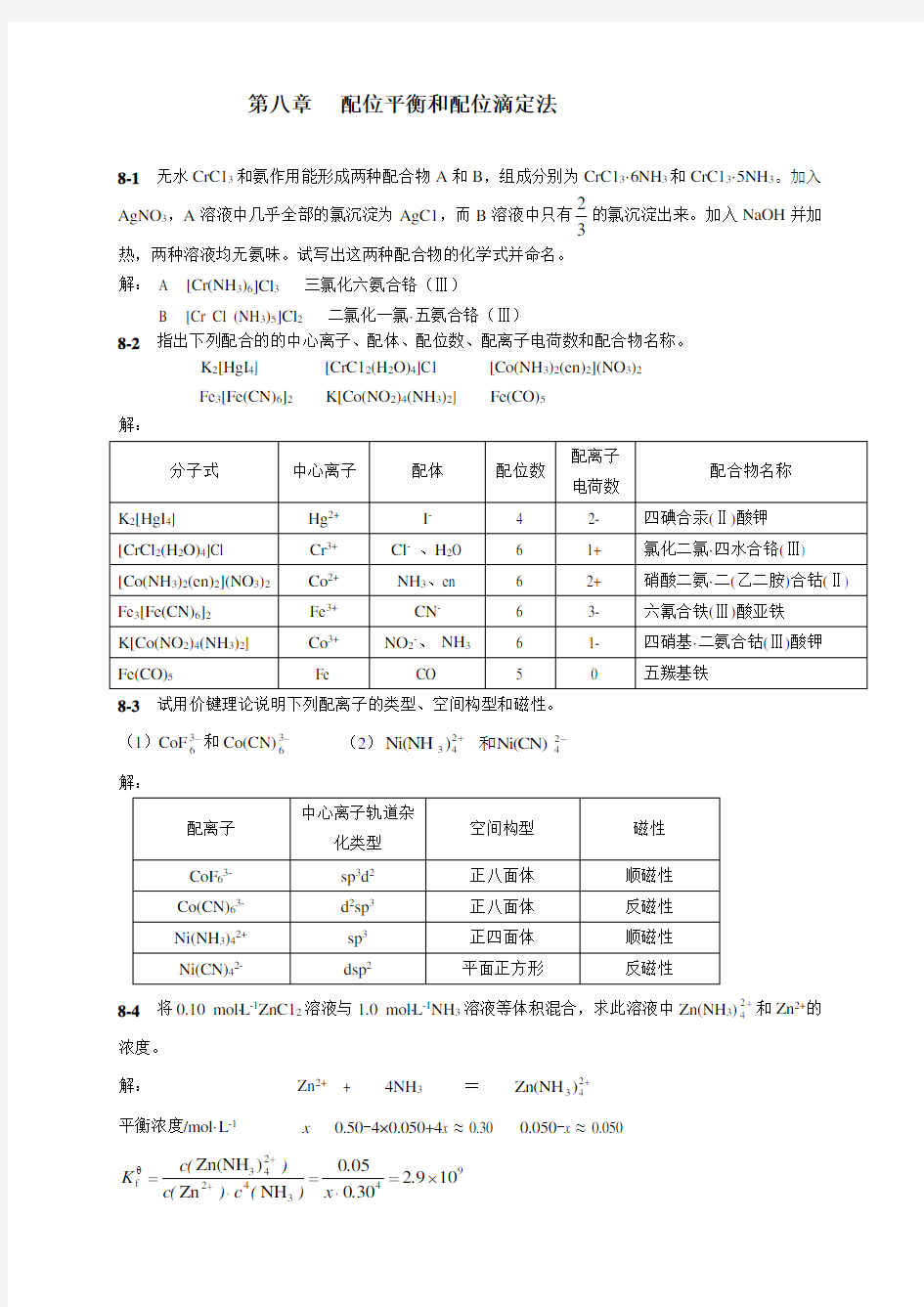
8-2 指出下列配合的的中心离子、配体、配位数、配离子电荷数和配合物名称。
K 2[HgI 4] [CrC12(H 2O)4]C1 [Co(NH 3)2(en)2](NO 3)2 Fe 3[Fe(CN)6]2 K[Co(NO 2)4(NH 3)2] Fe(CO)5
解:
8-3 试用价键理论说明下列配离子的类型、空间构型和磁性。
(1)CoF -36和Co(CN)-36
(2)+243)Ni(NH -
24
Ni(CN)和
解:
8-4 将0.10 mol·L -1ZnC12溶液与1.0 mol·L -1NH 3溶液等体积混合,求此溶液中Zn(NH 3)+
24和Zn 2+的浓度。
解: Zn 2+ + 4NH 3 ? +243)Zn(NH
平衡浓度/mol·L -1 x 0.50-4×0.050+4x ≈ 0.30 0.050-x ≈ 0.050
94342243θf
1092300050NH Zn )Zn(NH ?=?=?=++
..x .)(c )(c )(c K
x = c (Zn 2+) = 2.1×10-9 mol·L -1
8-5 在100.0 mL0.050 mol·L -1+23)Ag(NH 溶液中加入1.0 mL 1.0 mol·L -1NaC1溶液,溶液中NH 3的浓度至少需多大才能阻止AgC1沉淀生成?
解: +23)Ag(NH + Cl - ? AgCl + 2NH 3
平衡浓度/mol·L -1 0.050 0.010 c (NH 3)
10
7θsp
θf 2332θJ
1077.1101.11
1))Ag(NH ()Cl ()NH (-+-???=?=?=K K c c c K 1
10
73L mol 51010771101101000500)NH --?=????=
.....(c
8-6 计算AgC1在0.10 mol·L -1氨水中的溶解度。 解:设AgCl 的溶解度为S mol·L -1
AgCl + 2NH 3 ? +23)Ag(NH + Cl -
平衡浓度/mol·L -1 0.10-2S S S
3107θsp θf 32
23θJ
1095.11077.1101.1)
NH ())Ag(NH ()Cl (--+-?=???=?=?=K K c c c K 3
2
2109512100-?=-.)
S .(S S = 4.1×10-3mol·L -1
8-7 在100.0 mL 0.15mol·L -1Ag(CN)-
2溶液中加入50.0 mL 0.10 mol·L -1KI 溶液,是否有AgI 沉淀生成?在上述溶液中再加入50.0 mL 0.20 mol·L -1KCN 溶液,又是否会产生AgI 沉淀? 解:加入KI 后:
c (-2Ag(CN)) = 0.10 mol·
L -1,c (I -) = 0.033 mol·L -1 设-2Ag(CN)溶液中Ag +浓度为x mol·
L -1 -2Ag(CN) ? Ag + + 2CN -
0.10-x x 2x
212
22θf
103.1)
2(10.0)CN ()Ag ()Ag(CN)(?=?-=?=-+-x x x c c c K 解得: x =2.7×10-8 mol·L -1
Q = 0.033×2.7×10-8 = 8.8×10-10 >θ
sp K (AgI) = 8.5×10-12 ,故有沉淀产生。
再加入KCN 后:
c (-2Ag(CN)) = 0.075 mol L -1,c (I -) = 0.025 mol L -1,c (CN -) = 0.050 mol L -1
由于同离子效应,设平衡时Ag +浓度为y mol·L -1 -2Ag(CN) ? Ag + + 2CN - 0.075-y y 0. 050+y
212
2θf 103.105
.0075
.0)05.0(075.0?=?=+-=
y y y y K y = 2.3×10-20 mol L -1
Q = 0.025×2.3×10-20 = 5.8×10-22 <θsp K (AgI) = 8.5×10-12
故没有沉淀产生。
8-8 0.080 mol AgNO 3溶解在1L Na 2S 2O 3溶液中形成-
3232)0Ag(S ,过量的-
232O S 浓度为0.20 mol·L -1。
欲得到卤化银沉淀,所需I -和C1-的浓度各为多少?能否得到AgI ,AgC1沉淀? 解:设溶液中Ag +浓度为x mol·L -1
Ag + + 2-232O S ? -
3232)0Ag(S
x 0.20+2x ≈ 0.20 0.080-x ≈ 0.080
13
2
23223232θf
10
922000800O S Ag )O Ag(S ?=?=
=
-+-
.).(x .)
(c )(c )(c K ,x = c (Ag +) = 6.9×10-14 mol ?L -1 则生成AgI 沉淀需要c (I -)的最低浓度为:
3
14
17θsp
102110
9610518Ag I ---+-
?=??==...)(c K )(c ,故能生成AgI 沉淀。 生成AgCl 沉淀需要c (Cl -)的最低浓度为:
3
14
10θsp
106210
9610771Ag Cl ?=??==--+-
...)(c K )(c ,故不能生成AgCl 沉淀。 8-9 50.0 mL 0.10 mol·L -1AgNO 3溶液与等量的6.0 mol·L -1氨水混合后,向此溶液中加入0.119 g KBr 固体,有无AgBr 沉淀析出?如欲阻止AgBr 析出,原混合溶液中氨的初始浓度至少应为多少? 解:设混合后溶液中Ag +浓度为x mol·L -1
Ag + + 2NH 3 ? +
23)Ag(NH
x 3.0-2(0.050-x ) 0.050-x
≈ 2.9 ≈ 0.050
723223θf
1011920500NH Ag )Ag(NH ?=?=?=++.)
.(x .)(c )(c )(c K , c (Ag +) = x = 5.4×10-10 mol·L -1 c (Br -) = 0.119/119×0.10 = 0.010 mol·L -1
Q = c (Ag +) c (Br -) = 5.4×10-12 >θsp K (AgBr) =5.35×10-13
故有沉淀产生。
要不至生成AgBr 沉淀,则有:
c (Ag +)·c (Br -) <θ
sp K (AgBr),c (Ag +) <θ
sp K (AgCl)/0.01= 5.35×10-11 mol·L -1
c (NH 3) ={ c [ Ag(NH 3)2+]/[θ
f K c (A
g +)]}1/2 = 9.2 mol·L -1 则氨的初始浓度c (NH 3) = 9.22 + 0.05×2 = 9.3 mol·L -1
8-10 分别计算Zn(OH)2溶于氨水生成Zn(NH 3)+24和+243)Zn(NH 时的平衡常数。
若溶液中NH 3和NH +
4的浓度均为0.10 mol·L -1,则Zn(OH)2溶于该溶液中主要生成哪一种配离子?
解:Zn(OH)2 + 4NH 3 ? +24
3)Zn(NH + 2OH - (1) Zn(OH)2 + 2NH 3·H 2O ? -
24Zn(OH)- + 2NH 4+ (2)
=?=?=-
+θsp θf 34
2243θ1
)NH ()OH (])Zn(NH [K K c c c K 2.9 ×109 × 6.68 ×10-17 =1.9×10-7 2517172θb θsp θf 32
4224θ2
)1077.1(1068.6106.4)NH ()NH (]Zn(OH)[--+
-?????=??=?=K K K c c c K = 9.6×10-9
注:计算到此可以说明问题,因(1)的平衡常数远远大于(2),故主要生成+243)Zn(NH 。
还可继续计算两种配离子的浓度,计算如下:
当 c (NH 3) = c (+
4NH ) = 0.10 mol·L -1 543θb 1077.1)
NH ()NH ()OH (-+
-?=?=c c K c 74
2
5243109.110
.0)1077.1(])Zn(NH [--+?=??c ,c [+243)Zn(NH ] = 6.2×10-2 mol·L -1 92
2
24106.910
.010.]0Zn(OH)[--?=c ,c [Zn (OH)42-] = 9.6×10-9 mol·L -1 故主要生成+
24
3)Zn(NH 配离子。 8-11 将含有0.20 mol·L -1NH 3和1.0 mol·L -1NH +
4的缓冲溶液与0.020 mol·L -1+24
3)Cu(NH 溶液等体积混合,有无Cu(OH)2沉淀生成?[已知Cu(OH)2的θsp K =2.2×10-20]
解:设该溶液中C u 2+浓度为x m o l ·L -1
C u 2+ + 4N H 3 ? +
24
3)Cu(NH x 0.10+4x ≈ 0.10 0.010-x ≈ 0.010
134342243θf
101.2)10.0(010.0)NH ()Cu ())Cu(NH (?=?=?=++x c c c K ,x = c (C u 2+) = 4.8×10-12 mol·L -1 165
43θ
b L mol 105.350
.010.01077.1)NH ()NH ()OH (---+
-??=??=?
=c c K c Q = 4.8×10-12(3.54×10-6)2 = 6.0×10-23 <θ
sp K 因此,没有沉淀产生。
8-12 写出下列反应的方程式并计算平衡常数: (1)AgI 溶于KCN 溶液中;
(2)AgBr 微溶于氨水中,溶液酸化后又析出沉淀(两个反应)。 解:(1)AgI + 2CN - ? -2
Ag(CN) + I - 51721θsp θf 22θJ
1011.11051.8103.1)CN ()I (]Ag(CN)[?=???=?=?=--
-
-K K c c c K (2)AgBr + 2NH 3 ? +23)Ag(NH + Br -
6137θf 32
23θJ
1089.51035.5101.1)NH ()Br (])Ag(NH [---
+?=???=?=?=θsp K K c c c K (3)+23)Ag(NH + Br - + 2H + ? AgBr + 2+
4NH
232θw
θsp θf 2
θb 22342θJ 1032.5)H ()Br (])Ag(NH [)NH (?=??=??=+-++K K K K c c c c K 8-13 下列化合物中,哪些可作为有效的螯合剂?
(1)HO —OH (2)H 2N —(CH 2)3—NH 2 (3)(CH 3)2N —NH 2
(4)C
H 3OH COOH
(5)
N N
(6)H 2N(CH 2)4COOH
解:(2)、(4)、(5)可作为有效螯合剂。
8-14 计算pH=7.0时EDTA 的酸效应系数]Y(H)[α,此时Y 4-占EDTA 总浓度的百分数是多少? 解: 已知EDTA 的各级离解常数θ
a 1K ~θ
a 6K 分别为10-0.9,10-1.60,10-2.00,10-2.67,10-6.16, 10-10.26,故各级累积质子化常数H 1β~H 6β分别为1010.26,1016.42,1019.09,1021.09,1022.69, 1023.59,pH=7.00时,按下式计算,
H 66H 55H 44H 33H 22H 1)(H )(H )(H )(H )H ()H (1)]Y (H [ββββββα++++++++++++=c c c c c c
=1+1010.26-7.00+1016.42-14.00+1019.09-21.00+1021.09-28.00+1022.69-35.00+1023.59-42.00
=1+103.26+102.42+10-1.91+10-6.91+10-12.31+10-18.41 =103.32
)Y ()Y (]Y (H)[c c '=
α,则32.310)]
Y (H [1)Y ()Y (-=='αc c = 0.05% 8-15 在0.010 mol·L -1Zn 2+溶液中,用浓的NaOH 溶液和氨水调节pH 至12.0,且使氨浓度为0.010 mol·L -1(不考虑溶液体积的变化),此时游离Zn 2+的浓度为多少?
解:+243)Zn(NH 的θ
4θ1lg ~lg ββ分别为2.27,4.61,7.01,9.06。
()()()()θn 34θ233θ232θ133NH NH NH NH 1)]Zn(NH [ββββαc c c c ++++= = 1+102.27-2.00 +104.61-4.00 +107.01-6.00 +109.06-8.00 = 1+100.27 +100.61 +101.01 +101.06 = 101.46
查表知pH=12时,5.8)]Zn(OH [lg =α, 则5.846
.131010
)]Zn(OH [)]Zn(NH [)Zn (+=+=ααα= 108.5
则 游离的Zn 2+的浓度=='=
5.810
01
.0)Zn ()n Z ()Zn (αc c 3.2×
10-11 mol·L -1 8-16 pH=6.0的溶液中含有0.10 mol·L -1的游离酒石酸根(Tart ),计算此时)CdY (lg θ'K 。若Cd 2+的浓度为0.010 mol·L -1,能否用EDTA 标准溶液准确滴定?(已知Cd 2+-Tart 的8.2lg θ1=β) 解:pH = 6.00时,65.4]Y(H)[lg =α,查表知46.16(CdY )lg θ=K
8.18.21101.0101)Tart (1)CdT (=?+=+=c θβα
1.108.165.446.16)CdT (lg ]Y (H)[lg )(CdY lg CdY )(lg θ
θ=--=--=ααK 'K >8
CdY )(lg θ'K =10.1>8,故能用EDTA 标准溶液准确滴定。
8-17 pH = 4.0时,能否用EDTA 准确滴定0.010 mol·L -1Fe 2+? pH = 6.0,8.0时? 解:查表pH = 4、6、8时,]Y(H)[lg α=8.44、4.65、2.27,32.14)(FeY lg θ
=cK
pH=4,88.544.832.14Y (H)][lg (FeY )lg )FeY (lg θ
θ=-=-=αK 'K <8,故不能准确滴定, pH=6时,67.965.432.14)]Y (H [lg )(FeY lg )FeY (lg θ
θ=-=-=αK 'K >8, pH=8,05.1227.232.14)]Y (H [lg )(FeY lg )FeY (lg θ
θ=-=-=αK 'K >8,
又Fe 2+的滴定允许的最低pH 为:)]Y(H [lg α=14.32 – 8 = 6.32,pH = 5.1;滴定允许的最高 pH 为:8172θ
sp
100701010874Fe OH --+
-
?=?==
...)
(c K )(c ,pH = 6.80,
因此,pH = 6.0时能准确滴定,pH = 8.0时不能准确滴定。
8-18 若配制EDTA 溶液的水中含有Ca 2+、Mg 2+,在pH =5~6时,以二甲酚橙作指示剂,用Zn 2+标定该EDTA 溶液,其标定结果是偏高还是偏低?若以此EDTA 溶液测定Ca 2+、Mg 2+,所得结果又如何?
解:(1)pH = 5~6时,Ca 2+、Mg 2+不干扰,c (EDTA)为准确浓度,测定结果无影响;
(2) pH =10时,Ca 2+、Mg 2+消耗部分EDTA ,c (EDTA)的实际浓度小于计算浓度,测定结果偏高。 8-19 含0.010 mol·L -1Pb 2+、0.010 mol·L -1Ca 2+的溶液中,能否用0.010 mol·L -1EDTA 准确滴定Pb 2+?若可以,应在什么pH 下滴定而Ca 2+不干扰?
解:查表得:)(PdY lg θK =18.04, )(CaY lg θK =10.69, )(PdY lg θ
K ·c (Pb 2+)/ c (Ca 2+)·
(CaY )lg θK =107.35>106
故可用0.010 mol L -1EDTA 准确滴定Pb 2+。由)]Y(H [lg α=)(PdY lg θ
K -8得]Y(H)[lg α=18.04-8 =10.04
查表得pH=3.3。
由θ
sp K [Pb(OH)2] = c (Pb 2+) ·c 2(OH -) =1.42×10-20,c (OH -) = [θ
sp K / c (Pb 2+)]1/2 = 1.2×10-9 mol L -1
pH =14 - pOH=5,即滴定溶液的pH 在3.3到5之间。
8-20 用返滴定法测定A13+的含量时,首先在pH = 3左右加入过量的EDTA 并加热,使A13+完全配位。试问为何选择此pH ?
解:酸度不高时,Al 3+水解生成一系列多核、多羟基配合物如[Al 2(H 2O)6(OH)3]3+… ,即使酸度提高至EDTA 滴定Al 3+最高酸度pH = 4,仍不可避免水解;铝的多羟基配合物(多核配合物)与EDTA 反应缓慢,Al 3+对XO 等指示剂有封闭作用,因此不能直接滴定,
在pH=3时,酸度较大, Al 3+不水解,但EDTA 过量较多, Al 3+与EDTA 配位完全。设c (Al 3+)=
0.010 mol·L -1,则
11133
3
3θsp
L mol 1085.501
.0102)Al ()OH (---+
-
??=?==c K c ,pH =3.80,因此,为防止Al 3+发生水解选择pH =3左右比较合适。
8-21 量取含Bi 3+、Pb 2+、Cd 2+的试液25.00mL ,以二甲酚橙为指示剂,在pH=1.0时用0.02015 mol·L -1EDTA 溶液滴定,用去20.28 mL 。调节pH 至5.5,用此EDTA 滴定时又消耗28.86 mL 。加入邻二氮菲,破坏PbY 2-,释放出的EDTA 用0.01202 mol·L -1Pb 2+溶液滴定,用去18.05 mL 。计算溶液中的Bi 3+、Pb 2+、Cd 2+的浓度。
解:查表得:)(BiY lg θK =27.94, )(PdY lg θK =18.04,(CdY )lg θ
K =16.46, pH=1.0时,Y(H)][lg α=18.01; pH=5.5时,)]Y(H [lg α=5.69
由判据)MY (lg θ
'K c (M) >6知,pH=1时只能测定Bi 3+离子, pH=5.5时可测定Pb 2+,Cd 2+离子。 而由CdY 2-释放出来的EDTA 消耗的Pb 2+量相当于Cd 2+的量,则有: c (Bi 3+) = c (EDTA)·V (EDTA) /V (Bi 3+) = 20.28 × 0.02015/25.00 = 0.01635 mol·L -1 c (Cd 2+) = c (Pb 2+)·V (Pb 2+) /V (Cd 2+) = 0.01202 × 18.05/25.00 = 0.008678 mol·L -1
c (Pb 2+) = [ c (EDTA) ·V (EDTA)-c (Pb 2+)·V (Pb 2+)]/V (Pb 2+) = (0.02015×28.86-18.05×0.01202)/25.00
= 0.01458 mol·L -1
8-22 在25.00 mL 含Ni 2+、Zn 2+的溶液中加入50.00 mL 0.01500情况mol·L -1EDTA 溶液,用0.01000 mol·L -1Mg 2+返滴定过量的EDTA ,用去17.52 mL ,然后加入二巯基丙醇解蔽Zn 2+,释放出EDTA ,再用去22.00 mL Mg 2+溶液滴定。计算原试液中Ni 2+、Zn 2+的浓度。 解: c (Zn 2+) = 0.01000×22.00/25.00 = 0.008800 mol·L -1
c (Ni 2+) =(0.01500×50.00-0.01000×17.52)/25.00 = 0.01419 mol·L -1
8-23 间接法测定2-4SO 时,称取3.000g 试样溶解后,稀释至250.00 mL 。在25.00 mL 试液中加入25.00 mL0.05000 mol·L -1BaC12溶液,过滤BaSO 4沉淀后,滴定剩余Ba 2+用去29.15 mL 0.02002 mol·L -1 EDTA 。试计算2-4
SO 的质量分数。 解:n (2-4
SO ) = [n (Ba 2+)-n (EDTA)]×250.00/25.00
ω(2-4
SO ) = [(0.05000×25.00-0.02002×29.15)×10-3×10×M (2-
4SO )]/3.000 = 0.2133 8-24 称取硫酸镁样品0.2500 g ,以适当方式溶解后,以0.02115 mol·L -1EDTA 标准溶液滴定,用去24.90 mL ,计算EDTA 溶液对MgSO 4·7H 2O 的滴定度及样品中MgSO 4的质量分数。 解:1324L g 005203.01047.24602155.0)O/EDTA 7H MgSO (--?=??=?T
2536.02500
.04.1201090.2402155.0)MgSO (34=???=-ω
8-25 分析铜、锌、镁合金时,称取试样0.5000 g ,溶解后稀释至250.00 mL 。取25.00 mL 调至pH=6,用PAN 作指示剂,用0.03080 mol·L -1EDTA 溶液滴定,用去30.30 mL 。另取25.00 mL 试液,调至pH=10,加入KCN 掩蔽铜、锌,用同浓度EDTA 滴定,用去3.40 mL ,然后滴加甲醛解蔽剂,再用该EDTA 溶液滴定,用去8.85 mL 。计算试样中铜、锌、镁的质量分数。
解:查表得:)(ZnY lg θ
K =16.50, )(MgY lg θ
K =8.7, )(CuY lg θK =18.80,
pH=6时,]Y(H)[lg α=4.65;
pH=10.0时][Y(H)lg α= 0.45;
由准确滴定的判据可知pH = 6时,可滴定Cu 2+和Zn 2+,消耗EDTA 体积为30.30 mL 。 pH=10.0时,加KCN 掩蔽Cu 2+和Zn 2+,则滴定Mg 2+消耗3.40 mLEDTA 。 甲醛解蔽后,用去EDTA 体积为8.85 mL 为滴定Cu 2+所消耗的量。则有: ω(M) = c (EDTA) ·V (EDTA)×M /G ×(25.00/200.00) ω(Mg) =3.40×0.03080×24.30×10-3/(1/8)×0.5000
= 0.04070 ω(Zn) = 8.85×0.03080×65.39×10-3/(1/8)×0.5000 = 0.2852
ω(Cu 2+) = (30.30-8.85)×0.03080×63.55×10-3/(1/8)×0.5000 = 0.6718
8-26 A 100.0 mL sample of water is titrated with 12.24 mL of the EDTA solution(0.02040
mol·L -1). Calculate the degree of hardness of the water in parts per million of CaCO 3.
解:水的总硬度(ppmCaCO 3)= c (EDTA)·V (EDTA) ·M (CaCO 3)×1000/100 = 0.02040×12.24×100.09×1000/100 = 249.9(mg·L -1)
8-27 A 25.00 mL sample of unknown Fe 3+ and Cu 2+ required 16.06 mL of 0.05083 mol·L -1 EDTA for complete titraition. A 50.00 mL sample of unknown was treated with NH4F to protect the Fe 3+ .Then the Cu 2+ was reduced and masked by addition of thiourea.Upon addition of 25.00 mL of 0.05083 mol·L -1 EDTA ,the Fe 3+ was liberated from is fluoride complex and formed an EDTA complex.The excess EDTA required 19.77mL of 0.01883 mol·L -1 Pb 2+ to reach an endpoint using xylenol orange. Find the concentration of Cu 2+ in the unknown.
解:与Fe 3+反应的EDTA 为(25.00×0.05083-19.77×0.01883)m mol 则Cu 2+的物质的量浓度
00
.25)01883.077.1905083.000.25(00.5000
.2505083.006.16)Cu (2?-??-
?=
+c
=0.01468 mol·L -1
第5章配位滴定法习题答案 1.EDTA与金属离子的配位反应有何特点? 答:广泛,EDTA几乎能与所有的金属离子形成络合物;稳定,一般lg K MY> 15; 络合反应速度快,水溶性好;EDTA与无色的金属离子形成无色的络合物,与有色的金属离子形成颜色更深的络合物;络合比简单,一般为1:1。 2. EDTA与金属离子配合物的稳定常数与条件稳定常数有什么不同?影响条件稳定常数大小的因素有哪些? 答:在无副反应存在的情况下用平衡常数来衡量反应进行的程度,在有副反应存在的情况下用条件平衡常数来衡量反应进行的程度;响条件稳定常数大小的因素有:酸效应、配位效应、干扰离子效应等。 3. 影响配位滴定图月范围大小的因素有哪些?是怎样影响的? 答:(1)lg K′的影响:K′增大10倍,lg K′增加1,滴定突跃增加一个单位。 (2)C M的影响:C M增大10倍,滴定突跃增加一个单位。 4. 为什么大多数的配位滴定需要在一定的缓冲溶液中进行? 答:络合滴定中广泛使用pH缓冲溶液来保持酸度相对稳定,因为:(1)滴定过程中的[H+]变化:M + H2Y = MY + 2H+ (2)K′MY与pH有关; (3)指示剂需在一定的酸度介质中使用 5. 金属指示剂的作用原理是什么?应当具备的主要条件是什么? 答:金属指示剂本身是弱的配位剂,在一定条件下,指示剂与金属离子形成有一定稳定性的配合物,该配合物与指示剂本身具有显著不同的颜色。 6. 指示剂为什么会被封闭?如何消除? 答:指示剂的封闭现象是指某些指示剂能与某些金属离子生成极为稳定的络合物,这些络合物较对应的MY络合物更稳定,以致到达化学计量点时滴入过量的EDTA,也不能夺取指示剂络合物(MIn)中的金属离子,指示剂不能释放出来,看不到颜色的变化,这种现象就叫指示剂的封闭现象。 可能原因:(1)MIn(或共存离子N的NIn)的稳定性大于MY。 (2)终点变色反应的可逆性差。 解决方法:(1)若封闭现象是滴定离子本身M引起的,则可采用返滴定法。例二甲酚橙XO,Al3+对其有封闭现象。可加过量EDTA,采用返滴法测定铝。
配位滴定法课后练习题及参考答案 一、选择题 1.直接与金属离子配位的EDTA型体为() (A)H 6Y2+ (B)H4Y(C)H 2 Y2-(D)Y4- 2.一般情况下,EDTA与金属离子形成的络合物的络合比是() (A)1:1(B)2:1(C)1:3 (D)1:2 3.铝盐药物的测定常用配位滴定法。加入过量EDTA,加热煮沸片刻后,再用标准锌溶液滴定。该滴定方式是()。 (A)直接滴定法(B)置换滴定法 (C)返滴定法(D)间接滴定法 4.αM(L)=1表示() (A)M与L没有副反应(B)M与L的副反应相当严重 (C)M的副反应较小(D)[M]=[L] 5.以下表达式中正确的是() (A) >(B) > (C) > (D) > 6.用EDTA直接滴定有色金属离子M,终点所呈现的颜色是()(A)游离指示剂的颜色(B)EDTA-M络合物的颜色 (C)指示剂-M络合物的颜色(D)上述A+B的混合色 7.配位滴定中,指示剂的封闭现象是由()引起的 (A)指示剂与金属离子生成的络合物不稳定 (B)被测溶液的酸度过高
(C)指示剂与金属离子生成的络合物翁定性小于MY的稳定性 (D)指示剂与金属离子生成的络合物稳定性大于MY的稳定性 8.下列叙述中错误的是() (A)酸效应使络合物的稳定性降低 (B)共存离子使络合物的稳定性降低 (C)配位效应使络合物的稳定性降低 (D)各种副反应均使络合物的稳定性降低 9.用Zn2+标准溶液标定EDTA时,体系中加入六次甲基四胺的目的是()(A)中和过多的酸(B)调节pH值 (C)控制溶液的酸度(D)起掩蔽作用 10.在配位滴定中,直接滴定法的条件包括( ) ≤8 (B)溶液中无干扰离子 (A) > (C)有变色敏锐无封闭作用的指示剂(D)反应在酸性溶液中进行 11.测定水中钙硬时,Mg2+的干扰用的是( )消除的。 (A)控制酸度法(B)配位掩蔽法(C)氧化还原掩蔽法(D)沉淀掩蔽法12.配位滴定中加入缓冲溶液的原因是( ) (A)EDTA配位能力与酸度有关(B)金属指示剂有其使用的酸度范围
《配位化合物与配位滴定法》习题答案 9-1 命名下列配合物,并指出中心离子、配位体、配位原子和中心离子的配位数。 (1)[CoCl 2(H 2O)4]Cl (2)[PtCl 4(en)] (3)[Ni Cl 2(NH 3)2] (4)K 2[Co(SCN)4] (5)Na 2[SiF 6] (6)[Cr(H 2O)2(NH 3)4]2 (SO 4)3 (7)K 3[Fe(C 2O 4)3] (8)(NH 4)3[SbCl 6]·2H 2O 9-2 已知磁矩,根据价键理论指出下列配离子中中心离子的杂化轨道类型和配离子的空间构型。 (1)[Cd(NH 3)4]2+ (μ=0 B M) (2)[PtCl 4]2- (μ=0 B M) (3)[Mn(CN)6]4- (μ=1.73 B M) ( 4 ) [CoF 6]3- (μ=4.9 B M)
(5)[BF 4]- (μ=0 BM) (6)[Ag(CN)2]- (μ=0 B M) 9-3 解释下列名词 (1)配位原子 (2)配离子 (3)配位数 (4)多基(齿)配位体 (5)螯合效应 (6)内轨型和外轨型配合物 (7)高自旋和低自旋配合物 (8)磁矩 答:见教材。 9-4 选择适当试剂,实现下列转化。 Ag →AgNO 3→AgCl ↓→[Ag(NH 3)2]Cl →AgBr ↓→Na 3[Ag(S 2O 3)2]→AgI ↓→K[Ag(CN)2] →Ag 2S ↓ 答:转化路线: ↓?→???→?→?→???→?↓?→????→?↓?→???→?- - - - - ?S Ag ]K[Ag(CN)AgI ])O [Ag(S Na AgBr ]Cl )[Ag(NH AgCl AgNO Ag 22232323NH 32232233 S KCN I O S Br O H Cl HNO 要点:应记忆题给各常见配合物和沉淀物的稳定转化顺序。 9-11 用EDTA 标准溶液滴定金属离子M ,试证明在化学计量点时, (1)() ' 2 1MY pK pMY pM -= (2))(lg 2lg )(lg M c K MY c MY += 证明:
配位滴定法 一填空题 1. 当PH=9时,lga Y(H)=1.29,lgK MgY=8.7,则lg K、MgY=_________ 2 由于______的存在,使配位剂_____参加主反应能力______的 现象称为酸效应,它可用_________定量表述. 3 溶液酸度越大, a Y(H)越_____,[Y]越_____,EDTA的配位能力越_____. 4 以ZnO基准试剂标定EDTA溶液时,一般是以___________缓冲溶液调节溶液PH=10.并以___________为指示剂,滴定至溶液由_____色变成_____色为终点。 5 由于EDTA 与金属离子反应时有______放出,故配位滴定多以___________将溶液的PH控制在一定范围内。 _______ 6 配位反应生成的配合物必须足够稳定,要求K 稳 7 判断干扰情况时,酸效应曲线上被测金属离子M以下的离子____ 测定,被测离子M以上的离子N,在两者浓度相近时,如果__________则N不干扰 M的测定。 8 提高配位滴定选择性的途径主要是___________或_______。 9 指示剂与金属离子形成的配合物的稳定性要适当,如果稳定性太低,就会使终点 _______,如果稳定性太高,终点就会_______,通常要求满足________。 10 指示剂配合物MIn的稳定性应________EDTA配合物MY的稳定性,二者之间应满足__________________。 二选择题 1 水的硬度测定中,正确的测定条件包括() A 总硬度:PH=10,EBT为指示剂 B 钙硬度:PH大于等于12,XO为指示剂 C 钙硬度:调PH之前,可不加盐酸酸化并煮沸 D 水中微量钙离子可加三乙醇胺掩蔽 2 测定Fe3+所用指示剂为() A 六次甲基四胺 B PAN C 磺基水杨酸 D EDTA 15 配位滴定终点所呈现的颜色是() A 游离金属指示剂的颜色 B EDTA与待测金属离子形成配合物的颜色 C 金属指示剂与待测金属离子形成配合物的颜色 D 上述A与C项的混合色 3 通常测定水的硬度所用的方法是() A 控制溶液酸度法 B 氧化还原掩蔽法 C 配位掩蔽法 D 沉淀掩蔽法
滴定分析习题及答案标准化管理部编码-[99968T-6889628-J68568-1689N]
第三章滴定分析 一、选择题 1.滴定分析中,对化学反应的主要要求是(? ? ) (A)反应必须定量完成 (B)反应必须有颜色变化 (C)滴定剂与被测物必须是1:1的计量关系 (D)滴定剂必须是基准物 2.在滴定分析中,一般用指示剂颜色的突变来判断化学计量点的到达,在指示剂变色时停止滴定。这一点称为(? ? ) (A)化学计量点?(B)滴定误差?(C)滴定终点?(D)滴定分析 3.直接法配制标准溶液必须使用(? ? ) (A)基准试剂(B)化学纯试剂(C)分析纯试剂(D)优级纯试剂 4.将称好的基准物倒入湿烧杯,对分析结果产生的影响是(? ? ) (A)正误差? ? ? (B)负误差? (C)无影响(D)结果混乱 5.硼砂(Na2B4O7?10H2O)作为基准物质用于标定盐酸溶液的浓度,若事先将其置于干燥器中保存,则对所标定盐酸溶液浓度的结果影响是(? ? ) (A)偏高? ? ? ? ? (B)偏低? ? ? ? (C)无影响? ? ? (D)不能确定 6.滴定管可估读到±,若要求滴定的相对误差小于%,至少应耗用体积(? ? )mL (A) 10? ? ? ? ? (B) 20? ? (C) 30? ? ?(D) 40
(A) ? (B) ? (C) ? ? ? (D) 8.欲配制1000mL L HCl溶液,应取浓盐酸(12mol/L HCl) (? ? )mL。 (A) ? ? (B)? ? (C);? ? (D)12mL 9.既可用来标定NaOH溶液,也可用作标定KMnO4的物质为(? ? ) (A)H2C2O4?2H2O?(B) Na2C2O4? ? ? (C)HCl? ? ? (D)H2SO4 10.以甲基橙为指示剂标定含有Na2CO3 的NaOH标准溶液,用该标准溶液滴定某酸以酚酞为指示剂,则测定结果(? ? ) (A)偏高? ? ? (B)偏低? ? ? ? (C)不变? ? ? ? (D)无法确定 二、填空题 1.滴定分析法包括(? ? ? ? ? )、(? ? ? ? ? )、(? ? ? ? ? )和(? ? ? ? )四大类。 2.欲配制 mol?L的NaOH溶液500 mL,应称取(? ? ? ? )固体。 3.称取纯金属锌 g,溶于HCl后,稀释定容到250 mL的容量瓶中,则Zn2+ 溶液的物质的量浓度为(? ? ? ? )。 4.称取 H2C2O4?2H2O来标定NaOH溶液,消耗,则cNaOH=(? ? ? ? )。HCl=mL表示每(? ? ? ? )相当于(? ? ? ? ? )。 6.进行滴定分析计算时,如果选取分子、离子或这些粒子的某种特定组合作为反应物的基本单元,这时滴定分析结果计算的依据为: (? ? ? ? ? ? ? ? ? ? ? ? ? ? )。 三、判断题 1.(? )所谓化学计量点和滴定终点是一回事。
第八章配位平衡与配位滴定法 一、选择题 1. 关于配合物,下列说法错误的是() A. 配体是一种可以给出孤对电子或π键电子的离子或分子 B .配位数是指直接同中心离子相结合的配体总数 C. 广义地讲,所有金属离子都可能生成配合物 D. 配离子既可以存在于晶体中,也可以存在于溶液中 2. 关于外轨型与内轨型配合物的区别,下列说法不正确的是() A. 外轨型配合物中配位原子的电负性比内轨型配合物中配位原子的电负性大 B. 中心离子轨道杂化方式在外轨型配合物是ns、np、nd轨道杂化,内轨型配合物是(n-1)d、ns、np轨道杂化 C. 一般外轨型配合物比内轨型配合物键能小 D. 通常外轨型配合物比内轨型配合物磁矩小 3. 当下列配离子浓度及配体浓度均相等时,体系中Zn2+离浓度最小的是() A.Zn(NH3)42+ B. Zn(en)22+ C. Zn(CN)42- D. Zn(OH)42- 4. Fe(Ⅲ)形成配位数为6的外轨型配合物中,Fe3+离子接受孤对电子的空轨道是() A. d2sp3 B. sp3d2 C. p3d3 D. sd5 5.下列配离子能在强酸性介质中稳定存在的是() A.Ag(S2O3)23-B.Ni(NH3)42+C.Fe(C2O4)33-D.HgCl42- 6. 测得Co(NH3)63+的磁矩μ=0B.M,可知Co3+离子采取的杂化类型为( ) A.d2sp3 B.sp3d2 C.sp3 D. dsp2 7.下列物质具有顺磁性的是() A.Ag(NH3) +B.Fe(CN)64-C.Cu(NH3)42+D.Zn(CN)42- 8.下列物质中,能作为螯合剂的为( ) A. HO-OH B. H2N-NH2 C. (CH3)2N-NH2 D. H2N-CH2-CH2-NH2 9. 在[RhBr2(NH3)4]+中,Rh的氧化数和配位数分别是() A.+2和4 B.+3和6 C. +2和6 D. +3和4 10.Cu(en)22+的稳定性比Cu(NH3)42+大得多,主要原因是前者() A. 配体比后者大 B.具有螯合效应
第六章配位滴定法 计算pH=5时EDTA的酸效应系数αY(H)。若此时EDTA各种存在形式的总浓度为·L-1,则[Y4-]为多少 pH=5时,锌和EDTA配合物的条件稳定常数是多少假设Zn2+和EDTA的浓度皆为10-2 mol·L-1(不考虑羟基配位等副反应)。pH=5时,能否用EDTA标准溶液滴定Zn2+ 假设Mg2+和EDTA的浓度皆为10-2 mol·L-1,在pH=6时,镁与EDTA配合物的条件稳定常数是多少(不考虑羟基配位等副反应)并说明在此pH条件下能否用EDTA 标准溶液滴定Mg2+。如不能滴定,求其允许的最小pH。
试求以EDTA滴定浓度各为mol·L-1的Fe3+和Fe2+溶液时所允许的最小pH。 计算用mol·L-1 EDTA标准溶液滴定同浓度的Cu2+离子溶液时的适宜酸度范围。 称取0.1005g纯CaCO3溶解后,用容量瓶配成100mL溶液。吸取25mL,在pH﹥12时,用钙指示剂指示终点,用EDTA标准溶液滴定,用去。试计算: (1)EDTA溶液的浓度; (2)每毫升EDTA溶液相当于多少克ZnO和Fe2O3。
用配位滴定法测定氯化锌(ZnCl2)的含量。称取0.2500g试样,溶于水后,稀释至250mL,吸取,在pH=5~6时,用二甲酚橙作指示剂,用mol·L-1 EDTA标准溶液滴定,用去。试计算试样中含ZnCl2的质量分数。 称取1.032g氧化铝试样,溶解后移入250mL容量瓶,稀释至刻度。吸取,加入T Al2O3=mL的EDTA标准溶液,以二甲酚橙为指示剂,用Zn(OAc)2标准溶液进行返滴定,至红紫色终点,消耗Zn(OAc)2标准溶液。已知1mL Zn(OAc)2溶液相当于EDTA溶液。求试样中Al2O3的质量分数。
第九章 配位反应及配位滴定法 配位化合物简称配合物,是一类组成比较复杂的化合物,它的存在和应用都很广泛。生物体的金属元素多以配合物的形式存在。例如叶绿素是镁的配合物,植物的光合作用靠它来完成。又如动物血液中的血红蛋白是铁的配合物,在血液中起着输送氧气的作用;动物体的各种酶几乎都是以金属配合物形式存在的。当今配合物广泛地渗透到分析化学、生物化学等领域。我国著名科学家光宪教授作了如下的比喻:把21世纪的化学比作一个人,那么物理化学、理论化学和计算化学是脑袋,分析化学是耳目,配位化学是心腹,无机化学是左手,有机化学和高分子化学是右手,材料科学是左腿,生命科学是右腿,通过这两条腿使化学科学坚实地站在目标的地坪上。配位化学是目前化学学科中最为活跃的研究领域之一。本章将介绍配合物的基本概念、结构、性质和在定量分析化学中的应用。 §9-1 配合物的组成与定义 一、配合物及其组成 例如在硫酸铜溶液中加入氨水,开始时有蓝色Cu 2(OH)2SO 4沉淀生成,当继续加氨水过量时,蓝色沉淀溶解变成深蓝色溶液。总反应为: CuSO 4 + 4NH 3 = [Cu(NH 3)4]SO 4 (深蓝色) 此时在溶液中,除SO 42-和[Cu(NH 3)4]2+外,几乎检查不出Cu 2+的存在。再如,在HgCl 2溶液 中加入KI ,开始形成桔黄色HgI 2沉淀,继续加KI 过量时,沉淀消失,变成无色的溶液。 HgCl 2 + 2KI = HgI 2↓+ 2KCl HgI 2 + 2KI = K 2[HgI 4] 象[Cu(NH 3)4]SO 4和K 2[HgI 4]这类较复杂的化合物就是配合物。配合物的定义可归纳为:由一个中心元素(离子或原子)和几个配体(阴离子或分子)以配位键相结合形成复杂离子(或分子),通常称这种复杂离子为配离子。由配离子组成的化合物叫配合物。在实际工作中一般把配离子也称配合物。由中心离子和配体以配位键结合成的分子,如[Ni(CO)4]、 [Co(NH 3)3Cl 3]也叫配合物。 在[Cu(NH 3)4]SO 4中,Cu 2+占据中心位置,称中心离子(或形成体);中心离子Cu 2+的围, 以配位键结合着4个NH 3分子,称为配体;中心离子与配体构成配合物的界(配离子),通常 把界写在括号;SO 42-被称为外界,界与外界之间是离子键,在水中全部离解。 [Cu (NH 3)4] SO 4 K 3[Fe(CN)6] ↑↑↑↑↑↑↑↑中心离子 中心离子配体配体配位数配位数外界内界 外界内界配合物 配合物 1.中心离子 配合物的核心,它一般是阳离子,也有电中性原子,如[Ni(CO)4]中的Ni 原子。中心离子绝大多数为金属离子特别是过渡金属离子。
第五章配位滴定法习题答案 练习题答案 1. __________________________________________________ EDTA与金属离子形成螯合物时,其螯合比一般为______________________________ 。(1:1) 2. ___________________________________________________ EDTA与金属离子 络合时,一分子的 EDTA可提供 ______________________________ 配位原子。(6) 3. 在非缓冲溶液中,用EDTA滴定金属离子时溶液的pH值将降低 4. ______________________________________________________________ 当M 与丫反应时,溶液中有另一络合剂L存在,若口M(L)=1表示 _________________ o (M 与L没有副反应) 5. 两种金属离子M和N共存时,只有稳定常数的差值满足△ Igk》5时才可用控制酸度的方法进行分别滴定 6. 以下表达式中正确的是:(B) A K MY ' =C Y/C M C Y B K MY ' =[MY' ]/([M]+ [ML i])( [Y]+、[H i Y]) C K MY ' =[MY' ]/([MY]+ [ML i])( [Y]+、[H i Y]) D K MY ' =[MY]/([M]+ ' [ML i])( [Y]+ x [H i Y]+[MY]) 7. 在 pH = 10.0 的氨性溶液中,已计算出:Zn(NH3) = 104'7,: Zn(OH) = 102'4,-Y(H)=10°5, 已知 lgK znY=16.5;在此条件下,IgK znY'为_____________ 。(11.3) 8. 络合滴定中,若封闭现象是由被测离子引起的,则可米用回滴定法进行 9. 络合滴定法直接滴定Zn2+,铬黑T In-作指示剂,其滴定终点所呈现的颜色实际上是: (D) A. ZnIn的颜色 B. In-的颜色 C. ZnY的颜色 D. ZnIn和In-的颜色 10. 在EDTA法中,当MIn溶解度较小时,会产生( B ) A 封闭现象B僵化现象C掩蔽现象 D 络合效应和酸效应 11. 当K MIn>K MY时,易产生(A ) A 封闭现象B僵化现象C掩蔽现象 D 络合效应和酸效 12. 下列指示剂中,全部适用于络合滴定的一组是:(C) A 甲基橙、二苯胺磺酸钠、EBT B 酚酞、钙指示剂、淀粉 C 二甲酚橙、铬黑T、钙指示剂 D PAN、甲基红、铬酸钾
第六章 配位滴定法 思考题与习题 1.简答题: (1)何谓配位滴定法?配位滴定法对滴定反应有何要求? 答:以配位反应为基础的地点分析方法称为配位滴定法。配位滴定法要求配位反应按一定的反应式定量进行,且能进行完全;反应必须迅速;可以用适当的方法确定终点。 (2)EDTA 与其金属离子配合物的特点是什么? 答:E DT A具有广泛的配位性能;EDTA 与金属离子配位时可生成的螯合物稳定性高,配位反应的完全程度高;E DTA 与金属离子形成配位化合物的配位比几乎均为1:1;ED TA 与金属离子形成的配合物大多能溶于水;配位反应迅速;EDTA 与无色离子形成的配合物也无色,便于用指示剂确定终点。 (3)配位滴定可行性的判断条件是什么? 答:MY M K c lg ≥6 (4)配位滴定中可能发生的副反应有哪些?从理论上看,哪些对滴定分析有利? 答:配位滴定副反应包括:EDTA 的酸效应,金属离子的水解效应,金属离子与其他配位剂的配位反应,干扰离子效应,配合物与氢离子、氢氧根离子的副反应等。配合物与氢离子、氢氧根离子的副反应对滴定分析有利。 (5)何谓指示剂的封闭现象?怎样消除封闭? 答:如果指示剂与某些金属离子形成的配位化合物极其稳定,以至于加入过量的滴定剂也不能将金属离子从金属-指示剂配合物中夺取出来,溶液在化学计量点附近就没有颜色变化,这种现象称为指示剂受到了封闭。可加掩蔽剂消除指示剂的封闭现象。 (6)提高配位滴定选择性的条件与措施有哪些? 答:1)控制酸度;2)分别采用配位掩蔽法、沉淀掩蔽法、氧化还原掩蔽法掩蔽干扰离子;3)分离干扰离子。 2.名词解释 (1)酸效应
配位平衡和配位滴定法自测题 一.填空题 1. 钴离子Co3+和4个氨分子、2个氯离子生成配离子,它的氯化盐的分子式为_______________ , 叫做 ____________ 。 2. 溴化一氯三氨二水合钴(山)的内界为______________ ,外界为_____________ 。 3. 四氯合铂(II)酸四氨合铜(II)的化学式为______________ 。 4. 在[RhBr 2(NH3)2]+中,Rh的氧化态为______________ ,配位数为______________ 。 5. K[CrCI 4(NH3)2]的名称是__________ ,Cr的氧化数是 __________ ,配位数是 __________ < 6. 配离子[PtCI(NO 2)(NH 3)4]2+中,中心离子的氧化数为_____________ ,配位数为 _________ 该化合物的名称为 _________________ 。 7. 螯合物是由 __________ 和__________ 配位而成的具有环状结构的化合物。 8. 在[Ag(NH 3)2]NO3溶液中,存在下列平衡:Ag+ + 2NH 3 = [Ag(NH 3)2]+。(1)若向溶液中力口 入HCI,则平衡向 _______ 移动;(2)若向溶液中加入氨水,则平衡向____________ 移动。 9. [PtCI(NO 2)(NH3)4]CO3名称为_________________ ,中心离子的氧化数为_______ ,配离子 的电荷数为 ________ 。 10. KCN为剧毒,而K4[Fe(CN)6]无毒,这是因为__________________________ 。 11. 金属离子M溶液的pH值增大时,副反应系数Y(H) _________________ ,M(OH) ________________ , 条件稳定常数K MY,的变化趋势是 _________________ 。 12. 配位滴定中,若金属离子的原始浓度为0.01 mol/L,且以目视观察指示剂颜色变化的方 式确定终点,只有当 _____________ ,才能进行准确滴定(误差小于0.1%)。 13. 由于EDTA分子中含有___________ 和 _______ 两种配位能力很强的配位原子,所以它能 和许多金属离子形成稳定的_________________ 。 14. 配位滴定所用的滴定剂本身是弱酸或弱碱,容易给出或接受质子,因此试液的酸度引起 滴定剂的副反应是严重的。这种由于__________ 离子的存在,而使配体参与 ______ 反应能力降低的现象被称为酸效应。 15. EDTA酸效应曲线图中,金属离子位置所对应的pH值,就是滴定这种金属离子所允许 的 ________________ 。 16. 配位滴定的直接滴定过程中,终点时试液所呈现的颜色是________________________ 的颜色。 17. 在酸性及弱碱性条件下,EDTA与金属离子形成配合物的过程中,因有 ____________ 放出, 应加 ______________ 控制溶液的酸度。
第八章 配位平衡与配位滴定法 §8-1 配合物 教学目的及要求:1.掌握配合物及其组成。 2.掌握配合物命名。 教学重点:配合物命名。 教学难点:配合物命名。 一、配合物及其组成 1.中心离子 中心离子绝大多数为金属离子特别是过渡金属离子。 2.配体和配位原子 配合物中同中心离子直接结合的阴离子或中性分子叫配体,配体中具有孤电子对并与中心离子形成配位键的原子称为配位原子(单基(齿)配体,多基(齿)配体) 3.配位数 配合物中直接同中心离子形成配位键的配位原子的总数目称为该中心离子的配位数 配位数=配位体数×齿数 4.配离子的电荷数 配离子的电荷等于中心离子和配体电荷的代数和。 [Cu (NH 3)4] SO 4 K 3[Fe(CN)6] ↑↑↑↑↑↑↑↑中心离子中心离子配体配体配位数配位数外界 内界外界内界 配合物 配合物 二、配合物的命名
配离子按下列顺序依次命名:阴离子配体→中性分子配体→“合”→中心离子(用罗马数字标明氧化数)。氧化数无变化的中心离子可不注明氧化数。若有几种阴离子配体,命名顺序是:简单离子→复杂离子→有机酸根离子;若有几种中性分子配体,命名顺序是:NH 3→H 2O →有机分子。各配体的个数用数字一、二、三……写在该种配体名称的前面。 对整个配合物的命名与一般无机化合物的命名相同,称为某化某、某酸某和某某酸等。由于配离子的组成较复杂,有其特定的命名原则,搞清楚配离子的名称后,再按一般无机酸、碱和盐的命名方法写出配合物的名称。 举例:K 4[Fe(CN)6] 六氰合铁(Ⅱ)酸钾 H[AuCl 4] 四氯合金(Ⅲ)酸 [CoCl 2(NH 3)3(H 2O)]Cl 氯化二氯三氨一水合钴(Ⅲ) [PtCl(NO 2)(NH 3)4]CO 3 碳酸一氯一硝基四氨合铂(Ⅳ) [Ni(CO)4] 四羰基合镍 §8-2 配离子的配位离解平衡教学目的及要求: 1.理解配位平衡常数。 2.掌握配位平衡的移动。 教学重点: 1. 配位平衡常数的计算。 2. 配位平衡的移动。 教学难点:配位平衡常数的计算。 一、配离子的稳定常数 配位 Cu 2+ + 4NH 3 ? [Cu(NH 3)4]2+ 离解 4 NH Cu ])[Cu(NH f )()/(32243ΘΘΘΘ c /c c c c /c K ?= ++ 简写为:4 NH Cu ] )[Cu(NH f )(32243c c c K ?= ++
滴定分析 姓名:分数: 一、选择题 1.滴定分析中,对化学反应的主要要求是( ) (A)反应必须定量完成 (B)反应必须有颜色变化 (C)滴定剂与被测物必须是1:1的计量关系 (D)滴定剂必须是基准物 2.在滴定分析中,一般用指示剂颜色的突变来判断化学计量点的到达,在指示剂变色时停止滴定。这一点称为() (A)化学计量点(B)滴定误差(C)滴定终点(D)滴定分析3.直接法配制标准溶液必须使用() (A)基准试剂(B)化学纯试剂(C)分析纯试剂(D)优级纯试剂4.将称好的基准物倒入湿烧杯,对分析结果产生的影响是()(A)正误差(B)负误差(C)无影响(D)结果混乱5.硼砂(Na2B4O7?10H2O)作为基准物质用于标定盐酸溶液的浓度,若事先将其置于干燥器中保存,则对所标定盐酸溶液浓度的结果影响是( ) (A)偏高(B)偏低(C)无影响(D)不能确定6.滴定管可估读到±0.01mL,若要求滴定的相对误差小于0.1%,至少应耗用体积()mL (A) 10 (B) 20 (C) 30 (D) 40 7.0.2000 mol/LNaOH溶液对H2SO4的滴定度为()g?mL-1 (A) 0.00049 (B) 0.0049 (C) 0.00098 (D)0.0098 8.欲配制1000mL 0.1mol/L HCl溶液,应取浓盐酸(12mol/L HCl) ()mL。 (A) 0.84mL (B)8.4mL (C)1.2mL;(D)12mL 9.既可用来标定NaOH溶液,也可用作标定KMnO4的物质为( ) (A)H2C2O4?2H2O(B) Na2C2O4 (C)HCl (D)H2SO4 10.以甲基橙为指示剂标定含有Na2CO3 的NaOH标准溶液,用该标准溶液滴定某酸以酚酞为指示剂,则测定结果() (A)偏高(B)偏低(C)不变(D)无法确定
实验二水总硬度的测定(配位滴定法) 实验日期: 实验目的: 1、学习EDTA标准溶液的配制方法及滴定终点的判断; 2、掌握钙、镁测定的原理、方法和计算。 一、水硬度的表示法: 一般所说的水硬度就是指水中钙、镁离子的含量。最常用的表示水硬度的单位有:1、以度表示,1o=10 ppm CaO,相当10万份水中含1份CaO。 2、以水中CaCO3的浓度(ppm)计相当于每升水中含有CaCO3多少毫克。 M CaO—氧化钙的摩尔质量(56.08 g/mol), M CaCO3—碳酸钙的摩尔质量(100.09 g/mol)。 二、测定原理: 测定水的总硬度,一般采用配位滴定法即在pH=10的氨性溶液中,以铬黑T作为指示剂,用EDTA标准溶液直接滴定水中的Ca2+、Mg2+,直至溶液由紫红色经紫蓝色转变为蓝色,即为终点。反应如下: 滴定前:EBT +Me(Ca2+、Mg2+)=Me-EBT (蓝色) pH=10 (紫红色) 滴定开始至化学计量点前:H2Y2- + Ca2+= CaY2- + 2H+ H2Y2- + Mg2+= MgY2- + 2H+ 计量点时:H2Y2- + Mg-EBT = MgY2- + EBT +2H+ (紫蓝色)(蓝色) 滴定时,Fe3+、Al3+等干扰离子用三乙醇胺掩蔽,Cu2+、Pb2+、Zn2+等重金属离子可用KCN、Na2S 或巯基乙酸掩蔽。 三、主要试剂 1、0.02mol/LEDTA 2、NH3-NH4Cl缓冲溶液 3、铬黑T:0.5% 4、三乙醇胺(1:2) 5、Na2S溶液 2% 6、HCl溶液 1:1 7、CaCO3固体A.R. 四、测定过程 1、EDTA溶液的标定 准确称取在120度烘干的碳酸钙0.5~ 0. 55g 一份,置于250ml 的烧杯中,用少量蒸馏水润湿,盖上表面皿,缓慢加1:1HCl 10ml,加热溶解定量地转入250ml容量瓶中,定容后摇匀。吸取25ml,注入锥形瓶中,加20ml NH3-NH4Cl缓冲溶液,铬黑T指示剂2~3滴,用欲标定的EDTA溶液滴定到由紫红色变为纯蓝色即为终点,计算EDTA溶液的准确浓度。 2、水样测定
第五章 配位滴定法 习题答案 1计算pH=时EDTA 的酸效应系数αY(H)。若此时EDTA 各种存在形式的总浓度为·L -1,则[Y 4-]为多少 解:(1)EDTA 的61~K K :,,,,, 61~ββ:,,,,, pH=时: ()66554433221H Y ]H []H []H []H []H []H [1ββββββ++++++++++++=α =1++++++ = — (2)[Y 4-] = 45.610020.0=×10-9(mol·L -1) 2. pH=时,锌和EDTA 配合物的条件稳定常数是多少假设Zn 2+和EDTA 的浓度皆为10-2 mol·L -1(不考虑羟基配位等副反应)。pH = 时,能否用EDTA 标准溶液滴定Zn 2+ 解: 查表5-2: 当pH = 时,lg αY(H) = ,Zn 2+与EDTA 浓度皆为10-2 mol·L -1, lg K ’= lg K 稳-lg αY(H) =- = >8,可以准确滴定。 3. 假设Mg 2+和EDTA 的浓度皆为10-2 mol·L -1,在pH= 时,镁与EDTA 配合物的条件稳定常数是多少(不考虑羟基配位等副反应)并说明在此pH 条件下能否用EDTA 标准溶液滴定Mg 2+。如不能滴定,求其允许的最小pH 。 解:(1)查表5-2: 当pH = 时,lg αY(H) = ,lg K ’= lg K 稳-lg αY(H) = - = ,lg K ’<8, ∴不能准确滴定 (2)lg αY(H) = lg K 稳-8 = ,查表5-2或114页林邦曲线得pH ≈ 。 ! 4.试求以EDTA 滴定浓度各为 mol·L -1的Fe 3+和Fe 2+溶液时所允许的最小pH 。 解:(1)Fe 3+:lg αY(H) = lg K 稳-8 =-8 = ,查表5-2或114页林邦曲线得pH ≈ (2)Fe 2+:lg αY(H) = lg K 稳-8 =-8 = ,查表5-2或114页林邦曲线得pH ≈ 5.计算用 mol·L -1 EDTA 标准溶液滴定同浓度的Cu 2+离子溶液时的适宜酸度范围。 解:(1)lg αY(H) = lg cK 稳-6 = lg ×-6 =,查表5-2得pH ≈ (2)[OH -] =]Cu [2+sp K =0200.0102.220-?=×10-9, pOH= pH = ,∴ pH 范围:~ 6.称取0.1005g 纯CaCO 3溶解后,用容量瓶配成溶液。吸取,在pH >12时,用钙指示剂指示终点,用EDTA 标准溶液滴定,用去。试计算: · (1)EDTA 溶液的浓度;
第七章配位滴定法练习题 一、选择题 1、某溶液主要含有Ca2+、Mg2+及少量Fe3+、Al3+,今在pH=10的加入三乙醇胺,以EDTA滴定,用铬黑T为指示剂,则测出的是() A、Mg2+量 B、Ca2+量 C、Ca2+、Mg2+总量 D、Ca2+、Mg2+、Fe3+、Al3+总量 2、准确滴定单一金属离子的条件是() A、lgc M K′MY≥8 B、lgc M K MY≥8 C、lgc M K′MY≥6 D、lgc M K MY≥6 3、在配位滴定中,直接滴定法的条件包括() A、lgcK'MY≤ 8 B、溶液中无干扰离子 C、有变色敏锐无封闭作用的指示剂 D、反应在酸性溶液中进行 4、EDTA 滴定 Zn2+时,加入 NH3-NH4Cl可() A、防止干扰 B、控制溶液的pH值 C、使金属离子指示剂变色更敏锐 D、加大反应速度 5、取水样100mL,用C(EDTA)=0.02000mol/L,标准溶液测定水的总硬度,用去4.00毫升,计算水的总硬度是( )(用CaCO3 mg/L表示) A、20mg/L B、40 mg/L C、60 mg/L D、80mg/L 6、配位滴定终点所呈现的颜色是() A、游离金属指示剂的颜色 B、EDTA与待测金属离子形成配合物的颜色 C、金属指示剂与待测金属离子形成配合物的颜色 D、上述A与C的混合色 7、在EDTA配位滴定中,下列有关酸效应系数的叙述,正确的是() A、酸效应系数越大,配合物的稳定性愈大 B、酸效应系数越小,配合物的稳定性愈大 C、 pH值愈大,酸效应系数愈大 D、酸效应系数愈大,配位滴定曲线的pM突跃范围愈大 8、以配位滴定法测定Pb2+时,消除Ca2+、Mg2+干扰最简便的方法是() A、配位掩蔽法 B、控制酸度法 C、沉淀分离法 D、解蔽法 9、 EDTA的有效浓度[Y]与酸度有关,它随着溶液pH值增大而() A、增大 B、减小 C、不变 D、先增大后减小 10、 EDTA法测定水的总硬度是在pH=( )的缓冲溶液中进行,钙硬度是在pH=( )的缓冲溶液中进行。 A、4-5 B、6-7 C、8-10 D、12-13 11、用EDTA测定SO42-时,应采用的方法是() A、直接滴定 B、间接滴定 C、返滴定 D、连续滴定
第六章配位滴定法 5.1计算pH=5时EDTA的酸效应系数αY(H)。若此时EDTA各种存在形式的总浓度为0.0200mol·L-1,则[Y4-]为多少? 5.2 pH=5时,锌和EDTA配合物的条件稳定常数是多少?假设Zn2+和EDTA的浓度皆为10-2 mol·L-1(不考虑羟基配位等副反应)。pH=5时,能否用EDTA标准溶液滴定Zn2+? 5.3假设Mg2+和EDTA的浓度皆为10-2 mol·L-1,在pH=6时,镁与EDTA配合物的条件稳定常数是多少(不考虑羟基配位等副反应)?并说明在此pH条件下能否用EDTA标准溶液滴定Mg2+。如不能滴定,求其允许的最小pH。
5.4试求以EDTA滴定浓度各为0.01mol·L-1的Fe3+和Fe2+溶液时所允许的最小pH。 5.5计算用0.0200mol·L-1 EDTA标准溶液滴定同浓度的Cu2+离子溶液时的适宜酸度范围。 5.6称取0.1005g纯CaCO3溶解后,用容量瓶配成100mL溶液。吸取25mL,在pH﹥12时,用钙指示剂指示终点,用EDTA标准溶液滴定,用去24.90mL。试计算: (1)EDTA溶液的浓度; (2)每毫升EDTA溶液相当于多少克ZnO和Fe2O3。
5.7用配位滴定法测定氯化锌(ZnCl2)的含量。称取0.2500g试样,溶于水后,稀释至250mL,吸取25.00mL,在pH=5~6时,用二甲酚橙作指示剂,用0.01024 mol·L-1 EDTA标准溶液滴定,用去17.61mL。试计算试样中含ZnCl2的质量分数。 5.8称取1.032g氧化铝试样,溶解后移入250mL容量瓶,稀释至刻度。吸取25.00mL,加入T Al2O3=1.505mg/mL的EDTA标准溶液10.00mL,以二甲酚橙为指示剂,用Zn(OAc)2标准溶液进行返滴定,至红紫色终点,消耗Zn(OAc)2标准溶液12.20mL。已知1mL Zn(OAc)2溶液相当于0.6812mL EDTA溶液。求试样中Al2O3的质量分数。
实验二 水总硬度的测定 (配位滴定法 ) 实验日期: 实验目的: 1、 学习EDTA 标准溶液的配制方法及滴定终点的判断; 2、 掌握钙、镁测定的原理、方法和计算。 一、水硬度的表示法: 一般所说的水硬度就是指水中钙、镁离子的含量。最常用的表示水硬度的单位有: 1、 以度表示,1 10 PPm CaO ,相当10万份水中含1份 CaQ 2、 以水中CaCO 的浓度(PPm )计相当于每升水中含有 CaCQ 多少毫克。 M a 。一氧化钙的摩尔质量(56.08 g∕mol ), M CaCO3—碳酸钙的摩尔质量(100?09 g/mol )。 、测定原理: 测定水的总硬度,一般采用配位滴定法即在 PH = 10的氨性溶液中,以铬黑T 作为指示剂, 用EDTA 标准溶液直接滴定水中的 Ca 2+、Mg +,直至溶液由紫红色经紫蓝色转变为蓝色, 即为终 点。反应如下: 蓝色) PH=10 (紫红色) 滴定开始至化学计量点前: H 2Y 2- + Ca 2+ 1、0.02mol/LEDTA 2、NH-NfCI 缓冲溶液 3、铬黑T :0.5 % 4、三乙醇胺(1:2 ) 5、NaS 溶液2 % 6 、He 溶液1:1 7、CaCQ 固体 A . R . 四、测定过程 1、EDTA 溶液的标定 准确称取在120度烘干的碳酸钙0.5?0. 55g 一份, 置于250ml 的烧杯中,用少量蒸 馏水润湿,盖上表面皿,缓慢加1:1 HCl 10ml,加热溶解定量地转入 250ml 容量瓶中,定容 后摇匀。吸取25ml ,注入锥形瓶中,加20ml NM- NHCI 缓冲溶液, 铬黑T 指示剂2?3滴, 用欲标定的EDTA 溶液滴定到由紫红色变为纯蓝色即为终点,计算 EDTA 溶液的准确浓度。 2、水样测定 滴定前:EBT + M e (Ca +、Mgj M e — EBT 2- CaY 2- + 2H 2+ + Mg MgY 2- + 2H 2- 计量点时: H 2Y 2- + Mg-EBT 2- + = MgY 2- + EBT +2H + (紫蓝色) 滴定时 ,Fe 3+、 A l 3+等干扰离子用三乙醇胺掩蔽 或巯基乙酸掩蔽。 三、主要试剂 (蓝色) ,Cu 2+、Pb 2+、Zn 2+等重金属离子可用 KCN NaS
第九章配位化合物与配位滴定法章节测试题一、选择题(每题1.5分30分) 1.[Co(en)(C2O4)]2-中心离子的配位数是。 A. 3 B. 4 C. 5 D. 6 2.下列配合物命名不正确的是。 A [Co(ONO)(NH3)5]SO4硫酸一亚硝酸·五氨根合钴(III) B [Co(NH3)5H2O]Cl3三氯化一水·五氨合钴(Ⅲ) C [PtCl(NO2)(NH3)4]CO3碳酸一硝基·一氯·四氨合铂(IV) D [CrBr2(H2O)4]Br?2H2O 二水合溴化二溴·四水合铬(III)3.下列物质是顺磁的为。 A. [Zn (NH3)4]2+ B. [Co (NH3)6]3+ C. [TiF4] - D. [Cr (NH3)6]3+ 4.[Fe(CO)5]的磁矩为零。它的空间构型为。 A. 三角锥形 B. 四方形 C. 三角双锥形 D. 四方锥形5.对于配合物[Cu(NH3)4][PtCl4],下列说法正确的是。 A. 前面部分是外界 B. 后面部分是外界 C. 两部分都是配离子 D. 两部分都是外界 6.价键理论的解释正确的是。 A. 不是所有的中心原子都能生成内轨型配合物 B. 不是所有的中心原子都能生成外轨型配合物 C. 中心离子用于形成配位键的轨道是杂化轨道 D. 正电荷高的中心离子形成的配合物都是杂化轨道 7.K3[FeF6]的磁矩比K3[Fe(CN)6]大,可以解释为。 A. 中心离子的氧化数不同 B. F-对中心离子的影响更大 C. 配位原子的电负性不同 D. CN-是弱的电子接受体 8.根据晶体场理论,判断高自旋配合物的判据为。 A. 分裂能大于成对能 B. 电离能大于成对能