
酶动力学综合实验
实验(一)——碱性磷酸酶Km值的测定
【目的要求】
1.了解底物浓度对酶促反应速度的影响
2.了解米氏方程、Km值的物理意义及双倒数作图求Km值的方法。
【实验原理】
1、碱性磷酸酶:
碱性磷酸酶是广泛分布于人体各脏器器官中,其中以肝脏为最多。其次为肾脏、骨骼、肠和胎盘等组织。但它不是单一的酶,而是一组同功酶。本实验用的碱性磷酸酶是从大肠杆菌中提取的。
2、米氏方程:
Michaelis-Menten 在研究底物浓度与酶促反应速度的定量关系时,导出了酶促反应动力学的基本公式,即:
错误!未找到引用源。(1) 式中:v表示酶促反应速度,
错误!未找到引用源。表示酶促反应最大速度,
[S]表示底物浓度,
错误!未找到引用源。表示米氏常数。
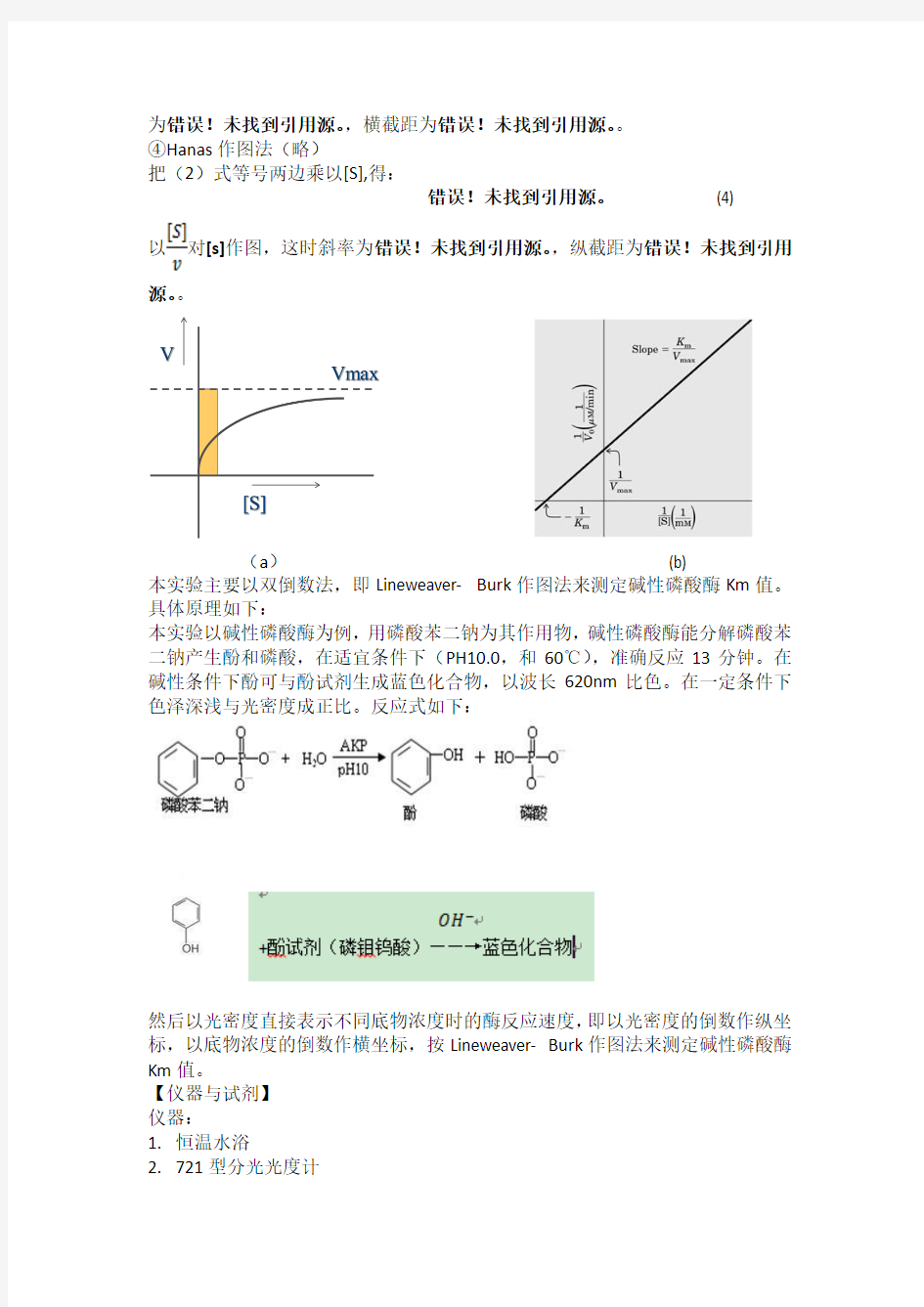
3、错误!未找到引用源。值的测定主要采用图解法,有以下四种:
①双曲线作图法(图1-1,a)
根据公式(1),以v对[s]作图,此时1/2错误!未找到引用源。时的底物浓度[s]值即为Km值,以克分子浓度(M)表示。这种方法实际上很少采用,因为在实验条件下的底物浓度很难使酶达到饱和。实测错误!未找到引用源。一个近似值,因而1/2错误!未找到引用源。不精确。此外由于v对[S]的关系呈双曲线,实验数据要求较多,且不易绘制。
②Lineweaver- Burk作图法双倒数作图法(图1-1,b)
实际工作中,常将米氏方程(式(1))作数学变换,使之成为直线形式,测定要方便、精确得多。其中之一即取(1)式的倒数,变换为Lineweaver- Burk方程式:错误!未找到引用源。(2)
以错误!未找到引用源。对错误!未找到引用源。作图,即为y=ax+b形式。此时斜率为错误!未找到引用源。,纵截距为错误!未找到引用源。。把直线外推与横轴相交,其截距相交,其截距即为—错误!未找到引用源。。
③Hofstee作图法(略)
把(2)式等号两边乘以错误!未找到引用源。,得:
错误!未找到引用源。(3)
以v对错误!未找到引用源。作图,这时斜率为错误!未找到引用源。,纵截距
为错误!未找到引用源。,横截距为错误!未找到引用源。。
④Hanas作图法(略)
把(2)式等号两边乘以[S],得:
错误!未找到引用源。(4)
以对[s]作图,这时斜率为错误!未找到引用源。,纵截距为错误!未找到引用源。。
(a)(b)
本实验主要以双倒数法,即Lineweaver- Burk作图法来测定碱性磷酸酶Km值。具体原理如下:
本实验以碱性磷酸酶为例,用磷酸苯二钠为其作用物,碱性磷酸酶能分解磷酸苯二钠产生酚和磷酸,在适宜条件下(PH10.0,和60℃),准确反应13分钟。在碱性条件下酚可与酚试剂生成蓝色化合物,以波长620nm比色。在一定条件下色泽深浅与光密度成正比。反应式如下:
然后以光密度直接表示不同底物浓度时的酶反应速度,即以光密度的倒数作纵坐标,以底物浓度的倒数作横坐标,按Lineweaver- Burk作图法来测定碱性磷酸酶Km值。
【仪器与试剂】
仪器:
1.恒温水浴
2.721型分光光度计
试剂:
1.酚试剂:称钨酸钠(错误!未找到引用源。W错误!未找到引用源。·2错误!未找到引用源。O)100g,钼酸钠(错误!未找到引用源。Mo错误!未找到引用源。·2错误!未找到引用源。O)25g置1500mL磨口回流装置内,加蒸馏水700mL,85%磷酸50mL和浓硫酸100mL。充分混匀,使其溶解。小火加热,回流10h(烧瓶内加小玻璃珠数颗,以防溶液溢出),再加入硫酸锂(LiSO4)150g,蒸馏水50mL及液溴数滴。在通风橱中开口煮沸15min,以除去多余的溴。冷却后定容至1000mL,过滤即成,此液应为鲜黄色,不带任何绿色。置棕瓶中,可在冰箱长期保存。若此贮存液使用过久,颜色由黄变绿,可加几滴液溴,煮沸几分钟,恢复原色仍可继续使用。使用时用蒸馏水稀释一倍,最后酸度为1N。
2.2.5mM磷酸苯二钠基质液:称取625mg磷酸苯二钠(C6H5PO4Na2?2H2O),溶于1,000ml容量瓶中,加蒸馏水稀释至刻度,加数滴夜溴以防腐,置冰箱内可保存一年之久。
3.碱性缓冲液(pH10.0):称取无水碳酸钠6.36g及碳酸氢钠3.36g,溶解于蒸馏水中,并稀释至1,000ml.
4.碱性磷酸酶液:称取碱性磷酸酶1mg,加水3~4ml,冰箱内可保存五周左右。【实验步骤】
取6支试管按下表加入试剂:
1 2 3 4 5 6
0.2 0.4 0.6 0.8 1.0 1.0 2.5mM磷酸苯二
钠(ml)
蒸馏水(ml)0.8 0.6 0.4 0.2 - 0.1 碱性缓冲液
1.0 1.0 1.0 1.0 1.0 1.0
(ml)
混匀后,60℃欲温5分钟
0.1 0.1 0.1 0.1 0.1 -
碱性磷酸酶液
(ml)
混匀后,60℃水浴13分钟(准确计时)
注意:1)加入碱性磷酸酶液要快速、准确。用移液枪加
2)此时为酶促反应,总体积2.1ml
3)第六管不加酶。
酚试剂(ml) 1.0 1.0 1.0 1.0 1.0 1.0 10%Na2CO3(ml
3.0 3.0 3.0 3.0 3.0 3.0
)
混匀后,室温放置15分钟
注意:1)酚试剂为显色剂,同时为酶的变性剂,故加入酚试
剂后酶促反应即停止。
2)Na2CO3 提供碱性环境,加入Na2CO3 后试剂才显色
以6管为调零点,在620nm波长处比色。
【结果处理】
1 将各管光密度和底物浓度记入下表
管号O.D 1/O.D [S] 1/[S]
1
2
3
4
5
2以1/O.D为纵坐标,1/[s]为横坐标,按Lineweaver- Burk作图,求出碱性磷酸酶的Km值。
【注意事项】
1)加入碱性磷酸酶的量要准确
2)保温时间要准确
准确保温的方法:从第一管加入酶液开始计时,每隔1分钟向下一只试管加酶液,直至加完,到准确13分钟立即向第一管加酚试剂,以终止其反应,并每隔1分钟向下一只试管加酚试剂,直至加完止,这样保证每管准确保温13分钟。【思考题】
1)Km 的意义及其影响因子
2)为什么酶促反应速度以初速度表示
3)为什么O.D可直接代替V作图
4)分析自己的实验数据
实验(二)——温度对酶活性的影响
【实验目的】
了解温度对酶活性及酶促反应速度的影响,加深对酶特性的认识。
【实验原理】
每种酶都有其最适温度,高于或低于此温度酶的活性都降低。一般而言,若酶处于过高的温度环境中,会使酶活性永久丧失;而若处于极低温度的环境中只会使酶活性受到抑制,一旦温度适宜,酶又会全部或部分的恢复其活性。
【仪器与试剂】
仪器:
1.冰箱 2.恒温水浴锅 3.试管和试管架
4.吸量管及吸量管架 5.移液枪及枪头 6.胶头滴管
7.烧杯
试剂:
1.PH6.8的缓冲液:量取15.45ml的0.2M磷酸氢二钠和4.55ml的柠檬酸混合摇匀即可。
2.0.5%淀粉的0.5%氯化钠溶液:0.5g可溶性淀粉和0.5g氯化钠,溶于100ml 蒸馏水(需加热)。
3.0.03175g/L碘液
4.1M HCl溶液 5.1M NaOH溶液 6.稀释100倍的唾液7.冰水浴
【实验步骤】
1.制管和预温
由于本实验对恒温反应要求较高,故每个温度梯度使用两支试管,分别标记为A 管和B 管,同时欲温底物与酶。A 管加入PH6.8的缓冲液和0.5%淀粉液;B 管使用移液枪加入稀释100倍的唾液,相对应的两支试管置于设定的温度下预温5min 。
取12支洁净试管,参照下表加入试剂:
*6号管为对照组(比色时作为0号管),置于室温,且淀粉液用蒸馏水代替
2.混合A 、B 管
将1号A 管试剂迅速加入温度对应的B 管中(为了最大限度保证酶的量),此时为计时的起点(使用秒表),摇匀后放回对应温度继续水浴。注意:转移A 管试剂前需将其摇匀。 3.时间控制
然后每隔1min 或2min (时间自定)按上步操作依次把2、3、4、5、6号的A 、B 管混合 ,严格控制好时间。 4.中止反应
准确反应13min ,向1号管加入2滴1M HCl 溶液,立即混匀,中止反应,按上一步的顺序和时间间隔依次对各管进行操作,并移至试管架。后再各用2滴1M NaOH 溶液中和每管。 5.显色
在每管中各加入2ml 0.03175g/L 碘液并混匀,观察现象。 6.比色
若不同温度梯度间现象差别不明显,则进行比色,通过光密度值来比较。 【结果处理】
记录现象(或比较吸光度值),做出合理分析。 【注意事项】
严格注意时间的控制及各物质的添加量。 【思考题】 如果某同学(没有严格按照教案步骤)做出的实验结果为唾液淀粉酶的最适温度为70度,请分析他得出这样的结果的可能原因。
管号 1(0℃) 2(室温) 3(37℃) 4(50℃) 5(70℃) 6(室温) A PH6.8的
缓冲液
(ml ) 2 2 2 2 2 2 含NaCl
的0.5%
淀粉液
(ml ) 2 2 2 2 2 用2ml
的蒸馏
水代替
B 稀释100倍的唾液(ml )
1 1 1 1 1 1
实验(三)——PH对酶活性的影响
【实验目的】
了解PH对酶活性及酶促反应速度的影响,加深对酶特性的认识。
【实验原理】
1.PH对酶活性影响的机理:PH影响酶活性中心的某些必须基团的解离,而这些基团往往仅在某一解离状态时才最容易同底物结合或具有最大催化活性;PH影响可解离基团的底物和辅酶的荷电状态,从而影响酶对他们的亲和力;PH还可以影响酶活性中心的空间构象,从而影响酶的活性。
2.本实验用唾液淀粉酶为材料来观察酶活性受PH的影响的情况。淀粉在该酶的催化作用下会随着时间的延长而出现不同程度的水解,从而得到各种糊精乃至麦芽糖,少量葡萄糖等水解产物。碘液与淀粉及其不同程度的水解产物反应呈现不同颜色,即淀粉(蓝色)、紫色糊精(紫色)、红色糊精(红色)、麦芽糖及少量葡萄糖(黄色)。
【仪器与试剂】
仪器:
1、冰箱
2、电炉
3、恒温水浴锅
4、
试管架及试管
5、移液管架及移液管
试剂:
1、0.2M磷酸氢二钠溶液:称取35.61g含2个结晶水的磷酸氢二钠,用水定容至1L。
2、0.1M柠檬酸溶液:称取21.01g含一个结晶水的柠檬酸,用水定容至1L。
3、唾液淀粉酶:将唾液分别稀释10倍、50倍和100倍,得三种不同浓度的酶液、
4、0.5%淀粉的0.5%氯化钠溶液:0.5g可溶性淀粉和0.5g氯化钠,溶于100ml 蒸馏水(需加热)。
5、0.1%淀粉液:0.1g可溶性淀粉,加到100ml蒸馏水中,加热溶解。
6、碘液:15g碘化钾和12.7g碘,加少许水使碘完全溶解后,再用水稀释至200ml。
7、1%氯化钠溶液。
8、0.1%硫酸铜溶液。
【实验步骤】
(一)PH对酶活性的影响
1、缓冲溶液的配制
取六只洁净的三角烧瓶,按表1编号和加试剂:
表1 磷酸氢二钠-柠檬酸缓冲液的配制
取六支洁净试管,编号后按表2操作:
表2 pH对酶活性的影响
【结果处理】
记录现象(或比较吸光度值),做出合理分析。
【注意事项】
充分摇匀,严格控制时间。
【思考题】
酶的最适PH值受哪些因素影响?
三角烧瓶号 1 2 3 4 5 6
PH值 5.4 6.2 6.8 7.0 7.4 8.0
0.2M磷酸二氢钠(ml)11.15 13.22 15.45 16.47 18.17 19.45 0.1M柠檬酸(ml)8.85 6.78 4.55 3.53 1.83 0.55
管号 1 2 3 4 5 6
PH值 5.4 6.2 6.8 7.0 7.4 8.0 缓冲液量(ml) 3 3 3 3 3 3
含Nacl的0.5%淀粉(ml) 2 2 2 2 2 2
稀释100倍唾液(ml) 2 2 2 2 2 2
充分摇匀,37℃水浴保温,严格控制时间5min后,立即向各管加入碘液
碘液(滴) 3 3 3 3 3 3
充分摇匀,观察各管颜色差异
实验(四)——酶浓度对酶活性的影响
【实验目的】
了解酶浓度对酶活性及酶促反应速度的影响,加深对酶特性的认识。
【实验原理】
在适宜的条件下,若反应物浓度大大高于酶浓度时,反应速度随酶浓度增加而增加,两者间成正比。但若反应底物浓度较低,而且酶的浓度足够高时,增加酶浓度,反应速度基本不变。
本实验采用唾液淀粉酶为例。加入不同浓度的酶,并比较在同一适当时间后,以碘检验淀粉的含量从而确认其反应程度。
【仪器与试剂】
仪器:
1.恒温水浴锅
2.吸量管
3.试管与试管架
试剂:
1.含NaCI的0.5%淀粉液
2.pH7.0的缓冲液
3.分别稀释过10倍、50倍和100倍后的唾液
【实验步骤】
1.取3支洁净试管,按下表加入淀粉液,缓冲液,加毕放入37度恒温水浴锅中保温5分钟;
2.保温后,快速加入不同浓度的稀释唾液,摇匀,立即放入37度恒温水浴中,并计时。约3至4分钟后加入等量碘液一至两滴,立即摇匀后,记录各管的颜色。
管号含NaCI的
0.5%淀粉液
/mL pH7.0的缓冲
液/mL
稀释唾液/mL 颜色
10倍50倍100倍
1 3
2 1
2 3 2 1
3 3 2 1
【结果处理】
记录现象,做出合理分析。
【思考题】
实验(五)——离子对酶活性的影响
【实验目的】
了解离子对酶活性及酶促反应速度的影响,加深对酶特性的认识。
【实验原理】
酶的活性常常受某些物质的影响,有些物质能使酶的活性增加,称为酶的激活剂;有些物质能使酶的活性降低,称为酶的抑制剂。Cl-是唾液淀粉酶的激活剂。其它的阴离子,如Br-、NO3-和I- 对该酶也有激活作用,但较微弱。而Cu2+对唾液淀粉酶具有抑制作用。激活剂和抑制剂影响酶活性的剂量是很少的,并且常具有特异性。
就本实验,低浓度CI-可以增加酶活性,高浓度的CI-或者低浓度的Cu2+则会抑制酶活性,同时低浓度的Na+、SO42-等对酶活性没有影响。激活剂的作用机制是多种多样的,可能是作为辅酶或辅基的一个组成部分,也可以直接作为酶活性中心的构成部分。
【仪器与试剂】
仪器:
1.恒温水浴锅
2.吸量管
3.试管与试管架
试剂:
1. 1%NaCI溶液
2. 0.1%CuSO4溶液
3. 0.1%淀粉液
4. 100倍稀释唾液
5.碘液
【实验步骤】
取3支洁净的试管,编号后按下表操作:
管号 1 2 3 1%NaCl(mL) 1
0.1%CuSO4(mL) 1
蒸馏水(mL) 1
0.1%淀粉液(mL) 3 3 3
100倍稀释唾液(mL) 1 1 1 37℃恒温水浴15min,取出滴加碘液
碘液 2 2 2
结果
【结果处理】
记录现象(或比较吸光度值),做出合理分析。
【思考题】
为什么加入淀粉后有试管内颜色显现为红色?
(思考题可以总结起来出在最后面)
酶动力学综合实验 实验(一)——碱性磷酸酶Km值的测定 【目的要求】 1.了解底物浓度对酶促反应速度的影响 2.了解米氏方程、Km值的物理意义及双倒数作图求Km值的方法。 【实验原理】 1、碱性磷酸酶: 碱性磷酸酶是广泛分布于人体各脏器器官中,其中以肝脏为最多。其次为肾脏、骨骼、肠和胎盘等组织。但它不是单一的酶,而是一组同功酶。本实验用的碱性磷酸酶是从大肠杆菌中提取的。 2、米氏方程: Michaelis-Menten 在研究底物浓度与酶促反应速度的定量关系时,导出了酶促反应动力学的基本公式,即: 错误!未找到引用源。(1) 式中:v表示酶促反应速度, 错误!未找到引用源。表示酶促反应最大速度, [S]表示底物浓度, 错误!未找到引用源。表示米氏常数。 3、错误!未找到引用源。值的测定主要采用图解法,有以下四种: ①双曲线作图法(图1-1,a) 根据公式(1),以v对[s]作图,此时1/2错误!未找到引用源。时的底物浓度[s]值即为Km值,以克分子浓度(M)表示。这种方法实际上很少采用,因为在实验条件下的底物浓度很难使酶达到饱和。实测错误!未找到引用源。一个近似值,因而1/2错误!未找到引用源。不精确。此外由于v对[S]的关系呈双曲线,实验数据要求较多,且不易绘制。 ②Lineweaver- Burk作图法双倒数作图法(图1-1,b) 实际工作中,常将米氏方程(式(1))作数学变换,使之成为直线形式,测定要方便、精确得多。其中之一即取(1)式的倒数,变换为Lineweaver- Burk方程式:错误!未找到引用源。(2) 以错误!未找到引用源。对错误!未找到引用源。作图,即为y=ax+b形式。此时斜率为错误!未找到引用源。,纵截距为错误!未找到引用源。。把直线外推与横轴相交,其截距相交,其截距即为—错误!未找到引用源。。 ③Hofstee作图法(略) 把(2)式等号两边乘以错误!未找到引用源。,得: 错误!未找到引用源。(3) 以v对错误!未找到引用源。作图,这时斜率为错误!未找到引用源。,纵截距
第九章酶促反应动力学 提要 酶促反应动力学是研究酶促反应的速率以及影响此速率各种因素的科学。它是以化学动力学为基础讨论底物浓度、抑制剂、pH、温度及激活剂等因素对酶反应速率的影响。化学动力学中在研究化学反应速率与反应无浓度的关系时,常分为一级反应、二级反应及零级反应。研究证明,酶催化过正的第一步是生成酶-底物中间产物,Michaelis-Menten该呢举中间产物学说的理论推导出酶反应动力学方程式,即Km、Vmax、kcat、kcat/Km。Km是酶的一个特征常数,以浓度为单位,Km有多种用途,通过直线作图法可以得到Km及Vmax。Kcat称为催化常数,又叫做转换数(TN值),它的单位为s-1,kcat值越大,表示酶的催化速率越高。kcat/Km常用来比较酶催化效率的参数。酶促反应除了单底物反应外,最常见的为双底物反应,按其动力学机制分为序列反应和乒乓反应,用动力学直线作图法可以区分。 酶促反应速率常受抑制剂影响,根据抑制剂与酶的作用方式及抑制作用是否可逆,将抑制作用分为可逆抑制作用及不可逆抑制作用。根据可逆抑制剂与底物的关系分为竞争性抑制、非竞争性抑制及反竞争性抑制3类,可以分别推导出抑制作用的动力学方程。竞争性抑制可以通过增加底物浓度而解除,其动力学常数Kˊm变大,Vmax不变;非竞争性抑制Km不变,Vˊmax变小;反竞争性抑制Kˊm及Vˊmax均变小。通过动力学作图可以区分这3种类型的可逆抑制作用。可逆抑制剂中最重要的是竞争性抑制,过度态底物类似物为强有力的竞争性抑制剂。不可逆抑制剂中,最有意义的为专一性Ks型及kcat型不可逆抑制剂。研究酶的抑制作用是研究酶的结构与功能、酶的催化机制、阐明代谢途径以及设计新药物的重要手段。 温度、pH及激活剂都会对酶促反应速率产生重要影响,酶反应有最适温度及最适pH,要选择合适的激活剂。在研究酶促反应速率及测定酶的活力时,都应选择酶的最适反应条件。 习题 1.当一酶促反应进行的速率为Vmax的80%时,在Km和[S]之间有何关系?[Km=0.25[S]] 解:根据米氏方程:V=Vmax[S]/(Km+[S])得: 0.8Vmax=Vmax[S]/(Km+[S]) Km=0.25[S] 2.过氧化氢酶的Km值为2.5×10-2 mol/L,当底物过氧化氢浓度为100mol/L时,求在此浓度下,过氧化氢酶被底物所饱和的百分数。[80%] 解:f ES=[S]/(Km+[S])=100×10-3/(2.5×10-2+100×10-3)=80% 3.由酶反应S→P测得如下数据: [S]/molL-1V/nmolL-1min-1 6.25×10-615.0 7.50×10-556.25 1.00×10-460.0 1.00×10-374.9 1.00×10-275.0 (1)计算Km及Vmax。[Km:2.5×10-5,Vmax:75 nmolL-1min-1] (2)当[S]= 5×10-5 mol/L时,酶催化反应的速率是多少?[50.0 nmolL-1min-1]
第九章酶促反应动力学 一、是非判断题 1.酶促反应的初速度与底物浓度无关。() 2.当底物处于饱和水平时,酶促反应的速度与酶浓度成正比。() 3.某些酶的Km由于代谢产物存在而发生改变,而这些代谢产物在结构上与底物无关。()4.在非竞争性抑制剂存在下,加入足量的底物,酶促的反应能够达到正常Vmax。()5.碘乙酸因可与活性中心-SH以共价键结合而抑制巯基酶,而使糖酵解途径受阻。()6.从鼠脑分离的己糖激酶可以作用于葡萄糖(K m=6×10-6mol/L)或果糖(K m=2×10-3mol/L),则己糖激酶对果糖的亲和力更高。() 7.K m是酶的特征常数,只与酶的性质有关,与酶浓度无关。() 8.K m是酶的特征常数,在任何条件下,K m是常数。() 9.K m是酶的特征常数,只与酶的性质有关,与酶的底物无关。() 10.一种酶有几种底物就有几种K m值。() 11.当[S]>>K m时,V趋向于V max,此时只有通过增加[E]来增加V。() 12.酶的最适pH值是一个常数,每一种酶只有一个确定的最适pH值。() 13.酶的最适温度与酶的作用时间有关,作用时间长,则最适温度高,作用时间短,则最适温度低。() 14.金属离子作为酶的激活剂,有的可以相互取代,有的可以相互拮抗。() 15.增加不可逆抑制剂的浓度,可以实现酶活性的完全抑制。() 16.竞争性可逆抑制剂一定与酶的底物结合在酶的同一部位。() 答案 1.错。2.对。3.对。4.错。5.对。6.错。7.对。8.错。9.错。10.对。11.对。12.错。13.错。14.对。15.对。16.错。 二、填空题 1.影响酶促反应速度的因素有、、、、和。 2.丙二酸和戊二酸都是琥珀酸脱氢酶的抑制剂。 3.通常讨论酶促反应的反应速度时,指的是反应的速度,即时测得的反应速度。 4.pH值影响酶活力的原因可能有以下几方面:影响,影响,影响。5.温度对酶活力影响有以下两方面:一方面,另一方面。 6.酶促动力学的双倒数作图(Lineweaver-Burk作图法),得到的直线在横轴的截距为,纵轴上的截距为。 7.磺胺类药物可以抑制酶,从而抑制细菌生长繁殖。 答案 1.[E];[S];pH;T(温度);I(抑制剂);A(激活剂) 2.竞争性 3.初;底物消耗量<5%
§2.8 酶促反应动力学(9章 P351) 一一一底物浓度对酶反应速率的影响 用反应初速度v对底物浓度[S]作图得P355 图9-6。 曲线分以下几段: 一1一OA段:反应底物浓度较低时v与[S]成正比,表现为一级反应, v = k[S]。 根据酶底物中间络合物学说,酶催化反应时,首先和底物结合生成中间 复合物ES,然后再生成产物P,并释放出E。 E + S = ES → P + E OA段上,底物浓度小,酶未被底物饱和,有剩余酶,反应速率取决于ES浓 度,与[S]呈线性关系,v正比于[S]。 一2一AB段:反应速度不再按正比升高,表现为混合级反应。此时酶渐渐为底物饱和,[E S]慢慢增加,v也慢慢增加,为分数级反应。 一3一BC段:反应速度趋于V max,为零级反应,酶促反应表现出饱和现象。此时底物过量[S]>[E], [E]已全部转为[E S]而恒定,因此反应速率也恒定,为最大反应速率,V m 为[E]所决定。 ax 非催化反应无此饱和现象。 酶与底物形成中间复合物已得到实验证实。 一一一酶促反应力学方程式 一1一米氏方程推导 1913年Michaelis和Menten提出并推导出表示[S]与v之间定量关系的米氏方程 V max[S] V = K m + [S] Km:米氏常数,物理意义为反应速率为最大速率V max一半时底物的浓度, 单位与底物浓度同。 推导:酶促反应分两步进行。 k1 k3 E + S ES → P + E k2 v = k3 [ES] 一般k3为限速步骤 v = k3 [ES] … ① 1.[ES] 生成速率: d[ES]/dt = k1([E] - [ES]) [S] 2.[E S]分解速率:
第九章酶促反应动力学 (一)底物浓度对酶反应速率的影响 (1)OA段:反应底物浓度较低时v与[S]成正比,表现为一级反应, v = k[S]。 根据酶底物中间络合物学说,酶催化反应时,首先和底物结合生成中间复合物ES,然后再生成产物P,并释放出E。 E + S = ES →P + E OA段上,底物浓度小,酶未被底物饱和,有剩余酶,反应速率取决于ES浓度,与[S]呈线性关系,v正比于[S]。 (2)AB段:反应速度不再按正比升高,表现为混合级反应。此时酶渐渐为底物饱和,[E S]慢慢增加,v也慢慢增加,为分数级反应。 (3)BC段:反应速度趋于V max,为零级反应,酶促反应表现出饱和现象。此时底物过量[S]>[E], [E]已全部转为[E S]而恒定,因此反应速率也恒定,为最大反应速率,V max为[E]所决定。 非催化反应无此饱和现象。 酶与底物形成中间复合物已得到实验证实。 (二)酶促反应力学方程式 (1)米氏方程推导 1913年Michaelis和Menten提出并推导出表示[S]与v之间定量关系的米氏方程 V max[S] V = K m + [S] Km:米氏常数,物理意义为反应速率为最大速率V max一半时底物的浓度,单位与底物浓度同。 2.9 酶的抑制作用 失活作用:使酶蛋白变性而引起酶活力丧失。 抑制作用:酶的必需基团的化学性质改变而引起酶活力降低或丧失,但不引起酶蛋白变性。 引起抑制作用的物质称为抑制剂。研究酶的抑制剂,可以研究酶的结构与功能、酶催化机制,进行药物、农药的设计与筛选。 (一)抑制作用的类型: (1)不可逆抑制作用: 抑制剂与酶必需基团以共价键结合而引起酶活力丧失,不能用透析、超过滤等物理方法除去抑制剂而使酶复活,酶被化学修饰。 (2)可逆抑制作用: 抑制剂与酶以非共价键结合而使酶活力降低或丧失,能用物理方法除去抑制剂而使酶复活。 可逆抑制又分为三种类型。 1.竞争性抑制:抑制剂(I)和底物(S)竞争酶的结合部位,从而影响了底物与酶的正常结 合。 抑制剂结构大多与底物类似,许多底物过渡态类似物为抑制剂。抑制剂与酶活性部位结合形成EI复合物,抑制酶与底物的结合。竞争性抑制可以通过增加底物浓度而解除,如丙二酸或戊二酸对琥珀酸脱氢酶的抑制。 2.非竞争性抑制:底物和抑制剂同时和酶结合,两者无竞争作用。I与S结构无共同之处, 酶活性降低或被抑制,不能用增加底物浓度来解除抑制,如Leu是精氨酸酶非竞争性抑制剂。 3.反竞争性抑制:酶只有与底物结合后才能与抑制剂结合。常见于多底物反应中,如肼类化 合物抑制胃蛋白酶。 (二)可逆抑制作用和不可逆抑制作用动力学鉴别 加入一定量抑制剂,以v与酶浓度[E]作图。 加不可逆抑制剂使直线原点右移,斜率不变,加入酶使浓度大于不可逆抑制剂,才表现酶
酶促反应动力学实验报告 杨恩原 实验目的: 1.观察底物浓度对酶促反应速度的影响 2.观察抑制剂对酶促反应速度的影响 3.掌握用双倒数作图法测定碱性磷酸酶的Km值 实验原理: 一、底物浓度对酶促反应速度的影响 在温度、pH及酶浓度恒定的条件下,底物浓度对酶的催化作用有很大的影响。在一般情况下,当底物浓度很低时,酶促反应的速度(v)随底物浓度[S]的增加而迅速增加,但当底物浓度继续增加时,反应速度的增加率就比较小,当底物浓度增加到某种程度时反应速度达到一个极限值(即最大速度Vmax)。底物浓度和反应速度的这种关系可用米氏方程式来表示(Michaelis-Menten方程)即: 式中Vmax为最大反应速度,Km为米氏常数,[S]为底物浓度 当v=Vmax/2时,则Km=[S],Km是酶的特征性常数,测定Km是研究酶的一种重要方法。但是在一般情况下,根据实验结果绘制成的是直角双曲线,难以准确求得Km和Vmax。若将米氏方程变形为双倒数方程(Lineweaver-Burk方程),则此方程为直角方程,即: 以1/V和1/[S]分别为横坐标和纵坐标。将各点连线,在横轴截距为-1/Km,据此可算出Km值。
本实验以碱性磷酸酶为例,测定不同浓度底物时的酶活性,再根据1/v和1/[S]的倒数作图,计算出其Km值。 二、抑制剂对酶促反映的影响 凡能降低酶的活性,甚至使酶完全丧失活性的物质,成为酶的抑制剂。酶的特异性抑制剂大致上分为可逆性和不可逆性两类。可逆性抑制又可分为竞争性抑制和非竞争性抑制等。竞争性抑制剂的作用特点是使该酶的Km值增大,但对酶促反映的最大速度Vmax值无影响。非竞争性抑制剂的作用特点是不影响[S]与酶的结合,故其Km值不变,然而却能降低其最大速度Vmax。本实验选取Na2HPO4作为碱性磷酸酶的抑制物,确定其抑制作用属于哪种类型。 实验步骤: 实验一:底物浓度对酶促反应速度的影响 管号 试剂 1.取试管9支,将L基质液稀释成下列不同浓度:
“蛋白酶凝乳特性研究” 1.实验目的 通过研究胃蛋白酶、木瓜蛋白酶作用于脱脂乳的最适凝乳温度、最适pH值、以及金属离子对酶凝乳效果的影响,使学生掌握酶学研究的基本方法,从而掌握生物化工研究的一些基本理论和主要思路,为科研开发打下必要的基础。 2.实验原理 胃蛋白酶、木瓜蛋白酶等具有很强的蛋白质催化特性,又具有良好的凝乳特性。因脱脂乳含大量酪蛋白,木瓜蛋白酶的凝乳特性主要表现为随机切割精氨酶-苯丙氨酸的肽键,达到破坏蛋白质稳定的效果,进而发生凝乳。奶酪的生产以前主要利用牛凝乳酶达到凝乳效果,但牛凝乳酶主要是从小牛的第四胃中提取得来,其来源受到极大的限制,通过研究蛋白酶、木瓜蛋白酶的凝乳特性并对其进行优化,一定程度地缓解凝乳酶来源的紧缺状态。 3.实验材料、仪器和试剂 3.1实验材料优质脱脂乳 3.2实验药品和器皿
3.3试剂 (1)配制浓度为100g/L的脱脂乳1000ml,混匀后待用。(5组) (2)配制浓度为10g/L的木瓜蛋白酶液和浓度为2g/L胃蛋白酶溶液各500ml,混匀后待用。(5组) (3)配制0.1mol/L NaOH和0.1mol/L的HCl溶液各1000ml,用于调节溶液pH 值。(5组) 4.操作步骤 4.1木瓜蛋白酶(胃蛋白酶)凝乳活力的测定 取 5mL100g.L-1的脱脂乳,在65℃下保温5min,加入0.5mL10g.L-1的木瓜蛋白酶液(或胃蛋白酶液),迅速混合均匀,准确记录从加入酶液到乳液凝固的时间(s)。把40min凝固1mL100g.L-1的脱脂乳的酶量定义为一个索氏单位(Soxhletunit),并以相对活性(RU)表示各因素的影响效果。SU=(2400/T)×(5 / 0.5)。式中:T为凝乳时间(s) RU(%)=(各因素下SU / 最大SU)×100 4.2酶的最适凝乳温度的测定:分别在55,60,65,70, 75℃下测定酶凝乳活性。 4.3酶的热稳定性:酶液分别在55 ,60,65,70,75℃下处理10,30,60min后, 测定酶的凝乳活性。(上述温度对凝乳特性研究,可根据实际情况,缩小两个水平间的差距) 4.4 pH对酶凝乳效果的影响:用0.1mol/LHCl和0.1mol/L NaOH将100g/L的 脱脂乳的pH调到6.0,6.5,7,7.5,8在65℃下测定酶的凝乳活性。 4.5 酶对pH的稳定性:用0.1mol/L HCl和0.1moL/LNaOH将酶液调到pH为 4.0, 5.0, 6.0, 7.0, 8.0,室温下(约25℃)放置1h后,再将酶液pH调到6.0, 在65℃下测定酶的凝乳活性。(上述pH对凝乳特性研究,可根据实际情况,缩小两个水平间的差距) 4.6 NaCl对酶活的影响:在酶液中添加0.2,0.5,0.8,1.1,1.5 (%)浓度的NaCl 溶液,分别测定酶的凝乳活性。 4.7 Ca2+、Mg2+、K+对酶凝乳效果的影响:在乳液中添加CaCl 2,MgCl 2 、KCl使其 含量分别为0.2,0.5,0.8, 1.1,1.4 (%),然后测定酶的凝乳活性。(上述离子对凝乳特性研究,可根据实际情况,缩小两个水平间的差距)
酶促反应动力学实验报告 14301050154 杨恩原 实验目的: 1.观察底物浓度对酶促反应速度的影响 2.观察抑制剂对酶促反应速度的影响 3.掌握用双倒数作图法测定碱性磷酸酶的Km值 实验原理: 一、底物浓度对酶促反应速度的影响 在温度、pH及酶浓度恒定的条件下,底物浓度对酶的催化作用有很大的影响。在一般情况下,当底物浓度很低时,酶促反应的速度(v)随底物浓度[S]的增加而迅速增加,但当底物浓度继续增加时,反应速度的增加率就比较小,当底物浓度增加到某种程度时反应速度达到一个极限值(即最大速度Vmax)。底物浓度和反应速度的这种关系可用米氏方程式来表示(Michaelis-Menten方程)即: 式中Vmax为最大反应速度,Km为米氏常数,[S]为底物浓度 当v=Vmax/2时,则Km=[S],Km是酶的特征性常数,测定Km是研究酶的一种重要方法。但是在一般情况下,根据实验结果绘制成的是直角双曲线,难以准确求得Km和Vmax。若将米氏方程变形为双倒数方程(Lineweaver-Burk方程),则此方程为直角方程,即: 以1/V和1/[S]分别为横坐标和纵坐标。将各点连线,在横轴截距为-1/Km,据此可算出Km值。 本实验以碱性磷酸酶为例,测定不同浓度底物时的酶活性,再根据1/v和1/[S]的倒数作图,计算出其Km值。 二、抑制剂对酶促反映的影响
凡能降低酶的活性,甚至使酶完全丧失活性的物质,成为酶的抑制剂。酶的特异性抑制剂大致上分为可逆性和不可逆性两类。可逆性抑制又可分为竞争性抑制和非竞争性抑制等。竞争性抑制剂的作用特点是使该酶的Km 值增大,但对酶促反映的最大速度Vmax 值无影响。非竞争性抑制剂的作用特点是不影响[S]与酶的结合,故其Km 值不变,然而却能降低其最大速度Vmax 。本实验选取Na 2HPO 4作为碱性磷酸酶的抑制物,确定其抑制作用属于哪种类型。 实验步骤: 实验一:底物浓度对酶促反应速度的影响 1. 取试管9支,将0.01mol/L 基质液稀释成下列不同浓度: 2. 另取9支试管编号,做酶促反应: 3. 混匀,37 ℃水浴保温5分钟左右。 4. 加入酶液后立即计时,各管混匀后在37 ℃准确保温15分钟。 5. 保温结束,立即加入0.5mol/L NaOH 1.0 ml 以中止反应。各管分别加入0.3% 4-氨基安替 比林1.0 ml 及0.5% 铁氰化钾 2.0 ml 。 试剂 管号 试剂 管号
酶促反应动力学 目的:酶催化反应的速度及各种因素对反应速度的影响1.米氏方程的推导 米氏学说是1913年Michaelis和Menton建立的,认为反应分为两步,先生成酶-底物复合物(中间产物),再分解形成产物,释放出游离酶。经过Briggs和Haldane的补充与发展,得到了现在的米氏方程。 S+E=SE=P+E 对于上面的反应,首先有三点假设:第一,底物大过量,即[S]》[E]。第二,在反应初期,产物浓度极小,忽略逆反应即k-2=0;第三,稳态假设,即随着反应的进行,复合物的形成速度逐渐降低,分解加快,在某一时刻达到平衡,复合物的浓度为常数,这种状态称为“稳态”。体系达到稳态后,底物的消耗和产物的生成速度都是常数,且相等。经测定,酶加入体系后,在几毫秒之内即可达到稳态,所以我们测定的初速度通常是稳态速度。在产物积累较多之前,体系一直保持稳态,所以反应速度 v=k2[ES]。根据稳态假设,有k1[E][S]=(k-1+k2)[ES],即 [ES]=k1[E][S]/(k-1+k2)。定义(k-1+k2)/k1=Km,因为[E]= [E]0-[ES],故[ES]= [E]0[S]/(Km+[S])。代入速度方程,得到v= k2[E]0[S]/(Km+[S])。因为当[ES]=[E]0时速度最大,所以 Vm=k2[E]0。代入,得到下列米氏方程: v=Vm×[S]/(Km+[S]) 2.米氏常数的意义
米氏常数的物理意义是反应速度达到最大反应速度一半时的底物浓度。其酶学意义在于,它是酶的特征常数,只与酶的性质有关,与酶浓度无关。不同的酶其Km不同,同种酶对不同底物也不同。在k2极小时1/Km可近似表示酶与底物的亲和力,1/Km越大,亲和力越大。在酶的多种底物中,Km最小的底物叫做该酶的天然底物。 3.米氏常数的测定 从酶的v-[s]图上可以得到Vm,再从1/2Vm处读出[s],即为Km。但实际上只能无限接近Vm,却无法达到。为得到准确的米氏常数,可以把米氏方程加以变形,使它相当于线性方程,通过作图得到准确的米氏常数。 双倒数作图法将方程改写为 1/v=Km/Vm×1/[S]+1/Vm 实验时在不同的底物浓度测定初速度,以1/v对1/[S]作图,直线外推与横轴相交,横轴截踞为-1/Km,纵轴截踞为1/Vm。此法称为Lineweaver-Burk作图法,应用最广,但实验点常集中在左端,作图不易准确。 Eadie-Hofstee法将方程改写为v=-Km×v/[S]+Vm以v对v/[S]作图,直线斜率为-Km。 2、米氏常数的求法: ①双倒数作图法 Lineweaver Burk方程: 1 /V = K m/V max (1/[S]) +1/ V max,横轴的截距为-1/ K m;
酶促反应动力学实验 Document serial number【UU89WT-UU98YT-UU8CB-UUUT-UUT108】
实验 酶促反应动力学 ————蔗糖酶米氏 常数的测 【目的要求】 1.了解酶促动力学研究的范围。 2.以蔗糖酶为例,掌握测定米氏常数(Km) 【实验原理】 在酶促反应中,当反应体系的温度、pH 和酶浓度恒定时,反应初速度(v)则随底物 浓度[S]的增加而加速,最后达到极限,称为最大反应速度(v)。Michaelis 和Menten 根据反应速度与底物浓度的这种关系,推导出如下方程: ] [] [S k S V v m += 此式称为米氏方程,式中Km 称为米氏常数,按此方程,可用作图法求出Km 。方法有: 1.以v[S]作图 由米氏方程可知,v=V /2时,Km =[S]即米氏常数值等于反应速度达到最大反应速度一半时所需底物浓度。因此,可测定一系列不同底物浓度的反应速度v,以v 对[S]作图。当v =V /2时,其相应底物浓度即为Km 。 2.以1/v 对1/[S]作图 取米氏方程的倒数式:
V S V k v m 1][11+?= 以1/v 对1/[S]作图可得一直线,其斜率为Km /V ,截距为1/V 。若将直线延长与横轴相交,则该交点在数值上等于—l /Km 。 本实验以蔗糖为底物.利用一定量蔗糖酶水解不同浓度蔗糖所形成的产物(葡萄糖和果糖)的量来计算蔗糖酶的Km 值。葡萄糖和果糖能与3,5—二硝基水杨酸试剂反应,生成桔红色化合物,可于520nm 处比色测定之。 【试验材料】 1.试剂 (1)标准葡萄糖溶液:准确称取100mg 葡萄糖溶于少量饱和的苯甲酸溶液%),再转移到100ml 容量瓶中,用饱和苯甲酸溶液稀释到刻度,混匀,即得浓度为1mg /m1的标准葡萄糖溶液。冰箱贮藏可长期保存; (2)的L 醋酸缓冲液:取lmol/L 醋酸钠溶液43m1及lmol /L 醋酸溶液57m1,稀释至1000m1即得;
酶动力学综合实验 实验(一)一一碱性磷酸酶Km直的测定 【目的要求】 i. 了解底物浓度对酶促反应速度的影响 2?了解米氏方程、Km值的物理意义及双倒数作图求Km值的方法。 【实验原理】 1、碱性磷酸酶: 碱性磷酸酶是广泛分布于人体各脏器器官中,其中以肝脏为最多。其次为肾脏、骨骼、肠和胎盘等组织。但它不是单一的酶,而是一组同功酶。本实验用的碱性磷酸酶是从大肠杆菌中提取的。 2、米氏方程: Michaelis-Menten在研究底物浓度与酶促反应速度的定量关系时,导出了酶促反 应动力学的基本公式,即: 式中:v表示酶促反应速度, 車表示酶促反应最大速度, [S]表示底物浓 度,表示米氏常 数。 3、?值的测定主要采用图解法,有以下四种: ①双曲线作图法(图1-1, a) 根据公式(1),以v对[s]作图,此时1/2%肚时的底物浓度[s]值即为Km值,以克分子浓度(M)表示。这种方法实际上很少采用,因为在实验条件下的底物浓度很难使酶达到饱和。实测—个近似值,因而1/2 一不精确。此外由于v对[S]的关系呈双曲线,实验数据要求较多,且不易绘制。 ②Lin eweaver- Burk作图法双倒数作图法(图1-1,b) 实际工作中,常将米氏方程(式(1))作数学变换,使之成为直线形式,测定要方便、精确得多。其中之一即取(1)式的倒数,变换为Lin eweaver- Burk方程式:
以対…作图,即为y=ax+b 形式。此时斜率为丄,纵截距为 丄。把直线外推与 u [jj % 横轴相交,其截距相交,其截距即为一 ③ Hofstee 作图法(略) Vmax 卩址1丄1 〒-心冏+1 以V 对 作图,这时斜率为 ,纵截距为二,横截距为 ④ Han as 作图法(略) 把(2)式等号两边乘以[S],得: 本实验主要以双倒数法,即 Li neweaver- Burk 作图法来测定碱性磷酸酶 Km 值。 具体原理如下: 本实验以碱性磷酸酶为例,用磷酸苯二钠为其作用物,碱性磷酸酶能分解磷酸苯 二钠产生酚和磷酸,在适宜条件下(PH10.0,和60C ),准确反应13分钟。在 碱性条件下酚可与酚试剂生成蓝色化合物,以波长 620nm 比色。在一定条件下 色泽深浅与光密度成正比。反应式如下: max 把(2)式等号两边乘以 ,得: ,纵截距为 --------------
酶促反应动力学实验
————————————————————————————————作者: ————————————————————————————————日期:
酶动力学综合实验 实验(一)——碱性磷酸酶Km值的测定 【目的要求】 1.了解底物浓度对酶促反应速度的影响 2.了解米氏方程、Km值的物理意义及双倒数作图求Km值的方法。 【实验原理】 1、碱性磷酸酶: 碱性磷酸酶是广泛分布于人体各脏器器官中,其中以肝脏为最多。其次为肾脏、骨骼、肠和胎盘等组织。但它不是单一的酶,而是一组同功酶。本实验用的碱性磷酸酶是从大肠杆菌中提取的。 2、米氏方程: Michaelis-Menten在研究底物浓度与酶促反应速度的定量关系时,导出了酶促反应动力学的基本公式,即: (1) 式中:v表示酶促反应速度, 表示酶促反应最大速度, [S]表示底物浓度, 表示米氏常数。 3、值的测定主要采用图解法,有以下四种: ①双曲线作图法(图1-1,a) 根据公式(1),以v对[s]作图,此时1/2时的底物浓度[s]值即为Km值,以克分子浓度(M)表示。这种方法实际上很少采用,因为在实验条件下的底物浓度很难使酶达到饱和。实测一个近似值,因而1/2不精确。此外由于v对[S]的关系呈双曲线,实验数据要求较多,且不易绘制。 ②Lineweaver- Burk作图法双倒数作图法(图1-1,b) 实际工作中,常将米氏方程(式(1))作数学变换,使之成为直线形式,测定要方便、精确得多。其中之一即取(1)式的倒数,变换为Lineweaver- Burk方程式: (2)
以对作图,即为y=ax+b形式。此时斜率为,纵截距为。把直线外推与横轴相交,其截距相交,其截距即为—。 ③Hofstee作图法(略) 把(2)式等号两边乘以,得: (3) 以v对作图,这时斜率为,纵截距为,横截距为。 ④Hanas作图法(略) 把(2)式等号两边乘以[S],得: (4) 以对[s]作图,这时斜率为,纵截距为。 (a)(b) 本实验主要以双倒数法,即Lineweaver-Burk作图法来测定碱性磷酸酶Km值。具体原理如下: 本实验以碱性磷酸酶为例,用磷酸苯二钠为其作用物,碱性磷酸酶能分解磷酸苯二钠产生酚和磷酸,在适宜条件下(PH10.0,和60℃),准确反应13分钟。在碱性条件下酚可与酚试剂生成蓝色化合物,以波长620nm比色。在一定条件下色泽深浅与光密度成正比。反应式如下:
第九章酶促反应动力学第一节化学动力学基础 一、反应速率及其测定 二、反应分子数和反应级数 反应分子数 反应级数 三、各级反应的特征 (一)一级反应 其速率与反应物浓度的一次方成正比。 -dc/dt=kc lnc=-kt+lnc0 lnc=-kt+B(直线) K=(1/t)ln(c0/c) c=(1/2)c0时 k=(ln2)/t1/2 t1/2=(ln2)/k 半衰期与反应物的初始浓度无关。
(二)二级反应 反应的速率与反应物浓度的二次方成正比。 1.若A和B为同一物质 -dc/dt=kc2,dc/c2=-kdt; c/c0=1/(1+kc0t); c/c0=1/2时,k=1/c0t1/2。 2.A和B的初始浓度相同 k=(1/t){x/[a(a?x)] } 3.A和B的初始浓度不同 k=[1/t(a?b)]/ln{[b(a?x)]/[a(b?x)]} a:反应物A的初始浓度。 b:反应物B的初始浓度。 (a-x):反应时间为t时A的浓度。 (b-x):反应时间为t时B的浓度。 (三)零级反应 反应速率与反应物的浓度无关。 -dc/dt=k,或dx/dt=k。 X=kt,或k=x/t。 第二节底物浓度对酶反应速率的影响
一、中间产物学说 中间产物学说的实验依据:(1)核酸和酶的复合物可直接用电镜观察;(2)下图;(3)复合物的溶解度和稳定性有所变化;(4)有些复合物可直接分离得到。 酶催化的反应中各成份的变化: 酶反应的速度在不停地变,实验上只有初速度的测定才有意义。
酶反应的初速度与底物浓度之间的关系: 二、酶促反应的动力学方程式(一)米氏方程的推导 米氏方程v=Vmax[S]/(Km+[S])符合v-[S]曲线。若Km>>[S],v=(Vmax/Km)[S]; 若[S]>>Km,v=Vmax;
第9章 酶促反应动力学 教学目的:使学生掌握影响酶促反应速率的各种因素; 教学重点:底物浓度、激活剂和抑制剂对酶促反应速率的影响 教学难点:抑制剂对酶促反应速率的影响 教学方法和手段:多媒体 教学内容: 酶促反应动力学是研究酶促反应的速率以及影响酶促反应速率的各种因素。 一、 酶浓度对酶作用的影响 在底物浓度足够过量而其他条件固定的情况下,并且反应系统中不含有抑制酶活 性或激活酶活性的物质及其它不利于酶发挥作用的因素时,则酶促反应速度与酶浓度成正比。 V = K [E] 可用中间产物学说来解释. 二、底物浓度对酶促反应的影响 1、在酶浓度一定、pH 、温度等条件不变的情况下,底物浓度与酶促反应速度的关系为: 2、解释:1913 Michaelis 和Menten 根据中间产物学说提出了单底物酶促反应的快速平衡模型,也叫米-曼氏模型,并推出了能解释酶促反应速度与[S]的数学关系式——米-曼方程。 1925年Briggs 和Haldane 提出了稳态理论,对米曼方程进行了修正 (1)Michaelis 和Menten 在建立米-曼模型和推导速率方程时作了5点假设: (2)1925年Briggs (布里格斯)和Haldane (霍尔丹) 将平衡态修改为稳态,仍保留米-曼氏假设中的后3点假设。 稳态是指反应进行一段时间后,反应体系中[ES]由零增加到一定数值后,尽管在 一定时间内,[S]和[P]在不断变化,ES 不断生成和分解,但ES 的生成和分解速度相等, [ES]的保持不变的反应状态叫稳态,当反应达到稳态时反应体系中[ES]不变。既在稳态时中间产物的生成速度等于分解速度。 根据这两种模型推导出的速率方程形式是一样的,叫米-曼方程 E + S ES E +P
实验 酶促反应动力学 ————蔗糖酶米氏常数的测 【目的要求】 1.了解酶促动力学研究的范围。 2.以蔗糖酶为例,掌握测定米氏常数(Km) 【实验原理】 在酶促反应中,当反应体系的温度、pH 和酶浓度恒定时,反应初速度(v)则随底物 浓度[S]的增加而加速,最后达到极限,称为最大反应速度(v)。Michaelis 和Menten 根据反应速度与底物浓度的这种关系,推导出如下方程: ] [] [S k S V v m += 此式称为米氏方程,式中Km 称为米氏常数,按此方程,可用作图法求出Km 。方法有: 1.以v[S]作图 由米氏方程可知,v=V /2时,Km =[S]即米氏常数值等于反应速度达到最大反应速度一半时所需底物浓度。因此,可测定一系列不同底物浓度的反应速度v,以v 对[S]作图。当v =V /2时,其相应底物浓度即为Km 。 2.以1/v 对1/[S]作图 取米氏方程的倒数式: V S V k v m 1][11+?= 以1/v 对1/[S]作图可得一直线,其斜率为Km /V ,截距为1/V 。若将直线延长与横轴相交,则该交点在数值上等于—l /Km 。 本实验以蔗糖为底物.利用一定量蔗糖酶水解不同浓度蔗糖所形成的产物(葡萄糖和果糖)的量来计算蔗糖酶的Km 值。葡萄糖和果糖能与3,5—二硝基水杨酸试剂反应,生成桔红色化合物,可于520nm 处比色测定之。 【试验材料】 1.试剂 (1)标准葡萄糖溶液:准确称取100mg 葡萄糖溶于少量饱和的苯甲酸溶液%),再转移到100ml
容量瓶中,用饱和苯甲酸溶液稀释到刻度,混匀,即得浓度为1mg/m1的标准葡萄糖溶液。冰箱贮藏可长期保存; (2)的L醋酸缓冲液:取lmol/L醋酸钠溶液43m1及lmol/L醋酸溶液57m1,稀释至1000m1即得; (3)的10%蔗糖溶液:准确取l0g蔗糖溶于少量的/L醋酸缓冲液,转移到100ml容量瓶中,用同样缓冲液稀释到刻度备用; (4)3,5—二硝基水杨酸试剂:溶液I:%NaOH溶液300m1,1%3,5一二硝基水杨酸溶液880m1及酒石酸钾钠(KNaC4O6·4H20)255g三者一起混合均匀。 溶液Ⅱ:取结晶酚10g及lo%NaOH溶液22m1,加蒸馏水稀释成100ml,混匀。 溶液Ⅲ:取溶于64ml溶液n中。 将溶液皿和溶液I混合,激烈振摇混匀,即得3,5—二硝基水杨酸溶液,放置一周后备用。 (5)酵母蔗糖酶溶液:称取鲜酵母l0g于研钵中,加少量细砂及10一15ml蒸馏水研磨。磨细后置冰箱中,过滤,滤液加2—3倍体积冷丙酮,搅拌均匀后离心,沉淀用丙酮洗两次,真空干燥得固体粉末状酶,再溶于100ml蒸馏水,即得酶溶液。若有不溶物可用离心法除去。该酶液活力以6—12单位为佳。蔗糖酶活力单位的定义为:在一定条件下反应5min,每产生lmg葡萄糖所需要的酶量。备用。 2.器材 (1)100m1三角烧瓶2只; (2)研钵1只; (3)50m1及100m1容量瓶各1只; (4)离心机1台(4000rpm); (5)糖管8支; (6)恒温水浴1台; (7)吸量管:×2支; (8)秒表1只; (9)72l型分光光度计1台。 【实验方法】 1.标准曲线的绘制 取干净糖管6支,如下表所示添加试剂。 调零点,于520nm处测定吸光度。以葡萄糖含量为横坐标,以吸光度为纵坐标作图。2.根据活力选择酶浓度 将10%蔗糖溶液稀释成的%的溶液,取此溶液5m1于试管中,共加两管。 将两管同时置于25℃水浴中保温5min,然后向管中加入蔗糖酶溶液,立即混匀, 同时用秒表计时,准确反应5min后,立即加入LNaOH溶液终止酶反应。另 一管先加入溶液,再加入蔗糖酶溶液(此为对照管)。 取干净糖管3支,第l、2管分别加入上述反应液各及水各,第3管加蒸馏水,然后各
§2.8 酶促反应动力学(9章P351) (一)底物浓度对酶反应速率的影响 用反应初速度v对底物浓度[S]作图得P355 图9-6。 曲线分以下几段: (1)OA段:反应底物浓度较低时v与[S]成正比,表现为一级反应, v = k[S]。 根据酶底物中间络合物学说,酶催化反应时,首先和底物结合生成中间 复合物ES,然后再生成产物P,并释放出E。 E + S = ES →P + E OA段上,底物浓度小,酶未被底物饱和,有剩余酶,反应速率取决于ES浓度,与[S]呈线性关系,v正比于[S]。 (2)AB段:反应速度不再按正比升高,表现为混合级反应。此时酶渐渐为底物饱和,[E S]慢慢增加,v也慢慢增加,为分数级反应。 (3)BC段:反应速度趋于V max,为零级反应,酶促反应表现出饱和现象。 此时底物过量[S]>[E], [E]已全部转为[E S]而恒定,因此反应速率也恒 定,为最大反应速率,V max为[E]所决定。 非催化反应无此饱和现象。 酶与底物形成中间复合物已得到实验证实。 (二)酶促反应力学方程式 (1)米氏方程推导 1913年Michaelis和Menten提出并推导出表示[S]与v之间定量关系的米氏方程 V max[S] V = K m + [S] Km:米氏常数,物理意义为反应速率为最大速率V max一半时底物的浓度,单位与底物浓度同。 推导:酶促反应分两步进行。 k1k3 E + S ES →P + E k2 v = k3 [ES] 一般k3为限速步骤v = k3 [ES] …① 1.[ES] 生成速率: d[ES]/dt = k1([E] - [ES]) [S] 2.[E S]分解速率: -d[ES] / dt = k2 [ES] + k3 [ES] = (k2 + k3) [ES] 3.稳态下[ES]不变,ES生成速率和分解速率相等: k1 ([E]- [ES]) [S] = (k2+k3) [ES] 4.引入K m:令K m = k2+k3 / k1 代入K m = ([E]- [ES]) [S] / [ES] , K m [ES] = [E] [S]- [S] [ES], [ES] (K m + S) = [E] [S], [ES] = [E] [S] / K m+[S], 5.代入①式:v = k3 [ES] = k3 [E] [S] / K m + [S] …② 6.引入V max:为所有酶都被底物饱和时的反应速率,即此时[E]= [ES]
2酶促反应动力学
2 酶促反应动力学 教学基本内容: 酶促反应的特点;单底物酶促反应动力学方程(米氏方程)的推导;抑制剂对酶促反应的影响,竞争性抑制和非竞争性抑制酶促反应动力学方程的推导;产物抑制、底物抑制的概念,产物抑制和底物抑制酶促反应动力学方程的推导;多底物酶促反应的机制,双底物酶促反应动力学的推导;固定化酶的概念,常见的酶的固定化方法,固定化对酶性质的影响及固定化对酶促反应的影响,外扩散过程和内扩散过程分析;酶的失活动力学。 2.1 酶促反应动力学的特点 2.2 均相酶促反应动力学 2.2.1 酶促反应动力学基础 2.2.2 单底物酶促反应动力学 2.2.3抑制剂对酶促反应速率的影响 2.2.4多底物酶促反应动力学 2.3 固定化酶促反应动力学 2.4 酶的失活动力学 授课重点: 1. 酶的应用研究与经典酶学研究的联系与区别 2. 米氏方程。 3 竞争性抑制酶促反应动力学方程。 4. 非竞争性抑制酶促反应动力学方程。 5. 产物抑制酶促反应动力学方程。 6. 底物抑制酶促反应动力学方程。 7. 双底物酶促反应动力学方程。 8. 外扩散对固定化酶促反应动力学的影响,Da准数的概念。 9. 内扩散对固定化酶促反应动力学的影响,φ准数的概念。 10. 酶的失活动力学。 难点: 1. 采用稳态法和快速平衡法建立酶促反应动力学方程。 2. 固定化对酶促反应的影响,五大效应(分子构象的改变、位阻效应、微扰效应、分配效应及扩散效应)的区分。
3. 内扩散过程分析,涉及到对微元单位进行物料衡算和二阶微分方程的求解、无因次变换、解析解与数值解等问题。 4.温度对酶促反应速率和酶的失活速率的双重影响,最适温度的概念。温度和时间对酶失活的影响。 本章主要教学要求: 1. 掌握稳态法和快速平衡法推导酶促反应动力学方程。 2. 了解酶的固定化方法。理解固定化对酶促反应速率的影响。掌握Da准数的概念及φ准数的概念,理解外扩散和内扩散对酶促反应速率的影响。 3. 了解酶的一步失活模型与多步失活模型,反应过程中底物对酶稳定性的影响。