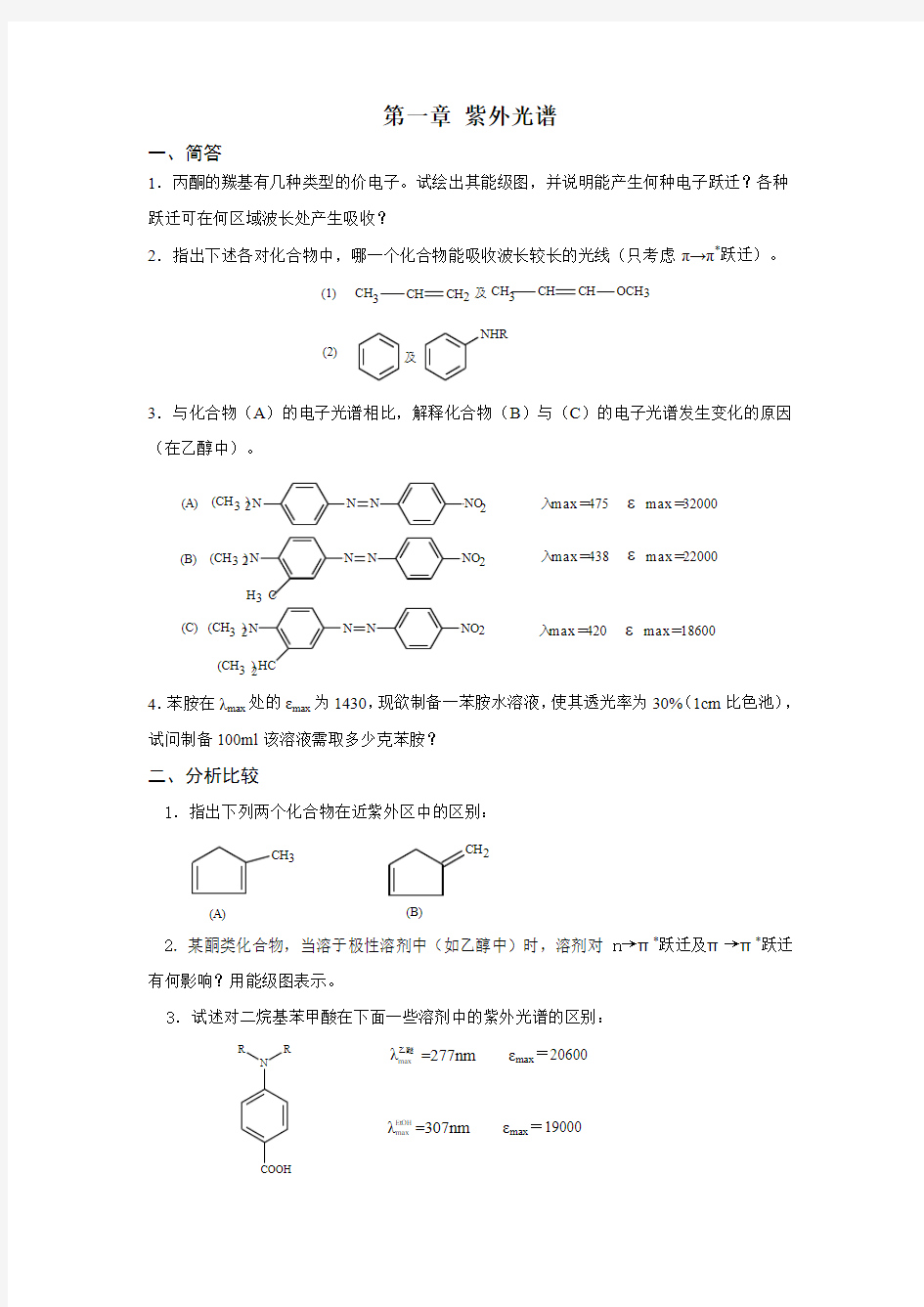

第一章 紫外光谱
一、简答
1.丙酮的羰基有几种类型的价电子。试绘出其能级图,并说明能产生何种电子跃迁?各种跃迁可在何区域波长处产生吸收?
2.指出下述各对化合物中,哪一个化合物能吸收波长较长的光线(只考虑π→π*跃迁)。
(2)
(1)
及
NHR
3
CH
CH
OCH 3
CH 及CH 3
CH CH
2
3.与化合物(A )的电子光谱相比,解释化合物(B )与(C )的电子光谱发生变化的原因(在乙醇中)。
(C)(B)
(A)
入max =420 εmax =18600
入max =438 εmax =22000
入max =475 εmax =320003
N N
N
NO HC
32(CH )2
N N
N
NO H C 32(CH )2
2
32(CH )(CH )23N
N
N
NO
4.苯胺在λmax 处的εmax 为1430,现欲制备一苯胺水溶液,使其透光率为30%(1cm 比色池),试问制备100ml 该溶液需取多少克苯胺?
二、分析比较
1.指出下列两个化合物在近紫外区中的区别:
CH CH 3
2
(A)(B)
2.某酮类化合物,当溶于极性溶剂中(如乙醇中)时,溶剂对n →π*
跃迁及π→π*
跃迁有何影响?用能级图表示。
3.试述对二烷基苯甲酸在下面一些溶剂中的紫外光谱的区别:
λ乙醚
max =277nm εmax =20600
λEtOH max =307nm εmax =19000
N
R
R
COOH
λHCl max =307nm εmax =970
三、试回答下列各问题
1.某酮类化合物λhexane
max =305nm ,其
λEtOH max =307nm,试问,该吸收是由n→π*跃迁还是π→π*
跃
迁引起的?
2. 1,1二苯乙烯(A )在环己烷中的UV 光谱与蒽(B )的UV 光谱有相当大的区别。在浓硫酸中这两个化合物UV 光谱非常相似,见表1-5,而在稀硫酸中又与环己烷中的UV 光谱相同,试问在浓硫酸中这两个化合物发生了什么变化?
表1-1 化合物(A )和(B )在不同溶剂中的λma
四.计算下述化合物的λmax :
1. 计算下列化合物的λmax :
2.计算全反式西红柿烯(结构如下)的λmax 及εmax :
3.计算一叶萩碱在乙醇中的λmax :
N
O
O
4.计算下列化合物的λmax :
(D )
(C )
(B )
(A )
2NH COOH
3
OH COCH O 3
3
O
OCH CH O
五、结构判定
1.由某挥发油中分得一种成分,其UVλhexane max =268nm,由其它方法初步确定该化合物的结构可能为A 或
B ,试问可否用UV 光谱做出判断?
(A)(B)
2. 一化合物初步推断其结构不是A 就是B ,经测定UV λEtOH max =352nm,试问其结构为何?
O O
(A)
(B)
3. 2-(环己-1-烯基)-2-丙醇在硫酸存在下加热处理,得到主要产物的分子式为C 9H 14,产物经纯化,测紫外光谱λmax =242nm (εmax =10100),推断这个主要产物的结构,并讨论其反应过程。
C
CH OH
CH 33
4. 胆甾烷-3-酮(结构如下)的UV λmax =286nm (lgεmax =1.36),而2α-氯取代为λmax =279nm (lgεmax =1.60),2β-氯取代物λmax =299.5nm (lgεmax =1.53)。试说明为什么2α-氯取代向紫位移?
第二章 红外光谱
一.分析
1. 指出下列各种振动形式,哪些是红外活性振动,(Δμ≠0),哪些是红外非活性振动(Δμ=0)。
分子 振动形式 (1) CH 3–CH 3 νC —C (2) CH 3–CCl 3 ν C —C (3) O ═ C ═ O νS ,CO2 (4) SO 2 νS , SO2 (5) CH 2═CH 2 νS , C ═ C (6)
CH 2═CH—CHO νS , C ═ C
二、回答下列问题:
1. C —H ,C —Cl 键的伸缩振动峰何者要相对强一些?为什么?
2. νC═O 与νC═C 都在6.0μm 区域附近。试问峰强有何区别?意义何在?
三、分析比较
1. 试将C═O 键的吸收峰按波数高低顺序排列,并加以解释。
(1)CH 3COCH 3 CH 3COOH CH 3COOCH 3 CH 3CONH 2 CH 3COCl CH 3CHO
(A ) (B ) (C ) (D ) (E ) (F )
(2) (A ) (B ) (C )
(D ) (E )
2.能否用稀释法将化合物(A )、(B )加以区分,试加以解释。
(A ) (B )
四.结构分析
1. 用红外光谱法区别下列化合物。
O
CH 3C
O CH 3C
CH 3
O CH 3C
CH 3
CH 3
CH O
O
OH
O O OH O CH 3C
NH 2
O CH 3C
NO 2
(1)
(2)
(A ) (B ) (A ) (B ) (3) (4)
(A ) (B ) (A ) (B )
2.某化合物在4000~1300cm –1区间的红外吸收光谱如下图所示,问此化合物的结构是(A)还是(B)?
(A) (B)
3.用IR 光谱(下图)表示的化合物C 8H 9O 2N 是下面哪一种?
C 8H 9O 2N 的红外光谱
O COOC 2H 5
O
COOC 2H 5COCH 3
COCH 3
CH 3
CH 3CH 3
O O
Me
O O
Me
OH
C O
CH 3
OH
C CH 3
O
HO
C N
C O
NH 2
NHCOCH 3OH
NH 2COOCH 3
CONH 2
OCH 3
CH 2NH 2COOH
NHCH 3COOH
4.某化合物初步推测为Ⅰ或Ⅱ或Ⅲ。试根据其部分红外光谱作出判断。
未知物的红外光谱
五、简答
1. 1–丙烯与1–辛烯的IR 光谱何处有明显区别?
2.下列两个化合物,哪个化合物的IR 光谱中有两个 C═ O 吸收峰?
(A) (B)
3. 某一天然产物结构不是(A)就是(B),在IR 光谱中,只有2870cm –1峰和926cm –1强吸收,而无2960cm –1峰,试判断该天然产物的正确结构?并说明理由。
(A) (B)
4. 用其它光谱确定某一苷类化合物的结构不是A 就是B ,在IR 光谱出现890cm –1弱至中强吸收试确定其可能结构是哪一个,为什么?
(A ) (B ) 六、结构解析.
O
O
OH
OH
O
O
OH
OH
HO
O
O
OC H 3
OC H 3
HO
O
O
O
O
O
OH
OH OC H 3
H OH O
OH
OH H
OC H 3OH OH
1. 某未知物1分子式为C8H7N,低温下为固体,熔点29℃,其IR光谱图见下图试解析其结构。
未知物1的红外光谱
2.某化合物2分子式为C6H12O,IR光谱见图,试推断其可能结构式,并说明1400~1360cm–1区域的特征。
某化合物2(C6H12O)的红外光谱
第三章核磁共振
一、简答
1.乙酸乙酯中的三种类型氢核电子屏蔽效应相同否?若发生核磁共振,共振峰应当怎么排列? 值何者最大?何者较小?为什么?
CH3—COO—CH2—CH3
(a)(b)(c)
2.在α-蒎烯中,标出的三种氢核为何有不同的化学位移值?
3. 醋酸在用惰性溶剂稀释时,其酸性氢核的共振峰将移向何处?
4.CHCl3可与苯环上的π电子按下列形式形成氢键,试问,CHCl3上的氢核共振信号将移向何处?
CCl
3
H
二、比较题
1. 标记的氢核可预期在1H-NMR的什么区域有吸收?
⑴
N
S
(a)H CH
3
(b)
CH
3
(c)
⑵
2
(a)
)
⑶⑷22C
O
)))
⑸
C
O
)
)
)
⑹
CH CH C
O
⑺
Cl CH C
O
O
23⑻2
)CH
3
C
O
N
CH
3
3⑽
C C H
⑾
Cl CH2CH2OH
(a)(b)⑿
C H
2
)
)
⑼
(a)1.63
(b)1.29
(c)0.85
CH3
H3C
CH3(a)
(b)
(c)
〔13〕
P
CH 3C 6H
NH
C
O
3 ⒁ N
H
O
O
Br
2. 下列化合物中,Ha 有几重峰?
Hc
Ha
Hb
N H 2Hb
NH 2
3. 以下为同一化合物的两种表达方式:
H H H H Cl H H H 23X
3N
4
1
S 77A
2
3X 3N
4
1
Cl H H H H
试解释为何J 1, 2 = 0~2Hz, J 2, 3N = 8~10Hz, J 3X, 2 = 3~5Hz, J 7A, 7S = 9~11Hz?另外,试推测J 2,
7A 与
J 2, 7S 中何者数值较大,为什么?
4. 已知1,2-二卤环己烷中的J ab =10Hz ,试问该化合物是顺式还是反式?其优势构象将是下列三者中的哪一种?
5.下列图谱为AB 系统氢核给出的信号还是AX 系统中的X 氢核给出的信号,为什么?
三、结构推定
1.试根据给出条件推测下列化合物的结构。
②
图3-2
图3-3
④
图3-4
2. 下列化合物各有几组磁不等同碳核,在噪音去偶谱上将出现几个13C 信号?试标出每个信
号的重峰数。
① 苯 ② 甲苯 ③ 萘 ④
⑤
3.一化合物,分子式为C 6H 8,高度对称,在噪音去偶谱(COM )上只有两个信号,在偏共振去耦谱(OFR )上只有一个三重峰(t )及一个二重峰(d),试写出其结构。
四、信号归属
1.试按给出结构对图3-4上各个信号做出确切的归属。
CH 3
C
H 3O
图3-5
2.按给出条件推测下列化合物的结构(括号内为峰的相对高度及重峰数)。
①C13H12O, 76.9(24, d),128.3 (99, d), 127.4 (57, d), 129.3 (87, d ), 144.7 (12, s)
②C9H10O, 63.1 (49, t), 126.4 (98, ?), 127.5 (44, ?), 128.5 (87, ?),128.7 (60, ?),130.7 (42,
d),136.8 (11, s)
③C5H6O4, 38.2 (100, t),128.3 (84, t),136.1 (99, s),168.2 (77, s),172.7 (78, s)
3.试按图3-6及条件,写出未知化合物的结构,并通过计算化学位移值进行复核。
图3-6
第四章质谱
一、简答题
1. m/z 200的离子,在分辨率为20,000的质谱仪上,可以与相差多少质量的离子分开?
2. 根据下面给出的质谱图,求出化合物的分子式,并推导其可能的结构。
3. 甲基环己烷的EIMS如下。归属下列信息:
a. 分子离子
b. 基峰
c. M+.-37碎片离子
4.一个未知物质的MS呈现强的[M]=79,如果这个化合物含氮或者含氧有多少可能的分子式?指出每个分子的不饱和度。
5. 从一个低分辨质谱中能够找出多少数据来区分C6H13Cl和C3H5Br?
6. 从一个高分辨质谱中能够找出多少数据来区分C6H12O和C5H8O2?
二、分析题
1. 预测下列裂解的结构:
O
OH
N
Cl
O
O
-R
-HCl
-R
?
?
?
?
?
?
(a)
(b)
(c)
(d)(e)
(f)
2. 环己烯的EIMS 如下所示,
(a) 简单的单键σ 裂解能解释m/z 的基峰吗? (b) m/z 54的碎片是由于双键的裂解产生的吗?
3. 3-甲基-3-庚醇有三种可能的α 裂解途径。在下面的EI 质谱中找到他们并指出他们的相对多少。
4. 薄荷酮和3D 代薄荷酮的EI 质谱如下所示。对比这两张谱图可以看出m/z 154,139和112的来源。
(a ) 对于用D 取代后这些峰的移位给出解释。
(b)预测以下两种薄荷酮的m/z154,139和112离子峰3D取代的位移情况
D3
三、区分化合物
1. 如何使用质谱区分下面的几对物质?
(a)丙基环己烷和1,2,4-三甲基环己烷
(b)
VS
(c)C18H14Cl4和C8H6Br2
(d)
N
OMe
VS
N
O
四、结构推断
1.两个同分异构的醇的分子式为C4H10O(MW 74)他们有十分不同的EIMS图并且有一个几乎看不见的分子离子峰m/z 74 。根据给出的数据确定这些醇是伯醇、仲醇还是叔醇:一个醇的基峰m/z 45,另一个m/z 31,两者都有m/z 56。
17. -二酮的结构如图所示,在EI质谱中重要的离子峰有m/z 176, 161(15%) 和147(65%)。推断碎片离子的结构。
O O
第五章综合解析
1.某化合物的谱图如5-1所示,试推断该化合物的化学结构。
图5-1 未知化合物的IR 、1H-NMR 、13C-NMR 、MS 图谱
2. 某化合物的谱图如5-2所示,试推断该化合物的化学结构。
图5-2 未知化合物的IR、1H-NMR、13C-NMR、MS图谱3.某一未知化合物的谱图如5-3所示,试推断该化合物的化学结构。
图5-3 未知化合物的IR 、1H-NMR 、13C-NMR 、MS 图谱
4. 某化合物的谱图如5-7所示,试推断该化合物的化学结构。
有机波谱分析习题 第一章电子辐射基础 (一)判断题 1.现代分析化学的任务是测定物质的含量。( ) 2.测定某有机化合物中C、H、O、N元素含量的方法属于定性分析。( ) 3.测定某有机化合物中是否含有羰基属于有机结构分析。( ) 4.利用物质分子吸收光或电磁辐射的性质,建立起来的分析方法属于吸收光谱分析。( ) 5.物质被激发后,利用物质跃迁至低能态或基态时发光的性质建立起来的分析方法属于发射光谱分析。( ) 6.根据Franck-condon原理,在电子能级发生跃迁时,必然伴随振动能级和转动能级的变化。( ) 7.紫外吸收光谱、红外吸收光谱、核磁共振波谱和质谱是有机结构分析的四种主要的有机光波谱分析方法,合称为四大谱。( ) 8.电磁辐射的波长越长,能量越大。( ) 9.有机波谱分析方法和仪器分析方法的灵敏度和准确度都要比化学分析法高得多。( ) 10.一般来讲,分子光谱远比原子光谱复杂,原子光谱通常为线状光谱,而分子光谱为带状光谱。( ) 11.吸收定律偏离线性完全是由于仪器因素引起的。( ) 12.电子能级间隔越小,跃迁时吸收光子的频率越大。( ) 13.分子光谱是由于电子的发射而产生的。( ) 14.分子荧光也叫二次光,都属吸收光谱的畴。( ) 15.ICP可用于测定F、Cl、Br、C、H、N、O、S等非金属元素。( ) (一)判断题答案 1.×2.×3.√4.√5.√6.√7.√8.×9.×l0.√11.×l2.×13.×l4.×l5.× (二)单选题 1.光或电磁辐射的二象性是指( )。 A.电磁辐射是由电矢量和磁矢量组成;B.电磁辐射具有波动性和电磁性; C.电磁辐射具有微粒性和光电效应;D.电磁辐射具有波动性和微粒性。 2.光量子的能量与电磁辐射的哪一个物理量成正比?( ) A.频率;B.波长;C.周期;D.强度 3.可见光区、紫外光区、红外光区、无线电波四个电磁波区域中,能量最大和最小的区域分别为( )。 A.紫外光区和无线电波区;B.紫外光区和红外光区; C。可见光区和无线电波区;D.可见光区和红外光区。 4.频率为l×107MHz的电磁辐射是处在哪个光区?( ) A.红外光区;B.紫外光区;C.无线电波区;D.可见光区。 5.有机化合物成键电子的能级间隔越小,受激跃迁时吸收电磁辐射的( )。 A.能量越大;B.波数越大;C.波长越长;D.频率越高。 6.分析化学发生第二次变革的年代是( )。 A.20世纪初;B.20世纪20年代;C.20世纪40年代;D.20世纪末。
名词解析 发色团(chromophoric groups):分子结构中含有π电子的基团称为发色团,它们能产生π→π*和n→π*跃迁从而你呢个在紫外可见光范围内吸收。 助色团(auxochrome):含有非成键n电子的杂原子饱和基团本身不吸收辐射,但当它们与生色团或饱和烃相连时能使该生色团的吸收峰向长波长移动并增强其强度的基团,如羟基、胺基和卤素等。 红移(red shift):由于化合物结构发生改变,如发生共轭作用引入助色团及溶剂改变等,使吸收峰向长波方向移动。 蓝移(blue shift):化合物结构改变时,或受溶剂的影响使吸收峰向短波方向移动。 增色效应(hyperchromic effect):使吸收强度增加的作用。 减色效应(hypochromic effect):使吸收强度减弱的作用。 吸收带:跃迁类型相同的吸收峰。 指纹区(fingerprint region):红外光谱上的低频区通常称指纹区。当分子结构稍有不同时,该区的吸收就有细微的差异,并显示出分子特征,反映化合物结构上的细微结构差异。这种情况就像人的指纹一样,因此称为指纹区。指纹区对于指认结构类似的化合物很有帮助,而且可以作为化合物存在某种基团的旁证。但该区中各种官能团的特征频率不具有鲜明的特征性。 共轭效应 (conjugated effect):又称离域效应,是指由于共轭π键的形成而引起分子性质的改变的效应。 诱导效应(Inductive Effects):一些极性共价键,随着取代基电负性不同,电子云密度发生变化,引起键的振动谱带位移,称为诱导效应。 核磁共振:原子核的磁共振现象,只有当把原子核置于外加磁场中并满足一定外在条件时才能产生。 化学位移:将待测氢核共振峰所在位置与某基准物氢核共振峰所在位置进行比较,其相对距离称为化学位移。 弛豫:通过无辐射的释放能量的途径核由高能态向低能态的过程。 分子离子:有机质谱分析中,化合物分子失去一个电子形成的离子。 基峰:质谱图中表现为最高丰度离子的峰。 自旋偶合:是磁性核与邻近磁性核之间的相互作用。是成键电子间接传递的,不影响磁性核的化学位移。 麦氏重排(McLafferty rearrangement):具有不饱和官能团 C=X(X为O、S、N、C 等)及其γ-H原子结构的化合物,γ-H原子可以通过六元环空间排列的过渡态,向缺电子(C=X+ )的部位转移,发生γ-H的断裂,同时伴随 C=X的β键断裂,这种断裂称为麦氏重排。 自旋偶合:是磁性核与邻近磁性核之间的相互作用。是成键电子间接传递的,不影响磁性核的化学位移。 自旋裂分:因自旋偶合而引起的谱线增多现象称为自旋裂分。 1.紫外光谱的应用 (1).主要用于判断结构中的共轭系统、结构骨架(如香豆素、黄酮等) (2).确定未知化合物是否含有与某一已知化合物相同的共轭体系。 (3).可以确定未知结构中的共轭结构单元。 (4).确定构型或构象 (5).测定互变异构现象 2.分析紫外光谱的几个经验规律 (1).在200~800nm区间无吸收峰,结构无共轭双键。 (2).220~250nm,强吸收(max在104~2104之间),有共轭不饱和键(共轭二烯,,-不饱和醛、酮)
有机波谱分析知识点
名词解析 发色团(chromophoric groups):分子结构中含有π电子的基团称为发色团,它们能产生π→π*和n→π*跃迁从而你呢个在紫外可见光范围内吸收。 助色团(auxochrome):含有非成键n电子的杂原子饱和基团本身不吸收辐射,但当它们与生色团或饱和烃相连时能使该生色团的吸收峰向长波长移动并增强其强度的基团,如羟基、胺基和卤素等。 红移(red shift):由于化合物结构发生改变,如发生共轭作用引入助色团及溶剂改变等,使吸收峰向长波方向移动。 蓝移(blue shift):化合物结构改变时,或受溶剂的影响使吸收峰向短波方向移动。 增色效应(hyperchromic effect):使吸收强度增加的作用。 减色效应(hypochromic effect):使吸收强度减弱的作用。 吸收带:跃迁类型相同的吸收峰。 指纹区(fingerprint region):红外光谱上的低频区通常称指纹区。当分子结构稍有不同时,该区的吸收就有细微的差异,并显示出分子特征,反映化合物结构上的细微结构差异。这种情况就像人的指纹一样,因此称为指纹区。指纹区对于指认结构类似的化合物很有帮助,而且可以作为化合物存在某种基团的旁证。但该区中各种官能团的特征频率不具有鲜明的特征性。 共轭效应 (conjugated effect):又称离域效应,是指由于共轭π键的形成而引起分子性质的改变的效应。 诱导效应(Inductive Effects):一些极性共价键,随着取代基电负性不同,电子云密度发生变化,引起键的振动谱带位移,称为诱导效应。 核磁共振:原子核的磁共振现象,只有当把原子核置于外加磁场中并满足一定外在条件时才能产生。 化学位移:将待测氢核共振峰所在位置与某基准物氢核共振峰所在位置进行比较,其相对距离称为化学位移。 弛豫:通过无辐射的释放能量的途径核由高能态向低能态的过程。 分子离子:有机质谱分析中,化合物分子失去一个电子形成的离子。 基峰:质谱图中表现为最高丰度离子的峰。 自旋偶合:是磁性核与邻近磁性核之间的相互作用。是成键电子间接传递的,不影响磁性核的化学位移。 麦氏重排(McLafferty rearrangement):具有不饱和官能团 C=X(X为O、S、N、C等)及其γ-H原子结构的化合物,γ-H原子可以通过六元环空间排列的过渡态,向缺电子(C=X+ )的部位转移,发生γ-H的断裂,同时伴随 C=X的β键断裂,这种断裂称为麦氏重排。 自旋偶合:是磁性核与邻近磁性核之间的相互作用。是成键电子间接传递的,不影响磁性核的化学位移。 自旋裂分:因自旋偶合而引起的谱线增多现象称为自旋裂分。 1.紫外光谱的应用 (1).主要用于判断结构中的共轭系统、结构骨架(如香豆素、黄酮等) (2).确定未知化合物是否含有与某一已知化合物相同的共轭体系。 (3).可以确定未知结构中的共轭结构单元。 (4).确定构型或构象 (5).测定互变异构现象 2.分析紫外光谱的几个经验规律 (1).在200~800nm区间无吸收峰,结构无共轭双键。
第一章质谱习题 1、有机质谱图的表示方法有哪些是否谱图中质量数最大的峰就是分子离子峰,为什么 2、以单聚焦质谱仪为例,说明质谱仪的组成,各主要部件的作用及原理。 3、有机质谱的分析原理及其能提供的信息是什么 4、有机化合物在离子源中有可能形成哪些类型的离子从这些离子的质谱峰中可以得到一些什么信息 5、同位素峰的特点是什么如何在谱图中识别同位素峰 6、谱图解析的一般原则是什么 7.初步推断某一酯类(M=116)的结构可能为A或B或C,质谱图上m/z 87、m/z 59、m/z 57、m/z29处均有离子峰,试问该化合物的结构为何 (A)(B) (C) 8.下列化合物哪些能发生McLafferty重排 9.下列化合物哪些能发生RDA重排 10.某化合物的紫外光谱:262nm(15);红外光谱:3330~2500cm-1间有强宽吸收,1715 cm-1处有强宽吸收;核磁共振氢谱:δ处为单质子单峰,δ处为四质子宽单峰,δ处为三质子单峰,质谱如
图所示。参照同位素峰强比及元素分析结果,分子式为C5H8O3,试推测其结构式。 部分习题参考答案 1、表示方法有质谱图和质谱表格。质量分析器出来的离子流经过计算机处理,给出质谱图和质谱数据,纵坐标为离子流的相对强度(相对丰度),通常最强的峰称为基峰,其强度定为100%,其余的峰以基峰为基础确定其相对强度;横坐标为质荷比,一条直线代表一个峰。也可以质谱表格的形式给出质谱数据。 最大的质荷比很可能是分子离子峰。但是分子离子如果不稳定,在质谱上就不出现分子离子峰。根据氮规则和分子离子峰与邻近峰的质量差是否合理来判断。 2、质谱仪的组成:进样系统,离子源,质量分析器,检测器,数据处理系统和真空系统。 进样系统:在不破坏真空度的情况下,使样品进入离子源。气体可通过储气器进入离子源;易挥发的液体,
第七章 有机化合物的波谱分析 (一) 概述 研究或鉴定一个有机化合物的结构,需对该化合物进行结构表征。其基本程序如下: 分离提纯→物理常数测定→元素分析→确定分子式→确定其可能的构造式(结构表征)。(参见P11-12) (1) 结构表征的方法 传统方法:(化学法) ①元素定性、定量分析及相对分子质量测定分子式; ②官能团试验及衍生物制备分子中所含官能团及部分结构片断; ③将部分结构片断拼凑完整结构; ④查阅文献,对照标准样,验证分析结果。 特点:需要较多试样(半微量分析,用样量为10-100mg ),大量的时间(吗啡碱,1805- 1952年),熟练的实验技巧,高超的智慧和坚韧不拔的精神。 缺点:①分子有时重排,导致错误结论; ②* C 及-C =C -的构型确定困难。 波谱法: ①质谱(最好用元素分析仪验证)分子式; ②各种谱图(UV 、IR 、NMR 、MS )官能团及部分结构片断; ③拼凑完整结构; ④标准谱图确认。 特点:样品用量少(<30mg ),不损坏样品(质谱除外),分析速度快,对*C 及-C =C -的 构型确定比较方便。 光谱法已成为有机结构分析的常规方法。但是化学方法仍不可少,它与光谱法相辅相成,相互补充,互为佐证。 (2) 波谱过程 波谱过程可表示为: 有机分子+电磁波 光谱 分子运动:平动、振动、转动、核外电子运动等 量子化的 每个分子中只能存在一定数量的转? ? (能量变化不 连续) 动、振动、电子跃迁能级
电子跃迁电磁波波长越短,频率越快,能量越高。 200nm400nm 800nm 红外光 微波、 电视波 200-800nm:引起电子运动能级跃迁,得到紫外及可见光谱; 2.5-15μm:引起分子振、转能级跃迁,得到红外光谱; 60-600MHz:核在外加磁场中取向能级跃迁,得到核磁共振谱。 (3) 不饱和度(U) 不饱和度亦称为分子中的环加双键数、缺氢指数、 双键等价值等。其定义为:当一个化合物衍变为相应的烃后,与其同碳的饱和开链烃比较,每缺少2个氢为1个不饱和度。 所以:一个双键的不饱和度为1,一个叁键的不饱和度为2,一个环的不饱和度为1,一个苯环的不饱和度为4。例如: U=2 CH2=CH-COOH CH2=CH-CN U=3 CCH3 O U=5U=2 O-P-O- 3 O U=9 U的计算: -O--CH- -N- -CH2--X-H -S-相当于 、;相当于;相当于。 实际上,O、S并不影响化合物的不饱和度。 例:C8H14U=2 C7H8 U=4
综合谱图解析 1.某未知物分子式为C5H12O,它的质谱、红外光谱以及核磁共振谱如图,它的紫外吸收光谱在200 nm以上没有吸收,试确定该化合物结构。并解释质谱中m/z 57和31的来源。
2?待鉴定的化合物(I )和(II )它们的分子式均为C 8H 12O 4。它们的质谱、红外 光谱和核磁共振谱见图。也测定了它们的紫外吸收光谱数据:(I )入max 223nm , S 4100; (II )入max 219nm 2300,试确定这两个化合物。 未之物(I )的谱图 127 100-1 - 10 10 曲 凹 M 亠亲) ? 册 -J P 科 J S W
未之物(II)的谱图
3、某未知物的分子式为C 9H 10O 2,紫外光谱数据表明:该物入max 在26 4、262 I? 257、252nm (&maxIOI 、158、147、194、153);红外、核磁数据如图所示,试 0 LOtMio. sopoiggg 翌g 嚴效 却31卿]卿丄电00 uyo iw mo 推断其结构,并说明理 由。 ! \ \ 「 1 CCh 1 I J —' 1 1 _■ ____ __ _ ,B . _ ,- T J.亠」亠亠」亠 | * --------------- U 5>0 4. 0 d/ppm
4.某未知物C ii H i6的UV 、IR 、中NMR 、MS 谱图及13C NMR 数据如下,推导 未知物结构。 序号 S c ( ppm ) 碳原子个数 序号 S c ( ppm ) 碳原子个数 1 143.0 1 6 32.0 1 2 128.5 2 7 31.5 1 3 128.0 2 8 22.5 1 4 125.5 1 9 10.0 1 5 36.0 1 MS(E[] 100 so 30D A/tnn 350 血 >0624*68<)2 4 內 OS n 2 2 98765^43211 0SU 'H bMRfCDCI^
《有机化合物波谱解析》教学大纲 适用专业: 化学工程与工艺专业精细化工方向、药用高分子材料方向;药物制剂专业、药物制剂专业天然药物制剂方向; 药学专业、药学专业医院药学方向;制药工程专业。
一、课程性质、目的和任务 有机化合物波谱解析是化学工程与工艺专业精细化工方向、化学工程与工艺专业药用高分子材料方向、药物制剂专业、药物制剂专业天然药物制剂方向;药学专业、药学专业医院药学方向;制药工程专业的必修课和限选课。根据其培养目标和要求,本课程将在学生学习有机化学、分析化学、物理化学等课程的基础上系统讲授紫外光谱(UV)、红外光谱(IR)、核磁共振光谱(NMR)和质谱(MS)这四大光谱的基本原理、特征、规律,以及图谱解析技术,并且介绍这四大光谱解析技术的综合运用。波谱分析法由于其快速、灵敏、准确、重现在有机药物结构分析和鉴定研究中起着重要的作用,已成为新药研究和药物结构分析和鉴定常用的分析工具和重要的分析方法,是上述专业及及方向的学生必须掌握的基本技能。其主要任务就是在学习波谱解析的基本概念、基本理论和基本技能及各类化合物波谱特征的基础上,培养学生识谱、解谱的能力,最终达到确定化合物的结构的目的。 教材:姚新生.有机化合物波谱分析.中国医药科技出版社,2004 习题:以本教研室陈熔、吕华冲老师编写的《波谱解析习题集》为主,教科书里的习题为辅,在讲授完每章内容后布置习题。 二、课程基本要求 1、本课程应结合目前有机化合物和天然药物结构研究的方法和发展趋势使学生意识到:(1)UV、IR、NMR、MS是目前研究有机化合物和天然化物结构不可缺少的主要工具和方法。 (2)掌握有机化合物重要官能团的光谱特征和规律是解析图谱、推测结构的基础。 2、讲授UV、IR、NMR、MS的基本原理、知识和理论;介绍它们的测定方法、图谱的特征以及基本有机化合物重要官能团在四大光谱中的特征及规律;介绍综合解析图谱的一般方法和技巧,要求学生通过学习做到: (1)掌握UV、IR、NMR、MS的基本原理、知识,了解它们的测定方法; (2)熟悉基本有机化合物重要官能团在UV、IR、NMR、MS光谱中的特征及规律; (3)能够根据有机化合物的结构式,初步推测它们的波谱学主要特征(UV、IR、NMR、MS); (4)掌握图谱解析的一般程序和方法; (5)了解标准图谱的应用。
第一章 紫外光谱 一、简答 1.丙酮的羰基有几种类型的价电子。试绘出其能级图,并说明能产生何种电子跃迁?各种跃迁可在何区域波长处产生吸收? 2.指出下述各对化合物中,哪一个化合物能吸收波长较长的光线(只考虑π→π*跃迁)。 (2) (1) 及 NHR 3 CH CH OCH 3 CH 及CH 3 CH CH 2 3.与化合物(A )的电子光谱相比,解释化合物(B )与(C )的电子光谱发生变化的原因(在乙醇中)。 (C)(B) (A) 入max =420 εmax =18600 入max =438 εmax =22000 入max =475 εmax =320003 N N N NO HC 32(CH )2 N N N NO H C 32(CH )2 2 32(CH )(CH )23N N N NO 4.苯胺在λmax 处的εmax 为1430,现欲制备一苯胺水溶液,使其透光率为30%(1cm 比色池),试问制备100ml 该溶液需取多少克苯胺? 二、分析比较 1.指出下列两个化合物在近紫外区中的区别: CH CH 3 2 (A)(B) 2.某酮类化合物,当溶于极性溶剂中(如乙醇中)时,溶剂对n →π* 跃迁及π→π* 跃迁有何影响?用能级图表示。 3.试述对二烷基苯甲酸在下面一些溶剂中的紫外光谱的区别: λ乙醚 max =277nm εmax =20600 λEtOH max =307nm εmax =19000 N R R COOH
λHCl max =307nm εmax =970 三、试回答下列各问题 1.某酮类化合物λhexane max =305nm ,其 λEtOH max =307nm,试问,该吸收是由n→π*跃迁还是π→π* 跃 迁引起的? 2. 1,1二苯乙烯(A )在环己烷中的UV 光谱与蒽(B )的UV 光谱有相当大的区别。在浓硫酸中这两个化合物UV 光谱非常相似,见表1-5,而在稀硫酸中又与环己烷中的UV 光谱相同,试问在浓硫酸中这两个化合物发生了什么变化? 表1-1 化合物(A )和(B )在不同溶剂中的λma 四.计算下述化合物的λmax : 1. 计算下列化合物的λmax : 2.计算全反式西红柿烯(结构如下)的λmax 及εmax : 3.计算一叶萩碱在乙醇中的λmax : N O O 4.计算下列化合物的λmax :
红外“活性”振动:在振动过程中?μ≠0,其吸收带在红外光谱中可见。 红外“非活性”振动:偶极矩不发生改变(?μ=0)的振动,这种振动不吸收红外光,在IR谱中观测不到。 3.自由度:基本振动的数目称为振动自由度。 4.振动偶合效应:当两个或两个以上相同的基团连接在分子中同一个原子上时,其振动吸收带常发生裂分,形成双蜂,这种现象称振动偶合 5.特征频率或特征吸收谱带:某些官能团有比较固定的吸收频率,可以作为鉴定官能团的依据。 6.相关峰:每个官能团都有几种振动方式,能产生红外吸收光谱的每种振动一般产生一个相应的吸收峰。习惯上把这些相互依存又可相互佐证的吸收峰。
7.指纹区:<1333cm-1的频率区域,主要是各种单键(如C-C,C-N,C-O等)的伸缩振动与各 种弯曲振动吸收区。当分子结构稍有不同时,该区的吸收就有细微的差异,并显示出分子特征,反映化合物结构上的细微结构差异。 简答题: ?1.红外光谱的原理:分子吸收红外光引起的振动能级和转动能级跃迁而产生的信号。 (记忆:振、转光谱——红外光谱) ?2.红外光谱的产生条件: 当红外光的频率恰好等于基团的振动频率时,分子能吸收该频率的红外光,即形成IR。 ①振动分为:伸缩振动(键长)、弯曲振动(键角) ②频率:化学键力常数k ③红外光被吸收条件:νIR = ν振动;Δμ振动≠0Δμ越大,吸收越强。 3.红外光谱表示方法: 用仪器按照波数(或波长)记录透射光强度(或吸收光强度)→红外光谱图 横坐标:波数(cm-1)或波长(μ m) 纵坐标:透光率(T/%)或吸光度(A) 7.理论上,每个振动自由度在红外光谱区均产生一个吸收峰,但实际的红外谱图中峰的数目比自由度少? 因为:(1)有偶极矩变化的振动才会产生红外吸收,无瞬间偶极矩变化的振动则不出现红外吸收。 (2)频率完全相同的振动导致峰重叠彼此发生简并。 (3)强宽峰往往要覆盖与它频率相近的弱而窄的吸收峰。 (4)某些振动的吸收强度太弱,以至无法清晰地予以记录。 (5)某些振动的吸收频率超出了记录范围(4000~650cm-1)。 ?8.决定峰强的因素 ①强度与分子振动的对称性:对称性↑→偶极矩变化↓→强度↓ ②强度与基团极性:极性↑→偶极矩变化↑→强度↑ ③强度与分子振动能级跃迁几率:跃迁几率↑→强度↑ ④强度与样品浓度:样品浓度↑→强度↑ 9.影响红外峰位、峰强的因素 1.内部因素: (1)电子效应: a.诱导效应:吸电子基团(-I 效应)使吸收峰向高频方向移动(兰移) b.共轭效应:(+C效应)吸收峰向低波数区移动 (2)空间效应: a.空间位阻:阻碍杂化或共轭 向高波数位移。 b.环张力:环张力的增大,ν C=C (3)场效应:原子或原子团的静电场通过空间相互作用 (4)氢键效应:氢键形成,低波数位移 (5)互变异构 (6)振动偶合效应。 2.外部因素:溶剂、浓度
有机化合物波谱解析 复习指导 广东药学院 天然药物化学教研室 200 5年 5 月
目录 第一章紫外光谱… … … … …… … … … … …… 2~4 第二章红外光谱… … … … … … …… ………… 5~11 第三章核磁共振… … … … … … … …… … ……… 12~34 第四章质谱… … … … …… … … … … … … …35~41 第五章综合解析… … … …… … … … … … … …… 42~70
第一章紫外光谱 一、名词解释 1、助色团 2、发色团 3、红移 4、蓝移 5、增色作用 6、减色作用 7、吸收带 二、选择题 1、不是助色团的是: A、-OH B、-Cl C、-SH D、CH3CH2- 2、所需电子能量最小的电子跃迁是: A、σ→σ* B、n →σ* C、π→π* D、n →π* 3、下列说法正确的是: A、饱和烃类在远紫外区有吸收 B、UV吸收无加和性 C、π→π*跃迁的吸收强度比n →σ*跃迁要强10-100倍 D、共轭双键数目越多,吸收峰越向蓝移 4、紫外光谱的峰强用εmax表示,当εmax=5000~10000时,表示峰带: A、很强吸收 B、强吸收 C、中强吸收 D、弱吸收 5、近紫外区的波长为: A、4-200nm B、200-300nm C、200-400nm D、300-400nm 6、紫外光谱中,苯通常有3个吸收带,其中λmax在230~270之间,中心为254nm 的吸收带是: A、R带 B、B带 C、K带 D、E1带 7、紫外-可见光谱的产生是由外层价电子能级跃迁所致,其能级差的大小决定了: A、吸收峰的强度 B、吸收峰的数目 C、吸收峰的位置 D、吸收峰的形状 8、紫外光谱是带状光谱的原因是由于: A、紫外光能量大 B、波长短 C、电子能级差大 D、电子能级跃迁的同时伴随有振动及转动能级跃迁的原因 9、π→π*跃迁的吸收峰在下列哪种溶剂中测量,其最大吸收波长最大: A、水 B、乙醇 C、甲醇 D、正己烷 10、下列化合物中,在近紫外区(200~400nm)无吸收的是:
分析化学考研有机化合物波谱解析真题
————————————————————————————————作者:————————————————————————————————日期: ?
第一章 紫外光谱 一、简答 1.丙酮的羰基有几种类型的价电子。试绘出其能级图,并说明能产生何种电子跃迁?各种跃迁可在何区域波长处产生吸收? 2.指出下述各对化合物中,哪一个化合物能吸收波长较长的光线(只考虑π→π*跃迁)。 (2) (1) 及 NHR 3 CH CH OCH 3 CH 及CH 3 CH CH 2 3.与化合物(A)的电子光谱相比,解释化合物(B)与(C )的电子光谱发生变化的原因(在乙醇中)。 (C)(B) (A)入max =420 εmax =18600 入max =438 εmax =22000 入max =475 εmax =320003 N N N NO HC 32(CH )2 N N N NO H C 32(CH )2 2 32(CH )(CH )23N N N NO 4.苯胺在λmax 处的εmax 为1430,现欲制备一苯胺水溶液,使其透光率为30%(1cm 比色池),试问制备100ml 该溶液需取多少克苯胺? 二、分析比较 1.指出下列两个化合物在近紫外区中的区别: CH CH 3 2 (A)(B) 2.某酮类化合物,当溶于极性溶剂中(如乙醇中)时,溶剂对n →π* 跃迁及π→π* 跃迁有何影响?用能级图表示。 3.试述对二烷基苯甲酸在下面一些溶剂中的紫外光谱的区别: λ乙醚 max =277nm εmax =20600 λEtOH max =307nm εm ax =19000 N R R COOH
中国海洋大学本科生课程大纲 课程属性:公共基础/通识教育/学科基础/专业知识/工作技能,课程性质:必修、选修 一、课程介绍 1.课程描述: 有机波谱解析是应用紫外光谱(UV)、红外光谱(IR)、核磁共振波谱(NMR)、质谱(MS)等现代物理手段研究有机化合物化学结构的一门科学,是有机化合物结构鉴定和分析的常用方法和技术,是药学专业学生需要掌握的基本技能。本课程以紫外吸收光谱、红外吸收光谱、核磁共振波谱和质谱为重点,讲授波谱分析方法的基本原理和应用,使学生掌握综合运用四种主要的有机波谱分析方法,进行有机化合物的结构鉴定,同时了解有机化合物立体结构测定的相关方法。课程的主要内容包括紫外光谱(UV)、红外光谱(IR)、核磁共振波谱(NMR)、质谱(MS)、圆二色谱和旋光谱(CD、ORD)以及谱图的综合解析;同时介绍现代有机波谱的发展趋势和最新进展及其在新药研究和开发方面的应用。 2.设计思路: 本课程讲授波谱分析方法的基本原理和应用,使学生具备利用四大波谱技术进行中等复杂有机化合物结构鉴定的能力。课程内容的选取基于学生具备了相关的有机化学的基础知识和大学物理的相关专业知识。课程内容主要包括五个模块:紫外光谱、红外光谱、核磁共振波谱、质谱、圆二色谱和旋光谱。 - 1 -
1)紫外光谱的主要内容包括紫外吸收光谱的基本原理,紫外吸收光谱与分子结构之间的关系,紫外光谱的解析及应用。 2)红外光谱的主要内容包括红外光谱的基本原理,特征基团与吸收频率,红外光谱的解析及应用。 3)核磁共振波谱的主要内容包括核磁共振的基本原理,化学位移及影响化学位移的因素,自旋偶合与裂分,偶合常数与分子结构的关系,氢谱和碳谱的解析及应用。 4)质谱的主要内容包括质谱的基本原理,分子离子与分子式,有机质谱中的裂解反应,各类有机化合物的质谱,质谱的解析及应用。 5)圆二色谱和旋光谱的主要内容包括圆二色谱和旋光谱的基本原理和方法,CD、ORD与UV之间的关系,CD和ORD的八区律及在有机化合物绝对构型测定中的应用。 通过上述内容的学习,学生能够综合运用四大光谱技术以及立体结构测定的相关方法进行有机化合物的结构解析及应用。 3. 课程与其他课程的关系: 先修课程:《分析化学》、《大学物理III-2》、《有机化学I-2》;后置课程:《天然药物化学》、《药物合成反应》和《药物化学》。学生在学习该课程之前需先修分析化学、有机化学、仪器分析等相关课程,具备相关的有机化学的基础知识和大学物理的相关专业知识。通过《有机波谱解析》课程的学习,有助于学生在后置课程学习中对药物的结构进行分析和确证。 二、课程目标 本课程是药学类学科的基础课程,是药学专业学生需要掌握的基本专业技能。通过本课程的学习,学生能够: 1)了解UV、IR、NMR、MS四种主要有机波谱方法的基本原理,仪器结构以及方法特点等;同时了解有机波谱解析方法在新药研究和开发方面的应用; - 2 -
五、有机化合物的波谱分析方法 仪器分析技术的发展,特别是波谱技术的发展,能为鉴定有机化合物和确定其结构提供非常有价值的信息。波谱方法具有分析速度快,用量少等优点,已在国内外获得了广泛的应用。本部分简要介绍了紫外、红外、核磁、质谱这四大谱图的原理和应用。 实验二十一紫外-可见光光谱 一、实验目的 了解紫外-可见光光谱。 二、基本原理 1. 基本概念 有机化合物的紫外-可见光光谱是由于分子中价电子的跃迁所形成的。紫外-可见光是电磁波中波长为100~800nm范围的波段。 分子在入射光的作用下,其电子从一个能级(E′)跃迁到另一个能级(E″),就要吸收光子的能量,所吸收光的频率ν决定于两个能级间的能量差,即 E″-E′=hν h为普朗克常数(h = 6.626×10-34J·s)。可见,产生跃迁的两个能级间隔愈小,吸收光的频率愈小,波长愈长;反之,两个能级间的间隔愈大,吸收光的频率愈大,波长愈短。实际上,分子吸收能量是相当复杂的过程。分子的内部运动包括有转动、振动、和电子的运动。分子的能级近似地就由转动能级、振动能级和电子能级所构成。一般分子的转动能级间隔约在0.05eV以下,振动能级间隔约为0.05~1eV,电子能级间隔约为1~20eV。当电子能级改变时,转动能级和振动能级都要发生改变,也要吸收光子能量。所以,由于电子跃迁所形成的电子光谱是相当复杂的,如果仪器的分辨力不够,许多谱线密集在一起就形成谱带。电子光谱一般包括一系列谱带系;不同的谱带系相当于不同的电子跃迁,每个谱带是由于振动能级的改变所形成,谱带内所包含的谱线是由于转动能级的改变所形成的。 如果吸收光谱是以吸收曲线(以吸收强度对波长作图所得到的曲线)表示,吸收曲线将呈现一些峰和谷。每个峰峦相当于谱带,在某些情况下,这些谱带或多或少地表现出明显的齿状结构,这就是所谓振动结构。 关于吸收光谱的吸收强度,在实验上可用Lambet-Beer定律来描述。定律指出:被吸收的入射光的分数正比于光程中分子数目;对于溶液,如果溶剂不吸收,则被溶液所吸收光的分数正比于溶液的浓度。这个定律可用下式表示: D= log (I0 / I) =εcL D称为光密度(或A,吸光度),L吸收层的厚度(cm),c是摩尔浓度,ε是摩尔消光系数,它用来描述分子吸收光的能力,通常以吸收峰位置的波长的消光系数ε或logεmax 来表示。 2. 典型有机化合物电子吸收光谱简介 前面已指出分子的紫外-可见光光谱是分子价电子的跃迁而产生的。 依据分子中化学键的特性和不同电子跃迁的类型,可以帮助我们了解有机化合物电子吸收光谱。有机化合物在远紫外都有强的吸收带。这大多是与分子中σ电子的跃迁有关;而紫外-可见区的吸收带,则几乎都是由于n→π*和π→π*跃迁所产生的。 (1) 若分子中只含有σ单键,则只能有σ→σ*跃迁,吸收带大多在200nm以下。 (2) 若分子中只含有单个的π键,则有π→π*跃迁。几乎所有含隔离双键的化合物,在190nm附近都有强吸收,ε≈10000,这是π键的特性。当分子中引入助色基后,吸收带移向长波,移动情况与取代基的特性有关。但由于有n→π*和π→π*跃迁,而产生两个吸收带。 (3) 若取代基的原子还含有孤对电子时,例如N=O,>C=O,>C=S,-N=N-,-N≡N-,NO2等,则呈现三个吸收带,分别是π→π*、n→π*和n→σ*跃迁。其中n→π*在较长的波长
1. 请对化合物Ph-CO-CO-Ph的1H-NMR进行指认(溶剂CDCl3)。 答:从结构式可知该化合物具有对称结构,两个苯环相应谱峰重合,只需考虑一个苯环。该化合物氢谱在7.0~8.0区间有三组峰,从峰面积判断从高场到低场质子数依次为2、1、2。其中,δ≈7.97的峰为d峰,2H,化学位移值较大说明它处于羰基的邻位(羰基为强吸电子基团,对邻对位有去屏蔽作用),应为a、a'。另外该峰为双峰也证明这一点(a仅和b,a'仅和b'耦合)。δ≈7.65的峰仅有一个H,因此应为c,该峰为t峰表明c与b、b'耦合。δ≈7.50的峰为t峰,2H,其化学位移值最小表明它应处于羰基间位,应为b、b',另外b和a、c,b'和a'、c耦合,因此该峰应为三重峰,与谱图吻合。 2. 请对下面化合物1H-NMR低场部分的谱峰进行指认(仪器频率400 MHz,溶剂CDCl3)。 解:该化合物的氢谱在低场共有6组峰,其中δ7.26处的单峰为溶剂峰(即氘代氯仿中残余的微量CHCl3质子吸收峰)。剩下5组峰从高场到低场峰面积比表明它们的质子数依次为1、2、1、2、1,对应a和a'、b和b'、c、d、e六种质子。 其中δ≈9.6的双峰根据化学位移应是醛基氢e,其耦合常数J = 8.0 Hz,应是e和邻位氢d的耦合常数。δ6.75处的峰(1H)为dd峰,耦合常数为J = 16, 8.0 Hz,其中16 Hz应是反式烯键的两个H的耦合常数,而8.0 Hz即是与醛基氢e的耦合常数,因此该峰为d。δ7.38处的双峰耦合常数J = 16 Hz,说明该氢和峰d处于烯键反位,因此为c。 δ 6.68 (2H, d, J = 8.8 Hz)和7.45 (2H, d, J = 8.8 Hz)应为对位二取代苯环上的两组质子,两个取代基中,二甲胺基是供电子基团,使邻对位质子移向高场,而烯键是吸电子基团,使
峰区 波数(cm –1 ) 键的振动类型 区别醇、酚、酸: 1.酸( ):νO-H ,3000,宽谱带,散谱 νO-H ,≈3500,强、宽峰 νC-O ,≈1230 νC-H ,3100-2700,多谱带 芳环骨架振动,1600-1450,3、4条谱带 叔,νC-O ,1150-1200 仲,νC-O ,1125-1150 伯,νC-O ,1050 第一峰区:(4000-2500) X —H 的伸缩振动 O —H 、 N —H 、 C —H 。 3750~3000 νOH, 游离,≈3700 缔合,≈3500,特点:峰强而宽 νNH,3500-3150,特点:弱尖峰 区别胺: 伯,3500-3100,2/3条 仲,3400 1条 叔,无 3300~3000 不饱和:>3000 ν≡CH,3300,谱带尖锐 ν=CH ,3100-3000 νAr —H ,3100-3000,多谱带 极少数可到2900cm –1 3000~2700 饱和:<3000 νC —H,>2900 νC —H (-CHO),2850-2720,双谱带 νS —H ,2600-2500,谱带尖锐 —CH 3,2960-2870 —CH 2-,2920-2850 第二峰区:(2400-2100) 叄键、累积双键 2400~2100 νC≡N ,2250-2240 νC≡C ,2200-2100 ν—C≡C—C≡C — 苯环特征吸收 2. 酚 3.醇 区别酰胺: 伯,3300、3150,双峰 仲,3200 1条 叔,无
图2: 氢谱 常见类型结构的质子化学位移:其他振动: [CH 2]n : CH 2平面摇摆振动,800~700,弱吸收带。 N<4,向高波波数移动。 RR'CH ═C H 2(同碳),895~885,1条(890) R CH ═C H R'(顺), 830~750,1条(800) 芳烃: ???见图2 单取代:740 ,690, 2条 邻二取代:740 , 1条 间二取代:860 ,770,,700,3条 对二取代:810, 1条 -COOH 12~10 -CHO 10~9 ArOH 8~4
目录 第二章:紫外吸收光谱法 .............................................................................................................................................. 3第三章红外吸收光谱法 ......................................................................................................................................... 8第四章NMR习题............................................................................................................................................... 12第五章质谱 ......................................................................................................................................................... 18波谱分析试卷A .......................................................................................................................................................... 29波谱分析试卷B .......................................................................................................................................................... 37波谱分析试卷C .......................................................................................................................................................... 46二.................................................................................................................................................................................. 54第二章红外光谱 ........................................................................................................................................................ 55第三章核磁共振 .................................................................................................................................................... 57第三章核磁共振-碳谱............................................................................................................................................. 61第四章质谱.............................................................................................................................................................. 63第一节:紫外光谱(UV) .............................................................................................................................................. 69
1HNMR P15 四、推断题 1、A、CH3COCH(CH3)2 B、CH3CH2COCH2CH3 2、(3) 3、A、C6H5COCH2CH3 B、C6H5CH2COCH3 4、(C) 5、A、CH3O C6H5COCH3 6、C6H5CH2OH P16 1. O COOH 2. HC C-CH 2 -CH 2 OH 3. CH 3 -C=C-C-H O H H 4. CH-C OH H 5. OH CH 2 -CH=CH 2 OMe 6. S CH 2 OH 7. CH 3 -C-CH 2 -CH 2 -CH=CH 2 O8. O-C-CH 3 O 9. CH 2 -CH 3 NO 2 10. COOH 11. COOCH 2 CH 3 12.CO-NH 2 13. CH 3 CH 314. CH 3 CH 3 15.CH 3 CH 316. CH=CH 2 17. OH
18.COOCH 3 19. C CH 第三章 二、 1A 2C 3A 4D 5B 6C 7A 8D 9A 10D 11 A 五、 1、CH 3 -CH-CH 2 -CH 2 Br CH 32、S CH 2 OH 3、 CH 3 -C-CH 2 -CH 2 -CH=CH 2 O 4、O-C-CH 3 O5、 CH 2 CH 3 NO 2 6、 COOH 7、COOCH 2 CH 3 8、 CH 3 CH 39、 CH 3 CH 3 10、 CH 3 CH 3 11、CH=CH 2 12、 OH 13、 COOCH 3 第四章 二、 1C 2C 3A 4B 5A 6B 7D 8D 9C 10A 11C 12 B 13C 16A 17B 18A 19D 20D 21C 22A 23C 24D 25D 26B 27C 28A 29A 30C 31C 32C 33D 34C 35 C 36 37A 38B 简答题 1、①B ②A 三、问答题 1、B 4、CH 2 CH 2 CH 3 5、 CH 3 -CO-CH 2 -CH 2 -CH 3 第五章