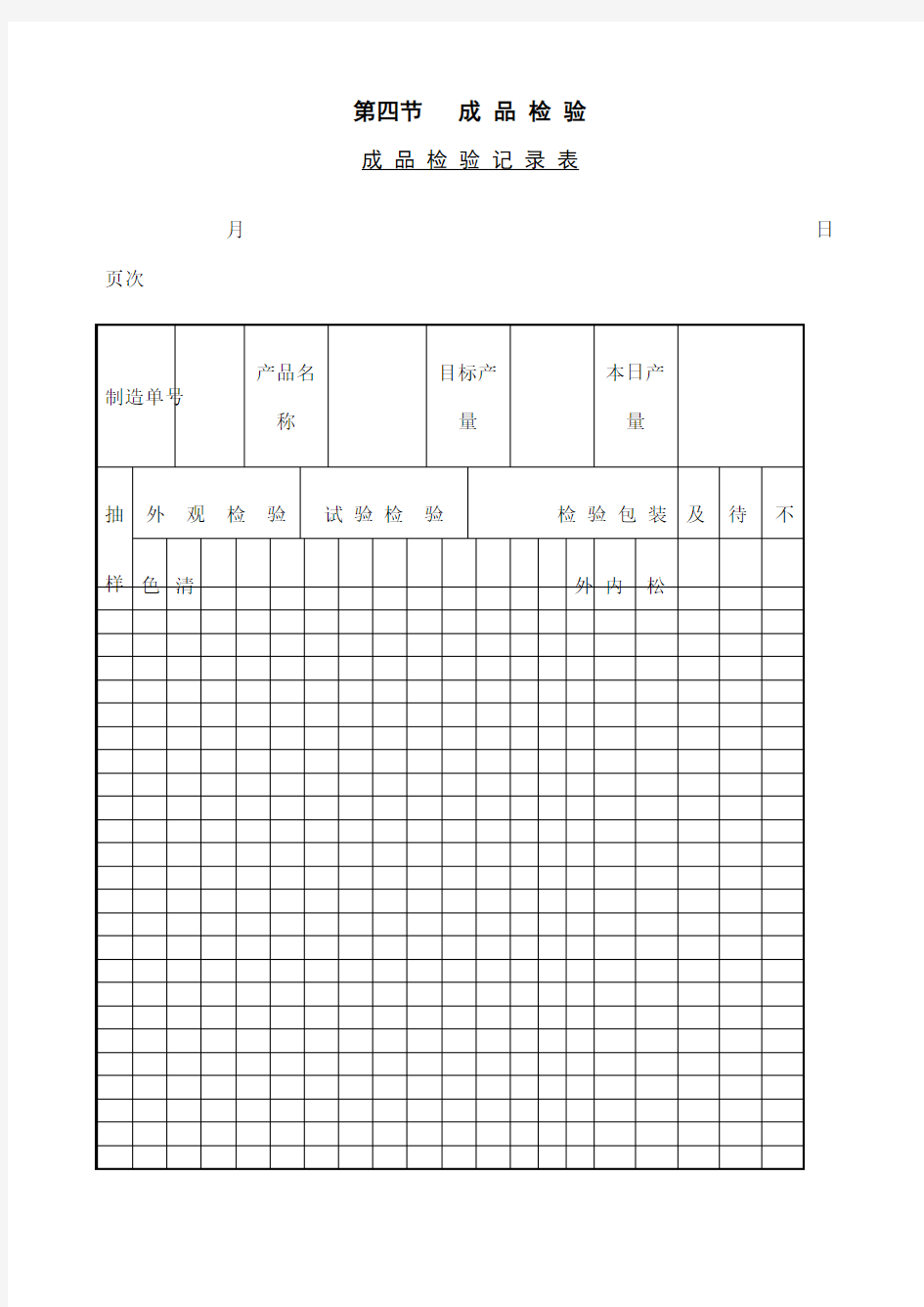

第四节成品检验
成品检验记录表
月日页次
证明记录
XXXXX药业(饮片)有限公司 原药材检验报告单 XXXXX药业(饮片)有限公司
原药材检验记录 【性状】 结果: 【鉴别】(1)显微鉴别 横截面: 结果: 粉末: 结果: (2)薄层鉴别 供试品溶液的制备:取粉末1g,加乙醇15ml,加热回流1小时,放冷,滤过,滤液
蒸干,残渣加乙醇5ml使溶解。 对照药材、对照品溶液配制:取菊花对照药材1g,同法制成对照药材溶液。再取绿原酸对照品,加乙醇制成每1ml含O.5mg的溶液。 温度:(℃) 相对湿度:(%) 展开剂:三氯甲烷-丙酮-甲醇-5%浓氨试液 (6:1:1:0.1) 薄层板:硅胶G 显色剂:稀碘化铋钾试液 灯光:白光、紫外光灯(365nm) 展距:(cm) 供试品色谱中,在与对照药材色谱相对应的位置 上,显相同颜色的荧光斑点。 S1为对照药材(对照品为中检所提供编号为) S2为对照品(对照品为中检所提供编号为) T为样品 结果: 【检查】杂质不得过 XX % (附录IX A) 杂质称重: g 杂质计算结果为: % (标准规定不得过 XX %) 结果: 膨胀度应不低于4.0(附录IX O) 温度:(℃)相对湿度:(%) 电子天平型号:CP214 溶剂:水 样品编号 1# 2# 3# 干燥品称重: g g g 第一次样品膨胀后体积: ml ml ml 第二次样品膨胀后体积: ml ml ml (两次差异不超过0.1ml) 膨胀度计算结果为:(标准规定不低于4.0)
结果: 水分不得过12.0% (附录Ⅸ H 第一法)。 温度:(℃)相对湿度:(%) 烘箱型号:DHG-91012SA型电子天平型号:CP214 样品编号 1# 2# 第一次称量瓶干燥(105℃ 3h) (g)(g)第二次称量瓶恒重(105℃ 1h) (g)(g)样品称重(g)(g)第一次称量瓶+样品干燥(105℃ 5h) (g)(g)第二次称量瓶+样品恒重(105℃ 1h) (g)(g)水分计算结果为:(%)(标准规定不得过12.0%) 结果: 总灰分不得过4.0%(附录Ⅸ K) 温度:(℃)相对湿度:(%) 马福炉型号:SX2.5-10 电子天平型号:CP214 样品编号 1# 2# 第一次坩锅称重(600℃ 3h) (g)(g)第二次坩锅恒重(600℃ 0.5h) (g)(g)样品称重(g)(g)第一次坩锅+残渣称重(600℃ 3h) (g)(g)第二次坩锅+残渣恒重(600℃ 0.5h) (g)(g)总灰分计算结果为:(%)(标准规定不得过4.0%) 结果: 酸不溶性灰分不得过3.0%(附录Ⅸ K)。 温度:(℃)相对湿度:(%) 马福炉型号 SX2.5-10 电子天平型号 CP214
住宅工程质量分户验收记录表 附表1
室内空间尺寸分户验收记录表
附表1.1 室内空间尺寸验收 1、验收内容: 1.1室内净高(按设计尺寸推算值)。 检查方法及数量:每个房间抽测5点,其中距墙(柱)500mm处各1点,中间测1点(厨房、卫生间等除外)。 1.2室内净开间、净进深(按设计尺寸推算值)。 检查方法及数量:每个房间抽测2点,其中距墙(柱)500mm处各1点(厨房、卫生间等除外),无墙体则测柱间净距。 1.3特殊的自然间可单独制定测量方法。 2、验收标准: 3.房型附图如下(房间应编号)。
门、窗、玻璃拦杆(板)安装分户验收记录表
附表1.2门、窗、玻璃安装验收 1、验收内容: 1.1外窗台高度。 检查方法及数量:钢尺检查,每一窗台不少于2点,记录最低点。全数检查。 1.2外窗渗漏。 检查方法及数量:观察检查。全数检查。 1.3推拉窗防脱落。 检查方法及数量:观察、手扳检查。全数检查。 1.4安全玻璃认证标志。 检查方法及数量:观察。全数检查。 1.5门窗开启性能。 检查方法及数量:观察、手板开启和关闭检查。全数检查。 1.6门窗配件。 检查方法及数量:观察、手板开启和关闭检查。全数检查。 1.7门窗扇密封条。 检查方法及数量:观察、手扳检查。全数检查。 1.8门窗排水。 检查方法及数量:观察、手扳检查。全数检查。 1.9进户门质量。 检查方法及数量:观察、开启检查、检查出厂合格证。全数检查。 1.10玻璃品种、规格、厚度 检查方法及数量:查合格证、游标卡尺检查。全数检查。 1.11门窗观感。 检查方法及数量:观察检查。全数检查。 2、验收标准: 2.1外窗台净高不低于0.90m,否则应采取防护措施。 2.2外窗及周边无渗漏。 2.3推拉窗必须有防脱落装置。 2.4应使用安全玻璃的,不得使用普通玻璃,玻璃上应有安全认证标志。 2.5门窗应开关灵活、关闭严密,无倒翘。 2.6门窗配件的规格、数量应符合设计要求,安装应牢固,位置应正确,功能应满足使用要求。窗锁扣应采用不锈钢等材料。 2.7密封条应安装完好,不脱槽,密封条应在转角处断开,并在转角处固定。 2.8有排水孔的门窗,排水孔应畅通,位置数量应满足排水要求。窗台流水坡度、滴水线、鹰嘴设置合理到位。 2.9进户门种类应符合设计要求。 2.10玻璃的品种、规格、厚度应符合设计要求和相应标准的要求。 2.11观感质量应符合质量要求。 2.12落地门窗、玻璃隔断等易受人体或物体碰撞的玻璃,应在视线高度设醒目标志或护栏,碰撞后可能发生高处人体或玻璃坠落的部位,必须设置可靠的护栏。 2.13栏板(杆)高度、型式、厚度应符合设计要求,同时必须符合强制性标准要求。
附件2 医疗器械生产企业日常监督检查表 企业名称: 条款检查内容及要求检查方式检查情况备注 生产企业许可证有效性1.生产企业许可证有效性 查看生产现场,核对企业工商营业执照与生产企业 许可证内企业名称、注册地址、生产地址一致性。 2.所生产产品是否与许可证核发 的产品范围相符合 查看企业生产现场,成品库房、销售台帐、与企业 许可证核定范围进行核对。 3.企业生产、质量管理人员有无 变化 查看企业人员名单,核对企业工商营业执照和生产 企业许可证内法人代表与负责人姓名的一致性。 4.企业管理层人员是否经过医疗 器械法规的培训 查看培训证书(各级食品药品监督管理部门或企业 内部培训)。 5.三类医疗器械生产企业是否有 内审员 查看证书。 生产条件的符合性检查1.生产、组装能力是否具备,设 备能否正常工作,维护保养是否 在有效期内 查看生产现场,看是否配备完成该工艺的生产设 备,核对企业工艺要求及设备维护保养记录。2.生产现场是否管理有序 查看现场及企业是否按产品注册标准的要求进行 生产,并查看是否制定了生产过程控制和管理文 件。 3.生产场地环境、照明是否与其 生产的产品及规模相适应 查看生产现场环境与照明情况,并查看环境监测记 录,查看生产面积是否拥挤。注:一次性无菌医疗 器械生产现场应符合《无菌医疗器具生产管理规
范》(YY0033)的要求。 医疗器械生产企业日常监督检查表 条款检查内容及要求检查方式检查情况备注 4.《生产实施细则》执行情况;有专项要求的,是否符合相应的《生产实施细则》的要求查看生产现场与生产记录是否符合相应的实施细则。尤其是生产输液器、注射器等一次性使用无菌医疗器械是否符合《一次性使用无菌医疗器械产品(注、输器具)生产实施细则》;生产外科植入物的是否符合《外科植入物的生产实施细则》。 5.原材料、外协件和外购件等采购产品是否符合规定要求检查企业供方的评审记录。原材料、外协件和外购件的采购检验记录,采购合同/技术协议是否符合该产品的质量要求,检查物资供应方的资质证明,尤其是原材料必须是有医疗器械注册证的(如义齿等),要注意检查相关资质证明。 6.生产过程的控制,在产品形成过程中,是否有清晰的状态标识和可追溯标识检查企业生产工艺的验证报告(或记录)。检查生产过程的记录,按生产批号能否追溯到产品原材料的批号、每批产品关键工序及特殊过程的控制情况、每批产品生产过程中有关设备、人员情况和质量记录。 出厂检验记录1.检验设备的配置是否能够覆盖 标准中所规定的出厂检验项目。检 验人员是否经过培训持证上岗 查看检验现场,检验设备清单,查验出厂检验报告 (与注册产品标准的要求核对)查看检验人员的上 岗证及相关的证明培训记录。 2.企业是否对检验设备(含计量器 具)的管理建立制度 查检验设备管理制度,应包括采购、入库、首次检 定、使用保养、周期检定及停用报废等内容。 3.检验设备的精度是否符合检验 要求,检验记录是否真实有效,出 查看(技术监督局)检定合格证是否在有效期内, 查看检验设备上的检定标签是否在有效期内,查看
盐城永胜蛋白饲料有限公司 成品检验管理表格 一、产品质量报告表 名称规格设计号业务号数量客户不合 格原 因检 查 车间主任不 合 格 内 容 说 明 不合格项目规格检验结果 不合 格原 因分 析及 改进 对策技术科长 车间主任厂长 批示 质 量 管 理 主 任 主管组长 二、产品质量检验表
第四十章 成品检验管理表格 387 制造 号码 产品 名称 生产数量 生产日程 月 日 至 月 日 工程名称 检验项目 上限 下 限 抽 查 记 录 次 时间 1 2 3 4 5 次 时间 1 2 3 4 5 次 时 间 1 2 3 4 5 三、产品质量抽查记录表 机器名称: 班别: 抽查时间 抽查项目 1 2 3 4 5 6 7 8 9 10 平均 标准 时分 时分 时分 时分 时分 时分 时分 时分 时分 时分 备 注 主管: 抽查员: 四、产品质量改进记录表 编号:
产品名称规格 管理项目原质量 标准 更改后 标准 变动 原因 交办 日期 完成 日期 变动因素 改进结果 制程设备材料操作技术 五、质量改进因素记录表 产品名称:产品规格:编号: 质量改进事项日期改进 结果 改进结果 比较 变动因素统计 项目细 目 编 号 内 容 交 办 完 成 结 果 改 进 费 用 改 进 前 改 进 后 差 异 制 造 条 件 操 作 标 准 控 制 基 准 原 料 改 进 设 备 改 进 技 术 性 作 业 水 平 填表:填表日期: 六、产品质量改进分析表 编号: 388
第四十章 成品检验管理表格 389 产品名称 规格 检验产品 目前水准 目标水准 产品质量分析图 原因分析 目前水准 拟变更 现状检查 改进对策 经办单位 主管批示 分析者 七、产品质量改进通知单 改进单位 改进项目 生产 过程 改变 项目 现况 改进方法 重点 批示 拟办 预定日程 月 方始 处理 结果 年 月 日以前 经办 完成 日期 经办 主管 批示 主管 批示 八、产品质量异常通知单 通知单位: 年 月 日
检测任务通知单 样品编号样品名称检验性质要求完成时间月日原料组成执行标准样品室负责人 检测项目分析方法养分含量%承检者任务完成时间承检者签字 样品制备要求 备注 经办人:任务通知日期:年月日
样品领取、返还登记表 表07 编号样品名称领样人领用日期样品用量返还人返还时间样品保管人备注注:一律用签字笔或钢笔黑体字填写。
试剂使用台帐 表08 试剂名称(纯 度) 试剂 用途领用人时间保管人备注领用量返还量 说明:一律用签字笔或钢笔黑体字填写。
称量瓶.坩埚恒重原始记录 表10 恒重日期天平编 号 干燥时 间 烘干温 度℃ 容器编号 测定次数 12345
标准溶液标定原始记录 表11 被标定溶液名称及配制浓度基准物(液)名称 及浓度 标定方法依据计算公式 标定日期年月日温度℃湿度%天平(基准液滴定管)编号被标定溶液滴定管编号 简要标定操作 过程 重复测定次数基准物质 量m (g) 或基准液 体积ml 起 始 读 数 ml 最 后 读 数 ml 滴定 管补 正 ml 空 白 补 正 ml 温度 补正 ml 真实 体积 V ml 被 标 液 浓 度 mol/L 平 均 值 mol/L 最 后 定 值 mol/L 标定1 2 3 4 复标1 2 3 4 标定质量控制方法允差实标误差结论 备注 标定人:复标人:审核人:
水分含量测定原始记录 (烘箱法) 表14样品名称样品编号检验性质 检验依据检验日期年月日 天平编号烘箱编号室内温度℃,湿度% 真空度MP a烘箱温度干燥时间分 测定次数 项目 1234干燥前称量瓶+试样m2g 干燥前称量瓶m3g 干燥前试样质量m=m2-m3g 干燥后称量瓶+试样m4g 干燥后试样的质量m1=m4-m0 g 计算结果H2O % 平均值H2O % 计算公式:H2O%=m-m1 ×100 m 空称量瓶恒重记录1234 平均重m0 检验人:复合人: 日期:日期: