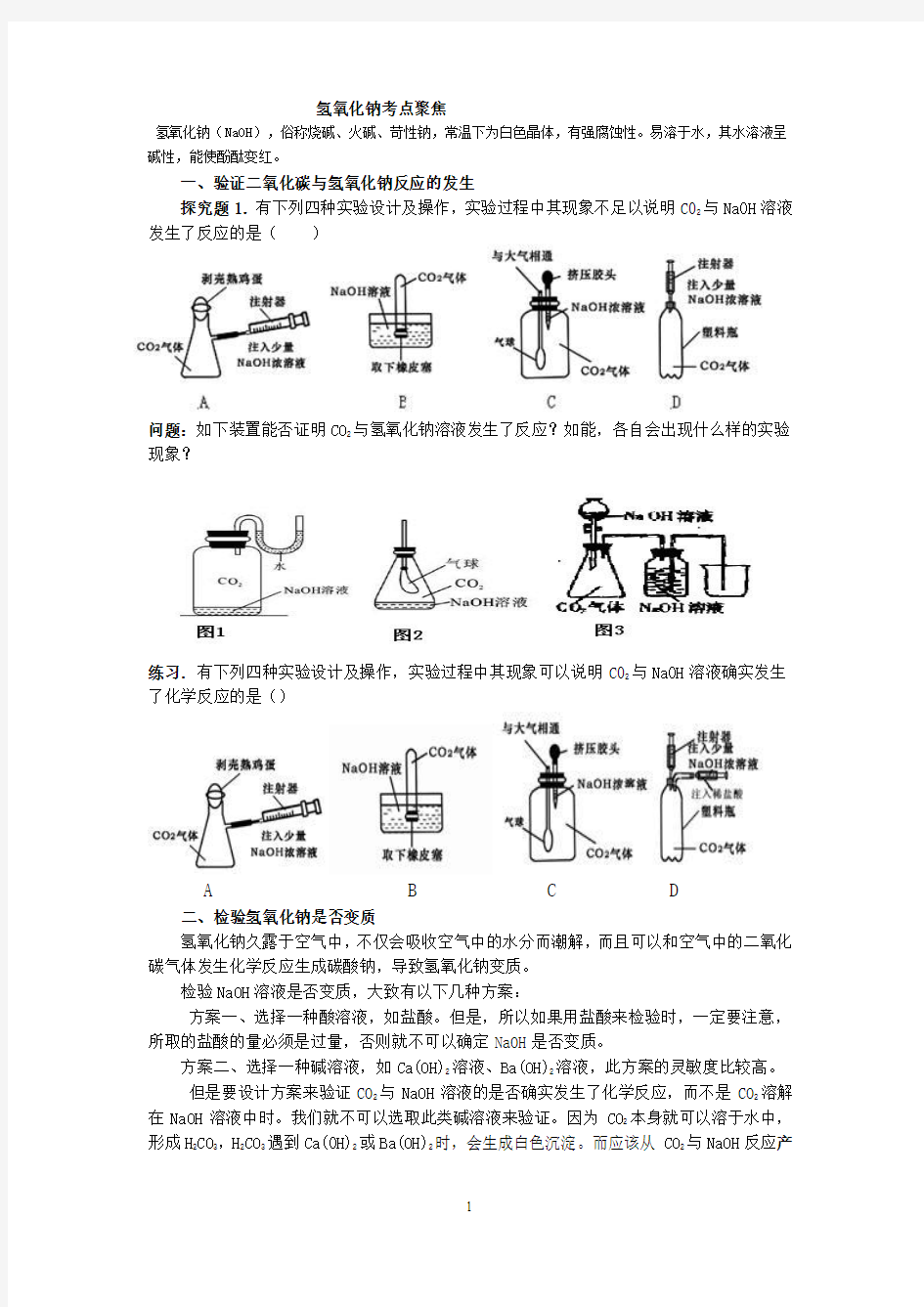

氢氧化钠考点聚焦
氢氧化钠(NaOH),俗称烧碱、火碱、苛性钠,常温下为白色晶体,有强腐蚀性。易溶于水,其水溶液呈碱性,能使酚酞变红。
一、验证二氧化碳与氢氧化钠反应的发生
探究题1.有下列四种实验设计及操作,实验过程中其现象不足以说明C02与Na0H溶液发生了反应的是()
问题:如下装置能否证明CO2与氢氧化钠溶液发生了反应?如能,各自会出现什么样的实验现象?
练习.有下列四种实验设计及操作,实验过程中其现象可以说明C02与Na0H溶液确实发生了化学反应的是()
A B C D
二、检验氢氧化钠是否变质
氢氧化钠久露于空气中,不仅会吸收空气中的水分而潮解,而且可以和空气中的二氧化碳气体发生化学反应生成碳酸钠,导致氢氧化钠变质。
检验NaOH溶液是否变质,大致有以下几种方案:
方案一、选择一种酸溶液,如盐酸。但是,所以如果用盐酸来检验时,一定要注意,所取的盐酸的量必须是过量,否则就不可以确定NaOH是否变质。
方案二、选择一种碱溶液,如Ca(OH)2溶液、Ba(OH)2溶液,此方案的灵敏度比较高。
但是要设计方案来验证CO2与NaOH溶液的是否确实发生了化学反应,而不是CO2溶解在NaOH溶液中时。我们就不可以选取此类碱溶液来验证。因为CO2本身就可以溶于水中,形成H2CO3,H2CO3遇到Ca(0H)2或Ba(OH)2时,会生成白色沉淀。而应该从CO2与NaOH反应产
物的角度来验证,可以取通入CO2后液体,向所取液体里加入足量的稀盐酸(或适量CaCl2溶液),充分振荡后,观察现象。
方案三、选择一种盐溶液,如BaCl2溶液。有时,同学们常用CaCl2溶液代替BaCl2溶液检验NaOH是否变质。这种方案存在缺陷。因为当加入的CaCl2溶液中的Ca2+与NaOH中的OH--的浓度比较大时,也会因为一定温度下Ca(OH)2的溶解度相对比较小,而有部分Ca(OH)2晶体析出,使得溶液中出现浑浊现象。所以关于盐的选择,最好选取BaCl2,不宜用CaCl2。
探究题2:四位同学分别用下列四种方法检验NaOH溶液是否已经变质(含有Na2CO3)
①加入少量稀盐酸,无气泡放出,则一定不含有Na2CO3;
②加少量澄清石灰水,有沉淀生成,则一定含有Na2CO3;
③加少量CaCl2溶液,有沉淀生成则一定含有Na2CO3;
④加少量BaCl2溶液,有沉淀生成,则一定含有Na2CO3。
其中探究方法和结论都正确的是()
A、①②
B、①②③
C、②④、①②③④
探究题3.向Na2CO3溶液里滴加盐酸,开始时无气泡产生,后来才有气泡产生;向盐酸里滴加Na2CO3溶液时,立即就有气泡产生。这说明()
A、Na2CO3过量时,主要发生的反应是 Na2CO3+HCl = NaHCO3+NaCl
B、Na2CO3跟盐酸不反应
C、盐酸过量时,主要发生的反应是Na2CO3+2HCl = 2NaCl+H2O+CO2↑
D、产生的气泡是挥发出来的氯化氢气体
三、探究氢氧化钠的变质程度
探究题4:某化学兴趣小组甲、乙、丙三位同学对暴露在空气中的氢氧化钠是否全部变质进行了探究:甲同学,取样品加入盐酸,有气泡产生,完全反应后,蒸干得到的固体全部是氯化钠,认为样品全部变质。
乙同学,取样品加水溶解,滴加无色酚酞试液变红色,认为样品没有全部变质。
丙同学,取样品加水后溶解,先加入过量的A溶液,过滤后在滤液中加入B溶液,通过观察现象得出正确结论:A为 B为。
得出正确结论的理由为。
四、除去氢氧化钠变质后的碳酸钠杂质
变质后的NaOH溶液中会有较多的CO32-,可以加入含Ca2+或Ba2+的溶液,与CO32-结合成沉淀,通过过滤而除去。为了不再引入新的杂质,考虑到原来NaOH溶液中存在OH-,此时选用Ba(OH)2溶液的效果比较好。因为,一定温度下Ca(OH)2溶液的质量分数相对比较小,溶液相对比较稀,除去杂质的效果远远不如用Ba(OH)2溶液好。
答案探究题1:B 1:能,图1中U形管中的红墨水被倒吸进集气瓶中。2:能,图2是锥形瓶内气球胀大。3:能,图3盛氢氧化钠溶液的广口瓶内的长导管口有气泡产生,原因是锥形瓶内二氧化碳气体反应后,气压减少,使盛氢氧化钠溶液的广口瓶内气压也减小,空气沿导管被压入广口瓶内。D
探究题2: C 探究题3:A、C
探究4:甲不正确。乙不正确。丙同学的方案是: BaCl2,无色酚酞试液
练习 1.为了验证二氧化碳与氢氧化钠可以发生化学反应,某小组用下左图所示装置进行实验.请回答下列问题:
(1)打开止水夹a 和c ,从长颈漏斗向锥形瓶中注入稀盐酸至 时停止.
(2)当观察到烧杯中有大量白色沉淀产生时,说明集气瓶中已集满二氧化碳气体.然后进行的操作是 ,关闭活塞b ,轻轻振荡集气瓶.一段时间后可观察到 ,证明二氧化碳与氢氧化钠发生了化学反应,该反应的化学方程式为
(3)小红认为仅做上述实验有不足之处,应利用上图装置做一个对比实验.该对比实验只需将所用的氢氧化钠溶液换成 即可.
(4)为了保证实验的成功,应在实验前对装置的气密性进行检验(不另加仪器),方法为
2. 化学活动小组的同学用上右图所示装置进行实验(装置的气密性良好):先关闭止水夹,将足量氢氧化钠溶液滴入锥形瓶中,充分反应后,再打开止水夹。
⑴锥形瓶中能观察到的现象是 ;
⑵根据上述现象,能否得出“二氧化碳与氢氧化钠能反应”的结论?
为什么?
⑶设计实验方案,探究反应后锥形瓶内溶液中溶质成份的几种可能情况,填写下表。
3、某兴趣小组同学将CO 2分别通入澄清石灰水和氢氧化钠溶液中,观察到前者变浑浊,后者无明显现象。
(1)写出上述澄清石灰水变浑浊的化学方程式 。
(2)为探究CO 2和NaOH 是否发生了化学反应,王强设计了如上图所示的A 、B 实验,验证CO 2与NaOH 溶液发生了化学反应。实验现象为:A 中试管内液面上升;B 中气球胀大。
①王强认为上述实验是可行的,其共同原理是 。 ②李莉提出质疑,她认为上述实验不严谨,其理由是 。 要得到科学严谨的结论,仍利用该装置,补做的对比实验是
③杨红通过检验生成物:向B实验后的溶液中加入,观察到现象,从而也证明CO2与NaOH发生了反应。
④你认为两个实验中存在安全隐患的是(填代号),理由是。
4.某化学兴趣小组设计了如下实验来探究CO2的制取和性质:
(1)该兴趣小组用干燥管、烧杯、铜网等设计装配了一个在实验室中制取二氧化碳气体的装置,如上中图所示。在干燥管内的铜网上应盛放;若将铜网换成铁网,可能产生的后果是,其原因是(用化学方程式表示) 。
(2)该兴趣小组同学将制得的CO2分别通人澄清石灰水和氢氧化钠溶液中,他们观察到前者变浑浊,后者无明显现象。CO2和NaOH是否发生了化学反应?
①小明设计了甲、乙两个实验来验证C02与NaOH发生了化学反应,如上右图所示。实验现象为:甲——软塑料瓶变瘪,乙——“瓶吞鸡蛋”。
小虎同学认为上述实验是可行的。其共同原理是
小雯同学提出质疑,她认为上述实验还不足以说明CO2和NaOH发生了反应。
其理由是。
小明同学针对小雯的质疑又补充了一个对照实验,这个实验是
。
②小虎向甲实验后变瘪塑料瓶的溶液中加入,观察到现象,从而证明CO
2与NaOH已经发生了反应。
5.某化学小组用上右图所示装置探究碱的性质。将适量氢氧化钠溶液放入A中,先打开止水夹Ⅰ,过一会儿,再打开止水夹Ⅱ,观察到A中溶液澄清,小试管中饱和石灰水变浑浊。(1)若B中有气泡产生,则小试管内发生反应的化学方程式为。C中的液体可能是(只写一种),验证你的猜想正确的方法是。
(2)若B中无气泡产生,则C中的液体为。饱和石灰水变浑浊的原因
是。
(3)该实验A中发生反应的化学方程式为。
6.在学习“NaOH化学性质”后的一节实验课上,同学们利用所学知识设计一个实验,通过观察到明显的实验现象,说明CO2与NaOH溶液发生了反应.同学们设计出多种方案.下列图示的是从中选出的四种方案:各方案的操作方法如下:
图A:取下玻璃塞,打开活塞,滴下少量NaOH浓溶液;图B:用适当的方法取下橡皮塞,晃动试管;图C:挤压胶头滴管,滴加少量NaOH浓溶液;图D:用注射器向塑料瓶中注入少量NaOH浓溶液,振荡.请回答下列有关问题:
(1)对于图A~D,你认为能达到实验目的装置有(填字母编号)
请从中任选一种,该装置的编号以及对应的实验现象是
(2)如何取下B装置中的橡皮塞(只要求回答一种方法)?
(3)根据你现有的知识思考:要想用上述装置产生类似的实验现象,还可换成
气体与溶液相互组合(各填一种即可).
6.请你参加有关二氧化碳的探究活动:
(1)请写出实验室用于制取二氧化碳的化学反应方程式:
(2)收集二氧化碳过程中,如何验证气体收集满
友情提示:现在实验室提供下列试剂,请你从中选择正确的序号填入(3)(4)题的空格中。
①石蕊试液②酚酞试液③澄清石灰水④BaCl2溶液⑤稀盐酸
(3)用集气瓶收集两瓶二氧化碳,向A瓶中加入少量蒸馏水,向B瓶中加入一定量氢氧化钠溶液,均盖上玻璃片振荡,观察,均无明显现象。从A瓶中取样,滴入振荡,可证明二氧化碳与水发生了反应。从B瓶中取样,滴入,可证明二氧化碳与氢氧化钠发生了反应。
(4)若要证明B瓶中氢氧化钠溶液是否剩余,从B瓶中取样,在样品中先加入
足量的,再加入。
7.小丽在实验室意外发现桌上有一瓶敞口放置已久的NaOH溶液,由此她有了探究欲望。【提出问题】这瓶NaOH溶液一定变质了,其变质程度如何呢?
【做出猜想】小丽的猜想:NaOH溶液部分变质。
你的猜想:。
【实验反思】(1)下列物质:①BaCl2溶液②Ca(NO3)2溶液③Ca(OH)2溶液
④Ba(OH)2溶液,不能代替小丽实验中CaCl2溶液的是(填序号)
(2)小丽第二次滴加的试剂除了指示剂外,还可以用代替。
【拓展应用】保存NaOH溶液的方法
8、 (7分)兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验。请你与他们一起完成以下探究活动:
【对固体猜想】猜想1:全部是NaOH;
猜想Ⅱ:全部是Na2CO3;猜想Ⅲ:是NaOH和Na2CO3混合物。
【实验和推断】
(1)若现象a为有气泡产生,则加入的A溶液是,说明氢氧化钠已经变质,有气泡产生的反应的化学方程式是。
(2)若A是Ca(OH)2溶液,现象a有白色沉淀,现象b为无色酚酞试液变红色,则白色沉淀为 (填化学式),该实验 (填“能千或“不能”)说明样品中有NaOH。
(3)若A是CaCl2溶液,当实验现象a为,现象b 为,则猜想Ⅱ成立。
【反思】久置的氢氧化钠变质的原因是(用化学方程式表示) 。
9.有一瓶纯净的烧碱因敞口放置在空气中而含有杂质,请你设计一个实验方案,既能验证其
答案:1.D 1.(1)长颈漏斗下端管口浸没在液面下(液封)
(2)关闭止水夹a,打开活塞b,向集气瓶中加入适量的NaOH溶液;烧杯中的混浊液体从导管倒吸入集气瓶中;CO2+2NaOH═Na2CO3+H2O(3)水(4)打开止水夹a(关闭活塞b和止水夹c),从长颈漏斗向锥形瓶中注入水至长颈漏斗下端管口浸没在液面下,继续加水,此时长颈漏斗中有一段水柱高于锥形瓶内液面,放置一段时间,液面不变化.说明气密性良好
2.⑴澄清石灰水倒流使溶液变浑⑵不能;可能是二氧化碳溶于氢氧化钠溶液中,或是二氧化碳与石灰水反应也会有这样的现象⑶实验操作:取少量反应后的上层清液两份,分别加入少量澄清石灰水和碳酸钠溶液。预期的现象和结论:若加入石灰水后有沉淀则反应后的溶质是氢氧化钠和碳酸钠;若加入碳酸钠后有沉淀则反应后的溶质是氢氧化钠和前因后果;若加入二者均无明星现象,则溶质为氢氧化钠
3、(1)CO2+Ca(OH)2=CaCO3↓+H2O (2)①氢氧化钠溶液与CO2发生反应,使容器内气压降低
②CO2能溶于水,也能使容器内气压降低;将氢氧化钠溶液换成等体积的水③稀盐酸;有气泡产生(或滴加CaCl2溶液;有白色沉淀生成其他合理答案均可)④A 氢氧化钠溶液有腐蚀性,易伤到手
4. (1)大理石(或石灰石) 铁网被腐蚀,制得的CO2气体中混有H2 Fe+2HCl=FeCl2+H2↑
(2)①氢氧化钠溶液能与CO2发生反应,瓶内气压降低 CO2能溶于水,也能使瓶内气压降低将氢氧化钠溶液换成等体积的水,做同样的实验,看现象是否有差别。②稀盐酸有气泡产生(或加氯化钙溶液有沉淀生成等)
5.(1)CO2+Ca(OH)2=CaCO3↓+H2O;酸(或碳酸盐);取少量C中的液体放入试管中,滴加紫色石蕊,紫色石蕊试液变红,证明是酸(或检验碳酸盐的方法)(2)浓硫酸;浓硫酸倒吸入B中,遇水放热,使氢氧化钙溶解度降低,饱和溶液析出固体。(3)NaOH + HCl = NaCl + H2O
答案6.(1)CaCO3 + 2HCl = CaCl2 + H2O + CO2↑(2)将燃着的木条放入集气瓶中,看木条是否熄灭。(3)①;④或⑤;④;①或②
答案7. 你的猜想:NaOH溶液全部变质;【实验探究】有白色沉淀产生,溶液由无色变为红色;有白色沉淀产生,溶液为无色;【实验反思】(1)③④(2)PH试纸【拓展应用】密封保存
答案8:(1)盐酸 Na2CO3+2HCl=2NaCl+H2O+CO2↑(或稀H2SO4等酸及其对应的化学方程式)
(2)CaCO3不能。 (3)有白色沉淀产生无色酚酞不变红色【反思】CO2+2NaOH=Na2CO3+H2O
答案9.(1)将烧碱样品放入试管中,加足量水震荡样品溶解,试管外壁发热烧碱固体溶于水放热(2)向上述溶液逐滴滴加Ba(OH) 2溶液或Ca(OH)2溶液或至不再产生沉淀为止。
(3)过滤,将滤液蒸发有白色固体析出得到纯净的烧碱
氢氧化钠标准溶液浓度测量不确定度评定报告 编制:付学飞 审核:王淑芳 批准:许百红 京博农化科技股份有限公司分析检测中心 2011-8-2
氢氧化钠标准溶液浓度测量不确定度评定报告 1目的 评定0.5mol/L 氢氧化钠标准溶液浓度测量的不确定度 2依据标准 《化学试剂标准滴定溶液的制备》GB /T 601-2002 3试验条件 1) 设备名称:分析天平 设备型号:AE-240 设备编号:CARC0007 测量范围:0-200g 准确度等级或示值误差:±0.0001g 分辨率或最小分度值:0.0001g 2) 玻璃仪器名称: 50ml 碱式滴定管 准确度等级:A 级 最大允许误差±0.05ml 最小分度值:0.01ml 3) 工作基准试剂名称名称:基准邻苯二甲酸氢钾 3.2 检测环境条件:温度——25℃ 湿度—— 50% 3.3标准溶液编号:20110712 4过程描述与数学模型 4.1配制过程 称取110g 氢氧化钠溶于100ml 无二氧化碳的水中,注入聚乙烯容器中,密闭放置至溶液清亮,用塑料管量取上层清液,用无二氧化碳的水稀释至1000ml 。 4.2标定过程 称取于105-110℃下用电烘箱箱至干燥的工作基准试剂邻苯二甲酸氢钾3.6g ,加无二氧化碳的水溶解,加入两滴酚酞指示液(10g/L ),用配制好的氢氧化钠滴定溶液滴定至浅粉色。并保持30s ,同时做空白试验。 氢氧化钠标准滴定溶液的浓度[])(NaOH c ,数值以mol/L 表示,按照下式计算 M V V m NaOH C ?-?=)(1000)(21 式中:m ——邻苯二甲酸氢钾的质量分数的准确值,g ; V 1——滴定消耗氢氧化钠滴定溶液的体积,ml ; V 2——空白试验耗用的氢氧化钠滴定溶液的体积,ml ;
氢氧化钠标准溶液的配 制 集团标准化办公室:[VV986T-J682P28-JP266L8-68PNN]
验四氢氧化钠标准溶液的配制和标定 一、目的 1、配制0.1mol/L 氢氧化钠溶液 2、氢氧化钠溶液的标定 二、材料 仪器:碱式滴定管(50ml )、容量瓶、锥形瓶、分析天平、台秤。 试剂:邻苯二甲酸氢钾(基准试剂)、氢氧化钠固体(A.R )酚酞指示剂:1g 酚酞溶于适量乙醇中,再稀释至100mL 。 三、实验原理 NaOH 有很强的吸水性和吸收空气中的CO 2,因而,市售NaOH 中常含有Na 2CO 3。 反应方程式:2NaOH+CO 2→Na 2CO 3+H 2O 由于碳酸钠的存在,对指示剂的使用影响较大,应设法除去。 除去Na 2CO 3最通常的方法是将NaOH 先配成饱和溶液(约52%,W/W ),由于Na 2CO 3在饱和NaOH 溶液中几乎不溶解,会慢慢沉淀出来,因此,可用饱和氢氧化钠溶液,配制不含Na 2CO 3的NaOH 溶液。待Na 2CO 3沉淀后,可吸取一定量的上清液,稀释至所需浓度即可。此外,用来配制NaOH 溶液的蒸馏水,也应加热煮沸放冷,除去其中的CO 2。 标定碱溶液的基准物质很多,常用的有草酸(H 2C 2O 42H 2O )、苯甲酸(C 6H 5COOH )和邻苯二甲酸氢钾(C 6H 4COOHCOOK )等。最常用的是邻苯二甲酸氢钾,滴定反应如下: C 6H 4COOHCOOK+NaOH →C 6H 4COONaCOOK+H 2O 计量点时由于弱酸盐的水解,溶液呈弱碱性,应采用酚酞作为指示剂。 四、操作步骤 1、0.1mol/LNaOH 标准溶液的配制 用小烧杯在台秤上称取120g 固体NaOH ,加100mL 水,振摇使之溶解成饱和溶液,冷却后注入聚乙烯塑料瓶中,密闭,放置数日,澄清后备用。准确吸取上述溶液的上层清液5.6mL 到1000毫升无二氧化碳的蒸馏水中(可以煮沸),摇匀,贴上标签。 2、0.1mol/LNaOH 标准溶液的标定 将基准邻苯二甲酸氢钾加入干燥的称量瓶内,于105-110℃烘至恒重,用减量法准确称取邻苯二甲酸氢钾约0.6000克,置于250mL 锥形瓶中,加50mL 无CO2蒸馏水,温热使之溶解,冷却,加酚酞指示剂2-3滴,用欲标定的0.1mol/LNaOH 溶液滴定,直到溶液呈粉红色,半分钟不褪色。平行滴定三次。同时做空白试验(滴定除了标定物——邻苯二甲酸氢钾以外的水)。 五、结果结算 NaOH 标准溶液浓度计算公式: m/M C NaOH = (V 2-V 1) 式中:m---邻苯二甲酸氢钾的质量,g V 1---氢氧化钠标准滴定溶液在滴定管中初读数,mL V 2---氢氧化钠标准滴定溶液在滴定管中末读数,mL 邻苯二甲酸氢钾的摩尔质量=204.2g/mol
NaOH密度,质量分数与摩尔浓度对应(一) 密度g/m3 质量分数%摩尔浓度mol/L密度g/m3质量分数,%摩尔浓度mol/L 1.005 0.602 0.151 1.095 8.74 2.391 1.01 1.045` 0.264 1.1 9.19 2.527 1.015 1.49 0.378 1.105 9.645 2.664 1.02 1.94 0.494 1.11 10.1 2.802 1.025 2.39 0.611 1.115 10.555 2.942 1.03 2.84 0.731 1.12 11.01 3.082 1.035 3.29 0.851 1.125 11.46 3.224 1.04 3.745 0.971 1.13 11.92 3.367 1.045 4.2 1.097 1.135 1 2.37 3.51 1.05 4.655 1.222 1.14 1 2.83 3.655 1.055 5.11 1.347 1.145 13.28 3.801 1.06 5.56 1.474 1.15 13.73 3.947 1.065 6.02 1.602 1.155 14.18 4.095 1.07 6.47 1.731 1.16 14.64 4.244 1.075 6.93 1.862 1.165 15.09 4.395 1.08 7.38 1.992 1.17 15.54 4.545 1.085 7.83 2.123 1.175 15.99 4.697 1.09 8.28 2.257 1.18 16.44 4.85 NaOH密度,质量分数与摩尔浓度对应(二) 密度g/m3 质量分数%摩尔浓度mol/L 密度g/m3 质量分数%摩尔浓度mol/L 1.185 16.89 5.004 1.37 34.03 11.65 1.19 17.345 5.16 1.375 34.52 11.86 1.195 17.8 5.317 1.38 35.01 1 2.08 1.2 18.255 5.476 1.385 35.5 1 2.29 1.275 25.1 8 1.39 36 1 2.51 1.28 25.56 8.178 1.395 36.495 1 2.73 1.285 26.02 8.357 1.4 36.99 1 2.95 1.29 26.488.0539 1.405 37.49 13.17 1.295 26.94 8.722 1.41 37.99 13.3 1.3 27.41 8.906 1.415 38.49 13.61 1.305 27.87 9.092 1.42 38.99 13.84 1.31 28.33 9.278 1.425 39.495 14.07 1.315 28.8 9.466 1.43 40 14.3 NaOH密度,质量分数与摩尔浓度对应(三)
实验 氢氧化钠标准溶液的配制与标定 一、实验目的 1、掌握氢氧化钠滴定液的配制和标定方法。 2、巩固用递减法称量固体物质。 3、熟悉滴定操作并掌握滴定终点的判断。 4、本实验需4学时。 二、仪器与试剂 仪器:分析天平、台秤、滴定管(50mL )、玻棒、量筒、试剂瓶(1000mL )、电炉、表面皿、称量瓶、锥形瓶 试剂:固体NaOH 、基准邻苯二甲酸氢钾、纯化水、酚酞指示剂 三、原理与方法 NaOH 易吸收空气中CO 2而生成Na 2CO 3,反应式为: 2NaOH + CO 2 = Na 2CO 3 + H 2O 由于Na 2CO 3在饱和NaOH 溶液中不溶解,因此将NaOH 制成饱和溶液,其含量约52%(w/w ),相对密度为1.56。待Na 2CO 3沉待淀后,量取一定量的上清液,稀释至一定体积,即可。用来配制NaOH 的纯化水,应加热煮沸放冷,除去水中CO 2。 标定NaOH 的基准物质有草酸(H 2C 2O 4·2H 2O )、苯甲酸(C 7H 6O 2)、邻苯二甲酸氢钾(KH C 8H 4O 4)等。通常用邻苯二甲酸氢钾标定NaOH 滴定液,标定反应如下: 计量点时,生成的弱酸强碱盐水解,溶液为碱性,采用酚酞作指示剂。按下式计算NaOH 滴定液的浓度: 3104 484 48?= O H KHC NaOH O H KHC NaOH M V m c 四、实验内容 1、NaOH 溶液的配制 (1)NaOH 饱和溶液的配制:用台称称取120g NaOH 固体,倒入装有100mL 纯水的烧杯中,搅拌使之溶解成饱和溶液。贮于塑料瓶中,静置数日,澄清后备用。 (2)NaOH 滴定溶液的配制(0.1mol/L ):取澄清的饱和NaOH 溶液2.8mL ,置于1000 mL 试剂瓶中,加新煮沸的冷纯化水500 mL ,摇匀密塞,贴上标签,备用。 2、NaOH 溶液的标定 用递减法精密称取在105~110℃干燥至恒重的基准物邻苯二甲酸氢钾3份,每份约0.5g ,
密度溶质的质量分数氢氧化钠溶液的浓度 密度(20℃ )g/cm3 NaOH的质量分数/(g/100g溶液) 物质的量浓度(mol/L) 1 0.159 0.0393 1.0050.6020.151 1.01 1.0450.264 1.015 1.490.378 1.02 1.940.494 1.025 2.390.611 1.03 2.840.731 1.035 3.290.851 1.04 3.7450.971 1.045 4.2 1.097 1.05 4.655 1.222 1.055 5.11 1.347 1.06 5.56 1.474 1.065 6.02 1.602 1.07 6.47 1.731 1.075 6.93 1.862 1.087.38 1.992 1.0857.83 2.123 1.098.28 2.257 1.0958.74 2.391 1.19.19 2.527 1.1059.645 2.664 1.1110.1 2.802 1.11510.555 2.942 1.1211.01 3.082 1.12511.46 3.224 1.1311.92 3.367 1.1351 2.37 3.51 1.141 2.83 3.655 1.14513.28 3.801 1.1513.73 3.947 1.15514.18 4.095 1.1614.64 4.244 1.16515.09 4.395 1.1715.54 4.545 1.17515.99 4.697 1.1816.44 4.85 1.18516.89 5.004 1.1917.345 5.16 1.19517.8 5.317 1.218.255 5.476 1.20518.71 5.636
实验七:氢氧化钠浓度的标定 一.实验目的 1练习分析天平的使用方法并掌握减量称量法 2 掌握滴定操作并学会正确判断终点; 3 学会配制和标定碱标准溶液的方法。 二.实验原理: 1、氢氧化钠标准溶液不能准确配制的原因; NaOH易吸湿,不是基准物质,故不能准确配制NaOH标准溶液,需用邻苯二甲酸氢钾标定,属于强碱滴定弱酸。 2、标定氢氧化钠溶液的工作基准试剂,滴定反应到达化学计量点时溶液的pH 值; 工作基准试剂是:邻苯二甲酸氢钾。 C 6H 4 COOHCOOK + NaOH → C 6 H 4 COONaCOOK + H 2 O 计量点时pH= 3、选用何种指示剂,终点时的颜色; 选用酚酞作指示剂,终点是溶液由无色变为淡红色,且内不退色。 如何选择指示剂 强碱滴定强酸时,随着NaOH溶液的加入,溶液pH值发生变化,以pH对NaOH 的加入量作图得滴定曲线,计量点前后NaOH溶液由不足到过量(%); 溶液pH的突然变化称滴定突跃,突跃的pH范围称滴定突跃范围; 酸碱指示剂、指示剂的变色范围酸碱指示剂本身是弱酸或弱碱:HIn = H+ + In-,HIn与In-有不同的颜色,pH=p K a(HIn)+lg[In-]/[HIn],当[In-] =[HIn],pH=p K a为理论变色点;[In-]/[HIn]≤ 看到酸色,≥10,看到碱色,变色范围的pH=p K a±1,但实际观测到的与理论计算有差,因人眼对各种颜色的敏感度不同,加上两种颜色互相掩盖,影响观察。如酚酞p K a=,变色pH范围为~。不同的人的观察结果也不同。
指示剂的选择使指示剂的理论变色点处于滴定突跃范围。 4、计算公式 C(NaOH)= m(KHC8H4O4) = m(KHC8H4O4) M(KHC8H4O4)V(NaOH) * V(NaOH) 三.主要仪器与试剂 主要仪器:电子天平,分析天平,250m烧杯(4个),表面皿(4个),滴定管,称量瓶,玻璃棒,干燥器,量筒。 主要试剂:NaOH(S)、邻苯二甲酸氢钾、酚酞 四.操作步骤:五.实验结果及分析 用到的计算公式: 1. C(NaOH)= m(KHC8H4O4) = m(KHC8H4O4) M(KHC8H4O4)V(NaOH) * V(NaOH) 2.平均值的计算: =(X1+X2+X3+……+X n)/n 3.标准偏差计算: 4:统计量计算式为:T n=(X n- ) /S 六.问题及思考题 ★思考题
氢氧化钠标准溶液的溶液配制与标定 一、实验目的 1.学会配制一定浓度的标准溶液的方法。 2.学会用滴定法测定酸碱溶液浓度的原理和操作方法。 3.进一步练习滴定管、移液管的使用。 4.初步掌握酸碱指示剂的选择方法。熟悉指示剂的使用和终点的判据。 二、实验原理 测定时,一般都使用浓度约为0.1mol/L NaOH标准溶液。由于NaOH固体试剂的纯度不高,并易吸收空气中的CO2和水分,因此,不能直接配制法配制NaO H标准溶液,而必须用标定法。 标定碱液的基准物质很多,经常使用的基准物,如草酸(H2C2O4·2H2O,相对分子质量为126.07)、邻苯二甲酸氢钾(HOOCC6H4COOK,简写KHP相对分子质量为204.44)等。其中最常用的是邻苯二甲酸氢钾,滴定反应的化学方程式如下: 滴定终点时由于弱酸盐的水解,溶液呈碱性,所以应采用酚酞为指示剂,当溶液呈现微红色,30s内不褪色即为终点。 计算公式: 三、实验步骤 1.NaOH标准溶液的配制 经计算配制500ml 0.1 mol/L NaOH标准溶液需4g NaOH固体。
用台秤称量4g NaOH于1000ml烧杯中,用100ml量筒加入500ml水,并用玻璃棒搅拌溶解。 2.NaOH溶液浓度的标定 用分析天平精确称量0.5g左右的KHP三份,分别于250ml锥形瓶中,用10 0ml量筒加入30ml水,充分振荡使其完全溶解,滴加2滴酚酞指示剂。 用50ml碱式滴定管盛装NaOH标准溶液滴定至终点,记录消耗NaOH标准溶液的体积。 四、数据记录与处理(利用表中数据,练习数据处理) 五、注意事项 1.称量邻苯二甲酸氢钾时,所用锥形瓶外壁要干燥并编号(以后称量同)。 2.NaOH饱和溶液侵蚀性很强,长期保存最好用聚乙烯塑料化学试剂瓶贮存(用一般的饮料瓶会因被腐蚀而瓶底脱落)。在一般情况下,可用玻璃瓶贮存,但必须用橡皮塞。 六、思考题 1.如果用H2C2O4·2H2O标定时,又如何操作? 2.标定时,三次滴定消耗标准溶液的体积之间,远超过容量分析允许的0.2 %相对误差,即0.04ml,如此分析测定的结果能准确吗?
河南(05-12年)中考氢氧化钠的知识点汇总 1、称量:由于它易潮解,不能放在纸上称量,必须放在玻璃器皿里称量。 2、用途:氢氧化钠制肥皂利用了它的化学性质 3、化学性质:(1)与二氧化碳的反应。利用实验装置中气球的变化,U形管中 液面的变化等,如何检验氢氧化钠是否变质、部分变质还是全部变质考查。 (2)腐蚀性(可否选用浓氢氧化钠溶液等碱性物质来涂抹蚊虫叮咬处)(3)与酸的反应(反应前后溶液质量的变化) (4)与盐反应(与硫酸铜反应) 4、工业制法:写方程式 5、俗称:火碱、烧碱、苛性钠 6、除杂(氢氧化钠中混有碳酸钠) 7、氢氧化钠溶液与氢氧化钙溶液具有相似化学性质的原因 8、保存:密封保存 9、氢氧化钠溶液的酸碱度 10、氢氧化钠溶于水温度变化(U形管中液面的变化) 未考内容:1、氢氧化钠去除油污 2、氢氧化钠做干燥剂 3、氢氧化钠溶液与石灰水的鉴别 4、氢氧化钠和三氧化硫反应 1. 下列实验操作正确的是() 2、.下列物质的用途只与物质的物理性质有关的是() A. 干冰用于人工降雨 B. 用熟石灰中和土壤的酸性 C. 液氧用作火箭的助燃剂 D. 氢氧化钠可用于制肥皂 3、检验一瓶长期露置在空气中的NaOH溶液是否变质,下列不能作为检验用的试剂的是()
A澄清石灰水B氢氧化钡溶液C氯化钙溶液D酚酞试液 4.围绕一瓶NaOH固体是否变质的问题,通过如下问题和实验进行研究。(1)写出NaOH固体变质的化学方程式:。(2)能否用酚酞试液检验NaOH是否变质?,理由是 (3)取少量固体于试管中,滴加稀盐酸,有气泡产生,该现象能否证明NaOH 已经变质?请说明理由。。(可用文字说明也可用化学方程式表示) (4)为证明变质的固体中仍然存在NaOH,某同学按如下操作进行实验: ①取少量固体溶于水,向其中加入足量CaCl 溶液,现象 2 为,反应的化学方程式 为。 ②取①所得溶液于试管中,向其中滴加少量的,现象 为。其结论是变质的固体中仍然存在NaOH。 5、甲、乙两同学为了探究实验室中久置的氢氧化钠固体是否变质,进行了如下实验。请与他们一起完成探究活动。 【探究问题】氢氧化钠固体是否变质。 【实验探究】甲、乙两同学分别设计了不同的实验方案并加以实验。 ⑴乙同学认为甲同学的结论不科学,其理由是。 ⑵乙同学的试验中,观察到的现象A应为,该反应的化学方程式为;氢氧化钠固体变质的原因是 (用化学方程式表示)。 【拓展应用】 ⑶氢氧化钠溶液容易变质,必须密封保存。实验室必须密封保存的药品还有很多,试另举一例。 ⑷若要除去上述变质的氢氧化钠溶液中的杂质,应加入适量的(填化学式)溶液而除去。 【答案】⑴碳酸钠溶液也显碱性(碳酸钠溶液的pH>7)⑵有白色沉淀产生
氢氧化钠浓度的标定 一.实验目的 1练习分析天平的使用方法并掌握减量称量法 2 掌握滴定操作并学会正确判断终点; 3 学会配制和标定碱标准溶液的方法。 二.实验原理: 1、氢氧化钠标准溶液不能准确配制的原因; NaOH易吸湿,不是基准物质,故不能准确配制NaOH标准溶液,需用邻苯二甲酸氢钾标定,属于强碱滴定弱酸。 2、标定氢氧化钠溶液的工作基准试剂,滴定反应到达化学计量点时溶液的pH 值; 工作基准试剂是:邻苯二甲酸氢钾。 C6H4COOHCOOK + NaOH → C6H4COONaCOOK + H2O 计量点时pH= 3、选用何种指示剂,终点时的颜色; 选用酚酞作指示剂,终点是溶液由无色变为淡红色,且内不退色。 如何选择指示剂 强碱滴定强酸时,随着NaOH溶液的加入,溶液pH值发生变化,以pH对NaOH 的加入量作图得滴定曲线,计量点前后NaOH溶液由不足到过量(%);
溶液pH的突然变化称滴定突跃,突跃的pH范围称滴定突跃范围; 酸碱指示剂、指示剂的变色范围酸碱指示剂本身是弱酸或弱碱:HIn = H+ + In-,HIn与In-有不同的颜色,pH=p K a(HIn)+lg[In-]/[HIn],当[In-] =[HIn],pH=p K a为理论变色点;[In-]/[HIn]≤ 看到酸色,≥10,看到碱色,变色范围的pH=p K a±1,但实际观测到的与理论计算有差,因人眼对各种颜色的敏感度不同,加上两种颜色互相掩盖,影响观察。如酚酞p K a=,变色pH范围为~。不同的人的观察结果也不同。 指示剂的选择使指示剂的理论变色点处于滴定突跃范围。 4、计算公式 C(NaOH)= m(KHC8H4O4) = m(KHC8H4O4) M(KHC8H4O4)V(NaOH) * V(NaOH) 三.主要仪器与试剂 主要仪器:电子天平,分析天平,250m烧杯(4个),表面皿(4个),滴定管,称量瓶,玻璃棒,干燥器,量筒。 主要试剂:NaOH(S)、邻苯二甲酸氢钾、酚酞
氢氧化钠水溶液的密度和浓度对照表 密度ρ20 kg/m3 浓度密度ρ20 kg/m3 浓度 %(质量)kmol/m3%(质量)kmol/m3 1000 0.159 0.040 1270 24.65 7.824 1010 1.045 0.264 1280 25.56 8.178 1020 1.94 0.494 1290 26.48 8.539 1030 2.84 0.731 1300 27.41 8.906 1040 3.75 0.971 1310 28.33 9.278 1050 4.66 1.222 1320 29.26 9.656 1060 5.56 1.474 1330 30.20 10.04 1070 6.47 1.731 1340 31.14 10.43 1080 7.38 1.992 1350 32.10 10.83 1090 8.28 2.257 1360 33.06 11.24 1100 9.19 2.527 1370 34.03 11.65 1110 10.10 2.802 1380 35.01 12.08 1120 11.01 3.082 1390 36.00 12.51 1130 11.92 3.367 1400 36.99 12.95 1140 12.83 3.655 1410 37.99 13.39 1150 13.73 3.947 1420 38.99 13.84 1160 14.64 4.244 1430 40.00 14.30 1170 15.54 4.545 1440 41.03 14.77 1180 16.44 4.850 1450 42.07 15.25 1190 17.35 5.160 1460 43.12 15.74 1200 18.26 5.476 1470 44.17 16.23 1210 19.16 5.796 1480 45.22 16.73 1220 20.07 6.122 1490 46.27 17.23 1230 20.98 6.451 1500 47.33 17.75 1240 21.90 6.788 1510 48.38 18.26 1250 22.82 7.129 1520 49.44 18.78 1260 23.73 7.475 1530 50.50 19.31
--- 实验氢氧化钠标准溶液的配制与标定 一、实验目的 、掌握氢氧化钠标准溶液的配制和标定方法。1 2、巩固用减量法称量固体物质。 3、熟悉滴定操作并掌握滴定终点的判断。 8 学时。4、本实验需 二、仪器与试剂 )、玻棒、胶头滴管、量筒、容仪器:分析天平、托盘天平、烧杯、碱式滴定管(50mL )、称量瓶、锥形瓶量瓶(1000 mL 、基准邻苯二甲酸氢钾、蒸馏水、酚酞指示剂三、原理NaOH 试剂:固体与方法 ,=Na2CO3 + H2O而生成NaOH 易吸收空气中CO2 Na2CO3,反应式为:2NaOH + CO2
溶液需要标定。因此配制的NaOH )KH C8H4O4)、苯甲酸(C7H6O2)、邻苯二甲酸氢钾(2H2O 标定NaOH 的基准物质有草酸(H2C2O4·滴定液,标定反应如下:等。通常用邻苯二甲酸氢钾标定NaOH 计量点时,生成的弱酸强碱盐水解,溶液为碱性,采用酚酞作指示剂。按下式计算NaOH 滴定液的浓度: m KHC 8 H 4O4 3c10NaOH MV KHC NaOH H O 4 8 4 c(NaOH):NaOH 标准溶液的浓度,mol/L ;式中m :邻苯二甲酸氢钾的质量,g; V :滴定消耗NaOH 标准溶液的体积,mL; M(KHC 8H4O4):KHC8 H4O4 的摩尔质量,204.2 g/mol。 四、实验步骤 1、配制0.1 mol/L 的NaOH 标准溶液
用托盘天平准确称取4.5 g NaOH 固体,加入到预先盛有300 mL 蒸馏水的烧杯中,搅拌 1000 mL 容量瓶中,用蒸馏水洗涤烧杯和冷却至室温,用玻璃棒引流,将烧杯中的溶液加入 2 cm 2~3 玻璃棒次,把洗涤后的水也加入容量瓶中,振荡;向容量瓶中加蒸馏水至离刻度线 --- --- 左右,改用胶头滴管滴加至刻度线,盖上瓶塞,摇匀,贴上标签注明“0.1 mol/L氢氧化钠溶液”, 放置待标定。 2、标定0.1 mol/L 的NaOH 标准溶液 称取已于105℃烘干至恒重的邻苯二甲酸氢钾0.5 ( 0±.02) g,称准至0.0001g,放入250 mL 锥形瓶中,加入约50 mL 蒸馏水使其溶解,加酚酞指示液
氢氧化钠溶液安全技术说明书 第一部分化学品及企业标识 化学品中文名:30%氢氧化钠溶液 化学品俗名或商品名:30%液碱 化学品英文名:Sodium hydroxide;Caustic soda 技术说明书编码:TTSX003 第二部分成分/组分信息 纯品混合物 化学品名称:氢氧化钠溶液 有害成分浓度CAS No. 氢氧化钠30% 1310-73-2 第三部分危险性概述 危险性类别:第8.2类碱性腐蚀品 侵入途径:吸入、食入 健康危害:本品有强烈刺激和腐蚀性。腐蚀鼻中隔;直接接触皮肤和眼可引起灼伤;误服可造成消化道灼伤,粘膜糜烂、出血和休克。环境危害:对水体可造成污染。 燃爆危险:本品不燃,具强腐蚀性、强刺激性,可致人体灼伤。 第四部分急救措施 皮肤接触:立即脱去污染的衣着,用大量流动清水冲洗至少15分钟就医。 眼睛接触:立即提起眼睑,用大量就动清水或生理盐水彻底冲洗至少15分钟。就医。 吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。 食入:用水漱口,给饮牛奶或蛋清。就医。
第五部分消防措施 危险特性:与酸发生中和反应并放热。具有强腐蚀性。 有害燃烧产物:可能产生有害的毒性烟雾。 灭火方法及灭火剂:本品不燃,由其它物质引起火灾时,应注意该物质的腐蚀性。 灭火注意事项:消防人员应穿防酸碱消防服。 第六部分泄漏应急处理 应急处理:隔离泄漏污染区,限制出入。液碱泄漏:收集回收后用水冲洗,冲洗水经中和处理后排入废系统。 消除方法:加入大量水中,调节至中性,再放入废水系统。也可用大量水冲洗,经稀释的洗水放入废水系统。如大量泄漏,收集回收或无害处理后废弃。 第七部分操作处理与储存 操作注意事项:操作人员必须经过专门培训持证上岗,严格遵守 工艺规程和岗位操作法。操作人员穿耐酸碱服,戴耐酸碱手套, 戴防护眼镜。避免与酸类接触。搬运时要轻装轻卸,防止包装及 容器损坏。配备泄漏应急处理设备。应当注意倒空容器内的残留 物。稀释或制备溶液时,应把碱加入水中,避免沸腾和飞溅。 储存注意事项:液碱贮槽应设围堤,并有明显标志。 第八部分暴露控制/个体防护 最高容许浓度:中国MAC(mg/m3):0.5 前苏联MAC(mg/m3):0.5 美国TLV—TWA:OSHA 2 mg/m3 美国TLV—STEL:ACGIH 2mg/m3 监测方法:重量法 工程控制:密闭操作。提供安全淋浴和洗眼设备。 呼吸系统防护:穿耐酸碱服,戴耐酸碱手套,戴防护眼镜。必要时,佩戴空气(氧气)呼吸器。 眼睛防护:呼吸系统防护中已作防护或佩戴防护眼镜。 身体防护:穿耐酸碱服。
密度g/m3 质量分数%摩尔浓度mol/L密度g/m3质量分数,%摩尔浓度mol/L 1.005 0.602 0.151 1.095 8.74 2.391 1.01 1.045` 0.264 1.1 9.19 2.527 1.015 1.49 0.378 1.105 9.645 2.664 1.02 1.94 0.494 1.11 10.1 2.802 1.025 2.39 0.611 1.115 10.555 2.942 1.03 2.84 0.731 1.12 11.01 3.082 1.035 3.29 0.851 1.125 11.46 3.224 1.04 3.745 0.971 1.13 11.92 3.367 1.045 4.2 1.097 1.135 1 2.37 3.51 1.05 4.655 1.222 1.14 1 2.83 3.655 1.055 5.11 1.347 1.145 13.28 3.801 1.06 5.56 1.474 1.15 13.73 3.947 1.065 6.02 1.602 1.155 14.18 4.095 1.07 6.47 1.731 1.16 14.64 4.244 1.075 6.93 1.862 1.165 15.09 4.395 1.08 7.38 1.992 1.17 15.54 4.545 1.085 7.83 2.123 1.175 15.99 4.697 1.09 8.28 2.257 1.18 16.44 4.85 NaOH密度,质量分数与摩尔浓度对应(二) 密度g/m3 质量分数%摩尔浓度mol/L 密度g/m3 质量分数%摩尔浓度mol/L 1.185 16.89 5.004 1.37 34.03 11.65 1.19 17.345 5.16 1.375 34.52 11.86 1.195 17.8 5.317 1.38 35.01 1 2.08 1.2 18.255 5.476 1.385 35.5 1 2.29 1.275 25.1 8 1.39 36 1 2.51 1.28 25.56 8.178 1.395 36.495 1 2.73 1.285 26.02 8.357 1.4 36.99 1 2.95 1.29 26.48 8.0539 1.405 37.49 13.17 1.295 26.94 8.722 1.41 37.99 13.3 1.3 27.41 8.906 1.415 38.49 13.61 1.305 27.87 9.092 1.42 38.99 13.84 1.31 28.33 9.278 1.425 39.495 14.07 1.315 28.8 9.466 1.43 40 14.3
氢氧化钠考点聚焦 氢氧化钠(NaOH),俗称烧碱、火碱、苛性钠,常温下为白色晶体,有强腐蚀性。易溶于水,其水溶液呈碱性,能使酚酞变红。 一、验证二氧化碳与氢氧化钠反应的发生 探究题1.有下列四种实验设计及操作,实验过程中其现象不足以说明C02与Na0H溶液发生了反应的是() 问题:如下装置能否证明CO2与氢氧化钠溶液发生了反应?如能,各自会出现什么样的实验现象? 练习.有下列四种实验设计及操作,实验过程中其现象可以说明C02与Na0H溶液确实发生了化学反应的是() A B C D 二、检验氢氧化钠是否变质 氢氧化钠久露于空气中,不仅会吸收空气中的水分而潮解,而且可以和空气中的二氧化碳气体发生化学反应生成碳酸钠,导致氢氧化钠变质。 检验NaOH溶液是否变质,大致有以下几种方案: 方案一、选择一种酸溶液,如盐酸。但是,所以如果用盐酸来检验时,一定要注意,所取的盐酸的量必须是过量,否则就不可以确定NaOH是否变质。 方案二、选择一种碱溶液,如Ca(OH)2溶液、Ba(OH)2溶液,此方案的灵敏度比较高。 但是要设计方案来验证CO2与NaOH溶液的是否确实发生了化学反应,而不是CO2溶解在NaOH溶液中时。我们就不可以选取此类碱溶液来验证。因为CO2本身就可以溶于水中,形成H2CO3,H2CO3遇到Ca(0H)2或Ba(OH)2时,会生成白色沉淀。而应该从CO2与NaOH反应产
物的角度来验证,可以取通入CO2后液体,向所取液体里加入足量的稀盐酸(或适量CaCl2溶液),充分振荡后,观察现象。 方案三、选择一种盐溶液,如BaCl2溶液。有时,同学们常用CaCl2溶液代替BaCl2溶液检验NaOH是否变质。这种方案存在缺陷。因为当加入的CaCl2溶液中的Ca2+与NaOH中的OH--的浓度比较大时,也会因为一定温度下Ca(OH)2的溶解度相对比较小,而有部分Ca(OH)2晶体析出,使得溶液中出现浑浊现象。所以关于盐的选择,最好选取BaCl2,不宜用CaCl2。 探究题2:四位同学分别用下列四种方法检验NaOH溶液是否已经变质(含有Na2CO3) ①加入少量稀盐酸,无气泡放出,则一定不含有Na2CO3; ②加少量澄清石灰水,有沉淀生成,则一定含有Na2CO3; ③加少量CaCl2溶液,有沉淀生成则一定含有Na2CO3; ④加少量BaCl2溶液,有沉淀生成,则一定含有Na2CO3。 其中探究方法和结论都正确的是() A、①② B、①②③ C、②④、①②③④ 探究题3.向Na2CO3溶液里滴加盐酸,开始时无气泡产生,后来才有气泡产生;向盐酸里滴加Na2CO3溶液时,立即就有气泡产生。这说明() A、Na2CO3过量时,主要发生的反应是 Na2CO3+HCl = NaHCO3+NaCl B、Na2CO3跟盐酸不反应 C、盐酸过量时,主要发生的反应是Na2CO3+2HCl = 2NaCl+H2O+CO2↑ D、产生的气泡是挥发出来的氯化氢气体 三、探究氢氧化钠的变质程度 探究题4:某化学兴趣小组甲、乙、丙三位同学对暴露在空气中的氢氧化钠是否全部变质进行了探究:甲同学,取样品加入盐酸,有气泡产生,完全反应后,蒸干得到的固体全部是氯化钠,认为样品全部变质。 乙同学,取样品加水溶解,滴加无色酚酞试液变红色,认为样品没有全部变质。 丙同学,取样品加水后溶解,先加入过量的A溶液,过滤后在滤液中加入B溶液,通过观察现象得出正确结论:A为 B为。 得出正确结论的理由为。 四、除去氢氧化钠变质后的碳酸钠杂质 变质后的NaOH溶液中会有较多的CO32-,可以加入含Ca2+或Ba2+的溶液,与CO32-结合成沉淀,通过过滤而除去。为了不再引入新的杂质,考虑到原来NaOH溶液中存在OH-,此时选用Ba(OH)2溶液的效果比较好。因为,一定温度下Ca(OH)2溶液的质量分数相对比较小,溶液相对比较稀,除去杂质的效果远远不如用Ba(OH)2溶液好。 答案探究题1:B 1:能,图1中U形管中的红墨水被倒吸进集气瓶中。2:能,图2是锥形瓶内气球胀大。3:能,图3盛氢氧化钠溶液的广口瓶内的长导管口有气泡产生,原因是锥形瓶内二氧化碳气体反应后,气压减少,使盛氢氧化钠溶液的广口瓶内气压也减小,空气沿导管被压入广口瓶内。D 探究题2: C 探究题3:A、C 探究4:甲不正确。乙不正确。丙同学的方案是: BaCl2,无色酚酞试液
氢氧化钠滴定液配制与标定 1误差要求 2 氢氧化钠滴定液(1mol/L、0.5mol/L、0.1mol/L、0.05mol/L、或0.02mol/L、0.01molL) 仪器:分析天平、托盘天平、烧杯、碱式滴定管(50mL)、玻棒、胶头滴管、量筒、容量瓶(1000 mL)、称量瓶、锥形瓶 3 配制:取氢氧化钠适量,加水振摇使溶解成饱和溶液,冷却后,置聚乙烯塑料瓶中,静置数日,澄清后备用。 氢氧化钠滴定液(1mol/L)取澄清的氢氧化钠饱和溶液56ml,加新沸过的冷水使成1000ml,摇匀。 氢氧化钠滴定液(0.5mol/L)取澄清的氢氧化钠饱和溶液28ml,加新沸过的冷水使成1000ml,摇匀。 氢氧化钠滴定液(0.1mol/L)取澄清的氢氧化钠饱和溶液 5.6ml,加新沸过的冷水使成1000ml,摇匀。 4 标定:氢氧化钠滴定液(1mol/L)取在105℃干燥至恒重的基准邻苯二甲酸氢钾约6g,精密称定,加新沸过的冷水50ml,振摇,使其尽量溶解;加酚酞指示液2滴,用本液滴定;在接这终点时,应使邻苯二甲酸氢钾完全溶解,滴定至溶液显粉红色。每1ml氢氧化钠滴定液(1mol/L)相当于204.2 mg 的邻苯二甲酸氢钾。根据本液的消耗量与邻苯二甲酸氢钾的取用量,算出本液的浓度,即得。 氢氧化钠滴定液(0.5mol/L)取在105℃干燥至恒重的基准邻苯二甲酸氢钾约3g,照上法标定。每1ml氢氧化钠滴定液(0.5mol/L)相当于102.1 mg 的邻苯二甲酸氢钾。 氢氧化钠滴定液(0.1mol/L)取在105℃干燥至恒重的基准邻苯二甲酸氢钾约0.6g,照
上法标定。每1ml氢氧化钠滴定液(0.1mol/L)相当于20.42 mg 的邻苯二甲酸氢钾。 如需用氢氧化钠滴定液(0.05mol/L、0.02mol/L、或0.01mol/L)时,可取氢氧化钠滴定液(0.1mol/L)加沸过的冷水稀释制成,必要时可用盐酸滴定液(0.05molL、0.02molL或0.01molL)标定浓度。 5 氢氧化钠滴定液(0.1mol/L)的浓度C(mol/L)按下式计算: M C(mol/L)= V 204.2 式中V:滴定所耗氢氧化钠滴定液的体积(ml) M:基准邻苯二甲酸氢钾的称取量(mg); 204.2与每1ml的氢氧化钠滴定液(1mol/L)相当以mg表示的邻苯二甲酸氢钾的质量; 6 注意事项 1固体氢氧化钠应放在表面皿上或小烧杯中称量,不能在称量纸上称量,因为氢氧化钠极易吸潮,因而称量速度尽量快。 2滴定前,应检查橡皮管内和滴定管尖处是否有气泡,如有气泡应排除,否则影响其读数,会给测定带来误差。 3盛放基准物的3个锥形瓶应编号,以免混淆,防止过失误差。 4有效期为3个月,若过有效期则需重新标定。 5用饱和氢氧化钠液制备应新沸冷水制成而且应陈化6小时左右。排除碳酸钠干扰与二氧化碳。 6制备饱和氢氧化钠时应分多次加入氢氧化钠固体,过饱和后应放置三天后取上清液,应一次取出避免倒流而冲浑液体。 7也可用新制热蒸馏水,但制好后应放至室温,尽量避免二氧化碳干扰。 8基准物(基准物质是分析化学中用于直接配制标准溶液或标定滴定分析中操作溶液浓度的物质。)应在乳钵中研细,利于溶解,在终点前基准应全溶解,否则结果有误。 9标定前贮存聚乙烯塑料瓶中,用虹吸法取用,进气管前端用钠石灰和棉花过滤,定期或钠石灰变色后更换,防止二氧化碳影响浓度。 10工作时应佩戴酸碱手套,防护服等。 11室温下密封存放至阴凉处。
1.000 0.159 0.0393 1.005 0.602 0.151 1.010 1.045 0.264 1.015 1.49 0.378 1.020 1.94 0.494 1.025 2.39 0.611 1.030 2.84 0.731 1.035 3.29 0.851 1.040 3.745 0.971 1.045 4.20 1.097 1.050 4.655 1.222 1.055 5.11 1.347 1.060 5.56 1.474 1.065 6.02 1.602 1.070 6.47 1.731 1.075 6.93 1.862 1.080 7.38 1.992 1.085 7.83 2.123 1.090 8.28 2.257 1.095 8.74 2.391
1.100 9.19 2.527 1.105 9.645 2.664 1.110 10.10 2.802 1.115 10.555 2.942 1.120 11.01 3.082 1.125 11.46 3.224 1.130 11.92 3.367 1.135 12.37 3.510 1.140 12.83 3.655 1.145 13.28 3.801 1.150 13.73 3.947 1.155 1 4.18 4.095 1.160 14.64 4.244 1.165 1 5.09 4.395 1.170 15.54 4.545 1.175 15.99 4.697 1.180 1 6.44 4.850 1.185 16.89 5.004 1.190 1 7.345 5.160 1.195 17.80 5.317
第七次课上机作业 一、查阅“氢氧化钠标准溶液的配制”标准,并阅读。 1.为什么氢氧化钠标准滴定溶液配制时需要标定,而有的滴定液配制时却不需要标定?符合哪些条件才可以用直接法配制标准滴定溶液?标定的原理是什么? 固体NaOH具有很强的吸湿性,还易吸收空气中的CO2生成Na2CO3,且含有少量的硅酸盐、硫酸盐和氧化物等,因此不能直接配制成标准溶液,只能用间接法配制,再用基准物质标定其浓度。常用的基准物是邻苯二甲酸氢钾,标定时用酚酞作指示剂。 能直接配制的标准溶液必须具备下列条件:物质纯度不小于99.9%;物质的组成,包括其结晶水含量,应与化学式相符合;性质稳定,如烘干时不分解,称量时不风化、不潮解、不氧化等;摩尔质量应尽可能大,以减少称量的相对误差。能满足上述条件的常用基准物质,除邻苯二甲酸氢钾外,还有无水Na2CO3、硼砂、硝酸银、氯化钠、碳酸钙等。 2.配制氢氧化钠饱和溶液的目的是什么? NaOH有很强的吸水性和吸收空气中的CO2,因而,市售NaOH中常含有Na2CO3。反应方程式: 2NaOH + CO2 → Na2CO3 + H2O 由于碳酸钠的存在,对指示剂的使用影响较大,应设法除去。 除去Na2CO3最通常的方法是将NaOH先配成饱和溶液(约52%,W/W),配制时边加边搅拌使溶解成饱和溶液,冷却至室温,将溶液连同过量的氢氧化钠转移至聚乙烯塑料瓶中,密塞,静置数日后,由于Na2CO3在饱和NaOH溶液中几乎不溶解,会慢慢沉淀出来,因此,可用饱和氢氧化钠溶液,配制不含Na2CO3的NaOH溶液。 3.如何判断饱和溶液中碳酸钠已沉淀完全? 答:取澄清的氢氧化钠饱和液少许,加水稀释,加氢氧化钡饱和液1毫升,十分钟内不产生浑浊,表示碳酸钠已沉淀完全。 4. 氢氧化钠饱和液的有效期有2个月,在取用放置较久的饱和液时,应注意什么? 答:氢氧化钠饱和溶液在贮存过程中,液面因为吸收二氧化碳而生成少量的碳酸钠膜状物;在取用澄清的氢氧化钠饱和溶液时,宜用刻度吸管插入溶液的澄清部分吸取(注意避免吸管内的溶液倒流而冲浑),以免因混入碳酸钠而影响浓度。 5. 氢氧化钠标准溶液配制时为何要用无二氧化碳的蒸馏水(新煮沸过的冷水)稀释? 答:避免二氧化碳的干扰,水中有CO2,二氧化碳与氢氧化钠反应生成碳酸钠,影响配制。 6. 为何选用邻苯二甲酸氢钾作为基准物质?用其他的试剂为基准物质可以吗? 答:易于提纯,在空气中稳定,不吸潮,易于保存,最常用。也可用草酸。苯甲酸标定碱溶液。 7. 关于基准邻苯二甲酸氢钾的溶解,为何写的是“使之尽量溶解”?如果尽量溶解?如果滴定之前还没有完全溶解,会有什么结果? 答:1)因为邻苯二甲酸氢钾溶解速度比较慢,还会浮在水面上,尤其是接近液面的杯壁处。