
叶绿素的提取及叶绿素铜钠的合成和测定
指导老师:
撰写人:
同组人:
一、实验意义:
叶绿素与蛋白质结合存在于植物的叶和绿色的茎中,是植物进行光合作用所必须的催化剂。它普遍存在于自然界的植物体中,广泛用于医药、化工、食品、饮料等行业的着色剂,对肝、肠、胃、皮肤等疾病有一定的疗效。由于天然叶绿素遇热、光、酸、碱等易分解,(在110度下会分解,)且不溶于水,难溶于甲醇,可溶于石油醚、易溶于乙醚、苯、丙酮、乙醇的酯性溶剂,使其应用受到了限制,故把提取的叶绿素制成叶绿素铜钠使其稳定性、溶解性大大提高。叶绿素铜钠具有色泽亮丽、性能稳定、使用安全等特点,且具有一定的营养价值和保健功能,是一种比叶绿素更为理想的天然色素,可广泛用于果酒、汽水、日用品、食品等生产行业.在医药上用来治疗传染性肝炎、胃、十二指肠溃疡和灼伤等。在我国叶绿素及其衍生物的制取主要以蚕沙为原料且资源丰富,所以我们对叶绿素铜钠盐制备工艺进行系统的研究。
二、实验目的:
1、从干蚕沙中提取叶绿素并计算提取率。
2、研究用叶绿素合成叶绿素铜钠的工艺条件。
3、分析叶绿素铜钠产品的纯度,计算产率。
三、实验原理:
蚕沙又称蚕屎,是我国丰富的农副的资源,其主要成分有:粗蛋白13.47%—14.45%,粗脂肪2.18%-2.29%,粗纤维:15.79%-16.24%,可溶物:56.92%-57.44%(其中果胶占12%),灰份:9.58%-9.95%。叶绿素:1%,有少量粪胡萝卜素,叶黄素和三十烷醇等。
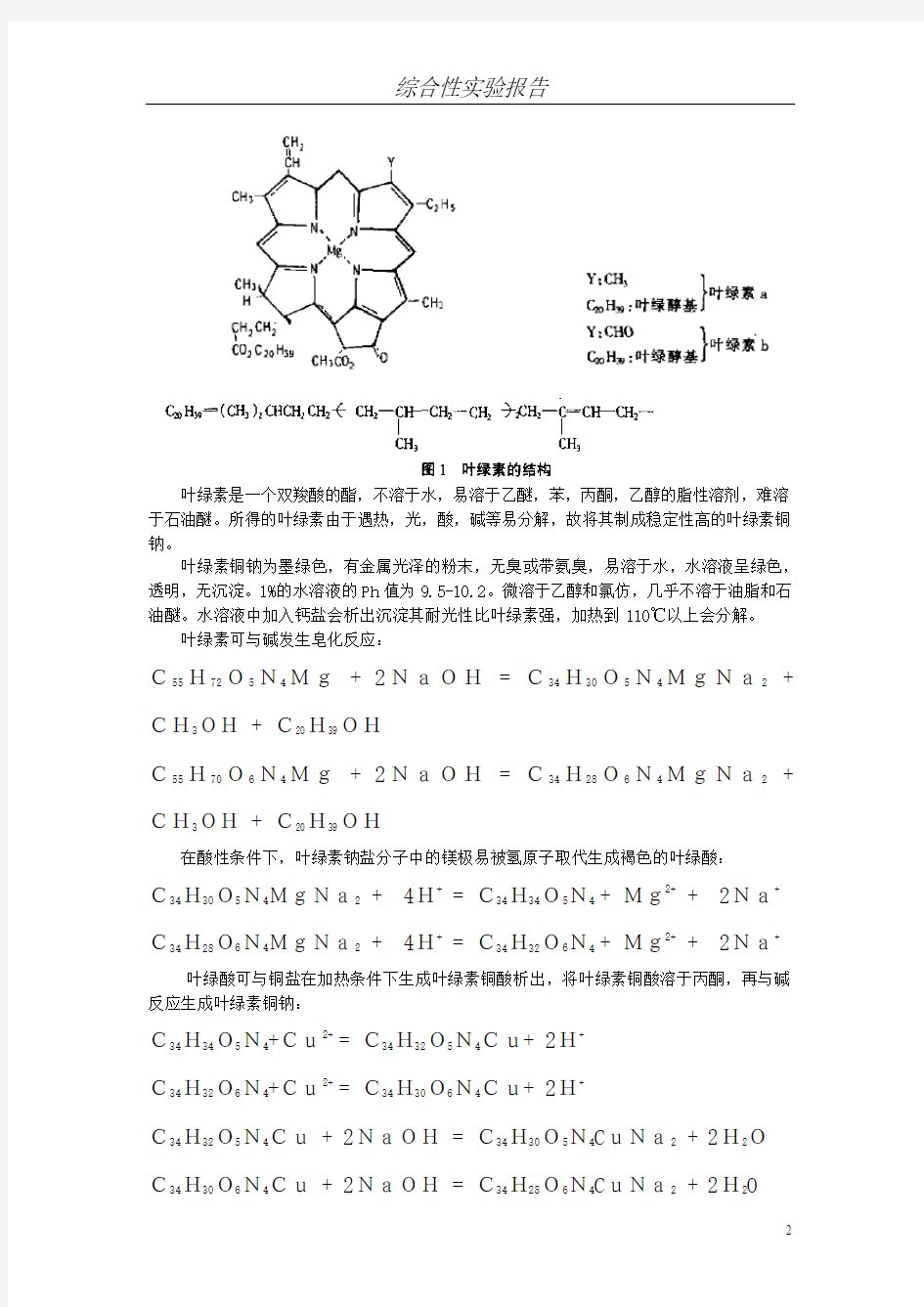
叶绿素是植物吸收太阳能进行光合作用的主要色素,高等植物中含有叶绿素a和叶绿素b分子式如下:
叶绿素是一个双羧酸的酯,不溶于水,易溶于乙醚,苯,丙酮,乙醇的脂性溶剂,难溶
于石油醚。所得的叶绿素由于遇热,光,酸,碱等易分解,故将其制成稳定性高的叶绿素铜
钠。
叶绿素铜钠为墨绿色,有金属光泽的粉末,无臭或带氨臭,易溶于水,水溶液呈绿色,
透明,无沉淀。1%的水溶液的Ph值为9.5-10.2。微溶于乙醇和氯仿,几乎不溶于油脂和石
油醚。水溶液中加入钙盐会析出沉淀其耐光性比叶绿素强,加热到110℃以上会分解。
叶绿素可与碱发生皂化反应:
C55H72O5N4Mg + 2NaOH= C34H30O5N4MgNa2 + CH3OH + C20H39OH
C55H70O6N4Mg + 2NaOH= C34H28O6N4MgNa2 + CH3OH + C20H39OH
在酸性条件下,叶绿素钠盐分子中的镁极易被氢原子取代生成褐色的叶绿酸:
C34H30O5N4MgNa2 + 4H+ = C34H34O5N4 + Mg2+ + 2Na+
C34H28O6N4MgNa2 + 4H+ = C34H32O6N4 + Mg2+ + 2Na+
叶绿酸可与铜盐在加热条件下生成叶绿素铜酸析出,将叶绿素铜酸溶于丙酮,再与碱
反应生成叶绿素铜钠:
C34H34O5N4+Cu2+ = C34H32O5N4Cu+ 2H+
C34H32O6N4+Cu2+ = C34H30O6N4Cu+ 2H+
C34H32O5N4Cu + 2NaOH = C34H30O5N4CuNa2 + 2H2O
C34H30O6N4Cu + 2NaOH = C34H28O6N4CuNa2 + 2H2O
四、实验仪器及材料
1、仪器 721型分光光度计 Ph-2B型酸度计电子天平或分析天平电热恒温水浴加热装置(带温度计)分液漏斗圆底烧瓶(500ml) (25,50,100,250,500ml)烧杯玻璃棒普通过滤装置减压抽滤装置蒸馏装置回流装置(10,100ml)量筒带塞广口瓶(500mL)真空干燥箱旋转蒸发仪容量瓶(10mL,,50mL,100mL)移液管一支(5mL)
2、试剂蚕沙50g 95%丙酮 5%的NaOH-C2H5OH溶液石油醚 1:1盐酸 1mol/L NaOH溶液 30%酒精溶液 pH试纸蒸馏水 95%乙醇 10%CuSO4 40%-50%乙醇磷酸盐缓冲液(PH=7.5)
五.实验步骤:
1、蚕沙的浸泡及溶剂的回收:
称取(干燥)蚕沙50g于500ml四口烧瓶中,用适量水润湿,加入150-200m95%的乙醇溶液使其完全浸没,加塞置于30-400C恒温水浴中搅拌回流浸泡,1.5小时后取出并立即过滤,分离得墨绿色溶液转入500ml圆底烧瓶,按以上步骤浸提三次,滤液用旋转蒸发仪于60-700C水浴蒸出乙醇,蒸馏至约80ml时, 蒸馏结束.回收的乙醇可循环用于下一批蚕沙的浸泡
2、皂化:
将上述滤液转入圆底烧瓶,加入5%的NaOH-C
2H
5
OH溶液,用酸度计调节PH=11,在60o C水浴
回流皂化1小时.将皂化后的溶液冷却转入分液漏斗,用等量石油醚萃取除杂(呈黄色),静置分层,下层为可溶性的叶绿酸盐,按上法提取2—3次。
3、铜代
在皂化液(下层绿色溶液)中加无水乙醇,使溶液中无水乙醇浓度达80%用1:1的HCl酸调PH到7,加入3mL10%的CuSO4,再用HCl调PH到2—3,用水浴加热至60℃,保温搅拌30
—60min,趁热过滤,滤渣用95%的乙醇洗涤抽干3次,合并滤液和洗液,加入等量的蒸馏水,有叶绿素铜酸析出,静置4h过液,滤饼依次用蒸馏水、石油醚洗涤3次至石油醚层变为浅绿色,以除去其中的H+
Cl及残留的叶黄素和其他有机杂质。
4、成盐
洗涤结束后抽干,抽干液用95%的丙酮溶解,加入5%NaOH-乙醇溶液,调节pH为11,搅拌30分,成盐(用滤纸法检验成盐情况:用玻棒点少许溶液放在滤纸上,滤纸不显绿色则说明完全成盐),过滤,滤饼用95%乙醇洗涤4次。取滤饼用少量蒸馏水溶解,接着再过滤,取滤液于小烧杯在60℃下加热蒸发以除去水分得墨绿色结晶物,然后再在60℃下烘箱中烘干结晶物,即制得墨绿色光泽的成品(略有胺味)。
5、叶绿素铜钠质量鉴定
叶绿素铜钠项目和指标:
项目指标
PH值9.0---10.7
1%E405nm(1cm) 568
消光比值 3.2---4.0
干燥失重% 4.0
5.1标准叶绿素铜钠盐的标准曲线
称取标准样品0.01克(精确至0.0002克),加水溶解,移入10 mL容量瓶中,加水至刻度,摇匀。准确取1mL溶液以pH为7.5磷酸盐缓冲液定容为100mL,摇匀,即为0.001%溶液,用分光光度计测定,在15分钟内用1cm 的比色杯,在405nm波长处测定吸光值(A),以缓冲液作空白对照。类似地配制0.0005%溶液、0.0015%溶液、0.002%溶液、0.0025%溶液,用分光光度计测定,在15分钟内用1cm 的比色杯,在405nm波长处测定它们的吸光值(A),以缓冲液作空白对照,并绘制标准曲线。
5.2、标准叶绿素铜钠盐的吸收曲线
称取标准样品0.01克(精确至0.0002克),加水溶解,移入10 mL容量瓶中,加水至刻度,摇匀。准确取1mL溶液以Ph=7.5磷酸盐缓冲液定容为100mL,摇匀,即为0.001%溶液,此液最大吸收峰为405nm与630nm,吸光比A405nm/A630nm为3.2~4.0。用分光光度计测定,用1cm 的比色杯,在350nm-700nm波长处测定溶液吸光值A(每隔5nm或10nm 测定一次),以缓冲液作空白对照,并绘制吸收曲线。
5.3、产品叶绿素铜钠盐的吸光比测定
称取烘干成品0.01克(精确至0.0002克),加水溶解,移入100mL容量瓶中,加水至刻度,摇匀。从容量瓶中准确取2mL溶液移入50mL容量瓶,用pH为7.5磷酸盐缓冲液定容至刻度,摇匀,即为0. 004%溶液,此液最大吸收峰为405nm与630nm。用分光光度计测
定,用1cm 的比色杯,在350nm-700nm 波长处测定溶液吸光值A (每隔5nm 或10nm 测定一次),以缓冲液作空白对照,并绘制吸收曲线。 计算:吸光比=A
A
nm
nm 630405
5.4、PH :
称取0.0100g 叶绿素铜钠溶于蒸馏水配制成1%溶液,用酸度计测其PH 值。
六、实验记录:
七、数据处理:
原料蚕沙的质量M=50.0g
产品叶绿素铜钠的质量:M 1=0.0418g
产品叶绿素铜钠的外观:粉末状墨绿色光泽固体 叶绿素铜钠产率w= 0.0418/50.0×100%=0.084%
产品叶绿素铜钠纯度: 由叶绿素铜钠盐标准曲线(见图1)可得,其标准方程为 Y=43460x+0.0987
通过测定得0.001%叶绿素铜钠溶液在405nm 下的吸光度值
A 405=0.052
在此吸光度值下通过叶绿素铜钠盐标准曲线可得此时的标准百分含量为: ξ=(0.052+0.0987)/478.41=0.000315
既在称取的制备的叶绿素铜钠盐0.0504g 中实际含有的铜钠盐质量为 m=1000×0.000315%=0.00315(g ) 所以产品叶绿素铜钠的纯度
P=(0.00315/0.0418)×100%=7.5% 产品吸收曲线:(图3) 吸光比:吸光比=
A
A
nm
nm 630405=
015
.0052.0=3.47
pH 的测定:浓度为1%的标准液的PH 值为8.88 1、标准曲线的绘制:
表1叶绿素铜钠盐标准曲线的测定数据表(光波长405nm )
标准叶绿素溶液浓度/g/ml
0.000005 0.00001 0.000015 0.00002 0.000025
吸光度
0.291
0.543
0.771
0.998
1.15
图1 叶绿素铜钠盐的标准曲线图
表2样品叶绿素铜钠盐标准曲线的测定数据表
波长/nm 吸光度A 波长/nm 吸光度A 波长/nm 吸光度A 350 0.407 470 0.15 590 0.14 355 0.432 475 0.136 595 0.145 360 0.464 480 0.127 600 0.152 365 0.502 485 0.119 605 0.162 370 0.545 490 0.114 610 0.179 375 0.609 495 0.112 615 0.212 380 0.677 500 0.112 620 0.25 385 0.756 505 0.11 625 0.28 390 0.818 510 0.106 630 0.297 395 0.888 515 0.099 635 0.29 400 0.939 520 0.096 640 0.264 405 0.966 525 0.094 645 0.227 410 0.939 530 0.093 650 0.197 415 0.82 535 0.094 655 0.166 420 0.637 540 0.094 660 0.14 425 0.487 545 0.094 665 0.121 430 0.325 550 0.096 670 0.108 435 0.323 555 0.097 675 0.094 440 0.28 560 0.099 680 0.084 445 0.247 565 0.103 685 0.066 450 0.221 570 0.11 690 0.066 455 0.201 575 0.119 695 0.059 460 0.181 580 0.128 700 0.054 465 0.164 585 0.135
样品标准曲线:
图2 吸光度A—波长曲线
3、吸收曲线的绘制:称取样品质量m =0.0100g ,制0.001%的溶液,测得吸光度如下:
样品吸收曲线如下:
图3 吸光度—波长曲线
八、实验结果分析与讨论:
由实验数据看出此次实验结果不理想,制得的产品的产率和纯度都比较低。其中主要存在和要改进的问题有以下几点:
1、首先是在蚕沙的浸泡及有机溶剂的回收这一步中,浸提的了三次,但是都是不够完全,溶液冲乙醇对蚕沙的浸泡温度以4O~45℃为宜.较低温时提取率降低,较高温度时则溶剂挥发,浸泡过程中温度过高,大约有50多度。在旋转蒸发回收乙醇时,没有注意调节仪器的温度,导致溶液暴沸,液体冲出烧瓶,导致有部分损失。在乙醇的蒸馏回收过程中,时间也有点过长,导致部分溶液变质了,在分离叶绿素及制备叶绿素铜钠的过程中,均应避免高温,否则会因产物的分解而致使收率降低。其次,尽管浸泡时间有4个多小时,但当时室温很低,明显达不到实验要求,从而导致提取率降低很多。
2、在皂化以后,用石油醚萃取过程中,上层杂质还是有少许的绿色,可能是皂化不够完全,也可能由于皂化后静置了一个晚上,导致叶绿素变质,还有就是皂化到冒小气泡为止,而我们没有注意到这个问题。
3、在铜代时,静置四个小时后应该有很多絮状的叶绿素铜酸析出,但是我们的却很少,原因是我们的溶液太稀了,通过旋转蒸发浓缩后,逐渐有絮状物出现。
4、在搅拌成盐1小时后,墨绿色液体中有固体小颗粒或者沉淀析出,我们等到玻璃棒滴在滤纸上扩散的液体为无色时,就进行几次抽滤,但是等过一段时间后却发现滤液中还有一些固体小颗粒,可能是我们没有使其充分搅拌成盐。在烘干这一步也没有做到位,是产品中混进了许多杂质。
九、实验心得与体会:
1通过本次实验,对基本实验的操作和种仪器的使用有了更深一步的了解。本实验中我学会了独立思考问题,对于做不出来的现象,能自己找出原因或者向老师同学请教,最终找出可行的办法。在提高自己的动手能力的同时也提高了学习的兴趣。
2 在实验过程中要培养自己严谨的实验态度,做实验要有足够的耐心。
3 欲速则不达,急躁只会导致实验失误。细心是做好每一步的关键。
4 合理利用手头上所得到的资料,但是资料毕竟是作为参考的,每一步我们都得弄懂其来
源,不能懵懵懂懂地生搬硬套,需要我们思考,及时纠正错误
植物生理学实验 叶绿体色素的提取分离及其理化性质 姓名 学号 系别 班级 实验日期 同组姓名
摘要:为探究植物叶绿素理化性质,根据不同的叶绿体色素分子结构不同,在有机溶剂中的溶解性和吸附剂上的吸附性差异,本实验在提取菠菜叶片叶绿体色素(叶绿素和类胡萝卜素)后,利用纸层析法将不同的色素分离的方法,对植物叶绿素的理化性质进行观察与检验。 一、实验原理及实验目的 实验原理: 1、提取: 叶绿体中含有叶绿素(叶绿素a与b)和类胡萝卜素(胡萝卜素和叶黄素),这两类色素均不溶于水,而溶于有机溶剂,故常用乙醇、丙酮等有机溶剂提取。 2、分离: 当溶剂沿支持物不断向前推进时,由于叶绿体中不同色素分子结构不同,在两相(流动相与固定相)间具有不同的分配系数,因此它们移动速率不同。对叶绿体色素进行层析可将不同色素分离。 3、理化性质的观察: 叶绿素是一种二羧酸酯,在碱作用下,发生皂化反应;在弱酸作用下,叶绿素中镁可被氢原子取代而成为褐色的去镁叶绿素,后者遇铜则成为绿色的铜代叶绿素,叶绿素具有荧光,故从与入射光相垂直的方向观察叶绿素溶液呈血红色。叶绿素的化学性质不稳定,易受强光氧化,特别是当叶绿素与蛋白质分离后,破坏更快。 分子吸收光能后,从基态转变到激发态。叶绿素分子有两种单线激发态,对应两个主要的光吸收区。 分子在激发态停留的时间不超过数纳秒(10-9秒) 由激发态回到基态的过程称为衰变(Decay)。 叶绿素a:C 55H 72 O 5 N 4 Mg,MW=893.4891 叶绿素b:C 55H 70 O 6 N 4 Mg,MW=907.4727 胡萝卜素:C 40H 56 , MW= 536.8726 叶黄素:C 40H 56 O 2 , MW=568.8714 实验目的: 以植物叶片组织为材料,提取叶绿体色素;以纸层析法分离其成分;鉴定叶绿体色素的理化性质. 二、实验材料和方法 1、实验材料:菠菜 2、实验用具:天平、研钵、三角漏斗、滤纸、层析缸、毛细管、分光镜、量筒、烧杯、试 管等 3、实验试剂:丙酮、碳酸钙、层析液(石油醚:丙酮=25:3),20%KOH-甲醇、乙醚、1%HCl、 醋酸铜 三、实验步骤 1、叶绿体色素的提取 (1)取新鲜菠菜叶片2克,擦干,去中脉,剪碎放入研钵; (2)加入少许石英砂和CaCO 3 ,再加入无水丙酮10ml,研磨成匀浆,再加丙酮15ml; (3)用漏斗滤去残渣,得叶绿体色素提取液(置于暗处). 2、纸层析分离叶绿体色素 (1)层析样纸制备,将优质滤纸剪成3cm×9cm的长条,将一端剪成中央留约1cm×0.5cm的
遮光后叶绿素含量升高和叶绿素a/b降低的原因 试题:如图,叶绿素的含量随着遮光比例的升高而升高,遮光后叶绿素a/b 降低,捕光能力上升。原因。 因为学生知道,光是叶绿素形成的必需条件,所以大部分学生都错误认为叶绿素含量随光照增强而增加。 从资料中可以看出,这些变化都是为了适应植物在遮光条件下的生长。 一、遮光后叶绿素含量为什么会升高 叶绿素含量受到光照、温度、矿质元素、逆境等外界因素及核基因、质基因等内在因素的共同影响,在外部因素中光对叶绿素的合成与分解起主导作用。植物体中叶绿素的合成和分解处于一个动态平衡中,叶片光照后,才能顺利地合成叶绿素,但形成叶绿素所要求光照强度相对较低,当然过弱也不利于叶绿素的生物合成,除680nm以上波长以外,可见光中各种波长的光照都能促使叶绿素形成,光过强反而会发生光氧化而受破坏。 植物中叶绿素和蛋白质结合为结合态叶绿素才能发挥作用,而自由态的叶绿素则会对细胞造成光氧化损伤。为了避免自由态叶绿素对细胞造成的光氧化损伤,植物必须快速降解这些物质。 在遮光条件下,集光色素蛋白在光合单位中的相对含量会增加,从而导致结合态叶绿素增加。与此同时,降低了叶绿素的降解和光氧化,所以遮光后叶绿素的含量会增加。 遮荫环境下,植物通过增加单位叶面积色素密度和叶绿素含量,有利于提高植株的捕光能力,吸收更多的光,提高光能利用率,是对弱光环境的一种适应。 二、遮光后叶绿素a/b降低 在不同生理条件下,叶绿素a和叶绿素b的合成、分解速度影响了叶绿素a/b的比值,但调节叶绿素a/b的比值主要通过“叶绿素循环”实现。叶绿素a 和叶绿素b的相互转化称为“叶绿素循环”。 在遮光条件下,叶绿素a向叶绿素b的转化加快,叶绿素a水解形成脱植基叶绿素a,脱植基叶绿素a再转化为脱植基叶绿素b,最后合成叶绿素b,从而降低了叶绿素a/b的比值。弱光下叶绿素b的相对含量增高是有其生理适应,有利于对弱光的利用。
叶绿素a测定实验报告 (一)实验目的及意义 水体富营养化可以通过跟踪监测水中叶绿素的含量来实现,其中叶绿素a是所有叶绿素中含量最高的,因此叶绿素a的测定能示踪水体的富营养化程度。 (二)水样的采集与保存 1.确定具体采样点的位置 2.在采样点将采样瓶及瓶盖用待测水体的水冲洗3-5遍 3.将采样瓶下放到距水面0.5-1m处采集水样2.5L 4.在采样瓶中加保存试剂,每升水样中加1%碳酸镁悬浊液1mL 5.将采样瓶拧上并编号 6.用GPS同步定位采样点的位置 (三)仪器及试剂 仪器: 1.分光光度计 2.比色池:10mm 3.过滤装置:过滤器、微孔滤膜(孔径0.45μm,直径60mm) 4.研钵 5.常用实验设备 试剂: 1.碳酸镁悬浮液:1%。称取1.0g细粉末碳酸镁悬浮于100mL蒸馏水中。每次使用时要充分摇匀 2.乙醇溶液 (四)实验原理 将一定量的试样用微孔滤膜过滤,叶绿素会留在滤膜上,可用乙醇溶液提取。 将提取液离心分离后,测定750、663、645、630mm的吸光度,计算叶绿素的浓度。 (五)实验步骤 1.浓缩:在一定量的试样中添加0.2mL碳酸镁悬浮液,充分搅匀后,用直径60mm 的微孔滤膜吸滤.过滤器内无水分后,还要继续抽吸几分钟.如果要延时提取,可把载有浓缩样品的滤膜放在干燥器里冷冻避光贮存。 2. 提取:将载有浓缩样品的滤膜放入研钵中,加入7mL乙醇溶液至滤纸浸湿的程度,把滤膜研碎,再少量地加乙醇溶液,把滤膜完全研碎,然后用乙醇溶液将已磨碎的滤膜和乙醇溶液洗入带刻度的带塞离心管中,使离心管内提取液的总体积不超过10mL,盖上管塞,置于的暗处浸泡24h。 3.离心:将离心管放入离心机中,以4000r/min速度离心分离20min。将上清液移入标定过的10mL具塞刻度管中,加少量乙醇于原提取液的离心管中,再次悬浮沉淀物并离心,合并上清液。此操作重复2-3次,直至沉淀不含色素为止,最后将上清液定容至10mL。 4.测定:取上清液于10mm的比色池中,以乙醇溶液为对照溶液,读取波长750,663,645和630mm的吸光度。
实验报告 课程名称: 植物生理学(乙)指导老师: 廖敏 成绩: 实验名称: 叶绿素理化性质和含量 实验类型: 定量探究型 同组学生姓名: 方昊 一、实验目的和要求(必填) 三、主要仪器设备(必填) 五、实验数据记录和处理 七、讨论、心得 二、实验内容和原理(必填) 四、操作方法和实验步骤 六、实验结果与分析(必填) 一、实验目的和要求 掌握植物中叶绿体色素的分离和性质鉴定、定量分析的原理和方法; 二、实验内容和原理 以青菜为材料,提取和分离叶绿体色素并进行理化性质测定和叶绿素含量 分析。原理如下: 1. 叶绿素和类胡萝卜素均不溶于水而溶于有机溶剂,常用95%的乙醇或80%的丙酮提取; 2. 叶绿素是二羧酸酯,与强碱反应,形成绿色的可溶性叶绿素盐,就可与有机溶剂中的类胡萝卜素 分开; 3. 在酸性或加温条件下,叶绿素卟啉环中的Mg++可依次被H+和Cu++取代形成褐色的去镁叶绿素和绿色的铜代叶绿素; 4. 叶绿素受光激发,可发出红色荧光,反射光下可见红色荧光; 5. 叶绿素吸收红光和蓝紫光,红光区可用于定量分析,其中645和663用于定量叶绿素a 、b 及总量,而652可直接用于总量分析。 专业:农业资源与环境 姓名: 吴主光 学号: 3110100403 日期: 2013.10.17 地点: 生物实验中心 装 订 线
三、主要仪器设备 1. 天平(万分之一)、可扫描分光光度计、离心机、研具、各种容(量)器、洒精灯等 四、操作方法、实验步骤以及实验现象 定性分析: 鲜叶5g+95%30ml(逐步加入),磨成匀浆 过滤入三角瓶中,观察荧光现象:透射光绿色,反射光红色。 皂化反应(3ml):加KOH数片剧烈摇均,加石油醚5ml和H2O1ml分层后观察:上层呈黄色,为类胡萝卜素,吸收蓝紫光;下层呈绿色,为叶绿素,吸收红光和蓝紫光。 取代反应(1):加醋酸约2ml,变褐(去镁叶绿素);取1/2加醋酸铜粉加热,变鲜绿色,为铜代叶绿素。 取代反应(2):鲜叶2-3cm2,加Ac-AcCu 20ml加热,观察: 3 min变为褐绿色的去镁叶绿素, 5 min后,变为深绿色的铜代叶绿素。 叶绿素和类胡萝卜素的吸收光谱测定: 皂化反应的上层黄色石油醚溶液(稀释470nm OD 0.5-1) 反复用石油醚粹取,直到无类胡萝卜素,离心得叶绿素(盐)(稀释663nm OD 0.5-1) 在400-700nm处扫描光谱,分别测定类胡萝卜素和叶绿素的吸收峰. 叶绿素定量分析:鲜叶0.1g,加1.9mlH2O,磨成匀浆,取0.2ml加80%丙酮4.8ml,摇匀,4000转离心3min,上清液在645,652,663测定OD,计算Chla,Chlb 和Chl总量的值。 五、实验数据记录和处理
叶绿素含量的测定 一、原理 根据叶绿体色素提取液对可见光谱的吸收,利用分光光度计在某一特定波长测定其吸光度,即可用公式计算出提取液中各色素的含量。根据朗伯—比尔定律,某有色溶液的吸光度A与其中溶质浓度C和液层厚度L成正比,即A=αCL式中:α比例常数。当溶液浓度以百分浓度为单位,液层厚度为1cm时,α为该物质的吸光系数。各种有色物质溶液在不同波长下的吸光系数可通过测定已知浓度的纯物质在不同波长下的吸光度而求得。如果溶液中有数种吸光物质,则此混合液在某一波长下的总吸光度等于各组分在相应波长下吸光度的总和。这就是吸光度的加和性。今欲测定叶绿体色素混合提取液中叶绿素a、b和类胡萝卜素的含量,只需测定该提取液在三个特定波长下的吸光度A,并根据叶绿素a、b 及类胡萝卜素在该波长下的吸光系数即可求出其浓度。在测定叶绿素a、b时为了排除类胡萝卜素的干扰,所用单色光的波长选择叶绿素在红光区的最大吸收峰。 二、材料、仪器设备及试剂 (一)材料:新鲜(或烘干)的植物叶片。 (二)仪器设备:1)分光光度计;2)电子顶载天平(感量0.01g);3)研钵;4)棕色容量瓶; 5)小漏斗;6)定量滤纸;7)吸水纸; 8)擦境纸;9)滴管。 (三)试剂:1)95%乙醇(或80%丙酮)(v丙酮:v乙醇=2:1的95%水溶液);2)石英砂;3)碳酸钙粉。暗中2h,0.5g,25ml 三、实验步骤 1)取新鲜植物叶片(或其它绿色组织)或干材料,擦净组织表面污物,剪碎(去掉中脉),混匀。 2)称取剪碎的新鲜样品 0.2g ,共3份,分别放入研钵中,加少量石英砂和碳酸钙粉及2~3ml 95%乙醇,研成均浆,再加乙醇10ml,继续研磨至组织变白。静置3~5m 3)取滤纸1张,置漏斗中,用乙醇湿润,沿玻棒把提取液倒入漏斗中,过滤到25ml棕色容量瓶中,用少量乙醇冲洗研钵、研棒及残渣数次,最后连同残渣一起倒入漏斗中。 4)用滴管吸取乙醇,将滤纸上的叶绿体色素全部洗入容量瓶中。直至滤纸和残渣中无绿色为止。最后用乙醇定容至25ml,摇匀。 5)把叶绿体色素提取液倒入光径1cm的比色杯内,以95%乙醇为空白,在波长663nm 和645nm下测定吸光度。在波长663nm、645nm下或652nm测定吸光度。 四、实验结果计算 叶绿素a的含量 = 12.7 ? OD 663 – 2.69 ? OD 645 叶绿素a的含量 = 22.9 ? OD 645 – 4.86 ? OD 663 叶绿素a、b的总含量 = 8.02 ? OD 663 + 20.20 ? OD 645
上肠ksd.(湖泊科学),2010,22(6):965-968 http:∥www.jlakes.org.E-mail:jhk∞@IligIas.ac.cn @20lOby如£册耐矿kksc泐鲫 YSI(多参数水质检测仪)测定叶绿素a浓度的准确性及误差探讨‘刘苑1”,陈宇炜H。,邓建明1’2 (1:中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,南京210008) (2:中国科学院研究生院,北京lo0049) 摘要:Ysl(多参数水质检测仪)由于其快速、轻便的特点,已广泛应用于野外水体中时绿素a的测定.通过将Y跚溯得的叶绿素a值与分光光度法测定值进行比较,对Ysl6600水质测定的准确性和数据采集进行评估.结果显示,Ysl测定值多数偏低。且与分光光度法测定值之间存在显著性差异;时间上,冬季比夏季具有更大的线性相关性.分段同归结果显示,随着叶绿素a浓度不断增大.两组数据的差值也不断增大.YsI测定误差产生于3个方面:(1)测定前YsI校准方法的不同;(2)其它种类具有荧光特性色素的存在;(3)YsI自身结构. 关键词:叶绿素a浓度;YSI;分光光度法;误差 DisCussiOn0naccuracyanderrOrSforphytopIanI∞nchlorophy¨-aconcentra埘0nanaIySiSusingYSl(MuItI-parameterwateranalyzer) U[UYu觚1r,C胍NYhweil&DENGJi柚min91.2 巧scie,lces.Nn嘲i他2、000s.P.Rcht舱)(1:胁把研k幻加fo秽巧上4妇&妇懈4耐勖佃研珊跏f,觑l咖g肺咄姚可&珊,印砂研d肠彻咖,劭加甜PAc扭娜(2:G,眦妇纪&幻Dz盯cJ咖e卵A棚d唧矿&£伽,&驴f,增l(-D049,P.尼西f,埘) Abst陀ct:YsI(Mlllti?pa强ln曲盱waler锄aly蹭r)is诵delyusedto山把皿i肿phytlDm锄kton 6eIdschl啪phyll-aconcentr撕加inm蛐ybec舢卵0fitsrapidne睇锄dportablene鹄.Tbepu叩∞e0ftllis咖由i8t0evalu砒etIlee伍c卵y0ft王leYSIEn“姒蛐entalMo_Ili试ngsye锄hw栅qIlalityⅡ地a棚他眦“tsanddalacouectionbycompfariItgtw0group邑0fdala憾illg蚰啪ltory耐}
实验题目: 湖塘水体叶绿素a测定 姓名:学号: 班级:组别:第一组 指导教师: 1.实验概述 1.1实验目的及要求 (1)初步了解叶绿素a测定的原理和常规测定方法; (2)通过实验,掌握叶绿素。的测定方法及富营养化水样的前处理方法; (3)熟练掌握抽滤装置及分光光度计的使用。 1.2实验原理 浮游植物的主要光合色素是叶绿素((Chlorophyll),常见的有叶绿素a、b和c。叶绿素a (chl-a >存在于所有的浮游植物中,大约占有机物干重的1-2%,是估算浮游植物生物量的重要指标,因此浮游植物叶绿素a含量的测定成为浮游植物生物量的重要指标而被广泛应用。 浮游植物叶绿素a的测定方法有许多种,根据所使用的仪器可以分为高效液相色谱法 萃取效率比较低,使得甲醇和乙醇成为替代丙酮的色素萃取剂。不过,甲醇对人体毒害性大,且在酸化过程中容易产生误差,于是,乙醇成为现在广泛应用的叶绿素a的萃取剂。超声破碎法因快速、提取效率高等特点也被研究者所青睐。 本实验介绍一种以热乙醇为萃取溶剂,结合超声细胞破碎法为基础的叶绿素a含量侧定方法。 2.实验内容 2.1实验方案设计 每组选择一个池塘,实地取水样,测定水样的叶绿素a含量。 2.2实验条件 2.2.1实验仪器: 1) 幼分光光度计1台; 2)抽滤装置(砂芯过滤器、负压表、真空泵等)1台; 3)4000r/min离心机1台; 4) 15mL带刻度及螺旋盖的离心分离试管6个; 5)恒温水浴锅1台; 6)直径47 mm的醋酸纤维滤膜; 8)超声细胞破碎仪 9 ) icm玻璃比色皿2个 10)表面皿若干 11)10mL比色管7个; 2.2.2实验材料 1)90%乙醇 2)1mol/L盐酸 2.3实验过程(实验步骤、记录、数据、分析) 2.3.1实验步骤 叶绿素含量的测定 一、原理 根据叶绿体色素提取液对可见光谱的吸收,利用分光光度计在某一特定波长测定其吸光度,即可用公式计算出提取液中各色素的含量。 根据朗伯—比尔定律,某有色溶液的吸光度A 与其中溶质浓度C 和液层厚度L 成正比,即A =αCL 式中:α比例常数。当溶液浓度以百分浓度为单位,液层厚度为1cm 时,α为该物质的吸光系数。各种有色物质溶液在不同波长下的吸光系数可通过测定已知浓度的纯物质在不同波长下的吸光度而求得。 如果溶液中有数种吸光物质,则此混合液在某一波长下的总吸光度等于各组分在相应波长下吸光度的总和。这就是吸光度的加和性。今欲测定叶绿体色素混合提取液中叶绿素a 、b 和类胡萝卜素的含量,只需测定该提取液在三个特定波长下的吸光度A ,并根据叶绿素a 、b 及类胡萝卜素在该波长下的吸光系数即可求出其浓度。在测定叶绿素a 、b 时为了排除类胡萝卜素的干扰,所用单色光的波长选择叶绿素在红光区的最大吸收峰。 已知叶绿素a 、叶绿素b 的80%丙酮溶液在红外区的最大吸收峰分别位于663、645nm 处。已知在波长663nm 下叶绿素a 、叶绿素b 在该溶液中的吸光系数的分别为82.04和9.27;在波长645nm 处的吸光系数分别为16.75和45.60。根据加和性原则列出以下关系式: A663=82.04Ca+9.27Cb (1) A645=16.76Ca+45.60Cb (2) 式(1) (2)A 663nm 和A645nm 为叶绿素溶液在663nm 和645nm 处的吸光度,C a C b 分别为叶绿素a 、叶绿素b 的浓度,以mg/L 为单位。 解方程(1) (2)组得 C a =12.72 A 663—2.59 A 645 (3) C b =22.88 A 645—4.67 A 663 (4) 将C a +C b 相加即得叶绿素总量C T C T = C a 十C b =20.29A 645—8.05 A 663 (5) 从公式(3)、(4)、(5)可以看出,,就可计算出提取液中的叶绿素a 、b 浓度另外,由于叶绿素a 叶绿素b 在652nm 的吸收峰相交,两者有相同的吸光系数(均为30.5),也可以在此波长下测定一次吸光度(A 652)而求出叶绿素a 、叶绿素 b 总量 所测定材料的单位面积或单位重量的叶绿素含量可按下式进行计算: C T = 5 .341000 652 A (6) 有叶绿素存在的条件下,用分光光度法可同时测出溶液中类胡萝卜素的含量。Licht-enthaler 等对Arnon 进行了修正,提出了 80%丙酮提取液中3种色素含量的计算公式: C a =12.21A 663—2.59 A 646 (7) 叶绿素的药理功能及特性 ■叶绿素的药理功能 叶绿素是植物中含的绿色色素,植物细胞内的叶绿体吸收太阳光能源,从水和空气中CO2合成糖等有机物。叶绿素结构类似动物血液中的红色素,为维持生命不可缺的重要物质。 叶绿素存在许多类似体,高等绿色植物和绿藻等含叶绿素a和b,褐藻、硅藻等含叶绿素a。为提高稳定性,食品和医药品中用叶绿素诱导体为多。 叶绿素有多种药理效果引起食品界的注目。铜叶绿素、铜叶绿素钠、铁叶绿素钠早在上世纪60年代初就被作为食品添加剂,用于口香糖、蔬菜等加工品的着色。日本研究表明,叶绿素的诱导体可作胃肠药、口臭防止药、洗口液等成分。 具体说,叶绿素有下列重要药理功能: 创伤治愈作用 叶绿素能促进切伤、火伤、溃疡等伤口的肉芽新生、加快治愈作用。对创伤、溃疡局部涂布能使创伤面干燥,加快肉芽及上皮细胞的产生,明显促进创伤治愈。 脱臭作用。叶绿素能除去饮食、香烟及新陈代谢产生的口臭、脚臭、腋下恶臭、饮酒后酒气臭。铜叶绿酸钠有显著抑制口臭的挥发性硫化物的效果。 抗过敏作用。铜叶绿酸钠对治疗顽固性慢性荨麻疹、顽固性慢性湿疹、支气管哮喘及冻疮均有明显效果。叶绿素的抗过敏作用强。 抗溃疡作用。据国外对鼠试验,对幽门结扎溃疡的鼠同时投服叶绿酸作制酸剂和抗胆碱药有明显抗溃疡效果。 肠蠕动功能亢进作用。叶绿素能使肠道蠕动轻度亢进,解消便秘。 抗变异原性。叶绿酸、叶绿素能和发癌物质Trp-p-2的活性体形成复合体,使其不活化,还能抑制黄曲霉素、苯并芘等变异原物质。 制癌作用。叶绿酸钠能使肝癌细胞的增殖消失。叶绿素提取物有抗肿瘤功能及大大提高肿瘤的光导疗法效果。 降血清胆固醇作用。叶绿素的分解物脱镁叶绿素及叶绿酸均有降低胆固醇效果。 叶绿素来自天然植物,安全性高,作为绿色的叶绿素的应用将更加广泛,在食品中作健康与功能食品添加剂。 ■叶绿素的制造及性质 叶绿素制造,以小球藻等为原料,用丙酮等有机溶剂提取,得到叶绿素a、b的混合物。但这种天然的叶绿素受光线(特别是紫外线)和热分解、易褪色。对酸非常不稳定,其中金属镁容易脱离生成脱镁叶绿素,呈褐色。 将叶绿素中的镁用铜、铁等置换,能使稳定化。以酯结合的叶绿醇用碱加水分解得到叶绿酸,叶绿酸的钠或钾盐溶于水。市售的叶绿素,是将叶绿素的镁置换为铜的铜叶绿素,铜叶绿素被钠、铁置换成水溶性的铁叶绿酸钠。 叶绿素为黑绿~浓绿色的油或膏状,易溶于醚、丙酮等有机溶剂和油脂类,微溶于乙醇,不溶于水,因此因乳化剂呈分散性制剂。铜叶绿素外观、溶解性和叶绿素相同,色调呈强绿色。 铜叶绿素酸钠及铁叶绿酸钠是青黑色~暗绿色的粉末。易溶于水或稀酒精溶液中,不溶于油脂类中,但在酸性溶液中钠游离而使不溶于水,在钙镁离子等存在下,生成不溶性的盐,因此用水须非常注意。 基于高光谱和高分一号卫星影像的冬小麦叶绿素遥感反演 小麦是世界上分布范围最广,种植面积最大的粮食作物之一,也 是我国的主要农作物之一。而叶绿素含量与植物的光合作用能力与生长状态密切相关,是植被光合能力强弱、营养生理状况以及衰老进程的良好指示剂,其含量的测定对农作物长势监测、施肥调控与产量评估具有重要意义。通过高光谱数据和卫星影像数据反演叶绿素等与农作物长势,产量密切相关的参数,可以实现农作物的长势监测从而为 农作物生产提供指导作用和参考价值。本研究以不同生育时期不同区域的冬小麦为研究对象,通过田间试验,获取了冬小麦高光谱数据、GF1卫星影像数据以及叶绿素含量(Chl),通过计算和数理统计分析比较,构建了冬小麦叶绿素含量最佳估算模型,并借助GF-1影像对冬小麦拔节期冠层叶绿素含量进行空间反演及精度验证。为冬小麦长势监测和田间精准管理提供理论依据和技术支撑。取得的主要结论如下:(1)冬小麦叶片叶绿素含量(Chl)在不同生育时期差异显著,且随着生育进程的推进呈现出逐步上升的变化趋势;冬小麦冠层叶绿素含量(Chl)随着生育进程的推进呈现出先上升后下降的变化趋势。总体来看,叶片尺度的Chl值均大于冠层尺度的Chl值。(2)原始光谱随着叶绿素含量的增加,在可见光区域反射率降低而在近红外区域反射率增加;不同叶绿素水平的叶片光谱反射率均比冠层光谱反射率高,在可见光波段更显著;叶片在不同Chl水平下红边特征有差异,红边 位置随Chl增加而不断发生“红移”,并且存在“双峰”或“多峰”的现象。随着生育期的推进,叶片光谱反射率在可见光波段的反射率 越来越低,在近红外波段反射率越来越高;冠层光谱反射率在可见光波段先降低后升高,在近红外波段相反。不同生育期和不同叶绿素含量下,冬小麦冠层光谱红边位置分布在735 nm附近,而冬小麦叶片光谱红边位置分布于710nm附近。(3)在4个生育期,一阶导数与Chl 值的相关性均强于原始光谱与Chl值的相关性,叶片光谱与Chl相关性强于冠层光谱。选取敏感波段作为自变量对叶片Chl进行反演,模型拟合精度除灌浆期外均较差。选择相关性高的“三边”参数建立Chl估算模型,冠层尺度下,除了开花期最优模型为基于黄边位置λ yellow构建的模型,其他生育期最优模型均为基于(SDr-SDb)/(SDr+SDb)构建的模型;叶片尺度下,拔节期、抽穗期、开花期和灌浆期最优模型依次为为基于(SDr-SDy)/(SDr+SDy)、SDr/SDb、红边位置λred、(SDr-SDy)/(SDr+SDy)构建的模型。除了灌浆期,其它生育期基于三边参数构建的冬小麦Chl 估算模型精度较单因素模型均有所提高。(4)分析15种植被指数与Chl的相关关系,筛选出8种植被指数构建Chl单素估算模型。在冠层尺度下,四个生育期最优模型分别为基于OSAVI、PRI、PRI、VOG2构建的模型;在叶片尺度下,四个生育期最优模型分别为基于 FD730/525、FD730/525、VOG2、FD(730-525)/(730+525)构建的模型。除灌浆期冠层尺度最佳模型为基于敏感波段D751构建的模型外,其它基于植被指数的模型精度较三边参数均有所提高,是冬小麦Chl值的最佳单因素估算模型。(5)将筛选出的精度较高的高光谱参数作为自变量, 叶绿素含量的测定 绿素含量的绿定叶 一、绿绿目的 1.了解分光光度绿的工作原理~ 2.掌握不同型分光光度绿的操作方绿~号 3.通绿本绿绿的绿掌握绿素含量绿定的一绿常绿的方法学叶------分光光度法。 二、绿绿原理 叶叶体体体叶绿素是脂溶性色素~主要存在于以绿绿首的色素中。在活中~绿绿 素脂蛋白绿合受到绿原系绿的保绿~绿和光是绿定的。与并氧 叶绿素的80%丙绿提取液在波绿663nm~645nm有吸收峰~绿素叶a和绿素叶b 的绿度符合以下公式, C=0.0127A-0.00259A a663645 C=0.0229A-0.00467A绿度绿位是,g/Lb645663 C=12.7A-2.59Aa663645 C=22.9A-4.67A绿度绿位是,mg/Lb645663 叶绿素绿绿度绿, C=C+CTab 若以绿液中色素含量表示~绿来 三、绿器、绿绿和材料 1.绿器 紫外-可绿分光光度绿、、研体25ml容量、璃漏斗、璃棒、皮绿滴管瓶玻玻2. 绿绿 丙绿;分析绿,、85%丙绿、80%丙绿 2.材料 绿绿、石英砂、酸绿碳 四、操作步绿 1. 在遮光件下取出等绿绿品~剪碎~混~取绿绿条匀称0.1-0.5g~ 2. 绿品置于绿~加入少量酸绿和石英砂~加入一定绿的丙绿磨绿绿~再加研内碳体研匀 85%丙绿适量绿绿磨至绿绿白色~研 3. 绿绿有绿绿的漏斗绿液绿入将匀25ml的容量中~用瓶并80%的丙绿分次洗绿和绿绿清研~ 最后用80%的丙绿定容。 4. 以80%的丙绿绿比液~在参663和645nm波绿绿绿定吸光绿;A绿在0.2-0.8范绿~内 绿度绿大绿用80%丙绿适稀绿,。当 五、绿果绿理 按照公式绿算出绿素叶a和绿素叶b的绿度~再绿算出绿素的含量。叶六、 注意事绿 1. 在活~绿合绿绿素是绿定的~绿绿一绿破~绿素易被光解。因此~抽提和绿体内叶坏叶 定工作绿可能避光快速完成。尽 2. 绿含有大量酸性液泡的绿品~绿首先加入微性的绿液~仔绿磨后加入丙绿绿行碱冲研抽提。 3. 分光光度绿的精度绿绿定的绿果有至绿重要的影~使用前绿绿器绿行校正。响七、思考绿 一、实验课题名称:不同环境条件下植物叶绿素a、b含量的比较 二、选题背景或文献综述: 《植物生理学实验指导》(第四版)、《植物生理学》(第六版)、上网查阅相关资料 阴生植物也称“阴性植物”,是在较弱的光照条件下生长良好的植物,但并不是阴生植物对光照强度的要求越弱越好,而是必须达到阴生植物的补偿点,植物才能正常生长,阳生植物也称“阳性植物”,光照强度对植物的生长发育及形态结构的形成有重要作用,在强光环境中生长发育健壮,在阴蔽和弱光条件下生长发育不良的植物称阳性植物,这类植物要求全日照,并且在水分、温度等条件适合的情况下,不存在光照过强的问题。 阳生植物和阴生植物的区别:关于光的饱和点和补偿点光是光合作用的能量来源,光照强度直接影响光合速率,在其它条件都适宜的情况下,在一定范围内,光合速率随光照强度提高而加快,当光照强度高到一定数值后,光照强度再提高而光合速率不再加快,这种现象叫光饱和现象。开始达到光饱和现象的光照强度称为光饱和点,在光饱和点以下,随着光照强度减弱,光合速率减慢,当减弱到一定光照强度时,光合作用吸收二氧化碳量与呼吸释放二氧化碳的量处于动态平衡,这时的光照强度称为光补偿点。此时植物制造有机物量和消耗有机物量相等,不同类型植物的光饱和点和 补偿点是不同的,阳性植物的光饱和点和补偿点一般都高于阴性植物。 结构和特性的区别:阴生植物的叶片的疏导组织比阳生植物稀疏,以叶绿体来说,阳生植物有较大的基粒,基粒片层数目多的多,叶绿素含量也高,阴生植物在较低的光照条件下充分的吸收光线,叶绿素a/叶绿素b的比值小,能够强烈的利用蓝紫光,阳性植物叶片小而厚,表面具蜡质或绒毛,叶脉密,单位面积内气孔多,叶绿素含量高,体内含盐分多,渗透压高,可以抗高温干旱,阳生植物的气孔一般在叶片下表皮分布的数量多于上表皮,这样可以避免阳光直晒而减少水分散失,阳生植物的呼吸速率高于阴生植物。 区分阳生植物与阴生植物,主要是根据植物对光照强度需要的不同,阳生植物要求充分直射日光才能生长或生长良好,阴生植物适宜于生长在荫蔽环境中,它们在完全日照下反而生长不良或不能生长,阳生植物和阴生植物之所以能适应不同光照,是与它们的生理特征和形态特征不同有关,以光饱和点来说,阳生植物的光饱合点是全光照(即全部太阳光照)的100%,而阴生植物是全光照的10%~50%。因为阴生植物叶片的输导组织比阳生植物的稀疏,当光照强度增大时,水分对叶片的供给不足,阴生植物便不再增加光合速率,以叶绿体来说,阴生植物与阳生植物相比,前者有较大的基粒,基粒片层数目多,叶绿素含量较高,能在较低光照强度下充分 探究光对叶绿素的影响 作者:史青见 上个星期我们刚刚学习了《细胞的能量供应和利用》,其中光与叶绿素之间的关系引起了我的兴趣,于是我便进行的一系列的探究: 一.提出问题 光对叶绿素有没有影响?如果有,那么会有什么样的影响? 二.根据现象提出假设 植物中有叶绿素的部位的细胞在光学显微镜下可以找到成绿色的叶绿体,而且叶绿素在光合作用下可以生成大量能量供植株生长。所以假设光对叶绿素的产生有促进作用。 三.设计并进行实验 用大蒜作为实验材料主要是因为,大蒜本身只有一种颜色,而且颜色比较浅,容易观察实验结果。 把实验材料大蒜若干均分为两组,分别记录为甲乙两个组别。利用控制变量法,将甲组大蒜放在阳光充足的地方,乙组是放在没有阳光照射的阴暗处,两组的土壤条件,水分,温度等其他影响植株生长的条件都一样。 实验过程中每次分别记录好两组的各个植株的生长状况,记录好数据。 将所有记录好的两组的数据取平均值后进行分析和对比。 最后得出的实验现象可能有以下几种: 1.甲组的植株株高比乙组高,甲组的有明显的颜色变化,乙组没有明显的颜色变化,甲组的植株长势比乙组好。 2.乙组的植株株高比甲组高,甲组的有明显的颜色变化,乙组没有明显的颜色变化,甲组的植株长势比乙组好。 3.甲组的植株株高比乙组高,甲组的有明显的颜色变化,乙组没有明显的颜色变化,乙组的植株长势比甲组好。 4.乙组的植株株高比甲组高,甲组的有明显的颜色变化,乙组没有明显的颜色变化,乙组的植株长势比甲组好。 四.观察并记录现象 甲组的植株株高比乙组高,甲组的有明显的颜色变化,乙组没有明显的颜色变化,甲组的植株长势比乙组好。 五.分析实验结果 根据实验现象可知光会促进叶绿素的产生。 六.得出的实验结论: 叶绿素在光下形成绿色,叶绿素在光合作用下可以生成大量能量供植株生长。 七.总结 在我的观察、试验和分析过程中,逐渐解释、揭示了光与叶绿素之间的奥秘,增长了知识,把学到的知识联系实际加以应用,既巩固了学到的知识,又提高了学习的兴趣,还初步学会了科学观察和分析方法。 叶绿素含量的测定 一.实验原理 根据叶绿体色素提取液对可见光谱的吸收,利用分光光度计在某一特定波长测定其吸光度,即可用公式计算出提取液中各色素的含量。 根据朗伯—比尔定律,某有色溶液的吸光度A与其中溶质浓度C和液层厚度L成正比,即A=αCL.式中:α比例常数。当溶液浓度以百分浓度为单位,液层厚度为1cm时,α为该物质的吸光系数。各种有色物质溶液在不同波长下的吸光系数可通过测定已知浓度的纯物质在不同波长下的吸光度而求得。 如果溶液中有数种吸光物质,则此混合液在某一波长下的总吸光度等于各组分在相应波长下吸光度的总和。就是吸光度的加和性。如欲测定叶绿体色素混合提取液中叶绿素a、b和类胡萝卜素的含量,只需测定该提取液在三特定波长下的吸光度A,并根据叶绿素a、b 及类胡萝卜素在该波长下的吸光系数即可求出其浓度。在测定叶绿素a、b时为了排除类胡萝卜素的干扰,所用单色光的波长选择叶绿素在红光区的最大吸收峰。 植物叶绿素含量测定----丙酮提取法 高等植物光合作用过程中利用的光能是通过叶绿体色素(光合色素)吸收的。叶绿体色素由叶绿素a、叶绿素b、胡萝卜素和叶黄素组成。叶绿体色素的提取、分离和测定是研究它们的特性以及在光合中作用的第一步。叶片叶绿素含量与光合作用密切相关,是反眏叶片生理状态的重要指标。在植物光合生理、发育生理和抗性生理研究中经常需要测定叶绿素含量。叶绿素含量也是指导作物栽培生产和选育作物品种的重要指标。 ● 叶绿素不溶于水,溶于有机溶剂,可用多种有机溶剂,如丙酮、乙醇或二甲基亚砜等研磨提取或浸泡提取。叶绿色素在特定提取溶液中对特定波长的光有最大吸收,用分光光度计测定在该波长下叶绿素溶液的吸光度(也称为光密度),再根据叶绿素在该波长下的吸收系数即可计算叶绿素含量。 ●利用分光光计测定叶绿素含量的依据是Lambert-Beer定律,即当一束单色光通过溶液时,溶液的吸光度与溶液的浓度和液层厚度的乘积成正比。其数学表达式为: ●A=Kbc 式中:A为吸光度;K为吸光系数;b为溶液的厚度;c为溶液浓度。 ●叶绿素a、b的丙酮溶液在可见光范围内的最大吸收峰分别位于663、645nm处。叶绿素a 和b在663nm处的吸光系数(当溶液厚度为1cm,叶绿素浓度为g·L-1时的吸光度)分别为82.04和9.27;在645nm处的吸光系数分别为16.75和45.60。根据Lambert-Beer定律,叶绿素溶液在663nm和645nm处的吸光度(A663和A645)与溶液中叶绿素a、b和总浓度(a+b)(Ca、Cb 、Ca十b,单位为g·L-1),的关系可分别用下列方程式表示: ●A663=82.04C a+9.27C b (1) ●A645=16.76C a+45.60C b(2) ●C a=12.7 A663—2.59 A645(3) ●C b=22.9 A645—4.67 A663 (4) ●C a十b=20.3 A645—8.04 A663 (5) ● 实验一植物叶绿素含量的测定 一、实验原理 根据叶绿体色素提取液对可见光谱的吸收,利用分光光度计在某一特定波长测定其吸光度,即可用公式计算出提取液中各色素的含量。根据朗伯—比尔定律,某有色溶液的吸光度A与其中溶质浓度C和液层厚度L成正比,即A=αCL式中:α比例常数。当溶液浓度以百分浓度为单位,液层厚度为1cm时,α为该物质的吸光系数。各种有色物质溶液在不同波长下的吸光系数可通过测定已知浓度的纯物质在不同波长下的吸光度而求得。如果溶液中有数种吸光物质,则此混合液在某一波长下的总吸光度等于各组分在相应波长下吸光度的总和。这就是吸光度的加和性。今欲测定叶绿体色素混合提取液中叶绿素a、b和类胡萝卜素的含量,只需测定该提取液在三个特定波长下的吸光度A,并根据叶绿素a、b 及类胡萝卜素在该波长下的吸光系数即可求出其浓度。在测定叶绿素a、b时为了排除类胡萝卜素的干扰,所用单色光的波长选择叶绿素在红光区的最大吸收峰。 二、材料、仪器设备及试剂 (一)材料:新鲜(或烘干)的植物叶片。 (二)仪器设备:1)分光光度计;2)电子天平;3)研钵;4)棕色容量瓶;5)小漏斗;6)定量滤纸;7)吸水纸;8)滴管。 (三)试剂:1)95%乙醇(或80%丙酮)(v丙酮:v乙醇=2:1的95%水溶液);2)石英砂;3)碳酸钙粉。 三、实验步骤 1)取新鲜植物叶片(或其它绿色组织)或干材料,擦净组织表面污物,剪碎(去掉中脉),混匀。 2)称取剪碎的新鲜样品0.2g ,共3份,分别放入研钵中,加少量石英砂和碳酸钙粉及2~3ml 95%乙醇,研成均浆,再加乙醇10ml,继续研磨至组织变白。静置3~5min。 利用高光谱技术反演作物叶绿素浓度 摘要:高光谱技术作为一种新兴光谱技术,被广泛应用于植物的无损检测中,植被叶片叶绿素含量的估测就是其中之一。利用可见-近红外成像光谱仪采集不同生育期玉米和大豆的冠层“图谱”数据,在逐步提取影像中光照土壤、阴影土壤、光照植被、阴影植被四种组分光谱的基础上,通过选取的敏感波段构建光谱植被指数和叶绿素密度进行波段自相关分析,探讨各个分量对作物叶绿素密度反演的影响。 关键词:高光谱技术;叶绿素;反演 0 引言 植物通过光合作用获取营养物质,在植物光合作用中,植物细胞中的叶绿体占据了重要的地位,而叶绿体中的色素有叶绿素(叶绿素a,叶绿素b 和叶绿素a+b)与类胡萝卜素(胡萝卜素和叶黄素)。其中,叶绿素是植物光合作用中最重要的色素,其作为主要吸收光能的物质,直接影响植物光合作用的光能利用率。叶片单位面积的叶绿素含量是植物总体生长状况的一个重要指标。叶片叶绿素含量的测定可以用来检测和研究植物突变、压力和营养状态,作物压力和萎黄病的检测对精细农业具有重要的潜在影响[1]。 随着光谱技术的发展,其被应用到各个领域。而高光谱技术作为光谱技术的一种,由于具有众多优点,在光谱检测方面应用十分广泛,备受人们的青睐。人类肉眼的视觉范围在380~780 nm 之间,而高光谱的波段非常宽,一些高光谱仪器的波段达350~2 500 nm。因此,通过高光谱技术可以对绿色植物进行叶绿素的检测和定量分析。本文对高光谱技术在植物,特别是在经济作物的叶绿素含量检测和定量分析中的应用加以概述[2]。 1 成像系统简介及数据处理 1.1 高光谱成像技术简介 高光谱成像技术是在多光谱成像的基础上发展而来的,在较宽的波段范围内,利用成像光谱仪对目标物体进行连续成像,从而获得每个像元的数十或数百条光谱信息。其成像特点是:光谱范围广(200~2 500nm)、超多波段(上百个波段)、高的高光谱分辨率(几个nm)、波段窄(≤10-2λ)和图谱合一等。由于所获得的图像信息不仅可以反映物体的大小、形状、缺陷等外部特征,而且不同物体因结构和成分的不同使光谱吸收也不同,从而可以用于物体内部的物理结构和化学成分的检测。 高光谱成像检测装置主要由光源、光谱相机(成像光谱仪+CCD)、装有图像采集卡的计算机组成,如图1所示[3] 叶绿素a测定复习试题 一、填空题 1.叶绿素a的测定方法有和,环境监测(生物)技术规范中规定用。 答:分光光度法;荧光光度法;分光光度法; 2.地表水环境质量标准(GHZB1-1999)中,对控制湖泊水库富营养化的特定项目之一叶绿素a作了明确规定:Ⅰ类水质的标准值为,Ⅱ类水质的标准值为,Ⅲ类水质的标准值为,Ⅳ类水质的标准值为,Ⅴ类水质的标准值为。 答:≤0.001mg/L;≤0.004mg/L;≤0.01mg/L;≤0.03mg/L;≤0.065mg/L。 3.进行生物样品污染物测定的样品处理可概括为二个过程:第一步是将样品 、、;第二步是将前一步处理过的样品 以消除干扰,提高被测组分的浓度。 答:分离;纯化;浓缩;分解消化或提取。 4.经丙酮浸取含有叶绿素a的溶液,以溶液为参比,在波长、 、、下测定吸光度。在波长测定丙酮溶液的空白值。丙酮溶液空白值应不大于。 答:丙酮;663nm;645nm;630nm;750nm;0.05。 5.经离心后的样品上清液,在750nm处测定吸光度,用以校正提取液的,当测定用1cm比色皿,吸光度超过时,提取液应。答:浊度;0.005;重新离心。 二、问答题 1. 控制叶绿素a指标值的意义是什么? 答:叶绿素a是反映水体富营养化的一个重要指标。控制叶绿素a就在于控制富营养化和藻类生物量,从而揭示湖库富营养化发生的内在实质。 2. 叶绿素a的涵义是什么? 答:指水中藻类具有光合色素的叶绿素。 3.什么叫富营养化? 答:营养物质特别是含氮和磷的化合物,在淡水或盐水中的富集。富营养化加速了藻类和较高等植物的生长。 4.评定水质富营养化的几种类型标准是什么? 答:参照国际经济合作与发展组织(OECD)规定和关于评定湖泊富营养化状态的叶绿素a划分标准:以≥78μg/L为重富营养型;11—78μg/L为富营养型;3.0—11μg/L为中营养型;<3.0μg/L为贫营养型。 5.用于叶绿素a测定的水样应如何保存? 答:每升水样加1%碳酸镁悬浊液1ml,以防止酸化引起色素溶解。如不能立即测定,则应在低温(0—4℃)避光保存。 6.叶绿素a测定方法的原理是什么? 答:原理是:以丙酮溶液提取浮游植物色素,浸取液经过滤离心后,依次在663、645、630nm波长下测定吸光度,按Jettrey—Humphrey方程式计算,可得出叶绿素a的含量。 7.一般用于测定叶绿素a的样品采集多少量较合适? 答:通常采样体积可根据水中叶绿素a含量的高低来确定,一般可采取1.5—2升。按浮游植物采样方法,湖泊、水库采样500毫升,池塘300毫升,按海洋监测方法规定,海水采取2—5升。 8.什么叫中营养水? 答:天然发生的,或由于营养累积形成的中等营养状态的水,及介于贫营养和富营养之间的水。 9.什么叫贫营养水? 答:贫营养物且含高浓度腐殖质的水。 叶绿素含量测定方法---丙酮法 由于微藻的生长周期比较复杂,包括无性繁殖阶段和有性繁殖阶段,其在不同阶段的生理形态不同,有时藻细胞会聚集在一起,以片状或团状形式存在,在显微镜下难以确定其所包含的细胞数量。 藻细胞中叶绿素的含量(特别是叶绿素a的含量)通常随与细胞的生长呈较好的线性关系,因此可通过测定藻细胞中叶绿素含量变化来反映微藻的生长情况。叶绿素测定采用丙酮研磨提取法。 取适量藻液于10 mL离心管中在4000 rpm转速下离心10 min,弃去上清液,藻泥中加入适量的100 %的丙酮。采用丙酮提取法时在试管研磨器中冰浴研磨5 min,4000 rpm离心后,上清液转入10 mL容量瓶中。按上述方法对藻体沉淀进行萃取,直至藻体沉淀呈白色为止。定容后,采用722S型可见分光光度计分别测定645 nm和663 nm下萃取液的吸光值,叶绿素含量用以下公式进行计算(Amon,1949): 叶绿素a含量用以下公式进行计算: Chlorophyll a (mg/L) = (12.7×A663 nm-2.69×A645 nm)×稀释倍数 叶绿素b含量用以下公式进行计算: Chlorophyll b (mg/L) = (22.9×A645 nm-4.64×A663 nm)×稀释倍数 叶绿素总含量用以下公式进行计算: Chlorophyll a+b (mg/L) = (20.2×A645 nm+8.02×A663 nm)×稀释倍数 由于丙酮的沸点较低,较高温度下挥发很快。此外,叶绿素稳定性较差,见光易分解,因此,本实验中叶绿素的提取和测定均在低温黑暗条件下进行,以减少提取过程中的损失。 叶绿素提取方法 提取液:本试验用DMSO/80%丙酮(l/2,v/v)提取的叶绿素,谭桂英周百成底栖绿藻叶绿素的二甲基亚砜提取和测定法* 海洋与湖沼 1987 18(3)295--300. 一、直接浸提法: 1、准确量取10ml藻液,加到15ml离心管中,放在台式离心机离心,3500r/min (根据不同的藻选择不同那个的离心转速)离心5min倒上清;留藻泥。随后在盛有藻泥的离心管中加入蒸馏水,与藻泥混匀后再次离心,目的是除去藻细胞表面的盐份,此清洗过程重复三次。 2、往藻泥中加二甲基亚砜3.33ml,65℃水浴9h,20h; 3、然后离心,将上清转移到10ml棕色瓶中, 4、添加6.67ml80%丙酮到离心管中,混匀,离心,再将上清转移到10ml棕色瓶中。 5、定容,待测。(完整word版)叶绿素含量的测定
叶绿素的药理功能及特性
基于高光谱和高分一号卫星影像的冬小麦叶绿素遥感反演
叶绿素含量的测定
不同环境条件下植物叶绿素a、b含量地比较
光对叶绿素的影响
叶绿素含量的测定
实验一 植物叶绿素含量的测定
利用高光谱技术反演作物叶绿素浓度
叶绿素A测定复习试题
叶绿素含量测定方法(精)