
蟾蜍坐骨神经干复合动作电位特性
1 材料
蟾蜍;任氏液;BB-3G标本屏蔽盒,微机生物信号采集处理系统。
2 方法
2.1 系统连接和参数设置RM6240多道生理信号采集处理系统与标本盒连接,1、2通道时间常数0.02s、滤波频率3KHz、灵敏度5mV,采样频率100KHz,扫描速度0.2ms/div。单刺激激模式,刺激波宽0.1ms,延迟1ms,同步触发。
2.2 制备蟾蜍坐骨神经干标本蟾蜍毁脑脊髓和下肢标本制备,下肢标本仰卧置于蛙板上,分离脊柱两侧的坐骨神经,紧靠脊柱根部结扎,近中枢端剪断神经干,将神经干从骶部剪口处穿出。循股二头肌和半膜肌之间的坐骨神经沟,纵向分离坐骨神经直至腘窝胫腓神经分叉处,将腓浅神经、胫神经与腓肠肌和胫骨前肌分离。置剪刀于神经与组织之间,剪切直至跟腱并剪断跟腱和神经。剥离附着在神经干的组织,坐骨神经干标本浸入任氏液中。
2.3 实验观察
2.3.1 中枢端引导动作电位神经干末梢端置于刺激电极处,用刺激电压1.0V,波宽0.1ms 的方波刺激神经干,测定第1和第2对引导电极引导的双相动作电位正相波和负相波的振幅和时程。
2.3.2 改变引导电极距离用刺激电压1.0V,波宽0.1ms的方波刺激神经干中枢端,记录引导电极距离10mm、20mm、30mm时的动作电位。分别测定上述三个引导电极距离的动作电位正相波和负相波的振幅和时程。
2.3.3 末梢端引导动作电位和测定动作电位传导速度引导电极距离10mm,神经干中枢端置于刺激电极处,用刺激电压1.0V,波宽0.1ms的方波刺激神经干,测定第1对引导电极引导的双相动作电位正相波和负相波的振幅和时程。分别测量两个动作电位起始点的时
间差和标本盒中两对引导电极之间的距离S(应测r
1- r
2
的间距),计算动作电位传导速度。
2.3.4 单相动作电位引导用镊子在第1对引导电极之间贴近后一电极处神经夹伤,用刺激电压1.0V,波宽0.1ms的方波刺激神经干,测量单相动作电位的振幅和动作电位持续时间。测量单相动作电位的上升时间和下降时间。
2.3.5 按0.02V步长,刺激强度从0V开始逐步增加至动作电位不再增大止。测量动作电位振幅与刺激电压对应数据。
2.3.6 换一神经干,用刺激电压1.0V,波宽0.1ms的方波刺激神经干,若第2对引导电
极引出一双相动作电位,用一小块浸有3mol KCl溶液的滤纸片贴附在第2对引导电极后一电极处处的神经干上。记录KCl处理前及处理后3min 第2对引导电极引导的动作电位振幅和时程。
2.3.7 用刺激电压1.0V,波宽0.1ms的方波刺激神经干,用一小块浸有40g/L 普鲁卡因溶液的滤纸片贴附在第1对引导电极后一电极处的神经干上。记录处理前及处理后5min 第1对引导电极引导的动作电位振幅和时程。
2.4 统计方法结果以?x±s表示,统计采用Student t test方法。
3 结果
3.1 蟾蜍坐骨神经干的阈强度、最大刺激强度、传导速度
以波宽0.1ms的电脉冲刺激蟾蜍坐骨神经干中枢端,引起动作电位的阈刺激为0.33±0.09V,最大刺激强度为0.80±0.18V,动作电位的传导速度为24.40±4.50 m/s。
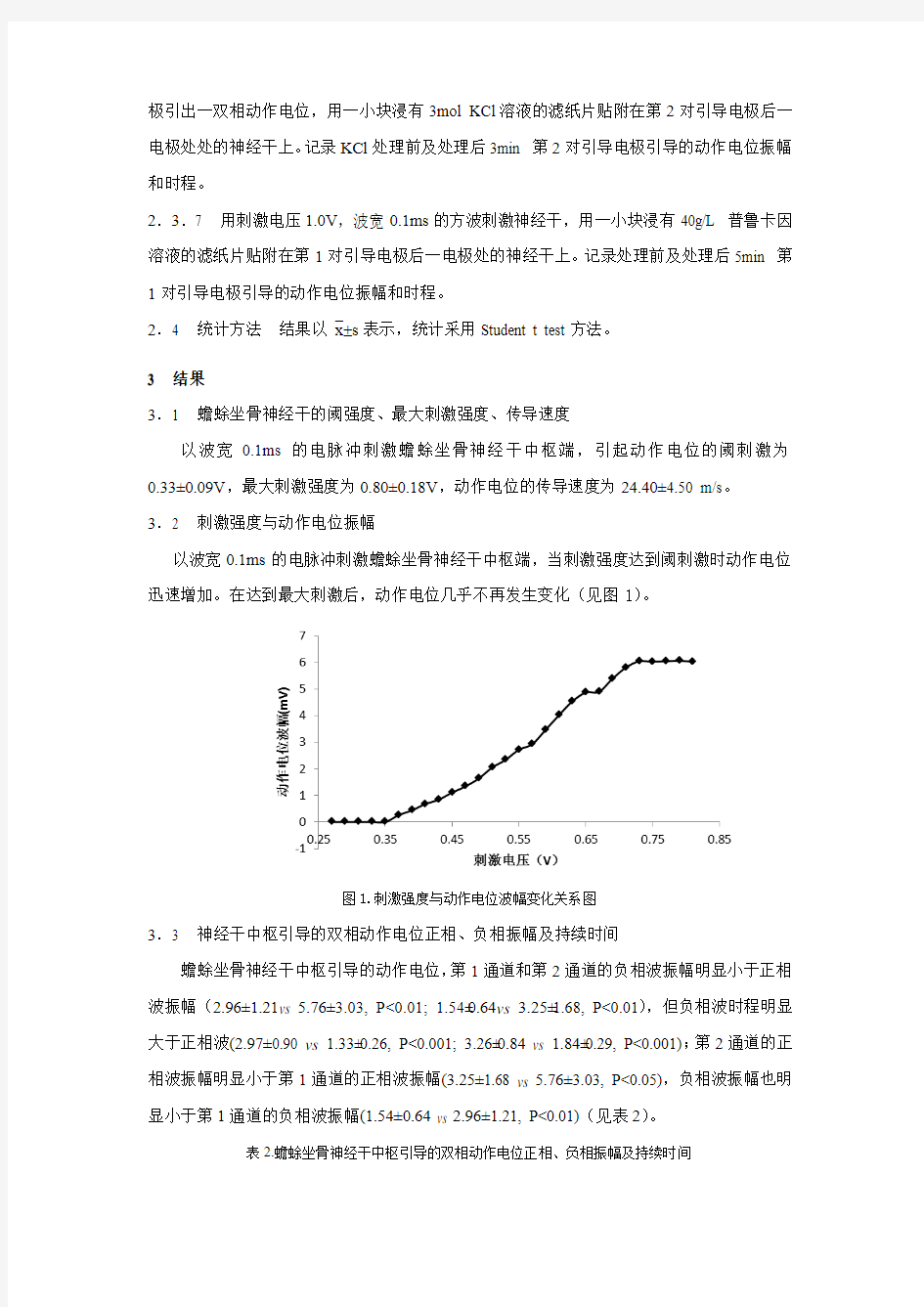
3.2 刺激强度与动作电位振幅
以波宽0.1ms的电脉冲刺激蟾蜍坐骨神经干中枢端,当刺激强度达到阈刺激时动作电位迅速增加。在达到最大刺激后,动作电位几乎不再发生变化(见图1)。
图1.刺激强度与动作电位波幅变化关系图
3.3 神经干中枢引导的双相动作电位正相、负相振幅及持续时间
蟾蜍坐骨神经干中枢引导的动作电位,第1通道和第2通道的负相波振幅明显小于正相波振幅(2.96±1.21vs 5.76±3.03, P<0.01; 1.54±0.64vs 3.25±1.68, P<0.01),但负相波时程明显大于正相波(2.97±0.90 vs 1.33±0.26, P<0.001; 3.26±0.84 vs 1.84±0.29, P<0.001);第2通道的正相波振幅明显小于第1通道的正相波振幅(3.25±1.68 vs 5.76±3.03, P<0.05),负相波振幅也明显小于第1通道的负相波振幅(1.54±0.64 vs 2.96±1.21, P<0.01)(见表2)。
表2.蟾蜍坐骨神经干中枢引导的双相动作电位正相、负相振幅及持续时间
A1chp(mV) A1chn( mV) D1chp(ms ) D1chn(ms ) A2chp(mV) A2chn( mV) D2chp(ms ) D2chn(ms ) Sample
10 10 10 10 10 10 10 10 size
?x±s 5.76±3.03 2.96±1.21** 1.33±0.26 2.97±0.90△△△ 3.25±1.68* 1.54±0.64□□## 1.84±0.29 3.26±0.84☆☆☆注:*:P<0.05,**:P<0.01,vs A1chp;△△△:P<0.001,vs D1chp;
□□:P<0.01,vs A
;##:P<0.01,vs A1chn;☆☆☆:P<0.001,vs D2chp
2chp
3.4 神经干末梢引导的双相动作电位正相、负相振幅及持续时间
蟾蜍坐骨神经干末梢引导的双相动作电位负相波振幅明显小于正相波振幅(3.59±1.13 vs
8.42±3.52, P<0.001),负相波时程明显大于正相波时程(2.98±0.81 vs 1.25±0.18, P<0.001)(见
表3)。
表3.蟾蜍坐骨神经干末梢引导的双相动作电位正相、负相振幅及持续时间
A bp(mV) A bn(mV ) D bp(ms ) D bn(ms )
Sample size 10 10 10 10
?x±s 8.42±3.52 3.59±1.13*** 1.25±0.18 2.98±0.81###
注:***:P<0.001,vs A bp;###:P<0.001,vs D bp;
3.5 神经干末梢引导的双相动作电位与单相动作电位的振幅及持续时间
蟾蜍坐骨神经干末梢引导的单相动作电位的振幅明显大于双相动作电位正相波振幅
(9.63±3.52 vs 8.42±3.52,P<0.01),时程也明显大于双相动作电位正相波时程(2.35±0.41vs
1.25±0.18,P<0.001)(见表4)。
表4.蟾蜍坐骨神经干末梢引导的双相动作电位与单相动作电位的振幅及持续时间
A bp(mV) A bn(mV ) D bp(ms ) D bn(ms ) A m(mV) D m(ms)
Sample size 10 10 10 10 10 10
?x±s 8.42±3.52 3.59±1.13*** 1.25±0.18 2.98±0.81###9.63±3.52** 2.35±0.41###
注:**:P<0.01,***:P<0.001,vs A bp;###:P<0.001,vs D bp;
3.6 引导电极间距离对坐骨神经干动作电位振幅和时程的影响
引导电极间距离为10,20,30mm时,负相波振幅均显著小于正相波振幅(3.47±1.22 vs
7.96±3.13, P<0.001; 6.49±1.96 vs 11.46±2.95, P<0.001; 5.72±2.38 vs 11.83±2.92, P<0.001);距离
为20mm时的正相波振幅显著大于10mm时正相波振幅(11.46±2.95 vs 7.96±3.13, P<0.001),
负相波振幅也显著大于10mm时负相波振幅(6.49±1.96 vs 3.47±1.22, P<0.001);距离为30mm
时的正相波振幅显著大于20mm时正相波振幅(11.83±2.92 vs 11.46±2.95, P<0.001),但是其负相波振幅与20mm时负相波振幅没有显著差异(5.72±2.38 vs 6.49±1.96, P>0.05)(见表5)。引导电极间距离为10,20,30mm时,负相波时程均显著大于正相波时程(3.08±0.71 vs 1.26±0.18, P<0.001; 3.18±0.71 vs 1.59±0.21, P<0.001; 3.80±0.84 vs 1.80±0.20, P<0.001);距离为20mm时的正相波时程显著大于10mm时正相波时程(1.59±0.21 vs 1.26±0.18, P<0.001),而负相波时程与10mm时负相波时程没有显著差异(3.18±0.71 vs 3.08±0.71, P>0.05);距离为30mm时的正相波时程显著大于20mm时正相波时程(1.80±0.20 vs 1.59±0.21, P<0.001),其负相波时程也显著大于10mm时负相波时程(3.80±0.84 vs 3.18±0.71, P<0.001)(见表6)。
表5.引导电极间距离对坐骨神经干动作电位振幅的影响
A10p(mV) A10n(mV) A20p(mV) A20n(mV) A30p(mV) A30n(mV) Sample size 10 10 10 10 10 10 ?x±s 7.96±3.13 3.47±1.22***11.46±2.95*** 6.49±1.96### □□11.83±2.92### 5.72±2.38△△△注:***:P<0.001,vs A10p;###:P<0.001,vs A20p; △△△:P<0.001,vs A30p;
□□:P<0.01,vs A
;
10n
表6.引导电极间距离对坐骨神经干动作电位时程的影响
D10p(ms) D10n(ms) D20p(ms) D20n(ms) D30p(ms) D30n(ms) Sample size 10 10 10 10 10 10 ?x±s 1.26±0.18 3.08±0.71*** 1.59±0.21*** 3.18±0.71### 1.80±0.20### 3.80±0.84△△△☆☆☆注:***:P<0.001,vs D10p;###:P<0.001,vs D20p; △△△:P<0.001,vs D30p; ☆☆☆:P<0.001,vs D20n; 3.7 KCl处理前后动作电位振幅
用3mol KCl处理蟾蜍坐骨神经干,2min后的动作电位正相波振幅明显大于处理前(4.51±1.19 vs 3.87±0.91, P<0.01),而负相波振幅则明显小于处理前(1.25±1.09 vs 1.88±0.86, P<0.05)(见表7)。
表7.蟾蜍坐骨神经干用3mol KCl处理前后动作电位振幅
A Kp(mV) A Kn(mV )
control 2min control 2min
Sample
10 10 10 10
size
?x±s 3.87±0.91 4.51±1.19** 1.88±0.86 1.25±1.09#
注:**:P<0.01,vs A Kp control;#:P<0.05,vs A Kn control;
3.8 普鲁卡因处理前后动作电位振幅
用4% procaine处理蟾蜍坐骨神经干,5min后的动作电位正相波振幅明显大于处理前(8.85±1.29 vs 7.70±1.33, P<0.05),而负相波振幅则明显小于处理前(2.24±1.24 vs 3.57±1.38, P<0.01)(见表8)。
表8.蟾蜍坐骨神经干4% procaine处理前后动作电位振幅
A pp(mV) A pn(mV )
control 5min control 5min
Sample
10 10 10 10
size
?x±s 7.70±1.33 8.85±1.29* 3.57±1.38 2.24±1.24##
注:*:P<0.05,vs A pp control;##:P<0.01,vs A pn control;
3.9 双相动作电位正、负波的叠加点
蟾蜍坐骨神经干末梢引导的单相动作电位的振幅明显大于双相动作电位正相波振幅(9.63±3.52 vs 8.42±3.52,P<0.01)(见表4),即双相动作电位正、负波的叠加点在动作电位去极化阶段。
4 讨论
4.1 神经干动作电位不具有“全或无”的性质
以波宽0.1ms的电脉冲刺激蟾蜍坐骨神经干中枢端,当刺激强度从阈刺激增加至最大刺激,神经干动作电位振幅随刺激电压增加而增高。在达到最大刺激后,动作电位几乎不再发生变化。而动作电位“全或无”的性质表现为刺激强度小于阈刺激时不会引发动作电位,当刺激强度达到阈刺激后可以引发动作电位,动作电位水平不随刺激强度的变化而变化。因此蟾蜍坐骨神经干动作电位不具有“全或无”性质。这是因为坐骨神经干由不同类型的神经纤维组成,各个类型的纤维兴奋性水平不同,在一个有限的范围内神经干动作电位的大小随着刺激强度的增加而增加。当刺激强度足以兴奋所有类型的神经纤维后,坐骨神经干动作电位保持稳定。蟾蜍坐骨神经干动作电位为复合动作电位(CAP)。
4.2 BAP正、负相波的形成
在两引导电极间夹伤坐骨神经干,神经冲动的传导被阻断,形成了单相动作电位,单相动作电位仅具有正相波。这说明双相动作电位的正相波和负相波分别是由R1和R2引导所
得。蟾蜍坐骨神经干末梢引导的单相动作电位的振幅明显大于双相动作电位正相波振幅,时程也明显大于双相动作电位正相波时程, 这说明双相动作电位是由不对称的正相波和负相波叠加而成的,叠加点在正相波的去极化阶段。
4.3药物对神经兴奋的影响
用KCl和procaine处理蟾蜍坐骨神经干后的动作电位正相波振幅明显大于处理前,而负相波振幅明显小于处理前。细胞膜外K+浓度升高,K+平衡电位发生变化,引起膜的超极化,从而导致Na+内流受抑制,细胞膜去极化受抑制,负相波的振幅减小。Procaine可以阻断电压门控Na+通道,造成去极化时Na+内流受抑制,表现为负相波的振幅减小。由于双相动作电位是由正相波和负相波叠加而成的,负相波振幅减小,正相波振幅就会相应增大。
一、蟾蜍坐骨神经干动作电位引导及传导速度测定 实验目的:加强理解兴奋传导的概念,掌握测定神经干动作电位传导速度的方法。熟悉仪器设备的操作。 实验原理:通过测出示波器上动作电位传导的距离和传导所需的时间,计算传导速度。 1.潜伏期法:测量第一个通道动作电位潜伏期的时间t,输入刺激电极到第一个引导 电极间的距离s,v=s/t。 2.潜峰法:测量两个通道的动作电位波峰间的时间差和两对引导电极间的距离,v= (s2-s1)/(t2-t1)。 实验步骤:1.制备坐骨神经-腓神经标本,放入神经屏蔽盒。 2.连接仪器,引导动作电位波形。 3.剪裁编辑图形,计算传导速度。 实验结果:1.图形 2.计算 S=10mm, t=0.33ms, v=10mm/0.33ms=33m/s 分析讨论: 1. 当刺激端和记录端离得较远时,引导的复合动作电位波形会发生什么改变,为什么? 2.用什么方法可使复合动作电位传导速度的测量更准确? 实验结论:神经干动作电位的传导速度为33m/s.
二、兴奋性不应期的测定 实验目的:了解测定不应期的方法和原理,并加深对兴奋性在兴奋过程中的变化过程的理解。 实验原理:神经纤维受到适宜刺激后,产生兴奋,即动作电位。一次兴奋产生后,必须经绝对不应期、相对不应期、超常期等变化后,兴奋性才能恢复。本实验通过生物电放大器引导并记录神经干复合动作电位,验证和测量动作电位的不应期。先给一个条件刺激,再用另一个检验刺激在兴奋的不同时期给予刺激,检查兴奋未阈值及所引起动作电位的幅度。 实验步骤: 1.制备坐骨神经-腓神经标本,并浸在任氏液中约5分钟,待其兴奋性稳定后实验。 2.连接仪器,设置实验参数,观察并测量神经干的不应期。 实验结果:(见图) 分析讨论: 1.为什么要先引导神经纤维的单向复合动作电位,然后再测量其兴奋性的不应期? 2.神经干不应期与单根神经纤维的不应期有何不同? 实验结论:兴奋性的不应期包括绝对不应期、相对不应期、超常期、低常期。
静息电位和动作电位的测定 1.静息电位和动作电位: 静息电位:在神经未受到刺激时,神经纤维处于静息状态,这时,由于细胞膜内外特异的离子分布特点,细胞膜两侧的电位表现为内负外正,称为静息电位。 动作电位:当神经纤维某一部位受到刺激时,这个部位的膜两侧出现暂时性的电位变化,由内负外正变为外负内正,这就是动作电位。2.基本原理: 神经细胞内K+明显高于膜外,而膜外Na+明显高于膜内。静息时,由于膜主要对K+有通透性,造成K+外流,使膜外阳离子多于膜内,所以外正内负。受到刺激时,细胞膜对Na+的通透性增加,钠离子内流,使膜内阳离子浓度高于外侧,所以表现为内正外负。之后,在膜上由于存在钠钾泵,在其作用下,将外流的钾离子运输进膜内,将内流的钠离子运出膜外,从而成膜电位又慢慢恢复到静息状态。 3.神经电位差测定的常见类型: (1)静息电位测定方式:静息电位常见的测定方式是将电流表的两个电极一个放在神经纤维的外侧,另一个放在神经纤维的内侧(如右上图),由于内外两侧存在电势差,因此电流表指针会发生偏转。
(2)动作电位测定方式: ①在一个神经纤维上的测定:是指将电流表的两个电极放在同一个神经纤维的外侧(A处和B处),来测定两个电极处是否有电位差。其放置方式如右下图。 对于一个神经纤维上电位的测定,如电流表指针发生了偏转,则说明A B两点存在电势差。一般的做法是在该神经纤维上C点给一个足够强度的刺激,从而观察电流表发生几次偏转,方向是否一致? 当刺激点C到达A、B两点距离相等时,神经冲动同时到达A、B两点,两点虽然均产生了动作电位,但是仍然不存在电势差,因此电流表不会发生偏转。 只要刺激点C与A、B点在同一神经元上,且CA与CB不相等,电流表就会发生两次方向相反的偏转。 ②在两个神经纤维上的测定:是指将电流表的两个电极放在两个相邻神经元的外侧,来测定两个电极处是否有电位差。其放置方式如右图。在A点给一个足够强度的刺激,观察电流表发生几次偏转,方向是否一致?
神经干动作电位、传导速度及不应期的测定 【目的和原理】 神经纤维的兴奋表现为动作电位的产生和传导,神经纤维上传导的动作电位通常称为神经冲动。在神经细胞外表面,已兴奋部位带“负电”,未兴奋部位带“正电”,用引导电极引导出此电位差,输入到示波器,则可记录到动作电位的波形。本实验用细胞外记录法,可引导出坐骨神经的复合动作电位。 神经纤维兴奋的标志是产生一个可以传导的动作电位,它依局部电流或跳跃传导的方式沿神经纤维传导。其传导速度取决于神经纤维的直径、内阻、有无髓鞘等因素,可用电生理学方法来记录和测量。 神经纤维在一次兴奋过程中,其兴奋性可发生周期性变化,包括绝对不应期、相对不应期、超常期和低常期。本实验主要目的是学习电生理仪器的使用方法,掌握离体神经干动作电位的细胞外记录法及其基本波形的判断和测量。掌握神经干动作电位传导速度及其不应期的测定方法,通过调整条件刺激和测试刺激之间的时间间隔,来测定坐骨神经干的绝对不应期。 【实验对象】 蟾蜍或蛙。 【实验器材和药品】 蛙类手术器械一套、电子刺激器、示波器(或计算机实时分析系统)、神经屏蔽盒、任氏液。 【实验步骤】 1.制备坐骨神经——胫、腓神经标本操作方法详见3.8。 2.连接装置(见图8-1-1)。 3.准备仪器: (1)刺激器:调节刺激器各项参数:刺激方式连续刺激,频率16Hz,刺激强度0.5v,波宽0.1ms。调节延迟使动作电位的图像位于示波器荧光屏的中央。 (2)示波器:灵敏度:1~2mv/cm,扫描速度:1~2ms/cm,引导电极输入到示波器的“AC”端,双边输入,刺激器的“同步输出”接示波器“外触发输入”,触发选择设置为“同步触发”。 4.观察项目:
人体解剖及动物生理学实验报告 神经干复合动作电位 【实验题目】 神经复合动作电位 1、蟾蜍坐骨神经干复合动作电位(CAP)阈值和最大幅度的测定 2、蟾蜍坐骨神经干复合动作电位(CAP)传导速度的测定 3、蟾蜍坐骨神经干复合动作电位(CAP)不应期的测定 【实验目的】 确定蟾蜍坐骨神经干复合动作电位(CAP)的 1、临界值和最大值 2、传导速度 3、不应期(包括绝对不应期和相对不应期) 【实验原理】 神经系统对维持机体稳态起着重要作用,动作电位(AP)是神经系统进行通信联系所采用的信号。多个神经元的轴突集结成束形成神经,APs沿感觉神经经外周传向中枢或沿运动神经由中枢传向外周。坐骨神经干由上百根感觉神经和运动神经组成,分别联系腿部的感受器和效应器(骨骼肌)。如果电刺激一根离体的坐骨神经干,通过细胞外引导方式,就能记录到神经干复合动作电位(CAP)。一个CAP是一系列具有不同兴奋性的神经纤维产生的多个AP的总和。刺激强度越大,兴奋的神经纤维数目就越多,CAP的幅度也就越大。与胞内引导得到的单细胞AP相比,CAP是双相电位,逐级递增(非全或无),并且幅度较小。 阈电位是指一个刚刚能观测到的CAP,所对应的刺激为阈刺激。在一定范围内增加刺激强度,CAP幅度相应增大。最大CAP所对应的最小刺激电位即最大刺激。 动作电位可以沿神经以一定的速度不衰减地传导,传导速度的快慢基于多种因素,这些因素决定了生物体对其坏境的适应性。它们包括神经的直径、有无髓鞘、温度等等。
神经在一次兴奋过程中,其兴奋性将发生一个周期性的变化,最终恢复正常。兴奋的周期性变化,依次包括绝对不应期、相对不应期等等。绝对不应期内,无论多么强大的刺激都不能引起神经再一次兴奋;相对不应期内,神经兴奋性较低,较大的刺激能够引起兴奋。绝对不应期决定了神经发放冲动(动作电位)的最高频率,保证了动作电位不能叠加(区别于局部电位),以及单向传导(只能有受刺激部位向远端传导,不能返回)的特性。不应期的产生依赖于细胞膜上特定离子通道的特点,如钠、钾离子通道。 【实验方法】 1、制作蟾蜍坐骨神经干标本 (1)双毁髓处死蟾蜍后,剥去皮肤,暴露腰骶丛神经,游离大腿肌肉之间的坐骨神经干及其下行到小腿的两个分支:胫神经和腓神经,三段结扎,剪去无关分支后离体。注意保持神经湿润。 (2)将神经搭于标本盒内,保证神经与电极充分接触,中枢端接触刺激电极S1和S2,外周端接触记录电极R1-R5,之间接触接地电极。 (3)刺激输出线两夹子分别连接标本盒的刺激电极S1和S2,插头接生物信号采集系统RM6240的刺激输出插口;信号输入倒显得红色和绿色夹子分别连接记录电极(绿色夹子在前,引导出正向波形,即出现的第一个波峰向上),黑色夹子连接接地电极,插头接通道A、蟾蜍坐骨神经干复合动作电位(CAP)临界和最大幅度的确定 (1)打开信号采集软件,从“实验”菜单中选取“神经干动作电位”,出现自动设置的界面,各项参数已设置好,界面中只有一个采集通道,对应仪器面板上的通道1(因此信号输入线应连接在通道1)。 (2)检查装置链接正确,确定装置是否正常工作,以及神经是否具有活性。采用刺激强度1V,刺激时程0.2ms,延时5ms,刺激模式为单刺激。选择“同步触发”,按下“开始刺激”后,正常情况下屏幕上会出现一个双相电位即CAP。 (3)降低刺激强度,确定CAP的阈电位。记录刺激阈值及CAP幅度(波峰与波谷之间的差值)。 (4)以0.05V或更小的间隔,逐渐增大刺激强度,观察CAP幅度的变化,同时,记录刺激电位及对应的CAP幅度,直到CAP达到稳定,即最大值(神经标本在正常生理活性时,1V 以内的刺激强度即可引起最大的CAP)。
对动作电位变化图的分析 1 各个阶段变化原因: 1.1 膜内外的离子分布 细胞内外离子分布不均匀是静息电位和动作电位形成的基础,这种分布不均匀与钠钾泵的作用密不可分。钠钾泵是一种普遍存在于动物各种细胞膜上的特异性蛋白质,这种载体蛋白每分解一个ATP分子,可以将3个Na+送出细胞外,同时将2个K+送入细胞内,从而使细胞内K+浓度高,细胞外Na+浓度高。除了Na+和K+分布不均匀以外,细胞内还存在着大量的带负电的有机大分子物质A-,细胞膜对他们是没有通透性的,同样在细胞膜外也存在着高浓度的Cl-。总的来看,细胞膜内:K+浓度高,同时存在大量的A-;细胞膜外:Na+浓度高,同时也存在着大量的Cl-。这种膜内外离子分布的不平衡是静息电位和动作电位形成的离子基础。 1.2 静息电位的形成 细胞处于静息状态时,细胞膜主要对K+有通透性,而对其他离子通透性很小甚至是没有通透性。这种对K+通透性的实质,是依赖于细胞膜上的漏K+通道来实现的,K+可以通过该通道被动外流,使得膜外的阳离子增多,膜内的阳离子减少,从而造成膜外电位高于膜内电位的状态,当K+的移动达到平衡时,细胞膜内外两侧就形成了一个相对稳定的电位差,这就是我们通常所说的静息电位,这个过程被称为极化。 1.3动作电位的形成 动作电位是膜电位的一次快速变化,随后恢复到静息膜电位状态,包括去极化、反极化和复极化三个连续变化的过程。受到一定的刺激时,细胞膜上的部分电压门控Na+通道开放,允许Na+流进细胞,膜内电位升高膜外电位降低,当膜内外电位相等时膜外仍为高Na+状态,该过程可称为去极化。Na+继续内流,膜内电位继续升高,直至Na+内流达到其平衡状态,膜内外两侧形成的电位差就是动作电位的最大值,这个过程可以称之为反极化。这两个过程也就是上图中所显示的动作电位的上升相。 当动作电位达到最大值时开放的电压门控Na+通道失活、关闭,而电压门控K+通道开放,少量的K+在细胞内强大的电动势和浓度梯度的作用下迅速外流,使细胞内电位降低,细胞外电位升高,这一变化也就是上图中所显示的动作电位的下降相。这个过程被称为复极化。在完全恢复到静息电位之前,钠钾泵的活动会增强,将进入细胞的Na+排出,将透出细胞的K+重新移入细胞内,恢复最开始的离子浓度梯度,为重建膜的静息电位做好准备。 2 关于该变化过程的几个疑问 2.1 钠钾泵的作用实质是什么? 细胞膜电位变化主要依赖于Na+、K+浓度梯度为基础而形成。用某些化学试剂(如氰化钠)使钠钾泵中毒失去作用,且神经细胞存在足够的离子浓度梯度,兴奋仍能传导多次。但每次冲动,钠离子进入细胞内不能泵出去,而钾离子穿出细胞后又不能泵回来。最后形成细胞内钠离子浓度太高而钾离子浓度太低以致没有足够的钾离子外流来维持静息电位,而只有处于静息电位的细胞膜才具有产生兴奋的能力。这时除非钠钾泵再开动,否则神经细胞将失去作用。也就是说若失去了膜内外的离子分布不平衡的状态,神经冲动是不能形成和传导的。因此,这种依赖于ATP的钠钾泵的活动,实质上是将细胞通过代谢产生的ATP中的能量转变为膜两侧的离子势能,细胞受到刺激后,再将这种离子势能转变为动能——动作电位而传播。 2.2 通过离子通道移动的离子何时会达到平衡? 静息状态时,细胞膜上的漏K+通道打开, K+外流既有动力又有阻力。动力来自于膜内的高浓度的K+,促使K+顺浓度梯度外流;K+的外流使膜外的电位逐渐升高,这种膜外的正电位形成的电场力又会阻止带正电荷的K+继续外流,这就是膜内K+外流的阻力。当这两种力达到
人体解剖及动物生理学实验报告 实验名称神经干复合动作电位 姓名 学号 系别 组别 同组姓名
实验室温度20℃ 实验日期2015年4月24日 一、实验题目 蟾蜍坐骨神经干复合动作电位(CAP) A蟾蜍坐骨神经干CAP阈值和最大幅度的确定 B蟾蜍坐骨神经干CAP传导速度的确定 C蟾蜍坐骨神经干CAP不应期的确定 二、实验目的 确定蟾蜍坐骨神经干复合动作电位(CAP)的 (1)临界值和最大值 (2)传导速度 (3)不应期(相对不应期、绝对不应期) 三、实验原理 神经系统对维持机体稳态起着重要作用,动作电位(AP)是神经系统进行通信联系所采用的信号,多个神经元的轴突集结成束形成神经,APs沿感觉神经有外周传向中枢或沿运动神经由中枢传向外周。坐骨神经干由上百根感觉神经和运动神经组成,分别联系腿部的感受器和效应器(骨骼肌)。如果电刺激一根离体的坐骨神经干,通过细胞外引导方式,就能记录到神经干复合动作电位(CAP)。一个CAP是一系列具有不同兴奋
性的神经纤维产生的多个AP的总和。刺激强度越爱,兴奋的神经纤维数目就越多,CAP 的幅度也就越大。与胞内引导得到的单细胞AP相比,CAP是双相电位,逐级递增(非全或无),并且幅度较小。 阈电位是指一个刚刚能观测到的CAP,所对应的刺激为阈刺激。在一定范围内增加刺激强度,CAP幅度相应增大。最大CAP所对应的最小刺激电位即最大刺激。 动作电位可以沿神经以一定的速度不衰减地传导,传导速度的快慢基于多种因素,这些因素决定了生物体对其坏境的适应性。它们包括神经的直径、有无髓鞘、温度等等。 神经在一次兴奋过程中,其兴奋性将发生一个周期性的变化,最终恢复正常。兴奋的周期性变化,依次包括绝对不应期、相对不应期等等。绝对不应期内,无论多么强大的刺激都不能引起神经再一次兴奋;相对不应期内,神经兴奋性较低,较大的刺激能够引起兴奋。绝对不应期决定了神经发放冲动(动作电位)的最高频率,保证了动作电位不能叠加(区别于局部电位),以及单向传导(只能有受刺激部位向远端传导,不能返回)的特性。不应期的产生依赖于细胞膜上特定离子通道的特点,如钠、钾离子通道。 四、实验方法 蟾蜍坐骨神经标本的制作 1.双毁髓处死蟾蜍后,剥去皮肤,暴露腰骶丛神经,游离大腿肌肉之间的坐骨神经 干及其下行到小腿的两个分支:胫神经和腓神经,三段结扎,剪去无关分支后离体。注意保持神经湿润。 2. 将神经搭于标本盒内,保证神经与电极充分接触,中枢端接触刺激电极S1和S2, 外周端接触记录电极R1-R2,之间接触接地电极。 3. 刺激输出线两夹子分别连接标本盒的刺激电极S1和S2,插头接生物信号采集系 统RM6240的刺激输出插口;信号输入倒显得红色和绿色夹子分别连接记录电极(绿色夹子在前,引导出正向波形,即出现的第一个波峰向上),黑色夹子连接接地电极,插头接通道1.
人体解剖及动物生理学实验报告实验名称神经干复合动作电位 姓名 学号 系别 组别 同组姓名 实验室温度20℃ 实验日期2015年4月24日一、实验题目 蟾蜍坐骨神经干复合动作电位(CAP) A蟾蜍坐骨神经干CAP阈值和最大幅度的确定 B蟾蜍坐骨神经干CAP传导速度的确定 C蟾蜍坐骨神经干CAP不应期的确定 二、实验目的 确定蟾蜍坐骨神经干复合动作电位(CAP)的 (1)临界值和最大值
(2)传导速度 (3)不应期(相对不应期、绝对不应期) 三、实验原理 神经系统对维持机体稳态起着重要作用,动作电位(AP)是神经系统进行通信联系所采用的信号,多个神经元的轴突集结成束形成神经,APs沿感觉神经有外周传向中枢或沿运动神经由中枢传向外周。坐骨神经干由上百根感觉神经和运动神经组成,分别联系腿部的感受器和效应器(骨骼肌)。如果电刺激一根离体的坐骨神经干,通过细胞外引导方式,就能记录到神经干复合动作电位(CAP)。一个CAP是一系列具有不同兴奋性的神经纤维产生的多个AP的总和。刺激强度越爱,兴奋的神经纤维数目就越多,CAP的幅度也就越大。与胞内引导得到的单细胞AP相比,CAP是双相电位,逐级递增(非全或无),并且幅度较小。 阈电位是指一个刚刚能观测到的CAP,所对应的刺激为阈刺激。在一定范围内增加刺激强度,CAP幅度相应增大。最大CAP所对应的最小刺激电位即最大刺激。 动作电位可以沿神经以一定的速度不衰减地传导,传导速度的快慢基于多种因素,这些因素决定了生物体对其坏境的适应性。它们包括神经的直径、有无髓鞘、温度等等。 神经在一次兴奋过程中,其兴奋性将发生一个周期性的变化,最终恢复正常。兴奋的周期性变化,依次包括绝对不应期、相对不应期等等。绝对不应期内,无论多么强大的刺激都不能引起神经再一次兴奋;相对不应期内,神经兴奋性较低,较大的刺激能够引起兴奋。绝对不应期决定了神经发放冲动(动作电位)的最高频率,保证了动作电位不能叠加(区别于局部电位),以及单向传导(只能有受刺激部位向远端传导,不能返回)的特性。不应期的产生依赖于细胞膜上特定离子通道的特点,如钠、钾离子通道。 四、实验方法 蟾蜍坐骨神经标本的制作 1.双毁髓处死蟾蜍后,剥去皮肤,暴露腰骶丛神经,游离大腿肌肉之间的坐骨神经干及其下行到小腿 的两个分支:胫神经和腓神经,三段结扎,剪去无关分支后离体。注意保持神经湿润。 2. 将神经搭于标本盒内,保证神经与电极充分接触,中枢端接触刺激电极S1和S2,外周端接触记录 电极R1-R2,之间接触接地电极。
实验4 神经干动作电位不应期和传导速度的测定 【实验目的】 1.加深理解兴奋传导的概念并了解神经兴奋传导速度测定的基本原理和方法。 2.验证和加深理解神经干动作电位后兴奋性的规律性变化。 【实验原理】 1.神经纤维兴奋时产生一个可以传播的动作电位,动作电位依局部电流或跳跃传导的方式 沿神经纤维传导,其速度取决于神经纤维直径、内阻、有无髓鞘等。坐骨神经的动作电位是由一群不同兴奋阈值、传导速度(v)和幅值的峰形电位所总和而成,为复合动作电位。测定该复合动作电位传导的距离(s)和经过这些距离所需的时间(t),即可根据v=s/t计算出神经干兴奋的传导速度。 2.神经组织和其他可兴奋组织一样,在接受一次刺激产生兴奋后,其兴奋性将会发生规律 性的变化,一次经过绝对不应期、相对不应期、超常期和低常期,然后再回到正常的兴奋水平。为了测定坐骨神经发生一次兴奋后的兴奋性周期变化,可采用双脉冲刺激法。 即先给与一个一定强度的“条件刺激”,使神经产生兴奋,在神经发生兴奋后,按不同的时间间隔在给与一个“测试刺激”,观察测试刺激是否引起动作电位以及动作电位的大小,以此来反应神经兴奋性的变化,测出相对不应期和绝对不应期。 【实验对象】 蛙或蟾蜍。 【实验器材与药品】 微机生物信号采集处理系统、蛙类手术器械1套、神经标本屏蔽盒、滤纸片、棉球、任氏液。 【实验方法和步骤】 一、蛙或蟾蜍坐骨神经标本制备 标本制备方法参见实验“神经干动作电位的引导”。 二、仪器连接及参数选定 1.仪器连接:同实验3。 2.刺激器参数选定:刺激方式:单次;刺激波宽:0.1~0.2ms;刺激强度:数伏至数十伏。 通过显示器观察到方波位置,而后调节延时使之到适当位置。 3.前置放大器调节:增益:1000;高频滤波:10kHz;时间常数:0.01。 4.计算机调节:见有关计算机操作部分。 三、观察项目 1.神经干兴奋传导速度的测量 将坐骨神经干标本置于神经标本屏蔽盒内的电极上,神经干需与两对引导电极r1和r2以及刺激电极保持良好的接触。 1.1 将r1记录电极连于前置放大器输入端,调节刺激器刺激强度以产生最大动作电位。 1.2 根据计算机采样时间,可测量出从刺激伪迹前沿至动作电位起始转折处的时间间隔(毫
2.神经干动作电位是神经兴奋的客观标志,给具有兴奋性的神经干以一定强度的刺激,会产生动作电位并传导。在神经细胞外面,已兴奋部位的膜外电位负于静息部位。当神经冲动通过后,兴奋处的膜外电位又恢复到静息时的水平。所以兴奋部位和邻近部位之间可出现电位差,用引导电极引导出此电位差,输入到示波器,则可记录到动作电位的波形。本实验采用细胞外记录法,可引导出坐骨神经的复合动作电位。 3.经纤维兴奋的标志是产生一个可以传导的动作电位,它以局部电流或跳跃式传导的方式沿神经纤维传导。其传导速度取决于神经纤维的直径、内阻、有无髓鞘等因素。坐骨神经-腓神经为一混合神经干,其动作电位是由一群不同兴奋阈值、传导速度和幅值的电位总和而成,为复合动作电位。蛙类坐骨神经干中以Aa类纤维为主,传导速度大约35~40m/s。测定神经冲动在神经干上传导的距离和通过这些距离所需的时间,即可计算出该神经干兴奋传导的速度。 4.动作电位在神经纤维上的传导有一定的速度。不同类型的神经纤维,其传导速度各不相同,取决于神经纤维的直径、有无髓鞘、环境温度等因素。蛙类坐骨神经干中以Aα类纤维为主,传导速度大约35~40m/s。测定神经冲动在神经干上传导的距离(d)与通过这一距离所需的时间(t),即可根据V=d/t 求出神经冲动的传导速度。 5.神经纤维的兴奋部位相对于未兴奋部位来说呈负电位,两点之间存在电位差,通过单极或双极电极的引导在记录系统上进行显示和分析。由于采用的是胞外记录的方法,因而在单极记录时,测得的动作电位实际上是组成神经干中的每根神经纤维兴奋后的超射值在神经干表面的叠加。即此动作电位是一复合波,其上升相、下降相及峰值不是相应的单一动作电位波形的去极化相、复极化相及峰电位。在双极记录时,测得的波形实际上是两个记录电极的电位差,与单一动作电位波形相差更大,这使问题的分析更加复杂。动物实验制作的坐骨神经 腓肠肌标本中,神经干是由具有不同生理特性的不同种类神经纤维所组成,故复合动作电位记录的是复合波。然而,每种纤维兴奋后传导速度各不一样,波长也各不相等,加上引导方式不同,这也增加了我们分析复合双相动作电位的复杂性及带来传导速度测定的困难。 6.对于单根神经纤维,其兴奋后产生负波。对于某一点,负波的产生和终止不是突然的,而需要一定的时间才能达到最高点,故记录曲线的上升和下降都具有一定的斜率。神经干受刺激后,由于不同神经纤维兴奋产生了不同的负波,它们波长不等,传导速度也不相等,所以
神经干双向动作电位的引导传导速度及不应期的测定作者:2011222681宋利婷组员:2011222702曾惜2011222709张芮2011222698杨袁虹 一、实验对象:蟾蜍 二、实验目的:观察蟾蜍坐骨神经动作电位的基本波形,掌握坐骨神经制备方法与引导动作电位的方法,理解与刺激和最大刺激强度的概念测定潜伏期时程和波幅,学会通过潜伏期法和潜峰法测定神经冲动的传导速度,通过测定神经干不应期理解兴奋性在兴奋过程中的变化过程。 三、实验内容 图一:阈刺激和最大刺激强度的测定 由上图可知,以0.100v为起始刺激强度,在0.100到0.300v的刺激时,不产生动作电位,
逐渐增大强度,一直到当刺激强度为0.4V时,刚好引产生动作电位,即阈刺激为0.4V,当刺激强度达到1.4V后,即使再增加刺激强度,动作电位的幅也不再改变,即最大(适)刺激强度为1.4V. 图二:潜伏期波幅时程及速度的测定 由在最适刺激强度时动作电位原图上进行区间测量可知,潜伏期为0.60ms,时程t1为2.84ms ,波幅为2.72mV,输入刺激电极到第一个引导电极间距离s=1.3cm,以传导速度和根据速度的公式计算传导速度v1=s/t1,求得的速度v1=45m/s 图三:潜峰法测量速度
如图是通过测量两个通道的动作电位波峰间的时间差,为(t1-t2),测量并输入两对引导电极间的距离为(s2-s1),s2=4.7cm,s1=3.8cm,t1-t2=0.28ms,由传导速度和用公式计算传导速度:v2=(s2-s1)/(t1-t2),v2=321m/s 图四:绝对不应期和相对不应期的测定
神经干动作电位实验报Experimental report of neUhtstem action potential 告 Intern ship report 实验报告
一、实验目的: 1. 学习蛙坐骨神经干标本的制备 2. 观察坐骨神经干的双相动作电位波形,并测定最大刺激强度 3. 测定坐骨神经干双相动作电位的传导速度 4. 学习绝对不应期和相对不应期的测定方法 5. 观察机械损伤或局麻药对神经兴奋和传导的影响 二、实验材料 1. 实验对象:牛蛙 2. 实验药品和器材:任氏液,2%普鲁卡因,各种带USB接口或插头的连接导线,神经屏 蔽盒,蛙板,玻璃分针,粗剪刀,眼科剪,眼科镊,培养皿,烧杯,滴管,蛙毁髓探针,BL-420N 系统 三、主要方法和步骤: 1. 捣毁脑脊髓 2. 分离坐骨神经 3. 安放引导电极 4. 安放刺激电极 5. 启动试验系统 6. 观察记录 7. 保存 8. 编辑输出 四、实验结果和讨论 1.观察神经干双相动作电位引导(单通道,单刺激) 如图,观察到一个双相动作电位波形。
Pm驴:i SQOQOKi 2.0 ms 7 射¥ 也00z 时间 一—j .................... : .................. 频率: 最大值- ...... ' ........ ' ......... [ ........ ;...... [协小值: -15 - -20 _ 1 OOY oo: oo. m兀卫EQ创 2.神经干双相动作电位传导速度测定(双通道,单刺激) -ID kUUUChz L.U ns ZlT m¥ii J.ttmz j ................. ■:- I 2? 1. WV 1 I --------------- 14 I I 4 I I I ooTio mo oa nr iins on oo oru oom coe co nr n o日on m nn oo oo ni2 DO on rtu OO CIJ ri^ oo oc OIA (1) 选择“神经骨骼肌实验”一“…传导速度测定” (2) 改变单刺激强度 (3) 传导速度=传导距离(R1--R2-)/传导时间(t 2-t 1) 如图所示,两个波峰之间的传导时间△ t = (t 2-t 1) = 0.66ms 实验中,我们设定在引导电极1和3之间的距离△ R = (R 1--R2-) = 1cm 故传导速度v = △ R/ △ t = 1cm / 0.66ms = 15.2 m/s 释: 最 大ii; ■小 值: 平均值: 嶂赠但? 面租 BJ祠; 最知宜. 环值: 平均值: 而租
For personal use only in study and research; not for commercial use 神经干动作电位传导速度的测定 实验对象:蟾蜍 一实验目的 掌握坐骨神经标本的制备方法。 掌握引导神经干复合动作电位和测定其传导速度的基本原理。 二相关知识 (一)兴奋及兴奋性的概念 (二)动作电位的潜伏期、动作电位时程和幅值 1、动作电位:各种可兴奋细胞在受到刺激而兴奋时,可以在细胞膜静息电位的基础 上发生一次短暂的,可向周围扩布的电位波动。这种电位波动称为动作电位。(三)、动作电位的传导 局部电流的形式 1、细胞外记录 2、神经干的动作电位 神经干是由许多粗细不等的有髓和无髓神经纤维组成的混合神经,故神经干动作电位与单根神经纤维的动作电位不同,它是由许多神经纤维的动作电位合成的一种复合电位。 三实验原理 (一)、单根神经纤维动作电位的引导及其传导 1、记录出了一个先升后降的双相动作电位的原理 当神经纤维未受刺激时,膜外与电极所接触的两点之间没有电位差,所以两电极之间也无电位差存在,扫描线为一水平基线。在神经干左端给予电刺激后,则产生一个向右传导的冲动(负电位),当冲动传到1电极(负电极)下方时,此处电位较2处为低,产生了电位差,扫描线向上偏转,记录出一个向上的波形(在电生理实验中,为了便于观察,习惯上规定负波向上)。随后,冲动继续向右侧传导,离开1电极传向2电极处。当它到达2电极(正电极)下方时,因1电极处神经差不多已恢复到原来的状态,于是2电极处又较1电极处为负,引起扫描线向下偏转,记录出一个向下的波形。这样,在神经冲动向右传导的过程中,就记录出了一个先升后降的双相动作电位。 负电极在前时,它首先记录到神经干表面由正变负的电位变化,经历了由正到负再到正的过程,因此记录出动作电位的上相。当在后的正电极记录到这种同样的电位变化过程时,显示相反的情况,记录出动作电位的下相。如果互换正、负电极的位置,则记录到先降后升的双相动作电位。 C.?? A点神经纤维多于B点(次要原因)。 (二)、神经干动作电位的引导及其传导 四实验步骤 (一)、制备蛙类坐骨神经-胫腓神经标本 通过观看录象让学生学习制作方法
一目的要求: 1.学习蛙类动物单毁髓与双毁髓的方法。 2.学习并掌握蛙类坐骨神经干标本的制备方法。 3.学习电生理学实验方法。 4.观察蟾蜍坐骨神经干复合动作电位的波形,了解其产生的基本原理。 二基本原理: 神经干在受到有效刺激后,可以产生动作电位,标志着神经发生兴奋。如果在神经干另一端引导传来的兴奋冲动,可以引导出双相的动作电位,如在两个引导电极之间将神经麻醉或损坏,则引导出的动作电位即为单相向动作电位。 神经细胞的动作位是以”全或无”方式发生的。坐骨神经干是由很多不同类型的神经纤维组成的,所以,神经干的动作电位是复合动作电位。复合动作电位的幅值在一定刺激强度下是随刺激强度的变化而变化的。 三动物与器材: 蟾蜍、常用手术器械(手术剪、手术镊、金冠剪、眼科剪、毁髓针和玻璃分针)、蛙板、固定针、不锈钢盘、污物缸、粗棉线、任氏液、计算机生理信号处理系统、神经屏蔽盒。 四方法步骤: 1.蟾蜍的单毁髓与双毁髓 一手握住蛙或蟾蜍(可用纱布包裹蟾蜍躯干部),背部向上。用拇指压住蛙或蟾蜍的背部,食指按压其头部前端,使头端向下低垂; 另一手持毁髄针,由两眼之间沿中线向后触划,当触及到两耳中间的凹陷处(此处与两眼的联机成等边三角形)时,持针手即感觉针尖下陷,此处即是枕骨大孔的位置。将毁髄针由凹陷处垂直刺入,即可进入枕骨大孔(图t-1)。然后将针尖向前刺入颅腔,在颅腔内搅动,以捣毁脑组织。如毁髄针确在颅腔内,实验者可感到针尖触及颅骨。此时的动物为单毁髓动物。再将毁髓针退至枕骨大孔,针尖转冋后方,与脊柱平行刺入椎管,以捣毁脊髓。彻底捣毁脊髓时,可看到动物的后肢突然蹬直,而后瘫痪如棉(图t-2),此时的动物为双毁髓动物。如动物仍表现肢肌肉紧张或活动自如,必须重新毁髓。操作过程中应注意使蟾蜍头部向外侧(不要挤压耳后腺),防止耳后腺分泌物射入实验者眼内(如被射入,则需立即手生理盐水冲洗眼睛)。 2.坐骨神经干标本制备 (1) 剥制后肢标本(图t-3) (2) 分离两后肢(图t-4)
神经干双向动作电位的引导传导速度及不应期的测定 组员:陈良鹏肖瑶伍思静袁果曼罗冰清 实验目的:观察蟾蜍坐骨神经动作电位的基本波形,掌握坐骨神经制备方法与引导动作电位的方法,理解与刺激和最大刺激强度的概念测定潜伏期时程和波幅,学会通过潜伏期法和潜峰法测定神经冲动的传导速度,通过测定神经干不应期理解兴奋性在兴奋过程中的变化过程。 实验对象:蟾蜍 实验药品和器材:蛙类手术器械,BL-410生物信号记录分析系统,神经屏蔽盒,任氏液等。 实验原理:1、神经动作电位是神经兴奋的客观标志。当神经受到有效刺激时,处于兴奋部位的膜外电位负于静息电位;当动作电位通过后,兴奋处的膜外电位又恢复到静息时水平。神经干兴奋过程所发生的膜电位变化称神经复合动作电位。如果将两个引导电极置于神经干表面时(双极引导),动作电位将先后通过两个引导电极处,可记录到两个相反的电位偏转波形,称为双向动作电位。 2、神经纤维兴奋的标志是产生一个可传播的动作电位。测定神经干上的神经冲动的传导速度,可以了解神经的兴奋状态。在示波器上测量动作电位传导一定距离所耗费的时间,便可计算出兴奋的传导速度。 3、神经与肌肉等可兴奋组织兴奋性在一次兴奋过程中可发生系列变化,即绝对不应期相对不应期超常期和低常期,组织的兴奋性才逐渐恢复。为了测定神经干在兴奋过程中的兴奋性变化,可先给一个条件刺激以引起神经兴奋,然后再用另一检验性刺激,检查神经对检验性刺激反应的兴奋阈值以及所引起的动作电位(AP)幅度,即可观察到神经组织兴奋性的变化过程。在本次实验中,主要观察的是不应期的变化,而非整个兴奋性的周期性变化。 实验对象:蟾蜍 实验步骤及方法: 1.坐骨神经—腓神经标本的制备。 2.将标本放入神经屏蔽盒,(注意刺激电极端为神经干的中枢端)。 3.仪器连接。 4.BL-410的操作。 实验内容: 1、刺激坐骨神经时诱发产生的动作电位
反射时测定和反射弧分析 神经干动作电位的测定 2013级生命科学3班张柏辉学号:20132501076 1.实验目的 1.观察蛙坐骨神经干动作电位的基本波形,并了解其产生的基本原理; 2.学习测定反射时的方法,了解反射弧的组成; 3.了解脊髓反射的功能特性。 2.实验原理 (一)反射时测定和反射弧分析 反射是指对某一刺激无意识的应答。反射活动的结构基础称为反射弧,包括感受器、传入神经、神经中枢、传出神经和效应器。从皮肤接受刺激至机体出现反应的时间称为反射时。反射时是反射通过反射弧所用的时间。反射弧的任何一部分缺损,原有的反射不再出现。中枢的兴奋和抑制同时存在又相互影响。在脊髓反射的中枢之间或高位脑和脊髓对低位脊髓反射中枢均存在抑制作用,这些抑制作用保证了机体活动的协调性。 (二)神经干动作电位的测定 神经干在受到有效刺激后可以产生复合动作电位,标志着兴奋的产生。如果在立体神经干的一端施加刺激,从另一端引导传来的兴奋冲动可以记录出双相动作电位,假如在引导的两个电极之间将神经干麻醉或损坏,阻断其兴奋传导能力,此时可以记录到单相动作电位。 3.实验对象与实验材料 (一)材料:虎纹蛙 (二)器具:手术剪、手术镊、手术刀、金冠剪、眼科剪、毁髓针、玻璃分针、木质蛙板、固定针、锌铜弓、瓷盘、污物缸、滴管、纱布、粗棉线、滤纸片、支架、蛙嘴夹、小烧杯、秒表、神经屏蔽盒、PowerLab、刺激线、USB线、电脑 (三)试剂:任氏液、2%普鲁卡因、0.5%及1%硫酸溶液 4.实验方法与步骤 (一)反射时与反射弧的测定 1. 屈反射
取一只虎纹蛙,只毁脑髓制成脊蛙(只毁脑),用蛙嘴夹夹住蛙下颌悬挂在支架上,右后肢最长趾浸入0.5%硫酸溶液中2~3mm(<10s),同时开始计时。当出现屈反射时立即停止计时,并用清水冲洗受刺激皮肤,纱布擦干,重复测屈反射时3次。同样方法测左后肢最长趾的屈反射时。 2.损毁感受器 用手术剪自后肢最长趾基部环切皮肤,后用手术镊剥净长趾上的皮肤,用0.5%硫酸溶液刺激去皮皮肤,并记录侧时结果。 3.对照没损毁感受器 改换同侧后趾有皮肤趾,将其浸入0.5%硫酸溶液中,测定反射时。 4.擦或抓反射 取一浸有0.5%硫酸溶液的滤纸片贴于虎纹蛙腹部,记录抓或擦反射的反射时。 5.麻醉神经 右侧坐骨神经滴加普鲁卡因液,加药同时开始计时,每2min重复步骤3,并记录加药时间。 屈反射消失后,重复步骤4,记录加药时间。 6.测左后肢最长趾屈反射时,并与步骤1比较。 7.毁坏脊髓,重复步骤7. (二)神经干动作电位的测定 1. 标本制备:坐骨神经干(双毁髓->剥制后肢->分离两后肢),分离坐骨神经到踝关节附近,将标本搭置在神经屏蔽盒各金属极上; 2.设置实验装置:连接神经屏蔽盒各接线; 3.设置CH3 BioAmp和Stimulator:打开PowerLab电源,打开Scope软件(或Chart5),设置通道3: Ch3 BioAmp:Range 5mV, Filter 20Hz,High Pass 10Hz (调零用DC档);设置Stimulator:单刺激Delay 120ms ,波宽Duration:10mS,振幅Ampt:100mV;设置Overlay on Top 点右下角Start ,即可看到刺激输出后得到的动作电位波形图。每点一次START,记录号增加在图下方,调节单刺激持续时间Duration和振幅大小,以及调节放大器HighPass等参数,均对实验结果有影响。得到双相电位后,以普鲁卡因液或棉线结扎法损伤神经,调参数至振幅Amp5.000mV,,观察单相电位。
蟾蜍坐骨神经干复合动作电位特性 1 材料 蟾蜍;任氏液;BB-3G标本屏蔽盒,微机生物信号采集处理系统。 2 方法 2.1 系统连接和参数设置RM6240多道生理信号采集处理系统与标本盒连接,1、2通道时间常数0.02s、滤波频率3KHz、灵敏度5mV,采样频率100KHz,扫描速度0.2ms/div。单刺激激模式,刺激波宽0.1ms,延迟1ms,同步触发。 2.2 制备蟾蜍坐骨神经干标本蟾蜍毁脑脊髓和下肢标本制备,下肢标本仰卧置于蛙板上,分离脊柱两侧的坐骨神经,紧靠脊柱根部结扎,近中枢端剪断神经干,将神经干从骶部剪口处穿出。循股二头肌和半膜肌之间的坐骨神经沟,纵向分离坐骨神经直至腘窝胫腓神经分叉处,将腓浅神经、胫神经与腓肠肌和胫骨前肌分离。置剪刀于神经与组织之间,剪切直至跟腱并剪断跟腱和神经。剥离附着在神经干的组织,坐骨神经干标本浸入任氏液中。 2.3 实验观察 2.3.1 中枢端引导动作电位神经干末梢端置于刺激电极处,用刺激电压1.0V,波宽0.1ms 的方波刺激神经干,测定第1和第2对引导电极引导的双相动作电位正相波和负相波的振幅和时程。 2.3.2 改变引导电极距离用刺激电压1.0V,波宽0.1ms的方波刺激神经干中枢端,记录引导电极距离10mm、20mm、30mm时的动作电位。分别测定上述三个引导电极距离的动作电位正相波和负相波的振幅和时程。 2.3.3 末梢端引导动作电位和测定动作电位传导速度引导电极距离10mm,神经干中枢端置于刺激电极处,用刺激电压1.0V,波宽0.1ms的方波刺激神经干,测定第1对引导电极引导的双相动作电位正相波和负相波的振幅和时程。分别测量两个动作电位起始点的时 间差和标本盒中两对引导电极之间的距离S(应测r 1- r 2 的间距),计算动作电位传导速度。 2.3.4 单相动作电位引导用镊子在第1对引导电极之间贴近后一电极处神经夹伤,用刺激电压1.0V,波宽0.1ms的方波刺激神经干,测量单相动作电位的振幅和动作电位持续时间。测量单相动作电位的上升时间和下降时间。 2.3.5 按0.02V步长,刺激强度从0V开始逐步增加至动作电位不再增大止。测量动作电位振幅与刺激电压对应数据。 2.3.6 换一神经干,用刺激电压1.0V,波宽0.1ms的方波刺激神经干,若第2对引导电
实验四 神经干动作电位的测定 【实验目的】 学习生物电活动的细胞外记录法;观察坐骨神经干动作电位的基本波形、潜伏期、幅值 以及时程。 【实验原理】 神经组织属于可兴奋组织,其兴奋的客观标志是产生动作电位,即当受到有效刺激时, 膜电位在静息电位的基础上将发生一系列的快速、可逆、可扩布的电位变化。 动作电位可以沿着神经纤维传导。在神经细胞外表面,已兴奋的部位带负电,未兴奋的 部位带正电。 采用电生理学实验方法可以引导出此电位差或电位变化, 根据引导的方式不同, 所记录到的动作电位可呈现单向或双向的波形。 由于坐骨神经干是由许多神经纤维组成的, 所以其产生的动作电位是众多神经纤维动作 电位的叠加,即为一个复合动作电位。这些神经纤维的兴奋性是不同的,所以在一定范围内 增大刺激强度可以使电位幅度增大。这和单一细胞产生的动作电位是有区别的。本实验所引 导出的动作电位即为坐骨神经干的复合动作电位。 【实验对象】 蛙或蟾蜍。 【实验材料】 两栖类手术器械 1 套、滴管、BL-410生物机能实验系统、神经屏蔽盒、刺激电极、接 收电极、任氏液。 【实验步骤】 1. 制备坐骨神经干标本 坐骨神经干标本的制备方法与制备坐骨神经-腓肠肌标本相似。首先按照制备坐骨神经- 腓肠肌标本的方法分离坐骨神经, 当游离至膝关节处时, 在腓肠肌两侧找到胫神经和腓神经, 任选其一剪断,然后分离留下的一支直至足趾并剪断。保留与坐骨神经相连的一小段脊柱, 其余组织均剪除。此时,即制成了坐骨神经干标本。将标本浸于任氏液中,待其兴奋性稳定 后开始实验。 2.接标本与实验仪器 1)棉球沾任氏液擦拭神经标本屏蔽盒内的电极,将标本的脊柱端置于屏蔽盒的刺激电 (图 4-1 屏蔽盒) 极端(即 0刻度端),其神经部分横搭在各个电极上。 2)取出 BL-410 生物机能实验系统专用刺激电极,将其插头插在与主机“刺激”插口 中, 另一端的两个鳄鱼夹分别夹在屏蔽盒左侧的两个刺激接口上。 红色接正极, 黑色接负极。 保持两鳄鱼夹的间距为 1cm。 3)取出 BL-410 生物机能实验系统专用生物电信号引导电极。引导电极的一端是一个5 芯插口,将该插口与主机的 1 通道相连;另一端有三个不同颜色的鳄鱼夹,其中黑色的夹子 用于接地,夹在屏蔽盒的接地接口上并和屏蔽盒本身的接地鳄鱼夹相对应的接在同一电极 上;红色的夹子引导正电信号,黄色的夹子引导负电信号,分别夹在屏蔽盒的两个接收电极 接口上(红、黄鳄鱼夹的连接位置可以任选,但要保证间距为 1cm,且所接的电极上搭有神
在测定可兴奋细胞膜电位的基础上,如何设计实验证实动作电位去极相是na 内流引 如何设计实验证实动作电位去极相是钠离子电流引起? 在测定可兴奋细胞膜电位的基础上,如何设计实验证实动作电位去极相是钠离子电流引起的。静息电位:1。增加细胞外K离子浓度观察电位变化2、使用K离子通道抑制剂,观察电位变化动作电位:使用NA离子通道抑制剂,来观察电位变化. 仪器的话电流表导线显微镜之类的。 These are cells which cannot propagate action potential. Fibroblasts These are connective tissue cells. They are located in the interstitial space between myocytes, providing structure and support for the heart muscle. Adipocites These cells make up the fat layer that surrounds and cushions the heart. Endothelial Cells These are cells that line the inside of arteries, veins and form the walls of capillaries. Though initially thought that these cells served no particular purpose, it has been recently shown that these cells release special chemicals which can affect other cells within the vessel wall (smooth muscle cells) and cells in the blood stream. 膜还是不太一样的,它没有电压门控性的Na+ or Ca2+通道 Non-excitable cell types are characterized by an inability to generate all-or-none action potentials in response to depolarizing stimuli due to a lack of voltage-gated Na+ or Ca2+ channels (Rink & Jacob, 1989; Fewtrell, 1993; Clapham, 1995; Berridge, 1997). Consequently, membrane potential changes are proposed to influence [Ca2+]i responses mainly by altering the driving force for Ca2+ entry through ligand-gated or second messenger-operated channels. Indeed, several reports have shown that depolarization results in a decrease in [Ca2+]i and hyperpolarization causes an increase of [Ca2+]i during activation of mast cells, lymphocytes and related cell lines (Penner et al. 1988; Lewis & Cahalan, 1989; Demaurex et al. 1992). Previous electrophysiological recordings from rat bone marrow-derived megakaryocytes have failed to detect voltage-dependent inward currents, which implies that this is a non-excitable cell type (Uneyama et al. 1993a; Somasundaram & Mahaut-Smith, 1994; Hussain & Mahaut-Smith,