
课程名称:动物生理学实验
实验项目:实验二神经干复合动作电位的记录和观察
[目的]
1、学习电生理学实验方法。
2、观察蛙坐骨神经干复合动作电位的波形,并了解其产生原理。
3、测量神经干动作电位产生的阈强度和顶强度。
[原理]
1、两栖类一些基本的生命活动和生理功能与温血动物类似,而离体组织器官所需的生活条件比较简单,并且易于控制和掌握,因此在生理实验中常用两栖类离体组织器官作为实验标本。
2、神经干在受到有效刺激后,可以产生动作电位,标志着神经发生兴奋。如果在神经干另一端引导传来的兴奋冲动,可以引导出双相的动作电位,如在两个引导电极之间将神经麻醉或损坏,则引导出的动作电位即为单相动作电位。
3、神经细胞的动作电位是以“全或无”方式发生的。坐骨神经干是由很多不同类型的神经纤维组成的,所以,神经干的动作电位是复合动作电位。复合动作电位的幅值在一定刺激强度下是随着刺激强度的变化而变化的。
[实验材料]蛙常用手术器械蛙板任氏液培养皿烧杯神经屏蔽盒Medlab生物信号采集系统
[实验流程] 神经干标本制备→仪器联接和调试→测定参数→测定神经干的刺激阈值→观察记录双相动作电位→观察记录单相动作电位
[实验步骤]
一、蛙坐骨神经干标本制备
1.毁脑、脊髓。
2.去躯干上部及内脏和皮肤将前半躯干、皮肤和内脏一并拉剥弃之,仅保留一段腰背部脊柱及两后肢,并将其放入盛有任氏液的培养皿中。
3.洗净手和所用过的用具,以防沾染标本。
4.平分标本沿脊柱正中线至耻骨联合中央将标本分为两半。放入任氏液中。
5.游离坐骨神经任取一标本,用玻璃分针游离坐骨神经腹腔段。然后换至背侧向上,持玻璃分针沿坐骨神经沟(股二头肌及半膜肌肌间沟)小心分离坐骨神经大腿段,用剪刀剪去神经干上各细小分支(切忌撕扯)。坐骨神经下行至腘窝处分为两支:内侧为胫神经,走行表浅;外侧为腓神经。沿胫、腓神经走向分离至踝部,尽量将神经干标本剥离长一些,要求上自脊神经发出部位,下沿腓神经与胫神经一直分离到踝关节附近,剪断侧支。尽量将神经干周围的组织剔除干净(剥离时切勿损伤神经干),结扎坐骨神经干的脊柱端及胫、腓神经的足端,游离神经干。
6、将坐骨神经干标本浸入任氏液中5分钟,以稳定其兴奋性。
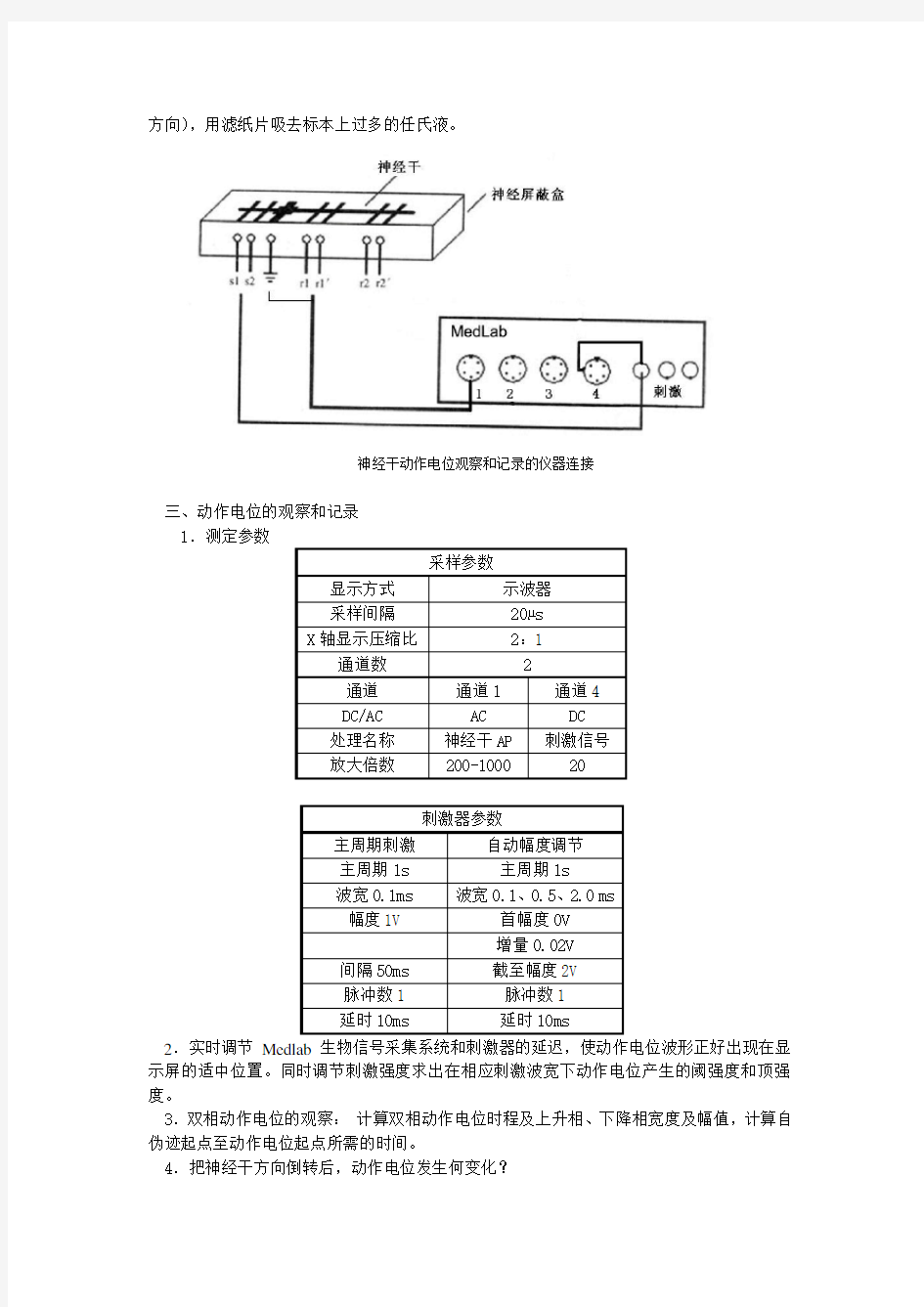
二、仪器联接和调试
打开Medlab生物信号采集系统软件,选通道1作为记录信号的通道, 选通道4用于刺激信号的监视通道(应用Q9三通将刺激输出分成两路,一路用于刺激标本,一路输入4通道)并用高阻抗导线将通道输入口与神经屏蔽盒的引导电极相连,用刺激导线将Medlab的刺激信号输出口与神经屏蔽盒的刺激电极相连。将神经屏蔽盒内所有电极用浸有任氏液的棉球擦净。用镊子夹住已制备好的神经标本的一端,将其放置于电极上(脊椎端位于刺激电极
方向),用滤纸片吸去标本上过多的任氏液。
神经干动作电位观察和记录的仪器连接
三、动作电位的观察和记录
1.测定参数
2.实时调节Medlab生物信号采集系统和刺激器的延迟,使动作电位波形正好出现在显示屏的适中位置。同时调节刺激强度求出在相应刺激波宽下动作电位产生的阈强度和顶强度。
3.双相动作电位的观察:计算双相动作电位时程及上升相、下降相宽度及幅值,计算自伪迹起点至动作电位起点所需的时间。
4.把神经干方向倒转后,动作电位发生何变化?
5.单相动作电位的观察:用镊子将两个记录电极之间的神经夹伤(或滴加普鲁卡因),此时显示屏上呈现单相动作电位,观察其形状并计算时程、幅值及伪迹至单相动作电位起点所需时间。
[实验结果]
(附图)(正常双相动作电位、倒转后双相动作电位、单相动作电位)
附图1 正常双相动作电位附图2 正常倒转动作电位附图3 正常单相动作电位
[分析讨论与心得]
序号1:1)当刺激持续时间分别为0.1ms、0.5ms、2.0ms时,阈强度分别为1.2V,0.4V和
0.4V。若排除实验测量误差和神经状态差异(神经状态逐渐变差),我们可以看出:
同一条神经其阈强度随着刺激持续时间的增加而减少,0.4V可能是该神经刺激的基强度;2)在不同的刺激时间下,三次的顶强度非常接近,约为0.13V。3)同时,我们可以看到,在2.0ms的矩形波刺激下,产生了两个双相电位,第二个图形的电位幅度小于第一个电位幅度。
分析:1)阈强度随时间的变化大致符合强度-时间曲线。2)三次实验的顶强度结果大致相等,等于混合神经中兴奋性最差的神经纤维的阈强度。3)在2.0ms的方波中产生了两个双相电位图,原因是通电和断电时分别有瞬时电流产生,间隔 2.0ms,产生了两个有效的刺激。同时,2.0ms大于神经的绝对不应期,落在相对不应期中,使得
第二个图形的动作电位小于第一个图形。而0.1和0.5ms均落在绝对不应期中,断电刺激不能产生另一个动作电位。
但是,其中存在一些问题:1)我们只是选取了3个时间变量对阈强度进行测量,并不能有效地观察出阈强度和刺激时间的关系。2)随着实验的进行,所测神经的状态随着表面任式液的蒸发而变差,而强度-时间是一个比较精确的测量,这样的实验结果不免存在着较大的误差和不确定性。3)我们可以看到0.1ms和0.5ms的测量值并不完全符合双曲线模型;0.4V作为基强度的误差很大。4)在0.1ms的刺激时间
下,本人通过测量三次,发现第一次的顶强度为0.12V,而第二次和第三次均为
0.19mv;产生该误差的原因可能是神经干的状态变差。或是,测量误差。
序号2:表中的正常双相电位、单相电位和倒转电位值都是在阈上刺激大于顶强度刺激的时候取得的。1)对单相动作电位进行分析时,可以发现图形不是完全轴对称的:峰电位和后电位。峰电位是神经冲动的电信号,代表神经冲动的兴奋过程,后电位与兴
奋后的恢复有关。而且,单相测量电位的宽度较其他两种图形偏大较多。2)倒转动作电位和正常双相动作电位的幅值相同,可能是倒转过后两测量处的粗细相差不大,状态差不多。
存在问题:在测量过程中,发现正常双相电位的顶强度为0.12V,单相电位的顶强
度为0.25V,而倒转电位的顶强度为0.36V。本人无法分析出来问题出在哪里。(可能是神经状态随着测量的进行而变差?)
[注意事项]
1、免污染、压挤、损伤和用力牵拉神经,不可用金属器械触碰神经干。
2、在操作过程中,应给神经滴上任氏液,防止表面干燥,以免影响标本的兴奋性。
[思考题]
1、神经干动作电位的图形为什么不是“全或无”的?
答:“全或无”原理是指某些生理现象不发生则无,一旦发生即为最大反应,反应的大小与引起该反应的刺激大小无关。而神经干是混合纤维,包含着多种兴奋性不同的神经。
阈强度的刺激刚刚可以引起其中一些兴奋性较高的纤维产生动作电位,随着刺激强度的增加,其余兴奋性较低的纤维陆续产生动作电位。当刺激超过顶强度时,全部神经纤维产生动作电位。所以神经干的动作电位会随着刺激的增大而增大,直到产生最大动作电位。
2、在神经干引导的双相动作电位的上、下相图形的幅值和波形宽度为什么不对称?
答:幅值和波形宽度不对称的原因:两个测量电极的相距距离不够长。当兴奋从第一个引导电极所在位置传导到第二个引导电极之后,第一个电极处并未完全恢复静息电位,而第二个电极处产生负相动作电位,两者产生叠加。净结果就是第一个上相图形的波形宽度减少,而下相图形的幅值降低,上下相图形不对称。即在原来两相对称的基础上,拖动负相向前,产生叠加后的图形。
3、当刺激强度达到一定值时,神经干动作电位的幅度就不再增大,为什么?
答:同第一问回答,神经干是混合纤维,由兴奋性和动作电位不同的神经混合而成。单纤维的动作电位符合“全或无”原理。当刺激强度达到一定值时,超过了所有纤维的阈强度最大值,导致所有神经纤维产生动作电位。此时,神经干动作电位的最大幅度就是所有神经纤维动作电位的总和,其值取决于系统的所储存的能量。所以,当刺激强度达到一定值后,神经干动作电位的幅度就不再增大。
4、如果将神经干标本的末梢端置于刺激电极一侧,从中枢端引导动作电位,图形将发生什
么样的变化?为什么?
答:引发的动作电位为倒转动作电位。正常情况下,倒转动作电位的图形与正常双相动
作电位的图形无异,电位的幅度等于或稍小于正常双相动作电位。因为,离体神经干的兴奋传播是双向的。当刺激发生在中枢端时,神经干较粗、蕴含能量较大,产生的动作电位幅度较末梢大。
神经干动作电位、传导速度及不应期的测定 【目的和原理】 神经纤维的兴奋表现为动作电位的产生和传导,神经纤维上传导的动作电位通常称为神经冲动。在神经细胞外表面,已兴奋部位带“负电”,未兴奋部位带“正电”,用引导电极引导出此电位差,输入到示波器,则可记录到动作电位的波形。本实验用细胞外记录法,可引导出坐骨神经的复合动作电位。 神经纤维兴奋的标志是产生一个可以传导的动作电位,它依局部电流或跳跃传导的方式沿神经纤维传导。其传导速度取决于神经纤维的直径、内阻、有无髓鞘等因素,可用电生理学方法来记录和测量。 神经纤维在一次兴奋过程中,其兴奋性可发生周期性变化,包括绝对不应期、相对不应期、超常期和低常期。本实验主要目的是学习电生理仪器的使用方法,掌握离体神经干动作电位的细胞外记录法及其基本波形的判断和测量。掌握神经干动作电位传导速度及其不应期的测定方法,通过调整条件刺激和测试刺激之间的时间间隔,来测定坐骨神经干的绝对不应期。 【实验对象】 蟾蜍或蛙。 【实验器材和药品】 蛙类手术器械一套、电子刺激器、示波器(或计算机实时分析系统)、神经屏蔽盒、任氏液。 【实验步骤】 1.制备坐骨神经——胫、腓神经标本操作方法详见3.8。 2.连接装置(见图8-1-1)。 3.准备仪器: (1)刺激器:调节刺激器各项参数:刺激方式连续刺激,频率16Hz,刺激强度0.5v,波宽0.1ms。调节延迟使动作电位的图像位于示波器荧光屏的中央。 (2)示波器:灵敏度:1~2mv/cm,扫描速度:1~2ms/cm,引导电极输入到示波器的“AC”端,双边输入,刺激器的“同步输出”接示波器“外触发输入”,触发选择设置为“同步触发”。 4.观察项目:
人体解剖及动物生理学实验报告 神经干复合动作电位 【实验题目】 神经复合动作电位 1、蟾蜍坐骨神经干复合动作电位(CAP)阈值和最大幅度的测定 2、蟾蜍坐骨神经干复合动作电位(CAP)传导速度的测定 3、蟾蜍坐骨神经干复合动作电位(CAP)不应期的测定 【实验目的】 确定蟾蜍坐骨神经干复合动作电位(CAP)的 1、临界值和最大值 2、传导速度 3、不应期(包括绝对不应期和相对不应期) 【实验原理】 神经系统对维持机体稳态起着重要作用,动作电位(AP)是神经系统进行通信联系所采用的信号。多个神经元的轴突集结成束形成神经,APs沿感觉神经经外周传向中枢或沿运动神经由中枢传向外周。坐骨神经干由上百根感觉神经和运动神经组成,分别联系腿部的感受器和效应器(骨骼肌)。如果电刺激一根离体的坐骨神经干,通过细胞外引导方式,就能记录到神经干复合动作电位(CAP)。一个CAP是一系列具有不同兴奋性的神经纤维产生的多个AP的总和。刺激强度越大,兴奋的神经纤维数目就越多,CAP的幅度也就越大。与胞内引导得到的单细胞AP相比,CAP是双相电位,逐级递增(非全或无),并且幅度较小。 阈电位是指一个刚刚能观测到的CAP,所对应的刺激为阈刺激。在一定范围内增加刺激强度,CAP幅度相应增大。最大CAP所对应的最小刺激电位即最大刺激。 动作电位可以沿神经以一定的速度不衰减地传导,传导速度的快慢基于多种因素,这些因素决定了生物体对其坏境的适应性。它们包括神经的直径、有无髓鞘、温度等等。
神经在一次兴奋过程中,其兴奋性将发生一个周期性的变化,最终恢复正常。兴奋的周期性变化,依次包括绝对不应期、相对不应期等等。绝对不应期内,无论多么强大的刺激都不能引起神经再一次兴奋;相对不应期内,神经兴奋性较低,较大的刺激能够引起兴奋。绝对不应期决定了神经发放冲动(动作电位)的最高频率,保证了动作电位不能叠加(区别于局部电位),以及单向传导(只能有受刺激部位向远端传导,不能返回)的特性。不应期的产生依赖于细胞膜上特定离子通道的特点,如钠、钾离子通道。 【实验方法】 1、制作蟾蜍坐骨神经干标本 (1)双毁髓处死蟾蜍后,剥去皮肤,暴露腰骶丛神经,游离大腿肌肉之间的坐骨神经干及其下行到小腿的两个分支:胫神经和腓神经,三段结扎,剪去无关分支后离体。注意保持神经湿润。 (2)将神经搭于标本盒内,保证神经与电极充分接触,中枢端接触刺激电极S1和S2,外周端接触记录电极R1-R5,之间接触接地电极。 (3)刺激输出线两夹子分别连接标本盒的刺激电极S1和S2,插头接生物信号采集系统RM6240的刺激输出插口;信号输入倒显得红色和绿色夹子分别连接记录电极(绿色夹子在前,引导出正向波形,即出现的第一个波峰向上),黑色夹子连接接地电极,插头接通道A、蟾蜍坐骨神经干复合动作电位(CAP)临界和最大幅度的确定 (1)打开信号采集软件,从“实验”菜单中选取“神经干动作电位”,出现自动设置的界面,各项参数已设置好,界面中只有一个采集通道,对应仪器面板上的通道1(因此信号输入线应连接在通道1)。 (2)检查装置链接正确,确定装置是否正常工作,以及神经是否具有活性。采用刺激强度1V,刺激时程0.2ms,延时5ms,刺激模式为单刺激。选择“同步触发”,按下“开始刺激”后,正常情况下屏幕上会出现一个双相电位即CAP。 (3)降低刺激强度,确定CAP的阈电位。记录刺激阈值及CAP幅度(波峰与波谷之间的差值)。 (4)以0.05V或更小的间隔,逐渐增大刺激强度,观察CAP幅度的变化,同时,记录刺激电位及对应的CAP幅度,直到CAP达到稳定,即最大值(神经标本在正常生理活性时,1V 以内的刺激强度即可引起最大的CAP)。
人体解剖及动物生理学实验报告 实验名称神经干复合动作电位 姓名 学号 系别 组别 同组姓名
实验室温度20℃ 实验日期2015年4月24日 一、实验题目 蟾蜍坐骨神经干复合动作电位(CAP) A蟾蜍坐骨神经干CAP阈值和最大幅度的确定 B蟾蜍坐骨神经干CAP传导速度的确定 C蟾蜍坐骨神经干CAP不应期的确定 二、实验目的 确定蟾蜍坐骨神经干复合动作电位(CAP)的 (1)临界值和最大值 (2)传导速度 (3)不应期(相对不应期、绝对不应期) 三、实验原理 神经系统对维持机体稳态起着重要作用,动作电位(AP)是神经系统进行通信联系所采用的信号,多个神经元的轴突集结成束形成神经,APs沿感觉神经有外周传向中枢或沿运动神经由中枢传向外周。坐骨神经干由上百根感觉神经和运动神经组成,分别联系腿部的感受器和效应器(骨骼肌)。如果电刺激一根离体的坐骨神经干,通过细胞外引导方式,就能记录到神经干复合动作电位(CAP)。一个CAP是一系列具有不同兴奋
性的神经纤维产生的多个AP的总和。刺激强度越爱,兴奋的神经纤维数目就越多,CAP 的幅度也就越大。与胞内引导得到的单细胞AP相比,CAP是双相电位,逐级递增(非全或无),并且幅度较小。 阈电位是指一个刚刚能观测到的CAP,所对应的刺激为阈刺激。在一定范围内增加刺激强度,CAP幅度相应增大。最大CAP所对应的最小刺激电位即最大刺激。 动作电位可以沿神经以一定的速度不衰减地传导,传导速度的快慢基于多种因素,这些因素决定了生物体对其坏境的适应性。它们包括神经的直径、有无髓鞘、温度等等。 神经在一次兴奋过程中,其兴奋性将发生一个周期性的变化,最终恢复正常。兴奋的周期性变化,依次包括绝对不应期、相对不应期等等。绝对不应期内,无论多么强大的刺激都不能引起神经再一次兴奋;相对不应期内,神经兴奋性较低,较大的刺激能够引起兴奋。绝对不应期决定了神经发放冲动(动作电位)的最高频率,保证了动作电位不能叠加(区别于局部电位),以及单向传导(只能有受刺激部位向远端传导,不能返回)的特性。不应期的产生依赖于细胞膜上特定离子通道的特点,如钠、钾离子通道。 四、实验方法 蟾蜍坐骨神经标本的制作 1.双毁髓处死蟾蜍后,剥去皮肤,暴露腰骶丛神经,游离大腿肌肉之间的坐骨神经 干及其下行到小腿的两个分支:胫神经和腓神经,三段结扎,剪去无关分支后离体。注意保持神经湿润。 2. 将神经搭于标本盒内,保证神经与电极充分接触,中枢端接触刺激电极S1和S2, 外周端接触记录电极R1-R2,之间接触接地电极。 3. 刺激输出线两夹子分别连接标本盒的刺激电极S1和S2,插头接生物信号采集系 统RM6240的刺激输出插口;信号输入倒显得红色和绿色夹子分别连接记录电极(绿色夹子在前,引导出正向波形,即出现的第一个波峰向上),黑色夹子连接接地电极,插头接通道1.
人体解剖及动物生理学实验报告实验名称神经干复合动作电位 姓名 学号 系别 组别 同组姓名 实验室温度20℃ 实验日期2015年4月24日一、实验题目 蟾蜍坐骨神经干复合动作电位(CAP) A蟾蜍坐骨神经干CAP阈值和最大幅度的确定 B蟾蜍坐骨神经干CAP传导速度的确定 C蟾蜍坐骨神经干CAP不应期的确定 二、实验目的 确定蟾蜍坐骨神经干复合动作电位(CAP)的 (1)临界值和最大值
(2)传导速度 (3)不应期(相对不应期、绝对不应期) 三、实验原理 神经系统对维持机体稳态起着重要作用,动作电位(AP)是神经系统进行通信联系所采用的信号,多个神经元的轴突集结成束形成神经,APs沿感觉神经有外周传向中枢或沿运动神经由中枢传向外周。坐骨神经干由上百根感觉神经和运动神经组成,分别联系腿部的感受器和效应器(骨骼肌)。如果电刺激一根离体的坐骨神经干,通过细胞外引导方式,就能记录到神经干复合动作电位(CAP)。一个CAP是一系列具有不同兴奋性的神经纤维产生的多个AP的总和。刺激强度越爱,兴奋的神经纤维数目就越多,CAP的幅度也就越大。与胞内引导得到的单细胞AP相比,CAP是双相电位,逐级递增(非全或无),并且幅度较小。 阈电位是指一个刚刚能观测到的CAP,所对应的刺激为阈刺激。在一定范围内增加刺激强度,CAP幅度相应增大。最大CAP所对应的最小刺激电位即最大刺激。 动作电位可以沿神经以一定的速度不衰减地传导,传导速度的快慢基于多种因素,这些因素决定了生物体对其坏境的适应性。它们包括神经的直径、有无髓鞘、温度等等。 神经在一次兴奋过程中,其兴奋性将发生一个周期性的变化,最终恢复正常。兴奋的周期性变化,依次包括绝对不应期、相对不应期等等。绝对不应期内,无论多么强大的刺激都不能引起神经再一次兴奋;相对不应期内,神经兴奋性较低,较大的刺激能够引起兴奋。绝对不应期决定了神经发放冲动(动作电位)的最高频率,保证了动作电位不能叠加(区别于局部电位),以及单向传导(只能有受刺激部位向远端传导,不能返回)的特性。不应期的产生依赖于细胞膜上特定离子通道的特点,如钠、钾离子通道。 四、实验方法 蟾蜍坐骨神经标本的制作 1.双毁髓处死蟾蜍后,剥去皮肤,暴露腰骶丛神经,游离大腿肌肉之间的坐骨神经干及其下行到小腿 的两个分支:胫神经和腓神经,三段结扎,剪去无关分支后离体。注意保持神经湿润。 2. 将神经搭于标本盒内,保证神经与电极充分接触,中枢端接触刺激电极S1和S2,外周端接触记录 电极R1-R2,之间接触接地电极。
2.神经干动作电位是神经兴奋的客观标志,给具有兴奋性的神经干以一定强度的刺激,会产生动作电位并传导。在神经细胞外面,已兴奋部位的膜外电位负于静息部位。当神经冲动通过后,兴奋处的膜外电位又恢复到静息时的水平。所以兴奋部位和邻近部位之间可出现电位差,用引导电极引导出此电位差,输入到示波器,则可记录到动作电位的波形。本实验采用细胞外记录法,可引导出坐骨神经的复合动作电位。 3.经纤维兴奋的标志是产生一个可以传导的动作电位,它以局部电流或跳跃式传导的方式沿神经纤维传导。其传导速度取决于神经纤维的直径、内阻、有无髓鞘等因素。坐骨神经-腓神经为一混合神经干,其动作电位是由一群不同兴奋阈值、传导速度和幅值的电位总和而成,为复合动作电位。蛙类坐骨神经干中以Aa类纤维为主,传导速度大约35~40m/s。测定神经冲动在神经干上传导的距离和通过这些距离所需的时间,即可计算出该神经干兴奋传导的速度。 4.动作电位在神经纤维上的传导有一定的速度。不同类型的神经纤维,其传导速度各不相同,取决于神经纤维的直径、有无髓鞘、环境温度等因素。蛙类坐骨神经干中以Aα类纤维为主,传导速度大约35~40m/s。测定神经冲动在神经干上传导的距离(d)与通过这一距离所需的时间(t),即可根据V=d/t 求出神经冲动的传导速度。 5.神经纤维的兴奋部位相对于未兴奋部位来说呈负电位,两点之间存在电位差,通过单极或双极电极的引导在记录系统上进行显示和分析。由于采用的是胞外记录的方法,因而在单极记录时,测得的动作电位实际上是组成神经干中的每根神经纤维兴奋后的超射值在神经干表面的叠加。即此动作电位是一复合波,其上升相、下降相及峰值不是相应的单一动作电位波形的去极化相、复极化相及峰电位。在双极记录时,测得的波形实际上是两个记录电极的电位差,与单一动作电位波形相差更大,这使问题的分析更加复杂。动物实验制作的坐骨神经 腓肠肌标本中,神经干是由具有不同生理特性的不同种类神经纤维所组成,故复合动作电位记录的是复合波。然而,每种纤维兴奋后传导速度各不一样,波长也各不相等,加上引导方式不同,这也增加了我们分析复合双相动作电位的复杂性及带来传导速度测定的困难。 6.对于单根神经纤维,其兴奋后产生负波。对于某一点,负波的产生和终止不是突然的,而需要一定的时间才能达到最高点,故记录曲线的上升和下降都具有一定的斜率。神经干受刺激后,由于不同神经纤维兴奋产生了不同的负波,它们波长不等,传导速度也不相等,所以
神经干双向动作电位的引导传导速度及不应期的测定作者:2011222681宋利婷组员:2011222702曾惜2011222709张芮2011222698杨袁虹 一、实验对象:蟾蜍 二、实验目的:观察蟾蜍坐骨神经动作电位的基本波形,掌握坐骨神经制备方法与引导动作电位的方法,理解与刺激和最大刺激强度的概念测定潜伏期时程和波幅,学会通过潜伏期法和潜峰法测定神经冲动的传导速度,通过测定神经干不应期理解兴奋性在兴奋过程中的变化过程。 三、实验内容 图一:阈刺激和最大刺激强度的测定 由上图可知,以0.100v为起始刺激强度,在0.100到0.300v的刺激时,不产生动作电位,
逐渐增大强度,一直到当刺激强度为0.4V时,刚好引产生动作电位,即阈刺激为0.4V,当刺激强度达到1.4V后,即使再增加刺激强度,动作电位的幅也不再改变,即最大(适)刺激强度为1.4V. 图二:潜伏期波幅时程及速度的测定 由在最适刺激强度时动作电位原图上进行区间测量可知,潜伏期为0.60ms,时程t1为2.84ms ,波幅为2.72mV,输入刺激电极到第一个引导电极间距离s=1.3cm,以传导速度和根据速度的公式计算传导速度v1=s/t1,求得的速度v1=45m/s 图三:潜峰法测量速度
如图是通过测量两个通道的动作电位波峰间的时间差,为(t1-t2),测量并输入两对引导电极间的距离为(s2-s1),s2=4.7cm,s1=3.8cm,t1-t2=0.28ms,由传导速度和用公式计算传导速度:v2=(s2-s1)/(t1-t2),v2=321m/s 图四:绝对不应期和相对不应期的测定
神经干动作电位实验报Experimental report of neUhtstem action potential 告 Intern ship report 实验报告
一、实验目的: 1. 学习蛙坐骨神经干标本的制备 2. 观察坐骨神经干的双相动作电位波形,并测定最大刺激强度 3. 测定坐骨神经干双相动作电位的传导速度 4. 学习绝对不应期和相对不应期的测定方法 5. 观察机械损伤或局麻药对神经兴奋和传导的影响 二、实验材料 1. 实验对象:牛蛙 2. 实验药品和器材:任氏液,2%普鲁卡因,各种带USB接口或插头的连接导线,神经屏 蔽盒,蛙板,玻璃分针,粗剪刀,眼科剪,眼科镊,培养皿,烧杯,滴管,蛙毁髓探针,BL-420N 系统 三、主要方法和步骤: 1. 捣毁脑脊髓 2. 分离坐骨神经 3. 安放引导电极 4. 安放刺激电极 5. 启动试验系统 6. 观察记录 7. 保存 8. 编辑输出 四、实验结果和讨论 1.观察神经干双相动作电位引导(单通道,单刺激) 如图,观察到一个双相动作电位波形。
Pm驴:i SQOQOKi 2.0 ms 7 射¥ 也00z 时间 一—j .................... : .................. 频率: 最大值- ...... ' ........ ' ......... [ ........ ;...... [协小值: -15 - -20 _ 1 OOY oo: oo. m兀卫EQ创 2.神经干双相动作电位传导速度测定(双通道,单刺激) -ID kUUUChz L.U ns ZlT m¥ii J.ttmz j ................. ■:- I 2? 1. WV 1 I --------------- 14 I I 4 I I I ooTio mo oa nr iins on oo oru oom coe co nr n o日on m nn oo oo ni2 DO on rtu OO CIJ ri^ oo oc OIA (1) 选择“神经骨骼肌实验”一“…传导速度测定” (2) 改变单刺激强度 (3) 传导速度=传导距离(R1--R2-)/传导时间(t 2-t 1) 如图所示,两个波峰之间的传导时间△ t = (t 2-t 1) = 0.66ms 实验中,我们设定在引导电极1和3之间的距离△ R = (R 1--R2-) = 1cm 故传导速度v = △ R/ △ t = 1cm / 0.66ms = 15.2 m/s 释: 最 大ii; ■小 值: 平均值: 嶂赠但? 面租 BJ祠; 最知宜. 环值: 平均值: 而租
For personal use only in study and research; not for commercial use 神经干动作电位传导速度的测定 实验对象:蟾蜍 一实验目的 掌握坐骨神经标本的制备方法。 掌握引导神经干复合动作电位和测定其传导速度的基本原理。 二相关知识 (一)兴奋及兴奋性的概念 (二)动作电位的潜伏期、动作电位时程和幅值 1、动作电位:各种可兴奋细胞在受到刺激而兴奋时,可以在细胞膜静息电位的基础 上发生一次短暂的,可向周围扩布的电位波动。这种电位波动称为动作电位。(三)、动作电位的传导 局部电流的形式 1、细胞外记录 2、神经干的动作电位 神经干是由许多粗细不等的有髓和无髓神经纤维组成的混合神经,故神经干动作电位与单根神经纤维的动作电位不同,它是由许多神经纤维的动作电位合成的一种复合电位。 三实验原理 (一)、单根神经纤维动作电位的引导及其传导 1、记录出了一个先升后降的双相动作电位的原理 当神经纤维未受刺激时,膜外与电极所接触的两点之间没有电位差,所以两电极之间也无电位差存在,扫描线为一水平基线。在神经干左端给予电刺激后,则产生一个向右传导的冲动(负电位),当冲动传到1电极(负电极)下方时,此处电位较2处为低,产生了电位差,扫描线向上偏转,记录出一个向上的波形(在电生理实验中,为了便于观察,习惯上规定负波向上)。随后,冲动继续向右侧传导,离开1电极传向2电极处。当它到达2电极(正电极)下方时,因1电极处神经差不多已恢复到原来的状态,于是2电极处又较1电极处为负,引起扫描线向下偏转,记录出一个向下的波形。这样,在神经冲动向右传导的过程中,就记录出了一个先升后降的双相动作电位。 负电极在前时,它首先记录到神经干表面由正变负的电位变化,经历了由正到负再到正的过程,因此记录出动作电位的上相。当在后的正电极记录到这种同样的电位变化过程时,显示相反的情况,记录出动作电位的下相。如果互换正、负电极的位置,则记录到先降后升的双相动作电位。 C.?? A点神经纤维多于B点(次要原因)。 (二)、神经干动作电位的引导及其传导 四实验步骤 (一)、制备蛙类坐骨神经-胫腓神经标本 通过观看录象让学生学习制作方法
一目的要求: 1.学习蛙类动物单毁髓与双毁髓的方法。 2.学习并掌握蛙类坐骨神经干标本的制备方法。 3.学习电生理学实验方法。 4.观察蟾蜍坐骨神经干复合动作电位的波形,了解其产生的基本原理。 二基本原理: 神经干在受到有效刺激后,可以产生动作电位,标志着神经发生兴奋。如果在神经干另一端引导传来的兴奋冲动,可以引导出双相的动作电位,如在两个引导电极之间将神经麻醉或损坏,则引导出的动作电位即为单相向动作电位。 神经细胞的动作位是以”全或无”方式发生的。坐骨神经干是由很多不同类型的神经纤维组成的,所以,神经干的动作电位是复合动作电位。复合动作电位的幅值在一定刺激强度下是随刺激强度的变化而变化的。 三动物与器材: 蟾蜍、常用手术器械(手术剪、手术镊、金冠剪、眼科剪、毁髓针和玻璃分针)、蛙板、固定针、不锈钢盘、污物缸、粗棉线、任氏液、计算机生理信号处理系统、神经屏蔽盒。 四方法步骤: 1.蟾蜍的单毁髓与双毁髓 一手握住蛙或蟾蜍(可用纱布包裹蟾蜍躯干部),背部向上。用拇指压住蛙或蟾蜍的背部,食指按压其头部前端,使头端向下低垂; 另一手持毁髄针,由两眼之间沿中线向后触划,当触及到两耳中间的凹陷处(此处与两眼的联机成等边三角形)时,持针手即感觉针尖下陷,此处即是枕骨大孔的位置。将毁髄针由凹陷处垂直刺入,即可进入枕骨大孔(图t-1)。然后将针尖向前刺入颅腔,在颅腔内搅动,以捣毁脑组织。如毁髄针确在颅腔内,实验者可感到针尖触及颅骨。此时的动物为单毁髓动物。再将毁髓针退至枕骨大孔,针尖转冋后方,与脊柱平行刺入椎管,以捣毁脊髓。彻底捣毁脊髓时,可看到动物的后肢突然蹬直,而后瘫痪如棉(图t-2),此时的动物为双毁髓动物。如动物仍表现肢肌肉紧张或活动自如,必须重新毁髓。操作过程中应注意使蟾蜍头部向外侧(不要挤压耳后腺),防止耳后腺分泌物射入实验者眼内(如被射入,则需立即手生理盐水冲洗眼睛)。 2.坐骨神经干标本制备 (1) 剥制后肢标本(图t-3) (2) 分离两后肢(图t-4)
反射时测定和反射弧分析 神经干动作电位的测定 2013级生命科学3班张柏辉学号:20132501076 1.实验目的 1.观察蛙坐骨神经干动作电位的基本波形,并了解其产生的基本原理; 2.学习测定反射时的方法,了解反射弧的组成; 3.了解脊髓反射的功能特性。 2.实验原理 (一)反射时测定和反射弧分析 反射是指对某一刺激无意识的应答。反射活动的结构基础称为反射弧,包括感受器、传入神经、神经中枢、传出神经和效应器。从皮肤接受刺激至机体出现反应的时间称为反射时。反射时是反射通过反射弧所用的时间。反射弧的任何一部分缺损,原有的反射不再出现。中枢的兴奋和抑制同时存在又相互影响。在脊髓反射的中枢之间或高位脑和脊髓对低位脊髓反射中枢均存在抑制作用,这些抑制作用保证了机体活动的协调性。 (二)神经干动作电位的测定 神经干在受到有效刺激后可以产生复合动作电位,标志着兴奋的产生。如果在立体神经干的一端施加刺激,从另一端引导传来的兴奋冲动可以记录出双相动作电位,假如在引导的两个电极之间将神经干麻醉或损坏,阻断其兴奋传导能力,此时可以记录到单相动作电位。 3.实验对象与实验材料 (一)材料:虎纹蛙 (二)器具:手术剪、手术镊、手术刀、金冠剪、眼科剪、毁髓针、玻璃分针、木质蛙板、固定针、锌铜弓、瓷盘、污物缸、滴管、纱布、粗棉线、滤纸片、支架、蛙嘴夹、小烧杯、秒表、神经屏蔽盒、PowerLab、刺激线、USB线、电脑 (三)试剂:任氏液、2%普鲁卡因、0.5%及1%硫酸溶液 4.实验方法与步骤 (一)反射时与反射弧的测定 1. 屈反射
取一只虎纹蛙,只毁脑髓制成脊蛙(只毁脑),用蛙嘴夹夹住蛙下颌悬挂在支架上,右后肢最长趾浸入0.5%硫酸溶液中2~3mm(<10s),同时开始计时。当出现屈反射时立即停止计时,并用清水冲洗受刺激皮肤,纱布擦干,重复测屈反射时3次。同样方法测左后肢最长趾的屈反射时。 2.损毁感受器 用手术剪自后肢最长趾基部环切皮肤,后用手术镊剥净长趾上的皮肤,用0.5%硫酸溶液刺激去皮皮肤,并记录侧时结果。 3.对照没损毁感受器 改换同侧后趾有皮肤趾,将其浸入0.5%硫酸溶液中,测定反射时。 4.擦或抓反射 取一浸有0.5%硫酸溶液的滤纸片贴于虎纹蛙腹部,记录抓或擦反射的反射时。 5.麻醉神经 右侧坐骨神经滴加普鲁卡因液,加药同时开始计时,每2min重复步骤3,并记录加药时间。 屈反射消失后,重复步骤4,记录加药时间。 6.测左后肢最长趾屈反射时,并与步骤1比较。 7.毁坏脊髓,重复步骤7. (二)神经干动作电位的测定 1. 标本制备:坐骨神经干(双毁髓->剥制后肢->分离两后肢),分离坐骨神经到踝关节附近,将标本搭置在神经屏蔽盒各金属极上; 2.设置实验装置:连接神经屏蔽盒各接线; 3.设置CH3 BioAmp和Stimulator:打开PowerLab电源,打开Scope软件(或Chart5),设置通道3: Ch3 BioAmp:Range 5mV, Filter 20Hz,High Pass 10Hz (调零用DC档);设置Stimulator:单刺激Delay 120ms ,波宽Duration:10mS,振幅Ampt:100mV;设置Overlay on Top 点右下角Start ,即可看到刺激输出后得到的动作电位波形图。每点一次START,记录号增加在图下方,调节单刺激持续时间Duration和振幅大小,以及调节放大器HighPass等参数,均对实验结果有影响。得到双相电位后,以普鲁卡因液或棉线结扎法损伤神经,调参数至振幅Amp5.000mV,,观察单相电位。
蟾蜍坐骨神经干复合动作电位特性 1 材料 蟾蜍;任氏液;BB-3G标本屏蔽盒,微机生物信号采集处理系统。 2 方法 2.1 系统连接和参数设置RM6240多道生理信号采集处理系统与标本盒连接,1、2通道时间常数0.02s、滤波频率3KHz、灵敏度5mV,采样频率100KHz,扫描速度0.2ms/div。单刺激激模式,刺激波宽0.1ms,延迟1ms,同步触发。 2.2 制备蟾蜍坐骨神经干标本蟾蜍毁脑脊髓和下肢标本制备,下肢标本仰卧置于蛙板上,分离脊柱两侧的坐骨神经,紧靠脊柱根部结扎,近中枢端剪断神经干,将神经干从骶部剪口处穿出。循股二头肌和半膜肌之间的坐骨神经沟,纵向分离坐骨神经直至腘窝胫腓神经分叉处,将腓浅神经、胫神经与腓肠肌和胫骨前肌分离。置剪刀于神经与组织之间,剪切直至跟腱并剪断跟腱和神经。剥离附着在神经干的组织,坐骨神经干标本浸入任氏液中。 2.3 实验观察 2.3.1 中枢端引导动作电位神经干末梢端置于刺激电极处,用刺激电压1.0V,波宽0.1ms 的方波刺激神经干,测定第1和第2对引导电极引导的双相动作电位正相波和负相波的振幅和时程。 2.3.2 改变引导电极距离用刺激电压1.0V,波宽0.1ms的方波刺激神经干中枢端,记录引导电极距离10mm、20mm、30mm时的动作电位。分别测定上述三个引导电极距离的动作电位正相波和负相波的振幅和时程。 2.3.3 末梢端引导动作电位和测定动作电位传导速度引导电极距离10mm,神经干中枢端置于刺激电极处,用刺激电压1.0V,波宽0.1ms的方波刺激神经干,测定第1对引导电极引导的双相动作电位正相波和负相波的振幅和时程。分别测量两个动作电位起始点的时 间差和标本盒中两对引导电极之间的距离S(应测r 1- r 2 的间距),计算动作电位传导速度。 2.3.4 单相动作电位引导用镊子在第1对引导电极之间贴近后一电极处神经夹伤,用刺激电压1.0V,波宽0.1ms的方波刺激神经干,测量单相动作电位的振幅和动作电位持续时间。测量单相动作电位的上升时间和下降时间。 2.3.5 按0.02V步长,刺激强度从0V开始逐步增加至动作电位不再增大止。测量动作电位振幅与刺激电压对应数据。 2.3.6 换一神经干,用刺激电压1.0V,波宽0.1ms的方波刺激神经干,若第2对引导电
实验四 神经干动作电位的测定 【实验目的】 学习生物电活动的细胞外记录法;观察坐骨神经干动作电位的基本波形、潜伏期、幅值 以及时程。 【实验原理】 神经组织属于可兴奋组织,其兴奋的客观标志是产生动作电位,即当受到有效刺激时, 膜电位在静息电位的基础上将发生一系列的快速、可逆、可扩布的电位变化。 动作电位可以沿着神经纤维传导。在神经细胞外表面,已兴奋的部位带负电,未兴奋的 部位带正电。 采用电生理学实验方法可以引导出此电位差或电位变化, 根据引导的方式不同, 所记录到的动作电位可呈现单向或双向的波形。 由于坐骨神经干是由许多神经纤维组成的, 所以其产生的动作电位是众多神经纤维动作 电位的叠加,即为一个复合动作电位。这些神经纤维的兴奋性是不同的,所以在一定范围内 增大刺激强度可以使电位幅度增大。这和单一细胞产生的动作电位是有区别的。本实验所引 导出的动作电位即为坐骨神经干的复合动作电位。 【实验对象】 蛙或蟾蜍。 【实验材料】 两栖类手术器械 1 套、滴管、BL-410生物机能实验系统、神经屏蔽盒、刺激电极、接 收电极、任氏液。 【实验步骤】 1. 制备坐骨神经干标本 坐骨神经干标本的制备方法与制备坐骨神经-腓肠肌标本相似。首先按照制备坐骨神经- 腓肠肌标本的方法分离坐骨神经, 当游离至膝关节处时, 在腓肠肌两侧找到胫神经和腓神经, 任选其一剪断,然后分离留下的一支直至足趾并剪断。保留与坐骨神经相连的一小段脊柱, 其余组织均剪除。此时,即制成了坐骨神经干标本。将标本浸于任氏液中,待其兴奋性稳定 后开始实验。 2.接标本与实验仪器 1)棉球沾任氏液擦拭神经标本屏蔽盒内的电极,将标本的脊柱端置于屏蔽盒的刺激电 (图 4-1 屏蔽盒) 极端(即 0刻度端),其神经部分横搭在各个电极上。 2)取出 BL-410 生物机能实验系统专用刺激电极,将其插头插在与主机“刺激”插口 中, 另一端的两个鳄鱼夹分别夹在屏蔽盒左侧的两个刺激接口上。 红色接正极, 黑色接负极。 保持两鳄鱼夹的间距为 1cm。 3)取出 BL-410 生物机能实验系统专用生物电信号引导电极。引导电极的一端是一个5 芯插口,将该插口与主机的 1 通道相连;另一端有三个不同颜色的鳄鱼夹,其中黑色的夹子 用于接地,夹在屏蔽盒的接地接口上并和屏蔽盒本身的接地鳄鱼夹相对应的接在同一电极 上;红色的夹子引导正电信号,黄色的夹子引导负电信号,分别夹在屏蔽盒的两个接收电极 接口上(红、黄鳄鱼夹的连接位置可以任选,但要保证间距为 1cm,且所接的电极上搭有神
实验报告 说明:1、实验报告务必独完成,对抄袭者将按不及格处理; 2、实验报告的格式请按下面的各项要求来填写,不要改动; 3、正文字体统一用“仿宋-GB2312”、,小四号,单倍行距,小标题加黑; 4、下面的“替换这里”字体底纹在完成后去除; 5、实验报告按时上传,上传时文件名统一按照网上说明来命名; 实验名称:神经干动作电位的引导和观察/动作电位传导速度的测定 同组姓名: 实验日期: 室 温: 气 压: 成 绩: 教 师: 一、实验结果 (一)神经干动作电位的引导和观察 (二)动作电位传导速度的测定 姓名: 学号:
二、分析与讨论 分析: (一)神经干动作电位的引导和观察 神经元以动作电位的形式传送神经冲动,给具有兴奋性的神经干以一定强度的刺激,会产生动作电位并传导。细胞膜外兴奋部位的膜外电位负于静息部位,冲动通过后,膜外电位又恢复到静息水平。因此兴奋部位与邻近部位之间会出现电位差,用引导电极引导出此电位差,则可记录到动作电位的波形。 本实验采用细胞外记录法引导出坐骨神经的复合动作电位。 1. 单相动作电位:两个引导电极之间的神经组织有损伤,兴奋波只通过第一个引导电极,不能传导至第二个引导电极,则只能记录到一个方向的电位偏转波形。 2. 双相动作电位:如果将两引导电极置于正常完整的神经干表面,当神经干一端兴奋之后,兴奋波先后通过两个引导电极,可记录到两个方向相反的电位偏转波形。 在实验中,两记录电极放置在神经干表面,记录已兴奋区域与未兴奋区域间的电位差。由于动作电位传导到神经干两记录电极放置点的时间先后差异,将在两记录电极间引导出电位波动,出现类似于正弦波的电位变化,这就是神经干复合动作电位。 双相动作电位特点:①第一相峰值总高于第二相;②第二相持续时间总大于第一相;③每相的上升支与下降支都不对称。 神经干动作电位与单根神经纤维中的动作电位不同:对单一的神经纤维而言,其动作电位呈“全或无”现象;在神经干中,它是由许多传导速度、幅度不同的神经纤维组成,在一定的范围内,随着刺激强度的增大,兴奋的纤维数目逐渐增多,神经干动作电位幅度也逐渐增强。 (二)动作电位传导速度的测定
神经干复合动作电位以及其传导速度和兴 奋不应期的测定 一目的要求 1.观察蛙坐骨神经复合动作电位的基本波形,并了解其产生的基本原理 2.学习测定蛙离体神经干上神经冲动传导速度的方法和原理 3.学习测定神经兴奋不应期的基本原理和方法 二基本原理 神经干在受到有效刺激以后可以产生复合动作电位,标志着神经发生兴奋。如果在离体神经干的一段施加刺激,从另一端引导传来的神兴奋冲动,可以记录出双相电位,加入在引导的两个电极之间将神经干麻醉或损伤,阻断其兴奋传导能力,这时候记录出的动作电位就成为单相电位。神经细胞的动作电位是以全或无的方式产生的。但是,复合动作电位的幅值在一定刺激强度下是随刺激强度的增加而增大的。 如果在远离刺激点的不同距离处分别引导离体神经干动作电位,两引导点之间的距离为m,在两引导点分别引导出的动作电位的时相差为s。即可按照公式v=m/s来计算出兴奋的传导速度。蛙类的坐骨神经干属于混合性神经,其中包含有粗细不等的各种纤维,其直径一般为3-29um,其中直径最粗的有髓纤维为A类纤维,传导速度在正常室温下为35-40 m/s。 神经每兴奋一次极其在兴奋以后的回复过程中,其兴奋性都要经历一次周期性的变化,其全过程依次包括绝对不应期、相对不应期、超常期和低常期4个时期。为了测定坐骨神经在发生一次兴奋以后兴奋性所发生的周期性变化,首先要给神经施加一个条件性刺激引起神经兴奋,然后在前一兴奋及其恢复过程不同时相再施加一个测试性刺激,用于检查神经的兴奋阈值和所引起的动作电位的幅度,以判定神经兴奋性的变化。 三实验材料 蛙,常用手术器械,PC机,信号采集处理系统,电子刺激器,神经屏蔽盒,任氏液 四实验步骤 1反射时和反射弧的测定 (1)制备脊蛙 (2)悬挂支架测定反射时 2神经干动作电位的测定 (1)坐骨神经标本的制作 (2)连接poewrlab通道,神经屏蔽盒 (3)打开scope软件设置 (4)刺激记录双相动作电位
神经干动作电位实验报告 篇一:泥蛙神经干动作电位的引导传导速度的测定实验报告 神经干动作电位传导速度的测定 一实验目的 一掌握坐骨神经标本的制备方法。 二掌握引导神经干复合动作电位和测定其传导速度的基本原理。 二相关知识 (一)兴奋及兴奋性的概念 (二)动作电位的潜伏期、动作电位时程和幅值 1、动作电位:各种可兴奋细胞在受到刺激而兴奋时,可以在细胞膜静息电位的基础上发生一次短暂的,可向周围扩布的电位波动。这种电位波动称为动作电位。 (三)、动作电位的传导 局部电流的形式 (一)、细胞外记录 1 (二)、神经干的动作电位 神经干是由许多粗细不等的有髓和无髓神经纤维组成的混合神经,故神经干动作电位与单根神经纤维的动作电位不同,它是由许多神经纤维的动作电位合成的一种复合电位。 四实验原理 (一)、单根神经纤维动作电位的引导及其传导 1、记录出了一个先升后降的双相动作电位的原理
当神经纤维未受刺激时,膜外与电极所接触的两点之间没有电位差,所以两电极之间也无电位差存在,扫描线为一水平基线。 在神经干左端给予电刺激后,则产生一个向右传导的冲动(负电位),当冲动传到1电极(负电极)下方时,此处电位较2处为低,产生了电位差,扫描线向上偏转,记录出一个向上的波形(在电生理实验中,为了便于观察,习惯上规定负波向上)。随后,冲动继续向右侧传导,离开1电极传向2电极处。当它到达2电极(正电极)下方时,因1电极处神经差不多已恢复到原来的状态,于是2电极处又较1电极处为负,引起扫描线向下偏转,记录出一个向下的波形。这样,在神经冲动向右传导的过程中,就记录出了一个先升后降的双相动作电位。 负电极在前时,它首先记录到神经干表面由正变负的电位变化,经历了由正到负再到正的过程,因此记录出动作电位 2 的上相。当在后的正电极记录到这种同样的电位变化过程时,显示相反的情况,记录出动作电位的下相。如果互换正、负电极的位置,则记录到先降后升的双相动作电位。 C.A点神经纤维多于B点(次要原因)。 (二)、神经干动作电位的引导及其传导 五实验步骤 (一)、制备蛙类坐骨神经-胫腓神经标本 通过观看录象让学生学习制作方法 (二)、连接实验装置 注意电极的安装,正负不要接反。 (三)、实验参数设置: (四)、实验观察、记录和测量
课程名称:动物生理学实验 实验项目:实验二神经干复合动作电位的记录和观察 [目的] 1、学习电生理学实验方法。 2、观察蛙坐骨神经干复合动作电位的波形,并了解其产生原理。 3、测量神经干动作电位产生的阈强度和顶强度。 [原理] 1、两栖类一些基本的生命活动和生理功能与温血动物类似,而离体组织器官所需的生活条件比较简单,并且易于控制和掌握,因此在生理实验中常用两栖类离体组织器官作为实验标本。 2、神经干在受到有效刺激后,可以产生动作电位,标志着神经发生兴奋。如果在神经干另一端引导传来的兴奋冲动,可以引导出双相的动作电位,如在两个引导电极之间将神经麻醉或损坏,则引导出的动作电位即为单相动作电位。 3、神经细胞的动作电位是以“全或无”方式发生的。坐骨神经干是由很多不同类型的神经纤维组成的,所以,神经干的动作电位是复合动作电位。复合动作电位的幅值在一定刺激强度下是随着刺激强度的变化而变化的。 [实验材料]蛙常用手术器械蛙板任氏液培养皿烧杯神经屏蔽盒Medlab生物信号采集系统 [实验流程] 神经干标本制备→仪器联接和调试→测定参数→测定神经干的刺激阈值→观察记录双相动作电位→观察记录单相动作电位 [实验步骤] 一、蛙坐骨神经干标本制备 1.毁脑、脊髓。 2.去躯干上部及内脏和皮肤将前半躯干、皮肤和内脏一并拉剥弃之,仅保留一段腰背部脊柱及两后肢,并将其放入盛有任氏液的培养皿中。 3.洗净手和所用过的用具,以防沾染标本。 4.平分标本沿脊柱正中线至耻骨联合中央将标本分为两半。放入任氏液中。 5.游离坐骨神经任取一标本,用玻璃分针游离坐骨神经腹腔段。然后换至背侧向上,持玻璃分针沿坐骨神经沟(股二头肌及半膜肌肌间沟)小心分离坐骨神经大腿段,用剪刀剪去神经干上各细小分支(切忌撕扯)。坐骨神经下行至腘窝处分为两支:内侧为胫神经,走行表浅;外侧为腓神经。沿胫、腓神经走向分离至踝部,尽量将神经干标本剥离长一些,要求上自脊神经发出部位,下沿腓神经与胫神经一直分离到踝关节附近,剪断侧支。尽量将神经干周围的组织剔除干净(剥离时切勿损伤神经干),结扎坐骨神经干的脊柱端及胫、腓神经的足端,游离神经干。 6、将坐骨神经干标本浸入任氏液中5分钟,以稳定其兴奋性。 二、仪器联接和调试 打开Medlab生物信号采集系统软件,选通道1作为记录信号的通道, 选通道4用于刺激信号的监视通道(应用Q9三通将刺激输出分成两路,一路用于刺激标本,一路输入4通道)并用高阻抗导线将通道输入口与神经屏蔽盒的引导电极相连,用刺激导线将Medlab的刺激信号输出口与神经屏蔽盒的刺激电极相连。将神经屏蔽盒内所有电极用浸有任氏液的棉球擦净。用镊子夹住已制备好的神经标本的一端,将其放置于电极上(脊椎端位于刺激电极
姓名张曦学院生命科学学院班级生科10.2班组别周五4组科目动物学大实验题目神经干复合动作电位的波形观察及其传导速度的测定专业动物科学 微生物实验报告1 一、【实验材料】 蟾蜍(frog);蛙类手术器械一套(毁髓针1根,手术剪、金冠剪各1把,圆头镊子、眼科镊子各1把,玻璃分针2根),蛙板1块,培养皿,滴管,废物缸、锌铜弓,丝线,棉花;任氏液;电脑,信号采集处理系统,张力传感器;神经屏蔽盒。 二、【目的要求】 1.观察蟾蜍坐骨神经干复合电位的基本波形,并了解其产生的基本原理。 2.学习测定蟾蜍离体神经干上神经冲动传导速度的方法和原理。 3.了解骨骼肌的收缩过程。 三、【基本原理】 可兴奋组织(神经、肌肉和腺体)在接受刺激后产生兴奋的能力称为兴奋性。当组织兴奋时,由于膜电位发生了一系列的变化,它的兴奋性也发生相应的变化,分为绝对不应期、相对不应期、超常期和低常期。调节双脉冲刺激之间的间距,可对其不应期进行测定。神经兴奋的标志是产生动作电位,其传播速度与神经纤维的粗细、有无髓鞘及环境温度等因素有关,通过测量神经冲动经过的路程和所需要的时间,可知兴奋传导速度的快慢。 四、【操作步骤】 1.制备坐骨神经干标本 制备方法与第一次实验相同,标本制备好后放置于盛有任氏液的小烧杯中备用。 2.连接实验装置 将Pclab生物信号采集处理系统和神经标本屏蔽盒连接好,将标本置于神经标本屏蔽盒内的电极上,盖好盒盖。 3.仪器调试 打开计算机,进入Pclab生物信号采集处理系统操作界面,点击实验项目→设置采样窗各项参数→设置各项刺激参数→确定。 4.观察项目 (1) 观察神经干复合动作电位:选择主周期刺激,并逐步调节双刺激的间隔,可观察神经干的不应期。 (2) 测定传导速度:用两个通道同时记录时,可较准确的测定动作电位传导的速度。 (3) 通过相应的按键完成测量、存盘、打印等操作。 五、【实验结果】
神经干动作电位的引导、传导速度和兴奋不应期的测定一、实验结果: 动作电位的引导: 动作电位的传导速度: 兴奋不应期的测定:
二、数据处理: 1.电位的引导: 潜伏期:0.6ms 时程:1.9ms 幅值:9.30mv 2.传导速度(潜峰法): 两个动作电位波峰间的时间差(t2-t1):12.24ms 两对引导电极间的距离(s2-s1):2.5cm V=(s2-s1)/(v2-v1)=2.5/12.24(cm/ms)≈2.04m/s 3.兴奋不应期时间: 由图可知: 绝对不应期:1.25ms 有效不应期:3.80ms 相对不应期=有效不应期-绝对不应期=(3.80-1.25)ms=2.55ms 三、实验结论: 1.引导的动作电位的潜伏期为0.6ms,时程为1.9ms幅值为9.30mv。 2.神经干动作电位的传导速度为2.04m/s。 3.神经干动作电位的有效不应期时间为3.80ms,其中绝对不应期时间为1.25ms,相对不应期时间为2.55ms。 四、实验讨论: 1.为什么这次实验动作电位的引导的动作电位是双相的? 答:当膜在外正内负的极化状态下爆发动作电位时,兴奋膜上的动作
电位呈现外负内正的去极化状态,这样兴奋部位和邻近静息电位产生了电位差。当兴奋传到第一根引导电极的时候膜外为负电位,相应第二根引导电极处膜电位为正,此时两根引导电极之间产生了一个正电位差,经过放大器放大,出现一个正的动作电位;当兴奋传到第二根引导电极时,膜外电位为负,第一根电极膜处电位恢复到0,此时产生了一个负的电位差,同理产生了一个负的动作电位,故为双相动作电位。 2.动作电位在传导过程中无衰减现象的意义? 答:为了保证信息的完整性。 3.通常所记录的双相动作电位的第一相和第二相何以在波形、幅值上不对称?在什么情况下可以记录到对称的双相动作电位? 答:(1)由于神经干由各种神经纤维混合而成,在一对引导电极下的神经纤维的数量和种类均不同,当产生动作电位时每一引导电极下参与动作电位的形成的数量及总类也均不同,故第一相和第二相在波形、幅值上不对称。 (2)①当两根引导电极相隔足够近时,上述影响因素可忽略不计 ②当第一和第二根引导电极下参与动作电位的形成的神经纤维 的数量及种类相同时;当第一和第二根引导电极下参与动作电位的形成的神经纤维的数量及种类产生的动作电位的总和相同时。 4.就单根细胞或单纤维而言,动作电位的产生是“全”和“无”的,为什么在坐骨神经干上,在阈刺激和最大刺激之间所引起的动作电位