
为你成材 尽我所能 - 37 - 师生同心 金石为开
已知:
1、 如何鉴别1-丙醇与2-丙醇。
2、 分子式为C 5H 12O 的醇,其中能被氧化为醛的结构是哪几种?能被氧化为酮的是哪几种?不能被氧化的是哪几种?
3、分子式为C 4H 8的烃可以发生如图转化:
其中E 、F 均呈酸性。 写出下列物质的结构简式: C 4H 8: C :
D :
E :
F :
C 4H 8
R —CH 2OH R —CHO ; 氧化 R’
R
CH —OH 氧化
R ——R ’
O
(酮); 则很难被氧化(R 、R ’、R ’’表示烃基)。
R —C —OH R ’ R ’’
为你成材 尽我所能 - 38 - 师生同心 金石为开
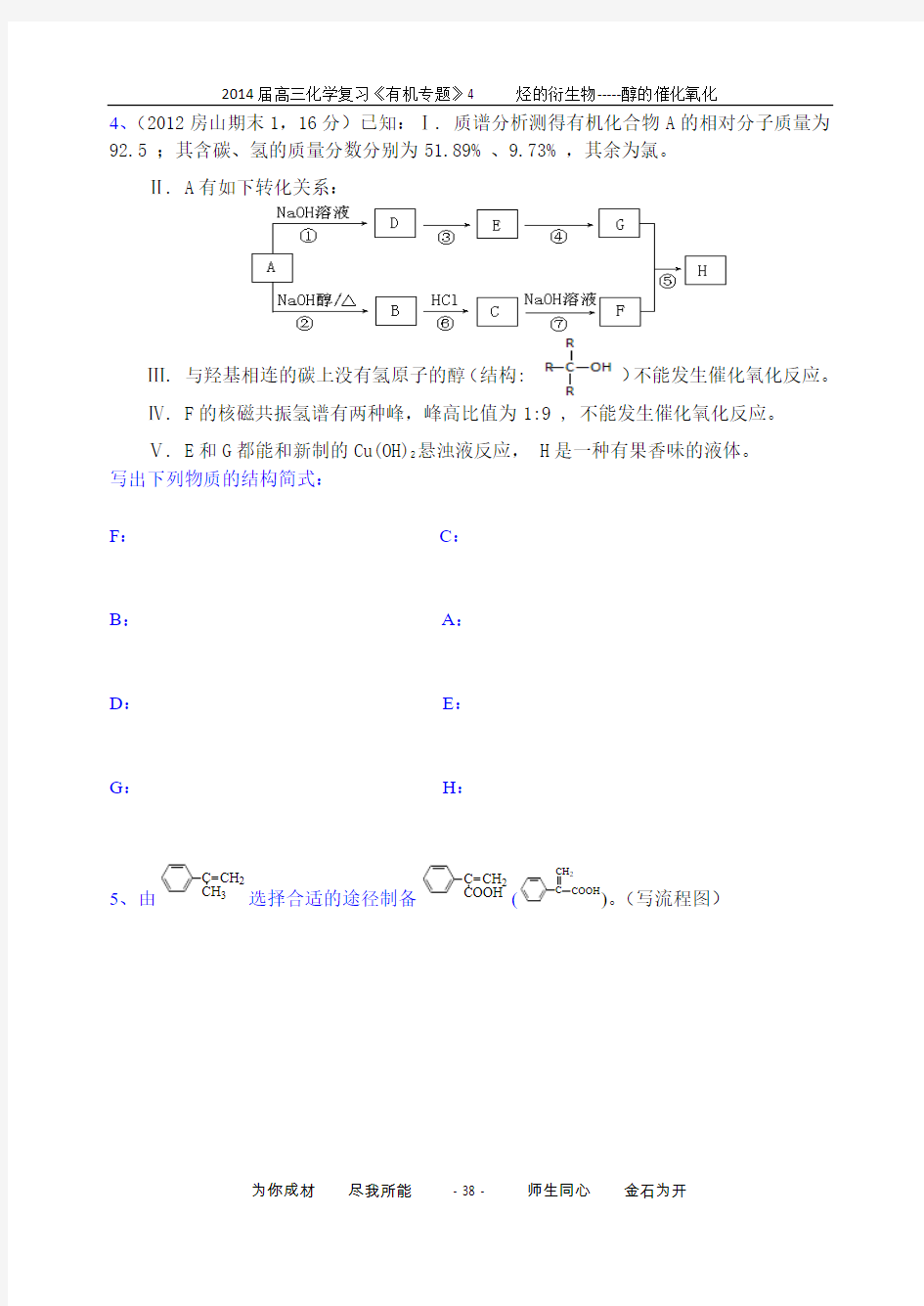
4、(2012房山期末1,16分)已知:Ⅰ. 质谱分析测得有机化合物A 的相对分子质量为92.5 ;其含碳、氢的质量分数分别为51.89% 、9.73% ,其余为氯。
Ⅱ. A 有如下转化关系:
Ⅲ. 与羟基相连的碳上没有氢原子的醇(结构: )不能发生催化氧化反应。 Ⅳ. F 的核磁共振氢谱有两种峰,峰高比值为1:9 , 不能发生催化氧化反应。 Ⅴ. E 和G 都能和新制的Cu(OH)2悬浊液反应, H 是一种有果香味的液体。 写出下列物质的结构简式:
F : C :
B : A :
D :
E :
G : H : 5、由选择合适的途径制备
(
C COOH
CH 2
)。(写流程图)
C=CH 3
CH 2
CH 2C=COOH
为你成材 尽我所能 - 39 - 师生同心 金石为开
6. (11东城期末)23.(14分)上海世博会英国馆――种子圣殿,由六万多根透明的亚克力[其分子式是(C 5H 8O 2)n ]杆构建而成。某同学从提供的原料库中选择一种原料X ,设计合成高分子亚克力的路线如下图所示:
原料库: a 、CH 2=CHCH 3 b 、CH 2=CHCH 2CH 3 c 、CH 2=CCH 3 , d 、CH 2CHCH 3
已知:① (不易被氧化成羧酸)
②
不易被氧化成醛或酮
③
(R 、R ’、R ’’表示烃基)
写出下列物质的结构简式:
X : A :
B :
C :
D :
E :
F : 亚克力:
R ——R ’(H) O HCN
R ——R ’(H)
OH CN
H +
/H 2O
R ——R ’(H)
OH COOH
’’ R —C —R ’ OH
R ——R ’ O
R ——R ’
OH
[O]
CH 3
CH 3
铂催化醇类的分子氧氧化 2016-08-24 12:58来源:内江洛伯尔材料科技有限公司作者:研发部 铂炭催化剂样品 金属Pt 能催化醇类的分子氧氧化反应发现于1855年。1995年, Zhou等首次报道了scCO2中Pt 金属催化的醇类分子氧氧化反应,他们研究了乙醇在Pt/TiO2催化剂上的氧化效果,发现乙醛的收率较低只有15 % —23 % ,主要原因在于乙醛的过度氧化难以抑制。 尽管对于醇类的分子氧氧化反应,铂的催化活性不如钯,但改进铂催化活性的研究却一直在进行。2001年, Steele等探讨了scCO2中石墨负载Pt 催化剂( Pt/C)对9-蒽基甲醇、正癸醇和对二苯基乙二醇的分子氧氧化的催化作用,研究表明负载Pt/C催化剂经氟化改性后具有较好的活性。在338 K、氧气分压5 MPa 、scCO2压力15MPa 条件下,添加1 %聚四氟乙烯氟化的Pt/C催化剂对9-蒽基甲醇氧化为相应醛的选择性大于99 % ,转化率达到96 %;未氟化的Pt/C 催化剂选择性虽大于99 % ,转化率只有45 % ,而相同条件的水溶剂体系中,转化率虽达到100 % ,但选择性只有65 %。由此表明清洁溶剂scCO2相对于水溶剂的优势。氟化的催化剂表面可以疏远水分,从而减少了形成羧酸的过度氧化反应。 2004 年,Tsang等进一步探讨了F添加量对Pt/C催化剂催化活性的影响,结果表明当 F/PC质量比为0.071 时,9-蒽基甲醇的氧化转化率最高。试验还研究了邻二苯基乙二醇的氧化反应,氧化产品的选择性不是很好,产品分布强烈依赖于温度和scCO2的压力。Gaser等也探讨了10—19 MPa 及40℃的scCO2中石墨负载5 %Pt/C 催化剂对1-丙醇和2-丙醇的氧化催化反
催化氧化反应新进展综述 (常熟理工学院化学与材料工程学院,江苏常熟215500) 摘要:本文主要总结了烯烃、烷烃、醇等在催化剂存在的条件下发生催化反应的新进展。 关键字:催化氧化;催化剂;烷烃;烯烃;醇 物质失去电子的反应叫氧化反应。在有机反应中,把有机物引入氧或脱去氢的反应叫做氧化反应。催化氧化反应是指在一定的压力和一定的温度条件下,在以金属材料(如Pt、Pd、Ni等)或非金属材料为催化剂的情况下,与空气、氧气、臭氧等氧化剂进行反应的氧化反应。 催化剂是指一种能够与反应物相互作用,改变反应速率而不改变反应标准自由焓,反应结束时本身依旧保持不变的物质。我们通常把加速化学反应速率的催化剂叫正催化剂,延缓化学反应速率的物质叫负催化剂。催化剂具有专一性和高效性,即不同催化剂对特定的反应体系具有选择性(机理选择性)和加速反应趋于平衡而不改变平衡位置的性能。 1 稀烃催化氧化 1.1 气固相催化 Leals[1]等开发研究双金属催化剂体系,将u-过五氰合钴(Ⅲ)五氰合水合氧化钼(Ⅵ)双(三苯基磷)亚铵盐负载到的硅胶上,在170℃时催化环己烯和氧气进行环氧化反应, 反应产物是氧化环基烯和环己酮,环己烯的选择性最高可以达到58%。 1.2 液相催化 Lunsford等将负载钼的沸石催化剂和钴离子交换后得到的沸石或氢型沸石催化剂催化环己烯的液相反应,环己烯的转化率可以达到50%时,生成环氧化物的选择性可达到50% [2]。此外,Mo-Mn氧化物、过渡金属硼酸盐、重金属络合物也可以作为烯烃液相环氧化的催化剂。 1.3 模拟酶催化 Tabushi[3]最先用锰卟啉络合物-氧化-还原体系来进行环已烯的氧化反应,生
已知: 1、 如何鉴别1-丙醇与2-丙醇。 2、 分子式为C 5H 12O 的醇,其中能被氧化为醛的结构是哪几种?能被氧化为酮的是哪几种?不能被氧化的是哪几种? 3、分子式为C 4H 8的烃可以发生如图转化: 其中E 、F 均呈酸性。 写出下列物质的结构简式: C 4H 8: C : D : E : F : C 4H 8 R —CH 2OH R —CHO ; 氧化 R’ R CH —OH 氧化 R —C —R ’ O (酮); 则很难被氧化(R 、R ’、R ’’表示烃基)。 R —C —OH R ’ R ’’
4、(2012房山期末1,16分)已知:Ⅰ. 质谱分析测得有机化合物A的相对分子质量为92.5 ;其含碳、氢的质量分数分别为51.89% 、9.73% ,其余为氯。 Ⅱ. A有如下转化关系: Ⅲ. 与羟基相连的碳上没有氢原子的醇(结构: )不能发生催化氧化反应。 Ⅳ. F的核磁共振氢谱有两种峰,峰高比值为1:9 , 不能发生催化氧化反应。 Ⅴ. E和G都能和新制的Cu(OH)2悬浊液反应, H是一种有果香味的液体。 写出下列物质的结构简式: F:C: B:A: D:E: G:H: 5、由C= CH3 CH2 选择合适的途径制备 CH2 C= COOH(C COOH CH2 )。(写流程图) 6. (11东城期末)23.(14分)上海世博会英国馆――种子圣殿,由六万多根透明的亚克力[其
分子式是(C 5H 8O 2)n ]杆构建而成。某同学从提供的原料库中选择一种原料X ,设计合成高分子亚克力的路线如下图所示: 原料库: a 、CH 2=CHCH 3 b 、CH 2=CHCH 2CH 3 c 、CH 2=CCH 3 , d 、CH 2CHCH 3 已知:① (不易被氧化成羧酸) ② 不易被氧化成醛或酮 ③ (R 、R ’、R ’’表示烃基) 写出下列物质的结构简式: X : A : B : C : D : E : F : 亚克力: R —C —R ’(H) O HCN R —C —R ’(H) OH H +/H 2O R —C —R ’(H) OH R ’’ R —C —R ’ OH R —C —R ’ O R —CH —R ’ OH [O] CH 3 CH 3
化学试剂,2005,27(8),459~463;499 专论与综述 催化分子氧氧化醇类的研究进展 李长辉3,李容,郑国钧,赵秀芳 (中国医学科学院中国协和医科大学药物研究所,北京 100050) 摘要:综述了用氧气或空气(分子氧)作为化学计量氧化剂,在催化剂作用下氧化醇类的研究进展,并对某些代表性的催化氧化反应的特点和选择性进行了讨论。 关键词:醇;催化氧化;分子氧;氧气;空气;均相催化;非均相催化 中图分类号:T Q224;O643.322 文献标识码:A 文章编号:025823283(2005)0820459205 收稿日期:2004210213作者简介:李长辉(19752),男,四川泸州人,硕士,实习研究员,主要研究方向为生物活性天然产物的全合成。 醇的氧化是有机合成和工业生产中制备羰基化合物的重要方法,应用化学剂量的氧化剂对醇进行氧化的方法沿用已久,所用的氧化剂包括无 机过渡金属氧化物和盐类,以及一些金属配合物等[1]。使用化学计量氧化剂的方法至今仍然在有机合成领域广泛应用,并在许多方面取得不小进步,但是从经济学以及环境学方面考虑,迫切需要使用氧气、空气等环保、清洁、符合原子经济性的氧化剂,在此过程中,除目标产物外,水为惟一副产物。 R R ′ OH 催化剂O 2(或空气) R R ′ O +H 2O 其中:R ,R ′=烷基,芳基或H 本文分均相催化氧化和非均相催化氧化两大 类,概要的介绍这一领域的最新进展,并对某些催化氧化反应的特点和选择性进行讨论。1 均相催化氧化 由于反应物和催化剂存在于同一相中,均相 催化体现出活性高、选择性好等优点。111 金属/TE MPO 催化体系 氮氧自由基类作为比较成熟的氧化剂(或催化剂),无论在实验室还是工业生产中,都已广泛地用于醇的氧化,2,2,6,62四甲基哌啶2N 2氧化物(TE MPO )是其中最重要的一个。TE MPO (1)是一个氮氧自由基,本身的氧化作用并不强,但其分解产物中的氮氧正离子(2)却是强的氧化剂,可以氧化各种醇成相应的羰基化合物,而自身被还原成为氮羟基化合物(3),继而重新被氧化成自由基形态。 自1984年Semmelhack 等 [2] 首次报道CuCl/ TE MPO 体系催化氧气进行伯醇的氧化以来,这一 体系在近年来取得许多进展。最近,Sheldon 等[3] 报道[Cu (Ⅱ)2(2,2′2二吡啶)]/TE MPO 体系以碱作为共催化剂,在室温下催化氧气将伯醇选择性地氧化成醛,对仲醇没有影响。Marko 等[4]也报 道了CuCl/1,102菲咯啉/二叔丁基胺二乙酸盐在温和条件下催化伯醇的选择性氧化取得很好效果。 TE MPO 催化氧化历程 研究发现,用其他金属化合物替代CuCl ,可 以取得更好的效果,Sheldon 等[5]使用Ru (PPh 3)32Cl 2/TE MPO 体系,顺利地催化活泼和不活泼的醇 高选择性(>99%)地氧化成相应的醛酮。使用12辛醇和22辛醇进行竞争实验表明,对伯醇的选择性高于仲醇(混合反应,二者的转化率分别为80%和10%)。其缺点是较高的氧气压力(1MPa ),反应温度(100℃)及三苯基膦配体自身的热不稳定性。此外,底物中的S ,N ,O 等原子会与Ru 离子配合而导致催化剂失活。Minisci 等[6]报 道了双金属的Mn (Ⅱ )2C o (Ⅱ)/TE MPO 体系,近室温条件高收率(>95%)地催化了一系列苄醇、脂肪伯醇和仲醇的氧化。此反应以醋酸作为溶剂,需使用大量价格昂贵的TE MPO (>10m ol %)。 112 Pd (Ⅱ )类催化剂9 54第27卷第8期李长辉等:催化分子氧氧化醇类的研究进展
选择性催化还原法(SCR)烟气脱硝技术概述 王清栋 (能源与动力工程1302班1306030217) 摘要:对选择性催化还原脱硝技术进行概述,分析了其机理,并简要介绍催化剂的种类及钝化与中毒机理.最后,对SCR技术进行总结与展望. 关键词:选择性催化还原;烟气脱硝;氮氧化物 Overview of Selective catalytic reduction (SCR) flue gas denitration Wang Qingdong (Power and Energy Engineering, class 1302 1306030217) Abstract: selective catalyst reduction flue gas denitration is reviewed. Its mechanism is analysed and catalyst is given a brief introduction. Catalyst passivation and poisoning mechanism is analysed. Finally, the summary and prospect of the technology are given. Keywords: SCR; NO x; flue gas denitration. 1.前言 氮氧化物是造成酸雨的主要酸性物质之一,是形成区域微细颗粒物污染和灰霾的主要原因,也是形成光化学烟雾的主要污染物,会引起多种呼吸道疾病,是“十二五”期间重点控制的空气污染物之一.2011年初通过的“十二五”规划纲要,要求NO x减少 10%,从而使NO x成为我国下一阶段污染减排的重点.烟气脱硝技术与NO的氧化、还原及吸附特性有关.根据反应介质状态的不同,分为干法脱硝和湿法脱硝.目前,已经在火力发电厂采用的烟气脱氮技术主要是选择性催化还原(SCR)和选择性非催化还原 (SNCR),其中采用最多的主流工艺是选择性催化还原法. 2.SCR反应原理 选择性催化还原脱氮是在一定温度和有催化剂存在的情况下,利用还原剂把烟气中的NO x还原为无毒无污染的N2和H2O.这一原理与1957年在美国发现,该工艺最早却在20世纪70年代的日本发展起来的. SCR 原理图如图一所示 氨气被稀释到空气或者蒸汽中,然后注入到烟气中脱硝,在催化剂表面,氨与NO x 生成氨气和水.SCR过程中的主要反应如下: 4NO+4NH3+O24N2+6H2O 基于V2O5的催化剂在有氧的条件下还对NO2的减少有催化作用,其反应式为 2NO2+4NH3+O23N2+6H2O
第七节选择性催化氧化 一、烃类晶格氧选择性催化氧化概念 烃类的选择性催化氧化,在工业上一般以氧气或空气为氧化剂,催化剂多为可变价过渡金属复合氧化物。就反应机理而言,大多符合Redox机理,它包括两个主要的过程:①气相的烃分子与高价态金属氧化物催化剂表面上的晶格氧(或吸附氧)作用,烃分子被氧化为目的产物,晶格氧参与反应后,催化剂的金属氧化物被还原为较低价态;②气相氧将低价金属氧化物氧化到初始高价态,补充晶格氧,完成Redox循环。按Mars和Van Krevenlen提出的Redox模型,选择氧化反应: C n H m+O2→C n H m-2+H2O (1) 可写成两个基元反应: C n H m+2OM→C n H m -2O+H2O+2M (2) 2M+O2→2OM (3)式中,M——低价态的活性位; OM——有晶格氧的活性位。 但是总反应(1)的速率,实际上是受两个基元反应(2)和(3)中速率较慢的反应所控制。在通常情况下,催化剂被烃分子还原的反应(2)是慢步骤。烃类催化氧化反应动力学的研究结果表明,副反应对氧气的反应级数比主反应对氧气的反应级数高,所以提高氧分压通常不能有效增加反应(1)的速率,反而会导致选择性下降。这是因为提高气相氧分压,一方面会增加与气相氧出于平衡的可逆吸附氧物种(如O2-、O22-、或O-)的表面浓度,这种高活性的可逆吸附氧物种,一般认为主要参与非选择性氧化反应;另一方面对于高温(>900K)的烃类氧化过程表面催化反应外,还伴随有气相自由基反应发生,气相氧的存在也会加快气相深度氧化反应,导致选择性下降。 为了避免气相氧对烃类分子的深度氧化,提高目的产物的选择性,人们在不断改进催化剂性能的同时,尝试了采用催化剂晶格氧作为氧源的反应新工艺。该工艺按Redox 模型将烃分子与氧气或空气分开进行反应,以便从根本上排除气相深度氧化反应。目前有两种反应工艺可用于烃类晶格氧选择氧化,一种是膜反应器,另一种是循环流化床。(1)膜反应器 对烃类选择氧化而言,所用的催化膜通常由具有氧离子/电子导体性能和催化活性的金属氧化物材料制得。其反应机制如下图所示,烃分子与催化膜左侧的晶格氧反应生成
为你成材 尽我所能 - 37 - 师生同心 金石为开 已知: 1、 如何鉴别1-丙醇与2-丙醇。 2、 分子式为C 5H 12O 的醇,其中能被氧化为醛的结构是哪几种?能被氧化为酮的是哪几种?不能被氧化的是哪几种? 3、分子式为C 4H 8的烃可以发生如图转化: 其中E 、F 均呈酸性。 写出下列物质的结构简式: C 4H 8: C : D : E : F : C 4H 8 R —CH 2OH R —CHO ; 氧化 R’ R CH —OH 氧化 R ——R ’ O (酮); 则很难被氧化(R 、R ’、R ’’表示烃基)。 R —C —OH R ’ R ’’
为你成材 尽我所能 - 38 - 师生同心 金石为开 4、(2012房山期末1,16分)已知:Ⅰ. 质谱分析测得有机化合物A 的相对分子质量为92.5 ;其含碳、氢的质量分数分别为51.89% 、9.73% ,其余为氯。 Ⅱ. A 有如下转化关系: Ⅲ. 与羟基相连的碳上没有氢原子的醇(结构: )不能发生催化氧化反应。 Ⅳ. F 的核磁共振氢谱有两种峰,峰高比值为1:9 , 不能发生催化氧化反应。 Ⅴ. E 和G 都能和新制的Cu(OH)2悬浊液反应, H 是一种有果香味的液体。 写出下列物质的结构简式: F : C : B : A : D : E : G : H : 5、由选择合适的途径制备 ( C COOH CH 2 )。(写流程图) C=CH 3 CH 2 CH 2C=COOH
为你成材 尽我所能 - 39 - 师生同心 金石为开 6. (11东城期末)23.(14分)上海世博会英国馆――种子圣殿,由六万多根透明的亚克力[其分子式是(C 5H 8O 2)n ]杆构建而成。某同学从提供的原料库中选择一种原料X ,设计合成高分子亚克力的路线如下图所示: 原料库: a 、CH 2=CHCH 3 b 、CH 2=CHCH 2CH 3 c 、CH 2=CCH 3 , d 、CH 2CHCH 3 已知:① (不易被氧化成羧酸) ② 不易被氧化成醛或酮 ③ (R 、R ’、R ’’表示烃基) 写出下列物质的结构简式: X : A : B : C : D : E : F : 亚克力: R ——R ’(H) O HCN R ——R ’(H) OH CN H + /H 2O R ——R ’(H) OH COOH ’’ R —C —R ’ OH R ——R ’ O R ——R ’ OH [O] CH 3 CH 3
甲醇电催化氧化可能的机理及研究进展 甲醇在电极上氧化为 CO2需要传输 6 个电子,但是 6 个电子同时传递是不太可能的。部分电子的传输导致一系列稳定的、可溶的中间产物的形成也是不太可能的。很明显,在铂电极催化剂表面上一定有表面吸附物质,正是这些物质抑制了催化剂的活性。关于甲醇氧化反应的机理研究,在不同的电解质中可能不同。一般认为在酸性电解质中,甲醇在 Pt 电极上的氧化机理为[i],[ii]: 2Pt + CH3OH → Pt-CH2OH + Pt-H ( 1-4) 2Pt + Pt-CH2OH → Pt2-CHOH + Pt-H (1-5) 2Pt + Pt2-CHOH → Pt3-COH + Pt-H (1-6) Pt-H → Pt + H+ +e- (1-7) Pt3-COH → Pt2-C=O + H+Pt + e-→ Pt-C≡O + Pt (1-8) 可以看出甲醇首先吸附在 Pt 的表面,同时脱去氢,反应速度由大到小依次为是(1-6),(1-5),(1-4)。Pt3-COH 是主要的吸附物质,即甲醇氧化的中间体,(1-7)反应极快,但在缺少活性氧时,(1-8)占主导地位。从上述方程式中不难看出,要保证催化剂不被毒化,就必须尽量避免反应(1-8)的发生,而只有电极表面含有大量含氧物种时,氧化反应才能发生。活性含氧物种通过如下反应发生: M + H2O → M-OHads + H+ + e- (1-9) 其中 M 可以是 Pt 或其它金属,如 Ru,Sn 等,对于 Pt 来说,Pt-OH ads很难在低电位时大量产生,不能有效阻止中毒现象的发生,因此往往引入其它金属,使得在较低电位下就能够生成大量的含氧物种,促进氧化发应的发生。活性含氧物种与甲醇吸附中间体之间的反应如下: Pt-CH2OH + M-OH ads→ HCHO + Pt + M + H2O (1-10) Pt2-CHOH + M-OH ads→ HCOOH + 2Pt + M + H2O (1-11) Pt3-COH + M-OH ads→ CO2+ 3Pt + M + 2H++ 2e- (1-12) 在阳极上甲醇氧化的总反应为:CH3OH + H2O → CO2↑ + 6H++ 6e- (1-13) 分析这些反应表明,甲醇氧化是一个涉及多步脱氢的复杂过程,只有在电极表面生成大量含氧物种,甲醇才能完全氧化生成 CO2。同时,对于实用的直接甲醇燃料电池在降低催化剂中毒的同时还要避免反应(1-8)的发生,保证甲醇完全氧化生成 CO2。 目前对甲醇电化学氧化的机理在某些方面还存在争议。其中一个主要争议是:甲醇在Pt电极上的氧化究竟是通过平行反应路径 (在平行路径中,CO是作为一个副产物形成,甲醇被直接氧化成CO2) 还是通过连续反应路径进行。Wang等人[iii]采用双薄层电解池与质谱结合定量测定了甲醇氧化中间产物,认为两种路径同时存在,即一个路径是通过吸附CO进行,另一个路径是通过溶解中间物 (甲醛和甲酸) 进行,这
醇类电催化氧化催化剂的研究进展 摘要:直接醇类燃料电池(DAFC)是以小分子醇类为燃料、直接将化学能转化为电能的装置。它具有能量转化效率高、燃料来源丰富、储运方便、成本低廉等优点,是理想的便携式电源。为提高碱性介质中多壁碳纳米管(MWCNT)负载 Pd 基催化剂对醇类电氧化反应的催化活性及抗中毒能力,本文采用乙二醇还原法制备了Pd/MWCNT 催化剂,并引入过渡金属进行改性,制备了 PdM/MWCNT(M = Ni、Mo、Ce)二元催化剂。采用透射电子显微镜(TEM)、X-射线光电谱(XPS)及差热分析(DTA)等手段对催化剂的形貌、组成及结构进行表征。以循环伏安法(CV)、线性扫描伏安法(LSV)、电化学阻抗谱(EIS)及计时电流法(CA)等电化学方法考察了催化剂在醇类电氧化反应中的催化活性及抗中毒能力。主要研究结果如下: (1)采用乙二醇还原法制备了 Pd/MWCNT 催化剂与 PdNi/MWCNT 催化剂,结果表明添加 Ni 后的催化剂在载体表面分散更均匀,平均粒径为 2.34nm。PdNi/MWCNT 催化剂中 Ni 主要以 Ni(OH)2和 NiOOH 形式存在,在碱性溶液中对甲醇的电催化氧化表现出较高的活性。 (2)通过 PdM/MWCNT(M=Mo、Ce)催化剂的优化实验,发现 Mo、Ce 纳米粒子的添加有助于提高催化剂的催化能力,且当 Pd:Mo=1:0.2、Pd:Ce=1:0.1 时,350℃焙烧制得的 PdMo/MWCNT、PdCe/MWCNT 催化剂分别对甲醇、乙醇的电催化氧化活性较为突出,抗 CO 中毒能力较强。 (3)通过对助催化剂钼、铈化合物的焙烧,发现随着温度的升高,金属氧化物的生成量增多,能为催化剂提供较丰富的含氧物种,促进中间产物的继续氧化,从而提高催化剂的抗中毒能力;但焙烧温度过高,会引起催化剂的导电能力下降,甚至破坏碳纳米管载体的结构,使催化剂失效。 Abstrac t: the direct alcohol fuel cell (DAFC) is a device which can convert chemical energy into electrical energy by the small molecule alcohol as fuel.. It has the advantages of high energy conversion efficiency, rich fuel source, convenient transportation, low cost, etc., is the ideal portable power source. In order to improve the alkaline medium multi
化学乙醇催化氧化实验https://www.doczj.com/doc/6715764670.html,work Information Technology Company.2020YEAR
某实验小组用下列装置进行乙醇催化氧化的实验。 (1)实验过程中铜网出现黑色和红色交替的现象,请写出相应的化学方程式、。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应 是反应。(填吸热或放热) (2)甲和乙两个水浴作用不相同.甲的作用是;乙的作用是。 (3)反应进行一段时间后,试管a中收集到的主要有机生成物是。(写名称)若要检验试管a中能收集的该物质,进行的操作为。 (4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有。(写结构简式) 要除去该物质,可向混合液中加入(填写序号)。再通 过(填试验操作名称)即可除去。 A.水B.苯C.碳酸氢钠溶 液 D.四氯化碳
(1)Cu+O 22CuO、CH3CH2OH+CuO CH3CHO+Cu+H2O;放热; (2)加热乙醇,便于乙醇的挥发;冷却,便于乙醛的收集;(3)乙醛;加入新制的氢氧化铜悬浊液,加热煮沸若有砖红色沉淀,证明产物是乙醛;(4)CH3COOH;C;蒸馏。 试题分析:(1)在加热Cu丝时发生反应Cu+O22CuO。当把热的Cu丝遇到乙醇蒸气时发生反应: CH 3CH2OH+CuO CH3CHO+Cu+H2O。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是放热反应,反应放出的热量就足够后面发生反应需要消耗的能量。(2)甲的水浴加热作用是产生乙醇蒸气,便于乙醇的挥发;而乙用的是冷水浴。目的是冷却降温,便于乙醛的收集。(3)由(1)的反应方程式可知:反应进行一段时间后,试管a中收集到的主要有机生成物是乙醛。若要检验试管a中能收集的该物质,可以利用醛基的性质进行的操作是加入新制的氢氧化铜悬浊液,加热煮沸若有砖红色沉淀产生,证明产物是乙醛;(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有酸性物质。在该该反应中产生的酸性物质只有乙酸CH3COOH。为除去乙酸。可以利用乙酸不同与乙醛的性质:有酸性,而且酸性比碳酸强,乙酸能跟碳酸盐发生反应消耗,同时生成的碳酸不温度,会分解,以
乙醇的催化氧化 一、选题来源 高一第二学期(上海教育出版社)p43.酒精的催化氧化。教材上是这样做的这个实验: “把铜丝烧成螺旋状,在火焰上加热后,铜丝表面发黑生成黑色的氧化铜,把它迅速插入酒精中,待黑色退去后,取出铜丝再加热,再插入酒精中,反复数次后嗅闻气味。” 反应的方程式为2Cu + O2→2CuO CuO + CH3CH2OH→CH3CHO + Cu + H2O 总方程式为:CH3CH2OH+ O2→CH3CHO +H2O 反应中起催化作用的是Cu,表面的氧化铜是中间产物。乙醇直接和氧化铜粉末反应生成的是什么?反应条件是什么? 二.实验步骤:实验.1加热乙醇使乙醇蒸汽通入氧化铜粉末中,检验收集到的液体并不是乙醛。 2.先加热氧化铜一段时间,再加热乙醇使乙醇蒸汽通入氧化铜粉末中,很快黑色的氧化铜变为红色。最后用希夫试剂检验生成的液体,显紫色。说明生成了乙醛。 三、实验中的问题: 在做上述实验的前两次试验中检验生成的物质是否为乙醛时,分别用了新制的氢氧化铜和银氨溶液来检验。但均未出现砖红色沉淀和银镜现象。最后用希夫试剂来检验,立即显现出浅紫色。证明生成了乙醛。
用新制的氢氧化铜和银氨溶液检验没现象的原因是乙醛中混有大量的乙醇。以下分别是希夫试剂与醛、所制生成物、乙醇反应的颜色对比图 出现这种不理想现象的可能原因是:乙醇过量,反应后没有立即撤去加热乙醇的酒精灯,致使乙醇蒸汽进入生成物中。 注意:1、该反应较快,氧化铜粉末很快都变成了红色的铜,在操作中必须先加热氧化铜,然后再加热乙醇,而且乙醇加热过程必须一直持续。反应结束后,必须先停止加热乙醇然后再停止加热氧化铜。 2、为减少生成物混入乙醇,应使氧化铜过量。 总结:乙醇和热的氧化铜粉末发生反应。反应的条件是氧化铜粉末必须先加热。该反应氧化铜被还原成铜,做的是氧化剂。 而铜作催化剂时,氧气做的是氧化剂,氧化铜是中间产物。 四、乙醇的催化氧化机理