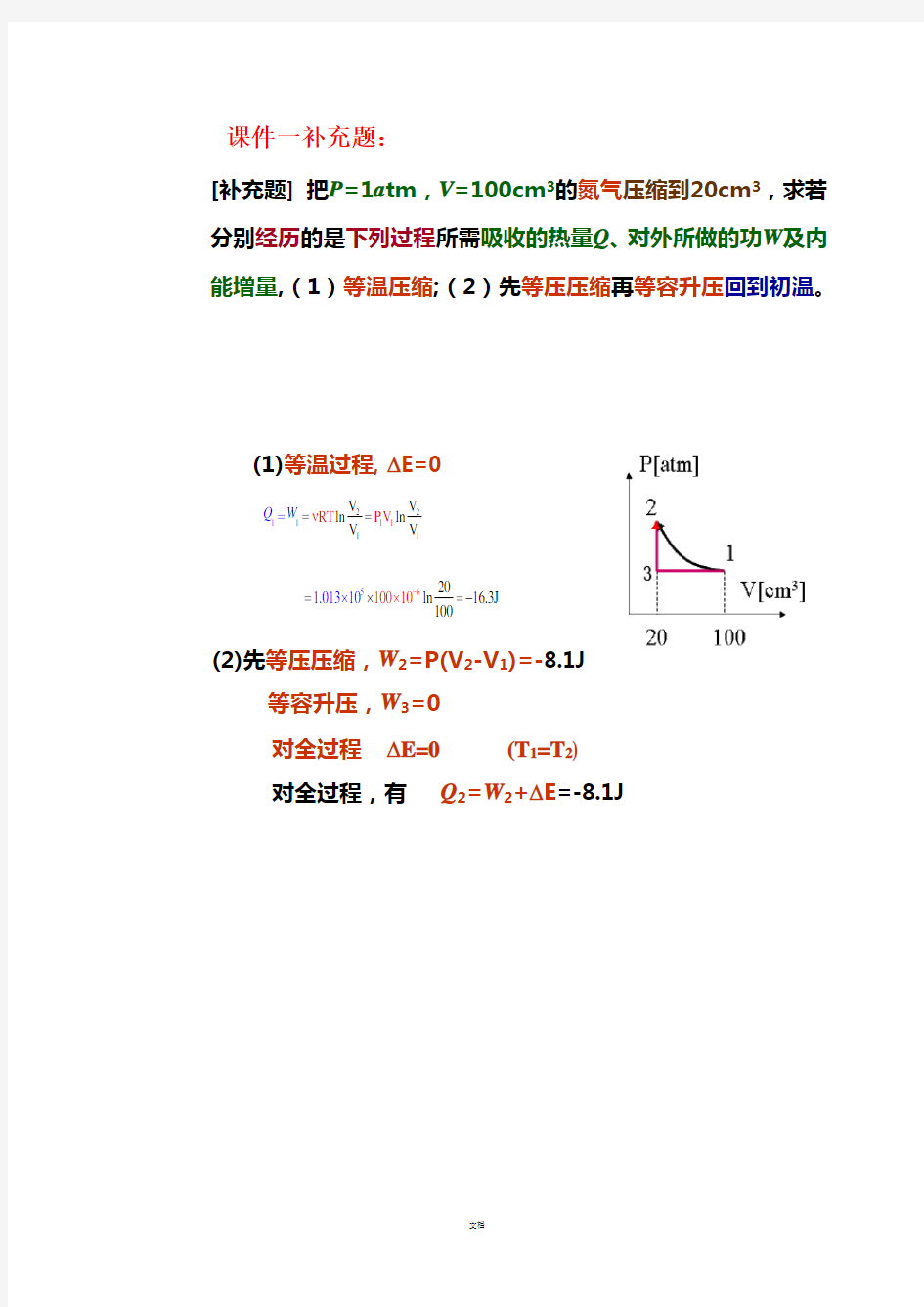

课件一补充题:
(2)先等压压缩,W 2=P(V 2-V 1)=-8.1J 对全过程,有 Q 2=W 2+?E =-8.1J
?E=0 (T 1=T 2) 对全过程 等容升压,W 3=0
(1)等温过程, ?E=0 12211111
V V
ln
ln V R P V T V Q W ν===561001020
ln
1.0131016.3J 100
-=-??=?
[补充题] 把P =1a tm ,V =100cm 3的氮气压缩到20cm 3,求若分别
经历的是下列过程所需吸收的热量Q 、对外所做的功W 及内能增量,(1)等温压缩;(2)先等压压缩再等容升压回到初温。
6-21 一热力学系统由如图6—28所示的状态a 沿acb 过程到达状态b 时,吸收了560J 的热量,对外做了356J 的功。
(1) 如果它沿adb 过
程到达状态b 时,对外做了220J 的功,它吸收了多少热量?
(2)当它由状态b 沿曲线ba 返回状态a 时,外界对它做了282J 的功,它将吸收多少热量?是真吸了热,还是放了热?
解: 根据热力学第一定律 Q E W =+
(1)∵a 沿acb 过程达到状态b ,系统的内能变化是: 560356204()ab acb acb E Q W J J J =-=-= 由于内能是状态系数,与系统所经过的过程无关 ∴系统由a 沿adb 过程到达状态b 时204()ab E J = 系统吸收的热量是:204220424()ab adb Q
E W J =+=+=
(2)系统由状态b 沿曲线ba 返回状态a 时,系统的内能变化:
204()ba ab E E J =-=-
204(282)486()ba ba Q E W J ∴=?+=-+-=-
即系统放出热量486J
6-22 64g 氧气的温度由0℃升至50℃,〔1〕保持体积不变;(2)保持压强不变。在这两个过程中氧气各吸收了多少热量?各增加了多少内能?对外各做了多少功?
解:(1)3.645
8.31(500) 2.0810()322
v m Q vC T J =?=
???-=? 32.0810()E J ?=? W =0
(2)3.64528.31(500) 2.9110()322
p m Q vC T J +=?=???-=? 3
2.0810()E J ?=?
3
2
(2.91 2.08)108.310()Q E J W -?=-?==?
6-24 一定量氢气在保持压强为4.00×5
10Pa 不
变的情况下,温度由0.0 ℃ 升高到50.0℃时,吸收了6.0×104 J 的热量。 (1) 求氢气的量是多少摩尔? (2) 求氢气内能变化多少? (3) 氢气对外做了多少功?
(4) 如果这氢气的体积保持不变而温度发生同样变化、它该吸收多少热量?
解: (1)由,2
2
p m i Q vC T v
R T +=?=? 得 4
22 6.01041.3(2)(52)8.3150
Q v mol i R T ??=
==+?+?? (2)4,5
41.38.3150 4.291022
V m i E vC T v R T J ?=?=?
?=???=? (3)4
4
(6.0 4.29)10 1.7110A Q E J =-?=-?=?
图6-24 习题6-21 图解 图2
(4)4
4.2910Q E J =?=?
6-25 使一定质量的理想气体的状态按图6-24中的曲线沿箭头所示的方向发生变化,图线的BC 段是以P 轴和V 轴为渐近线的双曲线。
(1)已知气体在状态A 时的温度A T =300K ,求气体在B ,C 和D 状态时的温度。
(2)从A 到D 气体对外做的功总共是多少? 解:(1)AB 为等压过程: 20
300600()10
B B A
A V T T K V ==?= BC 为等温过程:600(),C
B T T K ==
CD 为等压过程:20
600300()40
D D C
C V T T K V ==?= (2)
53353
534021.01310(2010)1021.013102010ln 11.01310()ln
()2.8110((2040)102)
0B AB BC C C
A B A C D C B D B
V P V V P V V V W J V W W P W ---=++?????-?+=-++-==?????+???-?????
?
6-27、如图2所示,一定量的理想气体经历ACB 过程时吸热200J ,则经历ACBDA 过程时吸热又为多少?
图6-25 习题6-25 图解
6-28 如图6—25为一循环过程的T —V 图线。该循环的工质是ν mo1的理想气体。其,V m C 和γ均已知且为常量。已知a 点的温度为1T ,体积为1V ,b 点的体积为2V ,ca 为绝热过程。求:
(1) c 点的温度; (2) 循环的效率。
解: (1)c a 为绝热过程,1
1
112r r a c
a c V V T T T V V --????== ? ?
??
??
(2)
a b 等温过程,1a b T T T ==
工质吸热2
11
ln ab V vRT Q V
W ==
bc 为等容过程,工质放热为
11..1.112()11r c V m b c V m V m bc T V vC T T vC T vC T T Q V -????
????
=-=-=- ? ?????????
循环过程的效率1
12.21
[1]11ln r V m
bc ab
Q V V V R V Q C η-??- ???=-
=-
图6-30 习题6-29 图解
6-30 1mol 氮气的循环过程如图6—30所示,ab 和cd 为绝热过程,bc 和da 为等体过程。求:
(1)a ,b ,c ,d 各状态的温度。
(2)
循环效率η。
解: (1)由理想理想气体状态方程pV RT ν=得PV
T R
ν=
a 状态温度53
21.001032.810 3.9510()18.31a a p V Ta K R ν-???===?? b 状态的温度53
23.181016.410 6.2810()18.31
b b b p V T K R ν-??===??
C 状态的温度53241016.4107.8910()18.31c c
c PV T K R ν-???===??
d 状态的温度53
21.261032.810 4.9710()18.31
d d d P V T K R ν-???===?? (2)根据热力学第一定律,d a → 为等体过程:
,||()v m d a Q C T T ν=-放
b c →为等体过程:
,()v m c b Q C T T ν=-吸
(2) ∴循环效率||1Q W
Q Q η=
=-放吸吸
136.65%d a
c b
T T T T -=-
=-
6-31 如图6—26表示一氮气循环过程,求一次循环过程气体对外做的功和循环效率。
解: 如图6—26所示,完成一次循环过程气体对外所做的功为矩形abcd 的面积:
即:35
(51)10(105)102000W J J -=-??-?= 或:()()ab cd a b a c d c W W W p V V p V V =+=-+-
5353
1010(51)10510(15)10J --??=??-?+?-???
2000J =
循环过程中氮气吸收的热量ab da Q Q Q =+吸 由理想气体状态方程PV
PV RT T R
γγ==
得 、、()()p m b b
a a a
b p m b b a a
c PV P V Q c PV P V R R R
γγγ∴=-=-
、、(
)()V m a a d d
da V m a a d d c P V P V Q c P V P V R R R
γγγ∴=-=- 、、2000
()()p m
v m ab da b b a a a a d d W c c Q Q PV P V P V P V R R
η∴==
+-+-
535353532000
7522(10105101010110)(1010110510110)
R R
R R ----=
???-???+???-???
2000
13.1%15250
=
=
图6-27 习题6-31 图解
6-32 图6—27所示为1mol 单原子理想气体经历的循环过程,其中ab 为等温线,若1V ,2V 已知,求循环的效率。
解: 设ab 等温线的温度为T ,b 点的压强:
2
b RT p V =
;
12
c b
V V T T = ;
b T T =
1
2
c V T T V =
; 2
1
ln ab V Q Wab RT V == c a →为等体过程
121,22
333
()()()222ca v m a c c V V V Q C T T R T T R T T RT V V ν-=-=
-=-= b c →为等压过程
121,22
()555
||()()()222bc p m b c c V V V Q C T T R T T R T T RT V V ν-=-=
-=-= ab ca Q Q Q =+吸
221
12
3ln 2V V V Q RT RT
V V -∴=+吸
2121212212121()5ln ||2113(3ln ln 22
V V V V RT Q V V W
V V V V V Q Q RT RT V V V η-+
∴==-=-=
-++
放吸吸
循环效率
6-33、一台冰箱工作时,其冷冻室中的温度为—10℃,室温为15℃。若按理想卡诺致冷循环计算,
则此致冷机每消耗3
10J 的功,可以从冷冻室中吸出
多少热量?
6-34 一台家用冰箱,放在气温为300K 的房间内,做一盘—13℃的冰块需从冷冻室取走5
2.0910J ?的热量。设冰箱为理想卡诺致冷机。
(1)做一盘冰块所需要的功是多少? (2)若此冰箱能以2
2.0910/J s ?的速率取出热量,求所要求的电功率是多少瓦?做冰块需多少时间?
解: 1)因为卡诺致冷机的制冷系数2
12
T e T T =
-,做一盘冰块所需要的功是:
54122300(13273)
2.0910
3.2210()13273
Q T T Q J e W T ---+=
==-∴=???+外吸吸 (2)取走5
2.0910J ?的热量所需用的时间为:532
2.091010()2.0910/J
t S J S
?==?
4
3
3.221032.2()10p W W t ?∴=?==所要求的功率
6-23 l 0g 氦气吸收103 J 的热量时压强未发生变化,它原来的温度是300K ,最后的温度是多少?
解: 由.212
()2
p m M i Q vC T R T T μ+=?=
?-
得33
213
2210410300319(2)(32)8.311010Q T T K i RM μ--???=+=+=++???
6-24 3 mol 氧气在压强为2atm 时体积为40L 。先将它绝热压缩到一半体积,接着再令它等温膨胀到原体积。
(1) 求这—过程的最大压强和最高温度;
(2) 求这一过程中氧气吸收的热量、对外做的功以及内能的变化。 解: (1)最大压强和最高温度出现在绝热过程的终态
1.4112(/)2(40/20) 5.28p p V V atm γ==?=
53
22 5.28 1.01310201042938.31
p V T K vR -????===?
(2)312240
0ln
38.31429ln 7.411020
V Q vRT J V =+=???=? 1112222
1
()ln 1V p V p V vRT V W γ-+-=
2140
(240 5.2820) 1.0131038.31429ln 1.4120
=
?-???+???-
30.9310J =?
33(7.410.93)10 6.4810E Q J W ?==?=?--
6-26 一定量氢气在保持压强为4.00×5
10Pa 不变的情况下,温度由0.0 ℃ 升高到50.0℃时,吸收了6.0×104 J 的热量。 (1) 求氢气的量是多少摩尔?
(2) 求氢气内能变化多少? (3) 氢气对外做了多少功?
(4) 如果这氢气的体积保持不变而温度发生同样变化、它该吸收多少热量?
解: (1)由,2
2
p m i Q vC T v
R T +=?=? 得 4
22 6.01041.3(2)(52)8.3150
Q v mol i R T ??=
==+?+?? (2)4,5
41.38.3150 4.291022
V m i E vC T v R T J ?=?=?
?=???=? (3)4
4
(6.0 4.29)10 1.7110A Q E J =-?=-?=? (4)4
4.2910Q E J =?=?
6-27 有可能利用表层海水和深层海水的温差来制成热机。已知热带水域表层水温约为25℃,300m 深处水温为5℃。求这两个温度之间工作的卡诺热机的效率多大?
解: 21278
11 6.7%298
T T η=-
=-= 6-28 一台冰箱工作时,其冷冻室中的温度为—10℃,室温为15℃。若按理想卡诺致冷循环计算,则此致冷机每消耗3
10J 的功,可以从冷冻室中吸出多少热量?
解: 由于2
12
T T Q e W T ==-吸外 所以3421210263
1.0510288263
T J W T Q T ?===?-?外吸
6-30 如图6—26表示一氮气循环过
程,求一次循环过程气体对外做的功和循环效率。
解: 如图6—26所示,完成一次循环过程气体对外所做的功为矩形abcd 的面积:
即:3
5
(51)10(105)102000W J J -=-??-?= 或:()()ab cd a b a c d c W W W p V V p V V =+=-+-
5353
1010(51)10510(15)10J --??=??-?+?-???
2000J =
循环过程中氮气吸收的热量ab da Q Q Q =+吸 由理想气体状态方程PV
PV RT T R
γγ==
得 、、(
)()p m b b
a a a
b p m b b a a
c PV P V Q c PV P V R R R
γγγ∴=-=- 、、()()V m a a d d
da V m a a d d c P V P V Q c P V P V R R R
γγγ∴=-=-
、、2000
()()p m v m
ab da b b a a a a d d W c c Q Q PV P V P V P V R R
η∴=
=
+-+-
535353532000
7522(10105101010110)(1010110510110)
R R
R R ----=
???-???+???-???
2000
13.1%15250
=
=
6-34 1mol 氧气(当成刚性分子理想气体)经历如图6—29的过程由a 经b 到c 。求在此过程中气体对外做的功、吸的热以及墒变。
解: 此过程中气体对外做功,由
pV
pV RT T R
γγ==
得
∴氧气在a 点的温度a a
c p V T R γ=
氧气在c 点的温度c c
c p V T R
γ=
此过程中氧气对外做的功:
11
()()()()22abc a b b a b c c b W p p V V p p V V =
+-++- 5353311
(68)10110(84)10110 1.310()22abc W J --=?+???++???=?
由a b c →→氧气内能的变化: 5551()()222c c a a abc ca c a p V p V R R E R T T T R R
ν
γγ==??-=?- 535335
(410310610110) 1.5102
J --=????-???=? 3331.310 1.51020810abc abc abc Q E W J J ∴=+=?+?=?
熵变:
、v m c c c c
a
a a a C dT dQ dW dE pdV S T T T T
+?===+?
??? ln ln 22c
c c c a
a a a
V T R i dT
i dV R R R V T V T =+=+?
?
6-35 求在一 个大气压下30 g ,—40℃的冰变为100℃的蒸汽时的熵变。已知冰的比
热1 2.1/(.)c J g K =,水的比热 2 4.2/(.)c J g K =,在1.013×5
10Pa 气压下冰的熔化热
334/J g λ=,水的汽化热2260/L J g =。
解: 40℃-的冰升温至0℃时的熵变为
2
21
1
12111
ln T T T R T c mdT T
dQ
S c m T
T T ?===??
冰等压等温熔成0℃的水时的熵变为
2
22222
T Q dQ m
S R T T T λ?===
? 0℃的水等压升温至100℃时的熵变为
3
3
2
23232
2
ln T T T T T c mdT dQ S R R c m T T T ?===?? 100℃的水等压等温汽化为100℃的水蒸气时的熵变为
3
44333
T Q dQ Lm
S R T T T ?===
? 40℃-的冰变为100℃的水蒸气时的总熵变为 32234121223
(ln
ln )T T L
S S S S S m c c T T T T λ?=?+?+?+?=+++ 2733343732260
30(2.1ln 4.2ln 268/233273273373
J K =??++?+=
6-36 你一天大约向用围环境散发6
810?J 热量,试估算你—天产生多少熵?忽略你进食时带进体内的熵,环境的温度按273K 计算。
解 :设人体温度为136℃309T k ==,环境温度为2273T k =。一天产生的熵即人和
环境熵的增量之和,即
63121211
810() 3.410/309273
Q Q S S S J K T T --?=?+?=
+=?+=?
6-37 一汽车匀速开行时,消耗在各种摩擦上的功率是20kW 。求由于这个原因而产生熵的速率(J/(K.s )是多大?设气温为12℃。
解: 产生熵的速率为
3
201070/()2851
S Q J K s t T t ??===????
6-38 云南鲁甸县大标水岩瀑布的落差为65m ,流量约为233
/m s 。设气温为20℃,求此瀑布每秒钟产生多少熵?
解: 水落下后机械能转变为内能使水温从1T 升高到2T 。2T 可由下式求得:
21()mgh cm T T =-,即 21gh
T T c
=
+ 由给定数值
139.8650.152934.210
gh T c ?===?
此问题中只有水发生熵变,1秒内水的熵变为:
221
1
2111
/ln ln T T R
T T R T T gh c dQ cmdT S cm cm T T T T +?====?
? 111
ln(1)gh gh mgh
cm cm cT cT T =+
≈?= 423109.865
5.010/293
J K ???=
=?
第八章 热力学基础 一、选择题 [ A ]1.(基础训练4)一定量理想气体从体积V 1,膨胀到体积V 2分别经历的过程是:A →B 等压过程,A →C 等 温过程;A →D 绝热过程,其中吸热量最多的过程 (A)是A →B. (B)是A →C. (C)是A →D. (D)既是A →B 也是A →C , 两过程吸热一样多。 【提示】功即过程曲线下的面积,由图可知AD AC AB A A A >>; 根据热力学第一定律:E A Q ?+= AD 绝热过程:0=Q ; AC 等温过程:AC A Q =; AB 等压过程:AB AB E A Q ?+=,且0 >?AB E [ B ]2.(基础训练6)如图所示,一绝热密闭的容器,用隔板分成相等的两部分,左边盛有一定量的理想气体,压强为p 0,右边为真空.今将隔板抽去,气体自由膨胀,当气体达到平衡时,气体的压强是 (A) p 0. (B) p 0 / 2. (C) 2γp 0. (D) p 0 / 2γ. 【提示】该过程是绝热自由膨胀:Q=0,A=0;根据热力学第一定律Q A E =+?得 0E ?=, ∴0T T =;根据状态方程pV RT ν=得00p V pV =;已知02V V =,∴0/2p p =. [ D ]3.(基础训练10)一定量的气体作绝热自由膨胀,设其热力学能增量为E ?,熵增量为S ?,则应有 (A) 0......0=???=?S E 【提示】由上题分析知:0=?E ;而绝热自由膨胀过程是孤立系统中的不可逆过程,故熵增加。
第六章热力学基础 引言:热学的研究对象和两种研究方法1.热学是关于温度有关的学问,与我们的日常生活,工农业生产 以及各行各业有着密切关系。 热学是研究热运动的规律对物质宏观性质的影响,以及与物质其他运动形态之间的转化规律的学科。所谓热运动即组成宏观物体的大量微观粒子的一种永不停息的无规运动。 2.按照研究方法的不同,热学可分为两门学科,即热力学和统计物理学。它们从不同角度研究热运动,二者相辅相成,彼此联系又互相补充。 3.热力学是研究物质热运动的宏观理论。从基本实验定律出发,通过逻辑推理和数学演绎,找出物质各种宏观性质的关系,得出宏观过程进行的方向及过程的性质等方面的结论。具有高度的普适性与可靠性。其缺点是因不涉及物质的微观结构,而将物质视为连续体,故不能解释物质宏观性质的涨落。 4.统计物理学是研究物质热运动的微观理论。从物质由大量微观粒子组成这一基本事实出发,运用统计方法,把物质的宏观性质作为大量微观粒子热运动的统计平均结果,找出宏观量与微观量的关系,进而解释物质的宏观性质。在对物质微观模型进行简化假设后,应用统计物理可求出具体物质的特性;还可应用到比热力学更为广阔的领域,如解释涨落现象是研究非线性科学奠基石。第七章气体动理论就是统计物理学的基础。 5.本章为热力学基础主要内容有: 理想气体物态方程; 功、热量; 热力学第一定律; 等温和绝热过程;
第一节 气体物态参量 平衡态 理想气体物态方程 一、状态参量——热学系统状态的描述 确定热学系统的宏观性质的量称为状态参量。 常用的状态参量有四类: 1.几何参量(如:气体体积) 2.力学参量(如:气体压强) 3.化学参量(如:混合气体各化学组的质量和摩尔数等) 4.电磁参量(如:电场和磁场强度,电极化和磁化强度等) 5.热学参量(如:温度,熵等) 【注意】 如果在所研究的问题中既不涉及电磁性质又无须考虑与化学成分有关的性质,系统中又不发生化学反应,则不必引入电磁参量和化学参量。此时只需温度、体积和压强就可确定系统的状态。 二、p 、V 、T 的单位 1.体积V 物理意义:热学系统中的物质所能达到的空间范围大小的量度。 单位(SI 制):m 3 (立方米),L 、ml . 2.压强 物理意义:作用于容器壁单位面积上的正压力的大小,S F p =单位:在SI 制中,压强的单位为帕斯卡,符号为Pa . 常用的单位有标准大气压(atm ),1atm=1.013×105Pa . 3.温度和温标 温度为系统内物质冷热程度的量度; 温标是温度的数值表示方法。 热力学温标,记号:T ,单位:开尔文, K ; 摄修斯温标,记号:t ,单位:℃; 两者关系:t T +=15.273或15.273-=T t 注意: 温度是热学中特有的物理量,它决定一系统是否与其他系统处于热平衡。处于热平衡的各系统温度相同。 温度是状态的函数,在实质上反映了组成系统大量微观粒子无规则运动的激烈程度。实验表明,将几个达到热平衡状态的系统分开之
第十三章习题 热力学第一定律及其应用 1、如图所示,一定量理想气体从体积V1,膨胀到体积V2分别经历的过程是:A→B等压过程,A→C等温过程;A→D绝热过程,其中吸热量最多的过程。 2、一定量的理想气体,分别经历如图(1) 所示 的abc过程,(图中虚线ac为等温线),和图(2) 所 示的def过程(图中虚线df为绝热线).判断这两 种过程是吸热还是放热. abc过程 热,def过程热. 3、如图所示,一绝热密闭的容器,用隔板分成相等的两部 分,左边盛有一定量的理想气体,压强为p0,右边为真空.今 将隔板抽去,气体自由膨胀,当气体达到平衡时,气体的压 强是。(= γC p/C V) 4、一定量理想气体,从同一状态开始使其体积由V1膨胀到2V1,分别经历以下三种过程:(1) 等压过程;(2) 等温过程;(3)绝热过程.其中:__________过程气体对外作功最多;____________过程气体内能增加最多;__________过程气体吸收的热量最多. 答案 1、是A-B吸热最多。 2、abc过程吸热,def过程放热。 3、P0/2。 4、等压,等压,等压V V
理想气体的功、内能、热量 1、有两个相同的容器,容积固定不变,一个盛有氦气,另一个盛有氢气(看成刚性分子的理想气体),它们的压强和温度都相等,现将5J 的热量传给氢气,使氢气温度升高,如果使氦气也升高同样的温度,则应向氨气传递热量是 。 2、 一定量的理想气体经历acb 过程时吸热500 J .则 经历acbda 过程时,吸热为 。 3、一气缸内贮有10 mol 的单原子分子理想气体,在压缩过程中外界作功209J , 气体升温1 K ,此过程中气体内能增量为 _____ ,外界传给气体的热量为___________________. (普适气体常量 R = 8.31 J/mol· K) 4、一定量的某种理想气体在等压过程中对外作功为 200 J .若此种气体为单 原子分子气体,则该过程中需吸热_____________ J ;若为双原子分子气体,则 需吸热______________ J. 5、 1 mol 双原子分子理想气体从状态A (p 1,V 1)沿p -V 图所示直线变化到状态B (p 2,V 2),试求: (1) 气体的内能增量. (2) 气体对外界所作的功. (3) 气体吸收的热量. (4) 此过程的摩尔热容. (摩尔热容C =T Q ??/,其中Q ?表示1 mol 物质在过程中升高温度T ?时所吸收的热量.) p (×105 Pa) -3 m 3) p p p 12
第13章 热力学基础作业题答案 一 简答题: 1、什么是准静态过程? 答:一热力学系统开始时处于某一平衡态,经过一系列状态变化后到达另一平衡态,若中间过程进行是无限缓慢的,每一个中间态都可近似看作是平衡态,那么系统的这个状态变化的过程称为准静态过程。 2、 比较摩尔定体热容和摩尔定压热容的异同。 答:相同点:都表示1摩尔气体温度升高1摄氏度时气体所吸收的热量。 不同点:摩尔定体热容是1摩尔气体,在体积不变的过程中,温度升高1摄氏度时气体所吸收的热量。摩尔定压热容是1摩尔气体,在压强不变的过程中,温度升高1摄氏度时气体所吸收的热量。两者之间的关系为R C C v p += 3、简述热力学第二定律的两种表述。 答:开尔文表述:不可能制成一种循环工作的热机,它只从单一热源吸收热量,并使其全部变为有用功而不引起其他变化。 克劳修斯表述:热量不可能自动地由低温物体传向高温物体而不引起其他变化。 4、什么是熵增加原理 答:一切不可逆绝热过程中的熵总是增加的,可逆绝热过程中的熵是不变的。把这两种情况合并在一起就得到一个利用熵来判别过程是可逆还是不可逆的判据——熵增加原理 二、选择题(每个题至少有一个正确答案) 1、对于理想气体的内能,下列说法中正确的是(B ) ( A ) 理想气体的内能可以直接测量的。 (B) 理想气体处于一定的状态,就有一定的内能。 (C )当理想气体的状态改变时,内能一定跟着变化。 (D )理想气体的内能变化与具体过程有关。 2、如图:一绝热容器被隔板K 隔开成ab 两部分,已知a 有一稀薄气体,b 内为真空。抽开隔板K 后,a 内气体进入b ,最终达到平衡状态,在此过程中(B ) ( A )气体对外做功,内能减少。 (B) 气体不做功,内能不变。 (C )气体压强变小,温度降低。 (D )气体压强变小,温度降低。
习题提示与答案 第六章 热能的可用性及火用分析 6-1 汽车用蓄电池中储存的电能为1 440 W ·h 。现采用压缩空气来代替它。设空气压力 为6.5 MPa 、温度为25 ℃,而环境的压力为0.1 MPa ,温度为25 ℃,试求当压缩空气通过容积 变化而作出有用功时,为输出1 440 W · h 的最大有用功所需压缩空气的体积。 提示:蓄电池存储的电能均为可转换有用功的火用 ,用压缩空气可逆定温膨胀到与环境平衡时所作出的有用功替代蓄电池存储的电能,其有用功完全来源于压缩空气的火用 ,即W u =me x ,U 1。单位质量压缩空气火用 值()()()010010011,x s s T v v p u u e U ---+-=,空气作为理想气体处理。 答案:V =0.25 m 3。 6-2 有一个刚性容器,其中压缩空气的压力为3.0 MPa ,温度和环境温度相同为25 ℃,环境压力为0.1 MPa 。打开放气阀放出一部分空气使容器内压力降低到1.0 MPa 。假设容器内剩余气体在放气时按可逆绝热过程变化,试求:(1) 放气前、后容器内空气比火用U e x,的值;(2) 空气由环境吸热而恢复到25 ℃时空气的比火用U e x,的值。 提示: 放气过程中刚性容器中剩余气体经历了一个等熵过程,吸热过程为定容过程; 空气可以作为理想气体处理;各状态下容器 中空气的比 火用()()()00000x s s T v v p u u e U ,---+-=。 答案:e x ,U 1=208.3 kJ/kg ,e x ,U 2=154.14 kJ/kg ,e x ,U 3=144.56 kJ/kg 。 6-3 有0.1 kg 温度为17 ℃、压力为0.1 MPa 的空气进入压气机中,经绝热压缩后其温度为207 ℃、压 力为0.4 MPa 。若室温为17 ℃,大气压力为0.1 MPa ,试求该压气机的轴功,进、出口处空气的比 火用 H e x ,。 提示:工质为理想气体;压气机的轴功T c h w p ?=?=-021,s ,比 火用e x ,H =(h -h 0)-T 0(s -s 0)。 答案:21,s -w =-19.08 kJ ,e x,H 1=0 kJ/kg ,e x,H 2=159.4 kJ/kg 。 6-4 刚性绝热容器由隔板分成A 、B 两部分,各储有1 mol 空气,初态参数分别为p A =200 kPa ,T A =500 K ,p B =300 kPa ,T B =800 K 。现将隔板抽去,求混合引起的熵产及火用损失。设大气环境温度为300 K 。 提示:工质为理想气体;熵产B A iso g S S S S ?+?=?=?, 火用损失g 0L x,S T E ?=。
大学物理第六章练 习答案 -CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN
第六章 热力学基础 练 习 一 一. 选择题 1. 一绝热容器被隔板分成两半,一半是真空,另一半是理想气体,若把隔板抽出,气体将进行自由膨胀,达到平衡后( A ) (A) 温度不变,熵增加; (B) 温度升高,熵增加; (C) 温度降低,熵增加; (D) 温度不变,熵不变。 2. 对于理想气体系统来说,在下列过程中,哪个过程系统所吸收的热量、内能的增量和对外作做的功三者均为负值。( C ) (A) 等容降压过程; (B) 等温膨胀过程; (C) 等压压缩过程; (D) 绝热膨胀过程。 3. 一定量的理想气体,分别经历如图 1(1)所示的abc 过程(图中虚线ac 为等温线)和图1(2)所示的def 过程(图中虚线df 为绝热线) 。 判断这两过程是吸热还是放热:( A ) (A) abc 过程吸热,def 过程放热; (B) abc 过程放热,def 过程吸热; (C) abc 过程def 过程都吸热; (D) abc 过程def 过程都放热。 4. 如图2,一定量的理想气体,由平衡状态A 变到平衡状态B(A p =B p ),则无论经过的是什么过程,系统必然( B ) (A) 对外做正功; (B) 内能增加; (C) 从外界吸热; (D) 向外界放热。 二.填空题 图.2 图1
1. 一定量的理想气体处于热动平衡状态时,此热力学系统不随时间变化的三个宏观量是P V T ,而随时间变化的微观量是每个分子的状态量。 2. 一定量的单原子分子理想气体在等温过程中,外界对它做功为200J ,则该过程中需吸热__-200__ ___J 。 3. 一定量的某种理想气体在某个热力学过程中,外界对系统做功240J ,气体向外界放热620J ,则气体的内能 减少,(填增加或减少),21E E -= -380 J 。 4. 处于平衡态A 的热力学系统,若经准静态等容过程变到平衡态B ,将从外界吸热416 J ,若经准静态等压过程变到与平衡态B 有相同温度的平衡态C ,将从外界吸热582 J ,所以,从平衡态A 变到平衡态C 的准静态等压过程中系统对外界所做的功为 582-416=166J 。 三.计算题 1. 一定量氢气在保持压强为4.00×510Pa 不变的情况下,温度由0 ℃ 升高到50.0℃时,吸收了6.0×104 J 的热量。 (1) 求氢气的摩尔数 (2) 氢气内能变化多少 (3) 氢气对外做了多少功 (4) 如果这氢气的体积保持不变而温度发生同样变化、它该吸收多少热量 解: (1)由,2 2 p m i Q vC T v R T +=?=? 得 4 22 6.01041.3(2)(52)8.3150 Q v mol i R T ??= ==+?+?? (2)4,5 41.38.3150 4.291022 V m i E vC T v R T J ?=?=??=???=? (3)44(6.0 4.29)10 1.7110A Q E J =-?=-?=? (4)44.2910Q E J =?=?
一、选择题 [ A ]1.(基础训练4)一定量理想气体从体积V 1,膨胀到体积V 2分别经历的过程是:A →B 等压过程,A →C 等温过程;A →D 绝热过程,其中吸热量最多的过程 (A)是A →B. (B)是A →C. (C)是A →D. (D)既是A →B 也是A →C , 两过程吸热一样多。 【提示】功即过程曲线下的面积,由图可知AD AC AB A A A >>; 根据热力学第一定律:E A Q ?+= AD 绝热过程:0=Q ; AC 等温过程:AC A Q =; AB 等压过程:AB AB E A Q ?+=,且0>?A B E [ B ]2.(基础训练6)如图所示,一绝热密闭的容器,用隔板 分成相等的两部分,左边盛有一定量的理想气体,压强为p 0,右边为真 空.今将隔板抽去,气体自由膨胀,当气体达到平衡时,气体的压强是(A) p 0. (B) p 0 / 2. (C) 2γp 0. (D) p 0 / 2γ . 【提示】该过程是绝热自由膨胀:Q=0,A=0;根据热力学第一定律Q A E =+?得 0E ?=,∴0T T =;根据状态方程pV RT ν=得00p V pV =;已知02V V =,∴0/2p p =. [ D ]3.(基础训练10)一定量的气体作绝热自由膨胀,设其热力学能增量为E ?,熵增量为S ?,则应有 (A) 0...... 0=???=?S E 【提示】由上题分析知:0=?E ;而绝热自由膨胀过程是孤立系统中的不可逆过程,故熵增加。 [ D ]4.(自测提高1)质量一定的理想气体,从相同状态出发,分别经历等温过程、等压过程和绝热过程,使其体积增加1倍.那么气体温度的改变(绝对值)在 (A) 绝热过程中最大,等压过程中最小. (B) 绝热过程中最大,等温过程中最小. (C) 等压过程中最大,绝热过程中最小. (D) 等压过程中最大,等温过程中最小. 【提示】如图。等温AC 过程:温度不变,0C A T T -=; 等压过程:A B p p =,根据状态方程pV RT ν=,得: B A B A T T V V =,2B A T T ∴=,B A A T T T -=
第六章热学答案 1. 解 :由致冷系数2122T T T A Q -== ε ()J T T AT Q 421221025.121 102731000?=-?=-= 2.解:锅炉温度K T 4832732101=+=,暖气系统温度K T 333273602=+=,蓄水池温度 K T 288273153=+=。kg 0.1燃料燃烧放出的热量为1Q 热机的工作效率1212111T T Q Q Q A -=-== η,向制冷机做功)1(1 21T T Q A -=,热机向暖气系统放热分别为11212Q T T A Q Q = -=;设制冷机的制冷系数3 2343T T T A A Q A Q -=-==ε, A T T T T T T T T T A Q ?-?-=-+ =3 22 1213234)1( 暖气系统得到热量为: 112322112421Q T T T T T Q T T Q Q Q ??? ? ??--+= +=1123231Q T T T T T ?-T -= cal 41049.115000483 333 288333288483?=???--= 3.解:(1)两个循环都工作与相同绝热线,且低温T 不变,故放热相同且都为2Q ,在第一个循环 过程中22 1212111Q A Q Q Q T T +- =-=- =η,2 122T T AT Q -=;在第二个循环过程中高温热源温度提高到3T 的循环过程中2223232111Q A Q Q Q T T +-=-=- =η,2 32 22T T T A Q -=;因此2 32 22122T T T A T T AT Q -=-= 解得()()K T T A A T T 473173373800 106.12733 211223=-?+=-+= (2)效率增大为:3.42473 273 1132=-=- =T T η % 4.解:热机效率 1211T T Q A -≤,当取等号时1Q 最小,此时1 211T T Q A -=,
§13.1~13. 2 13.1 如图所示,当气缸中的活塞迅速向外移动从而使气体膨胀时,气体所经历的过程【C 】 (A) 是准静态过程,它能用p ─V 图上的一条曲线表示 (B) 不是准静态过程,但它能用p ─V 图上的一条曲线表示 (C) 不是准静态过程,它不能用p ─V 图上的一条曲线表示 (D) 是准静态过程,但它不能用p ─V 图上的一条曲线表示 分析:从一个平衡态到另一平衡态所经过的每一中间状态均可近似当作平衡态(无限缓慢)的过程叫做准静态过程,此过程在p-V 图上表示一条曲线。题目中活塞迅速移动,变换时间非常短,系统来不及恢复平衡,因此不是准静态过程,自然不能用p -V 图上的一条曲线表示。 13.2 设单原子理想气体由平衡状态A ,经一平衡过程变化到状态B ,如果变化过程不知道,但A 、B 两状态的压强,体积和温度都已知,那么就可以求出:【B 】 (A ) 体膨胀所做的功; (B ) 气体内能的变化; (C ) 气体传递的热量; (D ) 气体的总质量。 分析:功、热量都是过程量,除了与系统的始末状态有关外,还跟做功或热传递的方式有关;而内能是状态量,只与始末状态有关,且是温度的单值函数。因此在只知道始末两个状态的情况下,只能求出内能的变化。对于答案D 而言,由物态方程RT PV ν=可以计算气体的物质的量,但是由于不知道气体的种类,所以无法计算气体总质量。 13.3 一定量的理想气体P 1、V 1、T 1,后为P 2、V 2、T 2, 已知V 2>V 1, T 2
06章 一、填空题 1、热力学第二定律的微观实质可以理解为:在孤立系统内部所发生的不可逆过程,总是沿着熵 的方向进行。 2、热力学第二定律的开尔文表述和克劳修斯表述是等价的,表明在自然界中与热现象有关的实际宏观过程都是不可逆的,开尔文表述指出了_____________的过程是不可逆的,而克劳修斯表述指出了__________的过程是不可逆的。 3.一定量的某种理想气体在某个热力学过程中,外界对系统做功240J ,气体向外界放热620J ,则气体的内能 (填增加或减少),E 2—E 1= J 。 4.一定量的理想气体在等温膨胀过程中,内能 ,吸收的热量全部用于 。 5.一定量的某种理想气体在某个热力学过程中,对外做功120J ,气体的内能增量为280J ,则气体从外界吸收热量为 J 。 6、在孤立系统内部所发生的过程,总是由热力学概率 的宏观状态向热力学概率 的宏观状态进行。 7、一定量的单原子分子理想气体在等温过程中,外界对它作功为200J.则该过程中需吸热_______J 。 8、一定量的气体由热源吸收热量526610J ??,内能增加5 41810J ??,则气体对外作 功______J 。 9、工作在7℃和27℃之间的卡诺致冷机的致冷系数为 ,工作 在7℃和27℃之间的卡诺热机的循环效率为 。 10、2mol 单原子分子理想气体,经一等容过程后,温度从200K 上升到500K,则气体吸收的热量为_____J 。 11、气体经历如图1所示的一个循环过程,在这个循环中, 外界传给气体的净热量是 J 。 12、一热机由温度为727℃的高温热源吸热,向温度为 527℃的低温热源放热。若热机可看作卡诺热机,且每一 循环吸热2000J,则此热机每一循环作功 J 。 13、1mol 的单原子分子理想气体,在1atm 的恒定压强下,从0℃加热到100℃,则气体的
热力学基础作业 班级:_____________ 姓名:_____________ 学号:_____________ 日期:__________年_______月_______日 成绩:_____________ 一、选择题 1. 一定量某理想气体按pV 2=恒量的规律膨胀,则膨胀后理想气体的温度 (A) 将升高. (B) 将降低. (C) 不变. (D)升高还是降低,不能确定. [ ] 2. 若室内生起炉子后温度从15℃升高到27℃,而室内气压不变,则此时室内的分子数减少了 (A)0.500. (B) 400. (C) 900. (D) 2100. [ ] 3. 若理想气体的体积为V ,压强为p ,温度为T ,一个分子的质量为m ,k 为玻尔兹曼常量,R 为普适气体常量,则该理想气体的分子数为: (A) pV / m . (B) pV / (kT ). (C) pV / (RT ). (D) pV / (mT ). [ ] 4. 理想气体向真空作绝热膨胀. (A) 膨胀后,温度不变,压强减小. (B) 膨胀后,温度降低,压强减小. (C) 膨胀后,温度升高,压强减小. (D) 膨胀后,温度不变,压强不变. [ ] 5. 对于理想气体系统来说,在下列过程中,哪个过程系统所吸收的热量、内能的增量和对外作的功三者均为负值? (A) 等体降压过程. (B) 等温膨胀过程. (C) 绝热膨胀过程. (D) 等压压缩过程. [ ] 6. 如果卡诺热机的循环曲线所包围的面积从图 中的abcda 增大为da c b a '',那么循环abcda 与da c b a ''所作的净功和热机效率变化情况是: (A) 净功增大,效率提高. (B) 净功增大,效率降低. (C) 净功和效率都不变. (D) 净功增大,效率不变. [ ] 7. 两个卡诺热机的循环曲线如图所示,一个工作在温度为T 1 与T 3的两个热源之间,另一个工作在温度为T 2 与T 3的两个热源之间,已知这两个循环曲线所包围的面积相等.由此可知: (A ) 两个热机的效率一定相等. (B ) 两个热机从高温热源所吸收的热量一定相等. c ' d T 2 a b b ' c T 1V O p
第八章2014) 一. 选择题 1. 【基础训练4】[ A ]一定量理想气体从体积V 1,膨胀到体积V 2分别经历的过程是:A →B 等压过程,A →C 等温过程;A →D 绝热过程,其中吸热量最多的过程 (A)是A →B. (B)是A →C. (C)是A →D. (D)既是A →B 也是A →C , 两过程吸热一样多。 【参考答案】根据热力学过程的功即过程曲线下的面积,知AD AC AB A A A >>; 再由热力学第一定律气体吸热E A Q ?+= AD 过程0=Q ; AC 过程AC A Q =; AB 过程AB AB E A Q ?+=,且0>?AB E 2 【基础训练6】 [ B ]如图所示,一绝热密闭的容器,用隔板分成相等的两部分, 左边盛有一定量的理想气体,压强为p 0,右边为真空.今将隔板抽去, 气体自由膨胀,当气体达到平衡时,气体的压强是 (A) p 0. (B) p 0 / 2. (C) 2γp 0. (D) p 0 / 2γ . 【参考答案】该过程是绝热的自由膨胀过程,所以0=Q 0=A 由热力学第一定律 0=?E ∴0=?T 2 20 /0/p P V V = ?=由 3【基础训练10】 [D ]一定量的气体作绝热自由膨胀,设其热力学能增量为E ?,熵增量为S ?,则 应有 (A) 0......0=???=?S E 【参考答案】由上题分析知:0=?E ;而绝热自由膨胀过程是不可逆的,故熵增加。 4. 【自测提高3】 [ A ]一定量的理想气体,分别经历如图(1) 所示的abc 过程,(图中虚线ac 为等温线),和图(2)所示的def 过程(图中虚线df 为 绝热 线).判断这两种过程是吸热还是放热. (A) abc 过程吸热,def 过程放热. (B) abc 过程放热,def 过程吸热. (C) abc 过程和def 过程都吸热. (D) abc 过程和def 过程都放热. 【参考答案】内能是状态量,与过程无关。所以图(1)中:abc 过程和ac 过程的内能增量相同,并由ac 为等温线可知 0=?E 。而功是过程曲线下的面积,显然abc 过程的功0>A 。 由热力学第一定律:abc 过程:0.>=?+=A E A Q 所以abc 过程是吸热过程。 同理,在图(2)中:def 过程和df 过程的内能增量相同,并由绝热df 过程知 A E -=? 根据过程曲线下的面积:def 过程的功/ .A 小于df 过程的功.A 所以def 过程0)(/ //<-+=?+=A A E A Q 所以def 过程是放热过程 5. 【自测提高4】 [ B ]用下列两种方法 (1) 使高温热源的温度T 1升高ΔT ; (2) 使低温热源的温度T 2降低同样的值ΔT , V
第十三章习题 热力学第一定律及其应用 1、关于可逆过程和不可逆过程的判断: (1) 可逆热力学过程一定是准静态过程. (2) 准静态过程一定是可逆过程. (3) 不可逆过程就是不能向相反方向进行的过程. (4) 凡有摩擦的过程,一定是不可逆过程. 以上四种判断,其中正确的是 。 2、如图所示,一定量理想气体从体积V 1,膨胀到体积V 2分别经历的过程是:A →B 等压过程,A →C 等温过程;A →D 绝热过程,其中吸热量最多的过程 。 3、一定量的理想气体,分别经历如图(1) 所示的abc 过程,(图中虚线ac 为等温线),和图(2) 所示的def 过程(图中虚线df 为绝热线).判断 这两种过程是吸热还是放热. abc 过程 热,def 过程 热. 4、如图所示,一绝热密闭的容器,用隔板分成相等的两部分,左边盛有一定量的理想气体,压强为p 0,右边为真空.今将隔板抽去,气体自由膨胀,当气体达到平衡时,气体的压强是 。 (=γ C p /C V ) 5、一定量理想气体,从同一状态开始使其体积由V 1膨胀到2V 1,分别经历以下 三种过程:(1) 等压过程;(2) 等温过程;(3)绝热过程.其中:__________过程 气体对外作功最多;____________过程气体能增加最多;__________过程气体吸收的热量最多. V V
答案 1、(1)(4)是正确的。 2、是A-B 吸热最多。 3、abc 过程吸热,def 过程放热。 4、P 0/2。 5、等压, 等压, 等压 理想气体的功、能、热量 1、有两个相同的容器,容积固定不变,一个盛有氦气,另一个盛有氢气(看成刚性分子的理想气体),它们的压强和温度都相等,现将5J 的热量传给氢气,使氢气温度升高,如果使氦气也升高同样的温度,则应向氨气传递热量是 。 2、 一定量的理想气体经历acb 过程时吸热500 J .则 经历acbda 过程时,吸热为 。 3、一气缸贮有10 mol 的单原子分子理想气体,在压缩 过程中外界作功209J , 气体升温1 K ,此过程中气体能增量为 _____ ,外界传给气体的热量为___________________. (普适气体常量 R = 8.31 J/mol · K) 4、一定量的某种理想气体在等压过程中对外作功为 200 J .若此种气体为单 原子分子气体,则该过程中需吸热_____________ J ;若为双原子分子气体,则 需吸热______________ J. p (×105 Pa) 3 m 3)
《大学物理学》热力学基础 一、选择题 13-1.如图所示,bca 为理想气体的绝热过程,b 1a 和b 2a 是任意过程,则上述两过程中气体做功与吸收热量的情况是 ( ) (A )b 1a 过程放热、作负功,b 2a 过程放热、作负功; (B )b 1a 过程吸热、作负功,b 2a 过程放热、作负功; (C )b 1a 过程吸热、作正功,b 2a 过程吸热、作负功; (D )b 1a 过程放热、作正功,b 2a 过程吸热、作正功。 【提示:体积压缩,气体作负功;三个过程中a 和b 两点之间的内能变化相同,bca 线是绝热过程,既不吸热也不放热,b 1a 过程作的负功比b 2a 过程作的负功多,由Q W E =+?知b 2a 过程放热,b 1a 过程吸热】 13-2.如图,一定量的理想气体,由平衡态A 变到平衡态B ,且他们的压强相等,即A B P P =。问在状态A 和状态B 之间,气体无论经过的是什么过程,气体必然 ( ) (A )对外作正功;(B )内能增加; (C )从外界吸热;(D )向外界放热。 【提示:由于A B T T <,必有A B E E <;而功、热量是 过程量,与过程有关】 13-3.两个相同的刚性容器,一个盛有氢气,一个盛氦气(均视为刚性理想气体),开始时它们的压强和温度都相同,现将3 J 的热量传给氦气,使之升高到一定的温度,若氢气也升高到同样的温度,则应向氢气传递热量为 ( ) (A )6J ; (B )3J ; (C )5J ; (D )10J 。 【提示:等体过程不做功,有Q E =?,而2 mol M i E R T M ?= ?,所以需传5J 】 13-4.有人想象了如图所示的四个理想气体的循环过程,则在理论上可以实现的是( ) A () C () B () D ()
第十三章 热力学基础 13 -1 如图所示,bca 为理想气体绝热过程,b1a 和b2a 是任意过程,则上述两过程中气体作功与吸收热量的情况是( ) (A) b1a 过程放热,作负功;b2a 过程放热,作负功 (B) b1a 过程吸热,作负功;b2a 过程放热,作负功 (C) b1a 过程吸热,作正功;b2a 过程吸热,作负功 (D) b1a 过程放热,作正功;b2a 过程吸热,作正功 分析与解 bca ,b1a 和b2a 均是外界压缩系统,由?=V p W d 知系统经这三个过程均作负功,因而(C)、(D)不对.理想气体的内能是温度的单值函数,因此三个过程初末态内能变化相等,设为ΔE .对绝热过程bca ,由热力学第一定律知ΔE =-W bca .另外,由图可知:|W b2a |>|W bca |>|W b1a |,则W b2a <W bca <W b1a .对b1a 过程:Q =ΔE +W b1a >ΔE +W bca =0 是吸热过程.而对b2a 过程:Q =ΔE +W b2a <ΔE +W bca =0 是放热过程.可见(A)不对,正确的是(B). 13 -2 如图,一定量的理想气体,由平衡态A 变到平衡态B ,且它们的压强相等,即p A =p B ,请问在状态A 和状态B 之间,气体无论经过的是什么过程,气体必然( ) (A) 对外作正功 (B) 内能增加 (C) 从外界吸热 (D) 向外界放热
分析与解 由p -V 图可知,p A V A <p B V B ,即知T A <T B ,则对一定量理想气体必有E B >E A .即气体由状态A 变化到状态B,内能必增加.而作功、热传递是过程量,将与具体过程有关.所以(A)、(C)、(D)不是必然结果,只有(B)正确. 13 -3 两个相同的刚性容器,一个盛有氢气,一个盛氦气(均视为刚性分子理想气体).开始时它们的压强和温度都相同,现将3J 热量传给氦气,使之升高到一定的温度.若使氢气也升高同样的温度,则应向氢气传递热量为 ( ) (A) 6J (B) 3 J (C) 5 J (D) 10 J 分析与解 当容器体积不变,即为等体过程时系统不作功,根据热力学第一定律Q =ΔE +W ,有Q =ΔE .而由理想气体内能公式T R i M m E Δ2 Δ= ,可知欲使氢气和氦气升高相同温度,须传递的热量 ? ?? ? ?????? ??=e e e 222e 2H H H H H H H H /:i M m i M m Q Q .再由理想气体物态方程pV =mM RT ,初始时,氢气和氦气是具有相同的温度、压强和体积,因而物质的量相同,则3/5/:e 2e 2H H H H ==i i Q Q .因此正确答案为(C). 13 -4 有人想像了四个理想气体的循环过程,则在理论上可以实现的为 ( )
大学物理课堂作业 热力学基础 一、填空题 1 在p?V图上 (1) 系统的某一平衡态用_____________来表示; (2) 系统的某一平衡过程用________________来表示; (3) 系统的某一平衡循环过程用__________________来表示; 2.处于平衡态A的一定量的理想气体,若经准静态等体过程变到平衡态B,将从外界吸收热量416 J,若经准静态等压过程变到与平衡态B有相同温度的平衡态C,将从外界吸收热量582 J,所以,从平衡态A变到平衡态C的准静态等压 过程中气体对外界所作的功为____________________. 3.一定量的某种理想气体在等压过程中对外作功为200 J.若此种气体为单 原子分子气体,则该过程中需吸热_____________ J;若为双原子分子气体,则 需吸热______________ J. 4.可逆卡诺热机可以逆向运转.逆向循环时, 从低温热源吸热,向高温热源放热,而且吸的热量和放出的热量等于它正循环时向低温热源放出的热量和从高温热源吸的热量.设高温热源的温度为T1 =450 K , 低温热源的温度为T2 =300 K, 卡诺热机逆向循环时从低温热源吸热Q2 =400 J,则该卡诺热机逆向循环一次外界必须 作功W=_________. 5. 一热机从温度为727℃的高温热源吸热,向温度为527℃的低温热源放热.若 热机在最大效率下工作,且每一循环吸热2000 J ,则此热机每一循环作功_____ ____________ J. 6. 从统计的意义来解释, 不可逆过程实质上是一个________________________ __________________________的转变过程, 一切实际过程都向着_____________ _____________________________的方向进行. γC p/C V为已知)的循环过程如T-V图所示,其中CA为绝热过程,7. 1 mol 理想气体(设= A点状态参量(T1,V1)和B点的状态参量(T2,V2)为已知.试求C点的状态参量:
第六章热力学第二定律 6-1 设每小时能造冰m克,则m克25℃的水变成-18℃的水要放出的热量为 25m+80m+0.5×18m=114m 有热平衡方程得 4.18×114m=3600×2922 ∴ m=2.2×104克=22千克 由图试证明:任意循环过程的效率,不可能大于工作于它所经历的最高热源温度与最低热温源温度之间的可逆卡诺循环的效率。 (提示:先讨论任一可逆循环过程,并以一连串微小的可逆卡诺循环过程。如以T m和T n分别代表这任一可循环所经历的最高热源温度和最低热源温度。试分析每一微小卡诺循环效率与的关系) 证:(1)d当任意循环可逆时。用图中封闭曲线R表示,而R可用图中一连串微笑的可逆卡诺循环来代替,这是由于考虑到:任两相邻的微小可逆卡诺循环有一总,环段绝热线是共同的,但进行方向相反从而效果互相抵消,因而这一连串微小可逆卡诺循环的总效果就和图中锯齿形路径所表示的循环相同;当每个微小可逆卡诺循环无限小而趋于数总无限多时,其极限就趋于可逆循环R。 考虑人一微小可逆卡诺循(187完) 环,如图中阴影部分所示,系统从高温热源T i吸热Q i,向低温热源T i放热,对外做功,则效率 任意可逆循环R的效率为 A为循环R中对外作的总功 (1) 又,T m和T n是任意循环所经历的最高温热源和最低温热源的温度 ∴对任一微小可逆卡诺循,必有: T i≤T m,T i≥T n 或
或 令表示热源T m和T n之间的可逆卡诺循环的效率,上式 为 将(2)式代入(1)式: 或 或(188完) 即任意循环可逆时,其效率不大于它所机灵的最高温热源T m和最低温度热源T n之间的可逆卡诺循环的效率。 (2)任意循环不可逆时,可用一连串微小的不可逆卡诺循环来代替,由于诺定理知,任一微小的不可逆卡 诺循环的效率必小于可逆时的效率,即(3) 对任一微小的不可逆卡诺循环,也有 (4) 将(3)式代入(4)式可得: 即任意不可逆循环的效率必小于它所经历的最高温热源T m和最低温热源T n之间的可逆卡诺循环的效率。 综之,必 即任意循环的效率不可能大于它所经历的最高温热源和最低温热源之间的可逆卡诺循环的效率。 *6-8 若准静态卡循环中的工作物质不是理想气体而是服从状态方程p(v-b)=RT。式证明这可逆卡诺循环的 效率公式任为
第十三章习题 热力学第一定律及其应用1、关于可逆过程和不可逆过程的判断: (1) 可逆热力学过程一定是准静态过程. (2) 准静态过程一定是可逆过程. (3) 不可逆过程就是不能向相反方向进行的过程. (4) 凡有摩擦的过程,一定是不可逆过程. 以上四种判断,其中正确的是。 2、如图所示,一定量理想气体从体积V1,膨胀到体积V2分别经历的过程是:A→B等压过程,A→C等温过程;A→D绝热过程,其中吸热量最多的过程。 3、一定量的理想气体,分别经历如图(1) 所示 的abc过程,(图中虚线ac为等温线),和图(2) 所 示的def过程(图中虚线df为绝热线).判断这两 种过程是吸热还是放热. abc过程 热,def过程热. 4、如图所示,一绝热密闭的容器,用隔板分成相等的两部 分,左边盛有一定量的理想气体,压强为p0,右边为真空.今 将隔板抽去,气体自由膨胀,当气体达到平衡时,气体的压 强是。(= γC p/C V) 5、一定量理想气体,从同一状态开始使其体积由V1膨胀到2V1,分别经历以下三种过程:(1) 等压过程;(2) 等温过程;(3)绝热过程.其中:__________过程气体对外作功最多;____________过程气体内能增加最多;__________过程气体吸收的热量最多.V V
答案 1、(1)(4)是正确的。 2、是A-B 吸热最多。 3、abc 过程吸热,def 过程放热。 4、P 0/2。 5、等压, 等压, 等压 理想气体的功、内能、热量 1、有两个相同的容器,容积固定不变,一个盛有氦气,另一个盛有氢气(看成刚性分子的理想气体),它们的压强和温度都相等,现将5J 的热量传给氢气,使氢气温度升高,如果使氦气也升高同样的温度,则应向氨气传递热量是 。 2、 一定量的理想气体经历acb 过程时吸热500 J .则 经历acbda 过程时,吸热为 。 3、一气缸内贮有10 mol 的单原子分子理想气体,在压 缩过程中外界作功209J , 气体升温1 K ,此过程中气体内能增量为 _____ ,外界传给气体的热量为___________________. (普适气体常量 R = 8.31 J/mol· K) 4、一定量的某种理想气体在等压过程中对外作功为 200 J .若此种气体为单 原子分子气体,则该过程中需吸热_____________ J ;若为双原子分子气体,则 需吸热______________ J. p (×105 Pa) 3 m 3)