
1分(0703)
0703
EDTA的酸效应曲线是指----------------------------------------------------------------------( )
(A)αY(H)-pH曲线(B) pM-pH曲线
(C) lg K'(MY)-pH曲线(D) lgαY(H)-pH曲线
1分(0703)
0703
(D)
2分(0706)
0706
在pH为10.0的氨性溶液中,已计算出αZn(NH3)=104.7,αZn(OH)=102.4,αY(H)=100.5。则在此条件下lg K'(ZnY)为----------------------------------------------------------------------------------------- ( ) [已知lg K(ZnY)=16.5]
(A) 8.9 (B) 11.8 (C) 14.3 (D) 11.3
2分(0706)
0706
(D)
1分(0707)
0707
αM(L)=1表示---------------------------------------------------------------------------------------( )
(A) M与L没有副反应(C) M与L的副反应相当严重
(C) M的副反应较小(D) [M]=[L]
1分(0707)
0707
(A)
2 分(0716)
EDTA滴定金属离子,准确滴定(E t<0.1%)的条件是----------------------------------------( )
(A) lg K(MY)≥6.0 (B) lg K'(MY)≥6.0 (C) lg[c计K(MY)]≥6.0 (D) lg[c计K'(MY)]≥6.0
2 分(0716)
(D)
2分(0730)
0730
已知乙二胺(L)与Ag+形成络合物的lgβ1-lgβ2分别是4.7与7.7。则AgL为络合物主要形式时pL范围是____________________。而pL为5.0时银的主要形式是_________。
2分(0730)
0730
3.0 < pL <
4.7 , Ag+
2 分(0740)
10.05 mL 0.02000 mol/L EDTA溶液与10.00 mL 0.02000 mol/L Pb(NO3)2溶液混合[lg K(PbY)=18.0, pH=5.0时lgαY(H)=6.5], 未络合的Pb2+的浓度为________________mol/L。
2 分(0740)
10-9.2 (或6.3×10-10)
10分(0746)
0746
在1L NH3-NH4Cl的缓冲溶液中,含0.10 mol Zn2+-EDTA络合物,溶液的pH=9.0,[NH3]=0.10 mol/L,计算Zn2+的浓度。已知lg K(ZnY)=16.5;锌氨络离子的lgβ1 -lgβ4分别为2.27,4.61,7.01,9.06; pH=9.0时lgαY(H) =1.3。
10分(0746)
0746
αZn(NH3) =1+10-1.00+2.27 +10-2.00+4.61 +10-3.00+7.01 +10 -4.00+9.06
=105.1
lg K'(ZnY) = 16.5-5.1-1.3=10.1
pZn'计=(10.1+1.0)/2=5.6
[Zn'] 10-5.6
[Zn2+]=───── =──── =10-10.7 (mol/L)
αZn 105.1
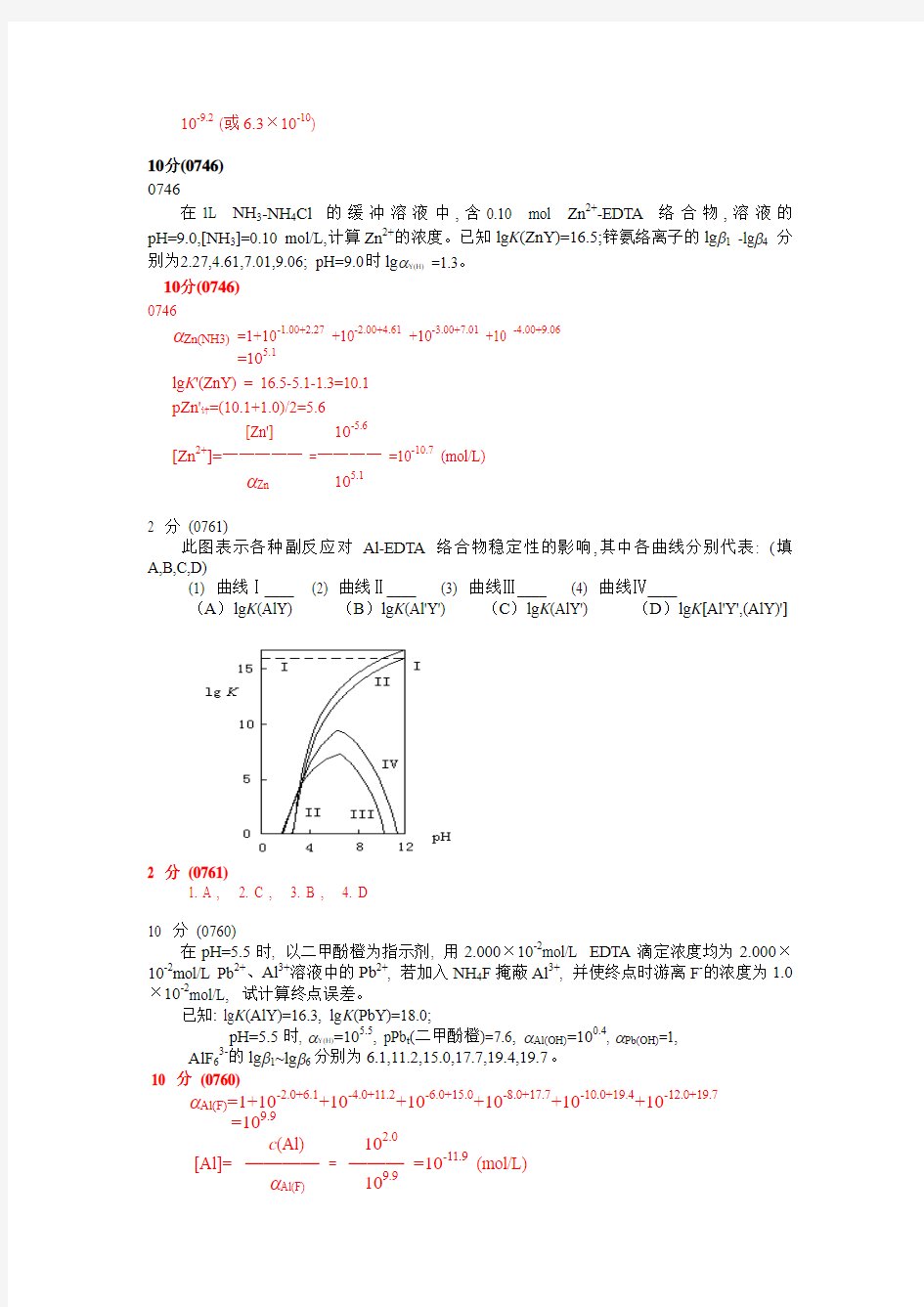
2 分(0761)
此图表示各种副反应对Al-EDTA络合物稳定性的影响,其中各曲线分别代表: (填A,B,C,D)
(1) 曲线Ⅰ____ (2) 曲线Ⅱ____ (3) 曲线Ⅲ____ (4) 曲线Ⅳ____
(A)lg K(AlY) (B)lg K(Al'Y') (C)lg K(AlY') (D)lg K[Al'Y',(AlY)']
2 分(0761)
1. A ,
2. C ,
3. B ,
4. D
10 分(0760)
在pH=5.5时, 以二甲酚橙为指示剂, 用2.000×10-2mol/L EDTA滴定浓度均为2.000×10-2mol/L Pb2+、Al3+溶液中的Pb2+, 若加入NH4F掩蔽Al3+, 并使终点时游离F-的浓度为1.0×10-2mol/L, 试计算终点误差。
已知: lg K(AlY)=16.3, lg K(PbY)=18.0;
pH=5.5时, αY(H)=105.5, pPb t(二甲酚橙)=7.6, αAl(OH)=100.4, αPb(OH)=1, AlF63-的lgβ1~lgβ6分别为6.1,11.2,15.0,17.7,19.4,19.7。
10 分(0760)
αAl(F)=1+10-2.0+6.1+10-4.0+11.2+10-6.0+15.0+10-8.0+17.7+10-10.0+19.4+10-12.0+19.7 =109.9
c(Al) 102.0
[Al]= ────= ───=10-11.9 (mol/L)
αAl(F) 109.9
αY(Al)=1+[Al3+]K(AlY)=1+10-11.9+16.3
=104.4《αY(H)(105.5)
αY=105.5
lg K'(PbY)=18.0-5.5=12.5, pPb计=(12.5+2)/2=7.3
?pPb=7.6-7.3=0.3
100.3-10-0.3
E t = ───────×100%=7×10-4%
(1012.5-2.0)1/2
10 分(0752)
试计算在pH=10.0的氨性缓冲溶液中, 设化学计量点时[NH3]=0.10 mol/L, 用0.0200 mol/L EDTA溶液滴定0.0200 mol/L Zn2+溶液时,化学计量点的pZn和pZn'值。
[lg K(ZnY)=16.5;pH=10.0时lgαY(H)=0.5, lgαZn(OH)=2.4,
Zn(NH3)42+的lgβ1~lgβ4分别是2.37、4.81、7.31、9.46]
10 分(0752)
αZn(NH3) = 1+10-1.00+2.37+10-2.00+4.81+10-3.00+7.31+10-4.00+9.46
=105.5
αZn=105.5+102.4=105.5
pZn'=(lg K(ZnY)-lgαY(H)-lgαZn+p c(Zn)) /2
=(16.5-0.5-5.5+2.0)/2=6.3
pZn=pZn'+lgαZn=6.3+5.5=11.8
10 分(0755)
以0.02000mol/L EDTA滴定浓度均为0.02000 mol/L Pb2+、Ca2+混合液中的Pb2+, 溶液pH 为5.0。计算:
(1) 化学计量点时的lg K'(PbY)和[Pb2+]、[CaY]值。
(2) 若以二甲酚橙为指示剂,此时[CaY]是多大?
已知pH=5.0时lgαY(H)=6.6、pPb终=7.0(二甲酚橙);lg K(PbY)=18.0, lg K(CaY)=10.7。
10 分(0755)
0755
αY(Ca)=1+10-2+10.7=108.7 >αY(H)
αY≈108.7
(1). lg K'(PbY) = 18.0-8.7 = 9.3
pPb计= (9.3+2.0)/2 = 5.7 = pY'计= pCaY计
[Pb2+]计= [CaY]计= 10-5.7(mol/L)
(2).
[PbY] 10-2.0
[CaY]终= [Y']终= ─────= ──────=10-4.3(mol/L)
[Pb]K'PbY10-7.0+9.3
或pCaY终= pY'终= pY'计+?pY = 5.7-1.3 = 4.4
2分(0802)
0802
以下表述正确的是--------------------------------------------------------------------------------( )
(A)二甲酚橙指示剂只适于pH>6时使用
(B)二甲酚橙既可适用于酸性也适用于弱碱性溶液
(C)铬黑T指示剂只适用于酸性溶液
(D)铬黑T指示剂适用于弱碱性溶液
2分(0802)
0802
1分(0804)
0804
用EDTA滴定Mg2+,采用铬黑T为指示剂,少量Fe3+的存在将导致-------------------( )
(A)终点颜色变化不明显以致无法确定终点
(B)在化学计量点前指示剂即开始游离出来,使终点提前
(C)使EDTA与指示剂作用缓慢,终点延长
(D)与指示剂形成沉淀,使其失去作用
1分(0804)
0804
(A)
2 分(0805)
铬黑T在溶液中存在下列平衡,它与金属离子形成络合物显红色,
p K a2=6.3 p K a3=11.6
H2In-HIn2-In3-
紫红蓝橙
使用该指示剂的酸度范围是--------------------------------------------------------------------------( )
(A) pH < 6.3 (B) pH > 11.6
(C) pH = 6.3~11.6 (D) pH = 6.3±1
2 分(0805)
(C)
2分(0806)
络合滴定中,若E t≤0.1%、?pM=±0.2,被测离子M 浓度为干扰离子N浓度的1/10, 欲用控制酸度滴定M,则要求lg K(MY) -lg K(NY)大于-----------------------------------------( )
(A) 5 (B) 6 (C) 7 (D) 8
2 分(0806)
(C)
1分(0811)
0811
在Fe3+,Al3+,Ca2+,Mg2+混合液中,用EDTA法测定Fe3+,Al3+含量时,为了消除Ca2+,Mg2+的干扰,最简便的方法是---------------------------------------------------------------------------( )
(A)沉淀分离法(B)控制酸度法
(C)络合掩蔽法(D)溶剂萃取法
1分(0811)
0811
(B)
1分(0819)
0819
EDTA与金属离子络合时,一分子的EDTA可提供的配位原子数是------------------( )
(A) 2 (B) 4 (C) 6 (D) 8
1分(0819)
0819
2 分(0820)
金属指示剂PAN 在溶液中有如下平衡:
p K a1=1.9 p K a2=12.2
H2In+HIn In-
黄绿黄粉红
它与金属离子形成的络合物MIn为红色, 当使用PAN作指示剂时, pH范围应是__________。
若使用PAN-Cu指示剂以EDTA溶液滴定Ca2+, 化学计量点前溶液是________ 颜色, 化学计量点后溶液呈_________颜色。
2 分(0820)
2.0~12.0
紫红(红色+蓝色) 绿(黄色+蓝色)
2分(0830)
0830
已标定好的EDTA标液若长期贮存于软玻璃容器中会溶解Ca2+,若用它去滴定铋,则测得铋含量将__________。(指偏高、偏低或无影响)
2分(0830)
0830
无影响
10分(0841)
0841
在pH=5.5时使用0.020 mol/L HEDTA(X)滴定同浓度Zn2+,Cd2+试液中的Zn2+,以KI掩蔽Cd2+,采用二甲酚橙为指示剂,
已知: lg K(ZnX)=14.5, lg K(CdX)=13.0,
pH=5.5时: lgαX(H)=4.6、pZn t(二甲酚橙)=5.7。
已计算得: lgαCd(I)=5.1 lgαX(Cd)=5.9
lg K(ZnX')=8.6 pZn计=5.3 E t=+0.1%
请根据以上数据完成下表(单位均为mol/L)
[X'] [X] [Cd2+ ]
化学计量点
终点
10分(0841)
0841
[X'] [X] ∑[H i X] [Cd2+]
i=1~3
化学计量点10-5.310-11.210-6.610-7.1
终点10-4.910-10.810-6.210-7.1
提示:化学计量点时[X ']=[Zn]=10-5.3(mol/L)
10-5.3
[X] =────── = 10-11.2(mol/L)
105.9
∑[H i X] = 10-11.2+4.6=10-6.6(mol/L)
[C Cd] 10-2
[Cd2+]=──── =──── = 10-7.1(mol/L)
αCd(Ⅰ)105.1
终点时?pX = -?pZn = -(5.7-5.3) = -0.4
终点时[X]、∑[H i X]、[X']比相应形式在化学计量点的浓度大100.4;
而终点与化学计量点的lgαCd(Ⅰ)一致,故终点与化学计量点的[Cd2+]相同
10分(0842)
0842
用2×10-2mol/L EDTA滴定同浓度Zn2+,Al3+混合液中的Zn2+,以磺基水杨酸(H2L)掩蔽Al3+。若终点时pH为5.5,未络合的磺基水杨酸总浓度为0.01 mol/L ,选二甲酚橙为指示剂。(1)计算终点误差(2)计算化学计量点时∑[H i Y]值
[lg K(ZnY)=16.5, lg K(AlY)=16.1, H2L的p K a1=2.6, p K a2=11.6;
Al-L的lgβ1~lgβ3分别为12.9,22.9,29.0 ;
pH=5.5时,lgαY(H)=5.5, pZn终(二甲酚橙)=5.7]
10分(0842)
0842
(1)αL(H)=1+10-5.5+11.6+10-11+14.2=106.1
10-2
[L]=─── =10-8.1(mol/L)
106.1
αAl(L)=1+10-8.1+12.9+10-16.2+22.9+10-24.3+2.9 =106.7
10-2
[Al]=─── =10-8.7(mol/L)
106.7
αY(Al)=1+10-8.7+16.1=107.4>αY(H)
αY=αY(Al)=107.4
lg K(ZnY')=16.5-7.4=9.1 pZn计=(9.1+2.0)/2=5.6
100.1-10-0.1
?pZn=5.7-5.6=0.1 E t=────────×100%=+0.01 %
10(9.1-2.0)/2
(2)化学计量点时[Y']=[Zn]=10-5.6
[Y'] 10-5.6
[Y] =──── =────── = 10-13.0
αY(Al)107.4
∑[H i Y]=[Y]αY(H)=10-13.0+5.5=10-7.5(mol/L)
i=1-6
10分(0843)
0843
在pH=5.0的六次甲基四胺缓冲溶液中,用0.02000 mol/L EDTA滴定浓度均为0.02000 mol/L的Pb2+,Ca2+液中的Pb2+,以二甲酚橙为指示剂,计算终点误差并填写下表(单位均为
mol/L)
[Pb] [Y] [CaY]
化学计量点
终点
[已知lg K(PbY)=18.0, lg K(CaY)=10.7, pH=5.0时: lgαY(H)=6.6、pPb t(二甲酚橙)=7.00]
10分(0843)
0843
αY(Ca)≈10-2.0+10.7=108.7>αY(H)
αY≈αY(Ca)=108.7
lg K(PbY')=18.0-8.7=9.3 pPb计=(9.3+2.0)/2=5.7=p[CaY]计
101.3-10-1.3
?pPb=7.0-5.7=1.3 E t=────────×100%=+0.4%
10(9.3-2.0)/2
[Y]计=[CaY]/αY(Ca)=10-5.7/108.7=10-14.4(mol/L)
[Pb] [Y] [CaY]
化学计量点10-5.710-14.410-5.7
终点10-7.010-13.110-4.4
求终点[Y]和[CaY]:
方法1.由pPb值求: ?pPb=-?pY=1.3故终点[Y][CaY]均较化学计量点时相应形式浓度大101.3倍
[PbY]
方法2.由K(PbY)=─────式求[Y],再求[CaY]
[Pb][Y]
10-2.0
[Y]=────── =10-13.0 (mol/L) (与方法1差别系舍入误差引起的)
1018.0-7.0
[CaY]=1010.7-2-13.0=10-4.3(mol/L)
10分(0844)
0844
在pH=5.0时以二甲酚橙作指示剂用2.000×10-2mol/L EDTA滴定浓度皆为2.000×10-2mol/L的Pb2+,Zn2+,Ca2+混合液中的Pb2+,用邻二氮菲(phen)掩蔽Zn2+,已知终点时过量的phen总浓度为10-2.0mol/L ,评价Zn2+被掩蔽的效果并计算终点误差(忽略加掩蔽剂后的体积变化)。
已知: lg K(PbY)=18.0, lg K(ZnY)=16.5, lg K(CaY)=10.7,
Zn-phen络合物的lgβ3=17.6, phen质子化常数lg=5.0,
pH=5.0时pPb t(二甲酚橙)=7.0、lgαY(H)=6.6。
10分(0844)
0844
αphen(H) =1+10-5.0×105.0=100.3
[phen]=10-2.0/100.3=10-2.3(mol/L)
αZn(phen)=1+10-6.9×1017.6=1010.7
[Zn2+]=10-2.0/1010.7=10-12.7(mol/L)
αY(Zn)=1+10-12.7+16.5=103.8≤αY(H)
(掩蔽很好)
αY(Ca)=1+10-2.0+10.7=108.7>αY(H)
lg K'(PbY)=18-8.7=9.3 pPb计=(9.3+2)/2=5.7
?pPb=7.0-5.7=1.3 101.3-10-1.3
E t=────────×100%=0.5%
──────
√ 10-2·109.3
10分(0845)
0845
a.用2×10-2 mol/L EDTA可否准确滴定同浓度M,N混合液中的M离子?
b.若加入掩蔽剂A并调节pH=8.0。已知终点未络合的掩蔽剂浓度c(A)=0.20 mol/L。问滴定M离子的准确度能否达到E t≤0.1%? (假如能选择到好的指示剂并在终点情况下N离子与指示剂不显色)
已知lg K(MY)=20.0 , lg K(NY)=18.0
H2A的p K a1=5.0、p K a2=8.0
A与M离子络合物的lgβ1=2.0、lgβ2=5.0,
A与N离子络合物的lgβ1=5.0、lgβ2=10.0,
pH=8.0时lgαY(H)=2.3。
10分(0845)
0845
a. lg K(MY)-lg K(NY)=20.0-18.0=2.0<6.0所以不能准确滴定M离子
b.αA(H)=1+108.0×10-8.0+108.0+5.0×10-16.0=2
[A2-]=0.20/2=0.10
αM(A) =1+102.0×10-1.0+105.0×10-2.0=1+10+103.0≈102.0
αN(A) =1+105.0×10-1.0+1010.0×10-2.0=1+104.0+108.0≈108.0
[N]=10-2.0/108.0=10-10.0 (mol/L)
αY(N)=1+1018.0×10-10.0=108.0
αY=102.3+108.0-1≈108.0
lg K'(MY)=20.0-3.0-8.0=9.0
lg K'(MY)=9.0>8.0 故此条件下能准确滴定M离子
5分(0857)
0857
在Al3+,Zn2+,Mg2+共存的酸性溶液中欲测定Mg2+,试指出以下分析步骤中的错误之处(简述理由),并改正之
“吸取一定量试液于锥形瓶中,加入10%KCN 1 mL,以NaOH溶液调试液的pH约为10,加入1:3三乙醇胺15mL,再加入0.2%二甲酚橙指示剂2~3滴,以EDTA标准溶液滴至溶液由红紫变亮黄色为终点。”
5分(0857)
0857
1.不能在酸性液中加KCN,否则生成剧毒挥发HCN气体。应当先调至碱性后加KCN
2.三乙醇胺应当在酸性中加入,否则Al3+水解不与三乙醇胺络合
3.不该用NaOH,而采用NH3调pH至10,因前者不具缓冲作用
4.测定Mg2+应采用铬黑T而不是二甲酚橙作指示剂
2分(2715)
2715
将2×10-2mol/L NaF溶液与2×10-4mol/L Fe3+的强酸性溶液等体积混合后,溶液的pH=1.0。此时铁络合物的主要存在形式是------------------------------------------------------( ) (已知HF的p K a=3.2, Fe3+-F-络合物的lgβ1~lgβ3分别为5.3,9.3, 12.1)
(A) FeF2+(B) FeF3(C) FeF2+和FeF3(D) FeF2+
2分(2715)
2715
(D)
2分(2721)
2721
在pH=10的氨性缓冲溶液中,以铬黑T为指示剂用EDTA滴定Mn2+,加入酒石酸或三乙醇胺的目的是______________________,加入抗坏血酸的目的是_____________。
2分(2725)
2分(2721)
2721
作辅助络合剂防止Mn(OH)2沉淀, 作还原剂防止生成能氧化铬黑T的Mn3+
2725
若络合滴定反应为
M + Y = MY
L││H+
ML H i Y(i=1~6)
则酸效应系数αY(H)的定义式为__________________,络合效应系数αM(L)的定义式为_________________________。
2分(2725)
2725
αY(H)=[Y']/[Y], αM(L)=[M']/[M]
2分(2728)
2728
金属离子M与络合剂L形成逐级络合物,溶液中各种存在型体的分布系数x与络合剂的平衡浓度________;与金属离子的总浓度________。(答有关或无关)
2分(2728)
2728
有关; 无关
2分(2729)
2729
EDTA的酸效应曲线是__________的关系曲线,pH越小,则________越大。
2分(2729)
2729
lgαY(H)~pH , lgαY(H)
2分(2730)
2730
乙二胺四乙酸是四元弱酸,它在强酸性溶液中为____元酸,这是因为________________ _____________________________________。
2分(2730)
2730
六, 分子中两个氨基上的氮原子具有孤对电子,在强酸性溶液中接受两个质子,故为六元酸。
5分(2731)
2731
某生采用以下方法测定溶液中Ca2+的浓度,请指出其错误。先用自来水洗净250mL锥形瓶,用50 mL容量瓶量取试液倒入锥形瓶中,然后加少许铬黑T指示剂,用EDTA标准溶液滴定。
33.在络合滴定中,什么叫络合剂的酸效应?试以乙二胺四乙酸二钠(Na2H2Y)为例,列出计算EDTA酸效应系数αY(H)的数学表达式。
5分(2731)
2731
络合剂一般为有机弱酸配位体,由于H+存在(或酸度提高)使配位体参加主反应(或滴定反应)的能力降低,这一现象称为酸效应。
αY(H)=1+β1[H+]+β2[H+]2+…+β6[H+]6
或[H+] [H+]2[H+]6
αY(H)=1+─── +─────── +…+───────────
K a 6K a 6·K a 5K a6·K a5·…·K1
2分(2757)
2757
用EDTA滴定Bi3+,Fe3+混合溶液中Bi3+的含量时,为了消除Fe3+干扰,可加入______作为掩蔽剂。若用EDTA滴定含有大量Ca2+,Mg2+和少量Fe3+的溶液中Ca2+,Mg2+含量时,消除Fe3+的干扰可加入________作为掩蔽剂。
2分(2757)
2757
抗坏血酸, 三乙醇胺
2分(2765)
2765
若以金属锌为基准物,以二甲酚橙为指示剂标定EDTA,而配制EDTA的水中含有Ca2+,用此标定后的EDTA测定CaCO3试剂纯度,其结果______。(指偏高,低或无影响)
2分(2765)
2765
高
2 分(2749)
在一定条件下,以0.020mol/L EDTA溶液滴定等浓度的金属离子M。设其条件稳定常数K'(MY)=108.0,当滴定误差E t=±0.1%时,滴定突跃范围有_________个pM单位。
2 分(2749)
0.4
2 分(2724)
在含有酒石酸(A)和KCN的氨性缓冲液中以EDTA滴定Pb2+,Zn2+混合液,在化学计量点时铅存在的主要形式是____________,锌存在的主要形式是_________。
2 分(2724)
PbY, Zn(CN)42-
2 分(2720)
在如下络合滴定反应中
M + Y = MY
L /\ OH
ML M(OH)
ML2M(OH)2
化学计量点时[M']=_________________, c(M)=_________________。
2 分(2720)
[ML]+[ML2]+[M(OH)]+[M(OH)2]+[M]
[MY]+[ML]+[ML2]+[M(OH)]+[M(OH)2]+[M]
2分(2770)
2770
将PO43-沉淀为MgNH4PO4,将沉淀过滤洗涤后溶于酸,用EDTA滴定时须采用回滴法,其原因是________________________________________________________。
2分(2770)
2770
滴定Mg2+必须在pH 10时进行,此时MgNH4PO4将又重新沉淀致使无法滴定,故需先加EDTA络合,再调pH,而后再回滴之。
2分(2774)
2774
已知Ag+, Ni2+与EDTA络合物的稳定常数分别为lg K(AgY)=7.8, lg K(NiY)=18.6, Ag+-CN-络合物的lgβ2=21.1,Ni2+-CN络合物的lgβ4=31.3。于含Ag+的试液中加入过量Ni(CN)42-络合物,然后在pH=10的缓冲溶液中以EDTA溶液滴定置换出的Ni2+量。在上述置换反应中,Ag+与Ni2+的物质的量之比n(Ag) : n(Ni)为________。
2分(2774)
2774
2:1
2分(2287)
2287
对某试样进行多次平行测定,各单次测定的偏差之和应为;而平均偏差
应 。 2分(2287) 2287
0,不为0(或填各偏差绝对值之和除以测定次数)
5分 (4704) 4704
已知金属离子M 2+-NH 3络合物的lg β1~lg β4分别为2.0,5.0,7.0,10.0;M 2+
-OH -络合物的lg β1~lg β4分别为4.0, 8.0, 14.0, 15.0。( 1 )在0.10 mol / L M 2+溶液中滴加氨水,使其中游离氨浓度为0.010 mol / L ,pH = 9.0,溶液中M 2+的主要存在形式是哪一种?其浓度为多少?( 2 )若将上述M 2+溶液用NaOH 和氨水调节至pH = 13.0其中游离氨浓度为0.010 mol / L ,溶液中的主要存在形式是什么? 5分(4704) 4704
解:( 1 ) αM(NH3) = 1 +β1[NH 3] +…… +β4[NH 3]4 = 1 + 102.0? 10-2.0 + 105.0? 10-4.0 + 107.0? 10-6.0 + 1010.0? 10-8.0 = 122
αM(OH) = 1 +β1[OH] + +β4[OH]4 = 1 + 104.0? 10-5.0 + 108.0?10-10.0 + 1014.0? 10-15.0 + 1015.0? 10-20.0≈ 1
αM(NH3) >>αM(OH) ,由αM(NH3)可知,主要存在形式为M(NH 3)42+。 [ M(NH 3)42+ ] =β4[NH 3]4?c M /αM(NH3) = (102 / 122)? 0.10 = 8? 10-2 mol / L
( 2 )αM(OH) = 1 + 104.0? 10-1.0 + 108.0? 10-2.0 + 1014.0? 10-3.0 + 1015.0? 10-4.0 = 1011.3 αM(NH3) = 122 (同(1) ) <<αM(OH)
由αM(OH)可知,主要存在形式为M(OH)3-和M(OH)42-。
10分 (4736) 4736
欲在pH = 10.0的氨性缓冲溶液中,以2.0? 10-3 mol / L EDTA 滴定同浓度的Mg 2+,下列两种铬黑类的指示剂应选用哪一种? [已知铬黑A(EBA)的p K a 1 = 6.2 , p K a 2 = 13.0 , lg K (Mg-EBA) = 7.2; 铬黑T(EBT)的p K a 2 = 6.3 , p K a 3 = 11.6 , lg K (Mg-EBT) = 7.0; lg K (MgY) = 8.7; pH = 10.0时,lg αY(H) = 0.45 ] 10分(4736) 4736
lg K '(MgY) = 8.7 - 0.45 = 8.25
(pMg)计 =( 8.25 + 3.00 )/2 = 5.62
αEBA(H)= 1 + 10-10.0 + 13.0 + 10-20.0 + 13.0 + 6.2 = 103.0 (pMg)t (EBA) = lg K '(Mg-EBA) = 7.2 - 3.0 = 4.2 ?pMg = 4.2 - 5.62 = -1.42 (EBA) αEBT(H) = 1 + 10-10.0 + 11.6 + 10-20.0 + 11.6 + 6.3 = 101.6 (pMg)t (EBT) = lg K '(Mg-EBT) = 7.0 - 1.6 = 5.4 ?pMg = 5.4 - 5.62 = -0.22 (EBT)
因为?pM 越小,滴定误差越小,故应选用EBT 为指示剂。
5分 (4738) 4738
PAN在pH = 2~12范围内呈黄色,它与Cu2+等金属离子的络合物显红色,但它与Ca2+不显色。为此,在pH = 10~12时,加入适量的CuY,即可用PAN作为滴定Ca2+的指示剂,简述其原理。
5分(4738)
4738
在pH = 10~12含有Ca2+的溶液中,当加入CuY和PAN时,发生以下反应:
蓝色黄色红色
滴定之前,由于Ca2+置换出CuY中的Cu2+,进而生成Cu-PAN,故显红色。滴入EDTA时,先与Ca2+反应,当滴定至终点时,过量1滴EDTA即可从Cu-PAN中夺出Cu2+,生成CuY 和游离的PAN,终点时显浅绿色(蓝色+黄色)。故CuY和PAN可作为滴定Ca2+的指示剂。
10分(4743)
4743
以2.00? 10-2 mol / L EDTA滴定相同浓度Zn2+ , Al3+混合溶液中的Zn2+,pH= 5.5时,欲以KF掩蔽其中的Al3+,终点时游离KF的浓度为10-2.0mol / L。计算说明在此条件下能否准确滴定Zn2+?[已知HF的p K a = 3.18;pH = 5.5时, lgαY(H) = 5.5;Al3+-F-络合物的lgβ1~ lgβ6分别为6.1 , 11.2 , 15.0 , 17.7 , 19.6 , 19.7;lg K(ZnY) = 16.5 , lg K(AlY) = 16.1]
10分(4743)
4743
pH >> p K(HF) ,故[ F- ]终= 10-2.0 mol / L
αAl(F) = 1 +β1[F-] + +β6[F-]6
= 1 + 106.1? 10-2.0+ 1011.2? 10-4.0 + 1015.0? 10-6.0 + 1017.7? 10-8.0
+ 1019.6? 10-10.0 + 1019.7? 10-12.0
≈ 1010.0
[ Al3+ ] = c (Al3+) /αAl(F) = 1.00? 10-2 / 1010.0 = 10 -12.0 mol / L
αY(Al) = 1 + K(AlY) [ Al3+ ] = 1 + 1016.1? 10-12.0 = 104.1
αY =αY(H) +αY(Al) -1 = 105.5 + 104.1-1≈ 105.5
lg K'(ZnY) = lg K(ZnY) - lgαY = 16.5 - 5.5 = 11.0
lg [c计K'(ZnY)] = -2.0 + 11.0 = 9 >> 6,可以准确滴定Zn2+。
10分(4744)
4744
在pH = 2.5的溶液中,用0.5 mol / L H2C2O4掩蔽0.1 mol / L Fe3+,计算[Fe3+]。
[已知H2C2O4的p K a1 = 1.3 , p K a2 = 4.3,设形成Fe(C2O4)33-络合物的lgβ3= 18.5]
10分(4744)
4744
αC2O4(H) = 1 + 104.3? 10-2.5 + 105.6? 10-5.0 =101.8
因为题设生成Fe(C2O4)33-形式络合物
c(C2O42-) = 0.5 - 3? 0.1 = 0.2 mol / L
[ C2O42- ] = c(C2O42-) /αC2O4(H) = 0.2 /101.8 = 10-2.5mol /L
αFe(C2O4) = 1 +β3[C2O42- ]3 = 1 + 1018.5?10-2.5?3 =1011.0
[ Fe3+ ] = c(Fe3+) /αFe(C2O4)= 0.1/1011.0 = 10-12.0 mol / L
5分(4745)
4745
为了测定某污水中SO42-的含量,移取一定量的试液,加入pH = 10.5的氨性缓冲溶液,
然后加入过量的BaCl
2标准溶液,以铬黑T为指示剂,再用EDTA标准溶液进行返滴定。实
验表明,当用EDTA返滴定至蓝色终点时,稍过片刻,颜色立即返为紫红色,其原因何在?为了正确判断滴定终点并获得较好的准确度,应如何改进上述操作?
5分(4745)
4745
加入过量BaCl2后,溶液中存在如下沉淀平衡:
当用EDTA返滴定过量的Ba2+至蓝色终点时,BaSO4沉淀离解出的Ba2+又与铬黑T 显色,故又返为红紫色。为此,可将生成的BaSO4沉淀过滤、洗净,然后再取滤液进行返滴定,这样,就可正确判断终点并获得较好的准确度。
2分(4751)
4751
已知Cu2+-NH3络合物的lgβ1~lgβ4分别为4.30 , 8.0 ,11.0 ,13.30。在铜氨溶液中,铜的总浓度为1.0? 10-3mol / L,氨的总浓度为1.4? 10-2mol / L,则平衡时[ Cu(NH3)32+ ] = ___________ mol / L;[ Cu(NH3)42+ ] = ____________________ mol / L。
2分(4751)
4751
3.3? 10-4
6.7? 10-4
分析化学基础知识题库 一、填空题 1.?铬酸洗液的主要成分是(重铬酸钾)(浓硫酸)和(水),用于去除器壁残留(油污),洗液可重复使用. 2.洗液用到出现(绿色)时就失去了去污能力,不能继续使用. 3.比色皿等光学仪器不能使用(去污粉),以免损伤光学表面. 4.电烘箱烘干玻璃仪器的适宜温度为(105~120℃),时间为(1小时) 5.干燥器底部最常用的是(变色硅胶)和无水(氯化钙)硅胶可以烘干重复使用. 6.对于因结晶或碱金属盐沉积及强碱粘住的瓶塞,可把瓶口泡在(水)或(稀盐酸)中,经过一段时间可能打开. 7.安装精度要求较高的电子天平理想的室温条件是20±2℃,相对湿度为45~60%;理化室的温度应保持在(18~26℃)内,湿度应保持在(55~75%) 。 8.化验室内有危险性的试剂可分为(易燃易爆危险品)、(毒品)和(强腐蚀剂)三类. 9.在分析实验过程中,如找不出可疑值出现原因,不应随意(弃去)或(保留),而应经过数据处理来决定(取舍) 。 10.准确度的大小用(误差)来表示,精密度的大小用(偏差)来表示. 11.化验室大量使用玻璃仪器,是因为玻璃具有很高的(化学稳定性)?(热稳定性)、有很好的(透明度)、一定的(机械强度)和良好绝缘性能. 12.带磨口的玻璃仪器,长期不用时磨口应(用纸垫上)以防止时间久后,
塞子打不开. 13.滤纸分为(定性)滤纸和(定量)滤纸两种,重量分析中常用(定量). 14.放出有毒,有味气体的瓶子,在取完试剂后要(盖紧塞子),还应该用(蜡)封口 15.滴定管使用前准备工作应进行(洗涤)(涂油)(试漏)(装溶液)和(赶气泡)五步. 16.玻璃仪器的干燥方式有(晾干)(烘干)(热或冷风吹干)三种. 17.石英玻璃的化学成份是(二氧化硅),耐(酸)性能好,能透过(紫外线),在分析仪器中常用来作紫外范围应用的光学元件. 18. 不同试样的分解要采用不同的方法,常用的分解方法大致可分为(溶解)和(熔融)两种. 19. 溶解试样时就是将试样溶解于(水)(酸)(碱)或其它溶剂中. 20. 熔融试样就是将试样与(固体熔剂)混合,在高温下加热,使欲测组分转变为可溶于(水)或(酸)的化合物. 21. 用氢氟酸分解试样应在(铂)或(聚四氟乙烯塑料)器皿中进行.. 22. 重量分析的基本操作包括样品(溶解)、(沉淀)、过滤、(洗涤)、(干燥)和灼烧等步骤. 23. 重量分析中使用的滤纸分(定性)滤纸和(定量)滤纸两种,重量分析中常用(定量)滤纸进行过滤,又称为(无灰)滤纸. 24. 玻璃砂芯漏斗在使用前,先用(强酸)处理,然后再用(水)洗净,洗涤时,通常采用(抽滤)法,该漏斗耐(酸),不耐(碱). 25. 干燥器底部放干燥剂,最常用的干燥剂是(变色硅胶)和(无水氯
分析化学试卷一 学号:________ 姓名:________ 年级:________ 专业:________ 成绩:________ 一、填空题,每空1分,共15分 1、有效数字是________。 2、在实际溶液中,除M n+外,还常存在M(OH)n-i i (i=1~n)等络离子,故氢氧化物的实际溶解度比计算值 。 3、采用________方法,可将沉淀表面上的抗衡离子部分除去。 4、有限次测量数据的分布规律可用________表示。 5、Fe(OH)3重量法测得Fe 3+时,宜用__________为洗涤液。 6、在重量分析中,洗涤无定形沉淀的洗涤液应该是___________。 7、盐效应会使沉淀的溶解度________。 8、报告分析结果时,不可缺少的三个参数是_________。 9、在络合滴定中,所用的EDTA 溶液是Na 2H 2Y 溶液,其pH 的计算式是___________。 10、以Al(OH)3为载体使Fe 3+和TiO 2+共沉淀是__________共沉淀。 11、沉淀滴定法中,常用________作为基准物质标定AgNO 3溶液。 12、频数分布形象直观地表示出测量值________的统计规律。 13、已知V Fe Fe 68.023/'=++-θ?,V Sn Sn 14.024/'=++-θ?,0.050mol?L -1 SnCl 210mL 与0.10mol?L -1 FeCl 320mL 相混合,平衡时体系的电位是_________V 。 14、在纯水中加入一些酸,则溶液中[H +]与[OH -]的乘积将_______。 15、已知V Cu Cu 159.0/2=++-θ?,K spCuI =1.1× 10-12,则=+-CuI Cu /2θ?_______。 第2部分:单选题,每题2分,共32分 1、 以下试剂能作为基准物的是-------------------------------------------( ) (A) 分析纯CaO (B) 分析纯SnCl 2·2H 2O (C) 光谱纯三氧化二铁 (D) 99.99%金属铜 2、 每100 mL 人体血浆中,平均含K +18.0mg 和Cl -365 mg 。已知M (K +)= 39.1 g/mol, M (Cl -) = 35.5 g/mol 。血浆的密度为1.0 g/mL 。则血浆中K +和Cl -的浓度为--------------------------( ) (A) 1.80 ×10-1和3.65 mol/L (B) 7.04×10-3和1.30×10-1 mol/L (C) 4.60×10-3和1.03×10-1 mol/L (D) 4.60×10-6和1.03×10-4 mol/L 3、以下试剂能作为基准物质的是: A. 优级纯NaOH B. 干燥过的分析纯CaO C. 分析纯SnCl 2·2H 2O D. 光谱纯三氧化二铁 E. 99.99%的金属铜 4、待测组分在试样中的相对含量在0.01~1%范围内的分析为: A. 痕量组分分析 B. 微量组分分析 C. 微量分析 D. 半微量分析 5、下列关于滴定度的叙述,正确的是: A. 1g 标准溶液相当被测物的体积(ml) B. 1ml 标准溶液相当被测物的质量 C. 1g 标准溶液相当被测物的质量(mg) D. 1ml 标准溶液相当被测物的体积(ml) 6、半微量分析法试样的用量是: A. 大于1g 、10mL B. 0.01~0.1g 、0.01~1mL C. 0.01~0.1g 、1~10mL D. 0.1~10mg 、1~10mL 7、用同一KMnO 4标准溶液,分别滴定体积相等的FeSO 4和H 2C 2O 4溶液,已知耗去KMnO 4的体积相等, 则两溶液浓度关系是: A. C FeSO4=C H2C2O4FeSO4=C H2C2O4FeSO4=2C H2C2O4Fe2SO4=0.4C H2C2O4 8、 海水平均含1.08×103μg/g Na +和270 μg/g SO 42-,海水平均密度为1.02g/mL, 则海水中Na +和SO 42-浓度(mol/L)为----------------------------------------------------------------------------( ) 已知 A r (Na)=23.0, M r (SO 42-)=96.1 (A) 4.79×10-5, 2.87×10-6 (B) 1.10×10-3, 2.75×10-4
第二章 误差和分析数据处理 1、 指出下列各种误差是系统误差还是偶然误差?如果是系统误差,请区别方法误差、仪器和试剂误差或操作误差,并给出它们的减 免方法。 答:①砝码受腐蚀: 系统误差(仪器误差);更换砝码。 ②天平的两臂不等长: 系统误差(仪器误差);校正仪器。 ③容量瓶与移液管未经校准: 系统误差(仪器误差);校正仪器。 ④在重量分析中,试样的非被测组分被共沉淀: 系统误差(方法误差);修正方法,严格沉淀条件。 ⑤试剂含被测组分: 系统误差(试剂误差);做空白实验。 ⑥试样在称量过程中吸潮: 系统误差(操作误差);严格按操作规程操作。 ⑦化学计量点不在指示剂的变色范围内: 系统误差(方法误差);另选指示剂。 ⑧读取滴定管读数时,最后一位数字估计不准: 偶然误差;严格按操作规程操作,增加测定次数。 ⑨在分光光度法测定中,波长指示器所示波长与实际波长不符: 系统误差(仪器误差);校正仪器。 ⑩在HPLC 测定中,待测组分峰与相邻杂质峰部分重叠 系统误差(方法误差);改进分析方法 6、两人测定同一标准试样,各得一组数据的偏差如下: ② 为什么两组数据计算出的平均偏差相等,而标准偏差不等; ③ 哪组数据的精密度高? 解:①n d d d d d 321n ++++= 0.241=d 0.242=d 1 2 i -∑= n d s 0.281=s 0.312=s ②标准偏差能突出大偏差。 ③第一组数据精密度高。 7、测定碳的相对原子质量所得数据:12.0080、12.0095、12.0099、12.0101、12.0102、12.0106、12.0111、12.0113、12.0118及12.0120。求算:①平均值;②标准偏差;③平均值的标准偏差;④平均值在99%置信水平的置信限。 解:① 12.0104i =∑=n x x ②0.00121 )(2 i =--∑= n x x s ③0.00038 == n s s
《水分析化学-1》理论课讲稿
第一次课(2h) 一、自我介绍 二、课程介绍 1、提问: (1)纯净水、自来水、地下水、矿泉水、河湖水、海水、城市污水等本质的区别是什么?科学的鉴别方法是什么? (2)环境水体质量如何表征?水中有哪些污染物?含量是多少?对环境、生物有没有危害?(3)城市给水、污水处理工艺的确定依据是什么?处理效果的如何评定? 春秋时的管子称:“水者,何也?万物之本原,诸生之宗室也”(《管子·水地篇》) 2、课程定位 ?给水排水工程专业的专业技术基础课,是专业指导委员会指定十门骨干课程之一。 ?教学时数56学时,其中课堂教学40学时,实验教学16学时。 ?先修课程:普通化学、有机化学和物理化学 3、水分析化学课程的学习目标:“6、2、1“ ?掌握6个基本点:基本概念、理论、原理、方法、操作、技能 ?注重2个培养:注重培养严谨的科学态度、培养独立分析和解决分析化学中实际问题的能力——分析数据是决策依据和技术参考 ?树立1个“量”概念:强化并树立准确“量”的观念——避免工作失误 4、本课程与传统分析化学的关系 建立在传统分析化学基础之上,以水质指标体系为讲授脉络,突出水质指标的工程应用地位,由水质分析技术引出相关的分析化学理论内容。 5、授课内容及安排
?*第1章绪论(6h) ?*第2章酸碱滴定法(4h) ?*第3章络合滴定法(4h) ?阶段复习与习题课(2h) ?第4章沉淀滴定法(2h) ?*第5章氧化还原滴定法(6h) ?容量分析法总结与讨论(2h) ?*第6章吸收光谱法(4h) ?第7章电化学分析(2h) ?*第8章色谱法与原子吸收光谱法(6h) ?总复习(2h) 注:带星号章节为重点内容。 6、实验内容及安排 ?实验一分析天平的称量练习(2h) ?实验二滴定分析基本操作(2h) ?实验三水中碱度的测定(酸碱滴定法)(2h) ?实验四水中硬度的测定(络合滴定法)(2h) ?实验五水中Cl-的测定(沉淀滴定法) (2h) ?实验六水中溶解氧的测定(或BOD5)(2h) ?实验七水中高锰酸盐指数的测定(2h) ?实验八分光光度法测水中的铁(2h) 7、教学方式
分析化学第六版分析化学模拟试题及答案 Newly compiled on November 23, 2020
分析化学模拟试题(一) 班级姓名分数 一、选择题 ( 共19题 38分 ) 1、下列情况中哪个不属于系统误差: ( ) A、定管未经过校正 B、所用试剂中含干扰离子 C、天平两臂不等长 D、砝码读错 2、下列溶液用酸碱滴定法能准确滴定的是 ( ) A、 mol/L HF (p K a = B、 mol/L HCN (p K a = C、 mol/L NaAc [p K a(HAc) = ] D、 mol/L NH4Cl [p K b(NH3) = ] 3、摩尔法测定Cl-含量时,要求介质在pH=~范围内,若酸度过高则会: ( ) A、AgCl沉淀不完全 B、形成Ag2O的沉淀 C、AgCl吸附Cl- D、Ag2CrO4沉淀不易生成 4、下列物质中,不能直接配制标准溶液的是:( ) A、K2Cr2O7 B、KMnO4 C、As2O3 D、H2C2O4·2H2O 5、下列各数中有效数字位数为四位的是:( ) A、w CaO=% B、[H+]= mol/L C、pH= D、420Kg 6、用mol·L-1HCl滴定mol·L-1NH3·H2O(PK b=的pH突跃范围为~,用mol·L-1HCl滴定mol·L-1的某碱 (PK b=的pH突跃范围则是: ( ) A、~ B、~ C、~ D、~ 7、某三元酸pKa1=2,pKa2=6,pKa3=12。利用NaOH标准溶液滴定至第二个化学计量点时,指示剂选用 ( ) A、甲基橙 B、甲基红 C、酚酞 D.溴甲酚绿(变色范围~) 8、以甲基橙为指示剂,用HCl标准溶液标定含CO32- 的NaOH溶液,然后用此NaOH溶液测定试样中的HAc含量,则HAc含量将会() A、偏高 B、偏低 C、无影响 D、无法判断
分析化学试题及答案集团标准化办公室:[VV986T-J682P28-JP266L8-68PNN]
一、选择题(20分。 1.用法扬司法测Cl时,常加入糊精,其作用是 --------------------------(B ) A. 掩蔽干扰离子; B. 防止AgCl凝聚; C. 防止AgCl沉淀转化 D. 防止AgCl感光 2.间接碘量法中正确使用淀粉指示剂的做法是 ----------------------------( D ) A. 滴定开始时加入指示剂; B. 为使指示剂变色灵敏,应适当加热; C. 指示剂须终点时加入; D. 指示剂必须在接近终点时加入。3.螯合剂二乙三氨五乙酸(EDPA,用H 5 L表示)的五个p K a值分别为,,,和,溶液中组分HL4-的浓度最大时,溶液的pH值为 ------( D ) A. ; B. ; C. ; D. 。 4. K 2Cr 2 O 7 法测定铁时,哪一项与加入H 2 SO 4 -H 3 PO 4 的作用无关 ---------- ( C ) A.提供必要的酸度; B.掩蔽Fe3+; C.提高E(Fe3+/Fe2+); D.降低E(Fe3+/Fe2+)。 5.用BaSO 4重量分析法测定Ba2+时,若溶液中还存在少量Ca2+、Na+、CO 3 2-、Cl- 、H+和OH-等离子,则沉淀BaSO 4 表面吸附杂质为 ------------------------------( A ) A. SO 42-和Ca2+; B. Ba2+和CO 3 2-; C. CO 3 2-和Ca2+; D. H+和OH-。 6.下列各条件中何者不是晶形沉淀所要求的沉淀条件 ---------------------(A ) A.沉淀作用宜在较浓溶液中进行; B.应在不断的搅拌下加入沉淀剂; C.沉淀作用宜在热溶液中进行; D.应进行沉淀的陈化。 7.为了获得纯净而易过滤、洗涤的晶形沉淀,要求 ----------------------(A ) A.沉淀时的聚集速度小而定向速度大; B.沉淀时的聚集速度大而定向速度小; C.溶液的过饱和程度要大; D.沉淀的溶解度要小。 8. 决定正态分布曲线位置的是 --------------------------------------------------( C ) A. 总体标准偏差; B. 单次测量的平均偏差;
某三元酸H3A的p K a1= 3.96、p K a2= 6.00、p K a3= 10.02,则0.10 mol/L Na3A溶液的pH是-----------------------------------------------------------------------------------------------------------( ) (A) 8.01 (B) 10.02 (C) 11.51 (D) 12.51 (C) 2分(0302) HPO42-的共轭碱是---------------------------------------------------------------------------------( ) (A) H2PO4-(B) H3PO4(C) PO43-(D) OH- 2 分(0302) (C) 1分(0307) 0307 浓度相同的下列物质水溶液的pH最高的是----------------------------------------------( ) (A) NaCl (B) NaHCO3 (C) NH4Cl (D) Na2CO3 1分(0307) 0307 (D) 2 分(0309) 水溶液呈中性是指--------------------------------------------------------------------------------( ) (A) pH = 7 (B) [H+] = [OH-] (C) pH+pOH = 14 (D) pOH = 7 2 分(0309) (B) 2分(0314) 0314 某MA2型(M2+、A-)电解质溶液,其浓度c(MA2) = 0.10mol/L,则该溶液的离子强度为--------------------------------------------------------------------------------------------------------------( ) (A) 0.10 mol/L (B) 0.30 mol/L (C) 0.40 mol/L (D) 0.60 mol/L 2分(0314) 0314 (B) 2分(0321) 0321 在磷酸盐溶液中,HPO42-浓度最大时的pH是-----------------------------------------------( ) (已知H3PO4的解离常数p K a1 = 2.12, p K a2= 7.20, p K a3 = 12.36) (A) 4.66 (B) 7.20 (C) 9.78 (D) 12.36 2分(0321) 0321 (C) 2分(0339)
分析化学试卷一答案 一、填空(共15分每空1分) 1.用无水Na2CO3标定HCl溶液时,选用甲基橙作指示剂。若Na2CO3吸水,则测定结果偏高。 2.标定EDTA时,若选用铬黑T作指示剂,则应控制pH=10 。若选用二甲酚橙作指示剂,则应控制pH= 5 。 3.测定水的总硬度时用三乙醇胺掩蔽Fe3+、Al3+等少量共存离子。 4.50ml滴定管的最小分度值是0。1 ml,如果放出约20ml溶液时,记录数据为位有效数字。在滴定操作中左手控制滴定管,右手握锥形瓶。 5.铝合金中铝含量的测定中,在用Zn2+返滴定过量的EDTA后,加入过量的NH4F,使AlY-与F-发生置换反应,反应式为AlY-+6F-+2H+== AlF63-+H2Y2- 6.用移液管吸取溶液时,右手拿移液管,左手拿吸耳球,溶液上升至标线以上,迅速用食指按紧上口。 7.在定量转移中,当溶液由烧杯沿玻璃棒转移主容量瓶内,溶液流完后,将烧杯沿玻璃棒稍向上提。 二、选择(共10分每题1分) 1.用SO42-使Ba2+形成BaSO4沉淀时,加入适当过量的SO42-,可以使Ba2+沉淀的更完全,这是利用何种效应?( E ) A.盐效应; B.酸效应; C.络合效应; D.溶剂化效应; E.同离子效应. 2.用重铬酸钾法测定铁矿石中铁的含量时选用下列哪种还原剂?( A ) A.二氯化锡; B.双氧水; C.铝; D.四氯化锡. 3.用下列哪一标准溶液滴定可以定量测定碘?(D ) A.Na2S; B.Na2SO3; C.Na2SO4; D.Na2S2O3. 4.用含有微量杂质的草酸标定高锰酸钾浓度时,得到的高锰酸钾的浓度将是产生什么结
分析化学试题(A) 一、单项选择 1. 对某试样进行平行三次测定,得CaO平均含量为30.6%,而真实含水量为30.3%,则 30.6%-30.3%=0.3%为( b )。a. 相对误差 b. 绝对误差 c. 相对偏差 d. 绝对偏差 2. 氧化还原滴定的主要依据是( c )。 a. 滴定过程中氢离子浓度发生变化 b. 滴定过程中金属离子浓度发生变化 c. 滴定过程中电极电位发生变化 d. 滴定过程中有络合物生成 3. 根据置信度为95%对某项分析结果计算后,写出的合理分析结果表达式应为(b )。 a.(25.48?0.1)% b.(25.48?0.13)% c.(25.48?0.135)% d.(25.48?0.1348)% 4. 测定NaCl+Na3PO4中Cl含量时,选用(c )标准溶液作滴定剂。 a.NaCl b.AgNO3 c.NH4SCN d.Na2SO4 5. 欲配制1000ml 0.1mol/L HCl溶液,应取浓盐酸( b )。 a. 0.84ml b. 8.4ml c. 1.2ml d. 12ml 6. 已知在1mol/L H2SO4溶液中,MnO4-/Mn2+和Fe3+/Fe2+电对的条件电极电位分别为1.45V 和0.68V。在此条件下用KMnO4标准溶液滴定Fe2+,其化学计量点的电位值为(c )。
a. 0.73V b. 0.89V c. 1.32V d. 1.49V 7. 按酸碱质子理论,Na2HPO4是(d )。 a. 中性物质 b. 酸性物质 c. 碱性物质 d. 两性物质 8. 下列阴离子的水溶液,若浓度相同,则(b )碱度最强。 a. CN-(K CN头= 6.2?10-10) b. S2-(K HS- = 7.1?10-15, K H2S=1.3?10-7) c. F-(K HF = 3.5?10-4) d. CH3COO-(K HAc = 1.8?10-5) 9. 在纯水中加入一些酸,则溶液中( c )。 a. [H+][OH-]的乘积增大 b. [H+][OH-]的乘积减小 c. [H+][OH-]的乘积不变 d. [OH-]浓度增加 10. 以EDTA滴定Zn2+,选用( b )作指示剂。 a. 酚酞 b. 二甲酚橙 c. 二苯胺磺酸钠 d. 淀粉 11. 在吸光光度法中,透过光强度和入射光强度之比,称为(b )。 a. 吸光度 b. 透光率 c. 吸收波长 d. 吸光系数 12. 在EDTA络合滴定中,( b )。 a. 酸效应系数愈大,络合物的稳定性愈大 b. 酸效应系数愈小,络合物的稳定性愈大
2分(1301) 1301 下表中的各种试剂按其纯度从高到低的顺序是--------------------------------------------( ) 代号 1 2 3 4 规格分析纯化学纯实验纯优级纯 (A) 1 , 2 , 3 , 4 (B) 4 , 1 , 2 , 3 (C) 4 , 3 , 2 , 1 (D) 4 , 2 , 1 , 3 2分(1301) 1301 (B) 2分(1302) 1302 重量法测定铁时,过滤Fe(OH)3沉淀应选用--------------------------------------------------( ) (A)快速定量滤纸(B)中速定量滤纸 (C)慢速定量滤纸(D)玻璃砂芯坩埚 2分(1302) 1302 (A) 2分(1303) 1303 重量法测定氯时,过滤AgCl沉淀选用-------------------------------------------------------( ) (A)快速定量滤纸(B)中速定量滤纸 (C)慢速定量滤纸(D)玻璃砂芯坩埚 2分(1303) 1303 (D) 2分(1304) 1304 体积比为1:1的HCl溶液浓度为__________________ mol/L , 体积比为1:2的H2SO4溶液浓度为__________________ mol/L。 2分(1304) 1304 6 , 6 2 分(1305) 各级试剂所用标签的颜色为(填A,B,C,D) (1) 优级纯_____________ (A)红色 (2) 分析纯_____________ (B)黄色 (3) 化学纯_____________ (C)蓝色 (4) 实验试剂____________ (D)绿色 2 分(1305) 1. D 2. A 3. C 4. B
一、选择题(每小题 1 分,共20 分) 1、在滴定分析法测定中出现的下列情况,哪种导致系统误差( D ) A 试样未经充分混匀; B 滴定管的读数读错; C 滴定时有液滴溅出; D 砝码未经校正; 2、滴定分析相对误差一般要求为%,滴定时耗用标准溶液体积应控制在:( C ) A 10ml 以下; B 10ml; C 10~40ml; D 50ml; 3、由计算器算得×/×的结果为 ,按有效数字运算规则应将结果修约为:( C ) A ; B ; C ; D 4、对______A____某试样进行三次平行测定,得CaO 平均含量为%,而真实含量为%,则%%=%为:( ) A 绝对误差; B 相对偏差; C 相对误差; D 绝对偏差; 5、用25ml 移液管移出的溶液体积应记录为:( C ) A 25ml; B ; C ; D 。 6、欲配制2mol/LHCl溶液,应在10ml 6 mol/L HCl溶液中加水:( ) A 100ml; B 50ml; C 30ml; D 20ml;D 7、可用于直接配制标准溶液的是( B ) A KMnO4; B K2Cr2O7; C Na2S2O3·5H2O; D NaOH。 8、间接碘量法测定水中Cu2+含量,介质的pH 值应控制在:( B ) A 强酸性; B 弱酸性; C 弱碱性; D 强碱性。 9、在滴定反应K2Cr2O7+FeSO4+H2SO4→Fe2(SO4)3+Cr2(SO4)3+K2SO4+H2O 达到等当点时,下列各说法哪些是正确的( ) A 溶液中Fe2(SO4)3与Cr2(SO4)3的浓度(单位:mol/L)相等; B 溶液中Fe2(SO4)3与Cr2(SO4)3的浓度(单位:mol/L)之比为3:1; C 溶液中不存在Fe2+和Cr2O72-; D 溶液中两个电对“Fe3+/Fe2+”和“Cr2O72-/Cr3+”的电位不相等 10、共轭酸碱对的Ka 和Kb的关系是:( C ) A ka=Kb; B Ka·Kb=1; C Ka/Kb=Kw; D Ka·Kb=Kw。 11、滴定分析中,一般利用指示剂颜色的突变来判断等当点的到达,在指示剂变色时停止滴定。这一点称为:( A )
2020分析化学题库及答案 I 分析化学概论 一、选择题 1下列数据中有效数字为四位的是 ( D ) (A)0.060 (B)0.0600 (C)pH = 6.009 (D)0.6000 2下列数据中有效数字不是三位的是(C) (A)4.00×10-5 (B)0.400 (C)0.004 (D)p K a = 4.008 3 为了消除0.0002000 kg 中的非有效数字,应正确地表示为(D) (A)0.2g (B)0.20g (C)0.200g (D)0.2000g 4下列数据中有效数字不是四位的是(B) (A)0.2500 (B)0.0025 (C)2.005 (D)20.50 5 下面数据中含有非有效数字的是(A) (1) 0.02537 (2) 0.2009 (3) 1.000 (4) 20.00 (A)1,2 (B)3,4 (C)1,3 (D)2,4 6 下列数据中为四位有效数字的是(C) (1) 0.068 (2) 0.06068 (3) 0.6008 (4) 0.680 (A)1,2 (B)3,4 (C)2,3 (D)1,4 7在下列数据中,两位有效数字的是(B) (2) 0.140 (3) 1.40 (3) K a=1.40×10-4 (4) pH=1.40 (A)1,2 (B)3,4 (C)1,4 (D)2,3 如果是等式,有效数字就是从小数点开始的(前提是小数点前面不是零),如多是单纯的数字,就不需要考虑上述情况。 8 用50 mL滴定管滴定,终点时正好消耗25 mL滴定剂,正确的记录应为(C) (A) 25 mL (B) 25.0 mL (C) 25.00 mL (D) 25.000mL 这个是精确度的问题 9 用25 mL移液管移取溶液,其有效数字应为(C) (A) 二位 (B) 三位 (C) 四位 (D) 五位
洛阳理工学院学年第学期分析化学期末考试试题卷() 适用班级:考试日期时间: 一、选择题(每题2分,共10题20分) 1. 下列有关随机误差的论述中不正确的是( ) (A) 随机误差具有随机性 (B) 随机误差具有单向性 (C) 随机误差在分析中是无法避免的 (D) 随机误差是由一些不确定的偶然因素造成的 2. 莫尔法测定Cl-采用滴定剂及滴定方式是( ) (A) 用Hg2+盐直接滴定(B) 用AgNO3直接滴定 (C) 用AgNO3沉淀后,返滴定(D) 用Pb2+盐沉淀后,返滴定 3. 采用EGTA(乙二醇二乙醚二胺四乙酸)作为络合滴定剂的主要优点是( ) (A) 可在大量Mg2+存在下滴定Ca2+ (B) 可在大量Ca2+存在下滴定Mg2+ (C) 滴定Cu2+时, Zn2+,Cd2+等不干扰 (D) 滴定Ni2+时, Mn2+等不干扰 4. 以下论述正确的是( ) (A) 单次测定偏差的代数和为零(B) 总体平均值就是真值 (C) 偏差用s表示(D) 随机误差有单向性 5. 将酚酞分别加入MnS (a)的饱和水溶液;CuS(b)的饱和水溶液中,所观察到的现象是:( ) (已知:K sp(MnS)=2×10-10;K sp(CuS)=6×10-36; H2S: K a1=1.3×10-7, K a2=7.1×10-15) (A) a、b均无色(B)?a中无色,b中呈红色 (C) a中呈红色b中无色(D) a、b均呈红色 6. Fe3+与F-形成络合物的lg?1~lg?3分别为5.3、9.3和12.1,已知在某一pH时溶液中游离F-的浓度为10-4.0mol/L,则溶液中铁络合物的主要存在形式是( ) (A) FeF2+和FeF2+(B) FeF2+和FeF3(C) FeF2+(D) FeF2+ 7. 叙述Na2H2Y溶液以Y4-形式存在的分布系数[δ(Y4-)]时,说法正确的是( ) (A) δ(Y4-)随酸度的增大而增大(B) δ(Y4-)随pH的增大而减小 (C) δ(Y4-)随pH的增大而增大(D) δ(Y4-)与pH的大小无关 8. 在pH=5.0的醋酸缓冲液中用0.002 mol/L的EDTA 滴定同浓度的Pb2+。已知: lg K(PbY)=18.0, lg?Y(H)=6.6, lg?Pb(Ac)=2.0,化学计量点时溶液中pPb应为( ) (A) 8.2 (B) 6.2 (C) 5.2 (D) 3.2 9. EDTA滴定Al3+,Zn2+,Pb2+混合液中的Al3+应采用( ) (A) 直接滴定法(B) 回滴法(C) 置换滴定法(D) 间接法 10. 下面哪种说法不符合正态分布的特点( ) (A) 大误差出现的概率小,小误差出现的概率大 (B) 绝对值相同,正负号不同的误差出现的概率相等 (C) 误差为零的测量值出现的概率最大 (D) 各种数值的误差随机出现
2 分(1001) 用重量法测定试样中钙含量时, 将钙沉淀为草酸钙, 高温(1100℃)灼烧后称量,则钙的换算因数为------------------------------------------------------------------------------------------------( ) A r(Ca) A r(Ca) (A) ─────(B) ────── M r(CaC2O4) M r(CaCO3) A r(Ca) M r(CaC2O4) (C) ────(D) ───── M r(CaO ) A r(Ca ) 2 分(1001) (C) 2分(1002) 1002 用重量法测定试样中的砷,首先使其形成Ag3AsO4沉淀,然后转化为AgCl,并以此为称量形式,则用As2O3表示的换算因数是-------------------------------------------------------------( ) (A) M r(As2O3)/M r(AgCl) (B) 2M r(As2O3)/3M r(AgCl) (C) 3M r(AgCl)/M r(As2O3) (D) M r(As2O3)/6M r(AgCl) 2分(1002) 1002 (D) 2 分(1003) 用重量法测定氯化物中氯的质量分数,欲使10.0mg AgCl沉淀相当于1.00%的氯,应称取试样的质量(g)------------------------------------------------------------------------------------ ( ) (A r(Cl) = 35. 5, M r(AgCl) = 143.3) (A) 0.1237 (B) 0.2477 (C) 0.3711 (D) 0.4948 2 分(1003) (B) 2分(1004) 1004 某石灰石试样含CaO约30%,用重量法测定其含量时,Fe3+将共沉淀。设Fe3+共沉淀的量为溶液中Fe3+含量的1%,则试样中Fe2O3的质量分数应不超过下列何数值时,所产生的误差才能≤0.1%---------------------------------------------------------------------------------------( ) (A) 3%(B) 1% (C) 0.1%(D) 0.03% 2分(1004) 1004 (A) 2分(1005) 1005 用重量法测定As2O3的含量时,将As2O3溶于NaOH溶液,处理为AsO43-,然后形成Ag3AsO4沉淀,过滤,洗涤,将沉淀溶于HNO3后,再以AgCl形式沉淀和称重,则换算因数表示为________________。 2分(1005) 1005 M r(As2O3)/6M r(AgCl)
有机污染物综合指标有:溶解氧(DO)、高锰酸盐指数、化学需氧量(COD)、生物化学需氧量(BOD5)、总有机碳(TOC)、总需氧量(TOD)和氯仿萃取物(CCE) 《水分析化学》分章节复习 第一、第二章 1.PH=7.00,表示其有效数字为位。2 像pM、 pH、lgK等对数值时,有效数字位数仅取决于 小数部分(即尾数)的位数。 1.P H=7.0,表示其有效数字为位。1 2.数字0.0530表示其有效数字为位。3(P) 3.(24.00-8.00) ×0.1000= 。 1.600加减法中,小数点后位数最少的那个数字相同; 4.(14.00-5.00) ×0.1000= 。 0.900 乘除法中,有效数字最少的那个数字相同。 5.某水样含锌1.0mg/l,相当于含锌。1.0ppm。 6.在电子分析天平上称取样品能精确至。0.0001克。(T、P) 7.欲配制0.1000mol.L-1Na2CO3溶液150.0ml,应准确称取Na2CO3的质量为克。1.590(T) 8.供分析用的水样,应该能够充分地代表该水的。全面性。 9.水样保存时常采用、和的方法,抑制化学反应和生化作用。 加入保存试剂、调节PH值冷藏或冷冻(T) 10.误差根据来源分为、。系统误差随机误差(T) 11.随机误差的大小、正负无法测量,也不能加以校正。随机误差的大小、正负无法测量,也无法校正,过随机误差又叫不可测误差。 12.误差可用误差和误差表示。绝对相对 2.对某项测定来说,它的系统误差大小是不可测量的。(×)系统误差具有单向性、重复性,为可测误差。 13.在化学定量分析中,常采用的分析方法是微量分析。(×) 14.准确度反映测定结果与真实值接近的程度,精密度反映测定结果互相接近的程度。 真实值接近互相接近的程度 15.准确度由和决定,所以要获得很高的,则必须有很高的。系统误差随机误差准确度精密度 16.校准、做试验,做试验,对分析结果加以能减少系统误差。 仪器空白对照校正 17.同一水样,多做几次取平均值,可减少,一般要求平行测定次。随机误差(平行样减少随机误差) 2-4(P)
第一章 1.1 分析化学的定义、任务和作用 1.分析化学是获得物质的组成和结构的信息科学。(对) 2.分析化学的任务是定性分析和定量分析。(错) 3.分析化学被称为科学技术的眼睛,是进行科学研究的基础。(对) 4.分析化学是一门学科,仪器分析也是一门学科。(错) 1.2 分析化学的分类与选择 填空: 1.分析化学根据测定原理的不同可分为(化学分析)和(仪器分析)。 2.化学分析法是以物质的(化学反应)为基础的分析方法,它包括(滴定分析)和(重量分析)两类分析方法。 3.按照式样用量,称取样品质量高于(0.1g)为常量分析,小于(0.1mg)为超微量分析。 4.根据分析任务,分析化学可分为(定性分析)、(定量分析)和(结构分析)。 1.6 滴定分析法概述 单选: 1.在滴定分析中,一般用指示剂颜色的突变来判断化学计量点的到达,在指示剂变色时停止滴定,这一点称为(C) A.化学计量点 B. 滴定误差 C. 滴定终点 D. 滴定分析 2.在滴定分析中,对其化学反应的主要要求是(A) A.反应必须定量完成 B. 反应必须有颜色 C. 滴定剂与被滴定物必须是1:1反应 D. 滴定剂必须是基准物
3. EDTA 滴定+3Al 、+2Zn 、+2Pb 混合液中的+ 3Al ,应采用(B ) A. 直接滴定法 B. 返滴定法 C. 置换滴定法 D. 间接滴定法 4. 使用高锰酸钾法测定石灰石中钙的含量时,应采用的滴定方式是(D ) A. 直接滴定法 B. 返滴定法 C. 置换滴定法 D. 间接滴定法 填空: 1. 在滴定分析中,指示剂变色时停止滴定的这一点称为(滴定终点)。实际分析操作中滴定终点与理论上的化学计量点不可能恰好相符,它们之间的误差称为(终点误差)。 1. 滴定误差指(滴定终点与化学计量点不一定恰好吻合造成的分析误差)。 2. 由于(返滴定法)、(置换滴定法)、(间接滴定)等滴定方法式的应用,大大扩展了滴定分析的应用范围。 2. 适合滴定分析的化学反应应该具备4个条件是(有确定的化学计量关系)、(反应定量进行)、(速度快)和(有确定终点的方法)。 简答: 1. 什么是滴定分析法? 滴定分析法是将标准溶液滴加到被测物质的溶液中(或者是用被滴定物质滴加到标准溶液中),直到标准溶液与被测物质按化学计量关系定量反应完为止,然后根据试剂溶液的浓度和用量,计算被测物质的含量的分析方法 2. 简述滴定分析法对化学反应的要求? 1. 反应必须具有确定的化学计量关系; 反应必须定量的进行; 反应必须有较快的反应速度; 反应必须具有适当简便的方法确定滴定终点 3. 简述定量分析的基本过程。 定量分析的任务是测定物质中某种或某些组分的含量。要完成一项定量分析工作,通常包括以下几个步骤:(1)取样;(2)试样分解及分析试液的制备;(3)分离及测定;(4)分析结果的评价 1.7 基准物质和标准溶液
苏州大学分析化学课程试卷(7)卷共8页 考试形式闭卷年月日院系年级专业 学号姓名成绩 一.选择题 (共36分) 1.(本题2分) 配制以下标准溶液必须用间接法配制的是一一一一一一一—-() (1) NaCl (2) K 2Cr 2 O 7 (3) NaOH (4) Na 2 CO 3 2.(本题2分) 下面哪种说法不符合正态分布的特点一一一一一一―――――( ) (1) 大误差出现的概率小,小误差出现的概率大 (2) 绝对值相同,正负号不同的误差出现的概率相等 (3) 误差为零的测量值出现的概率最大 (4) 各种数值的误差随机出现 3.(本题2分) 有两组分析数据,要比较它们的精密度有无显著性差异,则应当用 -----------------------------------------------------() (1) F检验(2) t检验(3) u检验(4) Q检验 4.(本题2分) 下列各组组分中不属于共轭酸碱对的是一一一一一一一一―――( ) (1) H 2CO 3 和C0 3 2- (2) NH 3 和NH 2 - (3) HCl和Cl- (4) HSO 4-和SO 4 2- 5.(本题2分) 下列试剂能使BaS0 4 沉淀的溶解度增加的是————————-( ) (1) 浓HCl (2) 1mol/L Na0H (3) 1mol/LNa 2S0 4 (4) 1mol/LNH 3 H 2 6.(本题2分) 下面四个电磁辐射区中,频率最小的是--------------------( )
(1) X射线区 (2) 红外光区 (3) 无线电波区 (4) 可见光区 7. (本题2分) 在进行发射光谱定性和半定量分析时------------------------ ( ) (1) 固定暗盒而移动哈特曼光栏 (2) 固定哈特曼光栏而移动暗盒 (3) 暗盒和光栏均要移动 (4) 暗盒和光栏均不移动 8.(本题2分) 原子吸收光谱仪与原子发射光谱仪在结构上的不同之处是-----( ) (1) 透镜 (2) 单色器 (3) 光电倍增管 (4) 原子化器 9.(本题2分) 双光束分光光度计与单光束分光光度计相比,其突出优点是----( ) (1) 可以扩大波长的应用范围 (2) 可以采用快速响应的检测系统 (3) 可以抵消吸收池所带来的误差 (4) 可以抵消因光源的变化而产生的误差 10.(本题2分) 某物质能吸收红外光波,产生红外吸收谱图,那么其分子结构必然是 ―――――――――――――――――――――――――――()(1)具有不饱和键 (2)具有共轭体系 (3)发生偶极矩的净变化 (4)具有对称性 11.(本题2分) 红外光谱法,样品状态可以是―――――――――――――――()(1)气体状态
第一章定量分析概论 思考题 1、为了探讨某江河地段底泥中工业污染物的聚集情况,某单位于不同地段采集足够量的原始平均试样,混匀后,取部分试样送交分析部门。分析人员称取一定量试样,经处理后,用不同方法测定其中有害化学成分的含量。试问这样做对不对?为什么? 答:不对。应将原始试样全部送交分析部门,再由分析人员对原始试样采用四分法进行缩分,依据经验公式取样,再分解、测定等。 2、镍币中含有少量铜、银。欲测定其中铜、银的含量,有人将镍币的表层擦洁后,直接用稀HNO3溶解部分镍币制备试液。根据称量镍币在溶解前后的质量差,确定试样的质量。然后用不同的方法测定试液中铜、银的含量。试问这样做对不对?为什么? 答:不对。应将镍币全部溶解,因为镍币中铜银分布不一定均匀,这样做取样无代表性。 3、怎样溶解下列试样:锡青铜、高钨钢、纯铝、镍币、玻璃 答:锡青铜:HNO3 ;高钨钢:H3PO4;纯铝:HCl;镍币:HNO3 ;玻璃:HF。 4、下列试样宜采用什么熔剂和坩埚进行熔融:铬铁矿、金红石、锡石、陶瓷 答:铬铁矿:Na2O2熔剂,铁、银、刚玉坩埚 金红石:酸性熔剂,石英或铂坩埚 锡石:酸性熔剂,石英或铂坩埚 陶瓷:碱性熔剂,铁、银、刚玉坩埚 5、欲测定锌合金中Fe、Ni、Mg的含量,应采用什么溶剂溶解试样? 答:用NaOH溶解试样,Fe,Ni,Mg形成氢氧化物沉淀,与Zn基体分离。 6、欲测定硅酸盐中SiO2的含量;硅酸盐中Fe,Al,Ca,Mg,Ti的含量。应分别选择什么方法分解试样? 答:测硅酸盐中SiO2的含量时采用碱熔法,用KOH熔融,是硅酸盐中的硅转化为可溶性的K2SiO3,再用容量法测定:测定硅酸盐中Fe,Al,Ca,Mg,Ti的含量时,用HF酸溶解试样,使Si以SiF4的形式溢出,再测试液中Fe,Al,Ca,Mg,Ti的含量。 7、分解物及试样和有机试样的主要区别有哪些? 答:分解无机试样和有机试样的主要区别在于:无机试样的分解时将待测物转化为离子,而有机试样的分解主要是破坏有机物,将其中的卤素,硫,磷及金属元素等元素转化为离子。 8、误差的正确定义是(选择一个正确答案)(C) a、某一测量使与其算术平均值之差 b、含有误差之值与真值之差 c、测量值与其真值之差 d、错误值与其真值之差