
《生物化学》(I)教学大纲
(供临床、预防、检验、全科、麻醉、口腔、影像专业)
前言
生物化学是一门在分子水平上研究和揭示生命现象的科学,是生命科学领域重要的基础学科,也是医学教育中重要的基础课程之一,其任务是通过教学使学生掌握生物化学的基本知识和基本技能,为学习其它基础和临床医学课程奠定基础。近年来,生物化学和其它领头学科的飞速发展推动了整个生命科学(包括医学)越来越深入到分子水平。根据我院本科教育教学计划,本大纲规定了生物化学的教学内容与基本要求,使师生按掌握、熟悉、了解等三种基本要求把握教与学的范围与深度。基本理论与重要內容要求讲够,难点內容要求讲透,了解內容要求学生自学、教师辅导,并适当介绍一些国内外的新进展,培养学生分析和解决实际问题的能力及科学的思维方法。
生物化学教学时数为112,其中理论课为64,实验课为48。使用万福生、揭克敏主编的《医学生物化学》(科学出版社)教材。
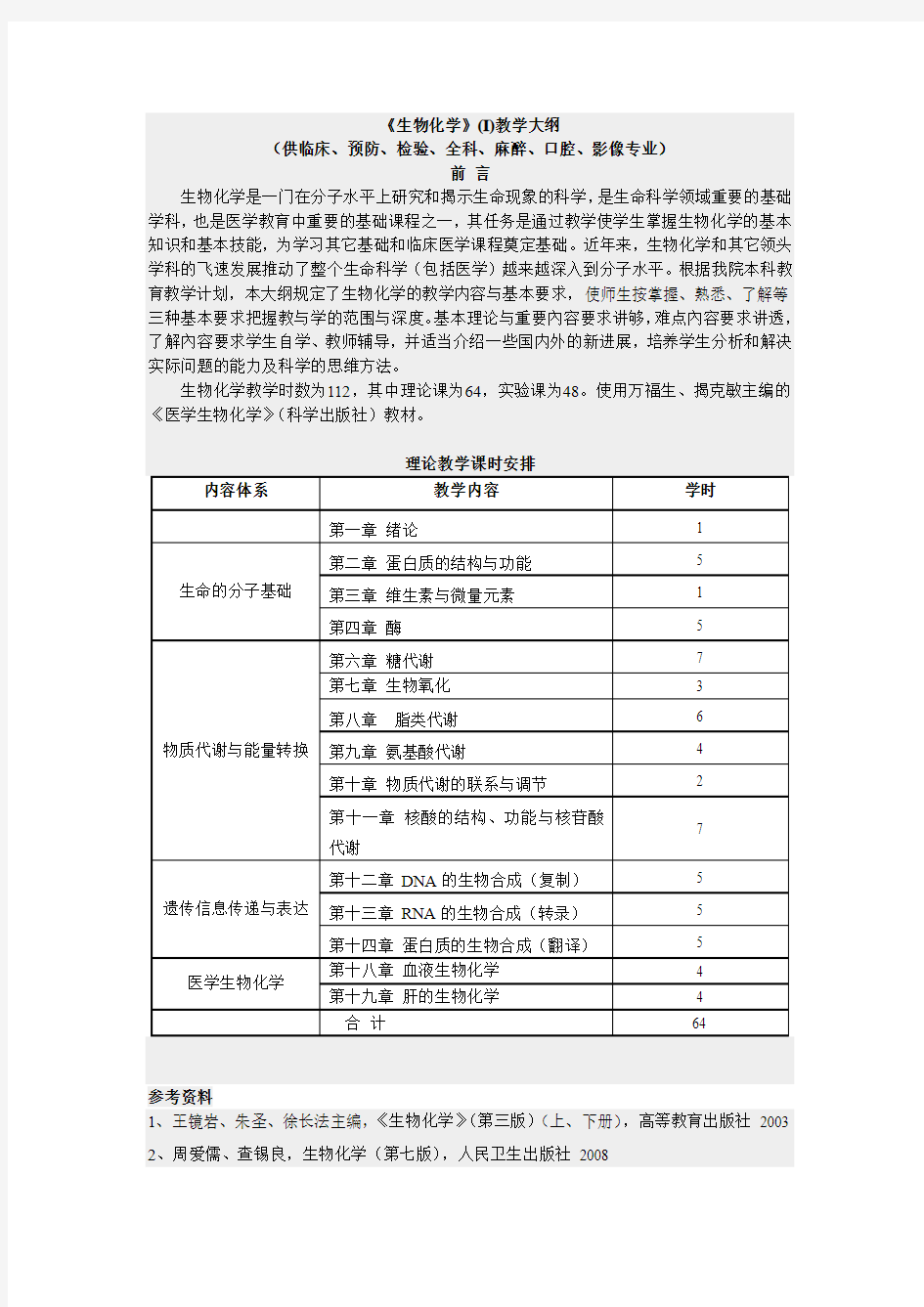
理论教学课时安排
内容体系教学内容学时
第一章绪论 1
生命的分子基础第二章蛋白质的结构与功能 5 第三章维生素与微量元素 1 第四章酶 5
物质代谢与能量转换第六章糖代谢7 第七章生物氧化 3
第八章脂类代谢 6 第九章氨基酸代谢 4 第十章物质代谢的联系与调节 2 第十一章核酸的结构、功能与核苷酸
代谢
7
遗传信息传递与表达第十二章DNA的生物合成(复制) 5 第十三章RNA的生物合成(转录) 5 第十四章蛋白质的生物合成(翻译) 5
医学生物化学第十八章血液生物化学 4 第十九章肝的生物化学 4 合计64
参考资料
1、王镜岩、朱圣、徐长法主编,《生物化学》(第三版)(上、下册),高等教育出版社2003
2、周爱儒、查锡良,生物化学(第七版),人民卫生出版社2008
3、《Haper’s Biochemistry》24 th ed. Robert K.Murray 2003
4、《Biochemistry》second edition B.D.Hames(影印版) 2003
5、《Principles of Biochemistry》four edition Lehninger 2001
教学内容与要求
第一章绪论
【预习要求】
预习生物化学发展简史及生物化学与医学的关系
【目的要求】
了解全章内容
【教学内容】
1、生物化学发展简史
2、当代生物化学研究的主要内容
3、生物化学与医学
4、本书纲要
【教学方法】
1、课堂讲授
2、多媒体辅助教学
第二章蛋白质结构与功能
【预习要求】
预习蛋白质的分子组成、分子结构及蛋白质结构与功能的关系
【目的要求】
1、掌握α-氨基酸通式;20种氨基酸的名称、三字符号及结构;肽键、肽链、氨基酸残
基及肽链书写规则。
2、掌握蛋白质一至四级结构的概念及稳定因素。
3、掌握蛋白质结构与功能的关系。掌握模体、结构域、分子伴侣等概念。
4、熟悉谷胱甘肽的结构与功能。
5、熟悉常见的蛋白质分离纯化方法。
6、了解氨基酸及蛋白质的的理化性质及蛋白质的分类。
7、自学多肽链中氨基酸序列分析和蛋白质空间结构测定。
【教学内容】
1、蛋白质的分子组成:氨基酸、肽键与肽
2、蛋白质的分子结构:蛋白质一、二、三、四级结构
3、蛋白质结构与功能的关系:蛋白质一级结构与功能的关系;蛋白质空间结构与功能
的关系
4、蛋白质的理化性质及其分离纯化:蛋白质的理化性质;蛋白质的分离和纯化
【教学方法】
1、课堂讲授
2、多媒体辅助教学
第三章核酸的结构与功能
【预习要求】
预习核酸的化学组成、结构与功能
【目的要求】
1、掌握核苷酸中碱基、戊糖的种类和结构;核苷、核苷酸的组成、类型与连接方式;3¢,
5¢-磷酸二酯键、核酸一级结构的概念及核酸的书写方式。
2、掌握DNA双螺旋结构模型要点、原核生物的超螺旋结构及真核生物染色体的基本
单位核小体。
3、掌握DNA的功能以及DNA的变性、复性与分子杂交。
4、掌握RNA的种类及信使RNA、转运RNA和核蛋白体RNA的结构特点与功能。
5、熟悉核酸的一般理化性质。
6、了解A-DNA、Z-DNA、分子杂交、核酶。
7、自学核酸酶
【教学内容】
1、核酸的化学组成:核苷酸中的碱基成分;戊糖与核苷;核苷酸的结构与功能
2、核酸的一级结构:3¢,5¢-磷酸二酯键;核酸的一级结构;核酸的书写方式。
3、DNA的空间结构与功能:DNA的二级结构;DNA的三级结构;DNA的功能
4、RNA的结构与功能:mRNA、tRNA和rRNA的结构与功能;其它小分子RNA;核
酶
5、核酸的理化性质及其应用:核酸的一般理化性质;DNA的变性、复性与分子杂交【教学方法】
1、课堂讲授
2、多媒体辅助教学
3、课堂提问
4、演示
第四章酶
【预习要求】
预习酶的分子结构与功能及酶促反应动力学
【目的要求】
1、掌握酶的分子组成、维生素与辅酶的关系、辅酶或辅基的符号及作用。
2、掌握酶的活性中心概念和酶活性中心内的必需基团。
3、掌握酶专一性的概念和类型。
4、掌握底物浓度、酶浓度、温度、pH及抑制剂对反应速度的影响。
5、掌握酶原和酶原激活的概念、酶原激活的实质及生理意义。
6、掌握同工酶概念、LDH同工酶及其临床意义。
7、熟悉酶促反应的特点与机制。
8、熟悉酶的共价修饰调节概念和主要方式。
9、了解激活剂对反应速度的影响、酶活性测定与酶活性单位。
10、了解变构酶和变构效应的概念、机理及生理意义。
11、了解酶的含量调节及酶的命名与分类。
12、自学酶与医学的关系。
【教学内容】
1、酶的分子结构与功能:酶的分子组成;酶的活性中心
2、酶促反应的特点与机制:酶促反应的特点;酶促反应的机制
3、酶促反应动力学:底物浓度、酶浓度、温度、pH及抑制剂对反应速度的影响
4、酶的调节:酶的活性调节;酶的含量调节;同工酶
5、酶的命名与分类:酶的命名;酶的分类
【教学方法】
1、课堂讲授
2、多媒体辅助教学
3、课堂提问
第五章维生素与微量元素
【预习要求】
复习辅酶与辅基;预习水溶性维生素的活性形式及其生化作用
【目的要求】
1、掌握维生素的概念和分类。
2、掌握水溶性维生素的活性形式及其生化作用。
3、了解脂溶性维生素。
4、了解水溶性维生素的化学性质及缺乏症。
5、自学微量元素。
【教学内容】
1、脂溶性维生素:维生素A ;维生素D ;维生素E ;维生素K
2、水溶性维生素:维生素B1;维生素B2;维生素PP;维生素B6;泛酸;生物素;叶
酸;维生素B12;维生素C;a-硫辛酸
【教学方法】
1、课堂讲授
2、多媒体辅助教学
3、课堂提问
第六章生物氧化
【预习要求】
复习ATP的结构;预习呼吸链与氧化磷酸化
【目的要求】
1、掌握生物氧化的概念、方式及特点。
2、掌握呼吸链的概念、组成和排列顺序。
3、掌握氧化磷酸化的概念和偶联部位、P/O比值的概念。
4、掌握胞液中NADH的氧化(α-磷酸甘油穿梭;苹果酸—天冬氨酸穿梭)。
5、熟悉常见的高能磷酸化合物以及能量和磷酸基的转移、贮存与利用。
6、了解呼吸链成分排列顺序的确定依据。
7、了解氧化磷酸化偶联机制以及影响氧化磷酸化的因素。
8、了解线粒体内膜的主要转运载体以及ATP、ADP和Pi的转运。
9、自学其他氧化体系。
【教学内容】
1、生成ATP的氧化体系:呼吸链;氧化磷酸化;影响氧化磷酸化的因素;ATP;通过
线粒体内膜的
物质转运
【教学方法】
1、课堂讲授
2、多媒体辅助教学
第七章糖代谢
【预习要求】
复习糖的分子结构;预习糖的分解代谢途径
【目的要求】
1、掌握糖酵解的概念、主要反应、限速酶、终产物、产能状况及生理意义。
2、掌握有氧氧化的概念、主要反应、限速酶、终产物、产能状况及三羧酸循环的
反应过程和生理意
义。
3、掌握磷酸戊糖途径的重要反应、限速酶、主要产物及生理意义。
4、掌握糖原的合成与分解代谢的概念、基本过程、限速酶、反应特点及生理意义。
5、掌握糖异生的概念、主要器官、原料、基本过程、限速酶及生理意义。
6、掌握血糖的概念、正常浓度、来源与去路
7、熟悉调节血糖浓度的主要激素。
8、了解糖的消化吸收及各种糖代谢途径的调节。
9、了解激素对血糖浓度的影响机理以及血糖水平异常。
【教学内容】
1、概述:糖的生理功能;糖的消化吸收;糖代谢的概况
2、糖的无氧分解:糖酵解的反应过程;糖酵解的调节;糖酵解的生理意义
3、糖的有氧氧化:有氧氧化的反应过程;有氧氧化生成的A TP;有氧氧化的调节;巴
斯德效应
4、磷酸戊糖途径:磷酸戊糖途径的反应过程;磷酸戊糖途径的调节;磷酸戊糖途径的
生理意义
5、糖原的合成与分解:糖原的合成代谢;糖原的分解代谢;糖原合成与分解的调节;
糖原累积症
6、糖异生:糖异生途径;糖异生的调节;糖异生的生理意义;乳酸循环
7、血糖及其调节:血糖的来源与去路;血糖水平的调节;血糖水平异常
【教学方法】
1、课堂讲授
2、多媒体辅助教学
3、课堂提问
第八章脂类代谢
【预习要求】
预习脂酸β-氧化及酮体的生成及利用
【目的要求】
1、掌握脂肪动员的概念及限速酶。
2、掌握脂酸β-氧化的组织特点、亚细胞部位、氧化方式、基本过程及能量生成。
3、掌握酮体的概念、组成、生成及利用、酮体生成的生理意义。
4、掌握甘油磷脂的合成部位、原料、辅助因子及基本过程。
5、掌握胆固醇的合成部位、原料、主要步骤、限速酶及胆固醇的转化产物。
6、掌握血脂的概念和组成、血浆脂蛋白的分类、组成、结构及功能。
7、熟悉脂酸、甘油三酯的合成代谢。
8、熟悉甘油磷脂的降解。
9、了解脂类的消化和吸收。
10、了解胆固醇合成的调节、载脂蛋白、血浆脂蛋白的代谢过程及血浆脂蛋白代谢异常。
11、自学脂酸碳链的延长、不饱和脂酸的合成及多不饱和脂酸的重要衍生物。
12、自学不饱和脂酸的命名、分类及鞘磷脂的代谢。
【教学内容】
1、脂类的消化和吸收:脂类的概述;脂类的消化和吸收
2、甘油三酯的代谢:甘油三酯的合成代谢;甘油三酯的分解代谢;脂酸的合成代谢
3、磷脂的代谢:甘油磷脂的种类与结构;甘油磷脂的合成;甘油磷脂的降解
4、胆固醇代谢:胆固醇的合成;胆固醇的转化
5、血浆脂蛋白代谢:血脂;血浆脂蛋白的分类、组成及结构;载脂蛋白;血浆脂
蛋白的代谢;血浆
脂蛋白代谢异常
【教学方法】
1、课堂讲授
2、多媒体辅助教学
第九章氨基酸代谢
【预习要求】
复习氨基酸的种类、结构;预习氨基酸脱氨基作用及尿素的生成
【目的要求】
1、掌握氮平衡概念(氮的总平衡;氮的正平衡;氮的负平衡)、营养必需氨基酸以
及蛋白质的互补作
用。
2、掌握联合脱氨基作用、转氨基作用、L-谷氨酸氧化脱氨基作用的概念、反应过程、
作用酶及其辅
酶以及GPT和GOT的组织分布特点和临床意义。
3、掌握体内氨的来源、氨的转运以及尿素生成的主要器官和反应过程。
4、掌握氨基酸脱羧基作用的概念、作用酶及其辅酶、主要产物。
5、掌握一碳单位的代谢的概念、种类、载体、来源及生理功用。
6、熟悉蛋白质的腐败、氨基酸代谢概况及嘌呤核苷酸循环、。
7、熟悉活性甲基载体SAM的生成、活性甲基的转移、甲硫氨酸循环及Vit.B12的功用。
8、了解蛋白质营养的重要性、蛋白质的生理需要量以及食物蛋白质的消化吸收。
9、了解α-酮酸的代谢、肌酸的合成以及苯丙氨酸和酪氨酸的代谢。
10、自学色氨酸、半胱氨酸与胱氨酸的代谢。
【教学内容】
1、蛋白质的营养作用:蛋白质营养的重要性;蛋白质的需要量和营养价值
2、蛋白质的消化、吸收与腐败:蛋白质的消化;蛋白质的吸收;蛋白质的腐败作用
3、氨基酸的一般代谢:氨基酸的脱氨基作用;α—酮酸的代谢
4、氨的代谢:体内氨的来源;氨的转运;尿素的生成
5、个别氨基酸的代谢:氨基酸的脱羧基作用;一碳单位的代谢;含硫氨基酸的代谢【教学方法】
1、课堂讲授
2、多媒体辅助教学
3、课堂提问
第十章核苷酸代谢
【预习要求】
复习核苷酸的组成与结构;预习嘌呤核苷酸和嘧啶核苷酸的从头合成
【目的要求】
1、掌握核苷酸的生物学功用。
2、掌握嘌呤核苷酸和嘧啶核苷酸从头合成的主要器官、元素来源、关键步骤、
重要中间产物以及限速酶。
3、掌握脱氧(核糖)核苷酸生成的反应过程和作用酶。
4、掌握嘌呤核苷酸和嘧啶核苷酸分解代谢的主要器官及其终产物。
5、熟悉嘌呤核苷酸和嘧啶核苷酸的补救合成及Lesch-Nyhan综合症。
6、了解嘌呤核苷酸和嘧啶核苷酸从头合成的调节。
7、了解嘌呤核苷酸和嘧啶核苷酸的抗代谢物。
8、了解嘌呤核苷酸和嘧啶核苷酸的分解代谢过程及痛风症。
【教学内容】
1、嘌呤核苷酸代谢:嘌呤核苷酸的合成代谢;嘌呤核苷酸的分解代谢
2、嘧啶核苷酸代谢:嘧啶核苷酸的合成代谢;嘧啶核苷酸的分解代谢
【教学方法】
1、课堂讲授
2、多媒体辅助教学
3、课堂讨论
第十一章物质代谢的联系与调节
【预习要求】
复习物质代谢各章;预习物质代谢的相互联系
【目的要求】
1、掌握糖、脂和蛋白质代谢之间的相互联系。
2、掌握关键酶的概念和特点。
3、熟悉变构调节的概念、机制和生理意义以及酶的化学修饰调节概念、常见修饰方式
及其特点。
4、了解物质代谢的特点。
5、了解组织、器官的代谢特点及联系。
6、了解激素水平的代谢调节和整体调节。
【教学内容】
1、物质代谢的特点
2、物质代谢的相互联系:在能量代谢上的相互联系;糖、脂和蛋白质代谢之间的相互
联系
3、组织、器官的代谢特点及联系
4、代谢调节:细胞水平的代谢调节;激素水平的代谢调节;整体调节
【教学方法】
1、课堂讲授
2、多媒体辅助教学
3、课堂提问
4、小测验
第十二章DNA的生物合成
【预习要求】
复习DNA的结构与功能;预习DNA复制的酶学及DNA生物合成过程
【目的要求】
1、掌握半保留复制的概念。
2、掌握DNA聚合酶的分类、功能以及复制的保真性。
3、掌握解螺旋酶、DNA拓扑异构酶、单链DNA结合蛋白、引物酶以及DNA连接酶
的性质和功能。
4、掌握双向复制、复制叉、复制子、领头链、随从链、冈崎片段的概念以及DNA生
物合成的基本过
程(起始、延长、终止)。
5、掌握突变的概念、因素和类型以及DNA损伤修复的主要方式。
6、熟悉逆转录的概念和逆转录酶功能及其意义、。
7、熟悉半保留复制的实验依据及意义。
8、了解滚环复制及真核生物的端粒和端粒酶。
9、了解突变的意义以及DNA损伤的修复过程。
【教学内容】
1、半保留复制:半保留复制的实验依据;半保留复制的意义
2、DNA复制的酶学:复制的化学反应;DNA聚合酶;复制中解链和DNA分子的拓扑
学变化;引物
酶和引发体;DNA连接酶
3、DNA生物合成过程:复制的起始;复制的延长;复制的终止
4、DNA损伤(突变)与修复:突变的意义;引发突变的因素;突变分子改变的类型;
DNA损伤的修复
5、逆转录现象和逆转录酶
【教学方法】
1、课堂讲授
2、多媒体辅助教学
3、演示
第十三章RNA的生物合成(转录)
【预习要求】
复习mRNA、tRNA及rRNA的结构与功能;预习RNA聚合酶及原核生物的转录过程【目的要求】
1、掌握转录的概念以及复制与转录的区别。
2、掌握结构基因、不对称转录、模板链及编码链的概念。
3、掌握原核生物RNA聚合酶的组成、功能以及真核生物RNA聚合酶的种类、性质及
其功能。
4、掌握断裂基因、内含子、外显子及核酶的概念。
5、掌握真核mRNA、tRNA的转录后加工。
6、熟悉原核生物转录的基本过程(起始、延长、终止)。
7、了解模板与酶的辨认结合过程。
8、了解真核生物的转录的起始和终止。
9、了解内含子剪接方式、分类及功能。
10、了解rRNA的转录后加工。
【教学内容】
1、模板和酶:转录模板;RNA聚合酶;模板与酶的辨认结合
2、转录过程:转录的起始;转录的延长;转录的终止
3、真核生物的转录后修饰:真核mRNA的转录后加工;tRNA的转录后加工;rRNA
的转录后加工
【教学方法】
1、课堂讲授
2、多媒体辅助教学
3、演示
第十四章蛋白质的生物合成(翻译)
【预习要求】
复习mRNA、tRNA及rRNA的结构与功能;预习它们在蛋白质生物合成中的作用【目的要求】
1、掌握翻译的概念。
2、掌握遗传密码的概念和特点以及摆动配对的概念和方式。
3、掌握mRNA、tRNA和rRNA在蛋白质生物合成中的作用。
4、熟悉蛋白质生物合成的基本过程(起始、延长、终止)。
5、熟悉蛋白质生物合成的干扰和抑制。
6、了解真核生物翻译起始的特点及翻译后加工。
【教学内容】
1、参与蛋白质生物合成的物质:mRNA是翻译的直接模板;核蛋白体是肽链合成的场
所;tRNA和氨基酰-tRNA
2、蛋白质的生物合成过程:翻译的起始;肽链的延长;肽链合成的终止
3、翻译后加工:高级结构的修饰;一级结构的修饰;蛋白质合成后的靶向转运
4、蛋白质生物合成的干扰和抑制:抗生素;干扰蛋白质生物合成的生物活性物质【教学方法】
1、课堂讲授
2、多媒体辅助教学
3、演示
第十五章基因表达调控
【预习要求】
复习RNA生物合成和蛋白质生物合成的过程;参与两个过程的物质以及它们的作用【目的要求】
1、掌握基因表达调控的概念和生物学意义
2、掌握乳糖操纵子的结构和调节机制
3、熟悉基因表达的特异性;基因表达调控的基本原理
4、熟悉真核基因组结构特点
5、熟悉顺式作用元件和反式作用因子的概念
6、了解原核生物翻译水平的调节
7、了解真核基因表达调控的特点;RNApolI 和polIII的转录调节;转录后水平的调
节;翻译水平的调节
【教学内容】
1、基因表达调控基本概念与原理:基因表达的概念;基因表达的特异性;基因表达
的方式;基因表达调控的生物学意义
2、基因表达调控的基本原理
3、原核基因表达调节:原核基因转录调节的特点;原核生物转录起始调节;原核生
物转录终止调节
4、真核基因表达调节:真核基因组结构特点;真核基因表达调控特点;RNA-polII转
录起始的调节
【教学方法】
1、课堂讲授
2、多媒体辅助教学
3、讨论
第十八章血液生物化学
【预习要求】
复习血红蛋白的结构与功能;预习红细胞的糖代谢特点及血红素的生物合成
【目的要求】
1、掌握血浆蛋白的功能。
2、掌握红细胞的糖代谢特点及生理意义。
3、掌握血红素的生物合成的基本原料、亚细胞部位、限速酶及辅酶。
4、熟悉血浆蛋白的分类与性质。
5、了解血红素的生物合成过程和调节以及血红蛋白的合成。
6、了解红细胞的脂代谢和白细胞的代谢。
7、自学血液凝固。
【教学内容】
1、血浆蛋白:血浆蛋白的分类与性质;血浆蛋白的功能
2、血细胞代谢:红细胞的代谢特点;白细胞的代谢
【教学方法】
1、课堂讲授
2、多媒体辅助教学
3、课堂讨论
第十九章肝的生物化学
【预习要求】
复习肝的解剖结构特点;预习胆汁酸代谢及胆色素代谢
【目的要求】
1、掌握生物转化的概念、生理意义及其类型。
2、掌握胆汁酸的分类、代谢以及胆汁酸的肠肝循环。
3、掌握胆色素的概念和胆红素的来源、生成与转运、在肝中的转变、排泄以及胆色素
的肠肝循环。
4、熟悉胆汁酸的功能。
5、熟悉肝在物质代谢中的作用。
6、了解生物转化反应过程和影响因素。
7、了解血清胆红素与黄疸。
【教学内容】
1、肝在物质代谢中的作用:肝在糖代谢中的作用;肝在脂类代谢中的作用;肝在蛋白
质代谢中的作用;肝在维生素代谢中的作用;肝在激素代谢中的作用
2、肝的生物转化作用:生物转化的概念;生物转化反应的主要类型;影响生物转化作
用的因素
3、胆汁与胆汁酸的代谢:胆汁;胆汁酸的代谢
4、胆色素的代谢与黄疸:胆红素的生成与转运;胆红素在肝中的转变;胆红素在肠道
中的变化和胆色素的肠肝循环;血清胆红素与黄疸
【教学方法】
1、课堂讲授
2、多媒体辅助教学
3、课堂讨论
第二十章重组DNA技术
【预习要求】
复习DNA聚合酶;DNA连接酶;核酸酶等性质和功能。质粒;噬菌体;病毒等结构和生活规律。
【目的要求】
1、掌握DNA克隆、基因工程的概念
2、掌握限制性核酸内切酶的概念、性质、分类方法
3、掌握基因载体的类型和特点、α-互补的概念
4、熟悉目的基因获取的方法、重组DNA技术的操作步骤
5、了解DNA的重组
6、了解重组DNA技术与医学的关系
【教学内容】
1、重组DNA技术的发展简史
2、重组DNA技术相关概念;重组DNA技术基本原理及操作步骤:目的基因的获取;
克隆载体的选择和构建;外源基因与载体的连接;重组DNA导入受体菌;重组体
的筛选;克隆基因的表达
3、重组DNA技术与医学的关系
【教学方法】
1、课堂讲授
2、多媒体辅助教学
3、讨论
当我被上帝造出来时,上帝问我想在人间当一个怎样的人,我不假思索的说,我要做一个伟大的世人皆知的人。于是,我降临在了人间。
我出生在一个官僚知识分子之家,父亲在朝中做官,精读诗书,母亲知书答礼,温柔体贴,父母给我去了一个好听的名字:李清照。
小时侯,受父母影响的我饱读诗书,聪明伶俐,在朝中享有“神童”的称号。小时候的我天真活泼,才思敏捷,小河畔,花丛边撒满了我的诗我的笑,无可置疑,小时侯的我快乐无虑。
“兴尽晚回舟,误入藕花深处。争渡,争渡,惊起一滩鸥鹭。”青春的我如同一只小鸟,自由自在,没有约束,少女纯净的心灵常在朝阳小,流水也被自然洗礼,纤细的手指拈一束花,轻抛入水,随波荡漾,发髻上沾着晶莹的露水,双脚任水流轻抚。身影轻飘而过,留下一阵清风。
可是晚年的我却生活在一片黑暗之中,家庭的衰败,社会的改变,消磨着我那柔弱的心。我几乎对生活绝望,每天在痛苦中消磨时光,一切都好象是灰暗的。“寻寻觅觅冷冷清清凄凄惨惨戚戚”这千古叠词句就是我当时心情的写照。
最后,香消玉殒,我在痛苦和哀怨中凄凉的死去。
在天堂里,我又见到了上帝。上帝问我过的怎么样,我摇摇头又点点头,我的一生有欢乐也有坎坷,有笑声也有泪水,有鼎盛也有衰落。我始终无法客观的评价我的一生。我原以为做一个着名的人,一生应该是被欢乐荣誉所包围,可我发现我错了。于是在下一轮回中,我选择做一个平凡的人。
我来到人间,我是一个平凡的人,我既不着名也不出众,但我拥有一切的幸福:我有温馨的家,我有可亲可爱的同学和老师,我每天平凡而快乐的活着,这就够了。
天儿蓝蓝风儿轻轻,暖和的春风带着春的气息吹进明亮的教室,我坐在教室的窗前,望着我拥有的一切,我甜甜的笑了。我拿起手中的笔,不禁想起曾经作诗的李清照,我虽然没有横溢的才华,但我还是拿起手中的笔,用最朴实的语言,写下了一时的感受:
人生并不总是完美的,每个人都会有不如意的地方。这就需要我们静下心来阅读自己的人生,体会其中无尽的快乐和与众不同。
“富不读书富不久,穷不读书终究穷。”为什么从古到今都那么看重有学识之人?那是因为有学识之人可以为社会做出更大的贡献。那时因为读书能给人带来快乐。
自从看了《丑小鸭》这篇童话之后,我变了,变得开朗起来,变得乐意同别人交往,变得自信了……因为我知道:即使现在我是只“丑小鸭”,但只要有自信,总有一天我会变成“白天鹅”的,而且会是一只世界上最美丽的“白天鹅”……
我读完了这篇美丽的童话故事,深深被丑小鸭的自信和乐观所折服,并把故事讲给了外婆听,外婆也对童话带给我们的深刻道理而惊讶不已。还吵着闹着多看几本名着。于是我给外婆又买了几本名着故事,她起先自己读,读到不认识的字我就告诉她,如果这一面生字较多,我就读给她听整个一面。渐渐的,自己的
语文阅读能力也提高了不少,与此同时我也发现一个人读书的乐趣远不及两个人读的乐趣大,而两个人读书的乐趣远不及全家一起读的乐趣大。于是,我便发展“业务”带动全家一起读书……现在,每每遇到好书大家也不分男女老少都一拥而上,争先恐后“抢书”,当我说起我最小应该让我的时候,却没有人搭理我。最后还把书给撕坏了,我生气地哭了,妈妈一边安慰我一边对外婆说:“孩子小,应该让着点。”外婆却不服气的说:“我这一把年纪的了,怎么没人让我呀?”大家人你一言我一语,谁也不肯相让……读书让我明白了善恶美丑、悲欢离合,读一本好书,犹如同智者谈心、谈理想,教你辨别善恶,教你弘扬正义。读一本好书,如品一杯香茶,余香缭绕。读一本好书,能使人心灵得到净化。书是我的老师,把知识传递给了我;书是我的伙伴,跟我诉说心里话;书是一把钥匙,给我敞开了知识的大门;书更是一艘不会沉的船,引领我航行在人生的长河中。其实读书的真真乐趣也就在于此处,不是一个人闷头苦读书;也不是读到好处不与他人分享,独自品位;更不是一个人如痴如醉地沉浸在书的海洋中不能自拔。而是懂得与朋友,家人一起分享其中的乐趣。这才是读书真正之乐趣呢!这所有的一切,不正是我从书中受到的教益吗?
我阅读,故我美丽;我思考,故我存在。我从内心深处真切地感到:我从读书中受到了教益。当看见有些同学宁可买玩具亦不肯买书时,我便想到培根所说的话:“世界上最庸俗的人是不读书的人,最吝啬的人是不买书的人,最可怜的人是与书无缘的人。”许许多多的作家、伟人都十分喜欢看书,例如毛泽东主席,他半边床上都是书,一读起书来便进入忘我的境界。
书是我生活中的好朋友,是我人生道路上的航标,读书,读好书,是我无怨无悔的追求。
南昌大学分子生物学复习资料 杨光焱南昌大学生物科学141班 5601114030 一、名词解释 1)分子生物学:从分子水平上研究生命现象物质基础的学科。研究细胞成分的 物理、化学的性质和变化以及这些性质和变化与生命现象的关系,如遗传信息的传递,基因的结构、复制、转录、翻译、表达调控和表达产物的生理功能,以及细胞信号的转导等。 2)移动基因:又称转座子。由于它可以从染色体基因组上的一个位置转移到另一个位置,是指在不同染色体之间跃迁,因此也称跳跃基因。 3)假基因:有些基因核苷酸序列与相应的正常功能基因基本相同,但却不能合 成出功能蛋白质,这些失活的基因称为假基因。 4)重叠基因:所谓重叠基因是指两个或两个以上的基因共有一段DNA序列,或是指一段DNA序列成为两个或两个以上基因的组成部分。 5)基因家族:是真核生物基因组中来源相同、结构相似、功能相关的一组基 因。 6)基因:能够表达和产生蛋白质和RNA的DNA序列,是决定遗传性状的功能单位. 7)基因组:细胞或生物体的一套完整单倍体的遗传物质的总和. 8)端粒:以线性染色体形式存在的真核基因组DNA末端都有一种特殊的结构叫 端粒.该结构是一段DNA序列和蛋白质形成的一种复合体,仅在真核细胞染色体末端存在. 9)操纵子:是指数个功能上相关的结构基因串联在一起,构成信息区,连同其上游的调控区 (包括启动子和操纵基因)以及下游的转录终止信号所构成的基因表达单位,所转录的RNA为多顺反子. 10)顺式作用元件:是指那些与结构基因表达调控相关,能够被基因调控蛋白特异性识别和结合的特异DNA序列.包括启动子,上游启动子元件,增强子,加尾信号和一些反应元件等. 11)反式作用因子:是指真核细胞内含有的大量可以通过直接或间接结合顺式作用元件而调节基因转录活性的蛋白质因子. 12)启动子:是RNA聚合酶特异性识别和结合的DNA序列. 13)增强子:位于真核基因中远离转录起始点,能明显增强启动子转录效率的特殊DNA序列. 它可位于被增强的转录基因的上游或下游,也可相距靶基因较远. 14)转录因子:直接结合或间接作用于基因启动子、形成具有RNA聚合酶活性 的动态转录复合体的蛋白质因子。有通用转录因子、序列特异性转录因子、辅助转录因子等。
《生物化学》教学大纲 课程名称:生物化学课程代码:120005 课程类型:专业基础课程课程性质:必修课 课程总学时:72学时理论学时:52学时 开课学期:第二学期使用专业:护理、助产、临床、药学 先修课程:人体解剖学、组织胚胎学、遗传学、有机化学 一、课程性质和任务 生物化学是研究生物体的化学组成及其变化规律的科学,是从分子水平和化学变化的本质上探讨并阐明生命现象,即生命的化学。生物化学是一门重要的医学基础课。它的任务是研究生物体内的化学组成、分子结构及其与功能的关系;生物体内物质的代谢变化及调控;生物体内信息的传递。要求学生通过本课程的学习,掌握生物化学的基础理论、基本知识和基本技能,为学好其它基础学科和专业学科打下基础。 二、课程教学目标 本课程的教学目标是:使学生掌握生物大分子的化学结构、性质及功能,在生命活动中的代谢变化及调控,遗传信息的传递与表达。掌握生物化学的基本技能,培养学生分析问题、解决问题及开拓创新的能力。 【知识目标】 1.掌握生物大分子的结构与功能。 2.掌握生物体内糖、脂类及蛋白质等物质的主要代谢变化及其与生理功能的关系。 3.掌握组织器官的代谢特点及其与功能的关系。 4.掌握遗传信息传递与表达的主要过程及规律。 【能力目标】 1.掌握生物化学常用仪器的使用。 2.具有生物化学的基本技能,能运用生化基础理论知识分析和解释各种实验现象。 3.掌握重要的临床生化指标,了解生物化学知识在临床、护理工作中的应用。 4.能运用所学的生物化学知识在分子水平上探讨病因和发病机制,具有一定的临床及护理操作技能。 【素质目标】 1.具有勤奋学习、事实就是的科学态度和理论联系实际的工作作风。 2.树立牢固的专业思想,具有良好的思想品质、职业道德和为人类健康服务的奉献精神。 3.具有健康的体魄和良好的心理素质。
《生物化学》课程教学大纲 biochemistry 学时数:62 其中:实验学时:10 课外学时: 学分数:3.5分 适用专业:临床护理学 执笔者:郭冬招 编写日期:2006年11月 一、课程的性质、目的和任务 生物化学是研究生命化学的科学,它是在分子水平上探讨生命的本质,即研究生物体的分子结构与功能、物质代谢与调节及其在生命活动中的作用。生物化学是高等医学院校各专业的重要基础课程之一,它的任务主要是介绍生物化学的基本知识,以及某些与医学相关的生物化学进展,为学生学习其它基础医学和临床医学课程,以及对认识疾病的病因和发病机理、诊断和防止疾病奠定扎实的基础。当今生物化学越来越多的成为生命科学的共同语言,它已成为生命科学领域的前沿学科。 通过本课程的学习,要求学生从理论上掌握生物体的分子结构与功能,理解物质代谢与调节及其在生命活动中的作用。了解物质代谢异常与临床疾病的关系。通过实验课熟悉生物化学基本实验技术的原理及生化检验项目检测的临床意义等。 为了完成和达到生物化学的教学任务和要求,在整个教学环节中,要特别注意培养学生的独立思考能力。教学内容宜以物质代谢为主线,加强生物化学基本理论和基本知识的教学与训练,使学生能牢固和熟练地掌握和应用。 二、课程教学的基本要求 (一)绪论 1.掌握生物化学的定义 2.熟悉生物化学研究的对象和方法。理解新陈代谢的特点与其生理功能之间的关系。 3.了解生化与各基础学科的关系,生化与临床医学的关系。 (二)蛋白质的化学 1. 掌握组成蛋白质20种氨基酸的结构特点。掌握肽键和肽的概念。 2. 掌握蛋白质一级结构、二级结构、三级结构、四级结构及亚基的概念和特点,掌握稳定蛋白质各级结构中的非共价键和共价键。 3. 理解蛋白质一级结构、空间结构与功能的关系,并举例说明。 4. 理解蛋白质的理化性质及实际应用:蛋白质的两性解离、胶体性质、变性与沉淀。 5.了解氨基酸的呈色反应和蛋白质的分类。
南昌大学抚州医学分院 《分析化学》试卷(2) 题号一二三四五六七总分总分人 得分 一、选择题( 每小题2分,共 24分) 中,计算以Fe3+滴定Sn2+至99.9%、100%、100.1%时的电位分别为多少? ----------------------------------( ) (A) 0.50 V、0.41 V、0.32 V (B) 0.17 V、0.32 V、0.56 V (C) 0.23 V、0.41 V、0.50 V (D) 0.23 V、0.32 V、0.50 V 2. 下列试剂能使BaSO4沉淀的溶解度增加的是 -----------------------------------------------( ) (A)浓HCl (B)1mol/L NaOH (C)1mol/L Na2SO4 (D)1mol/L NH3·H2O 4. 用BaSO4重量法测定Ba2+含量,若结果偏低,可能是由于 --------------------------------( ) (A) 沉淀中含有Fe3+等杂质(B) 沉淀中包藏了BaCl2 (C) 沉淀剂H2SO4在灼烧时挥发(D) 沉淀灼烧的时间不足 5. 当两电对的电子转移数均为2时,为使反应完全度达到99.9%,两电对的条件电位至少大于------------------------------( ) (A) 0.09V (B) 0.18V (C) 0.27V (D) 0.36V 6. 沉淀重量法中,称量形的摩尔质量越大,将使 -------------------------------- ( ) (A) 沉淀易于过滤洗涤(B) 沉淀纯净 (C) 沉淀的溶解度减小(D) 测定结果准确度高 姓名 学号系别专业班级 得分评卷人… … … … … … … … … … … … 装 … … … … … … … … … … … 订 … … … … … … … … … … … 线 … … … … … … … … … … …
生物化学实验须知 一、实验目的 1.培养学生严谨的科学作风,独立工作能力及科学的思维方法。 2.学习基础的生物化学实验方法,为今后的学习与研究准备更好的条件。 3.培养学生爱护国家财物、爱护集体、团结互助的优良道德品质。 4.培养学生的书面及口头表达能力。 二、实验的总要求 1.按教研室予先公布的实验进度表,了解各次实验的具体内容,并认真做好预习。弄清各步骤的意义,避免教条或机械式做实验。 2.进行实验不仅要求结果良好,而且要求敏捷高效。为达到此目的,实验者应注意:①一切步骤都按正规操作法进行;②样品与试剂勿过量取用;③宜粗者勿细(例如粗天平称量物品即足够准确时,不用分析天平,用量筒取液足够准确时,不用吸量管);④试剂、仪器防止污染及破损,保持实验环境的整洁。⑤注意力集中,避免差错。 3.实验中观察要仔细,记录要详尽、及时与客观,不得于实验后追记,应直接记在实验报告本中,而且无论实验成功与失败,都应记下。对于失败的实验,要分析其原因。 4.实验室是集体学习与工作的场所,实验时应保持肃静,不得大声喧哗,以免影响他人的工作与思考。对师长尊敬,对同学要团结友爱。实验后应清洗整理用过的仪器及清理自己的实验场所。 三、实验报告 实验报告的书写是培养学生书面表达能力和科学作风的重要手段之一,实验者应该重视。实验报告的内容包括下列各项:实验名称、实验日期、实验目的、实验原理、实验步骤、实验记录、计算(定量测定、解释)、讨论或小结。实验记录除应包括“实验总要求”的第3项要求外,还应包括原始记录。原始记录是随做随记的第一手记录,应由指导教师签字认可。书写实验报告要字迹工整,语句通顺。书写工整的实验报告,是尊师的重要表现之一。 四、组织与分组 1.每一个班学习委员负责①实验报告的收集与分发;②安排清扫值日名单; ③反映同学学习情况及对教学工作的意见;④其它临时性的工作。 2.一般实验都为两个学生单独进行。有的实验要4人一组,由相邻两学生组成固定小组。小组的成员在指导教师的同意下,可作适当的调整。
南昌大学896分析化学考研练习题 计算题(共5题35分) 1.10分(1156) 以邻二氮菲(以R表示)作显色剂用光度法测定Fe,显色反应为: Fe2++3R=FeR3lgK(FeR3)=21.3 (1)若过量显色剂的总浓度为[R]=1.0×10-4mol/L,问在pH=3.0时能否使99.9%的Fe2+络合为’ FeR32+?(pH=3.0时,lg R(H)=1.9) (2)称取0.5000g试样,制成100mL试液,从中移取10.00mL显色后稀释为50mL,用1.0cm比色皿,在510nm处测得透射比T=60.0%。求试样中Fe的质量分数。 [已知510=1.1×104L/(mol·cm),Ar(Fe)=55.85] 2.5分(0365) 假设某酸碱指示剂HIn的变色pH范围为2.60,若观察到刚显酸式(HIn)色时比率[HIn]/[In-]和碱式(In-)色时[In-]/[HIn]是相同的。当指示剂刚显酸色或碱色时,HIn或In-形体所占的百分比为多少? 3.5分(4216) 测定某试样中锰的质量分数w(Mn),五次测定的平均值为1.48%,标准偏差为0.09%。试比较置信度分别为90%和95%时平均值的置信区间。 4.5分(2948) 用每毫升含KMnO45.980mg的溶液,滴定0.4006g不纯的H2C2O4·2H2O试样,消耗28.62mL。计算试样的纯度。 [Mr(KMnO4)=158.03,Mr(H2C2O4·2H2O)=126.07] 5.10分(1029)
计算CdCO3在纯水中的溶解度。 [pKsp(CdCO3)=11.28,Cd2+基本不形成羟基络合物,H2CO3的pKa1=6.38,pKa2=10.25]
临床生物化学实验原理、分析方法及检测技术 中国中医研究院广安门医院临床检测中心 生物化学实验——是把化学(分析技术)和生物化学(实验反应原理)的方法应用于疾病的诊断、治疗、监控的实验分支。 一个生化实验的最后测定结果应包括四大部分来完成。 一、实验反应原理及分析方法(理论依据) 二、实验检测技术(手段)生化仪的分析技术。 三、质量控制程序(质量保证)室内质控、室间质评、仪器、试剂、人员五要素。 四、临床意义(目的)咨询服务、异常结果的解释。 实验反应原理及分析方法(理论依据) 一个生物化学实验的反应原理设计,首先要找出所检测的化学特性,如测定体液(首先是血液)中酶的含量血液中除少数酶(如凝血溶血酶、铜氧化酶及假性胆碱脂酶等)含量较多外,血液正常生理状况下含量微乎其微。一般每毫升含微微克(Pg)水平,要直接测定如此微量物质是相当困难的。用免疫化学方法可测定全部酶蛋白分子含量(不论其有无活性)而用化学方法测定只能测定酶的催化活性,间接计算出酶的含量。目前利用酶具有催化活性这一特性,在临床上已普遍应用测定酶蛋白,同时还可以测定三大代谢的产物,如糖、脂类、蛋白质、这样也就建立起利用酶促反应的一级反应测定代谢物的方法。一级反应—反应速度与底物浓度成正比,因此只有当酶反应为一级反应时,才能准确测定底物含量,(如测定血糖、总甘油三脂、总胆固醇等)。从此在临床试剂盒的方法中出现了以酶为试剂测定各种代谢产物。 临床化学方法的分类 特别是自动生化仪方法的特点 以往临床化学实验都采用比色法进行各个项目的测定,这是因为比色法具有微量、迅速、准确的优点,特别适合于微量的生物体体液中各项物质测定。 在一般比色法中,手工使用比色计或分光光度计可以测定各种反应溶液的吸光度,但由于很难控制测定时间和反应温度,很难准确记录反应过程中吸光度变化,因此,毫不奇怪在很长一段时间内我们所使用的方法,都是在呈色反应达到完全或者反应达到平衡时,吸光度达到稳定时才进行测定。即所谓平衡法或终点法。 但自从自动生化仪出现后,从根本上改变了上述情况。通过各项先进技术,人们可以精确测定反应的动态过程。并可以准确计算任何一段反应时间内的反应速率,这样大大开阔了临床化学家对方法选择。除经典的终点法外还可以进行动态测定。这样不仅缩短了操作时间,大大提高了工作效率,还可进行一些用常规比色方法不能进行的测定。如测定酶反应的初速 度(V o )等等。测酶初速度(V o )只能用分光光度法。 因此,用好自动生化仪一个重要前提必须对自动生化仪可以提供的测试方法类型有所了解。 生化自动分析仪特点: 1 精确测定反应的动态过程; 2 准确计算任何一段反应时间内的反应速率; 3 除经典的终点法外还可以进行动态测定。 分析方法的分类
系统生物学复习题 一、名词解释 同源性(homology):进化过程中源于同一祖先的分支之间的关系。在进化上或个体发育上的共同来源而呈现的本质上的相似性,但其功能不一定相同。 直系同源:指的是不同物种之间的某一部分具有的同源性,不是整个物种之间的对比,只是其中的某些基因序列例如蛋白质的同源性,DNA序列的同源性。 并系同源:同一个基因组中有不同功能的同源基因,通过基因组、基因复制等过程形成。 分子钟:单位时间内同源蛋白质氨基酸顺序或DNA核苷酸序列取代的比率 有根树和无根树:有根树是具有方向的系统发生树(phylogenetic tree),包含唯一的节点,将其作为树中所有物种的最近共同祖先。把有根树去掉根即成为无根树。无根树是没有方向的,其中线段的两个演化方向都有可能。 分子系统树:根据生物大分子的序列资料建立起来的、用图解法表示的、类似树状的分子进化模型。 分子进化(molecular evolution):生物进化过程中生物大分子的演变现象。主要包括蛋白质分子的演变、核酸分子的演变和遗传密码的演变。 同源性搜索(Blast):应用最广泛的序列相似性搜索工具。 NCBI:美国国立生物信息中心。全球最大的生物信息资源中心 序列比对(alignment):为确定两个或多个序列之间的相似性以至于同源性,而将它们按照一定的规律排列。 分子系统学:通过对生物大分子(蛋白质、核酸等)的结构、功能等的进化研究,来阐明生物各类群(包括已绝灭的生物类群)间的谱系发生关系的一门学科。转导:由噬菌体将一个细胞的基因传递给另一细胞的过程。它是细菌之间传递遗传物质的方式之一。
非编码RNA:除mRNA外的其他所有RNA(不参与编码蛋白质的RNA)。 snRNA基因:核内小RNA,它是真核生物转录后加工过程中RNA剪接体的主要成分。 两点杂交:是基因定位最基本的一种方法,它首先通过一次杂交和一次用隐性亲本测交来确定两对基因是否连锁,然后再根据交换值来确定它们在同一染色体上的位置。 密码子偏爱:不同生物对编码同一氨基酸的不同密码子使用频率不同。 转录组:广义上指某一生理条件下,细胞内所有转录产物的集合,包括信使RNA、核糖体RNA、转运RNA及非编码RNA;狭义上指所有mRNA的集合。 基因组:一套染色体中的完整的DNA序列,包括其全部的遗传信息。 RFLP:指基因型之间限制性片段长度的差异,这种差异是由限制性酶切位点上碱基的插入、缺失、重排或点突变所引起的。 启动子:位于结构基因5'端上游的DNA序列,能活化RNA聚合酶,使之与模板DNA准确的结合并具有转录起始的特异性。 基因岛:是有横向起源迹象的一部分基因组。一个基因岛可以与多种生物功能相关,能与共生或病原机理相关,与生物体的适应性相关等。 snoRNA基因:是最早在核仁发现的小RNA,称作小核仁RNA,最初发现它们的生物功能是用来修饰rRNA的。 MicroRNA:是一类21~23 nt 的小RNA,其前体大概是70~100 nt 左右,形成标准的stem 结构,加工后成为21~23 nt 的单链RNA。microRNA 的作用机制是与mRNA 互补,让mRNA 沉默或者降解。 孟德尔第一定律:又称分离定律,在生物体的细胞中,控制同一性状的遗传因子成对存在,不相融合;在形成配子时,成对的遗传因子发生分离,分离后的遗传因子分别进入不同的配子中,随配子遗传给后代。 蛋白酶体:是在真核生物和古菌中普遍存在的,在一些原核生物中也存在的一种巨型蛋白质复合物。在真核生物中,蛋白酶体位于细胞核和细胞质中。主要作用
《生物化学》课程教学大纲 一、基本信息 课程编号:10301100350 课程名称:生物化学 英文名称:Biochemistry 课程性质:必修课 总学时:64 学分:4 理论学时:48 实验学时:16 实践学时:0 指导自学学时:0 适用专业:食品质量与安全、制药工程、药物制剂、适用层次:本科 药学、中药学、中药学(国际交流) 先修课程:化学(基础化学,有机化学基础) 承担院部:基础医学院;学科组:生物化学与生物工程学科组 二、课程介绍 (一)课程目标及地位 生物化学(biochemistry)是研究生命化学的科学,是从分子水平阐明生物体化学组成及其在体内的化学变化的一门基础课,是生命科学的前沿课程。通过本课程的理论知识学习和实验技能训练,使学生具备较系统和扎实的生物化学基础理论知识和较强的实验动手能力,以及一定的创新思维,为学习后续的药学、中药学基础课程奠定必要的基础,为将来开展中医药学现代化提供必要的支撑。 (二)教学基本要求 在教学内容上,注重加强基础、突出重点,由浅入深地介绍本课程基本理论、基本知识和基本技能;注意联系生物化学国内外科学研究新理论和新成果在药学、中药学的应用;注意各章节知识衔接协调、避免与其它课程知识重复或者脱节。 在教学方法上,积极运用多媒体课堂教学设施,采用启发式、讨论式、案例教学法,使学生在有限的课时教学内能够正确理解并掌握生物化学基本理论知识;并充分利用已有的实验室条件,训练学生实验操作技能,提高学生分析问题和解决问题能力,着重对学生综合素质的培养。 (三)课程的重点和难点 本课程的讲授一般安排在药学、中药学专业大学二年级第一个学期,本课程重点是静态生物化学、动态生物化学和遗传信息传递转接三篇章的内容;掌握生物化学基本理论、基本知识和基本技能, 培养学生现代科学的生命思维和一定的创新思维。重点章节是教材第三章、第四章、第五章、第七章、第八章、第十章、第十一章、第十二章、第十三章、第十四
分析化学课试卷 (A卷) (答题纸在另页) 一.选择题(每题1分,共35分) 1.按被测组分含量来分,分析方法中常量组分分析指含量( D ) A.<0.1% B.>0.1% C.<1% D.>1% 2.比较两组测定结果的精密度( B ) 甲组:0.19%,0.19%,0.20%, 0.21%, 0.21% 乙组:0.18%,0.20%,0.20%, 0.21%, 0.22% A.甲.乙两组相同 B.甲组比乙组高 C.乙组比甲组高 D.无法判别 3.国家标准规定的实验室用水分为( C )级。 A.4 B.5 C.3 D.2 4.分析纯化学试剂标签颜色为( C ) A.绿色 B.棕色 C.红色 D.蓝色 5.可用下列何种方法减免分析测试中的系统误差( A ) A.进行仪器校正 B.增加测定次数 C.认真细心操作 D.测定时保证环境的湿度一致 6.测定试样中CaO的质量分数,称取试样0.9080g,滴定耗去EDTA标准溶液20.50mL,以下结果表示正确的是 ( C ) A.10% B.10.1% C.10.08% D.10.077% 7.在滴定分析中,一般用指示剂颜色的突变来判断化学计量点的到达,在指示剂变色时停止滴定。这一点称为( C ) A.化学计量点 B.滴定误差 C.滴定终点 D.滴定分析 8.滴定管可估读到±0.01mL,若要求滴定的相对误差小于0.1%,至少应耗用体积( B )mL A. 10 B. 20 C. 30 D. 40 9.使用分析天平时,加减砝码和取放物体必须休止天平,这是为了( B ) A . 防止天平盘的摆动; B . 减少玛瑙刀口的磨损; C . 增加天平的稳定性; D. 加块称量速度; 10.共轭酸碱对的K a 与K b 的关系是( B ) A. K a K b = 1 B. K a K b =K w C. K a /K b =K w D. K b /K a =K w 11.酸碱滴定中选择指示剂的原则是( C ) A.指示剂变色范围与化学计量点完全符合 B.指示剂应在pH =7.00时变色 C.指示剂的变色范围应全部或部分落入滴定pH突跃范围之内 D.指示剂变色范围应全部落在滴定pH突跃范围之内 12.测定(NH 4) 2 SO 4 中的氮时,不能用NaOH直接滴定,这是因为( D ) A. NH 3的K b 太小 B. (NH 4 ) 2 SO 4 不是酸 C. (NH 4) 2 SO 4 中含游离H 2 SO 4 D. NH 4 +的K a 太小 13.指出下列滴定分析操作中,规范的操作是( A ) A.滴定之前,用待装标准溶液润洗滴定管三次 B.滴定时摇动锥形瓶有少量溶液溅出
《生物化学》实验教学大纲 课程类别:专业基础 适用专业:本科临床学专业 课程总学时:实验学时:32 实验指导书:生物化学与分子生物学实验教程 开课实验室名称:生化实验室 一、目的和任务 生物化学是一门在分子水平上研究生命现象的学科,也是一门重要的实验性较强的基础医学课程.随着医学的发展,该学科已渗透到医学的各个领域。生物化学实验技术已被广泛地应用于生命科学各个领域和医学实验的研究工作。生物化学实验是生物化学教学的重要组成部分,它与理论教学既有联系,又是相对独立的组成部分,有其自身的规律和系统。我们根据国家教委对医学生物化学课程基本技能的要求,开设了大分子物质的常用定量分析法、酶活性分析、电泳法、层析技术、离心技术及临床生化,使学生对生物化学实验有一个比较系统和完整的概念,培养学生的基本技能和科学思维的形成,提高学生的动手能力。 二、基本要求 1.通过实验过程中的操作和观察来验证和巩固理论知识,加深学生对理论课内容的理解。 2.通过对实验现象的观察,逐步培养学生学会观察,比较,分析和综合各种现象的科学方法,培养学生独立思考和独立操作的能力。 3.通过对各类实验的操作和总结,培养学生严谨的科学态度。 4.进行本学科的基本技能的训练,使学生能够熟练各种基本实验方法和实验技术的操作。 三、考试方法及成绩评定方法 四、说明 实验教材及参考书: 1.揭克敏主编:生物化学与分子生物学实验教程(第2版)。科学出版社,2010 参考资料: 1..袁道强主编:生物化学实验(第1版)。化学工业出版社,2011 五、实验项目数据表
2)要求:0:必修1选修 3)类型:0:演示1:验证2:综合3:设计 4)每组人数:指教学实验项目中一次实验在每套仪器设备上完成实验项目的人数。 六、各实验项目教学大纲 实验一蛋白质的沉淀反应 【预习要求】 预习四个小实验的具体实验原理和操作内容。 【实验目的】 1. 加深对蛋白质胶体溶液稳定因素的认识; 2. 了解沉淀蛋白质的几种方法及其实用意义。 【实验内容】 (一)蛋白质的盐折 1. 原理 大量中性盐类如硫酸铵((NH4)2SO4)、硫酸钠(Na2SO4)和氯化钠(NaCl)等加入到蛋白质溶液后,可引起蛋白质颗粒因失去水化膜和电荷而沉淀。各种蛋白质分子的颗粒大小和电荷数量不同,用不同浓度中性盐可使各种蛋白质分段沉淀。例如血清中的球蛋白可在半饱和硫酸铵溶液中沉淀。当硫酸铵浓度达到饱和时血清中的白蛋白使沉淀下来。盐析沉淀蛋白质时能保持蛋白质不变性,加水稀释降低盐浓度,能使沉淀的蛋白质重新溶解,并保持其生物活性。因此,利用盐析法可达到分离提纯蛋白质的目的。 2. 操作步骤 ①取小试管1支、加入5%鸡蛋清溶液20滴,饱和硫酸铵溶液20滴,充分摇匀后静置5min,记录结果。
学院●生命科学学院 系别●生物技术系 教师●刘玮 课程●生物化学(上) 团结勤奋 求是创新 南昌大学教务处
《生物化学》 (上) 刘玮 南昌大学生命科学学院 生物技术系 2013年8月
南昌大学课程教学进度表 (2013 – 2014 学年第一学期适用) 任课老师在每学期开课前根据课程教学大纲编写“课程进度表”,经教研室讨论在开学后一周内发至学生班级,并送学生所在系一份。 学院:生命科学系:生物技术任课教师:刘玮 性别:男年龄: 59 职称:研究员 学历:硕士所学专业:动物生理学任课班级:生物技术122 课程名称:生物化学(上)
南昌大学课程教学大纲 课程名称(含英文译名):生物化学(Biochemistry) 课程编号:J5602Z001 课程类别:(指通识课、学科核心课、选修课)学科核心课 教学时数总计:64学时 授课时数:本学期32学时 实践教学时数:无 实验时数:本学期48学时(见《生物化学实验》J5602Z002)设计:无 实习:无 教学大纲制定单位:生命科学学院生物技术系 教学大纲制订时间;2012年9月 系主任签字; 南昌大学教务处
生物化学(上)教学大纲 (适用于生物技术专业) 课程编码:J5602Z001 课程英文译名:Biochemistry 课程类别:学科核心课开课对象:生物科学专业 开课学期:第三学期总学分:4 总学时:64 先修课程:无机化学、有机化学 教材:《生物化学原理》2e,张楚富主编,高教出版社,2011 主要参考书: [1] Lehninger Principles of Biochemistry, 5e, David Nelson & Michael Cox, 2009 [2] Color Atlas of Biochemistry, 2e, Jan Koolman, 2005 [3] Biochemistry for Dummies, John T Moore, 2008 [4] 生物化学考研精解,毛慧玲、朱笃主编,2007 一、课程性质、目的和任务 生物化学是研究生物体的化学组成和生命过程中化学变化规律的科学,是一门理论性和实践性并重的课程。本课程是生物科学各专业最重要的专业基础课之一,其学习目的和任务主要是: 1. 掌握基础生物化学内容以及基本的生物化学技术原理; 2. 认识生物化学和生物工程的相关关系; 3. 为学习微生物学、分子生物学、发酵及食品工艺学和生物制药学等后续专业课程打 好基础 二、课程的基本要求 本大纲分为掌握/记住、理解/熟悉及了解等层次要求 三、课程基本内容(授课顺序有所调整,参见教学进度表) 第一章绪论 1. 了解生物化学发展简史、推动生化研究飞跃发展的若干重大突破及相关学者 2. 了解当代生化研究的主要任务 3. 了解主要生物大分子的结构及功能 第二章氨基酸与肽 1. 掌握蛋白质中含有的氨基酸的结构特点 2. 理解氨基酸主要物性与结构的关系 3. 理解氨基酸的两性解离、等电点以及等电点pI与解离基团pK值的关系 4. 了解氨基酸的分类方法,记住氨基酸的三字母符号 5. 了解氨基酸的主要化学性质及特征反应 6. 了解蛋白质的概念及重要性,了解蛋白质的元素组成,掌握其氮含量特点 7. 掌握蛋白质的一级结构概念及其重要性
一、选择题 ( 共 9题 18分 ) 1. 2 分 (0207) 下列有关随机误差的论述中不正确的是-----------------------( ) (A) 随机误差具有随机性 (B) 随机误差具有单向性 (C) 随机误差在分析中是无法避免的 (D) 随机误差是由一些不确定的偶然因素造成的 2. 2 分 (5026) 莫尔法测定Cl-采用滴定剂及滴定方式是------------------------- ( ) (A)用Hg2+盐直接滴定 (B)用AgNO3直接滴定 (C)用AgNO3沉淀后,返滴定 (D)用Pb2+盐沉淀后,返滴定 3. 2 分 (0816) 采用EGTA(乙二醇二乙醚二胺四乙酸)作为络合滴定剂的主要优点是--------------( ) (A) 可在大量Mg2+存在下滴定Ca2+ (B) 可在大量Ca2+存在下滴定Mg2+ (C) 滴定Cu2+时, Zn2+,Cd2+等不干扰 (D) 滴定Ni2+时, Mn2+等不干扰 4. 2 分 (2224) 以下论述正确的是--------------------------------( ) (A) 单次测定偏差的代数和为零(B) 总体平均值就是真值 (C) 偏差用s表示(D) 随机误差有单向性
将酚酞分别加入MnS (a)的饱和水溶液;CuS(b)的饱和水溶液中 [已知:K sp(MnS)=2×10-10;K sp(CuS)=6×10-36; H2S: K a1=1.3×10-7, K a2=7.1×10-15],所观察到的现象是:--( ) (A) a、b均无色 (B) a中无色,b中呈红色 (C) a中呈红色 b中无色 (D) a、b均呈红色 6. 2 分 (2716) Fe3+与F-形成络合物的lgβ1~lgβ3分别为5.3,9.3和12.1,已知在某一pH时溶液中游离F-的浓度为 10-4.0mol/L,则溶液中铁络合物的主要存在形式是------------------( ) (A) FeF2+和FeF2+ (B) FeF2+和FeF3 (C) FeF2+ (D)FeF2+ 7. 2 分 (2708) 叙述Na2H2Y溶液以Y4-形式存在的分布系数[x(Y4-)]时,说法正确的是-------------( ) (A) x(Y4-)随酸度的增大而增大 (B) x(Y4-)随pH的增大而减小 (C) x(Y4-)随pH的增大而增大 (D) x(Y4-)与pH的大小无关 8. 2 分 (0721) 在pH=5.0的醋酸缓冲液中用0.002 mol/L的 EDTA 滴定同浓度的Pb2+。已知: lg K(PbY)=18.0, lgαY(H)=6.6, lgαPb(Ac)=2.0, 化学计量点时溶液中pPb应为---------------( ) (A) 8.2 (B) 6.2 (C) 5.2 (D) 3.2
南昌大学864有机化学考研心得 写这篇心得时,考研成绩还没有出来,闲着无事,写一下自己对于有机考研的感受,希望对以后能看到这篇文章的同学,即考南昌大学864有机化学的同学有所帮助。这里我只谈一下专业课的考试,南昌大学有机考研科目可分为以下:有机化学或物理化学(任选其一),分析化学或无机化学(任选其一),总共两门专业课,其中分析化学不含仪器分析。 详细如下(2012年考研的) 070303有机化学01有机合成化学02元素及金属有机化学 03有机光电子学04精细有机化学05有机材料化学【初试科目】 ①101思想政治 理论 ②201英语一 ③617无机化学 或635分析化学 ④854物理化学 或864有机化学 【复试科目】 专业课笔试 化学实验与技术 同等学力加试 ①普通化学 同等 学力 加试 ②任 选一 门初 试中 未考 科目 【初试书目】无机化学 (上、下册),武汉大 学,高等教育出版社; 分析化学(上册),武 汉大学主编,第五版, 高等教育出版社;有机 化学(上、下册),胡 宏纹(南京大学)编, 高等教育出版社;物理 化学(上、下册),傅 献彩等(南京大学), 高等教育出版社 【复试书目】现代化学
②物理化学实验与技术,陈六平, 邹世春编,科学出版 社;有机化学实验,兰 州大学,复旦大学编, 高等教育出版社;普通 化学,浙江大学普通化 学教研室编,第五版, 高等教育出版社;物理 化学简明教程,印永嘉 编,高等教育出版社 对于2013年考研的同学来说,复习准备从暑假就应开始了,在暑假结束时就应把专业课看一遍,要想考的很好,在正式考之前你至少应把书看三遍,除非你记忆很好,毕竟有机内容很多,不过从糖类以后的就不考了,2012年出了一个关于糖类的推断题,这部分内容最多出一个,我认为知识最好看一下,以防万一,至少不用看细,周环反应要看啊,重点。我从暑假开始复习专业课,复习了一遍以后,结果发现什么都没记住,还感叹看了就忘,以后我陆续看了第二第三遍,边做课后题(不考),边整理笔记,把易忘的分类整理,暑假也报了辅导班,感觉曲师大的有机老师的课件很好,(我不是曲师的),系统性很强对做题很有用,复习一遍有一遍的收获,只是在做合成题时有所生熟,我不甘心,再把有机看了一遍,这一遍我收获很大,有机关
生物化学实验报告 姓名:郭玥 学号: 3120100021 专业年级: 2012级护理本科 组别:第8实验室 生物化学与分子生物学实验教学中心
【实验报告第一部分(预习报告内容):①实验原理、②实验材料(包括实验样品、主要试剂、主要仪器与器材)、③实验步骤(包括实验流程、操作步骤和注意事项);评分(满分30分):XX】 实验目的:1、掌握盐析法分离蛋白质的原理和基本方法 2、掌握凝胶层析法分离蛋白质的原理和基本方法 3、掌握离子交换层析法分离蛋白质的原理和基本方法 4、掌握醋酸纤维素薄膜电泳法的原理和基本方法 5、了解柱层析技术 实验原理:1、蛋白质的分离和纯化是研究蛋白质化学及其生物学功能的重要手段。 2、不同蛋白质的分子量、溶解度及等电点等都有所不同。利用这些性质的差别, 可分离纯化各种蛋白质。 3、盐析法:盐析法是在蛋白质溶液中,加入无机盐至一定浓度或达饱和状态,可 使蛋白质在水中溶解度降低,从而分离出来。蛋白质溶液中加入中性盐后,由 于中性盐与水分子的亲和力大于蛋白质,致使蛋白质分子周围的水化膜减弱乃 至消失。中性盐加入蛋白质溶液后由于离子强度发生改变,蛋白质表面的电荷 大量被中和,更加导致蛋白质溶解度降低,蛋白质分子之间聚集而沉淀。
4、离子交换层析:离子交换层析是指流动相中的离子和固定相上的离子进行可逆 的交换,利用化合物的电荷性质及电荷量不同进行分离。 5、醋酸纤维素薄膜电泳原理:血清中各种蛋白质的等电点不同,一般都低于pH7.4。 它们在pH8.6的缓冲液中均解离带负电荷,在电场中向正极移动。由于血清中 各种蛋白质分子大小、形状及所带的电荷量不同,因而在醋酸纤维素薄膜上电 泳的速度也不同。因此可以将它们分离为清蛋白(Albumin)、α1-球蛋白、α 2-球蛋白、β-球蛋白、γ-球蛋白5条区带。 实验材料:人混合血清葡聚糖凝胶(G-25)层析柱 DEAE纤维离子交换层析柱饱和硫酸铵溶液 醋酸铵缓冲溶液 20%磺基水杨酸 1%BaCl 溶液氨基黑染色液 2 漂洗液 pH8.6巴比妥缓冲溶液 电泳仪、电泳槽 实验流程:盐析(粗分离)→葡聚糖凝胶层析(脱盐)→DEAE纤维素离子交换层析(纯化)→醋酸纤维素薄膜电泳(纯度鉴定) 实验步骤: (一)盐析+凝胶柱层析除盐:
2007年南昌大学生物化学考研真题 一、名词解释 1.蛋白质工程: 2.鞘磷脂: 3.增色效应: 4.解偶联剂: 5.substrate cycle: 6.essential fatty acid: 7.翻译后加工: 8.α-/β-异头物: 二、判断下列句子对与错,并说明理由 1.K m是酶的特征性常数,一种酶只有一个K m值。 2.mRNA的3'端大多具有poly A 尾链。 3.虽然两者的作用部位不同,但胰高血糖素的肾上腺素都能增高血糖含量。4.与NADH相似,NADPH也是主要经由呼吸链的电子传递以提供ATP。5.糖原磷酸化酶和糖原合酶经磷酸化共价修饰后均转化成相应的低活性形式。6.脂肪酸的生物合成并非只是其β-氧化反应的简单逆转。 7.嘌呤霉素只能抑制原核生物的蛋白质合成。 8.长期不适用蔬菜、水果会导致V A、V B、V C、V D、V E等多种维生素的缺乏。9.溴化氰(CNBr)能断裂Gly-Met-Pro三肽。
10.氨甲酰磷酸既可合成尿素,又可合成嘌呤核苷酸。 三、问答题 1.简述组氨酸(His)的作用。(5分) 2.生活在北极的哺乳动物腿部及蹄内与身体其他部位相比含有更多的不饱和脂肪酸。请解释该现象。(6分) 3.2006年诺贝尔生理学或医学奖的得主是谁?他或他们是哪个国家的?因何成就而获得此殊荣?(8分) 4.试述酶活性的调节方式有哪些?(10分) 5.请解释:细胞经紫外线照射后,置于黑暗处的细胞存活率远不及暴露于光下的细胞。(6分) 6.从一个正常的人体中分离到的脱氧血红蛋白其pI为6.7,从镰刀形红细胞贫血症患者中分离的脱氧血红蛋白,其pI为6.9。 (1)请对这种差别提出结构基础; (2)若在pH7.5的条件下进行电泳,对血红蛋白的电泳行为发生什么样的影响? 7.简要说明下列试剂在蛋白质的分离纯化和测定中的作用。 (1)国体硫酸铵 (2)三氯醋酸 (3)巯基乙醇 (4)溴酚蓝 (5)十二烷基硫酸钠
南方医科大学本科专业教学大纲 生物化学 Biochemistry 适用专业:临床医学专业(五年制本科) 基础医学专业(五年制本科) 医学影像学专业(五年制本科) 护理学专业(四年制本科) 医学检验专业(医学实验技术方向)(四年制本科) 医学检验专业(临床检验方向)(四年制本科) 生物技术专业(四年制本科) 生物信息学专业(四年制本科) 口腔医学专业(五年制本科) 执笔人:朱利娜 审定人:方振伟 学院负责人:马文丽 南方医科大学教务处 二零零六年十二月
一、课程简介 课程代码:B820006 学分:6分 学时:108学时 先修课程:基础化学、有机化学、医用物理学、细胞生物学 后续课程:病理生理学、医学微生物学、医学免疫学、医学遗传学、药理学、实验诊断学、内科学、外科学 适用专业:临床医学专业(五年制本科) 基础医学专业(五年制本科) 医学影像学专业(五年制本科) 护理学专业(四年制本科) 医学检验专业(医学实验技术方向)(四年制本科) 医学检验专业(临床检验方向)(四年制本科) 生物技术专业(四年制本科) 生物信息学专业(四年制本科) 口腔医学专业(五年制本科) 生物化学是一门应用化学的原理和方法在分子水平上研究生物体的化学组成,生物体分子结构与功能,物质代谢与调节,以及遗传信息的分子基础与调控规律的科学。生物化学与分子生物学的理论和技术已经渗透到基础医学和临床医学的各个领域:许多疾病的病理或征象都要用生化的理论在分子乃至基因水平上加以解释;生化的技术和方法应用于疾病诊断、治疗和预防等诸方面具有独特的优势,因而生物化学是一门极为重要的医学专业基础课程。本课程由生物化学和分子生物学两部分内容组成。通过教学要使学生掌握人体的化学组成,重要生物大分子的结构与功能及其相互关系,物质代谢的基本过程和调控规律,遗传信息的分子基础与调控规律,以及细胞间信息传递,血液、肝脏的生物化学等生命科学内容,为学习其它基础医学和临床医学课程以及医学各学科的研究工作中在分子水平上探讨疾病的病因、发病机理及疾病诊断、预防、治疗奠定扎实的理论基础。 Introduction COURSE CODE:B82006 UNITS OF CREDIT:6 HOURS OF CREDIT:108 REQUIRING COURSE:Basic Chemistry,Organic Chemistry,Medical Physics,Cell Biology COUNTINUING COURSE:Pathophysiology,Medical Microbiology,Medical Immunology, Medical Genetics,Pharmacology,Laboratory Diagnostics,Medicine, Surgery SUITED PROGRAM:Clinical Medicine(Undergraduate Courses For 5 Years) Basic Medicine(Undergraduate Courses For 5 Years) Medical Imageology(Undergraduate Courses For 5 Years)
南昌大学理学院化学系2018年考研知识点总结(部分)备注:此资料仅供南昌大学应届毕业生考本校硕士点复习使用,切勿流传入社会 一.无机化学(理论部分)知识点应用归纳 1、无机物(分子或离子)构型: (1)简单分子(或离子): (2)配合物: 2、物质的熔、沸点(包括硬度): (1)晶体类型:原子晶体,离子晶体,金属晶体,分子晶体 (2)离子晶体: (3)分子晶体 (4)金属晶体:金属键(与价电子、价轨道有关) 3、物质的稳定性: (1)无机小分子: (2)配合物: 4、物质的磁性: (1)无机小分子:MO(掌握双原子分子轨道能级图) (共价双原子分子) (2)配合物: 5、物质的颜色: (1)无机小分子:极化理论 (2)配合物: 6、无机物溶解度: (1)离子晶体: (2)共价化合物: 7、物质的氧化还原性:影响因素 (1)溶液酸、碱度 (2)物质的聚集状态 8、化学反应方向: (1)热力学数据: (2)软硬酸碱理论 9、分子极性、键的极性、键角、键长等: 10、推导元素在周期表中的位置:能级组取值, 选择—组合理量子数:四个量子数取值规则 11、溶液中有关质点浓度计算: 化学平衡,电离平衡,沉淀—溶解平衡,氧化—还原平衡,配合解离平衡: 利用多重平衡规则,K是关键 12、常见的基本概念: 对角线规则;惰性电子对效应;Lewis酸、碱;质子酸、碱;缓冲溶液;屏蔽效应;钻穿效应;同离子效应;盐效应;镧系收缩;电负性;电离势;电子亲合势;晶格能;键能;有效核电荷及求法等。 二.无机化学(元素部分) (1)结构 (2)性质: 重点是化学性质 第一讲分子结构(molecular structure) 1-1离子键理论 一、基本要点 活泼金属和活泼非金属的原子反应时,生成的化合物如NaCl等都是离子型化合物,它们具有一些固有的特征,如它们都以晶体的形式存在,具有较高的熔、沸点,在熔融态或水溶液中可导电等。 这种由于原子间发生电子转移,生成正负离子,并通过静电库仑作用而形成的化学键称为离子键。通常,生成离子键的条件是两原子的电负性差大于1.7以上,由离子键形成的化合物叫做离子键化合物。 二、离子特征 1、离子电荷: 是指原子在形成离子化合物过程中失去或获得的电子数。正离子电荷通常是+1、+2、+3或+4;阴离子:-1、-2,而-3、-4的负离子一般都是含氧酸根离子或配阴离子。