
第20卷 第4期2005年12月 西 南 科 技 大 学 学 报JOURNAL OF S OUTH W EST UN I V ERSI TY OF SC I E NCE AND TECHNOLOGY Vol .20No .4 Dec .2005
收稿日期:2005-05-09
不对称催化环氧化研究进展
刘思曼
(绵阳师范学院化学系 四川绵阳 621000)
摘要:综述了近年来Ti (O -i -Pr )4-DET 催化体系、手性Salen 催化体系、手性酮催化体系和负载手性催化体系等在不对称催化环氧化应用中的研究进展,并对其催化环氧化的特点进行了比较和讨论。Shar p less 催化体系具有操作简单、催化剂价廉易得、对映体选择性高的优点;Jacobsen 催化剂对双键环氧化有一定通用性,合成相对简单;手性酮催化剂能有效减少重金属污染;负载型催化剂具有催化剂易于回收、产物易于提纯等优点。
关键词:手性 不对称催化 环氧化 对映选择性
中图分类号:O621.3+4 文献标识码:A 文章编号:1671-8755(2005)04-0068-08
D evelop m en t of A sy mm etr i c Ca t a lyz i n g Epox i da ti on
L iu Si m an
(D epart m ent of Che m istry,M ianyang N or m al U niversity,M ianyang 621000,S ichuan,China )
Abstract:Catalysis syste m s used in asy mmetric catalyzing epoxidati on were revie wed .These syste m s in 2clude Ti (O -i -Pr )4-DET reagent,chiral Salen syste m ,chiral acet one reagent,l oaded chiral catalyst,and s o on .Their p r operties in catalyzing epoxidati on was discussed,t oo .Shar p less is a facile,easy operated and high enanti o -selectivity catalyst;Jacobsen catalyst has p r om ising industrial app licati on;chiral acet one reagent is p r os per ous in decreasing polluti on of heavy metal;l oaded catalyst is easy recycled and purified f or industrial value .
Key words:chiral;asy mmetric;epoxidati on;enanti o -selectivity
手性是人类赖以生存的自然属性,人体中起到不同生理作用的酶都具有手性,人体内的各个生理过程均是在高度不对称环境中进行的,因而不同手性的药物将具有不同的药理活性。1960年,作为镇静剂用的“反
应停”
(thalidom ide )以外消旋体直接使用,被孕妇服用后发生了多起胎儿致畸事件,直到1965年科学家们才发现只有S -型反应停具有镇静作用,而R -型反应停则有致畸作用。由此,美国药物和食品管理局在1992年3月发布了手性药物的指导原则,并要求在美国上市的手性药物必须进行拆分。
合成手性药物通常有化学合成后手性拆分和不对称催化合成两种手段。前者在合成药物时需消耗等当量的手性拆分剂,在具有几个手性中心的药物合成中,其消耗将成倍增长。后者仅需少量的手性催化剂,就可合成出大量的手性药物,且污染小,是符合环保要求的绿色合成,从而引起了人们的关注,近年来已成为有机化学界的研究热点。
双键的不对称催化氧化反应在手性药物的合成中具有很重要的地位。在这一领域,Shar p less 和Jacobs 2en 做出了突出的贡献[1~4]。
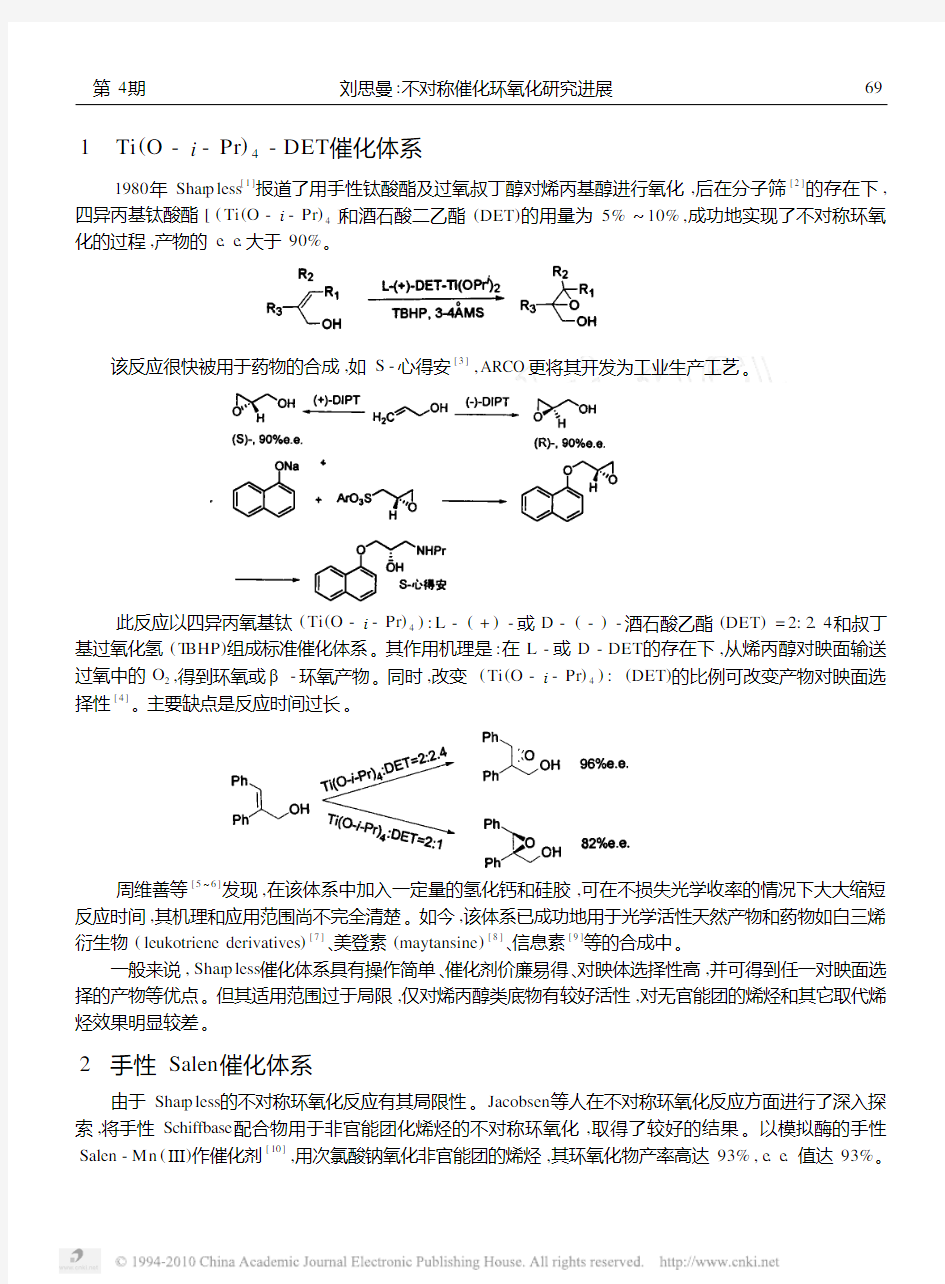
1 Ti (O -i -Pr )4-DET 催化体系
1980年Shar p less [1]报道了用手性钛酸酯及过氧叔丁醇对烯丙基醇进行氧化,后在分子筛[2]的存在下,四异丙基钛酸酯[(Ti (O -i -Pr )4]和酒石酸二乙酯(DET )的用量为5%~10%,成功地实现了不对称环氧化的过程,产物的e .e .大于90%
。
该反应很快被用于药物的合成,如S -
心得安[3],ARCO 更将其开发为工业生产工艺。
此反应以四异丙氧基钛(Ti (O -i -Pr )4):L -(+)-或D -(-)-酒石酸乙酯(DET )=2:2.4和叔丁基过氧化氢(T BHP )组成标准催化体系。其作用机理是:在L -或D -DET 的存在下,从烯丙醇对映面输送过氧中的O 2,得到环氧或β-环氧产物。同时,改变(Ti (O -i -Pr )4):(DET )的比例可改变产物对映面选择性[4]。主要缺点是反应时间过长。
周维善等[5~6]发现,在该体系中加入一定量的氢化钙和硅胶,可在不损失光学收率的情况下大大缩短反应时间,其机理和应用范围尚不完全清楚。如今,该体系已成功地用于光学活性天然产物和药物如白三烯
衍生物(leukotriene derivatives )[7]、美登素(maytansine )[8]、信息素[9]等的合成中。
一般来说,Shar p less 催化体系具有操作简单、催化剂价廉易得、对映体选择性高,并可得到任一对映面选择的产物等优点。但其适用范围过于局限,仅对烯丙醇类底物有较好活性,对无官能团的烯烃和其它取代烯烃效果明显较差。
2 手性Salen 催化体系
由于Shar p less 的不对称环氧化反应有其局限性。Jacobsen 等人在不对称环氧化反应方面进行了深入探索,将手性Schiffbase 配合物用于非官能团化烯烃的不对称环氧化,取得了较好的结果。以模拟酶的手性
Salen -Mn (Ⅲ)作催化剂[10],用次氯酸钠氧化非官能团的烯烃,其环氧化物产率高达93%,e .e .值达93%。
96 第4期 刘思曼:不对称催化环氧化研究进展
与此同时,日本Katsuki 研究小组
[11]也报道了下列手性Salen 配体的Mn (III )配合物对前手性的非功能
性烯烃的催化环氧化
。1994年Jacobsen 等[12]
又合成了被称之“创纪录催化剂”的手性Schiff 碱Mn (III )配合物,以13%NaCl O
水溶液为氧源、氧化吡啶为轴配体,在CH 2Cl 2溶液中,实现了PhCH =CHCOOE t 的不对称环氧化,创造了非酶催化的最好结果
。1996年Katsuki 合成了手性Schiff 碱Mn (III )配合物,并用于烯烃环氧化反应。
Mukaiya ma 等[13]
用分子氧为氧源,叔丁基甲醛作为还原剂,在101.325kPa 压力和室温下,用下列手性Schiff 碱Mn (III )配合物催化各种非功能性烯烃环氧化,其e .e%可达60%~70%
。07 西 南 科 技 大 学 学 报 2005
通过改变手性二胺和不同取代基的水杨醛很容易合成出一系列的催化剂[14~15],其通式如下
:
手性二胺主要有环己基二胺和1,2-二苯基乙二胺,水杨醛上的取代基:X =H,t
Bu,OMe;X ’=H,Me,t Bu,OMe,OSi i -Pr 3,中心金属也有采用Cr 、Co 、Mo 、W 等过渡金属[16]。Jacobsen 在研究取代基的电子效应[17]时发现,给电子基比吸电子基在催化环氧化时具有更高的e .e .值。此外还发现,当向催化体系中加
入少量的吡啶-N -氧化物的衍生物[18~19]或手性季胺盐[20](如金鸡纳碱、奎尼定、麻黄碱的衍生物)能有效
地提高转化率,e .e .值也有所增加。当催化剂为环己基二胺与4,6-二叔丁基水杨醛所生成的锰催化剂,以Na OCl 为氧源,不加对-苯基吡啶-N -氧化物时转化率为67%,加入后转化率达到98%,而e .e .值没有变
化,都达到了93%。Kochi [21]证实了吡啶-N -氧化物在环氧化中以轴向配体的方式参与到反应中,而Ja 2
cobsen
则进一步指出这种轴向配体作用能有效地阻止单氧配合物转化为μ-络合物而失活[15]。Pietik inen [22]在研究这一体系时,以H 2O 2为氧源,加入羧酸盐后,有明显的助催化作用。其原因之一被
认为是羧酸盐充当了碱的角色,使H 2O 2更易转化为HO 2-,从而有利于Mn (Ⅲ)生成Mn (Ⅲ)-O -OH,但
其真正原因尚不能清楚解释。
一般地,Jacobsen 催化剂对双键环氧化有一定通用性,如对顺式双取代烯烃、反式双取代烯烃[20]、三取
代烯烃[19]及四取代烯烃[23]等都取得了较好的结果,而催化剂的合成相对简单,是一类具有很好工业应用前景的催化体系。
3 手性酮催化体系
1984年,Curci [24]最早报道了手性酮用于烯烃的不对称环氧化,此后有大量研究成果见于报道[25~27]
。
该体系一般采用KHS O 5为氧化剂
,与手性酮原位反应生成di oxirane,后者可不对称环氧化烯烃,其反应过程图示如下:Yian Shi [28
]等用D -果糖为原料经两步反应合成了手性酮1,反应过程如图所示。
17 第4期 刘思曼:不对称催化环氧化研究进展
在这个体系中,pH 值对反应的影响非常显著。当pH 在7~8时,反应几乎不进行,转化率还不到10%,
而当pH 在11~13,转化率提高到80%以上,e .e .值[29]也达到80%左右。pH =12时,反应转化率达到最大
值。这说明OH -参与了反应。其机理[30]描述如下
:
由上图可知,中间体2易发生Baeyer -V iliiger 反应生成内酯而失活;当pH 值升高,碱浓度增大,则有利于2转化为3,转化率得以提高。该催化体系在反式烯烃和三取代烯的不对称氧化中有较高的活性,而对顺式烯烃和端烯(如苯乙烯)活性较差。采用CH 3CN 和二甲氧基甲烷(1:2,V /V )作溶剂,催化反式-β-甲基苯乙烯时,转化率为88%,e .e .为94%。
Dan Yang [30]等报道了手性酮远端非共轭取代基电子效应的存在。以R -香芹酮为原料合成了手性酮
7,后者在催化富电子烯时具有较高的e .e .值。尽管手性酮8中Cl 空间尺寸较9中甲基小,但同样条件下,催化环氧化反式-1,2-二苯基乙烯时,前者达到85%e .e .,而后者仅有32%e .e .。这一结果显然与空间位阻无关,其机理由远端基团电子效应解释
。
手性酮作为催化剂用于烯烃的不对称环氧化具有较高的产率和对映选择性,同时由于未使用金属,可有效减少重金属污染,是一类很有前途的催化体系,但研究相对较少,许多问题尚待解决。
4 负载手性催化体系
由于Jacobsen 等均相催化剂体系均存在无法回收、产物提纯不易等问题,为实现工业化带来困难。聚合物负载催化剂是解决这一问题研究最多的途径之一,归纳起来,主要有以下4种方法:
1)将Salen 结构以非共价键的形式嵌入到刚性基质中,如沸石、粘土、硅烷等。这种方法用于不对称环
氧化是成功的,但存在络合物易从基质中渗出及环氧化产率低的缺点[31]。
2)用无机物如硅胶、MC M -41等进行负载。这类催化剂催化活性随底物有所不同,但均存在对映面选
27 西 南 科 技 大 学 学 报 2005
择性低、转化率低、回收相对较困难等缺点[32]。
3)将侧链含有乙烯基的Salen 单体与有机聚合物如苯乙烯等共聚,可得到较好的环氧化产率,但对映面选择性很低。
4)将侧基Salen 结构以分步聚合的方式接在聚合物预聚体上的方法[33],其催化活性相对较高。Jan 2
da [34]等使用Janda Jel 交联树脂嫁接Salen -Mn 组成催化剂,环氧化苯乙烯及其衍生物,反应产物纯化容易,对映面选择性较高,e .e .值达88%,催化剂回收使用3次后,催化性能改变较小,具有一定实用价值
。
负载型催化剂具有催化剂易于回收,产物易于提纯等优点,具有较高的工业价值,因此20世纪90年代以来成为不对称催化领域研究的热点之一。但与均相催化剂相比,这类催化剂的转化率还很低,对映选择性差,使得在迈向工业化的道路上还需加倍努力。
5 其它
近年来,P .Page [35]发展了一类新的催化体系,以二氢异喹啉-N -取代衍生物为催化剂,KHS O 5为氧化
剂,当底物为反式-二苯基乙烯时,转化率达78%,e .e .值达73%。Juli á[36]等人于1980年代报道了聚氨基
酸用于查耳酮的环氧化反应。2004年,M ilitzer 等人研究了聚亮氨酸催化不对称环氧化反应,发现相转移催
化剂T BAB 能显著地提高反应的速度[37];同时,聚氨基酸合成中聚合温度较高,有利于催化剂的活性提
高[38]。K .M ika m i 在1997年提出了不对称活化(asy mmetric activati on )策略并发表在Nature [39]上。使用这种方法,一种手性甚至外消旋催化剂可以被另一种手性活化试剂通过分子识别对映选择性地活化,从而催化反应生成光学活性产物。目前运用这一策略的成功例子尚有较大局限,主要涉及领域为aldol 、D iels -A lder 、羧
基的烷基化和加氢反应等[40],在不对称催化环氧化上的应用还有待发展,但无疑会给化学家们带来新的思
路。
此外还有一大类催化剂,这就是卟啉衍生物。这类催化剂曾被认为是模拟细胞色素P -450最好的模型,在催化氧化研究上取得过很多成果。但在不对称催化领域,其催化环氧化的对映选择性与Jacobsen 等催化剂相比毫无优势,而催化剂本身价格高昂、合成及修饰相对更困难,近年来在不对称催化环氧化领域的研究逐渐减少。
6 结束语
不对称催化氧化研究已形成了Ti (O -i -Pr )4-ET 催化体系、手性Salen 催化体系、手性酮催化体系和负载手性催化体系等几大体系,并都各具特色,一些成果已成功应用于手性药物的生产中。但总的看来,这方面的研究还有很多问题需要解决,催化研究理论还很不健全,迈向工业化的路还很漫长,这一切都有待更多的科学家的关注和参与。
参考文献
1 Katsuki,T .and Shar p less,K . B.The First Practical M ethod f or A sy mmetric Epoxidati on [J ].J.Am.Che m.Soc .,1980,102(18):5974~5976
37 第4期 刘思曼:不对称催化环氧化研究进展
47 西 南 科 技 大 学 学 报 2005
2 Gao,Y.and Shar p less,K. B.Catalytic A sy mmetric Epoxidati on and Kinetic Res oluti on:Modified Pr ocedures I ncluding in Situ Derivatizati on[J].J.Am.Chem.Soc.,1987,109(19):5765~5780
3 Klunder,J.M.,Ona m i,T.and Shar p less,K. B.A renesulfonate Derivatives of Homochiral Glycidol:Versatile Chiral Building
B l ocks for O rganic Synthesis[J].J.O rg.Che m.,1989,54(6):1295~1304
4 Lu,L. D.,Johns on,R. A.,Finn.M.G.,and et al.T wo Ne w A sy mmetric Epoxidati on Catalysts.Unusual St oichi ometry and
I nverse Enanti ofacial Selecti on[J].J.O rg.Che m.,1984,49(4):728~731
5 W ang,Z.M.,Zhou,W.S.and L in,G.Q.Effect of Metal Hydride and Silica Gel on the Shar p less A sy mmetric Epoxidati on [J].Tetrahedr on Lett.,1985,26(50):6221~6224
6 W ang,Z.M.and Zhou,W.S.A sy mmetric Epoxidati on of A llylic A lcohol by the Modified Shar p less Reagent[J].Tetrahedr on, 1987,43(13):2935~2944
7 Corey,E.J.and Hashi m ot o,S.Chirally D irected Synthesis of(-)-methyl5(S),6(S)-oxido-7-hydr oxyhep tanoate,a Key I nter mediate f or the T otal Synthesis of Leukotrienes A,C,D and E,A.E.Bart on[J].J.Am.Che m.Soc.,1981,103(3): 721~722
8 Meyers,A.I.and Huds peth,J.P.Enanti oselective Synthesis of C3-C10Frag ment(Northeastern Zone)ofMaytansinoids with 4-chiral Centers(4S,5S,6R,7S)[J].Tetrahedr on Lett.,1981,22(40):3925~3928
9 Mori,K.and Ueda,H.Synthesis of the Op tically Active For m s of2,6-di m ethyl-1,5-hep tadien-3-ol Acetate,the Pher o2 mone of the Com st ock Mealybug[J].Tetrahedr on,1981,37(15):2581~2583
10 Zhang,W.,Loebach,J.L.,W ils on,S.R.and et al.Enanti oselective Epoxidati on of Unfuncti onalized O lefins Catalyzed by Salen Manganese Comp lexes[J].J.Am.Che m.Soc.,1990,112(7):2801~2803
11 Irie,R.,Noda,K.,It o,Y.and et al.Catalytic A sy mmetric Epoxidati on of Unfuncti onalized O lefins[J].Tetrahedr on Lett., 1990,31(50):7345~7348
12 Jacobsen,E.N.and Deng,L.Enanti oselective Catalytic Epoxidati on of Cinna mate Esters[J].Tetrahedr on,1994,50(15): 4323~4334
13 Ya mada,T.,I m aga wa,K.,Nagata,T.and et al.Enanti oselective Epoxidati on of Unfuncti onalized O lefins with Molecular Oxy2 gen and A ldehyde Catalyzed by Op tically Active Manganese(III)Comp lexes[J].Chem.Lett.,1992,11:2231~2234
14 Zhang,W.and Jacobsen,E.N.A sy mmetric O lefin Epoxidati on with Sodiu m Hypochl orite Catalyzed by Easily Prepared Chiral M anganese(III)Salen Comp lexes[J].J.O rg.Che m.,1991,56(7):2296~2298
15 Jacobsen,E.N.,Zhang,W.and Güler,M.L.Electr onic Tuning of A sy mmetric Catalysts[J].J.Am.Che m.Soc.,1991, 113(17):6703~6704
16 W ang,X.Y.,Shi,H.C.,Sun,C.and et al.A sy mmetric Epoxidati on of Cis-1-p r openyl phos phonic Acid(CPP A)Cata2 lyzed by Chiral Tungsten(V I)and Molybdenu m(V I)Comp lexes[J].Tetrahedr on,2004,60(48):10993~10998
17 Palucki,M.,Finney,N.S.,Pos p isil,P.J.and et al.The Mechanistic Basis f or Electr onic Effects on Enanti oselectivity in the (salen)Mn(III)-Catalyzed Epoxidati on Reacti on[J].J.Am.Che m.Soc.,1998,120(5):948~954
18 Jacobsen,E.N.,Deng,L.,Furuka wa,Y.and et al.Enanti oselective Catalytic Epoxidati on of Cinna mate Esters[J].Tetra2 hedr on,1994,50(15):4323~4334
19 B randes, B. D.and Jacobsen,E.N.H ighly Enanti oselective,Catalytic Epoxidati on of Trisubstituted O lefins[J].J.O rg.
Che m.,1994,59(16):4378~4380
20 Chang,S.,Galvin,J.M.and Jacobsen,E.N.Effect of Chiral Quaternary Ammoniu m Salts on(salen)Mn-Catalyzed Epoxi2 dati on of cis-O lefins.A H ighly Enanti oselective,Catalytic Route t o Trans-Epoxides[J].J.Am.Chem.S oc.,1994,116
(15):6937~6938
21 Sa m sel,E.G.,Srinivasan,K.and Kochi,J.K.Mechanis m of the Chr om iu m-catalyzed Epoxidati on of O lefins.Role of oxo2 chr om iu m(V)cati ons[J].J.Am.Che m.Soc.,1985,107(25):7606~7617
22 Pietik?inen,P.Convenient A sy mmetric(Salen)M n(III)-catalyzed Epoxidati on of Unfuncti onalized A lkenes with Hydr ogen Per oxide U sing Carboxylate Salt Cocatalysts[J].Tetrahedr on,1998,54(17):4319~4326
23 B randes,B. D.and Jacobsen,E.N.Enanti oselective Catalytic Epoxidati on of Tetrasubstituted O lefins[J].Tetrahedr on Lett., 1995,36(29):5123~5126
24 Curci,R.,Fi orentino,M.and Seri o,M.R.A sy mmetric Epoxidati on of Unfuncti onalized A lkenes by D i oxirane I nter mediates
Generated fr om Potassiu m Per oxomonosulfate and Chiral ket ones [J ].J.Che m.Soc .,Che https://www.doczj.com/doc/bb1076811.html,mun .,1984:155~156
25 Curci,R.,Accolti,L. D.,Fi orentino,M.and et al .Enanti oselective Epoxidati on of Unfuncti on A lized A lkenes U sing D i ox 2
iranes Generated in Situ [J ].Tetrahedr on Lett .,1995,36(22):5831~5834
26 B r own,D.S .,M ar p les,B. A.,S m ith,P .and et al .Epoxidati on with D i oxiranes Derived fr om 2-fluor o -2-substituted -1
-tetral ones and -1-indanones [J ].Tetrahedr on,1995,51(12):3587~3606
27 Yang,D.,Yi p,Y .C .Tang,M.W.and et al .A C2Sy mmetric Chiral Ket one for Catalytic A sy mmetric Epoxidati on of Unfunc 2
ti onalized O lefins [J ].J.Am.Che m.Soc .,1996,118(2):491~492
28 W ang,Z .X .,Tu,Y .,Fr ohn,M.and et al .An Efficient Catalytic A sy mmetric Epoxidati on Method[J ].J.Am.Che m.Soc .,
1997,119(46):11224~11235
29 W ang,Z .X .and Shi,Y .A PH Study on the Chiral Ket one Catalyzed A sy mmetric Epoxidati on of Hydr oxyalkenes [J ].J.O rg .
Che m.,1998,63(9):3099~3104
30 Yang,D.,Yi p,Y .C .,Chen,J.and et al .Significant Effects of Nonconjugated Remote Substituents in Catalytic A sy mmetric
Epoxidati on [J ].J.Am.Che m.S oc .,1998,120(30):7659~7660
31 Ogun wu m i,S .and Bein,T .
I ntrazeolite A sse mbly of a Chiral Manganese Salen Epoxidati on Catalyst [J ].Che https://www.doczj.com/doc/bb1076811.html,mun .,1997,(9):901~902
32 Pini,D.,M andoli,A.,O rlandi,S .and et al .First Examp le of a Silica Gel -supported Op tically Active Mn (III )-salen Com 2
p lex as a Heter ogeneous A sy mmetric Catalyst in the Epoxidati on of O lefins [J ].Tetrahedr on:A sy mmetry,1999,10:3883~3886
33 Canali,L.,Cowan,E .,Deleuze,H.and et al .Re markable Matrix Effect in Poly mer -supported JacobsensA lkene Epoxidati on
Catalysts[J ].Che https://www.doczj.com/doc/bb1076811.html,mun,1998,(23):2561~2562
34 Reger,T .S .and Janda,K . D.Poly mer -Supported (Salen )M n Catalysts f or A sy mmetric Epoxidati on:A Comparis on Bet w een
Soluble and I ns oluble Matrices [J ].J.Am.Che m.S oc .,2000,122(29):6929~6934
35 Juli á,S .,Masana,J.and Vega,J.C .Synthetic Enzy mes.H ighly Stereoselective Epoxidati on of Chalcone in a Tri phasic T olu 2
ene -W ater -Poly[(S )-alanine ]Syste m [J ].Ange w .Che m.,I nt .Ed .Engl .1980,19(11):929~931
36 Thomas,G .,Kr üger,C .M.and M ilitzer,H.C .Scop ing the Tri phasic /PTC Conditi ons f or the Juli á-Col onna Epoxidati on Re 2
acti on [J ].Tetrahedr on Lett .2004,45(26):5069~5071
37 Thomas,G .,Gerlach,A.,Kr üger,C .M.and et al .Novel Conditi ons for the Juli á-Col onna Epoxidati on Reacti on Pr oviding
Efficient Access t o Chiral,Nonrace m ic Epoxides [J ].Tetrahedr on Lett .2004,45(26):5065~5067
38 Page,P .C . B.,Rassias,G . A.,Bethell,D.and et al .A Ne w Syste m f or Catalytic A sy mmetric Epoxidati on U sing I m iniu m
Salt Catalysts [J ].J.O rg .Che m.,1998,63(8):2774~2777
39 M ika m i,K .and Matsuka wa,S .A sy mmetric Synthesis by Enanti omer -selective Activati on of Racem ic Catalysts[J ].Nature,
1997,385:613~615
40 丁奎岭,林国强.催化不对称反应新近展———不对称活化[J ].有机化学,2000,20(1):1~1057 第4期 刘思曼:不对称催化环氧化研究进展
烯烃的不对称环氧化反应 ************* 摘要 本文主要论述了传统的烯烃环氧化反应的不足之处,并简述了Sharpless以及Jacobsen 等人在不对称环氧化反应发面的研究成果及其贡献。并简要讨论了未来的研究方向。 关键词烯烃环氧化手性合成催化剂 前言 手性化合物具有十分重要的应用价值,然而其合成具有很大的难度。因此,目前有机合成化学家们在手性合成这一领域展开了大量的研究工作,新的不对称合成反应和合成路线不断涌现。 在不对称合成中最具有挑战性的是不对称催化反应,它是利用催化剂的不对称中心来诱导产生产物的手性。 研究类容及讨论 通常在没有手性催化剂的条件下,实验室中常用有机过酸作环氧化试剂。环氧化反应是顺势加成,所以环氧化合物的构型与原料烯烃的构型保持一致。因为环氧化反应可以在双键平面的任一侧进行,所以当平面两侧空阻相同,而产物的环碳原子为手性碳原子时,产物是一对外消旋体。当平面两侧的空阻不同时,位阻小的反应快,如此便能得到以某种构型为主的混合产物。 因该方法只能用于大量合成空间位阻较小的产物,并不能满足手性合成的需求,因此化学工作者们作出了进一步探究。其中最著名的是20世纪80年代初Sharpless发展的不对称环氧化。在该反应中D-酒石酸二乙酯作为手性源控制环氧化只从双键平面的一边进行。如果在反应中用L-酒石酸二乙酯,那么环氧化将从双建平面的另一边进行。只需要催化剂量的光学纯酒石酸二乙酯就可以实现高度对映选择性的环氧化。【1】 图2. Sharpless不对称环氧化反应 Sharpless的不对称环氧化适用于双键α位上含羟基的底物——烯丙醇类化合物。20世
化学试剂,2005,27(8),459~463;499 专论与综述 催化分子氧氧化醇类的研究进展 李长辉3,李容,郑国钧,赵秀芳 (中国医学科学院中国协和医科大学药物研究所,北京 100050) 摘要:综述了用氧气或空气(分子氧)作为化学计量氧化剂,在催化剂作用下氧化醇类的研究进展,并对某些代表性的催化氧化反应的特点和选择性进行了讨论。 关键词:醇;催化氧化;分子氧;氧气;空气;均相催化;非均相催化 中图分类号:T Q224;O643.322 文献标识码:A 文章编号:025823283(2005)0820459205 收稿日期:2004210213作者简介:李长辉(19752),男,四川泸州人,硕士,实习研究员,主要研究方向为生物活性天然产物的全合成。 醇的氧化是有机合成和工业生产中制备羰基化合物的重要方法,应用化学剂量的氧化剂对醇进行氧化的方法沿用已久,所用的氧化剂包括无 机过渡金属氧化物和盐类,以及一些金属配合物等[1]。使用化学计量氧化剂的方法至今仍然在有机合成领域广泛应用,并在许多方面取得不小进步,但是从经济学以及环境学方面考虑,迫切需要使用氧气、空气等环保、清洁、符合原子经济性的氧化剂,在此过程中,除目标产物外,水为惟一副产物。 R R ′ OH 催化剂O 2(或空气) R R ′ O +H 2O 其中:R ,R ′=烷基,芳基或H 本文分均相催化氧化和非均相催化氧化两大 类,概要的介绍这一领域的最新进展,并对某些催化氧化反应的特点和选择性进行讨论。1 均相催化氧化 由于反应物和催化剂存在于同一相中,均相 催化体现出活性高、选择性好等优点。111 金属/TE MPO 催化体系 氮氧自由基类作为比较成熟的氧化剂(或催化剂),无论在实验室还是工业生产中,都已广泛地用于醇的氧化,2,2,6,62四甲基哌啶2N 2氧化物(TE MPO )是其中最重要的一个。TE MPO (1)是一个氮氧自由基,本身的氧化作用并不强,但其分解产物中的氮氧正离子(2)却是强的氧化剂,可以氧化各种醇成相应的羰基化合物,而自身被还原成为氮羟基化合物(3),继而重新被氧化成自由基形态。 自1984年Semmelhack 等 [2] 首次报道CuCl/ TE MPO 体系催化氧气进行伯醇的氧化以来,这一 体系在近年来取得许多进展。最近,Sheldon 等[3] 报道[Cu (Ⅱ)2(2,2′2二吡啶)]/TE MPO 体系以碱作为共催化剂,在室温下催化氧气将伯醇选择性地氧化成醛,对仲醇没有影响。Marko 等[4]也报 道了CuCl/1,102菲咯啉/二叔丁基胺二乙酸盐在温和条件下催化伯醇的选择性氧化取得很好效果。 TE MPO 催化氧化历程 研究发现,用其他金属化合物替代CuCl ,可 以取得更好的效果,Sheldon 等[5]使用Ru (PPh 3)32Cl 2/TE MPO 体系,顺利地催化活泼和不活泼的醇 高选择性(>99%)地氧化成相应的醛酮。使用12辛醇和22辛醇进行竞争实验表明,对伯醇的选择性高于仲醇(混合反应,二者的转化率分别为80%和10%)。其缺点是较高的氧气压力(1MPa ),反应温度(100℃)及三苯基膦配体自身的热不稳定性。此外,底物中的S ,N ,O 等原子会与Ru 离子配合而导致催化剂失活。Minisci 等[6]报 道了双金属的Mn (Ⅱ )2C o (Ⅱ)/TE MPO 体系,近室温条件高收率(>95%)地催化了一系列苄醇、脂肪伯醇和仲醇的氧化。此反应以醋酸作为溶剂,需使用大量价格昂贵的TE MPO (>10m ol %)。 112 Pd (Ⅱ )类催化剂9 54第27卷第8期李长辉等:催化分子氧氧化醇类的研究进展
已知: 1、 如何鉴别1-丙醇与2-丙醇。 2、 分子式为C 5H 12O 的醇,其中能被氧化为醛的结构是哪几种?能被氧化为酮的是哪几种?不能被氧化的是哪几种? 3、分子式为C 4H 8的烃可以发生如图转化: 其中E 、F 均呈酸性。 写出下列物质的结构简式: C 4H 8: C : D : E : F : C 4H 8 R —CH 2OH R —CHO ; 氧化 R’ R CH —OH 氧化 R —C —R ’ O (酮); 则很难被氧化(R 、R ’、R ’’表示烃基)。 R —C —OH R ’ R ’’
4、(2012房山期末1,16分)已知:Ⅰ. 质谱分析测得有机化合物A的相对分子质量为92.5 ;其含碳、氢的质量分数分别为51.89% 、9.73% ,其余为氯。 Ⅱ. A有如下转化关系: Ⅲ. 与羟基相连的碳上没有氢原子的醇(结构: )不能发生催化氧化反应。 Ⅳ. F的核磁共振氢谱有两种峰,峰高比值为1:9 , 不能发生催化氧化反应。 Ⅴ. E和G都能和新制的Cu(OH)2悬浊液反应, H是一种有果香味的液体。 写出下列物质的结构简式: F:C: B:A: D:E: G:H: 5、由C= CH3 CH2 选择合适的途径制备 CH2 C= COOH(C COOH CH2 )。(写流程图) 6. (11东城期末)23.(14分)上海世博会英国馆――种子圣殿,由六万多根透明的亚克力[其
分子式是(C 5H 8O 2)n ]杆构建而成。某同学从提供的原料库中选择一种原料X ,设计合成高分子亚克力的路线如下图所示: 原料库: a 、CH 2=CHCH 3 b 、CH 2=CHCH 2CH 3 c 、CH 2=CCH 3 , d 、CH 2CHCH 3 已知:① (不易被氧化成羧酸) ② 不易被氧化成醛或酮 ③ (R 、R ’、R ’’表示烃基) 写出下列物质的结构简式: X : A : B : C : D : E : F : 亚克力: R —C —R ’(H) O HCN R —C —R ’(H) OH H +/H 2O R —C —R ’(H) OH R ’’ R —C —R ’ OH R —C —R ’ O R —CH —R ’ OH [O] CH 3 CH 3
第五章不对称氧化反应 氧原子直接与不对称碳原子相连的含氧取代基广泛存在于天然产物和药物中,同时也容易被其它基团如氨基,卤原子,硫原子甚至烷基等取代,成为所合成化合物重要的官能部分。不对称氧化反应可以直接在反应物中引入含氧取代基,使所连接的碳原子具有手性,是极其重要的一类反应,对这类反应的研究,已经取得了引人瞩目的发展,但仍然是不对称合成研究的重点。 3.1 烯丙醇烯烃的不对称环氧化 3.1.1 Sharpless反应及特点 烯烃的环氧化最开始使用过酸作氧化剂来完成的,因此很早就有人使用手性的过酸来进行不对称环氧化,但e.e.值一般都低于20%,普遍认为这是由于手性中心离反应中心太远了。后来发现了过渡金属催化的环氧化反应,因此很多手性配体的金属配合物用于不对称环氧化的研究,但结果都不是特别好。Sharpless在经过10年多的潜心研究后,终于在1980年发展了高效的金属钛-酒石酸酯不对称环氧化催化剂,这种催化剂适用于非常广泛的烯丙醇类烯烃,具有能和生物酶比美的高的催化活性和对映体选择性,容易得到,价格便宜,自从发现以来广为人们用于合成手性的烯丙醇的环氧化物。因此,Sharpless 获得了2001年的诺贝尔化学奖。 Sharpless不对称环氧化催化剂使用钛酸异丙酯中的钛作为催化中心,天然或者人工合成的作为手性配体,叔丁基过氧化氢(TBHB)为供氧剂,以无水的二氯甲烷为溶剂,在-20o C下对烯丙醇类烯烃进行环氧化,反应一般在24小时左右完成,产率70-90%,对映体选择性大于90%。 Me COOH, Ti(O-i-Pr) 22 o 70 - 90% O R2R1 R3 OH >90% ee D-(-)-tartrate L-(+)-tartrate 将等摩尔的钛酸异丙酯和酒石酸二异丙酯(DIPT)混合,即释放出2当量的异丙醇,同时生成Ti(O-i-Pr)2(DIPT)2配合物。通过分子量测定,
甲醇电催化氧化可能的机理及研究进展 甲醇在电极上氧化为 CO2需要传输 6 个电子,但是 6 个电子同时传递是不太可能的。部分电子的传输导致一系列稳定的、可溶的中间产物的形成也是不太可能的。很明显,在铂电极催化剂表面上一定有表面吸附物质,正是这些物质抑制了催化剂的活性。关于甲醇氧化反应的机理研究,在不同的电解质中可能不同。一般认为在酸性电解质中,甲醇在 Pt 电极上的氧化机理为[i],[ii]: 2Pt + CH3OH → Pt-CH2OH + Pt-H ( 1-4) 2Pt + Pt-CH2OH → Pt2-CHOH + Pt-H (1-5) 2Pt + Pt2-CHOH → Pt3-COH + Pt-H (1-6) Pt-H → Pt + H+ +e- (1-7) Pt3-COH → Pt2-C=O + H+Pt + e-→ Pt-C≡O + Pt (1-8) 可以看出甲醇首先吸附在 Pt 的表面,同时脱去氢,反应速度由大到小依次为是(1-6),(1-5),(1-4)。Pt3-COH 是主要的吸附物质,即甲醇氧化的中间体,(1-7)反应极快,但在缺少活性氧时,(1-8)占主导地位。从上述方程式中不难看出,要保证催化剂不被毒化,就必须尽量避免反应(1-8)的发生,而只有电极表面含有大量含氧物种时,氧化反应才能发生。活性含氧物种通过如下反应发生: M + H2O → M-OHads + H+ + e- (1-9) 其中 M 可以是 Pt 或其它金属,如 Ru,Sn 等,对于 Pt 来说,Pt-OH ads很难在低电位时大量产生,不能有效阻止中毒现象的发生,因此往往引入其它金属,使得在较低电位下就能够生成大量的含氧物种,促进氧化发应的发生。活性含氧物种与甲醇吸附中间体之间的反应如下: Pt-CH2OH + M-OH ads→ HCHO + Pt + M + H2O (1-10) Pt2-CHOH + M-OH ads→ HCOOH + 2Pt + M + H2O (1-11) Pt3-COH + M-OH ads→ CO2+ 3Pt + M + 2H++ 2e- (1-12) 在阳极上甲醇氧化的总反应为:CH3OH + H2O → CO2↑ + 6H++ 6e- (1-13) 分析这些反应表明,甲醇氧化是一个涉及多步脱氢的复杂过程,只有在电极表面生成大量含氧物种,甲醇才能完全氧化生成 CO2。同时,对于实用的直接甲醇燃料电池在降低催化剂中毒的同时还要避免反应(1-8)的发生,保证甲醇完全氧化生成 CO2。 目前对甲醇电化学氧化的机理在某些方面还存在争议。其中一个主要争议是:甲醇在Pt电极上的氧化究竟是通过平行反应路径 (在平行路径中,CO是作为一个副产物形成,甲醇被直接氧化成CO2) 还是通过连续反应路径进行。Wang等人[iii]采用双薄层电解池与质谱结合定量测定了甲醇氧化中间产物,认为两种路径同时存在,即一个路径是通过吸附CO进行,另一个路径是通过溶解中间物 (甲醛和甲酸) 进行,这
为你成材 尽我所能 - 37 - 师生同心 金石为开 已知: 1、 如何鉴别1-丙醇与2-丙醇。 2、 分子式为C 5H 12O 的醇,其中能被氧化为醛的结构是哪几种?能被氧化为酮的是哪几种?不能被氧化的是哪几种? 3、分子式为C 4H 8的烃可以发生如图转化: 其中E 、F 均呈酸性。 写出下列物质的结构简式: C 4H 8: C : D : E : F : C 4H 8 R —CH 2OH R —CHO ; 氧化 R’ R CH —OH 氧化 R ——R ’ O (酮); 则很难被氧化(R 、R ’、R ’’表示烃基)。 R —C —OH R ’ R ’’
为你成材 尽我所能 - 38 - 师生同心 金石为开 4、(2012房山期末1,16分)已知:Ⅰ. 质谱分析测得有机化合物A 的相对分子质量为92.5 ;其含碳、氢的质量分数分别为51.89% 、9.73% ,其余为氯。 Ⅱ. A 有如下转化关系: Ⅲ. 与羟基相连的碳上没有氢原子的醇(结构: )不能发生催化氧化反应。 Ⅳ. F 的核磁共振氢谱有两种峰,峰高比值为1:9 , 不能发生催化氧化反应。 Ⅴ. E 和G 都能和新制的Cu(OH)2悬浊液反应, H 是一种有果香味的液体。 写出下列物质的结构简式: F : C : B : A : D : E : G : H : 5、由选择合适的途径制备 ( C COOH CH 2 )。(写流程图) C=CH 3 CH 2 CH 2C=COOH
为你成材 尽我所能 - 39 - 师生同心 金石为开 6. (11东城期末)23.(14分)上海世博会英国馆――种子圣殿,由六万多根透明的亚克力[其分子式是(C 5H 8O 2)n ]杆构建而成。某同学从提供的原料库中选择一种原料X ,设计合成高分子亚克力的路线如下图所示: 原料库: a 、CH 2=CHCH 3 b 、CH 2=CHCH 2CH 3 c 、CH 2=CCH 3 , d 、CH 2CHCH 3 已知:① (不易被氧化成羧酸) ② 不易被氧化成醛或酮 ③ (R 、R ’、R ’’表示烃基) 写出下列物质的结构简式: X : A : B : C : D : E : F : 亚克力: R ——R ’(H) O HCN R ——R ’(H) OH CN H + /H 2O R ——R ’(H) OH COOH ’’ R —C —R ’ OH R ——R ’ O R ——R ’ OH [O] CH 3 CH 3
手性药物及其不对称催化合成的研究进展 【摘要】本文介绍了手性药物的重要性和类型;结合实例对不对称催化法合成 手性药物作简要概述,尤其是化学不对称催化技术,包括不对称催化氢化、羰基的不对称催化还原、不对称催化氧化、不对称环丙烷化、不对称催化羰基化及不对称催化加成反应等;展望了不对称催化反应在手性药物合成中的发展方向。 【关键词】手性药物;不对称催化反应;合成 手性是自然界的普遍特征。作为生命活动重要基础的生物大分子,如蛋白质、多糖、核酸和酶等几乎全是手性的。当今世界常用的化学药物中手性药物占据了超过60%的比例,它们的药理作用是通过与体内大分子之间严格手性匹配与分子识别实现的。近年来,世界手性药物的销售总额也在不断增加,据资料统计,1995年为425亿美元,1997年为900亿美元,2000年已超过1200亿美元[1],2010年可望超过2500亿美元。由于市场巨大,已经引起了学术界和工业界的极大重视,并在国际上兴起手性技术的热潮。 1 手性药物及其药理活性 在生命的产生和演变过程中,自然界往往对一种手性有所偏爱,如自然界存在的糖为D-构型,氨基酸为L-构型,蛋白质和DNA的螺旋构象又都是右旋的。所以,当手性药物、农药等化合物作用于这个不对称的生物界时,由于它们的分子的立体结构在生物体内引起不同的分子识别造成“手性识别”现象,两个异构体在人体内的药理活性、代谢过程及毒性往往存在显著的差异,具体可能存在以下几种情况[2]: 1. 1 一个对映体具有显著的活性,另一对映体活性很低或无此活性例如普萘洛尔(propranolol)的(-阻滞作用中,S-普萘洛尔的活性是其R-普萘洛尔的100倍以上。 1. 2 对映体之间有相同或相近的某一活性例如噻吗洛尔(timolol)两个对映体都具有降低眼压治疗青光眼的作用,其中S-噻吗洛尔为(-阻滞剂,用它制备滴眼液治疗青光眼时,曾引起支气管收缩,使有支气管哮喘史的患者致死,所以仅R-噻吗洛尔治疗青光眼是安全的。因此从全面平衡仍宜选用单一对映体。 1. 3 对映体活性相同,但程度有差异例如S-氯胺酮(ketamine)的麻醉镇痛作用是R-氯胺酮的1/3,但致幻作用较R型强。 1. 4 对映体具有不同性质的药理活性例如(2S,3R)-丙氧芬(右丙氧芬)是止痛药,(2R,3S)-丙氧芬(左丙氧芬)是镇咳药。 1. 5 一个对映体具有疗效,另一对映体产生副作用或毒性-个典型的例子是20世纪50年代末期发生在欧洲的“反应停”事件,孕妇因服用沙利度胺(俗称“反应停”)而导致海豹畸形儿的惨剧。后来研究发现,沙利度胺包含两种不同构型的光学异构体,(R)-对映体具有镇静作用,而(S)-对映体具有强致畸作用。 以前由于对此缺少认识,人类曾经有过惨痛的教训。因此,如何合成手性分子的单一光学异构体就成了化学研究领域的热门话题,同时也是化学家面临的巨大挑战。近年来各大制药公司正在研发的和已上市的药物中,以单一对映异构体上市或研究的药物分别占到相当大比例。由于手性药物市场前景看好,巴斯夫、陶氏化学、罗地亚等国际知名企业均成立了各自的手性中间体开发机构。但是我国手性药物工业与世界发展水平尚有较大差距。
醇类电催化氧化催化剂的研究进展 摘要:直接醇类燃料电池(DAFC)是以小分子醇类为燃料、直接将化学能转化为电能的装置。它具有能量转化效率高、燃料来源丰富、储运方便、成本低廉等优点,是理想的便携式电源。为提高碱性介质中多壁碳纳米管(MWCNT)负载 Pd 基催化剂对醇类电氧化反应的催化活性及抗中毒能力,本文采用乙二醇还原法制备了Pd/MWCNT 催化剂,并引入过渡金属进行改性,制备了 PdM/MWCNT(M = Ni、Mo、Ce)二元催化剂。采用透射电子显微镜(TEM)、X-射线光电谱(XPS)及差热分析(DTA)等手段对催化剂的形貌、组成及结构进行表征。以循环伏安法(CV)、线性扫描伏安法(LSV)、电化学阻抗谱(EIS)及计时电流法(CA)等电化学方法考察了催化剂在醇类电氧化反应中的催化活性及抗中毒能力。主要研究结果如下: (1)采用乙二醇还原法制备了 Pd/MWCNT 催化剂与 PdNi/MWCNT 催化剂,结果表明添加 Ni 后的催化剂在载体表面分散更均匀,平均粒径为 2.34nm。PdNi/MWCNT 催化剂中 Ni 主要以 Ni(OH)2和 NiOOH 形式存在,在碱性溶液中对甲醇的电催化氧化表现出较高的活性。 (2)通过 PdM/MWCNT(M=Mo、Ce)催化剂的优化实验,发现 Mo、Ce 纳米粒子的添加有助于提高催化剂的催化能力,且当 Pd:Mo=1:0.2、Pd:Ce=1:0.1 时,350℃焙烧制得的 PdMo/MWCNT、PdCe/MWCNT 催化剂分别对甲醇、乙醇的电催化氧化活性较为突出,抗 CO 中毒能力较强。 (3)通过对助催化剂钼、铈化合物的焙烧,发现随着温度的升高,金属氧化物的生成量增多,能为催化剂提供较丰富的含氧物种,促进中间产物的继续氧化,从而提高催化剂的抗中毒能力;但焙烧温度过高,会引起催化剂的导电能力下降,甚至破坏碳纳米管载体的结构,使催化剂失效。 Abstrac t: the direct alcohol fuel cell (DAFC) is a device which can convert chemical energy into electrical energy by the small molecule alcohol as fuel.. It has the advantages of high energy conversion efficiency, rich fuel source, convenient transportation, low cost, etc., is the ideal portable power source. In order to improve the alkaline medium multi
第20卷 第4期2005年12月 西 南 科 技 大 学 学 报JOURNAL OF S OUTH W EST UN I V ERSI TY OF SC I E NCE AND TECHNOLOGY Vol .20No .4 Dec .2005 收稿日期:2005-05-09 不对称催化环氧化研究进展 刘思曼 (绵阳师范学院化学系 四川绵阳 621000) 摘要:综述了近年来Ti (O -i -Pr )4-DET 催化体系、手性Salen 催化体系、手性酮催化体系和负载手性催化体系等在不对称催化环氧化应用中的研究进展,并对其催化环氧化的特点进行了比较和讨论。Shar p less 催化体系具有操作简单、催化剂价廉易得、对映体选择性高的优点;Jacobsen 催化剂对双键环氧化有一定通用性,合成相对简单;手性酮催化剂能有效减少重金属污染;负载型催化剂具有催化剂易于回收、产物易于提纯等优点。 关键词:手性 不对称催化 环氧化 对映选择性 中图分类号:O621.3+4 文献标识码:A 文章编号:1671-8755(2005)04-0068-08 D evelop m en t of A sy mm etr i c Ca t a lyz i n g Epox i da ti on L iu Si m an (D epart m ent of Che m istry,M ianyang N or m al U niversity,M ianyang 621000,S ichuan,China ) Abstract:Catalysis syste m s used in asy mmetric catalyzing epoxidati on were revie wed .These syste m s in 2clude Ti (O -i -Pr )4-DET reagent,chiral Salen syste m ,chiral acet one reagent,l oaded chiral catalyst,and s o on .Their p r operties in catalyzing epoxidati on was discussed,t oo .Shar p less is a facile,easy operated and high enanti o -selectivity catalyst;Jacobsen catalyst has p r om ising industrial app licati on;chiral acet one reagent is p r os per ous in decreasing polluti on of heavy metal;l oaded catalyst is easy recycled and purified f or industrial value . Key words:chiral;asy mmetric;epoxidati on;enanti o -selectivity 手性是人类赖以生存的自然属性,人体中起到不同生理作用的酶都具有手性,人体内的各个生理过程均是在高度不对称环境中进行的,因而不同手性的药物将具有不同的药理活性。1960年,作为镇静剂用的“反 应停” (thalidom ide )以外消旋体直接使用,被孕妇服用后发生了多起胎儿致畸事件,直到1965年科学家们才发现只有S -型反应停具有镇静作用,而R -型反应停则有致畸作用。由此,美国药物和食品管理局在1992年3月发布了手性药物的指导原则,并要求在美国上市的手性药物必须进行拆分。 合成手性药物通常有化学合成后手性拆分和不对称催化合成两种手段。前者在合成药物时需消耗等当量的手性拆分剂,在具有几个手性中心的药物合成中,其消耗将成倍增长。后者仅需少量的手性催化剂,就可合成出大量的手性药物,且污染小,是符合环保要求的绿色合成,从而引起了人们的关注,近年来已成为有机化学界的研究热点。 双键的不对称催化氧化反应在手性药物的合成中具有很重要的地位。在这一领域,Shar p less 和Jacobs 2en 做出了突出的贡献[1~4]。
收稿:2006年6月,收修改稿:2006年8月 3河北省自然科学基金项目(N o.299158)和河北农业大学科研发展基金项目(N o.2005018)资助33通讯联系人 e 2mail :wangc69@https://www.doczj.com/doc/bb1076811.html, 手性联萘酚配合物催化的缺电子烯烃 不对称环氧化反应 3 高勇军 马晶军 吴秋华 臧晓欢 王 春 33 (河北农业大学理学院 保定071001) 摘 要 缺电子烯烃的不对称环氧化反应是有机合成领域最具挑战性的课题之一。手性联萘酚配体所 修饰的催化剂是一种很优异的C 2轴对称手性诱导源,可以催化各种α,β2不饱和羰基化合物例如α,β2不饱和酮、α,β2不饱和酰胺,α,β2不饱和羧酸酯等的不对称环氧化反应,具有良好的催化活性和对映选择性。本文对由手性联萘酚类配体所修饰的小分子催化剂、聚合物负载的催化剂和自负载催化剂在不饱和羰基化合物的催化不对称环氧化反应中的应用进行了综述,探讨了催化剂结构、配位金属原子、添加物、氧化剂、溶剂和反应温度等因素对手性联萘酚催化剂催化效能和对映选择性的影响。 关键词 手性联萘酚 不对称环氧化 对映选择性 中图分类号:O62113;O623142+ 5 文献标识码:A 文章编号:10052281X (2007)0520796209 Asymmetric Epoxidation of E lectron 2Deficient Olefins C atalyzed by Coordination Compound Derived from Chiral Binaphthol and Its Derivatives Gao Yongjun Ma Jingjun Wu Qiuhua Zang Xiaohuan Wang Chun 33 (C ollege of Sciences ,Agricultural University of Hebei ,Baoding 071001,China ) Abstract The asymmetric epoxidation of electron 2deficient olefins ,especially α,β2unsaturated carbonyl com pounds ,is one of the m ost challenging fields in m ordern organic synthesis in recent years.The catalysts m odified by chiral 1,1′2bi 222naphthol and its derivatives are excellent chiral C 22symmetric inducers which can catalyze the asymmetric epoxidation reaction of electron 2deficient olefins with high catalytic activity and excellent enantioselectivity.The substrates inv olves α,β2unsaturated ketones ,α,β2unsaturated carboxylic acid amides ,α,β2unsaturated esters and s o on.The applications of small m olecular catalysts generated from optically active 1,1′2bi 222naphthol and its derivatives,polymer 2supported catalysts and self 2supported catalysts in the asymmetric epoxidation reaction of α,β2unsaturated carbonyl com pounds are reviewed in this paper.In addition ,the catalytic activity and enantioselectivity in fluenced by the structures of the catalysts derived from chiral binaphthol derivatives ,coordinative metal atoms ,additives ,oxidants ,s olvents and reaction tem perature are als o discussed. K ey w ords chiral binaphthol ;asymmetric epoxidation ;enantioselectivity 1 引言 近年来对于单一手性的医药、农药、香料、香精和食品添加剂等精细化学品以及电子工业对手性液 晶和功能高分子材料的需求,无论在数量上还是种 类上都越来越多,因此手性技术日益兴起。在有机合成领域,由于催化不对称合成反应很容易实现不对称增值,从而成为以化学手段获得光学活性物质 第19卷第5期2007年5月 化 学 进 展 PROG RESS I N CHE MISTRY Vol.19No.5 May ,2007