
常用溶剂的沸点、溶解性和毒性 溶剂名称沸点(101.3kPa)溶解性毒性 液氨-33.35℃特殊溶解性:能溶解碱金属和碱土金属剧毒性、腐蚀性 液态二氧化硫-10.08 溶解胺、醚、醇苯酚、有机酸、芳香烃、溴、二硫化碳,多数饱和烃不溶剧毒 甲胺-6.3 是多数有机物和无机物的优良溶剂,液态甲胺与水、醚、苯、丙酮、低级醇混溶,其盐酸盐易溶于水,不溶于醇、醚、酮、氯仿、乙酸乙酯中等毒性,易燃 二甲胺7.4 是有机物和无机物的优良溶剂,溶于水、低级醇、醚、低极性溶剂强烈刺激性 石油醚不溶于水,与丙酮、*****、乙酸乙酯、苯、氯仿及甲醇以上高级醇混溶与低级烷相似 ***** 34.6 微溶于水,易溶与盐酸.与醇、醚、石油醚、苯、氯仿等多数有机溶剂混溶*****性 戊烷36.1 与乙醇、*****等多数有机溶剂混溶低毒性员?婷疋0? 二氯甲烷39.75 与醇、醚、氯仿、苯、二硫化碳等有机溶剂混溶低毒,*****性强 二硫化碳46.23 微溶与水,与多种有机溶剂混溶*****性,强刺激性 溶剂石油脑与乙醇、丙酮、戊醇混溶较其他石油系溶剂大 丙酮56.12 与水、醇、醚、烃混溶低毒,类乙醇,但较大 1,1-二氯乙烷57.28 与醇、醚等大多数有机溶剂混溶低毒、局部刺激性 氯仿61.15 与乙醇、*****、石油醚、卤代烃、四氯化碳、二硫化碳等混溶中等毒性,强*****性甲醇64.5 与水、*****、醇、酯、卤代烃、苯、酮混溶中等毒性,*****性 四氢呋喃66 优良溶剂,与水混溶,很好的溶解乙醇、*****、脂肪烃、芳香烃、氯化烃吸入微毒,经口低毒己烷68.7 甲醇部分溶解,比乙醇高的醇、醚丙酮、氯仿混溶低毒。*****性,刺激性 三氟代乙酸71.78 与水,乙醇,*****,丙酮,苯,四氯化碳,己烷混溶,溶解多种脂肪族,芳香族化合物 1,1,1-三氯乙烷74.0 与丙酮、、甲醇、*****、苯、四氯化碳等有机溶剂混溶低毒类溶剂 四氯化碳76.75 与醇、醚、石油醚、石油脑、冰醋酸、二硫化碳、氯代烃混溶氯代甲烷中,毒性最强 乙酸乙酯77.112 与醇、醚、氯仿、丙酮、苯等大多数有机溶剂溶解,能溶解某些金属盐低毒,*****性 乙醇78.3 与水、*****、氯仿、酯、烃类衍生物等有机溶剂混溶微毒类,*****性 丁酮79.64 与丙酮相似,与醇、醚、苯等大多数有机溶剂混溶低毒,毒性强于丙酮 苯80.10 难溶于水,与甘油、乙二醇、乙醇、氯仿、*****、、四氯化碳、二硫化碳、丙酮、甲苯、二甲苯、冰醋酸、脂肪烃等大多有机物混溶强烈毒性 乙睛81.60 与水、甲醇、乙酸甲酯、乙酸乙酯、丙酮、醚、氯仿、四氯化碳、氯乙烯及各种不饱和烃混溶,但是不与饱和烃混溶中等毒性,大量吸入蒸气,引起急性中毒 异丙醇82.40 与乙醇、*****、氯仿、水混溶微毒,类似乙醇 1,2-二氯乙烷83.48 与乙醇、*****、氯仿、四氯化碳等多种有机溶剂混溶高毒性、致癌 乙二醇二甲醚85.2 溶于水,与醇、醚、酮、酯、烃、氯代烃等多种有机溶剂混溶。能溶解各种树脂,还是二氧化硫、氯代甲烷、乙烯等气体的优良溶剂吸入和经口低毒 三氯乙烯87.19 不溶于水,与乙醇.*****、丙酮、苯、乙酸乙酯、脂肪族氯代烃、汽油混溶有机有毒品_ 三乙胺89.6 水:18.7以下混溶,以上微溶。易溶于氯仿、丙酮,溶于乙醇、***** 易爆,皮肤黏膜刺激性强 丙睛97.35 溶解醇、醚、DMF、乙二胺等有机物,与多种金属盐形成加成有机物高度性,与氢氰酸相似 庚烷98.4 与己烷类似低毒,刺激性、*****性
化学溶解性表 图例 溶:该物质可溶于水 难:难溶于水(溶解度小于0.01g,几乎可以看成不溶,但实际溶解了极少量,绝对不溶于水的物质几乎没有) 微:微溶于水 挥:易挥发或易分解 —:该物质不存在或遇水发生水解
常见沉淀 白色:BaSO4 BaCO3 CaCO3 AgCl Ag2CO3 Mg(OH)2 Fe(OH)2 Al(OH)3 CuCO3 ZnCO3 MnCO3 Zn(OH)2 蓝色:Cu(OH)2 浅黄色:AgBr 红褐色:Fe(OH)3 溶解性口诀 溶解性口诀一 钾钠铵盐溶水快,① 硫酸盐除去钡银铅钙。② 氯化物不溶氯化银, 硝酸盐溶液都透明。③ 氢氧根多溶一个钡④ 口诀中未有皆下沉。⑤ 注:①钾钠铵盐都溶于水; ②硫酸盐中只有硫酸钡、硫酸铅不溶(硫酸钙硫酸银微溶也是沉淀); ③硝酸盐都溶于水; ④碱性物质中除了钾离子钠离子铵离子锂离子还有钡离子也可溶 ⑤口诀中没有涉及的盐类都不溶于水; 溶解性口诀二 钾、钠、铵盐、硝酸盐; 氯化物除银、亚汞; 硫酸盐除钡和铅; 碳酸、磷酸盐,只溶钾、钠、铵。 说明,以上四句歌谣概括了8类相加在水中溶解与不溶的情况。 溶解性口诀三 钾钠铵硝皆可溶、盐酸盐不溶银亚汞; 硫酸盐不溶钡和铅、碳磷酸盐多不溶。 多数酸溶碱少溶、只有钾钠铵钡溶 溶解性口诀四 钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。) 盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。) 再说硫酸盐,不容有钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。) 其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物) 只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶) 最后说碱类,钾、钠、铵和钡。(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶) 另有几种微溶物,可单独记住。 溶解性口诀五(适合初中化学课本后面的附录) 钾钠铵盐硝酸盐① 氢氧根多钡离子② 硫酸盐除钡钙银③ 碳酸溶氢钾钠铵④ 生成沉淀氯化银⑤ 溶解性口诀六(初学记忆) 不是沉淀物……我们初中的口诀是 钾【化合物】、钠【化合物】、铵【铵根】、硝【硝酸盐】都可溶 氯化物里银不溶 硫酸盐里钡不溶 注:①钾盐、钠盐、铵盐、硝酸盐都溶于水 ②除了以上四种,氢氧根和钡离子结合时也溶于水 ③硫酸根除了和钡离子、钙离子、银离子结合时不溶于水,其他都溶 ④碳酸根除了和氢离子、钾离子、钠离子和铵离子结合时溶于水,其他都不溶 ⑤氯离子只有和银离子结合时不溶于水
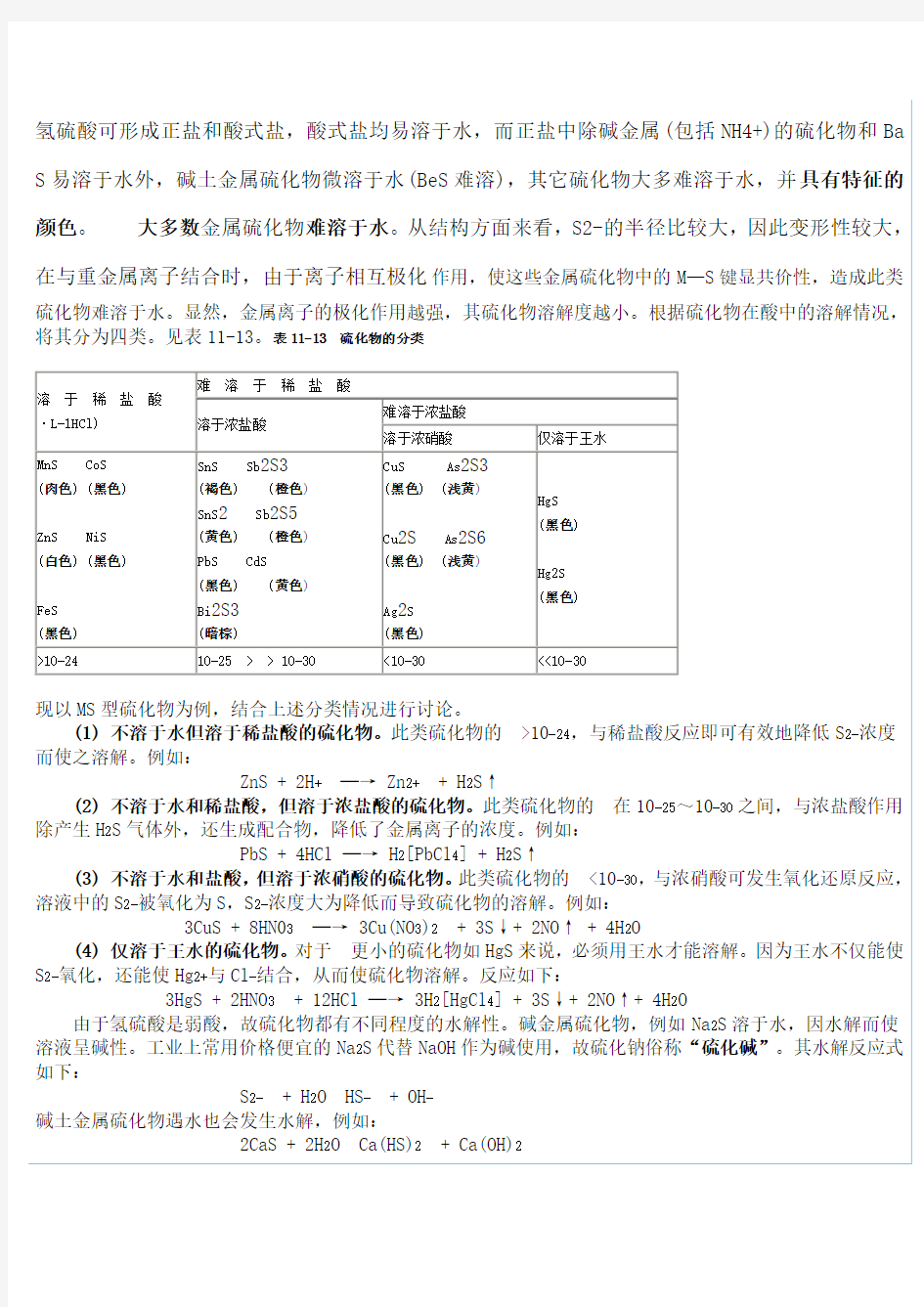
现以MS型硫化物为例,结合上述分类情况进行讨论。 (1) 不溶于水但溶于稀盐酸的硫化物。此类硫化物的>10-24,与稀盐酸反应即可有效地降低S2-浓度而使之溶解。例如:ZnS + 2H+→ Zn2++ H2S↑
(2) 不溶于水和稀盐酸,但溶于浓盐酸的硫化物。此类硫化物的在10-25~10-30之间,与浓盐酸作用除产生H2S气体外,还生成配合物,降低了金属离子的浓度。例如: PbS + 4HCl → H2[PbCl4] + H2S↑ (3) 不溶于水和盐酸,但溶于浓硝酸的硫化物。此类硫化物的<10-30,与浓硝酸可发生氧化还原反应,溶液中的S2-被氧化为S,S2-浓度大为降低而导致硫化物的溶解。例如: 3CuS + 8HNO3→ 3Cu(NO3)2+ 3S↓+ 2NO↑+ 4H2O (4) 仅溶于王水的硫化物。对于更小的硫化物如HgS来说,必须用王水才能溶解。因为王水不仅能使S2-氧化,还能使Hg2+与Cl-结合,从而使硫化物溶解。反应如下: 3HgS + 2HNO3+ 12HCl → 3H2[HgCl4] + 3S↓+ 2NO↑+ 4H2O 由于氢硫酸是弱酸,故硫化物都有不同程度的水解性。碱金属硫化物,例如Na2S溶于水,因水解而使溶液呈碱性。工业上常用价格便宜的Na2S代替NaOH作为碱使用,故硫化钠俗称“硫化碱”。其水解反应式如下: S2-+ H 2O HS-+ OH- 碱土金属硫化物遇水也会发生水解,例如: 2CaS + 2H 2O Ca(HS)2+ Ca(OH)2 某些氧化数较高金属的硫化物如Al2S3、Cr2S3等遇水发生完全水解: Al2S3+ 6H2O ==2Al(OH)3↓+ 3H2S↑
硫化物的溶解性 杜晓莹 高一化学第六章《氧族元素》在讲授“氢硫酸与某些重金属盐反应”这一性质时,经常会碰到这样的问题: H2S + CuSO4=CuS↓+ H2SO4 H2S + Pb(NO3)2=PbS↓+ 2HNO3 H2S + FeCl2 -→(不反应) 如果是通过对鲜明的实验现象让学生接受上述反应并不困难。但是往往有学生会有这样的疑问:这些反应为什么有的能发生,有的不能发生?能发生的反应是不是复分解反应?弱酸怎么能制取强酸?要理解这些问题就必须弄清硫化物在水中的溶解性。新教材对硫化物的要求已不是很高,为了方便学生学习和教师参考,现将硫化物的溶解性归纳如下。 硫化物可以看作是氢硫酸所生成的正盐,一般认为是由电负性较硫小的元素与硫形成的化合物,其中大多数为金属硫化物。自然界中金属硫化物矿约200余种。有辉铜矿Cu2S、辉锑矿Sb2S3、辉钼矿MoS2、闪锌矿ZnS、方铅矿PbS、辰砂HgS、黄铁矿FeS2、雄黄As4S4、雌黄As2S3、辉铋矿Bi2S3、黄铜矿CuFeS2、斑铜矿Cu5FeS4等,无碱金属、碱土金属(Be除外)硫化物矿。 在金属硫化物中,碱金属硫化物和CaS、BaS是易溶于水的,其余碱土金属硫化物微溶于水(除BeS难溶),其余大多数硫化物都是难溶于水,并具有不同颜色的固体。实际应用中常利用硫化物的特殊颜色来鉴别和判断所含的金属离子。 硫化物在水中或酸中的溶解包括溶解和电离两个过程,根据溶解平衡的观点硫化物的溶解过程显然与溶液中的硫离子浓度有很大关系,故了解硫化物的溶解性首先要知道H2S的溶解性。在饱和的H2S水溶液中H+和S2-浓度之间的关系是: [ H+ ]2[ S2- ]=9.23×10-22 从上式可以看出,溶液的PH值与S2-浓度密切相关。 同样,难溶金属硫化物在水中的溶解情况也与其溶度积常数有一定关系。若溶液中金属离子和硫离子浓度的乘积小于该金属硫化物的Kθsp,此时该硫化物在溶液中以溶解状态存在。实际操作中,可用控制溶液酸度的方法使一些金属硫化物溶解。在酸性溶液中H+浓度大,S2-浓度低,所以只能沉淀出溶度积小的金属硫化物。而在碱性溶液中H+浓度小,S2-浓度高,可以将多种金属离子沉淀成硫化物。 在水中,由于S2-离子是弱酸根离子,所以金属硫化物无论是微溶还是易溶,都有不同程度的水解作用。即使是难溶金属硫化物,其溶解部分也会发生水解。使溶液显碱性: Na2S + H2O =NaHS + NaOH(Na2S溶液显强碱性,可作为强碱使用) 2CaS + 2H2O =Ca(OH)2 + Ca(HS)2 2BaS + 2H2O =Ca(OH)2 + Ba(HS)2
土壤可溶性有机氮、硝态氮、铵态氮、微生物量氮最方便最简单的测定方法 1.母液制样:称取新鲜土壤(30.0g)于放置烧杯中,加约等于田间持水量60%水在25℃下培养7~15d。取15.0g土于烧杯,置于真空干燥器中,同时内放一装有用100ml精制氯仿的小烧杯,密封真空干燥器,密封好的真空干燥器连到真空泵上,抽真空至氯仿沸腾5分钟,静置5分钟,再抽滤5分钟,同样操作三次。干燥器放入25℃培养箱中24小时后,抽真空15-30分钟以除尽土壤吸附的氯仿。按照土:0.5M K2SO4=1:4(烘干土算,一般就是湿土:0.5M K2SO4=1:2),加入0.5M K2SO4溶液(未熏蒸为空白直接称取15.0g土,加同样比例0.5M K2SO4溶液)震荡30分钟,过滤。其中熏蒸后的土壤过滤液为A母液,未熏蒸的土壤过滤液为B母液。母液要是不及时测定,需立即在-15℃以下保存 2.测定 可溶性有机氮=可溶性全氮-(铵态氮+硝态氮) 要是有流动分析仪器还有TOC的话可以利用A母液测得碳氮减去B母液的碳氮含量根据公式计算得出微生物碳氮,可以用B母液测的铵态氮、硝态氮和可溶性全氮,是很方便的。 以下的是用传统的方法测定以上指标,经过852个土壤样品试验结果还是很好的。
土壤可溶性全氮测定 氧化剂:将6g NaOH 和30g K2S2O8溶于蒸馏水中并定容至1 L(K2S2O8 比较难溶,在低于60℃得瑟水浴中溶解,高于60℃配置的溶液至其氧化性失效,NaOH制成溶液,致其温度达到常温后与K2S2O8 溶液混合定容至1L) 测定:移取A母液10ml至消化试管,加入10ml氧化剂,水浴中加热,温度升高到120℃后保持90min,使用紫外分光光度计测定A220和A275,空白需加入1ml氧化剂并同时作水浴处理。(Tips:农化上母液与氧化剂各取25ml,此处取其比例为1:1。) 标准曲线:0.7218g硝酸钾溶于水中,转入1000ml容量瓶中定容摇匀,制得浓度为100mg/L的氮标准贮存液。稀释10倍即为10mg/L 的氮标准溶液。吸取氮标准溶液(梯度为0ml,1ml,2ml,3ml,4ml,5ml,6ml;对应浓度分别为0 mg/L,0.02 mg/L,0.04 mg/L,0.06 mg/L,0.08 mg/L,0.10 mg/L,0.12mg/L)于50ml容量瓶中,各加入1ml 氧化剂并定容,得氮的标准系列,与样品同样消煮测定A220和A275。以A(A= A220-A275)为纵标,氮浓度为横标绘制标准曲线。 硝态氮测定1 注:硝态氮测定1仅适合于农田土壤,腐殖质含量比较低的土壤,森林土壤和腐殖质含量比较高的土壤不适用,因为森林土壤和腐殖质高的土壤有腐植酸的颜色,干扰比色可采用硝态氮测定2进行测定
硫化物的溶解性归纳氢硫酸可形成正盐和酸式盐,酸式盐均易溶于水,而正盐中除碱金属(包括NH4+)的硫化物和BaS易溶于水外,碱土金属硫化物微溶于水(BeS难溶),其它硫化物大多难溶于水,并具有特征的颜色。大多数金属硫化物难溶于水。从结构方面来看,S2-的半径比较大,因此变形性较大,在与重金属离子结合时,由于离子相互极化作用,使这些金属硫化物中的M—S键显共价性,造成此类硫化物难溶于水。显然,金属离子的极化作用越强,其硫化物溶解度越小。根据硫化物在酸中的溶解情况,将其分为四类。见表11-13。表11-13 硫化物的分类 溶于稀盐酸(0.3mol·L-1HCl) 难溶于稀盐酸 溶于浓盐酸 难溶于浓盐酸 溶于浓硝酸仅溶于王水 MnS CoS (肉色) (黑色) ZnS NiS (白色) (黑色) FeS (黑色) SnS Sb2S3 (褐色) (橙色) SnS2Sb2S5 (黄色) (橙色) PbS CdS (黑色) (黄色) Bi2S3 (暗棕) CuS As2S3 (黑色) (浅黄) Cu2S As2S6 (黑色) (浅黄) Ag2S (黑色) HgS (黑色) Hg2S (黑色) >10-2410-25 > > 10-30<10-30<<10-30 现以MS型硫化物为例,结合上述分类情况进行讨论。 (1) 不溶于水但溶于稀盐酸的硫化物。此类硫化物的>10-24,与稀盐酸反应即可有效地降低S2-浓度而使之溶解。例如: ZnS + 2H+─→ Zn2+ + H2S↑ (2) 不溶于水和稀盐酸,但溶于浓盐酸的硫化物。此类硫化物的在10-25~10-30之间,与浓盐酸作用除产生H2S气体外,还生成配合物,降低了金属离子的浓度。例如:
硫化物的溶解性归纳 氢硫酸可形成正盐和酸式盐,酸式盐均易溶于水,而正盐中除碱金属(包括NH4+)的硫化物和BaS易溶于水外,碱土金属硫化物微溶于水(BeS 难溶),其它硫化物大多难溶于水,并具有特征的颜色。大多数金属硫化物难溶于水。从结构方面来看,S2-的半径比较大,因此变形性较大,在与重金属离子结合时,由于离子相互极化作用,使这些金属硫化 物中的M—S键显共价性,造成此类硫化物难溶于水。显然,金属离子的极化作用越强,其硫化物溶解度越小。根据硫化物在酸中的溶解情况,将其分为四类。见表11-13。表11-13 硫化物的分类 现以MS型硫化物为例,结合上述分类情况进行讨论。 (1) 不溶于水但溶于稀盐酸的硫化物。此类硫化物的>10-24,与稀盐酸反应即可有效地降低S2-浓度而使之溶解。例如: ZnS + 2H+─→ Zn2+ + H2S↑ (2) 不溶于水和稀盐酸,但溶于浓盐酸的硫化物。此类硫化物的在10-25~10-30之间,与浓盐酸作用除产生H2S气体外,还生成配合物,降低了金属离子的浓度。例如: PbS + 4HCl ─→ H2[PbCl4] + H2S↑
(3) 不溶于水和盐酸,但溶于浓硝酸的硫化物。此类硫化物的<10-30,与浓硝酸可发生氧化还原反应,溶液中的S2-被氧化为S,S2-浓度大为降低而导致硫化物的溶解。例如: 3CuS + 8HN03─→ 3Cu(NO3)2+ 3S↓+ 2NO↑ + 4H2O (4) 仅溶于王水的硫化物。对于更小的硫化物如HgS来说,必须用王水才能溶解。因为王水不仅能使S2-氧化,还能使Hg2+与Cl-结合,从而使硫化物溶解。反应如下: 3HgS + 2HNO3+ 12HCl ─→ 3H2[HgCl4] + 3S↓+ 2NO↑+ 4H2O 由于氢硫酸是弱酸,故硫化物都有不同程度的水解性。碱金属硫化物,例如Na2S溶于水,因水解而使溶液呈碱性。工业上常用价格便宜的Na2S代替NaOH 作为碱使用,故硫化钠俗称“硫化碱”。其水解反应式如下: S2- + H2O HS- + OH- 碱土金属硫化物遇水也会发生水解,例如: 2CaS + 2H2O Ca(HS)2 + Ca(OH)2 某些氧化数较高金属的硫化物如Al2S3、Cr2S3等遇水发生完全水解: Al2S3 + 6H2O ─→ 2Al(OH)3↓ + 3H2S↑ Cr2S3 + 6H2O ─→ 2Cr(OH)3↓ + 3H2S↑ 因此这些金属硫化物在水溶液中是不存在的。制备这些硫化物必须用干法,如用金属铝粉和硫粉直接化合生成Al2S3。 可溶性硫化物可用作还原剂,制造硫化染料、脱毛剂、农药和鞣革,也用于制荧光粉。 判断金属硫化物的溶解性 (1)K→Na的金属硫化物易溶于水。 (2)Mg→Al的金属硫化物易水解,在水中不存在。 (3)Zn→Pb的金属硫化物均不溶于水。 16 判断金属硫化物的颜色 (1)K→Zn的金属硫化物为无色或白色。
可溶性有机碳测定: 1. 取10 g 新鲜土样,按照土:水为1∶5的比例混匀,在25℃条件下,以250 r/min 的速度振荡1 h,接着在转速为15 000 r/min 离心10min,上部悬浮液过0·45μm 薄滤膜[1],以后的步骤采取测有机碳的方。 2. 取过0·45μm 薄滤膜的溶液放入消煮管中,加5ml 0.8000mol/L 的1/6K 2Cr 2O 7标准溶液, 然后用注射器注人5ml 浓硫酸,旋转摇匀,在消煮管上加一小漏斗。 3. 将盛土样的消煮放人铁丝笼架中,放入已预热至185 -190oC 的油浴锅中(豆油)加热。 此时应控制锅内温度在170-180oC ,沸腾开始,准确加热5min ,取出冷却,如溶液呈绿色,表示重铬酸钾用量不足,应再取较少的样品(或适当增加重铬酸钾的量)重做。 4. 冷却后的溶液呈橙黄色或黄绿色,用洗瓶将消煮管中的溶液洗人250ml 三角瓶中,使三 角瓶内溶液体积在60-80ml 左右,加邻啡啰啉指示剂3—4滴,用0.2mol /L FeSO 4滴定,溶液的颜色变化为:橙黄—→蓝绿—→棕红色,记录硫酸亚铁用量(V )。 每批分析样,应做2—3个空白;空白标定用0.1-0.5g 石英砂代替土样,其它步骤与测定土样时完全相同,记录硫酸亚铁用量(V 0)。 5. 计算方法 有机碳(g/kg )=10001.1003.0)(0.58000.02100????-??K m V V V 有机质(g/kg )=有机碳(g/kg )×1.724 式中:0.8000——1/6 K 2Cr 2O 7标准溶液的浓度(mol/L ); 5.0——1/6 K 2Cr 2O 7标准溶液的体积(ml ); V 0——空白标定用去硫酸亚铁溶液体积(ml ); V ——滴定土样用去硫酸亚铁溶液体积(ml ); 0.003——1/4碳原子的摩尔质量(g/m mol); 1.1——氧化校正系数; 1.724——将有机碳换算成有机质的系数; m 1——风干土样质量(g ); K 2——将风干土换算成烘干土系数。土壤碳氮比的计算: )/() /(kg g kg g 全氮有机碳碳氮比= 1.耕作措施对土壤有机碳和活性有机碳的影响.严昌荣,刘恩科,何文清,刘爽,刘勤.
生态环境学报 2010, 19(1): 45-50 https://www.doczj.com/doc/bf5600552.html, Ecology and Environmental Sciences E-mail: editor@https://www.doczj.com/doc/bf5600552.html, 基金项目:福建省自然科学基金青年基金项目(2009J05033);国家自然科学基金青年基金项目(20807033) 作者简介:罗专溪(1979年生),男,博士,主要从事污染物在水环境介质中的行为过程研究。E-mail: zxluo@https://www.doczj.com/doc/bf5600552.html, *通讯作者:颜昌宙,研究员,博士。E-mail: czyan@https://www.doczj.com/doc/bf5600552.html, 收稿日期:2009-10-30 淡水水体溶解有机氮对有毒藻种的生物有效性 罗专溪1 ,魏群山1 ,王振红2 ,颜昌宙 1* 1. 中国科学院城市环境研究所城市环境与健康重点实验室, 福建 厦门 361021; 2. 漳州师范学院化学与环境科学系, 福建 漳州 363000 摘要:溶解有机氮(Dissolved organic nitrogen, DON )是多数天然水体中溶解氮的主要组成部分。天然水体DON 是许多微生命体包括有毒藻种的氮营养源,在供水安全以及水体富营养化等方面的生态环境效应不容忽视。文章系统地介绍了淡水水体DON 含量与来源、生物有效性与估算方法,以及对有毒藻种生长的影响。DON 的来源是影响水体中DON 含量动态特征的关键因素。DON 来源包括陆地径流,植物碎屑,土壤淋溶液,沉积物释放,大气沉降,藻类、大型植物、细菌与细胞死亡或自我分解,微型及大型浮游动物捕食和排泄、分泌物释放等。研究表明约有12%~72%的DON 可迅速被生物所利用,具显著差异,究其原因可能是其来源组成、化学本质(分子质量与极性)、测试生物组成、是否有细菌作用等因素造成的。不同藻种具有不同氮源利用能力,DON 对藻类生长具有直接或间接的作用,并可能影响藻类群落结构(有毒藻类成为优势种)。考虑到水环境保护与饮用水安全供水的重要性,未来研究应重视淡水水体DON 生物有效性与其化学本质的揭示,尤其是对有毒藻种。 关键词:溶解有机氮;生物有效性;有毒藻种 中图分类号:X17 文献标识码:A 文章编号:1674-5906(2010)01-0045-06 全世界河流中的总氮有14%~90%由有机氮组成[1]。而作为有机氮的主要成分,溶解有机氮(Dissolved organic nitrogen, DON )是多数天然水体中溶解氮的主要组成部分,所占百分比约达60%~69%[2]。传统观点认为DON 是一类难以被利用、生物有效性(bioavailability )低的有机氮库,不会促进水体水质富营养化[3][4],因而不重视DON 的管理和控制[5],甚至在水体氮负荷估算时忽略不计DON 含量[6][4]。DON 是天然水体有机质的重要组成成分,其含量、生物有效性及其生态环境效应逐渐受到关注[6]-[8]。目前世界上DON 的研究报道主要关注河口、近海和海洋生态系统,而淡水生态系统中的DON 研究相对较为缺乏。 能利用DON 的浮游植物,特别是一些有毒藻种(如水华束丝藻Aphanizomenon flosaquate 、铜绿微囊藻 Microcystis aeruginosa )具有其他藻种所没有的强大竞争力,可在无机氮缺乏而有机氮浓度相对较高的环境中很好的生长[9]-[10]。有毒藻种可以产生肝毒素、神经毒素等藻毒素[11],不利于作为饮用水源的淡水水体的安全保障。 当前我国微污染原水普遍存在有机物含量超标、含氮化合物浓度高、藻类大量繁殖等问题。另外,DON 绝大部分物质本身对人体具有直接或间接的毒害作用。因而本文综合分析淡水水体DON 对有毒藻种的生物有效性,希望有助于揭示淡水水体DON 的潜在生态风险与环境效应。 1 淡水水体DON 含量与来源 1.1 淡水水体的DON 含量 多数自然水体中的TDN 含量与其中的DON 密切相关。开阔海洋表面DON 约占TDN 的83%,河口DON 约占13%;近海约占18%[2]。在淡水生态系统中,其DON 浓度要比DIN 浓度高0[13]。如美国乔治亚州Satilla 河水的DON 浓度 (以N 计,下同) 为59.0 μmol/L ,而其TDN 浓度 (以N 计,下同) 仅 为62.6 μmol/L [14]。 又如日本琵琶湖的DON 浓度为4.0~7.2 μmol/L ,而其TDN 浓度仅为7.0~8.0 μmol/L [15]。以色列 Kinneret 湖为中富营养化湖泊,其水中DON 含量(1975—1974年均值)呈现季节差异性,9月份DON 占TDN 的65%,而三月份DON 占TDN 比例变小,仅为39%[2]。分析报道的文献,目前世界上DON 的研究报道主要关注河口、近海和海洋生态系统,而淡水生态系统中的DON 研究(包括DON 动态特征的量化描述及其影响因素等)较为缺乏。 当前,测定DON 含量的所有方法都是采用差减法,需依赖于测定总溶解性氮(TDN, Total dissolved nitrogen )浓度的测定,然后再减去溶解性无机氮(DIN, dissolved inorganic nitrogen )浓 度(分别测定的NH 4+,NO 3-和NO 2-浓度的加和) ,这使得测定结果具有3方面的分析误差,即测定TDN 、NH 4+和(NO 3-、NO 2-)的分析误差,因此DON 含量测定时,为了提高其测定精度,应尽可
全世界河流中的总氮有14%~90%由有机氮组成。而作为有机氮的主要成分,溶解有机氮(Dissolved organic nitrogen, DON)是多数天然水体中溶解氮的主要组成部分,所占百分比约达60%~69%。传统观点认为DON是一类难以被利用、生物有效性(bioavailability)低的有机氮库,不会促进水体水质富营养化,因而不重视DON的管理和控制,甚至在水体氮负荷估算时忽略不计DON含量。DON 是天然水体有机质的重要组成成分,其含量、生物有效性及其生态环境效应逐渐受到关注。目前世界上DON的研究报道主要关注河口、近海和海洋生态系统,而淡水生态系统中的DON研究相对较为缺乏。 能利用DON的浮游植物,特别是一些有毒藻种(如水华束丝藻Aphanizomenon flosaquate、铜绿微囊藻Microcystis aeruginosa)具有其他藻种所没有的强大竞争力,可在无机氮缺乏而有机氮浓度相对较高的环境中很好的生长。有毒藻种可以产生肝毒素、神经毒素等藻毒素,不利于作为饮用水源的淡水水体的安全保障。当前我国微污染原水普遍存在有机物含量超标、含氮化合物浓度高、藻类大量繁殖等问题。另外,DON绝大部分物质本身对人体具有直接或间接的毒害作用。研究发现,水中DON 大部分组成物质本身对人体具有直接或间接致毒作用,可生成更多的消毒副产物、产生较为严重的膜污染等,因此DON 相关研究已成为国际饮用水处理领域新的研究方向。尤其是近年来,研究人员发现DON 易和消毒剂发生反应生成含氮消毒副产物( N-DBPs) ,如卤化腈、二甲基亚硝胺、卤代硝基甲烷、卤代酰胺等,这些N-DBPs 的浓度远低于三卤甲烷、卤乙酸等常规消毒副产物,但其“三致”特性却远超过后者。DON 是N-DBPs 的前体物,有效削减DON 是控制消毒过程中N-DBPs 生成的重要手段,而了解微污染原水中DON 的组成规律是关键。 1.淡水水体DON 含量与来源 (1)含量 多数自然水体中的TDN含量与其中的DON密切相关。开阔海洋表面DON 约占TDN的83%,河口DON约占13%;近海约占18%。在淡水生态系统中,其DON浓度要比DIN浓度高。 当前,测定DON含量的所有方法都是采用差减法,需依赖于测定总溶解性氮(TDN, Totaldissolved nitrogen)浓度的测定,然后再减去溶解性无机氮(DIN,
金属硫化物 ?金属硫化物: (1)碱金属硫化物(Li----Cs)全部易溶于水。(硫化铵在低温下0度左右易溶于 水,但是在常温下会逐渐分解为氨和硫化氢) (2)碱土金属硫化物(除了Be)(Mg----Ba)易溶于水,但是同时完全水解为氢 氧化物和硫氢化物。 (3)铝,铍,铬的硫化物全部水解为硫化氢气体和氢氧化物沉淀。 (4)FeS,ZnS,MnS,NiS,CoS不溶于水但溶于稀盐酸。 (5)Bi2S3,SnS,SnS2,PbS,CdS,Bi2S5等不溶于水和稀盐酸,只溶于浓盐酸。 (6)CuS,Cu2S,Ag2S不溶于水,稀盐酸,浓盐酸,只溶于浓硝酸。 (7)Hg2S,HgS不溶于水,浓稀盐酸,浓硝酸,只溶于王水。 ?金属硫化物的溶解性归纳: 1.溶于水的有:等,由于的水解,此类金属硫化物的水溶液显碱性: 。 2.不溶于水但溶于稀盐酸的有:FeS、ZnS、MnS等。如: 。 3.不溶于稀盐酸但溶于浓盐酸的有:Cds、SnS、PbS等。 4.不溶于浓盐酸但溶于硝酸溶液的有:CuS等。 5.仅溶于王水的有:HgS等。
注意:遇水后,都水解,且相互促进,反应方程式为 ,因而不能与水共存,只能在干态下制取。 硫的价态转化规律: 硫元素的价态比较多,常见的有-2、0、+4、+6 价,它们间的转化关系是:现将它们在化学反应中复杂的变化规律归结如下: 1.邻位价态转化规律 (1)是硫元素的最低价态,只有还原性。它与氧化剂反应,其价态一般会升至相邻的价态()。 (2)S能发生自身氧化还原反应(即歧化反应),在反应时分别升至和降至与其相邻的价态。如 (3)处于中间价态,既有氧化性又有还原性。与弱氧化剂作用时,被氧化成相邻的高价态;与弱还原剂作用时,被还原成相邻的低价态。如 (4)是硫元素的最高价态,只有氧化性。遇到还原剂时,其价态一般降至相邻的 价态()。如 2.跳位转化规律 (1)遇到强氧化剂时,价态会发生跳位转化。如
DON(可溶性有机氮)测定方法 编辑 | 删除 | 权限设置 | 更多▼ 设置置顶推荐日志转到私密记事本 DemのHunt‰发表于2009年08月12日 08:12 阅读(0) 评论(0) 分类:东游记权限:指定好友可见 原理: 与MBC一样,DON(可溶性有机氮)TDN的测定不能够直接进行,而是由TDN(可溶性总N)减去TIN(可溶性无机氮)而得出结果。TIN又包括NH4+-N和NO3--N。即: DON = TDN - NH4+-N - NO3--N 测定方法如下: TDN:(过硫酸钾氧化-紫外分光光度法,农化p128,12.3.4); NO3--N:(紫外分光光度法,农化p129,12.4); NH4+-N:(靛酚蓝比色法,农化p159); 具体操作步骤(此处较简略,详见农化分析): 前处理:称取10.00克左右过2mm筛鲜土于100ml离心管中,加入2mol/L的KCl溶液50ml(149.1g KCl溶于去离子水,定容至1L),250r/min震荡1h后静置30min,使用普通定性滤纸&漏斗&小三角瓶过滤,制得母液。
TDN测定:移取1ml母液至50ml容量瓶中,加入1ml氧化剂,水浴中加热,温度升高到100℃后保持90min,使用紫外分光光度计测定A220和A275,空白需加入1ml氧化剂并同时作水浴处理。(Tips:农化上母液与氧化剂各取25ml,此处取其比例为1:1。) TDN标准曲线:0.7218g硝酸钾溶于水中,转入1000ml容量瓶中定容摇匀,制得浓度为100mg/L的氮标准贮存液。稀释10倍即为10mg/L的氮标准溶液。吸取氮标准溶液(梯度为0ml,1ml,2ml,3ml,4ml,5ml,6ml;对应浓度分别为0 mg/L,0.02 mg/L,0.04 mg/L,0.06 mg/L,0.08 mg/L,0.10 mg/L,0.12mg/L)于50ml容量瓶中,各加入1ml氧化剂并定容,得氮的标准系列,与样品同样消煮测定 A220和A275。以A(A= A220-A275)为纵标,氮浓度为横标绘制标准曲线。 NO3--N测定:移取5ml母液定容至50ml容量瓶中,使用紫外分光光度计测定即可,在220nm和275nm直接测定A220和A275,用校正吸光度A=A220-A275查得硝酸根浓度,空白为去离子水。 NO3--N标准曲线:0.1631g硝酸钾溶解定容至1L,制得浓度为100mg/L的硝酸根标准溶液。标准曲线梯度为0ml,0.5ml,1ml,2ml,3ml,4ml,5ml,对应浓度分别为0mg/L,1mg/L,2mg/L,4mg/L,6mg/L,8mg/L,10mg/L。 NH4+-N测定:移取5ml母液至50ml容量瓶中,用浸提剂2mol/L
本溶解性表崔扬(vmbn)录入,2003-5-5,修正于2003-7-27
]锕、氨、铵 物质化学式0°C10°C20°C30°C40°C50°C60°C70°C80°C90°C100°C 氢氧化锕(III)Ac(OH) 3 0.0022 氨NH 3 88.5 70 56 44.5 34 26.5 20 15 11 8 7 叠氮化铵NH 4N 3 16 25.3 37.1 苯甲酸铵NH 4C 7 H 5 O 2 20 碳酸氢铵NH 4HCO 3 11.9 16.1 21.7 28.4 36.6 59.2 109 170 354 溴化铵NH 4 Br60.6 68.1 76.4 83.2 91.2 108 125 135 145 碳酸铵(NH 4) 2 CO 3 100 氯酸铵NH 4ClO 3 28.7 氯化铵NH 4 Cl29.4 33.2 37.2 41.4 45.8 50.4 55.3 60.2 65.6 71.2 77.3 氯铂酸铵(NH 4) 2 PtCl 6 0.289 0.374 0.499 0.637 0.815 1.44 2.16 2.61 3.36
铬酸铵(NH 4) 2 CrO 4 25 29.2 34 39.3 45.3 59 76.1 重铬酸铵(NH 4) 2 Cr 2 O 7 18.2 25.5 35.6 46.5 58.5 86 115 156 砷酸二氢铵NH 4H 2 AsO 4 33.7 48.7 63.8 83 107 122 磷酸二氢铵NH 4H 2 PO 4 22.7 39.5 37.4 46.4 56.7 82.5 118 173 氟硅酸铵(NH 4) 2 SiF 6 18.6 甲酸铵NH 4HCO 2 102 143 204 311 533 磷酸一氢铵(NH 4) 2 HPO 4 42.9 62.9 68.9 75.1 81.8 97.2 硫酸氢铵NH 4HSO 4 100 酒石酸氢铵NH 4HC 4 H 4 O 6 1.88 2.7 碘酸铵NH 4IO 3 2.6 碘化铵NH 4 I155 163 172 182 191 209 229 250 硝酸铵NH 4NO 3 118 150 192 242 297 421 580 740 871
1.锕、氨、铵 物质化学式0℃10℃20℃30℃40℃50℃60℃70℃80℃90℃100℃氢氧化锕Ac(OH)3 0.0022 氨NH3 88.5 70 56 44.5 34 36.5 20 15 11 8 7 叠氮化氨NH2N2 16 25.3 37.1 苯甲酸氨NH4C7H5O2 20 碳酸氢氨NH4CO3 11.9 16.1 21.7 28.4 36.6 59.2 109 170 354 溴化氨NH4Br 60.6 68.1 76.4 83.2 91.2 108 125 135 145 碳酸氨(NH4)2CO3100 氯酸氨NH4ClO328.7 氯化氨NH4Cl 29.4 33.2 37.2 41.4 45.8 50.4 55.3 60.2 65.6 71.2 77.3 氯铂酸铵(NH4)2PtCl60.289 0.374 0.499 0.637 0.815 1.44 2.16 2.61 3.36 铬酸铵(NH4)2CrO425 29.2 34 39.3 45.3 59 76.1 重铬酸铵(NH4)2Cr2O718.2 25.5 35.6 46.5 58.5 86 115 156 砷酸二氢铵NH4H2AsO433.7 48.7 63.8 83 107 122 磷酸二氢铵NH4H2PO422.7 39.5 37.4 46.4 56.7 82.5 118 173 氟硅酸铵(NH4)2SiF6 18.6 甲酸铵NH4HCO2 102 143 204 311 533 磷酸一氢铵(NH4)2HPO4 42.9 62.9 68.9 75.1 81.8 97.2 碳酸氢铵NH4HSO4 100 酒石酸氢铵NH4HC4H4O6 1.88 2.7 碘酸铵NH4IO3 2.6 碘化铵NH4I 155 163 172 182 191 209 229 250 硝酸铵NH4NO3 118 150 192 242 297 421 580 740 871 高碘酸铵(NH4)5IO6 2.7 草酸铵(NH4)2C2O4 2.2 3.21 4.45 6.09 8.18 14 22.4 27.9 34.7 高氯酸铵NH4ClO4 12 16.4 21.7 37.7 34.6 49.9 68.9 高锰酸铵NH4MnO4 0.8 磷酸铵(NH4)3PO4 26.1 硒酸铵(NH4)2SeO4 96 105 115 126 143 192 硫酸铵(NH4)2SO4 70.6 73 75.4 78 81 88 95 103 亚硫酸铵(NH4)2SO3 47.9 54 60.8 68.8 78.4 104 114 150 153 酒石酸铵(NH4)2C4H4O6 45 55 63 70.5 76.5 86.9 硫氰酸铵NH4SCN 120 144 170 208 234 346 硫代硫酸铵(NH4)2S2O3 2.15 钒酸铵NH4VO3 0.48 0.84 1.32 2.42
摘要:可溶性有机氮的含量对土壤有一定的影响,可解决土壤中的污染问题,还能提高作物的产量。为了提高可溶性有机氮的使用量,必须明确其含量的影响因素,因此,本研究重点对此开展相关实验,旨在为作物生长提供优质的土壤环境。 关键词:土壤; 可溶性有机氮; 含量; 影响因素 土壤中可溶性有机氮的来源较多,其在可溶性总氮中占有90%以上的含量。可溶性有机氮对土壤的影响比较大,受外部因素的干扰,会导致土壤中可溶性有机氮的含量不同。而作物种植中,土壤中可溶性有机氮的含量影响着作物的产量和品质,因此明确影响其含量的因素,才能维护可溶性有机氮在土壤中处于平衡状态。 1 土壤中可溶性有机氮含量影响因素的实验设计 分析土壤中可溶性有机氮的含量影响因素,需开展相关实验。本研究以实验室分析为例,在实验室中,选取待检测的土壤样本,提供可变的条件,明确土壤中可溶性有机氮含量的相关影响因素。首先,实验室内,土壤样本的环境气温平均在13 ℃左右,提供500~650 mm的降水,保持土壤样本的湿度;其次,待检测的土壤样本中,有机质总量约为13.79 g/kg,其中铵态氮约为241.00 mg/kg、硝态氮约为5.45 mg/kg。记录土壤样本的实验数据,分别进行覆草设计、改变温度、施加氮肥等条件控制,观察实验条件下土壤样本中可溶性有机氮含量的变化。 试验共设4组,其中1组为对照组,实验组按照覆草设计、改变温度、施加氮肥的条件控制(其他条件一致)设计3组实验组,来完成含量检测的实验。土壤样本的规格为5~10 cm,主要检测土壤中可溶性有机氮(son)、铵态氮和硝态氮,实验3次,记录结果。由于可溶性有机氮含量影响因素实验是在实验室中进行的,所以各项条件的控制必须准确,排除不良因素的干扰,既要保障该实验的环保性,又要确保实验的可实施性。 2 土壤中可溶性有机氮含量影响因素的测量方法 针对土壤样本中不同形态氮含量进行测试,便于找出影响可溶性有机氮含量的因素。 2.1 铵态氮、硝态氮测量铵态氮、硝态氮可以总称为无机氮,在实验室测量土壤样本中此形态氮的含量时,可选用氯化钾浸提的方法,混合并振捣,测量时间1.0 h,过滤实验溶液中的杂质,使用仪器检测样本中铵态氮、硝态氮的实际含量。 2.2 可溶性总氮测量测定可溶性总氮(tsn)含量时,需先过滤掉混合的无机氮,使用0.45μm滤膜,全面过滤无机氮[1]。可溶性总氮通过氧化法进行测量,试剂为氢氧化钠与过硫酸钾的混合物,氧化时间控制在0.5 h,待溶液稳定后,利用光度法完成测量。 2.3 可溶性有机氮测量可溶性有机氮含量=可溶性总氮测量含量-无机氮测量含量,即可计算出准确的结果。 3 土壤中可溶性有机氮含量的影响因素分析 结合实验室土壤样本实验,测定可溶性有机氮的含量,分析影响可溶性有机氮含量的因素如下。 3.1 覆草实验室中的覆草设计,代表了植物种植的一种栽培模式,与之类似的还有覆膜栽培,经实验分析发现,覆草对土壤中可溶性有机氮含量的影响较为明显,属于一类比较重要的影响因素。实验室中,对照组与覆草实验组中的可溶性有机氮含量,土壤样本中可溶性有机氮的含量分别是29.81 mg/kg、61.88 mg/kg,含量明显提升。土壤样本的覆草实验设计,表明此类栽培模式有利于提高土壤内可溶
化学高考必背知识点归纳 分享借鉴,希望可以帮助到各位考生同学. 化学高考必背知识点1 一.物理性质 1.有色气体:F2(淡黄绿色).Cl2(黄绿色).Br2(g)(红棕色).I2(g)(紫红色).NO2(红棕色).O3(淡蓝色),其余均为无色气体.其它物质的颜色见会考手册的颜色表. 2.有刺激性气味的气体:HF.HCl.HBr.HI.NH 3.SO2.NO2.F2.Cl2.Br2(g);有臭鸡蛋气味的气体:H2S. 3.熔沸点.状态: ①同族金属从上到下熔沸点减小,同族非金属从上到下熔沸点增大. ②同族非金属元素的氢化物熔沸点从上到下增大,含氢键的NH3.H2O.HF反常. ③常温下呈气态的有机物:碳原子数小于等于4的烃.一氯甲烷.甲醛. ④熔沸点比较规律:原子晶体离子晶体分子晶体,金属晶体不一定. ⑤原子晶体熔化只破坏共价键,离子晶体熔化只破坏离子键,分子晶体熔化只破坏分子间作用力. ⑥常温下呈液态的单质有Br2.Hg;呈气态的单质有H2.O2.O3.N2.F2.Cl2;常温呈液态的无机化合物主要有H2O.H2O2.硫酸.硝酸. ⑦同类有机物一般碳原子数越大,熔沸点越高,支链越多,熔沸点越低. 同分异构体之间:正异新,邻间对. ⑧比较熔沸点注意常温下状态,固态液态气态.如:白磷二硫化碳干冰. ⑨易升华的物质:碘的单质.干冰,还有红磷也能升华(隔绝空气情况下),但冷却后变成白磷,氯化铝也可;三氯化铁在1_度左右即可升华. ⑩易液化的气体:NH3.Cl2,NH3可用作致冷剂. 4.溶解性 ①常见气体溶解性由大到小:NH3.HCl.SO2.H2S.Cl2.CO2.极易溶于水在空气中易形成白雾的气体,能做喷泉实验的气体:NH3.HF.HCl.HBr.HI;能溶于水的气体:CO2.SO2.Cl2.Br2(g).H2S.NO2.极易溶于水的气体尾气吸收时要用防倒吸装