
重组毕赤酵母产木聚糖酶摇瓶培养实验
毕赤酵母简介
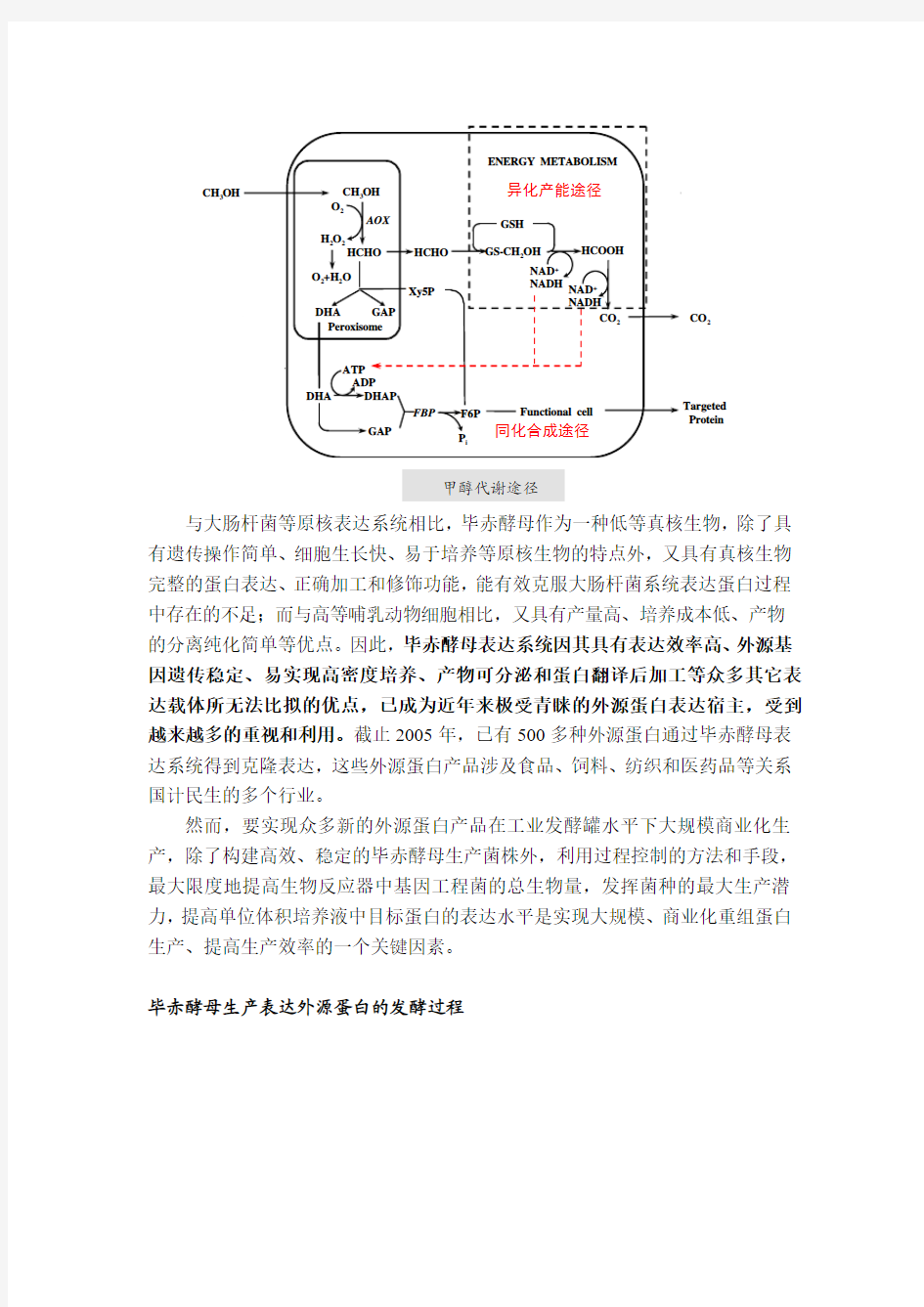
甲醇营养型毕赤酵母(Pichia pastoris) 表达系统是80年代初被开发和研制的一种新型酵母表达系统。40年前,Ogata等人首次发现有些酵母能够利用甲醇作为唯一的碳源和能源进行生长。随后,甲醇营养酵母作为潜在的单细胞蛋白(single cell protein, SCP) 来源立即引起广泛关注,最初将其作为高蛋白的动物饲料在市场上销售。在20世纪70年代,Phillips Petroleum公司开发出毕赤酵母利用甲醇生长的培养基、发酵操作手册和高密度连续培养生产工艺。70年代的石油危机导致了甲烷价格的急剧上升,与此同时,动物饲料蛋白的主要替代源——大豆价格的下降,导致利用甲醇生产SCP在经济上已不再合适。在以后的10年中,PhiLLips PetroLeum公司与SIBIA公司合作开发利用毕赤酵母作为生物体表达外源蛋白的研究,研究人员分离了醇氧化酶(alcohol oxidase, AOX) 的基因和启动子,构建了表达载体和菌株,开发了毕赤酵母基因操作相关技术。成熟的SCP发酵方法的开发,加上醇氧化酶强启动子的可调控表达特性,极大地影响着外源蛋白在毕赤酵母中的高水平表达。1993年,Phillips Petroleum公司委托Invitrogen公司代理毕赤酵母表达系统产品。
毕赤酵母能在以甲醇为唯一碳源的培养基中快速生长,其中醇氧化酶AOX ——甲醇代谢途径的关键酶可达细胞可溶性蛋白的30%。而在葡萄糖、甘油或乙醇作为碳源的培养细胞中则检测不到AOX。AOX的合成是在转录水平调控的。其基因启动子具有明显的调控功能,可用于调控外源基因的表达。此调控作用是由一般碳源抑制/解抑制及碳源特殊诱导机制控制的。外源基因在甲醇以外的碳源中处于非表达状态,而在培养液中加入甲醇后,外源基因即被诱导表达。巴斯德毕赤酵母中存在着一种称为微体的细胞器,其中大量合成过氧化物酶,因此也称为过氧化物酶体。
CH 3Targeted Protein
CO 2
甲醇代谢途径
与大肠杆菌等原核表达系统相比,毕赤酵母作为一种低等真核生物,除了具有遗传操作简单、细胞生长快、易于培养等原核生物的特点外,又具有真核生物完整的蛋白表达、正确加工和修饰功能,能有效克服大肠杆菌系统表达蛋白过程中存在的不足;而与高等哺乳动物细胞相比,又具有产量高、培养成本低、产物的分离纯化简单等优点。因此,毕赤酵母表达系统因其具有表达效率高、外源基因遗传稳定、易实现高密度培养、产物可分泌和蛋白翻译后加工等众多其它表达载体所无法比拟的优点,已成为近年来极受青睐的外源蛋白表达宿主,受到越来越多的重视和利用。截止2005年,已有500多种外源蛋白通过毕赤酵母表达系统得到克隆表达,这些外源蛋白产品涉及食品、饲料、纺织和医药品等关系国计民生的多个行业。
然而,要实现众多新的外源蛋白产品在工业发酵罐水平下大规模商业化生产,除了构建高效、稳定的毕赤酵母生产菌株外,利用过程控制的方法和手段,最大限度地提高生物反应器中基因工程菌的总生物量,发挥菌种的最大生产潜力,提高单位体积培养液中目标蛋白的表达水平是实现大规模、商业化重组蛋白生产、提高生产效率的一个关键因素。
毕赤酵母生产表达外源蛋白的发酵过程
一般而言,毕赤酵母高密度流加培养生产表达外源蛋白过程由甘油分批培养、甘油流加培养和甲醇诱导表达三个不同阶段构成。甘油分批培养的目的是为了积累一定的生物量,同时抑制AOX启动子及外源蛋白表达;甘油流加培养是通过限制性的甘油流加,进一步增加生物量,尽可能地获得高细胞浓度,同时解除过量甘油对AOX启动子的抑制作用,为细胞进入诱导期作准备;甲醇诱导表达阶段是通过添加诱导剂甲醇,实现AOX高水平转录和外源蛋白的高效表达。
木聚糖酶简介
木聚糖是植物细胞壁的主要成分之一,属于非淀粉多糖。作为半纤维素的一种,在自然界中是含量仅次于纤维素的可更新多糖,存在于各种陆生植物的几乎所有部位.它从仅由β-1,4糖苷键连接的多聚糖线形分子到以α-糖甘键形成取代基支链的高度分枝的异质多糖,结构变化的范围很大。通常,木聚糖以异质多糖形式存在并与纤维素结合在一起。木聚糖酶是木聚糖的专一降解酶。属于水解酶类,包括内切木聚糖酶、外切木聚糖酶和木糖苷酶三种。内切木聚糖酶能随机切
断木聚糖主链上的木聚糖苷键,生成分子量不同的木寡糖;外切木聚糖酶则从木聚糖非还原性末端切下单个的D-木糖;而木糖苷酶则水解木寡糖生成D-木糖,且仅能水解木二糖。三者酶解作用产生的D-木糖可以被动物吸收和利用。近年来对木聚糖酶的研究发现,它应用于饲料中提高了饲料营养价值,突破了饲料资源开发利用的局限,增强了动物的生产与抗病能力,减少了动物排泄物造成的污染,作为一种环保添加剂,在发展环保型畜牧业中具有十分重要的意义与价值。
毕赤酵母产木聚糖酶摇瓶实验方案
培养基组成:
种子培养基(g/L):葡萄糖20,酵母粉10,蛋白胨20。
甘油生长培养基(g/L):甘油20 mL/L,MgSO4 1,K2SO4 1,(NH4)2SO4 5,CaSO4 0.1,H3PO4 2% (v/v),PTM1 10 mL/L,KOH 20,pH 6.0。
甲醇诱导培养基(g/L):甲醇10 mL/L,MgSO4 1,K2SO4 1,(NH4)2SO4 5,CaSO4 0.1,H3PO4 2% (v/v),PTM1 10 mL/L,KOH 20,pH 6.0。
PTM1组成(g/L):CuSO4·5H2O 6g,NaI 0.08g,MnSO4·H2O 3g,Na2MoO4 0.2g,H3BO3 0.02g,CoCL2 0.5g,ZnCL2 20g,FeSO4·7H2O 65g,H2SO4 5mL,生物素0.2g 培养基配置过程注意事项:
1.KOH 等其它试剂溶解后最后加人;
2.PTM1、调pH用氨水和甲醇在灭菌后、接种前添加。
具体实验操作步骤如图1:
250mL 摇瓶种子培养(30 °C ,220rpm ,24h )
每瓶种子培养基体积25mL
250mL 摇瓶甲醇诱导培养(30 °C ,220rpm )
每瓶甲醇诱导培养基体积25mL
离心(2000rpm ×2min )收集菌体,将菌体转入
等体积诱导培养基中进行诱导培养
8000rpm ×5min )后
72h (3d )
图1 毕赤酵母产木聚糖酶摇瓶实验操作流程图
检测方法:
细胞浓度的测定
采用比浊法,使用紫外分光光度仪进行测定。将从摇瓶中所采集的样品经适当稀释,测定其在600nm 下的吸光度OD 600。
总蛋白浓度测定(考马斯亮蓝比色法):
原理:考马斯亮蓝G-250是一种染料,在游离状态下呈红色,当它与蛋白质结合后变为青色。蛋白质含量在0~1000mg 范围内,蛋白质-色素结合物在595nm 下的吸光度与蛋白质含量成正比,故可用比色法测定A 595。
试剂配制
(1) 标准蛋白质溶液 称取100mg 牛血清白蛋白,溶于蒸馏水并定容至100mL ,制成1g/L 的原液。
(2) 考马斯亮蓝G-250蛋白试剂 称取100mg 考马斯亮蓝G-250,溶于50mL 90%乙醇中,加入 85%(m/v)的磷酸 100mL ,最后用蒸馏水定容到1000mL 。此溶液在常温下可放置一个月。
操作步骤
标准曲线的制作
取6支带塞试管,编号后,按下表所示加入相应试剂:
盖上塞子,摇匀。放置2min后在595 nm波长下比色测定(比色应在1h内完成)。以牛血清白蛋白含量(g)为横坐标,以吸光度为纵坐标,绘出标准曲线。
发酵上清液样品蛋白浓度测定
吸取经适当稀释的待测发酵上清液样品1.0mL于比色管中,加入5.0mL考马斯亮蓝G-250试剂,摇匀,放置5min后,在595nm波长下比色,记录A595
中考理化生实验操作考试方案 市教育局有关初中毕业生升学及学业水平测试理科实验操作考查的精神,为做好2013年全市初中毕业生升学理化生实验操作考查工作,特制订本《实施方案》。 一、组织领导 实验操作考试工作在市、县市区教育局及全市高中阶段学校招生工作领导小组的统一领 导下,由市、县教育局具体组织实施。 二、考试范围、内容、对象 考试范围:依据《义务教育课程标准》,考查范围为学生初中阶段应掌握的分组必做实验 内容与基本实验操作规范,用开放性和探究性题目考查学生动手实践和解决问题的能力。理化生试题各1套,每科满分为10分,每套试题含6个不同实验内容、实验操作难度系数基 本相同、考查时间相同的考查题目,共18个实验考查题目。 考试内容:主要考查学生实验仪器的认识、装配、操作,实验设计,实验现象观察、数 据记录、实验结果表述等。 考试对象:2013年初中毕业生。 三、考试办法 1.由市教育局统一命题、制卷。命题将突出新课程标准教学理念,重点考查学生实验设计、实验探究、实验操作过程的规范。 2.由县市区教育局派出考务组到各考点组织学生现场测试,考生抽签确定实验测试项目;县市区考生由所在县市区教育局组织考试,市直由市教育局组织考试;考试实行封闭管理。 四、时间安排 1.4月20日前组织考生报名,以县市区为单位将参考人数报市教育局中教科;4月25日前完成考点资格审查并上报考点名单;5月4日各县市区到市教育局中教科领取试卷及考 试用品、材料;5月5日培训监考教师,5月6日至25日为全市统一考试时间。 2.考生实验操作考试时间为每场15分钟,间隔5-10分钟,每天考试场次由考务组依据 考点考生人数确定。 五、考前准备 1.报名、办理准考证 报名以学校为单位组织,4月20日前,各学校填写《佳木斯市2013年初中毕业生升学实验操作考试报名、成绩登记册》(一式3份),交县市区教育局中教科。报名时应注意与文
毕赤酵母表达实验手册 大肠杆菌表达系统最突出的优点是工艺简单、产量高、生产成本低。然而,许多蛋白质在翻译后,需经过翻译后的修饰加工,如磷酸化、糖基化、酰胺化及蛋白酶水解等过程才能转化成活性形式。大肠杆菌缺少上述加工机制,不适合用于表达结构复杂的蛋白质。另外,蛋白质的活性还依赖于形成正确的二硫键并折叠成高级结构,在大肠杆菌中表达的蛋白质往往不能进行正确的折叠,是以包含体状态存在。包含体的形成虽然简化了产物的纯化,但不利于产物的活性,为了得到有活性的蛋白,就需要进行变性溶解及复性等操作,这一过程比较繁琐,同时增加了成本。 与大肠杆菌相比,酵母是低等真核生物,具有细胞生长快,易于培养,遗传操作简单等原核生物的特点,又具有真核生物时表达的蛋白质进行正确加工,修饰,合理的空间折叠等功能,非常有利于真核基因的表达,能有效克服大肠杆菌系统缺乏蛋白翻泽后加工、修饰的不足。因此酵母表达系统受到越来越多的重视和利用。 大肠杆菌是用得最多、研究最成熟的基因工程表达系统,当前已商业化的基因工程产品大多是通过大肠杆菌表达的,其主要优点是成本低、产量高、易于操作。但大肠杆菌是原核生物,不具有真核生物的基因表达调控机制和蛋白质的加工修饰能力,其产物往住形成没有活性的包涵体,需要经过变性、复性等处理,才能应用。近年来,以酵母作为工程菌表达外源蛋白日益引起重视,主更是因为酵母是单细胞真核生物,不但具有大肠杆菌易操作、繁殖快、易于工业化生产的特点,还具有真核生物表达系统基因表达调控和蛋白修饰功能,避免了产物活性低,包涵体变性、复性等等间题[1]。 与大肠杆菌相比,酵母是单细胞真核生物,具有比较完备的基因表达调控机制
2017年会昌实验学校理化实验操作考试工作方案 为认真贯彻落实会昌县教育局《关于做好2017年中考物理、化学实验操作考查工作的通知》精神。为了确保考试的顺利进行及安全有序,特拟定会昌实验学校理化实验考试方案。 一、工作领导小组 组长:刘旭东 副组长:许德友张会明何勋邹新华蓝晶晶 成员:初三年级组成员、总务处负责人、校务办负责人、校医、各班班主任、全体理化教师、学校保卫值班人员及值周值日教师。 二、实验考试地点及时间: 物理:考场物理实验室2 侯考室:物理实验室1 化学:考场化学实验室2 候考室:生物实验室2 时间:5月22至23两天(周一、周二) 三、具体分工及主要职责 总协调:邹新华 总体负责:郑志华 各班联系人:班主任 考场布置: 胡小荣、姚立军分别组织负责物理、化学侯考室的布置。5 月19日前,胡小荣、姚立军牵头、其他理化教师协助负责物理、化学考场内实验器材和药品的分组准备布置。 候考联络组:
职责:侯考室负责各班学生考试联系、学生实验顺序抽签、纪律秩序维护、实验中应注意的事项告知等。 物理:刘香荣(组长)柯小冬吴才长刘则萍余永真 化学:吴林飞(组长)张慧慧章珏曾金凤张臣唐三根 后勤保障组:王金生、汪罗发、周玲徐翠花(开水) 保卫组:邹剑及保卫值班人员 四、考前工作安排 1、各班务必在5月18日前完成所有考试题目的训练,并指出学生在理化集训中出现的操作问题。 2、请各班相关理化老师给学生并负责好考前对学生的叮嘱交代。 3、班主任利用考试当天早读课开好考务会,强调纪律和安全,并认真学习理化实验操作考试实施细则。 五、考试期间,具体工作安排: 1、所有考生在班级上课等待考试,没有安排考试的班级在教室按课表上课。班主任随时等候联络员的电话,期间班主任确保通信畅通;轮到考试的班级,班主任服从安排带好本班学生到指定地点候考并按顺序排好队,负责清点人数,发放准考证,组织学生入场。8:00开始考试。 2、行走路线:物理从综合楼东边楼梯上,化学从综合楼西边楼梯上,考完后统一从综合楼中间楼梯下。 3、考试完毕,全体学生有序回教室上课,然后等待下一科目考试。 4、考试具体安排:
毕赤酵母表达系统研究进展 作者:齐连权, 陈薇, 来大志, 于长明, 王海涛 作者单位:军事医学科学院微生物学流行病学研究所,北京,100071 刊名: 中国生物工程杂志 英文刊名:JOURNAL OF CHINESE BIOTECHNOLOGY 年,卷(期):2002,22(6) 被引用次数:11次 参考文献(21条) 1.Trinh L;Noronha S B;Fannon M Recovery of mouse endostatin producedby Pichia pastoris using expanded bed adsorption[外文期刊] 2000(04) 2.查看详情 3.Barr KA;Hopkins S A;Sreekrishna K Protocol for efficient secretion of HSA developed from Pichia pastoris 1992 4.Cereghino J L;Cregg J M Heterologous protein expression in the methylotrophic yeast Pichia pastoris[外文期刊] 2000(1) 5.Kjeldsen T;Pettersson A F;Hach M Secretory expression and characterization of insulin in Pichia pastoris[外文期刊] 1999(29) 6.Bewley M C;Tam B M;Grewal J X ray crystallography and massspectroscopy reveal that the N lobe of human transferrin expressed in Pichia pastorisis folded correctly but is glycosylated on serine 32 [外文期刊] 1999(08) 7.Kalidas C;Joshi L;Batt C Characterization of glycosylated variantsof beta lactoglobulin expressed in Pichia pastoris[外文期刊] 2001(03) 8.Briand L;Perez V;Huet J C Optimization of the production ofa honeybee odorant binding protein by Pichia pastoris[外文期刊] 1999(03) 9.Rydberg E H;Sidhu G;Vo H C Cloning mutagenesis and structural analysis of human pancreatic alpha amylase expressed in Pichia pastoris[外文期刊] 1999(03) 10.Guo R T;Chou L J;Chen Y C Expression in Pichia pastoris andcharacterization by circular dichroism and NMR of rhodostomin[外文期刊] 2001(04) 11.Zani M;Brillard Bourdet M;Lazure C Purification and characterization of active recombinant rat kallikrein rK9[外文期刊] 2001(02) 12.ChirulovaV;Cregg J M;Meagher M M Recombinant protein production in an alcohol oxidase defective strain of Pichia pastoris in fed batch fermentations[外文期刊] 1997 13.Hasslacher M;Schall M;Hayn M High level intracellular expression of hydroxynitrile lyase from the tropical rubber tree Hevea brasiliensis in microbial hosts[外文期刊] 1997(1) 14.Takahashi K;Takai T;Yasuhara T Effects of site directed mutagenesis in the cysteine residues and the N glycosylation motif in recombinant Der f 1on secretion and protease activity[外文期刊] 2001(04) 15.Boado R J;Ji A;Pardridge W M Cloning and expression in Pichia pastoris of a genetically engineered single chain antibody against the rat transferrin receptor[外文期刊] 2000(06)
Pichia酵母表达系统使用心得 甲醇酵母表达系统有不少优点,其中以Invitrogen公司的Pichia酵母表达系统最为人熟知,并广泛应用于外源蛋白的表达。虽然说酵母表达操作简单表达量高,但是在实际操作中,并不是每个外源基因都能顺利得到高表达的。不少人在操作中会遇到这样那样的问题,收集了部分用户在使用EasySelect Pichia Expression System这个被誉为最简单的毕赤酵母表达的经典试剂盒过程中的心得体会。其中Xiang Yang是来自美国乔治城大学(Georgetown University)Lombardi癌症中心(Lombardi Cancer Center),部分用户来自国内。 甲醇酵母部分优点: 1.属于真核表达系统,具有一定的蛋白质翻译后加工,有利于真核蛋白的表达; 2.AOX强效启动子,外源基因产物表达量高,表达产物可以达到每升数克的水平; 3.酵母培养、转化、高密度发酵等操作接近原核生物,远较真核系 统简单,非常适合大规模工业化生产; 4.可以诱导表达,也可以分泌表达,便于产物纯化; 5.可以甲醇代替IPTG作为诱导物,部分甲醇酵母更可以用工业甲醇替代葡萄糖作为碳源,生产成本低。 产品性能:优点——使用简单,表达量高,His-tag便于纯化;缺点——酵母表达蛋白有时会出现蛋白切割问题。 巴斯德毕赤酵母(Pichia pastoris)是一种能高效表达重组蛋白的酵母品种,一方面由于其是属于真核生物,因此表达出来的蛋白可以进行糖基化修饰,另一方面毕赤酵母生长速度快,可以将表达的蛋白分泌到培养基中,方便蛋白纯化。 毕赤酵母表达载体pPICZ在多克隆位点(MCR)3'端带有his-tag和c-myc epitopes,这些tag有利于常规检测和纯化,而且在MCR5'端引入了alpha factor(α-factor)用以分泌表达,并且在表达后α-factor可以自动被切除。在进行克隆的时候,如果你选择的是EcoRI,那么只需在目标蛋白中增加两个氨基酸序列即可完成。另外pPICZ系列选用的是Zeocin抗生素作为筛选标记,而诱导表达的载体需要甲醇——甲醇比一般用于大肠杆菌表达诱导使用的IPTG便宜。 第一步——构建载体 Xiang Yang:pPICZ系列有许多克隆位点可供选择,同时也有三种读码框以便不用的用户需要。 红叶山庄:有关是选择pPIC9K还是pPICZ系列?pPIC9K属于穿梭质粒,也可以在原核表达,而pPICZ系列比较容易操作,大肠和毕赤酵母均用抗Zeocin筛选(PIC9K操作麻烦一点,大肠用amp抗性,而毕赤酵母先用His缺陷筛选阳性克隆,在利用G418筛选多拷贝),而且对于大小合适(30—50KD)的蛋白在产量上是pPIC9K无法比拟的。 leslie:要做毕赤酵母表达实验,首先当然就要了解这个可爱的酵母了(椭圆形,肥嘟嘟的,十分可爱),她和大肠杆菌长得有较大区别(大肠杆菌是杆状的),因此在培养的过程中要区别这两种菌体,除了气味,浓度,颜色以外,也可以取样到显微镜中观测。大家做毕赤表达的时候应该都遇过这种情况吧,表达过程中染菌(我们实验室曾经污染过各种颜色形状的细菌,那真是一段可怕的经历),如果在不知情的情况下继续做下去,那可以就是浪费大把的
培养基的配方: YPD完全培养基:酵母提取物10g/L ,蛋白胨20g/L ,葡萄糖20g/L,(固体培养基1.5%琼脂); MM:13.4 g/L YNB,4x10-4 g/L 生物素,5 ml/L 甲醇,15 g/L 琼脂 MD:13.4g/L酵母基本氮源;0.4mg/L生物素;20g/L葡萄糖 操作方法: 用无菌牙签挑取his+转化子的单克隆并分别按先后顺序划到MM和MD平板上(不同的克隆需换牙签),30℃培养两天,观察平板。在MM和MD平板上均能正常生长的菌落表型为Mut+(Methanol utilization plus),在MD 平板上能正常生长但在MM 平板上生长相对缓慢或者不生长的菌落表型为Muts (Methanol utilization slow)。 用点MM、MD平板点方法。 准备几块MM、MD,平板用maker笔划小格子,标号,两种平板点标号要一一对应。准备无菌牙签,点取G418板上长出点菌落,先轻轻点MM平板(小格内),再点到MD平板相同标号点小格内。如此点约100个转化子,30℃培养2-5天,观察比较MM、MD上相同标号点菌落,MD平板上生长快,MM平板上生长缓慢或不生长点为Muts,生长速度一样点为Mut+。 原理是Mut+能够快速利用甲醇为碳源,而Muts则不能利用甲醇为碳源。所以Mut+能够在含甲醇(MM)平板也快速生长,而Muts只能在含葡萄糖(MD)平板快速生长。 MD培养基是怎么筛选酵母的?细菌在这种培养基上是不是不生长?MD (Minimal Dextrose Medium,最小葡萄糖培养基)组成如下:(YNB 13.4g/l、葡萄糖20g/l、生物素4×10-4g/l、若制平板加琼脂粉15g/l),它属于组氨酸缺陷型培养基,细菌能生长,配制完后仍需高压蒸气灭菌处理。 用于表达的毕赤酵母都属于组氨酸缺陷型的,只有染色体上成功整合入重组质粒载体基因的毕赤酵母菌株才能在组氨酸缺失的MD培养基生长,以此筛选出重组子。 酵母菌可以利用有机物和无机物作为氮源,有机氮源有酵母浸膏、蛋白胨、胰蛋白胨等,无机氮源有尿素、醋酸铵、硫酸铵、磷酸氢二铵等铵盐。
毕赤酵母表达实验手册 作者:Jnuxz 来源:丁香园时间:2007-9-5 大肠杆菌表达系统最突出的优点是工艺简单、产量高、周期短、生产成本低。然而,许多蛋白质在翻译后,需经过翻译后的修饰加工,如磷酸化、糖基化、酰胺化及蛋白酶水解等过程才能转化成活性形式。大肠杆菌缺少上述加工机制,不适合用于表达结构复杂的蛋白质。另外,蛋白质的活性还依赖于形成正确的二硫键并折叠成高级结构,在大肠杆菌中表达的蛋白质往往不能进行正确的折叠,是以包含体状态存在。包含体的形成虽然简化了产物的纯化,但不利于产物的活性,为了得到有活性的蛋白,就需要进行变性溶解及复性等操作,这一过程比较繁琐,同时增加了成本。 大肠杆菌是用得最多、研究最成熟的基因工程表达系统,当前已商业化的基因工程产品大多是通过大肠杆菌表达的,其主要优点是成本低、产量高、易于操作。但大肠杆菌是原核生物,不具有真核生物的基因表达调控机制和蛋白质的加工修饰能力,其产物往住形成没有活性的包涵体,需要经过变性、复性等处理,才能应用。近年来,以酵母作为工程菌表达外源蛋白日益引起重视,原因是与大肠杆菌相比,酵母是低等真核生物,除了具有细胞生长快,易于培养,遗传操作简单等原核生物的特点外,又具有真核生物时表达的蛋白质进行正确加工,修饰,合理的空间折叠等功能,非常有利于真核基因的表达,能有效克服大肠杆菌系统缺乏蛋白翻译后加工、修饰的不足。因此酵母表达系统受到越来越多的重视和利用。[1]。 同时与大肠杆菌相比,作为单细胞真核生物的酵母菌具有比较完备的基因表达调控机制和对表达产物的加工修饰能力。酿酒酵母(Saccharomyces.Cerevisiae)在分子遗传学方面被人们的认识最早,也是最先作为外源基因表达的酵母宿主。1981年酿酒酵母表达了第一个外源基因----干扰素基因[2],随后又有一系列外源基因在该系统得到表达[3、4、5、6]。干扰素和胰岛素虽然已经利用酿酒酵母大量生产并被广泛应用,当利用酿酒酵母制备时,实验室的结果很令人鼓舞,但由实验室扩展到工业规模时,其产量迅速下降。原因是培养基中维特质粒高拷贝数的选择压力消失[7、8],质粒变得不稳定,拷贝数下降。拷贝数是高效表达的必备因素,因此拷贝数下降,也直接导致外源基因表达量的下降。同时,实验室用培养基成分复杂且昂贵,当采用工业规模能够接受的培养基时,导致了产量的下降[9]。为克服酿酒酵母的局限,1983年美国Wegner等人最先发展了以甲基营养型酵母(methylotrophic yeast)为代表的第二代酵母表达系统[10]。 甲基营养型酵母包括:Pichia、Candida等.以Pichia.pastoris(毕赤巴斯德酵母)为宿主
xx酵母表达实验手册 (作参考) 部分试剂中英文名称: 小牛肠碱性磷酸酶(CIP)、AOX1(alcohol oxidase,醇氧化酶) 10*YNB(含有硫酸铵、无氨基酸的 13.4%酵母基础氮源培养基) 500*B( 0.02%生物素Biotin)、100*H( 0.4%Histidine组氨酸) 10*D(20%Dextrose葡萄糖)、10*M(5%Methanol甲醇) 10*GY(10%Glycerol甘油)、100*AA( 0.5% of each Amino Acid,各种氨基酸)、1M磷酸钾溶液(potassium phosphate buffer,pH 6.0) Sorbitol (山梨醇)、磷酸钾溶液(potassium phosphate buffer) YEPDM(Yeast Extract Peptone Dextrose Medium,酵母浸出粉/胰蛋白胨/右旋葡萄糖培养基) Minimal Glycerol Medium(最小甘油培养基) YPD培养基的配制: 每(L)液体预混合物(50g/L)终浓度酵母提取物10g250g1%蛋白栋 20g500g2%葡萄糖20g500g2%※注:
配制YPD培养基时,20%(10×)葡萄糖溶液最好采用单独过滤除菌或高压灭菌(在灭菌后再加入到其他各种成分),以免在高压灭菌时培养基变黑并妨碍酵母菌的最佳生长。 ※极限培养基{合成葡萄糖(SD)培养基} 每(L)液体预混合物(50g/L)终浓度YNB-AA/AS 1.7g68g 0.17%(NH 4) 2SO 45g200g 0.5%葡萄糖20g800g2%注: 这种极限培养基可以培养没有特殊营养要求的酵母菌,但更多时候这种培养基是作为一种待添加其他成分的极限培养基(见下文提到的CM省却成分培养基)。 完全极限(CM)省却成分培养基(每L中含): 省却成分粉剂 1.3g(见表 13.1.1) YNB-AA/AS 1.7g (NH 4)
2011年合肥市区初中毕业学业理科实验操作考试实施方案 为全面贯彻党的教育方针,大力推进素质教育,促进学校提高实验教学水平和质量,培养学生实验操作能力和创新精神,根据省教育厅相关文件精神,结合我市实际,制定本实施方案。 一、考试科目和分值 (一)理科实验操作考试科目为:物理、化学。考生随机抽考其中一科。理科实验操作考试按照现行教材中的学生分组实验要求命题。 (二)分值为10分,计入考生初中毕业学业考试总分;同时,考试结果分为A(10-9分)、B(8-7分)、C(6-5分)和D(4分及以下)4个等级,作为初中生综合素质评价“实践与创新”方面重要实证材料之一。 二、考试时间和地点 (一)4月11日公布理科实验操作考试具体范围。 (二)考试时间为4月19日-22日,共4天。 (三)考点分别设在合肥一中(滨湖区)、合肥五中、合肥六中(寿春路校区)、合肥七中、合肥八中(政务区)和合肥九中等6所学校。每个考点设物理、化学考场各2个。 三、对残疾和伤病考生的有关规定 因残疾丧失实验操作能力(须有残疾证)或因伤病确实不能参加实验操作考试的考生(须有病历或有关证明),由
本人申请,学校审核确认(学校应将申请免试的学生名单在学校公示栏公示,不少于3天),无异议后,在4月7日之前报区教育局(教育主管部门),并做好复查的准备。区教育局复核后,于4月8日汇总上报市教育考试院审批。免考的证明材料进入考生档案。被批准理科实验操作免试的考生按6分计算。考试时因考生本人操作因素造成事故受伤而中断考试的学生以实际已得分计算。 四、考试安排 (一)物理、化学试卷均为A、B、C、D、E、F各6套,每套8组。 (二)考生考前30分钟抽签决定考试科目和座位号,以座位定题。 (三)每场开考前30分钟,负责抽签的工作人员要核对考生理科实验操作考试准考证,安排考生抽签,考生按抽签号顺序列队等候入场。 (四)理科实验操作考试时间为每场20分钟。 (五)每个考场由8名考评教师组织考试,含1名主考教师、1名检录员。2名考评教师同时考评8名考生,分别评分后当场交给主考教师,由主考教师、检录员登录实验操作成绩并算出平均分后送交微机登录室登录、打印、公布。 (六)考生允许带钢笔(或圆珠笔)、铅笔、直尺和橡皮,不允许携带任何书籍和其他用品。 (七)考生要按指定时间到达考场,无故缺考的不予补
毕赤酵母发酵手册 总览 简介: 毕赤酵母和酿酒酵母很相似,都非常适合发酵生长。毕赤酵母在有可能提高总体的蛋白质产量的发酵中能够达到非常高的细胞浓度, 我们建议只有那些有过发酵经验或者能得到有经验的人的指导的人参与发酵。因为发酵的类型很多,所以我们很难为您的个人案例提高详细的过程。下面所给出的指导是基于Mut+和Mut s两种基因型的毕赤酵母菌株在15L的台式玻璃发酵罐中发酵而成。请在您的发酵开始前先阅读操作员手册。下面所给出的表就 发酵参数: 在整个发酵过程中监测和调控下列参数非常重要。下面的表格描述了这些参
设备推荐: 下面是所推荐设备的清单: ·发酵罐的夹套需要在发酵过程中给酵母菌降温,尤其是在甲醇流加过程中。你需要一个固定的来源来提供冷却水(5-10℃)。这可能意味着你需要一个冷冻装置来保持水的冷却。 ·一个泡沫探针就像消泡剂一样不可或缺。 ·一个氧气的来源——空气(不锈钢的发酵罐需要1-2vvm)或者纯氧(玻璃发酵罐需要0.1-0.3vvm)。 ·添加甘油和甲醇的补料泵。 ·pH的自动控制。 培养基的准备: 你需要准确配置下列溶液: ·发酵所需的基本盐类(第11页) ·PTM1补充盐类(第11页) ·75ml的50%的甘油每升初始发酵液,12ml的PTM1补充盐每升甘油。 ·740ml的100%的甲醇每升初始发酵液,12ml的PTM1补充盐每升甲醇。毕赤酵母生长的测定: 在不同的时间点通过测OD600的吸光值和湿细胞的重量来检测毕赤酵母的生长。培养的代谢速率通过通过观察溶氧浓度对应于有效碳源来测定。
溶氧的测定: 简介: 溶解氧的浓度时指氧气在培养基中的相关比例,溶氧100%是指培养基中氧达到饱和。毕赤酵母的生长需要消耗氧气,减少溶解氧的满度。毕赤酵母在生长时会消耗氧气,减少溶氧的程度。然而,因为代谢甲醇的最初阶段需要氧气,所以将溶氧浓度维持在一个适当的水平(>20%)来确保毕赤酵母在甲醇上的生长就至关重要。准确测定和监测培养中的溶氧浓度将会为您提供关于培养状态和健康程度之类的重要信息。因此,精确校正您的发酵设备非常重要,请查阅您的操作手册。 溶氧浓度的维持: 1、很难依靠发酵罐的氧气转换速率(OTR)将溶氧浓度维持在20%,特别是在 小型的玻璃罐中。在玻璃发酵罐中,通气一般约为0.1-0.3vvm(1L发酵液每分钟1L氧气)来提供氧气使DO保持在20%。氧气消耗的变化依赖于所添加的甲醇的总量和蛋白质的表达。 2、在通气为0.1-0.3vvm时,氧气可达到足够的水平,这在许多玻璃发酵罐中可 以通过通入无菌空气来实现。在不锈钢发酵罐中,压力可增加OTR(与K L a 有关)。 3、如果一个发酵罐不能提供足够水平的氧气,甲醇的添加需要因此适当降低。 请注意降低甲醇的总量可能导致蛋白质表达水平的降低。 4、为了使蛋白质表达水平达到最大,发酵时间应被分割来以较低的流加速度添 加相似水平的甲醇。对许多重组蛋白质来说,可以观察到甲醇消耗的总量和蛋白质产生的总量有直接的关系。 DO测量的用处: 在毕赤酵母生长阶段,消耗氧气而使DO浓度维持在较低水平。请注意不管是在甘油或甲醇中生长,都要消耗氧气。DO浓度可用来衡量代谢速率和碳源是否受抑制,代谢速率则是培养健康程度的一个指标。如果你希望能够完全的诱导AOX1启动子,确定碳源是否受抑制就非常重要。例如:DO浓度的改变可让你确定是否在添加甲醇前所有的甘油都已耗尽,其次还可以确定甲醇流加的速率是否超过消耗的速率。过多的甲醇(>1-2%vvm)可能会产生毒害。 DO的调控: 如果碳源受到抑制,关闭碳源的添加将会导致培养理工甲醇的速率降低,DO值会上升。终止碳源的添加,观察在碳源的流加关闭后需要多长时间来使DO值上升10%。如果延迟时间很短(<1min),说明碳源受抑制。
生物技术通报 BIOTECHNOLOGY BULLETIN 2009年第3期 ·综述与专论· 收稿日期:2008-09-01 基金项目:国家自然科学基金(30560184),国家“863”计划(2007AA02Z114),新世纪优秀人才支持计划(NCET -04-0837),海南省重点学科建 设项目专项与海南省教育厅高等学校科研项目(Hjkj200719) 作者简介:高炳淼(1982-),男,安徽明光人,硕士研究生,研究方向:海洋药物通讯作者:罗素兰,Tel :0898-********,E -mail :luosulan2003@https://www.doczj.com/doc/e113682343.html, 从生物体中有效分离纯化基因重组蛋白质一直是个难题。对于基因重组蛋白纯化技术来说,选择合适的表达系统是相当重要的,因为表达系统决定了细胞培养过程中产物的性质以及可能产生的杂蛋白。毕赤酵母是近年来流行的原核和真核蛋白质的表达载体。毕赤酵母能使外源真核基因正确翻译和翻译后加工,并分泌多种蛋白质,使产物易于提纯。纯化重组蛋白质的主要目的是分离出目的蛋白,主要的方法有浓缩沉淀、离子交换、亲和层析、反相层析等。 1酵母表达体系 巴斯德毕赤酵母(Pichia pastoris )是在酿酒酵母 表达体系的基础上,用其他的酵母菌株构建的、可高效稳定表达外源基因的新表达系统,即甲醇营养 型酵母(Methy -lotrophicyeast )表达系统[1]。作为第2代酵母表达系统,它不仅克服了大肠杆菌表达系统不能表达结构复杂的蛋白质、表达的蛋白不能分泌到细胞外、背景蛋白多、表达水平低等缺点,并且弥补了哺乳类细胞、昆虫细胞表达系统操作复杂、表达水平低、产业化生产造价昂贵的不足,此外,还具有其他酵母表达系统无法比拟的优越之处[2]。 巴斯德毕赤酵母表达系统具有强有力的醇氧化酶基因启动子,可严格调控外源蛋白的表达;同时作为真核表达系统,可对表达的蛋白进行翻译后的加工与修饰,从而使表达出的蛋白具有生物活性[3]。另外,毕赤酵母菌营养要求低、生长快、培养基廉价,易于进行操作和培养;其高密度发酵技术业已成熟,便于工业化生产;表达量高,许多蛋白可达到 毕赤酵母表达体系中重组蛋白的分离纯化 高炳淼 长孙东亭罗素兰安婷婷 (热带生物资源教育部重点实验室海南大学海洋学院材料与化工学院海南大学生物技术实验中心,海口570228) 摘 要:随着基因重组技术的快速发展,基因工程产品的利用越来越广泛,但其分离纯化的成本约占总成本的 60%~70%。因此,探索一些简单有效的分离纯化方法尤为必要。简单介绍了目前较为流行的毕赤酵母表达体系,着重概述了重组蛋白分离纯化技术方法的应用情况。 关键词:毕赤酵母 重组蛋白质 分离 纯化 Study on Separation and Purification of Recombinant Proteins in Pichia pastoris Expression System Gao Bingmiao Zhangsun Dongting Luo Sulan An Tingting (Key Laboratory for Tropical Biological Resources ,Ministry of Education Ocean College College of Materials &Chemical Engineering Center for Experimental Biotechnology ,Hainan University ,Haikou 570228) Abstract :Along with fast development of the gene recombinant technology ,the application of genetic engineering product is getting widespread , but the cost of the separation and purification approximately have been being high.So it is essential to explore simple and effective separation and purification method to decrease the cost.This review focused on progress of Pichia pastoris yeast expression system ,the technique of separation and purification of the recombinant proteins recently. Key words :Pichia pastoris R ecombinant protein Separation Purification
版权声明: 本站几乎所有资源均搜集于网络,仅供学习参考,不得进行任何商业用途,否则产生的一切后 果将由使用者本人承担! 本站仅仅提供一个观摩学习与交流的平台, 将不保证所提供资源的完 整性,也不对任何资源负法律责任。所有资源请在下载后 24 小时内删除。如果您觉得满意, 请购买正版,以便更好支持您所喜欢的软件或书籍! ☆☆☆☆☆生物秀[https://www.doczj.com/doc/e113682343.html,] ☆☆☆☆☆中国生物科学论坛[https://www.doczj.com/doc/e113682343.html,/bbs/] ☆☆☆☆☆生物秀下载频道[https://www.doczj.com/doc/e113682343.html,/Soft/] 生物秀——倾力打造最大最专业的生物资源下载平台! ■■■ 选择生物秀,我秀我精彩!!■■■ 欢迎到生物秀论坛(中国生物科学论坛)的相关资源、软件版块参与讨论,共享您的资源,获 取更多资源或帮助。
毕赤酵母多拷贝表达载体试剂盒 用于在含多拷贝基因的毕赤酵母菌中表达并分离重组蛋白 综述: 基本特征: 作为真核生物,毕赤酵母具有高等真核表达系统的许多优点:如蛋白加工、折叠、翻译后修饰等。不仅如此,操作时与E.coli及酿酒酵母同样简单。它比杆状病毒或哺乳动物组织培养等其它真核表达系统更快捷、简单、廉价,且表达水平更高。同为酵母,毕赤酵母具有与酿酒酵母相似的分子及遗传操作优点,且它的外源蛋白表达水平是后者的十倍以至百倍。这些使得毕赤酵母成为非常有用的蛋白表达系统。 与酿酒酵母相似技术: 许多技术可以通用: 互补转化基因置换基因破坏另外,在酿酒酵母中应用的术语也可用于毕赤酵母。例如:HIS4基因都编码组氨酸脱氢酶;两者中基因产物有交叉互补;酿酒酵母中的一些野生型基因与毕赤酵母中的突变基因相互补,如HIS4、LEU2、ARG4、TR11、URA3等基因在毕赤酵母中都有各自相互补的突变基因。 毕赤酵母是甲醇营养型酵母: 毕赤酵母是甲醇营养型酵母,可利用甲醇作为其唯一碳源。甲醇代谢的第一步是:醇氧化酶利用氧分子将甲醇氧化为甲醛,还有过氧化氢。为避免过氧化氢的毒性,甲醛代谢主要在一个特殊的细胞器-过氧化物酶体-里进行,使得有毒的副产物远离细胞其余组分。由于醇氧化酶与O2的结合率较低,因而毕赤酵母代偿性地产生大量的酶。而调控产生醇过氧化物酶的启动子也正是驱动外源基因在毕赤酵母中表达的启动子。 两种醇氧化酶蛋白: 毕赤酵母中有两个基因编码醇氧化酶-AOX1及AOX2。细胞中大多数的醇氧化酶是AOX1基因产物。甲醇可紧密调节、诱导AOX1基因的高水平表达,较典型的是占可溶性蛋白的30%以上。AOX1基因已被分离,含AOX1启动子的质粒可用来促进编码外源蛋白的目的基因的表达。AOX2基因与AOX1基因有97%的同源性,但在甲醇中带AOX2基因的菌株比带AOX1基因菌株慢得多,通过这种甲醇利用缓慢表型可分离Muts菌株。 表达: AOX1基因的表达在转录水平受调控。在甲醇中生长的细胞大约有5%的polyA+ RNA 来自AOX1基因。AOX1基因调控分两步:抑制/去抑制机制加诱导机制。简单来说,在含葡萄糖的培养基中,即使加入诱导物甲醇转录仍受抑制。为此,用甲醇进行优化诱导时,推荐在甘油培养基中培养。注意即使在甘油中生长(去抑制)时,仍不足以使AOX1基因达到最低水平的表达,诱导物甲醇是AOX1基因可辨表达水平所必需的。 AOX1突变表型: 缺失AOX1基因,会丧失大部分的醇氧化酶活性,产生一种表型为Muts的突变株(methanol utilization slow),过去称为Mut,而Muts可更精确地描述突变子的表型。结果细胞代谢甲醇的能力下降,因而在甲醇培养基中生长缓慢。Mut+(methanol utilization plus)指利用甲醇为唯一碳源的野生型菌株。这两种表型用来检测外源基因在毕赤酵母转化子中的整合方式。 蛋白胞内及分泌表达: 外源蛋白可在毕赤酵母胞内表达或分泌至胞外。分泌表达需要蛋白上的信号肽序列,将外源蛋白靶向分泌通路。几种不同的分泌信号序列已被成功应用,包括几种外源蛋白本身分 制作者:陈苗商汉桥
毕赤酵母同源重组的原理及目的基因整合方式毕赤酵母同源重组的原理及目的基因整合方式通过转化DNA与毕赤酵母基因组中同源序列的同源重组,毕赤酵母与酿酒酵母一样可产生 稳定的阳性转化子。这些重组的菌株在无选择压力条件下,即使其携带的基因是多拷贝的, 也表现出极度稳定性。常用的表达载体都含有HIS4基因,编码组氨酸脱氢酶基因,这些载 体经限制性内切线性化以后,可在AOX1或his4位点进行同源重组,从而产生HIS+重组子。单交换插入比双交换(替换)要更容易发生,多拷贝事件自发发生的几率只有单交换几率的 1-10%。 1. 基因插入AOX1或aox1::AGR4位点 GS115 的AOX1或KM71 的aox1::AGR4 位点可以与载体上AOX1位点(AOX1 启动 子,AOX1 转录终止子TT或下游3’AOX1三个位点发生同源重组,这样就在AOX1 或 aox1::AGR4 基因的上游或下游插入一个或多个基因拷贝。因为插入的表达盒没有破坏 原有基因组中的AOX1,所以转化子在GS115 中为HIS+ Mut+表型,在KM71 中为HIS+ Muts表型。 2. 基因替换AOX1位点
在his4 菌株如GS115 中,载体及基因组中AOX1启动子及3’AOX1 区的双交 换事件(取 代),结果AOX1 编码区全部被取代,产生HIS+Muts 表型。以AOX1 位点由基 因替 代而产生的Muts表型作为指示,可很容易地筛选出HIS+转化子的Mut 表 型。基因取 代的结果是缺失了AOX1 位点(Muts),增加了含有pAOX1、目的基因、HIS4 的表达 盒。基因取代(双交换事件)不如基因插入(单交换事件)发生得多。 3. 基 因插入His4位点 GS115(Mut+)或KM71(Muts)中,载体上HIS4 基因与染色体上his4 位点之 间发生 单交换事件,结果在his4位点插入一个或多个基因拷贝。由于基因组上AOX1 或 aox1::AGR4 位点未发生重组,这些His+转化子的表型均与亲本菌株相同。 4. 多拷贝插入 尽管多拷贝事件自发发生的概率很低,但是通过在培养基中加入选择性标记, 还是很容 易在转化子中筛选到插入多拷贝的表达核的转化子。
2019年初中实验操作考试工作方案 为规范实验操作考试工作,确保实验考试公平、公正、安全,根据教育部、省教育厅有关规定,结合我市实际,制定本工作方案。 一、考试组织 共划分4个考区,分别为东港考区(包括东港区、日照经济技术开发区、山海天旅游度假区,由东港区组织)、岚山考区、莒县考区、五莲县考区。 各考区要成立实验操作考试工作组织机构,制定实验操作考试工作方案,报市教育局备案。 各考点要成立相应的组织机构,设置考务、检录、医务、后勤、安保等专项工作组,具体负责实验考试各个环节的组织工作。要制定实验操作考试工作手册和突发事件应急预案,报区县教育和体育局。 二、考试内容 日照市教育局《关于公布<2019年初中实验操作考试内容及评价标准>的通知(日教便字〔2019〕12号)》中确定的内容。 三、考试时间 五月底前完成,不安排补考。具体考试时间由各考区确定。每学科实验操作考试用时均为10分钟。 四、考试方式 初三物理和化学实验操作考试,每名考生在两个学科中各抽
考一个实验;初二生物实验操作考试,每名考生抽考一个实验。 每学科实验操作考试满分均为10分。各科实验操作分别按实际得分计入中考成绩。 每考场内有1名评委组长和6名评委,每名评委监考4名考生。每考场共安排24名考生,单人单桌考试。实验考试采取评委现场赋分、考生摁手印确认的方式进行。 五、考务管理 (一)考区统筹。 1.周密部署安排。根据考生人数合理安排考试日程,各考区可设置若干考试小组,每个考试小组由领队、检录员、评委组长、评委、成绩登录员等人员组成。 2.严格安全管理。各考区要组织专家对各考点的消防安全、实验设施、仪器装备等情况进行全面检查,对考场布置进行验收。达不到要求的学校一律不得安排考点。 3.严格评委培训。各考区要遴选责任意识强、业务素质高、身体状况好的教师承担考试工作, 参与人员都要签订《实验操作考试工作人员承诺书》。当年有子女、直系亲属等参加考试者不得参与考试工作。 各考区要做好评委培训工作,加强相关法律法规、职业道德、考试规程、作弊识别、安全管理、风险防范等方面的培训,确保评委准确把握实验操作考试内容及评分要点,监督考生遵守安全规程进行实验,及时处置突发情况。 4.严格证件管理。工作人员必须佩戴由各考区统一印制的工作证。考生使用由市教育局统一模板印制并由各区县教育主管
精心整理 Pichia酵母表达系统使用心得 甲醇酵母表达系统有不少优点,其中以Invitrogen公司的Pichia酵母表达系统最为人熟知,并广泛应用于外源蛋白的表达。虽然说酵母表达操作简单表达量高,但是在实际操作中,并不是每个外源基因都能顺利得到高表达的。不少人在操作中会 这个 是来中心( 1. 3. 4. 5. 产品性能:优点——使用简单,表达量高,His-tag便于纯化;缺点——酵母表达蛋白有时会出现蛋白切割问题。 巴斯德毕赤酵母(Pichiapastoris)是一种能高效表达重组蛋白的酵母品种,一方面由
于其是属于真核生物,因此表达出来的蛋白可以进行糖基化修饰,另一方面毕赤酵母生长速度快,可以将表达的蛋白分泌到培养基中,方便蛋白纯化。 毕赤酵母表达载体pPICZ在多克隆位点(MCR)3'端带有his-tag和c-mycepitopes,这些tag有利于常规检测和纯化,而且在MCR5'端引入了alphafactor(α-factor)用以 的是系 PIC9K G418无 leslie:要做毕赤酵母表达实验,首先当然就要了解这个可爱的酵母了(椭圆形,肥嘟嘟的,十分可爱),她和大肠杆菌长得有较大区别(大肠杆菌是杆状的),因此在培养的过程中要区别这两种菌体,除了气味,浓度,颜色以外,也可以取样到显微
镜中观测。大家做毕赤表达的时候应该都遇过这种情况吧,表达过程中染菌(我们实验室曾经污染过各种颜色形状的细菌,那真是一段可怕的经历),如果在不知情的情况下继续做下去,那可以就是浪费大把的时间了。 基本熟悉了毕赤酵母,了解了她生长的喜好(多糖偏酸环境),生长的周期等等 有 的 余的 (起始密码子),有人认为酵母启动子与外源基因的ATG之间的距离越短对于表达的该基因越有利; ⑤如果不希望有c-myc和His-tag,可以在基因片段末尾加入终止密码子;