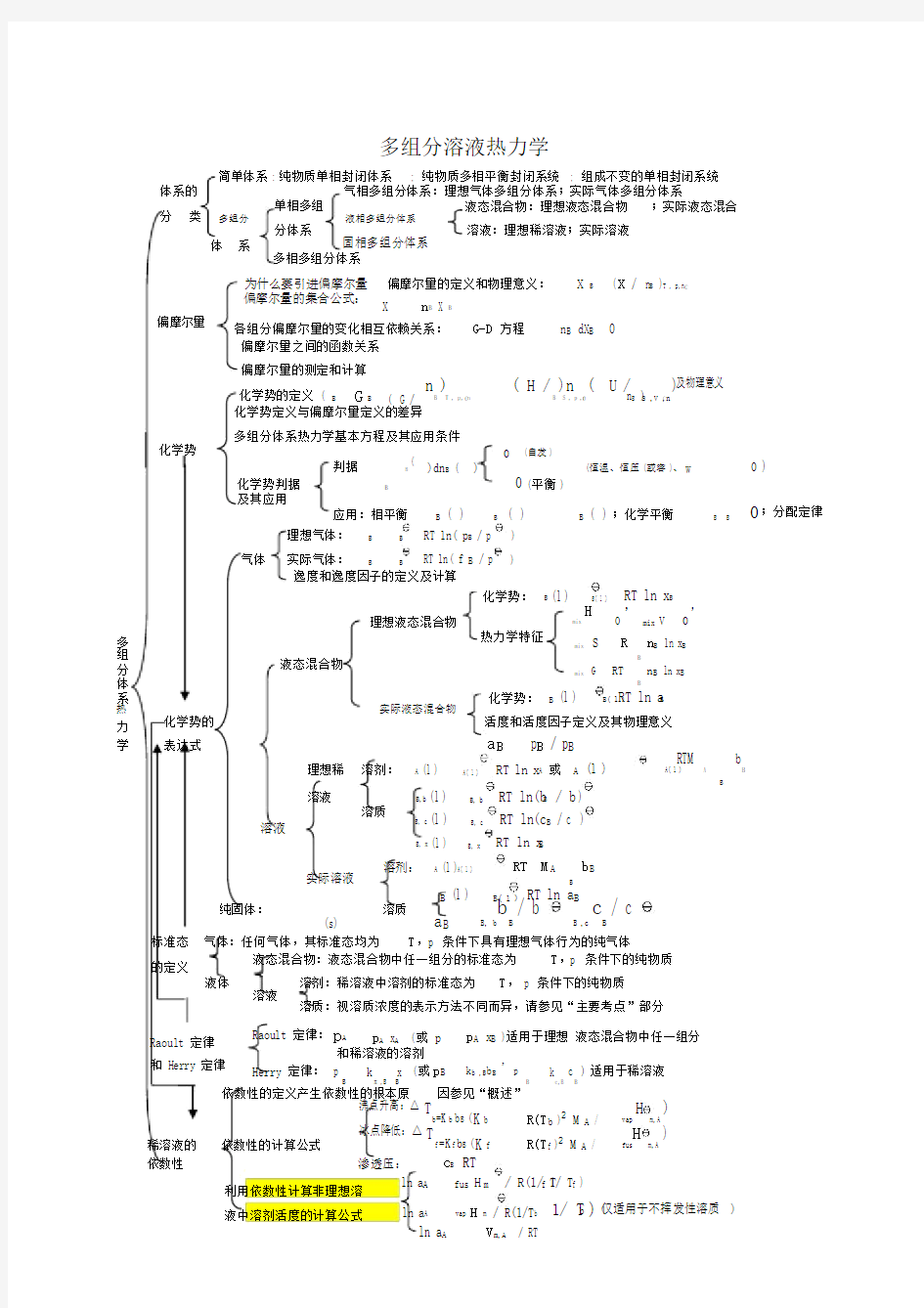

多组分溶液热力学
简单体系 : 纯物质单相封闭体系 ; 纯物质多相平衡封闭系统 ; 组成不变的单相封闭系统
体系的 气相多组分体系:理想气体多组分体系;实际气体多组分体系
分 类 单相多组 液态混合物:理想液态混合物 ;实际液态混合
多组分 液相多组分体系
分体系 溶液:理想稀溶液;实际溶液
体 系
固相多组分体系 多相多组分体系
偏摩尔量
化学势
为什么要引进偏摩尔量 偏摩尔量的定义和物理意义: X B
( X / n B )T , p,n C
偏摩尔量的集合公式:
X
n B X B
各组分偏摩尔量的变化相互依赖关系:
G-D 方程
n B dX B 0
偏摩尔量之间的函数关系 偏摩尔量的测定和计算
化学势的定义 ( B G B ( G / n B )
T , p, n C
( H / n B )
S , p ,n C
( U /
n B )S ,V ,n C
)及物理意义
化学势定义与偏摩尔量定义的差异
多组分体系热力学基本方程及其应用条件
0 (自发 )
化学势判据 判据
B
(
)dn B ( )
0 (恒温、恒压 (或容 )、 W
0 )
B
(平衡 )
及其应用
应用:相平衡
B ( ) B
( )
B ( ) ;化学平衡
B B
0;分配定律
理想气体:
B
B
RT ln( p B / p ) 气体
实际气体: B B
RT ln( f B / p )
逸度和逸度因子的定义及计算
化学势:
B
(l )
B( l )
RT ln x B
理想液态混合物
mix
H
, mix V
,
多 热力学特征
mix
S
R
n B ln x B
组
液态混合物
B
分 mix
G RT
n B ln x B
体
B
化学势: B (l )
B( l )
RT ln a B
系
热 化学势的
实际液态混合物
力 活度和活度因子定义及其物理意义
a B p B / p B
学
表达式
理想稀 溶剂:
A
(l )
A( l ) RT ln x A 或 A (l )
A( l )
RTM
A
b
B
B,b
(l )
RT ln(b B / b ) B
溶液
溶质 B, b
B, c
(l )
B, c
RT ln(c B / c )
溶液
B, x
(l )
RT ln x B
B, x
实际溶液
溶剂:
A
(l )A( l )
RT M A
b B
B
纯固体:
(s)
溶质 B (l )
B( l )
RT ln a B
a B
B, b
b B
/ b
B ,c
c B
/ c
标准态 气体:任何气体,其标准态均为 T ,p 条件下具有理想气体行为的纯气体
的定义
液态混合物:液态混合物中任一组分的标准态为 T ,p 条件下的纯物质 液体
T , p 条件下的纯物质
溶液 溶剂:稀溶液中溶剂的标准态为
溶质:视溶质浓度的表示方法不同而异,请参见“主要考点”部分 Raoult 定律 Raoult 定律: p A p A x A (或 p
p A x B )适用于理想 液态混合物中任一组分
和稀溶液的溶剂
和 Herry 定律
Herry 定律: p B
k x ,B x (或 p B k b ,B b B ,
p k c ) 适用于稀溶液
B
B c,B B
依数性的定义产生依数性的根本原
因参见“概述”
依数性的计算公式
沸点升高:△
T
b =K b b B (
K b R(T b )2
M A / vap H
m,A
)
稀溶液的
冰点降低:△ T
f =K f b B (
K
f
R(T f )2
M A /
fus
H
m,A
)
依数性
渗透压:
c B RT
利用依数性计算非理想溶
ln a A fus H m / R(1/ T f 1/ T f )
ln a A
vap
H m / R(1/T b
1/ T b ) (仅适用于不挥发性溶质 )
液中溶剂活度的计算公式
ln a A
V m,A / RT
一、选择题
1. A,B,C 三种物质组成的溶液,物质
C 的偏摩尔量为
(a)
n
C T , p, n ,n
(b)
G n C T, p,n
, n
A B
A
B
(c) A n A T ,v,n
, n
(d)
H n C T,s,n
,n
B
A
B
A
(答案 ) b (什么叫偏摩尔量 (P 165-166 )偏摩尔量具有哪些性质和特点。 1-6 题)
讨论:①就象只有容量性质才有摩尔量一样,只有容量性质才有偏摩尔量。
②偏摩尔量定义式 Z B
( Z
)T , p,n c B 的物理意义为: 在恒温, 恒压并保持除 B 以
n B
外其他物质量不变条件下,往一无限大的体系中加入 1molB 物质所引起的热力学量
Z 的变
化值叫做热力学量 Z 在该混合体系中的偏摩
尔量。
③根据定义,只有在恒温,恒压下组分对
Z 的偏微分才叫偏摩尔量,任何偏摩尔
量都是 T ,p 和组成的函数。 Z B
f (T , p, n 1,n 2 L L )
④ 偏摩尔量为强度性质
⑤ 纯物质的偏摩尔量就是它的摩尔量。 ⑥ 偏摩尔量可以大于零,等于零,小于零。
2. 关于偏摩尔量 , 下面的说法中正确的是
( a ) 偏摩尔量的绝对值都可求算
( b ) 系统的容量性质才有偏摩尔量 ( c ) 同一系统的各个偏摩尔量之间彼此无关
( d ) 没有热力学过程就没有偏摩尔量
(答案 ) b
3. 关于偏摩尔量 , 下面的叙述中不正确的是
( a ) 偏摩尔量是状态函数 , 其值与物质的数量无关 ( b ) 系统的强度性质无偏摩尔量 ( c ) 纯物质的偏摩尔量等于它的摩尔量
( d ) 偏摩尔量的数值只能为整数 (答案 )
d
4 .没有偏摩尔量的的状态性质是
( a ) G (b )p
( c )V (d )H
(答案 ) b
5.关于偏摩尔量,下面的叙述中不正确的是
(a)偏摩尔量的数值可以是正数、负数和零
(b)溶液中每一种广度性质都有偏摩尔量,而且都不等于其摩尔量
(c)除偏摩尔吉布斯自由能外,其他偏摩尔量都不等于化学势
(d)溶液中各组分的偏摩尔量之间符合吉布斯-杜亥姆关系式(答案 ) b
6.下列各式中哪个是化学势
H A
(a) (b)
n B
T , S,n C n B
T , p, n C
G U (c) (d)
n
B
T ,V ,n C n
B
S,V , n C
(答案 ) d(什么叫化学势化学势具有哪些性质和特点。6-15 题 ) U H A G
i
n
i
S, p ,n j i n
i
T,V ,n j i
n
i
T , p, n j i
n
i
S ,V , n j i
①化学势可以用不同的状态函数进行定义,但相应的
G
既符下标不同。只有
n i T , p,n j i
合化学势的定义,又符合偏摩尔量的定义。又因为大多数过程是在恒温恒压下进行的,所以该定义式应用最广泛。
②仅就
G
定义式而言,根据i G i G i的关系可知,纯物质的化学势i
n i T , p ,n j i
就等于其摩尔吉布斯自由能函数,即B G B ,m,且为强度性质,其绝对值不知道。
7.下列四个偏微商中哪个既是偏摩尔量,又是化学势
( a)( U
) S,V ,n C ( b)(
H
)S, p,n C ( c)(
A
)T ,V ,n C ( d)(
G
)T , p,n C n B n B n B n B
(答案 ) d
8. 298 K, p 下,苯和甲苯形成理想液体混合物,第一份溶液体积为 2 dm 3,苯的摩尔分数为,苯的化学势为 1 3
,苯的摩尔分数为,化学势为 2
,第二份溶液的体积为 1 dm μ,则
(a) μ>μ(b) μ<μ
1 2 1 2
(c) μ1=μ2 (d) 不确定
(答案 ) b
化学势的表达式
IG:
B = B (T)
RT ln
p B
p
IL:
B (l )B (l ) RT ln x B
9. 在和 101325Pa?下水的化学势与水蒸气化学势的关系为
( a ) μ(水 )=μ (汽) (b ) μ(水 )<μ (汽 )
( c ) μ(水 )>μ(汽 ) ( d ) 无法确定
(答案 ) a
①什么叫相平衡。
②两相平衡,化学势相等,
( )=( )
10. 273 K , 2× kPa 时,水的化学势比冰的化学势
(a) 高 (b) 低
(c) 相等
(d)
不可比较
(答案 ) b ,
增压能可使冰变为水。
11. 饱和溶液中溶质的化学势
与纯溶质的化学势
* 的关系式为
(a )
* (b )
*
( c )
*
(d )不能确定
(答案 ) a (两相平衡,化学势相等,
( )= ( ))
12. 不饱和溶液中溶质的化学势
与纯溶质的化学势 的关系式为:
(a )
* ( b ) * ( c ) * ( d )不能确定
(答案 ) c
13. 单一组分的过冷液体的化学势比其固体的化学势:
( a ) 高 ( b ) 低
(c ) 相等
(d ) 不可比较
(答案 ) a
14. 在
, 两相中均含有 A 和 B 两种物质 ,当达到平衡时 ,下列哪种情况是正确的
(a) α= α(b) α = β
(c) αβ
(d)
ββ= =
(答案 ) b
15.下列四种状态纯水的化学势最大的是
(a)K,101325 Pa, H2O(l)的化学势μ1
(b)K,101325 Pa, H2O(g)的化学势μ2
(c)K,202650 Pa, H2O(l)的化学势μ3
(d)K,202650 Pa, H2O(g)的化学势μ4
(答案 ) d
16.气体热力学标准态为
(a) 25℃、 100kPa 状态
(b), 101325Pa,理想气体状态
(c)100kPa,纯理想气体状态
(d) 25℃, 100kPa 纯理想气体状态
(答案 ) c (标准态定义气体、理想液态混合物各组份及理想稀溶液中溶质和溶剂的标准怎
么定义的 16-17 题 )
①任何气体的标准态都相同,其定义为在温度T、压力为P=101325 Pa 且具有理想气
体形为的那个状态
②纯固体物质的标准状态就是标准压力p(100KPa)下的纯固体
③纯液体物质的标准状态就是标准压力p(100KPa)下的纯液体
④在理想混合物中,任一组分的标准态都是p 下的纯物质。
⑤溶液中,溶剂和溶质标准态的定义不同。溶剂的标准态为p下的纯物质与理想混合物中任一组分的标准态一样。而溶质的标准态定义则根据浓度的表示方法不同而异。
17.涉及纯物质标准状态的下列说法中不正确的是
( a)纯理想气体的标准状态就是标准压力p (100KPa)下的状态
( b)纯液体物质的标准状态就是标准压力p (100KPa)下的纯液体
( c)纯固体物质的标准状态就是标准压力p (100KPa)下的纯固体
( d)不同的物质在相同温度下都处于标准状态时,它们的同一热力学函数值都应相同
(答案 ) d
18.关于理想液体混合物,下面的表述中不正确的是
(a)理想液体混合物一定是无热溶液,但无热溶液不一定是理想溶液
(b)理想液体混合物可以是电解质溶液,也可是非电解质溶液
(c)理想液体混合物中任一组分在所有浓度时都遵守拉乌尔定律
(d)理想液体混合物是指所有分子之间的引力和分子体积都相仿的多组分体系
(答案 ) b (什么叫理想液态混合物,其热力学特性
18-22)
任意组分,在任意浓度下均遵守
Raoult ’ s law 的溶液称为理想混合物
①
mix V,
mix H m ,
mix S 和
mix G 是理想混合物形成过程中四个重要 的热力学性质的变
化值。
② ②Δ mix
V = 0,
mix
H = 0,说理想液态混合物在行成过程中没有体积的变化
(
mix V = 0),
m
并且无热效应(
mix m
H =0)。
③ ③Δ mix G m = RT ∑ x B lnx B <0 说明理想液态混合物的混合过程是自发过程。
④ ④Δ
S =- RT ∑ x lnx ,
G = RT ∑ x lnx
B 具有与理想气体等温等压混合过程完全
mix m
BB
mix m
B
相同的形式。
19. 假设 A ,B 两组分混合可以形成理想液体混合物,则下列叙述中不正确的是
(a) A , B 分子之间的作用力很微弱 (b) A , B 都遵守拉乌尔定律
(c) 液体混合物的蒸气压介于A ,B 的蒸气压之间
(d) 可以用重复蒸馏的方法使A , B 完全分离
(答案 ) a
20. 对于理想液体混合物
(a) mix H = 0 mix S = 0
(b) mix H = 0 mix G = 0
(c)
mix V = 0
mix H = 0
(d)
mix V = 0
mix S = 0
(答案 )
c
21. 二组分理想液态混合物的蒸气压
(a) 一定大于任一纯组分的蒸气压 (b) 一定小于任一纯组分的蒸气压 (c) 一定介于两种纯组分的蒸气压之间 (d) 以上三种情况均有可能
(答案 )
c
p p A
p B
p A * x A p B * (1 x A )
设 p A *
p B * , Q x A 1, p p A *
22. 在一定压力下, A 和 B 形成的理想溶液的沸点
(a ) 一定大于纯 A 的沸点
( b ) 一定大于纯 B 的沸点
(c ) 一定在 A 和 B 的沸点之间
( d ) 一定小于纯 A 的沸点也小于纯 B 的沸点
(答案 ) c
23.
关于亨利系数,下列说法中正确的是
(a)其值与温度、浓度和压力有关
(b)其值与温度、溶质性质和浓度有关
(c)其值与温度、溶剂性质和浓度有关
(d)其值与温度、溶质和溶剂性质及浓度的标度有关(答案 ) d p B=K B x B
关于 Henry’s law
①Henry’s law 适用于稀溶液中挥发性或气体的溶质,所以度和平衡状态下,气体在 B 溶液中的溶解度(用物质量分数Henry’s Law可表述为:在一定温x B表示)与该气体的平衡分压
p B成正比。若为挥发性的溶质,则可表述为:在一定温度和平衡状态下,稀溶液中挥发性溶质在气相中的平衡分压与其在溶液中的摩尔分数(或质量摩尔浓度、物质的量浓度)成正比。
②当溶质用不同的表示方法时,Henry’s law有如下形式,
p B K
B ,x
x
B , p B
K
B ,b
b
B , p B K B ,c c B
Q x B c B b B K
B, x
K
B,b
K
B ,c
③Henry’s law中的比例系数其物理意义不同于Raoult ’s law中
的p*A,它不是纯B的饱和
蒸气压,仅是一个由实验确定的比例常数而已,在数值上等于x 0 时 B 分压对 x B作图的正切值。 K B f (T , 溶剂和溶质性质 L L )。
④对于混合气体,在总压不大时,Henry’s law可分别适用于每一种气体。
⑤溶质在气相和在溶液中的分子状态必须相同。
如 HCl,在气相为 HCl 分子,在溶相为H+和 Cl-,则 Henry’s law不适用。
⑥溶液浓度愈稀,对Henry’s law符合得愈好。对气体溶质,T↑或 p↓,降低了溶解度,能更好地符合Henry’s law。
24.稀溶液中挥发性溶质在气相中分压力与液相组成的关系符合
( a)拉乌尔定律(b)亨利定律(c)气相方程(d)液相方程
(答案 ) b
25.稀溶液的依数性包括蒸汽压下降、沸点升高、凝固点降低和渗透压 ,下面的陈述都与它们有关,其中正确的是
(a)只有溶质不挥发的稀溶液才有这些依数性
(b)所有依数性都与溶液中溶质的浓度成正比
(c)所有依数性都与溶剂的性质无关
(d)所有依数性都与溶质的性质有关
(答案 ) b
稀溶液的依数性:(蒸汽压下降、沸点升高、凝固点降低和渗透压)与溶质的性质无关,
只与溶质的数量有关的性质称为稀溶液的依数性。
蒸汽压下降:p A p*A x B
沸点升高:T K b b b
凝固点降低:T f K f , b b B
渗透压:c B RT
26.下列哪种现象不属于稀溶液的依数性
( a)凝固点降低(b)沸点升高(c)渗透压(d)蒸气压升高(答案 ) d
27.影响沸点升高常数和凝固点降低常数值的主要因素是
( a)溶剂本性(b)温度和压力
( c)溶质本性(d)温度和溶剂本性
(答案 ) a
沸点升高常数:
R(T b* ) 2 M A K b
vap
H
m
凝固点降低常数:K f ,b ( R(T f* ) 2 M A fus H m, A
28.海水不能直接饮用的主要原因是
(a) 不卫生(b) 有苦味
(c) 含致癌物(d) 含盐量高
(答案 ) d , 饮用高盐海水后将发生反渗透,使体内缺水。盐卤破坏体内胶体营养成分。
29.挥发性溶质溶于溶剂形成的稀溶液,溶液的沸点会
(a)降低(b) 升高
(c)不变(d) 可能升高或降低
(答案 ) d
30.将非挥发性溶质溶于溶剂中形成稀溶液时,将引起
( a)沸点升高(b)熔点升高
(c)蒸气压升高(d)都不对
(答案 ) a
31. 两只各装有 1 kg 水的烧杯,一只溶有mol 蔗糖 ,另一只溶有mol NaCl,按同样速度降温冷却,则
(a) 溶有蔗糖的杯子先结冰(c) 溶有 NaCl 的杯子先结冰(b) 两杯同时结冰(d) 视外压而定
(答案 ) a , NaCl 在水中解离后 ,粒子数增加一倍 ,冰点下降更多。
32. 少量 NaCl 放入水中形成稀溶液后将引起溶液
(a) 凝固点升高(b) 沸点降低
(c) 蒸汽压降低(d) 三个都不对 (答案 ) c
二、计算题
1. 0℃时, 101325Pa 的氧气在水中的溶解度为 344.90cm 3,同温下, 101325Pa 的氮气在水中的溶解度为 23.50cm 3 ,求 0℃时与常压空气呈平衡的水中所溶解的氧气和氮气的摩尔比。
解: k(O 2)=101325/ ; k(N 2 )=101325/
c(O 2)=× 101325/k(O 2 )=72.43 cm 3;
3
显然二者之比为
2. 20℃时乙醚的蒸气压为,今有 100.0g 乙醚中溶入某挥发性有机物质 10.0g ,蒸汽压下降到,试求该有机物的摩尔质量。
解: p p * x 2 p *
n 2
p *
G 2
/ M
2
n 1
G 1/M 1
59.00 56.80 59.00
10/ M 2 ;解得
M 2
= mol
-1
100/ 73
3. 25℃时水的蒸气压为, 若一甘油水溶液中甘油的质量分数 w =,问溶液的蒸气压为多少 (甘油即丙三醇,摩尔质量为 93.1g/mol ,是不挥发性溶质) 。
解: x B
99/18
1/ 93.1 =; p=× =
99 /18
4. 60℃ 时,液体 A 和 B 的饱和蒸气压分别为
$
和 $,在该温度时 A 和 B 可形成稳定
化合物 AB ,其饱和蒸气压为
$
,并假设任何给定的混合物具有理想液体混合物性质。如今 在 60℃ 时,将 1 mol A 和 4 mol B 混合为 —液体体系,求算此体系的蒸气压和蒸气组成。
解:将 1 mol A
和 4 mol B 混合可形成 1 mol AB 和 3 mol B
*
*
$
$
) ×3/4= $
[2]
p =p AB x AB + p B x B = )/4 +
B B $ )(3/4)/ $ [2]
y =p /p=( =
y AB = 1 - y B= [1]
5. 液体 A 和 B 可形成液态理想混合物。今有 1 mol A 和 2 mol B 组成液态理想混合物。在
50 °C与此混合物呈平衡的蒸气总压为33 Pa,若再加 1 mol A 到该混合物中,则与此混合物在 50 °C呈平衡的饱和蒸气压为39 Pa。试计算50°C 时 , 纯 A、纯 B 的饱和蒸气压p A,p B为多少
解: p p A ( p B p A ) x B [3]
33 330.6 p A ( p B p A ) 2
(1) 3
39 996.7 p A ( p B
1
(2) p A )
联立 (1),(2)式得
2
p A 5999.5 Pa [2]
p B 19 998.4 Pa
6. 在 K 时,乙醚的蒸气压为kPa,今在 0.10 kg 乙醚中溶入某非挥发性有机物质0.01 kg,乙醚的蒸气压降低到kPa,试求该有机物的摩尔质量。
解:
p
A p
A
1 x
B
p A
x B 1
p
A
m B
M B p E m B m A 1 p M B A
M A
0.01kg
0.01kg
M B 1 56.79kPa 0.01kg 58.95kPa
M B 0.0741kg mol-1
M B 0.195kg mol -1
7. 设苯和甲苯组成的溶液为理想溶液,求293K1mol 苯和 1mol 甲苯进行混合过程的V,
H , G 为若干
解:
V = 0; H = 0; G =-3379J
8. 苯在 101 325 Pa 下的沸点为
K ,沸点升高常数为 K kg mol 1 ,求苯的摩尔汽化焓。
解: K b
R(T b ) 2
M A
vap
H m
vap
H
m
R(T b ) 2 M A 30.9 kJ mol 1
K b
9. 血浆的渗透压在 K(37 °C)时为 kPa ,计算葡萄糖等渗
透溶液的质量摩尔浓度。 (设血浆密
度为 1
103 kg m 3 )
解:
n
B
RT
m B RT
[3]
V 1kg / 水
m B
(1kg / ) 0.2829 mol kg 1 [2]
RT
10. 40℃时苯及二氯乙烷的蒸气压分别为及, 求 40℃时与 x(苯 )=的苯 -二氯乙烷溶液呈平衡的
蒸气组成及苯的分压。设系统可视为理想液态混合物。
解: p=p 1+p 2=× +×=;
[2]
y 1=× = [2]
p 2=× =
[2]
11.
K 时,物质的量相同的 A 和 B 形成理
想液体混合物,试求mix V, mix H, mix G, mix S 。
解: mix V = 0
[1] mix H = 0
[1]
mix G = RT(n A lnx A + n B lnx B ) = -3437n A Jmol · -1
[2]
mix
S
R
-1 -1
[2]
n B ln x B = JK · ·mol
B
12. 在 p= kPa, 85℃时,由甲苯 (a)及苯 (b)组成的二组分液态混合物沸腾(视为理想液态混合
物)。试计算该理想液态混合物在苯和纯苯的饱和蒸气压分别为
kPa及 85℃沸腾的液相组成及气相组成。已
知kPa和 kPa。
85℃时纯甲
解: p p A x A p B x B p A ( p B p A )x B [2]
x B p p A
0.780 [2] p B p A
x A 1 x B 0.220 [1]
y B p B / p p B x B / p 116.9 0.780 / 101.3 0.900 [2] y A 0.100 [1]
多组分溶液热力学 ; 组成不变的单相封闭系统 液态混合物:理想液态混合物;实际液态混合 溶液:理想稀溶液;实际溶液 因?参见“概述” B c RT ∏= T b=K b b B (2 A,A ()/ b b vap m K R T M H * =? ) T f =K f b B (2 A,A ()/ f f fus m K R T M H * =? ) A /(1/1/) fus m f f a H R T T * =?- A,A / m a V RT * =-∏ A /(1/1/) vap m b b a H R T T* =?- (仅适用于不挥发性溶质) (或 A B p p x* ?=)适用于理想液态混合物中任一组分 (或 B,B B b p k b =, B,B B c p k c =) 适用于稀溶液 B B,, (/) C T p n X X n =?? B B X G-D方程 B B n dX= ∑ ,,,,,, )(/)(/) C C C B T p n B S p n B S V n n H n U n =??=??)及物理意义 B B B ()()() μαμβμδ ==???=;化学平衡 B B νμ= ∑;分配定律B )() dnα(恒温、恒压(或容)、0 W'=) =(平衡) 0(自发) ln(/) B f p ln(/) B p p A A()A ()ln l l RT x μ =+ 或 A A()A B B () l l RTM b μμ =-∑ B,B,B ()ln(/) c c l RT c c μ =+ B,B,B ()ln x x l RT x μ =+ B,B,B ()ln(/) b b l RT b b μ =+ A A()A B B () l l RT M b μμ? =-∑ B B()B ()ln l l RT a μμ =+ ,, // B B b B B c B a b b c c γγ == 化学势: B B()B ()ln l l RT a μμ =+ 活度和活度因子定义及其物理意义 / B B B a p p* = 化学势: B B()B ()ln l l RT x μμ =+ 热力学特征 mix B B B ln S R n x ?=-∑ mix H=,mix0 V ?=, mix B B B ln G RT n x ?=∑ T,p 条件下的纯物质 T,p 条件下的纯物质 ,p 条件下具有理想气体行为的纯气体
第四章多组分系统热力学 主要公式及其适用条件 基本概念 1. 溶剂和溶质 如果组成溶液的物质有不同的状态,通常将液态物质称为溶剂,气态或固态物质称为溶质。 如果都是液态,则把含量多的一种称为溶剂,含量少的称为溶质。 2. 溶液 广义地说,两种或两种以上物质彼此以分子或离子状态均匀混合所形成的体系称为溶液。 溶液以物态可分为气态溶液、固态溶液和液态溶液。 根据溶液中溶质的导电性又可分为电解质溶液和非电解质溶液。 3. 混合物 多组分均匀体系中,溶剂和溶质不加区分,各组分均可选用相同的标准态,使用相同的经验定律,这种体系称为混合物,也可分为气态混合物、液态混合物和固态混合物。 1. 偏摩尔量的定义 偏摩尔量的物理意义:在定温定压条件下,往无限大的系统中(可以看作其浓度不变)加入1 mol 物质B 所引起的系统中某个(容量性质的)热力学量X 的变化。 几点注意事项: 只有在定温和定压条件下才有偏摩尔量。 只有广度性质才有偏摩尔量,而偏摩尔量是强度性质。 纯物质的偏摩尔量就是它的摩尔量。
任何偏摩尔量都是T,p和组成的函数。 化学势定义 保持温度、压力和除B以外的其它组分不变,体系的G自由能随nB的变化率称为化学势,所以化学势就是偏摩尔G自由能。 化学势在判断相变和化学变化的方向和限度方面有重要作用。化学势的物理意义:是决定物质传递方向和限度的强度因素。 多相和多组分体系的热力学基本方程 多组分系统多相平衡的条件为:除系统中各相的温度和压力必须相同以外,各物质在各相中的化学势必须相等。如果某物质在各相中的化学势不等,则该物质必然从化学势较大的相向化学势较小的相转移。 由于考虑了系统中各组分物质的量的变化对热力学状态函数的影响。因此该方程不仅能应用于封闭系统,也能应用于开放系统。 拉乌尔定律和亨利定律 乌拉尔定义:一定温度时,溶液中溶剂的蒸气压pA与溶剂在溶液中的物质的量分数xA成正比,其比例系数是纯溶剂在该温度时的蒸气压pA*。 拉乌尔定律只适用于稀溶液中的溶剂 1. 在稀溶液中,溶剂分子之间的引力受溶质分子的影响很小,即溶剂分子周围的环境与纯溶剂几乎相同。 2. 混合物中各种分子之间的相互作用力完全相同。
第三章 多组分系统热力学 3.1 溶液(s o l u t i o n ) 广义地说,两种或两种以上物质彼此以分子或离子状态均匀混合所形成的体系称为溶液。 溶液以物态可分为气态溶液、固态溶液和液态溶液。根据溶液中溶质的导电性又可分为电解质溶液和非电解质溶液。 本章主要讨论液态的非电解质溶液。 溶剂(solvent )和溶质(solute ) 如果组成溶液的物质有不同的状态,通常将液态物质称为溶剂,气态或固态物质称为溶质。 如果都是液态,则把含量多的一种称为溶剂,含量少的称为溶质。混合物(mixture ) 多组分均匀体系中,溶剂和溶质不加区分,各组分均可选用相同的标准态,使用相同的经验定律,这种体系称为混合物,也可分为气态混合物、液态混合物和固态混合物。 3.2 溶液组成的表示法 在液态的非电解质溶液中,溶质B 的浓度表示法主要有如下四种: 1.物质的量分数 B x (mole fraction) B B def (n x n 总) 溶质B 的物质的量与溶液中总的物质的量之比称为溶质B 的物质的量分数,又称为摩尔分数,单位为1。 2.质量摩尔浓度m B (molality ) B B A def n m m
溶质B 的物质的量与溶剂A 的质量之比称为溶质B 的质量摩尔浓度,单位是-1mol kg ?。这个表示方法的优点是可以用准确的称重法来配制溶液,不受温度影响,电化学中用的很多。 3.物质的量浓度c B (molarity ) B def B n c V 溶质B 的物质的量与溶液体积V 的比值称为溶质B 的物质的量浓度,或称为溶质B 的浓度,单位是 3mol m -? ,但常用单位是3mol dm -?。 4.质量分数w B (mass fraction ) B B () m w m = 总 溶质B 的质量与溶液总质量之比称为溶质B 的质量分数,单位为1。 3.3 偏摩尔量与化学势 3.3.1 单组分体系的摩尔热力学函数值 体系的状态函数中V ,U ,H ,S ,A ,G 等是广度性质,与物质的量有关。设由物质B 组成的单组分体系的物质的量为B n ,则各摩尔热力学函数值的定义式分别为: 摩尔体积(molar volume ) * m,B B V V n = 摩尔热力学能(molar thermodynamic energy ) * m,B B U U n = 摩尔焓(molar enthalpy ) *m,B B S S n = 摩尔Helmholz 自由能(molar Helmholz free energy ) * m,B B A A n = 摩尔Gibbs 自由能(molar Gibbs free energy ) * m,B B G G n = 这些摩尔热力学函数值都是强度性质。 3.3.2 多组分体系的偏摩尔热力学函数值
多组分系统热力学 一、判断题: 1 克拉佩龙方程适用于纯物质的任何两相平衡。() 2 克—克方程比克拉佩龙方程的精确度高。( ) 3 一定温度下的乙醇水溶液,可应用克—克方程式计算其饱和蒸气压。() 4 将克—克方程的微分式用于纯物质的液气两相平衡,因为vap H m>0,所以随着温度的 升高,液体的饱和蒸气压总是升高的。() 5 二组分理想液态混合物的总蒸气压大于任一纯组分的蒸气压。() 6 理想混合气体中任意组分B的逸度就等于其分压力p B。() 7 因为溶入了溶质,故溶液的凝固点一定低于纯溶剂的凝固点。() 8 溶剂中溶入挥发性溶质,肯定会引起溶液的蒸气压升高。() 9 理想稀溶液中的溶剂遵从亨利定律,溶质遵从拉乌尔定律() 10 理想液态混合物与其蒸气成气、液两相平衡时,气相总压力p与液相组成x B呈线性关 系。() 11 如同理想气体一样,理想液态混合物中分子间没有相互作用力。() 12 一定温度下,微溶气体在水中的溶解度与其平衡气相分压成正比。() 13 化学势是一广度量。() 14 只有广度性质才有偏摩尔量。() 15 稀溶液的沸点总是高于纯溶剂的沸点。() 16 单组分系统的熔点随压力的变化可用克劳休斯-克拉佩龙方程解释。() 17.公式d G = -S d T + V d p只适用于可逆过程。() 18.某一体系达平衡时,熵最大,自由能最小。() 19.封闭体系中,由状态1经定温、定压过程变化到状态2,非体积功W/<0,且有W/>?G和?G<0,则此变化过程一定能发生。() 20.根据热力学第二定律,能得出,从而得到。() 21.只有可逆过程的?G才可以直接计算。() 22.凡是自由能降低的过程一定都是自发过程。() 23.只做体积功的封闭体系,的值一定大于零。() 24.偏摩尔量就是化学势。() 25.在一个多组分溶液中,只有溶质才有偏摩尔量。() 26.两组分混合成溶液时,没有热效应产生,此时形成的溶液为理想溶液。() 27.拉乌尔定律和亨利定律既适合于理想溶液,也适合于稀溶液。() 28.偏摩尔量因为与浓度有关,因此它不是一个强度性质。() 29.化学势判据就是Gibbs自由能判据。() 30.自由能G是一状态函数,从始态I到终态II,不管经历何途径,?G总是一定的。()31.定温、定压及W/=0时,化学反应达平衡,反应物的化学势之和等于产物的化学势之和。()
第三章多组分系统热力学 一、选择题 1. 1 mol A与n mol B组成的溶液,体积为0.65dm3,当x B= 0.8时,A的偏摩尔体积V A= 0.090dm3·mol-1,那么B的偏摩尔V B 为: (A) 0.140 dm3·mol-1;(B) 0.072 dm3·mol-1; (C) 0.028 dm3·mol-1;(D) 0.010 dm3·mol-1。 2. 对于亨利定律,下列表述中不正确的是: (A) 仅适用于溶质在气相和溶液相分子状态相同的非电解质稀溶液; (B) 其表达式中的浓度可用x B,c B,m B ; (C) 其表达式中的压力p是指溶液面上的混合气体总压; (D) 对于非理想溶液*B p k x=。 k x≠,只有理想溶液有*B p 3、在293K时,从一组成为NH3·19/2 H2O的大量溶液中取出1molNH3往另一组成为NH3·21H2O 的溶液中转移,此过程的Δμ的表达式为:( ) A.Δμ=RTln(2/19) B.Δμ=RTln(1/22) C.Δμ=RTln(21/44) D.Δμ=RTln(44/21) 4. 对于偏摩尔量,指出下列说法错误者( ) (1)偏摩尔量必须有恒温恒压条件; (2)偏摩尔量不随各组分浓度的变化而变化; (3)偏摩尔量不随温度T和压力p的变化而变化; (4)偏摩尔量不但随温度T、压力p的变化而变化,而且也随各组分浓度变化而变化。 (A) (2) (4) (B) (3) (4) (C) (2) (3) (D) (1) (4) 5. 下列气体溶于水溶剂中,哪个气体不能用亨利定律: (A) N2;(B) O2;(C) NO2;(D) CO 。 6. 298.2K,1×105Pa,有两瓶四氯化碳溶液,第一瓶为1dm3(含有0.2mol的碘),第二瓶为2dm3(含 0.4mol的碘),若以μ1和μ2分别表示两瓶中碘的化学势,则( ) (A) μ12=μ2(B) 10μ1=μ2(C) μ1=μ2(D) 2μ1=μ2 7. 在恒温密封容器中有A、B两杯稀盐水溶液,盐的浓度分别为c A和c B(c A> c B),放置足够长的时间后: (A) A杯盐的浓度降低,B杯盐的浓度增加; (B) A杯液体量减少,B杯液体量增加; (C) A杯盐的浓度增加,B杯盐的浓度降低; (D) A、B两杯中盐的浓度会同时增大。 8. 化学势不具有的基本性质是( )
二、概念题 题号 1 2 3 4 5 6 7 8 选项 C A B C B D B B 题号 9 10 11 12 13 14 15 选项 B D C A A C D 1. 2 mol A 物质和3 mol B 物质在等温、等压下,混合形成理想液态混合物,该系统中A 和B 的偏摩尔体积分别为1.79×10-5 m 3?mol -1, 2.15×10-5 m 3?mol -1 ,则混合物的总体积为( )。 (A )9.67×10-5 m 3 (B )9.85×10-5 m 3 (C )1.003×10-4 m 3 (D )8.95×10-5 m 3 答:(C )运用偏摩尔量的集合公式(B B A A V n V n V +=)。 2. 下列偏微分中,能称为偏摩尔量的是( )。 (A )()C B C B T p n V n ≠????????,, (B )() C B C B S p n H n ≠????? ???,, (C )() C B C B p V n G n ≠?? ?? ????,, (D )() C B C B T H n S n ≠?? ?? ????,, 答:(A )偏摩尔量定义。 () C B C B T p n X X n ≠?? ?=?? ???,, 3. 下列偏微分中,不是化学势的是( )。 (A )C ,,(C B)B ( )S V n U n ≠?? (B )() C B C B T p n H n ≠????????,, (C )C ,,(C B)B ( )T p n G n ≠?? (D )C ,,(C B)B (T V n A n ≠?? 答:(B )广义的化学式: C C C C B ,,(C B),,(C B),,(C B),,(C B)B B B B ( )()()()S V n S p n T V n T p n U H A G n n n n μ≠≠≠≠????====????4. 已知373 K 时,液体A 的饱和蒸气压为133.24 kPa ,液体B 的饱和蒸气压为66.62 kPa 。设A 和B 形成理想液态混合物,当A 在溶液中的摩尔分数为0.5时,在气相中A 的摩尔分数为( )。 (A )1 (B ) 12 (C )23 (D )1 3 答:(C )用Roult 定律算出总蒸气压,再把A 的蒸气压除以总蒸气压。 ()()9399501626650241331A B A A B B A A .....x p x p x p x p p =?×+×=?+=+=? ???kPa
第四章多组分系统热力学及其在溶液中的应用 一、选择题 1.恒温时,在A-B双液系中,若增加A组分使其分压p A上升,则B 组分在气相中的分压p B将()。 (a)上升(b)下降(c)不变(d)不确定 2.已知373K时液体A的饱和蒸气压为105Pa,液体B的饱和蒸气压为105Pa。设A和B构成理想溶液,则当A在溶液中的摩尔分数为时,在气相中A的摩尔分数为()。 (a)1 (b)1/2 (c)2/3 (d)1/3 3.,101325Pa下,1dm3水中能溶解49mol氧或氮,在标准情况下,1dm3水中能溶解的空气的量为()。 (a) (b) (c)96mol (d) 4.一封闭钟罩中放一杯纯水A和一杯糖水B,静置足够长时间后发现()。 (a)A杯水减少,B杯水满后不再变化 — (b)A杯水减少至空杯,B杯水满后溢出 (c) B杯水减少,A杯水满后不再变化 (d) B杯水减少至空杯,A杯水满后溢出 5.保持压力不变,在稀溶液中溶剂的化学势随温度降低而()。 (a)降低(b)不变(c)增大(d)不确定 6.温度为273K,压力为1106Pa下液态水和固态水的化学势(l)和(s)之间的关系为()。
(a)(l)>(s)(b)(l)=(s) (c)(l)<(s)(d)无确定关系 7.在等温、等压下,溶剂A和溶质B形成一定浓度的稀溶液,采用不同浓度表示的话,则()。 (a)溶液中A和B的活度不变 < (b)溶液中A和B的标准化学势不变 (c)溶液中A和B的活度因子不变 (d)溶液中A和B的化学势值不变 8.有一稀溶液质量摩尔浓度为m,沸点升高值为T b,凝固点降低值为T f,则()。 (a)T f >T b(b)T f =T b (c)T f 多组分系统热力学小结 一、重要概念 混合物(各组分标准态相同)与溶液(分溶剂与溶质,标准态不同), 组成表示:物质B的摩尔分数x B、质量分数w B、(物质的量)浓度c B、质量摩尔浓度b B, 理想稀溶液,理想液态混合物,偏摩尔量,化学势,稀溶液的依数性,逸度与逸度系数,活度与活度系数 二、重要定理与公式 1.稀溶液的性质 (1)拉乌尔定律:稀溶液的溶剂:p A=p A*x A (2)亨利定律:稀溶液的溶质:p B=k x、B x B , p B=k B、C C B , p B=k b、B b B (3)Nernst分配定律: (4)依数性:溶剂蒸气压降低:?p A=p A*x B 凝固点降低: ?T f=K f b B 沸点升高: ?T b=K b b B 渗透压: ∏B=c B RT 2.理想混合物 定义:任一组分在全部组成范围内符合拉乌尔定律的液态混合物。 性质:d p=0, d T=0 混合 (1) ?mix V=0 (2) ?mix H=0(3) ?mix S=-nR∑x B ln x B (4) ?mix G=?mix H-T?mix S=nRT∑x B ln x B 3.偏摩尔量 定 义:X B=(X/ n B)T,p,nc≠nB 性质:恒温恒压下: 4.化学势 (1)定义: B=G B=(G/ n B)T,p,nc'≠n B 自发:朝化学势小的方向 (3)化学势的表达式 理想气体:μB=μB*(T,p,y c)=μB(T)+RT ln(py B/p) 实际气体:μB=μB*(T,p,y c)=μB(T)+RT ln(p B/p) 逸度 :有效压力逸度系数:?B= /p B= /py B 理想液态混合物:μB=μB*+RT ln(x B) 真实液态混合物:μB=μB*+RT ln(αB) 活度α=f B x B 在常压下,压力影响可忽略不计,故 μB=μBθ+RT ln(αB) 若气相为理想气体,则活度的计算式: αB=p B/p B* f B=αB/x B=p B/p B*x B 稀溶液:溶剂或溶质:μA=μA+RT ln(x A) 真实溶液 溶剂: μA=μA+RT ln(αA) 溶质:采用质量摩尔浓度时:μB=μB,b+RT ln(αb,B) 采用浓度时μB=μc,B+RT ln(αc,B) 多组分体系热力学 1、不挥发的溶质溶于溶剂中形成溶液之后将会引起 蒸汽压降低 。 2、“在1θp 下,有0.002mol 的气体溶解在1000g 水中,当在相同温度下压力增大为2θp 时,就有0.004mol 该气体溶于1000g 水中”描述这一实验规律的定律是 亨利(Henry )定律 。 4、稀溶液的凝固点降低公式f m ?中,m 所代表的是稀溶液中f T K Δ= 溶质的质量摩尔浓度 。 6、25℃时,0.01m 糖水的渗透压为π1,0.01m 食盐水的渗透压为π2,则 π1<π2 。 7、若要使CO 2在水中的溶解度为最大,应选择的条件是 低温高压 。 8、理想溶液的通性是: 000V H S G Δ=Δ=Δ>Δ<混合混合混合混合0 。 9、在讨论稀溶液的蒸汽压降低规律时,溶质必须是 非挥发性物质 。 11、25℃时A 和B 两种气体在某一溶剂中溶解的亨利系数分别为k A 和k B ,且知 k A >k B ,则当A 和B 压力相同时在该溶剂中所溶解的量是 A 的量 第四章 多组分系统热力学及其在溶液中的作用 一、选择题 1、对于偏摩尔量,指出下列说法错误者( ) (1)偏摩尔量必须有恒温恒压条件; (2)偏摩尔量不随各组分浓度的变化而变化; (3)偏摩尔量不随温度T 和压力p 的变化而变化; (4)偏摩尔量不但随温度T 、压力p 的变化而变化,而且也随各组分浓度变化而变化。 (A) (2) (4) (B) (3) (4) (C) (2) (3) (D) (1) (4) 2、1 mol A 与n mol B 组成的溶液,体积为0.65dm 3,当x B = 0.8时,A 的偏摩尔体积 V A = 0.090dm 3·mol -1,那么B 的偏摩尔V B 为:( ) (A) 0.140 dm 3·mol -1 (B) 0.072 dm 3·mol -1 (C) 0.028 dm 3·mol -1 (D) 0.010 dm 3·mol -1 3、在恒温恒压下形成理想液体混合物的混合吉布斯自由能Δmix G ≠ 0,恒温下Δmix G 对温度T 进行微商,则: ( ) (A) (?Δmix G/?T)T < 0 (B) (?Δmix G/?T)T > 0 (C) (?Δmix G/?T)T = 0 (D) (?Δmix G/?T)T ≠ 0 4、在恒定温度与压力p 下,理想气体A 与B 混合后,说法中正确的是( ) (1)A 气体的标准态化学势不变; (2)B 气体的化学势不变 ; (3)当A 气体的分压为p A 时,其化学势的改变量为ΔμA =RTln(p A /p ?); (4)当B 气体的分压为p B 时,其化学势的改变量为ΔμB =-RTln(p B /p*)。 (A) (B) (1) (2) (B) (1) (3) (C) (2) (4) (D) (3) (4) 5、下列各式中哪个是化学势( ) (A) ()j n ,V ,T i n U/?? (B)()j n ,V ,T i n H/?? (C) ()j n ,V ,T i n A/?? (D) ()j n ,V ,T i n G/?? 6、在293K 时,从一组成为NH 3·19/2 H 2O 的大量溶液中取出1molNH 3往另一组成为 NH 3·21H 2O 的溶液中转移,此过程的Δμ的表达式为: ( ) (A)Δμ=RTln(2/19) (B)Δμ=RTln(1/22) (C)Δμ=RTln(21/44) (D)Δμ=RTln(44/21) 多组分系统热力学习题参考答案 三、习题的主要类型 1.计算溶液中由于某组分物质的量改变引起偏摩尔体积的变化以及溶液混合过程中体积的变化。(例3-2, 例3-4) 2.计算从大量或少量等物质量的A 和B 之理想混合物中分离出1mol 纯A 过程的吉布斯自由能。(例3-6) 3.由液体和固体的饱和蒸气压与温度的关系式,计算不可逆相变过程的热力学函数。(例4-14题) 4.用拉乌尔定律和亨利定律计算溶液的气、液组成以及亨利系数 (1) 根据气液平衡计算蒸气分压力。(例3-7) (2) 根据气液平衡计算亨利系数。(例3-8) (3) 根据稀溶液气液平衡计算溶质的溶解度。(例3-9) (4) 计算蒸发过程中,最后一滴液体的组成。(例3-10) (5) 根据克-克方程和拉乌尔定律,计算气、液组成。(例3-11题) 5.逸度及活度的应用与计算 (1) 气体的逸度和逸度系数的概念和计算。(例3-5) (2) 由非理想液态混合物应用拉乌尔定律时,其浓度应以活度表示的方法计算活度。(例 3-15题) 6.稀溶液依数性的计算。(例3-12、例3-13题) 7.证明题 (1) 证明物质的摩尔分数、物质的质量摩尔浓度和量浓度三种浓度表示法之间的联系。 (例3-1) (2)证明偏摩尔体积与物质浓度之间的关系。(例3-3题) 四、精选题及其解 例3-1 若以x 代表物质的摩尔分数,m 代表质量摩尔浓度,c 代表物质的量浓度。 (1)证明这三种浓度表示法有如下关系 B B A B B A B B B A 1.0A c M m M x c M c M m M ρ= = -++ 式中,ρ为溶液的密度,单位为kg·m -3,A M 、B M 分别为溶剂和溶质的摩尔质量。 (2)证明当浓度很稀时有如下关系 B A B B A A c M x m M ρ= = 式中,A ρ为纯溶剂的密度。 多组分体系热力学试题 (一)填空题(每小题2.0分) 1.3-1-1-1溶液是 。 2.3-1-1-2拉鸟尔定律表示为: 或 。 3.3-1-1-2享利定律表示为:P B = = = 。 4.3-1-1-3 在理想混合物中 。 5.3-1-1-3 理想混合物的三个特点是 。 6.3-1-1-4理想稀溶液是 。 7.3-1-1-4某理想稀溶液溶质的标准态选择不同,化学势μB ,标准态化学势μθB 。 8.3-1-1-5蒸气压的降低的条件是: 。 9.3-1-1-5沸点的升高的条件是: 。 10.3-1-1-2 25℃时,纯水的饱和蒸汽压p *(水) =3168Pa ,若一甘油水溶液中甘油的摩尔分数为0.020,则溶液上方的水的蒸气压力为 (二)单项选择题(每小题1.0分) 11.3-4-2-5在一定压力下,纯物质A 的沸点,蒸气压和化学势分别为T b *,p A *和μA *,加入少量不挥发 的溶质形成溶液之后分别变成T b ,p A 和μA ,因此有: (A) T b *< T b ,p A *< p A , μA *< μA ;(B) T b *> T b ,p A *> p A , μA *> μA ; (C) T b *> T b ,p A *< p A , μA *> μA ;(D) T b *< T b ,p A *> p A , μA *> μA 。 12.3-4-2-5已知环己烷、醋酸、萘、樟脑的(摩尔)凝固点降低系数k f 分别是20.2,9.3,6.9及39.7 K ·kg ·mol -1。今有一未知物能在上述四种溶剂中溶解,欲测定该未知物的相对分子质量,最适宜的溶剂是: (A) 萘; (B) 樟脑; (C) 环己烷; (C) 醋酸 。 13.3-4-2-3 40℃时,纯液体A 的饱和蒸气压是纯液体B 的饱和蒸气压的21倍,且组分A 和B 能形成理想液态混合物,若平衡气相中组分A 和B 的摩尔分数相等,则平衡液相中组分A 和B 的摩尔分数之比x A :x B 应为: (A) 1:21; (B) 21:1; (C) 22:21; (D) 1:22。 14.3-4-2-5 (B)有四杯含有不同溶质相同浓度m = 0.1mol.Kg -1的水溶液,分别测定其沸点,沸点升得最高的是: (A) Al 2(SO 4)3 ; (B) MgSO 4; (C) K 2SO 4 ; (D) C 6H 5SO 3H 。 15.3-4-2-2. 25℃时,CH 4(g)在H 2O(l)和C 6H 6(l)中的亨利常数分别为4.18×109 Pa 和57×106 Pa ,则在相同的平衡气相分压p (CH 4)下,CH 4在水中与在苯中的平衡组成: (A). x (CH 4,水)>x (CH 4,苯); (B). x (CH 4,水)<x (CH 4,苯); (C). x (CH 4,水)=x (CH 4,苯); (D). 不能确定。 16.3-4-2-2 指出关于亨利定律的下列几点说明中,错误的是: (A) 溶质在气相和在溶剂中的分子状态必须相同; (B) 溶质必须是非挥发性溶质; (C) 温度愈高或压力愈低,溶液愈稀,亨利定律愈准确; (D) 对于混合气体,在总压力不太大时,亨利定律能分别适用于每一种气体,与其他气体的分压力无关。 17.3-4-2-3 形成理想液态混合物过程的混合性质是: (A) mix ?V=0 ,m ix ?H =0 mix ?S >0 , mix ?G <0 ; (B) mix ?V >0 ,mix ?H <0, mix ?S =0 , mix ?G =0 ; 第三章多组分系统热力学 ;选择题 1.在373.15K和101325Pa?下水的化学势与水蒸气化学位的关系为 (A) μ(水)=μ(汽) (B) μ(水)<μ(汽) (C) μ(水)>μ(汽) (D) 无法确定答案:A。两相平衡,化学势相等。 2.下列哪种现象不属于稀溶液的依数性 (A) 凝固点降低(B)沸点升高 (C) 渗透压(D)蒸气压升高答案:D。稀溶液的依数性之一为蒸气压下降。 3.98K时,A、B两种气体在水中的亨利常数分别为 k1和 k2,且k1> k2,则当P1=P2时,A、B在水中的溶解量C1 和 C2 的关系为 (A) C1>C2 (B) C1<C2 (C) C1=C2 (D) 不能确定答案:B 4.将非挥发性溶质溶于溶剂中形成稀溶液时,将引起 (A)沸点升高 (B)熔点升高(C)蒸气压升高(D)都不对答案:A。稀溶液的依数性包括沸点升 高、凝固点下降、蒸气压下降和渗透压。 5.涉及纯物质标准状态的下列说法中不正确的是 (A)纯理想气体的标准状态就是标准压力P(100KPa)下的状态 (B)纯液体物质的标准状态就是标准压力P(100KPa)下的纯液体 (C)纯固体物质的标准状态就是标准压力P(100KPa)下的纯固体 (D)不同的物质在相同温度下都处于标准状态时,它们的同一热力学函数值都应相同答案:D 6.稀溶液的依数性包括蒸汽压下降、沸点升高、凝固点降低和渗透压,下面的陈述都与它们有关,其中正确的是 (A) 只有溶质不挥发的稀溶液才有这些依数性 (B) 所有依数性都与溶液中溶质的浓度成正比 (C) 所有依数性都与溶剂的性质无关 (D) 所有依数性都与溶质的性质有关答案:B 7.关于亨利系数, 下面的说法中正确的是 (A) 其值与温度、浓度和压力有关 (B) 其值只与温度、溶质性质和浓度标度有关(C) 其值与溶剂性质、温度和浓度大小有关 (D) 其值与温度、溶剂和溶质的性质及浓度标度等因素都有关答案:D 8.定义偏摩尔量时规定的条件是 (A) 等温等压 (B) 等熵等压 (C) 等温, 溶液浓度不变 (D) 等温等压, 溶液浓度不变答案:D 9.关于偏摩尔量, 下面的说法中正确的是 (A) 偏摩尔量的绝对值都可求算 (B) 系统的容量性质才有偏摩尔量 (C) 同一系统的各个偏摩尔量之间彼此无关 (D) 没有热力学过程就没有偏摩尔量答案:B 10.关于偏摩尔量, 下面的叙述中不正确的是 (A) 偏摩尔量是状态函数, 其值与物质的数量无关 (B) 系统的强度性质无偏摩尔量(C) 纯物质的偏摩尔量等于它的摩尔量 (D) 偏摩尔量的数值只能为整数或零答案:D 11.影响沸点升高常数和凝固点降低常数值的主要因素是 多组分溶液热力学 简单体系 : 纯物质单相封闭体系 ; 纯物质多相平衡封闭系统 ; 组成不变的单相封闭系统 体系的 气相多组分体系:理想气体多组分体系;实际气体多组分体系 分 类 单相多组 液态混合物:理想液态混合物 ;实际液态混合 多组分 液相多组分体系 分体系 溶液:理想稀溶液;实际溶液 体 系 固相多组分体系 多相多组分体系 偏摩尔量 化学势 为什么要引进偏摩尔量 偏摩尔量的定义和物理意义: X B ( X / n B )T , p,n C 偏摩尔量的集合公式: X n B X B 各组分偏摩尔量的变化相互依赖关系: G-D 方程 n B dX B 0 偏摩尔量之间的函数关系 偏摩尔量的测定和计算 化学势的定义 ( B G B ( G / n B ) T , p, n C ( H / n B ) S , p ,n C ( U / n B )S ,V ,n C )及物理意义 化学势定义与偏摩尔量定义的差异 多组分体系热力学基本方程及其应用条件 0 (自发 ) 化学势判据 判据 B ( )dn B ( ) 0 (恒温、恒压 (或容 )、 W 0 ) B (平衡 ) 及其应用 应用:相平衡 B ( ) B ( ) B ( ) ;化学平衡 B B 0;分配定律 理想气体: B B RT ln( p B / p ) 气体 实际气体: B B RT ln( f B / p ) 逸度和逸度因子的定义及计算 化学势: B (l ) B( l ) RT ln x B 理想液态混合物 mix H , mix V , 多 热力学特征 mix S R n B ln x B 组 液态混合物 B 分 mix G RT n B ln x B 体 B 化学势: B (l ) B( l ) RT ln a B 系 热 化学势的 实际液态混合物 力 活度和活度因子定义及其物理意义 a B p B / p B 学 表达式 理想稀 溶剂: A (l ) A( l ) RT ln x A 或 A (l ) A( l ) RTM A b B B,b (l ) RT ln(b B / b ) B 溶液 溶质 B, b B, c (l ) B, c RT ln(c B / c ) 溶液 B, x (l ) RT ln x B B, x 实际溶液 溶剂: A (l )A( l ) RT M A b B B 纯固体: (s) 溶质 B (l ) B( l ) RT ln a B a B B, b b B / b B ,c c B / c 标准态 气体:任何气体,其标准态均为 T ,p 条件下具有理想气体行为的纯气体 的定义 液态混合物:液态混合物中任一组分的标准态为 T ,p 条件下的纯物质 液体 T , p 条件下的纯物质 溶液 溶剂:稀溶液中溶剂的标准态为 溶质:视溶质浓度的表示方法不同而异,请参见“主要考点”部分 Raoult 定律 Raoult 定律: p A p A x A (或 p p A x B )适用于理想 液态混合物中任一组分 和稀溶液的溶剂 和 Herry 定律 Herry 定律: p B k x ,B x (或 p B k b ,B b B , p k c ) 适用于稀溶液 B B c,B B 依数性的定义产生依数性的根本原 因参见“概述” 依数性的计算公式 沸点升高:△ T b =K b b B ( K b R(T b )2 M A / vap H m,A ) 稀溶液的 冰点降低:△ T f =K f b B ( K f R(T f )2 M A / fus H m,A ) 依数性 渗透压: c B RT 利用依数性计算非理想溶 ln a A fus H m / R(1/ T f 1/ T f ) ln a A vap H m / R(1/T b 1/ T b ) (仅适用于不挥发性溶质 ) 液中溶剂活度的计算公式 ln a A V m,A / RT 第三章 多组分系统热力学 § 引言 基本概念 1、多组分系统 两种或两种以上的物质(或称为组分)所形成的系统称为多组分系统。 多组分系统可以是均相的,也可以是多相的。它(如:多组分单相系统)的热力学性质,则不仅由系统的温度、压力所决定,还与系统的相的组成有关。 2、混合物(mixture ) 多组分均匀系统中,各组分均可选用相同的方法处理,有相同的标准态,遵守相同的经验定律,这种系统称为混合物。 混合物有气相、液相和固相之分。 3、溶液(solution ) 含有一种以上组分的液体相或固体相称之为溶液。溶液有液态溶液和固态溶液之分,但没有气态溶液。 4、溶剂(solvent )和溶质(solute ) 如果组成溶液的物质有不同的状态,通常将液态物质称为溶剂,气态或固态物质称为溶质。 如果都具有相同状态,则把含量多的一种称为溶剂,含量少的称为溶质。 溶剂和溶质要用不同方法处理,他们的标准态、化学势的表示式不同,服从不同的经验定律。 溶质有电解质和非电解质之分,本章主要讨论非电介质所形成的溶液。 如果在溶液中含溶质很少,这种溶液称为稀溶液,常用符号“∞”表示。 多种气体混合在一起,因混合非常均匀,称为气态混合物,而不作为气态溶液处理。 多组分系统的组成表示法 1、B 的质量浓度 B def (B) m V ρ 即用B 的质量m B 除以混合物的体积V 。B ρ的单位是: kg ·m —3。 2、B 的质量分数 B A A def (B) m w m ∑ 即B 的质量m B 与混合物的质量之比。w B 的单位为1。 3、B 的浓度 B B def n c V 即B 的物质的量与混合物体积V 的比值。c B 常用单位是mol ·L —1。 4、B 的摩尔分数 第四章 多组分系统热力学及其在溶液中的应用 1.在298K 时,有质量分数为的硫酸H 2SO 4水溶液,试分别用(1)质量摩尔浓度B m ;(2)物质的量浓度和B c (3)摩尔分数B x 来表示硫酸的含量。已知在该条件下,硫酸溶液的密度为331.060310kg m -?? ,纯水的浓度为3997.1kg m -? 。 解:质量摩尔浓度: ()241 0.19.47% /1009.47%0.1 981.067mol H SO B n m W kg -?= = -?=?水 物质量浓度: ()2433 1009.47%0.1 0.19.47%/ 98997.1 1.02310mol H SO B n c V m --??= = =?水 摩尔分数:24 2420.0189H SO B H SO H O n x n n ==+ 2、在K 298和大气压力下,含甲醇()B 的摩尔分数B x 为0.458的水溶液密度为 30.8946kg dm -?,甲醇的偏摩尔体积313()39.80V CH OH cm mol -=?,试求该水溶液中水的 摩尔体积2()V H O 。 解:3322CH OH CH OH H O H O V n V n V =+ 3322CH OH CH OH H O H O V n V V n -= 以1mol 甲醇水溶液为基准,则 3 3 0.45832(10.458)180.027290.894610 m V dm ρ ?+-?= = =? ∴23310.027290.45839.801016.7210.458 H O V cm mol ---??==?- 3.在298K 和大气压下,某酒窖中存在酒,其中含乙醇的质量分数为。今欲加水调制含乙醇的质量分数为的酒,试计算 (1)应加入水的体积; 物化习题 第四章多组分系统热力学 一判断题 1、在101.3Kpa下,往纯水中加入少量NaCl,与纯水比较,此稀溶液沸点升高。() 2、偏摩尔量集合公式Z=∑nBzB,m适用条件是恒温过程。() 恒温恒压过程 3、Henry系数Kx,B只与溶剂溶质性质有关,而与温度无关。() 温度不同,亨利系数不同。温度升高,系数升高。 4、沸点升高系数Kb的数值与溶剂、溶质的性质有关,且与温度有关。() Kb的量仅与溶剂的性质有关 5.、若A分子和B分子之间的相互作用力,与A,B各自处于纯态时分子之间的相处作用力相同,混合后,则有⊿Hmin=0.( ) 6、标准就态是认为规定的某些特定状态。() 7、理想溶液中,各种微粒间的相互作用力可忽略不计。() 处于凝聚态的分子,其分子间的距离很小,分子间的相互作用力和分子的体积均不能忽略。 8、一切纯物质的凝固点都随外压的增大而上升。() 9、稀溶液的非典一定比纯溶剂的沸点高。() 在同一外压条件下 10、在相同温度和压力下,相同质量摩尔浓度的葡萄糖和食盐水的渗透压不相同。() Ⅱ=CbRT,溶液的渗透压的大小只由溶液中的溶质的浓度决定,而与溶质的本性无关。 11、摩尔分数和质量摩尔浓度与温度无关,而物质的量浓度与温度有关() 12、在相平衡中,若各相中均有组分B,则组分B在个相中的化学势一定相等。() 系统处于相平衡,由于系统任一组分B在其存在的每个相中的化学势相等。 13、溶剂中融入挥发性溶质,肯定会引起溶液的蒸汽压升高。() 14、二组分理想液态混合物的总蒸汽压大于任一组分的蒸汽压。() 处于中间态。 15、只有广度性质才有偏摩尔量。( ) 16、凡是自由能降低的过程一定都是自发过程。() 17、拉乌尔定律和亨利定律既适合于理想溶液,也适合于稀溶液。() 18、偏摩尔量因为与浓度有关,因此它不是一个强度性质。() 19、某一体系达平衡时,熵最大,自由能最小。() 20、在一个多组分溶液中,只有溶质才有偏摩尔量。() 21、封闭系统中,由状态1经定温、定压过程变化到状态2,非体积功W′>△G和△G﹤0,则此过程一定能发生。() 22、两组分混合成溶液时,没有热效应产生,此时形成的溶液为理想溶液。()多组分系统热力学小结
4多组分体系热力学
第四章 多组分系统热力学及其在溶液中的作用
多组分系统热力学习总结题参考答案点评
多组分体系热力学及溶液
第三章 多组分系统热力学
多组分溶液热力学复习题.doc
多组分系统热力学
第四章 多组分系统热力学及其在溶液中的应用
第四章多组分系统热力学2