
作者简介:陈国怀,医学生物学工程师,主要从事诊断试剂生产和检定工作。
通讯作者:席仲兴,E-mail:xiyue8342181@sina.com ·论著·
甲型副伤寒沙门菌培养条件的优化
陈国怀,曹玲,罗广,刘晓,刘大东,金红燕,陈刚,席仲兴
兰州生物制品研究所有限责任公司甘肃省疫苗工程技术研究中心,甘肃兰州730046
摘要:优化甲型副伤寒沙门菌的培养条件,提高菌体产量。方法通过单因素及正交试验,对影响甲型副伤寒沙门菌生长的培养温度、NaCl浓度和pH等条件进行优化。结果甲型副伤寒沙门菌在NaCl浓度0.75%、温度35?、pH6.5时菌体产量最高。结论通过对甲型副伤寒沙门菌培养条件进行优化,获得较高的菌体产量,为后期诊断试剂盒的开发奠定了基础。
关键词:甲型副伤寒沙门菌;优化培养
中图分类号:R378.2+4文献标志码:A DOI:10.13309/j.cnki.pmi.2014.04.006
Optimization on growth condition of Salmonella paratyphoid A CHEN Guo-huai,CAO Lin,LUO Guong,LIU Xiao,LIU DA-dong,JIN Hong-yan,XI Zhong-xing Lanzhou Institute of Biological Products Co.Ltd.,Center for Gansu Provincial Vaccine EngineeringRresearch,
Lanzhou730046,Gansu Provionce China
Corresponding author:XI Zhong-xing,E-mail:xiyue8342181@sina.com
Abstract:Objective To optimize the growth condition of Salmonella paratyphoid A.Methods To study the effect for temperature,pH and NaCl concentration on the growth of Salmonella paratyphoid A by using the method of orthogonal d esign.Results The optimal culture condition of Salmonella paratyphoid A is NaCl concentration0.75%,temperature3 5?and pH6.5.Conclusion The optimal culture condition of Salmonella paratyphoid A is successfully achieved in this investigation.
Key words:Salmonella paratyphoid A;Optimization for cultivation
肠热症是由伤寒沙门菌(Typhoidal salmonello-sis)和副伤寒沙门菌(Salmonella paratyphi)引起的严重肠道传染病。
在近年流行病调查结果显示,甲型副伤寒沙门菌引起的疾病所占比例逐渐升高,中国每年均有不同程度的甲型副伤寒流行及暴发[1],需要及时采用相应的诊断试剂盒进行诊断,而诊断菌液的生产需要大规模培养菌体,副伤寒沙门菌各型要求的培养条件各不相同,在同等培养条件下,甲型副伤寒沙门菌与培养基的投入产出比值偏低。
实验中试图对甲型副伤寒沙门菌培养条件进行优化,以达到提高其菌体的产量,降低试剂盒制备的生产成本,这将对甲型副伤寒沙门菌的诊断和预防具有重要的现实意义。1材料与方法
1.1材料
1.1.1菌种甲型副伤寒沙门菌菌株号为CM-CC50001,来源于中国食品药品检定研究院,由兰州生物制品研究所有限责任公司保管。
1.1.2仪器OLYMPUS CX22LED生物显微镜,购自日本OLYMPUS公司;PHSJ-5型精密pH计,上海雷磁精密仪器有限公司产品;AL104-IC电子天平,梅特勒-托利多(上海)有限公司。电热恒温培养箱,上海一恒科学仪器有限公司产品;VS-1300L-U洁净化工作台,购自苏州安泰空气技术有限公司;LKB—UltrospecⅢ型分光光度计为LKB Biochrom England 产品。
1.1.3试剂与培养基培养基由兰州生物制品研究所有限责任公司培养基室提供。盐酸、氯化钠和氢氧化钠,分析纯,均购自国药集团化学试剂有限公司。
1.2方法
1.2.1菌悬液的制备将菌种开启于牛肉水中活化,经诊断用品常规培养基37?培养18h,取典型菌落经革兰染色镜检、生化检定与血清学试验等系列检定合格后,作为供试菌,转种于诊断用品常规培养基,收集新鲜菌苔置于生理盐水中,用中国细菌浊度标准比浊管(批号为2013-1)制成浓度为1?109 cfu/mL作为试验用菌悬液。
1.2.2单因素培养条件的筛选将常规诊断用品培养基进行适当的处理后分装成若干等份,分别于31?、33?、35?、37?、39?、41?和43?用作培养试验。同时分别配制成含不同NaCl浓度(0、0.1%、0.2%、0.3%、0.4%、0.5%,0.75%,1.0%,1.5%,2.0%,2.5%,3.0%,3.5%)的培养基;另外将培养基用1mol/L的氢氧化钠或1mol/L盐酸调制成8个不同酸碱度(20?测定),其分别为pH4.0、pH5.0、pH6.0、pH6.5、pH7.0、pH7.5、pH8.0和pH9.0。所有培养基经过无菌分装及0.07MPa高压灭菌30min后备用;以0.5mL的试验菌悬液分别接种到上述各培养基中培养22h,重复取样3份置于比色皿中,以空白培养基作对照调零,用分光光度计A600读数,取其平均值。在不同的温度、NaCl浓度和pH的条件下,对甲型副伤寒沙门菌培养效果进行分析,以选择适合培养甲型副伤寒沙门菌生长的温度、NaCl浓度和pH值范围。
1.2.3正交试验设计在单因素试验获得适宜其生长的温度、NaCl浓度、pH的范围基础上,以温度、NaCl浓度、pH为因素,选三水平,以测定A
600
的菌浓度为指标;进行正交试验,因素水平设计见表1。
表1三因素三水平正交实验设计
Tab.1The orthogonal design test including3factors
and3levels
实验编号温度(?)pH NaCl(%)1336.00.40
2336.50.50
3337.00.75
4356.00.50
5356.50.75
6357.00.40
7376.00.75
8376.50.40
9377.00.502结果
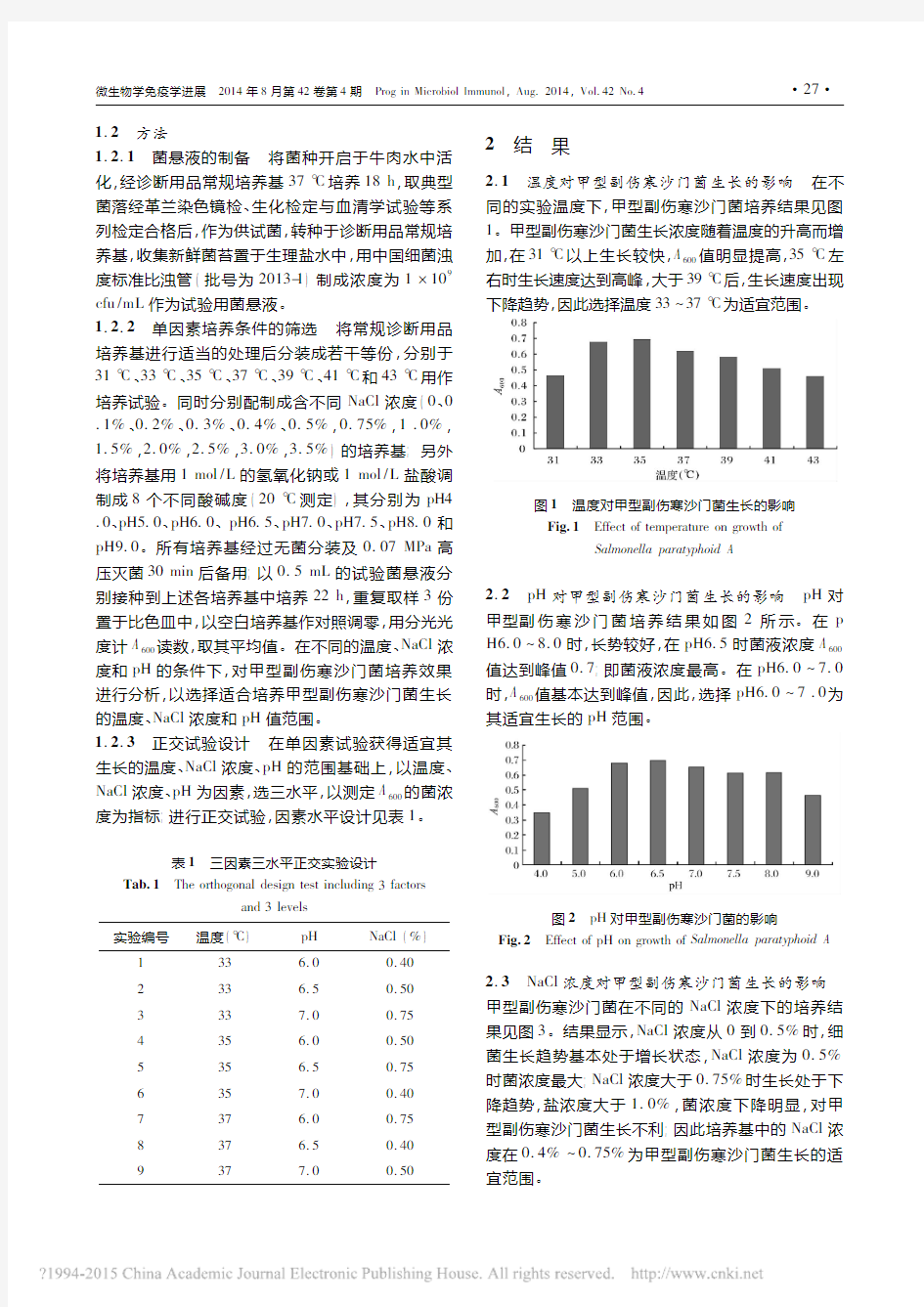
2.1温度对甲型副伤寒沙门菌生长的影响在不同的实验温度下,甲型副伤寒沙门菌培养结果见图1。甲型副伤寒沙门菌生长浓度随着温度的升高而增加,在31?以上生长较快,A600值明显提高,35?左右时生长速度达到高峰,大于39?后,生长速度出现下降趋势,因此选择温度33 37?为适宜范围
。
图1温度对甲型副伤寒沙门菌生长的影响
Fig.1Effect of temperature on growth of
Salmonella paratyphoid A
2.2pH对甲型副伤寒沙门菌生长的影响pH对甲型副伤寒沙门菌培养结果如图2所示。在p H6.0 8.0时,长势较好,在pH6.5时菌液浓度A
600值达到峰值0.7;即菌液浓度最高。在pH6.0 7.0时,A600值基本达到峰值,因此,选择pH6.0 7.0为其适宜生长的pH范围
。
图2pH对甲型副伤寒沙门菌的影响
Fig.2Effect of pH on growth of Salmonella paratyphoid A 2.3NaCl浓度对甲型副伤寒沙门菌生长的影响甲型副伤寒沙门菌在不同的NaCl浓度下的培养结果见图3。结果显示,NaCl浓度从0到0.5%时,细菌生长趋势基本处于增长状态,NaCl浓度为0.5%时菌浓度最大;NaCl浓度大于0.75%时生长处于下降趋势,盐浓度大于1.0%,菌浓度下降明显,对甲型副伤寒沙门菌生长不利;因此培养基中的NaCl浓度在0.4% 0.75%为甲型副伤寒沙门菌生长的适宜范围。
图3NaCl浓度对甲型副伤寒沙门菌生长的影响Fig.3Effect of NaCl on growth of Salmonella paratyphoid A
2.4培养条件的优化综合单因素试验结果,选取培养温度、NaCl浓度和pH为自变量,用三因素三水平的正交分析,优化其培养条件,以菌液A600为比值,结果见表2。结果显示,温度对甲型副伤寒沙门菌的生长影响最大,NaCl浓度次之,pH最小。并且温度35?、pH6.5和NaCl浓度为0.75%时,最利于甲型副伤寒沙门菌的生长。
表2正交试验优化结果
Tab.2The results of orthogonal design on growth
conditions of Salmonella paratyphoid A
实验编号温度(A)pH(B)NaCl(C)A600 1336.00.400.65 2336.50.500.67 3337.00.750.69 4356.00.500.79 5356.50.750.85 6357.00.400.78 7376.00.750.77 8376.50.400.73 9377.00.500.75均值10.670.740.72
均值20.810.750.74
均值30.750.740.77
极差0.140.010.05
最佳培养条件356.50.75
因素主次A>C>B
注:A、B、C分别表示温度、pH和NaCl浓度3种不同因素。
3讨论
当培养基中营养物质浓度适宜时,微生物才能良好生长,营养物质浓度过低时,不能满足微生物正常生长所需;浓度过高,则可能对生长起抑制作用。培养基的pH值必须控制在6.0 7.0的一定范围内,以满足不同类型微生物的生长繁殖[2]。任何微生物都有着其特有的生长特性,细菌在培养过程中,受各种营养成分、pH和温湿度等诸多因素的影响。对生存环境有特定严格的要求。实验中利用正交试验就温度,NaCl浓度和pH对甲型副伤寒沙门菌的生长进行了优化。正交试验是利用数理统计学正交原理进行合理安排的一种方法[3]。利用一套规格化的正交表将各实验因素和各水平之间的组合均匀搭配,合理安排,可大量减少实验次数,并提供较多的信息,已在实际中广泛应用,是安排多因素实验、寻求最优水平组合,并被证明是十分有效的高效率实验设计方法。
单因素优化结果显示,甲型副伤寒沙门菌在温度33 37?、NaCl浓度0.40% 0.75%、pH6.0 7.0均生长较好。在此基础上利用正交试验设计,优化甲型副伤寒沙门菌的最优培养条件为温度3 5?、pH值6.5和NaCl浓度0.75%时,该细菌生长最好;同时,在这3个因素中,培养温度对甲型副伤寒沙门菌菌浓度影响为最大,在生产中应对温度进行严格控制。实验中未涉及到琼脂和其他工艺参数的变更,目前仍需要进行相关试验的验证,以期实现甲型副伤寒沙门菌培养的投入产出最大化。
参考文献
[1]高翔,闫梅英,阚飙.甲型副伤寒沙门菌疫苗靶标蛋白筛选技术及应用[J].疾病监测,2011,26(7):568-574.
[2]沈萍,陈向东.微生物学[M].2版.北京:高等教育出版社,2012:87.
[3]何为,薛卫东,唐斌.优化试验设计方法与数据分析[M].北京:化学工业出版社,2012:1.
收稿日期:2014-02-10修回日期:2014-04-03编辑:王祖森
沙门氏菌快速检测方法 1试剂与仪器 1.1所用器具 三角烧瓶、玻璃珠、具塞试管、培养皿、1000μL枪头、5mL枪头、称量勺、接种环、接种针 1.2仪器:分析天平、恒温培养箱、微型振荡器、超净工作台、高压灭菌锅 1.3所用试剂和培养基 1.3.1缓冲蛋白胨水(BPW)培养基 称取BPW培养基20.1g,加入蒸馏水1L,搅拌加热煮沸至完全溶解,以90mL/瓶分装到各锥形瓶,并于121℃灭菌15min,冷至常温。 1.3.2四硫磺酸钠煌绿(TTB)增菌液 取TTB增菌液基础93.6g,加入蒸馏水1L,搅拌加热煮沸至完全溶解,分装于锥形瓶中,每瓶100mL。 将锥形瓶放入灭菌锅中,121℃灭菌20min;冷至30℃,每100mL基础培养基中加入TTB配套试剂碘液和煌绿各一支(开启前用75%酒精棉消毒西林瓶表面),混合均匀。 2、操作步骤 2.1配制BPW培养基(第一天) 2.2培养基冷却至室温后,对培养基和整个房间进行紫外灭菌15分钟,关灯60min 后使用。(第一天) 2.3预增菌(第一天) 称量样品10g至含BPW培养基的锥形瓶,并及时盖上盖子,150rpm下振荡10min,于36℃±1℃培养18h左右。 2.4配制TTB增菌液(第一天) 2.5增菌(第二天) 2.5.1接种和培养 轻轻摇动培养过的样品混合物,移取1mL,转种于9mLTTB增菌液内,于42℃±1℃培养18h~24h。 2.5.2培养现象 菌名菌号生长状况 TTB培养特征 静置后浑浊CMCC(B)50071 伤寒沙门氏菌良好 静置后浑浊良好鼠伤寒沙门氏菌 CMCC(B)50115 静置后清亮不生长大肠埃希氏菌 ATCC25922
沙门菌属和志贺菌属检验 步骤和方法 1 .形态观察 (1)革兰染色:沙门菌属细菌为革兰阴性细长杆菌。志贺菌属细菌为革兰阴性杆菌,散在分布。 (2)观察鞭毛染色标本片:镜下可见沙门菌属细菌具有周鞭毛。志贺菌属细菌无鞭毛。 2?菌落观察 (1)沙门菌属:将本菌接种在SS MAC平板上经35 'C孵育18?24h。由于本菌不分解乳糖并产碱,故在SS和MAC 平板上形成无色、半透明、光滑湿润、凸起的小菌落,产生H2S的菌落可在SS平板上形成中心带黑褐色的小菌落。 (2)志贺菌属:将本菌接种在SS和MAC平板上经35C孵育18?24h。由于志贺菌不分解乳糖,宋内志贺菌某些菌株可迟缓发酵乳糖,故其在SS平板和MAC平板上形成无色透明的、中等大小的菌落。除宋内志贺菌菌落外均为光滑型菌落。 3.生化反应氧化酶试验:方法同大肠埃希菌。沙门菌属和志贺菌属细菌氧化酶试验均为阴性。初步试验鉴定:挑取志贺菌和沙门菌的单个菌落分别接种在KIA、MIU和硝酸盐培养基上,经35C孵育18?24h,同时做触酶试验。其结果见表2—4。 最终鉴定:须做全面生化反应和血清学试验。 4 .血清学试验 (1)志贺菌属的分型鉴定:凡生化反应符合志贺菌属者均需做血清学鉴定。取1环志贺菌四种多价血清于载玻片 一端,再取少许待测菌与之混合,同时在玻片另一端取待测菌与生理盐水混合对照。结果:对照呈均匀混浊,待检菌 与志贺菌四种多价血清混合后,数分钟内出现肉眼可见的颗粒状凝集物即为阳性。继之用 A B、C D群最常见的单价 血清凝集定种。 结果判断、解释和报告: ①分离培养未见可疑菌落或经鉴定不符合志贺菌属鉴定依据者可报告“未分离到志贺菌属细菌”。 ②经分离鉴定后符合鉴定依据者,可报告“分离岀XX志贺菌”,若进一步做多种生化反应及因子血清分型后,可报告:“分离岀XX志贺菌X型”。 (2)沙门菌属的分型鉴定:如果生化反应及形态学检查疑为沙门菌,可选用沙门菌的多价诊断血清进行玻片凝集。 首先选用A?F组多价“ O诊断血清做玻片凝集试验。在试验时应以生理盐水作对照。血清凝集试验在5?10min内不 岀现凝集者可确定为阴性。但若生化反应比较典型,应考虑选用Vi凝集试验。若凝集,则用无菌生理盐水将菌洗下, 制成浓厚的悬液,加热100 C、30min,再与A?F组多价“ O诊断血清做凝集试验。若与A?F组多价“ O血清发生凝集,应再与沙门菌单价因子血清分别做玻片凝集试验,以确定该菌株属于哪一组。一般先选用本地区检岀率最高菌型的相应血清做玻片凝集反应。 若已确定哪一沙门菌种后,再分别先用H因子血清检查第I相抗原,然后检查第H相抗原,最后确定该菌种属 于哪一型沙门菌。 结果判断、解释和报告: ①分离培养未发现可疑菌落或经鉴定不符合沙门菌属细菌鉴定依据者,可报告“未分离岀沙门菌”。 ②生化反应符合沙门菌、玻片凝集试验结果阳性,可初步报告为:“分离到XX沙门菌”,或“X群沙门菌”。 5 ?肥达试验 (1)原理:用已知的伤寒沙门菌O H抗原,甲、乙型副伤寒沙门菌的H抗原(PA、PB)与肠热症患者血清做定量
沙门氏菌的检验 食品学院14食品质量与安全1班 刘文敏柳基炜卫杰恒温紫君 2 2 2 2 摘要:本实验采用GB/T4789.4-2010的检测方法测定鸡场中的沙门氏菌。通过本实验学习沙门氏菌的检测方法和技术,了解沙门氏菌的一些生化特性;本实验先用显色培养基找出可疑菌落,再做生化试验找出可疑的典型性的沙门氏菌,再通过血清学试验最终确定是否为沙门氏菌属。 关键词:沙门氏菌接种生化试验血清学鉴定 前言 沙门氏菌病是公共卫生学中具有重要意义的人畜共患病种之一,其病原沙门氏菌属于肠道细菌科。沙门氏菌是一个统称,泛指 2000 多种有紧密连系的细菌,包括引起食物中毒,导致胃肠炎、伤寒和副伤寒的细菌。虽然只有少数人因沙门氏菌而患病,但是,在世界范围内的细菌性食物中毒事件中,由沙门氏菌引起的占大多数。因此,采用科学、合理的方法检验食品中沙门氏菌,已经成为了人们最关心的问题之一[1]。国标法(GB4789.4-2010)是目前中国规定的食品中沙门氏菌的标准检测方法,也是基层实验室普遍采用的检测方法,它根据沙门氏菌的生长特点和生化特性,采取前增菌、增菌、分离、生化试验和血清学鉴定5个步骤进行[2]。 1材料与方法 1.1实验材料 1.1.1仪器设备 均质器、三角烧瓶、平皿、玻璃棒、接种棒 恒温培养箱:36℃±1℃,42℃±1℃ 吸管:1 mL(具 0.01 mL刻度)、10mL(具0.1mL刻度或微量移液器及吸头
电子天平PL602-S,梅特勒-托利多仪器(上海)有限公司; 手提式不锈钢压力蒸汽灭菌锅SYQ-DSX-280B,上海申安医疗器械厂 1.1.2试剂药品 鸡肠、靛基质试剂、沙门氏菌O和H诊断血清、API20E生化试剂盒或VITEKGNI 生化鉴定卡 1.1.3培养基 蛋白胨水(BPW)、四硫磺酸钠煌绿(TTB)、亚硒酸盐胱氨酸(SC)增菌液、亚硫酸铋(BS)琼脂、HE琼脂、三糖铁琼脂、蛋白胨水、尿素琼脂、氰化钾、氰化钾对照、赖氨酸脱羧酶、赖氨酸脱羧酶对照、甘露醇、山梨醇、β-D半乳糖苷(ONPG)培养基 1.2 实验方法 1.2.1培养基的制备 1.2.1.1培养基的配制步骤 蛋白胨水(BPW):称取蛋白胨10g、氯化钠5g、磷酸氢二钠9g、磷酸二氢钠1.5g、蒸馏水1000ml,将各成分加入蒸馏水中,搅混均匀,静置约 10 min,煮沸溶解,调节 pH,高压灭菌 121 ℃,15 min。分装10瓶,每瓶90ml 四硫磺酸钠煌绿(TTB):高压灭菌 121 ℃,15 min灭菌冷却后至30℃,每100ml 基础培养液加碘液2ml,煌绿液1ml 1.2.1.2配制培养基的注意事项 (1)按照说明书上的用量进行换算,称取准确分量的合成培养基粉末; (2)加热煮沸溶解培养基时,留意锅内水位的变化,水位下降可再添加适量的水,以免水分蒸发过多,导致后面分装不够量; (3)往试管中放小导管时,注意处理气泡。 1.2.2 沙门氏菌群检测 1.2.2.1沙门氏菌检测程序
由于病原性球菌主要引起化脓性炎症,故又称化脓性球菌(pyogenic coccus)。化脓性球菌分为G+球菌和G-球菌。前者有葡萄球菌、链球菌和肺炎球菌;后者有淋球菌和脑膜炎球菌等。 葡萄球菌属(Staphylococcus)至少包括有20个种。其中金黄色葡萄球菌是人类的一种重要病原菌,引起许多严重感染。表皮葡萄球菌和腐生葡萄球菌是人体正常菌群。 三种葡萄球菌的主要性状区别 ————————————————————————————————— 主要性状金黄色葡萄球菌表皮葡萄球菌腐生性葡萄球菌—————————————————————————————————色素金黄色白色白色或柠檬色 血浆凝固酶+(-) - - 甘露醇发酵+ - - 溶血+ - - 耐热核酸酶活性+ - - 磷壁酸核糖醇型+ - + 磷壁酸甘油型- + + 蛋白A(SPA)+ - - 致病性强弱或无无————————————————————————————————— 一、生物学性状 (一)形态与染色 葡萄球菌直径约0.8~1.0μm,呈葡萄串状排列,革兰染色阳性。 (二)培养和生化反应 普通培养基上生长良好,金黄色葡萄球菌菌落呈金黄色。表皮葡萄球菌呈白色。腐生性葡萄球菌呈白色或柠檬色。于血液琼脂平板上培养,致病性葡萄球菌菌落周围可形成完全透明溶血环(β溶血),在液体培养基中呈混浊生长。葡萄球菌分解甘露醇产酸在鉴定葡萄球菌致病性方面有一定意义。 (三)抗原构造 1.葡萄球菌A蛋白(staphylococcal protein A, SPA):SPA是存在于90%以上的金黄色葡萄球菌细胞壁表面的一种蛋白质,为完全抗原,能与人及多种哺乳动物的IgG1、IgG2和IgG4分子的Fc段非特异性结合,而结合后的IgG分子
沙门氏菌病又称副伤寒。是沙门氏菌细菌引起人和动物共患疾病的总称。猫副伤寒主要是由鼠伤寒沙门氏菌所致。临床主要以肠炎和败血症为特征,以幼小猫为主,成年猫多为隐性感染,怀孕的动物会因此而流产。 鼠伤寒沙门氏菌在自然界分布很广,很容易在动物、人和环境之间传播。猫主要是经消化道'呼吸道感染。圈养的猫常因吃了没煮熟的或没加工的食物而感染,散养的猫在自由觅食时,吃了变质食物而发病。另外,器皿、医疗器械亦可成为传播媒介。 此病症状: 根据患猫不同年龄、营养状况、免疫状态和细菌感数量等因素而表现出以下几种类型: 1 胃肠炎型:潜伏期3-5天。患病初期表现出精神沉郁,食欲下降,体温上升至40°C至41.1°C。随后呕吐、流涎、腹痛、腹泻。腹泻物初为水样粪便,后为带血的粪便。病后几天内体重减轻,严重脱水,粘膜苍白,虚弱,休克。表现为机体应激性增强,后肢瘫痪,失明抽搐。少数病例可引起肺炎,出现咳嗽,呼吸困难及鼻出血。 2 菌血症与毒血症型:主要见于小猫,是一般的胃肠炎过程的前期症状。患病的猫表现为极度沉郁、全身虚弱、体温下降,微循环发生障碍,毛细血管充盈不良,可发生转移性感染,侵害某个器官,潜伏期往往多年。 治疗方法: 1 抗菌消炎:如果患猫呕吐不太严重,可经口给药。氯霉素(2毫克/千克体重)口服,每日4次,肌肉注射时剂量减半,连用4-6天;呋喃唑酮(0.01克/千克体重)每日2次,连用5-7天;甲氧苄氨嘧啶(0.04-0.08克/千克体重)每日2次,连用7天;磺胺甲基异恶唑或磺胺嘧碇(0.02-0.04克/千克体重)每日2次,连用7天。 2 对症治疗:有肠道出血的猫可肌肉注射止血敏2毫升,每日3次。另外,用0.1%高锰酸钾或口服补液盐和次硝酸铋液直肠深部灌肠。 3 辅助疗法:对呕吐、腹泻较为严重的猫,为防脱水可静滴糖盐水或复方氯化钠。心脏功能减退者,可肌肉注射0.5%强尔心,剂量为0.5-2毫升。 预防措施: 猫沙门氏菌病预防比较困难。为了降低此病发生,要采取预防措施: 1 严格控制副伤寒病猫和带菌猫与健康猫接触。有病猫生活过的环境及用具,用5%氨水或2%-3%烧碱溶液彻底消毒。
沙门氏菌的检验 2.2 恒温培养箱:36 ℃±1 ℃,42 ℃±1 ℃。 2.3 均质器。 2.4 振荡器。 2.5天平:感量0.1 g。 2.6 无菌锥形瓶:容量500 mL,250 mL。 2.7 无菌吸管:1 mL(具0.01 mL 刻度)、10 mL(具0.1 mL 刻度)或微量移液器及吸头。 2.8 无菌培养皿:直径90 mm。 2.9 无菌试管:3 mm×50 mm、10 mm×75 mm。 2.10 无菌毛细管。 2.11 pH 计或pH 比色管或精密pH 试纸。 3 培养基和试剂 3.1 缓冲蛋白胨水(BPW):见附录A 中A.1。 3.2 四硫磺酸钠煌绿(TTB)增菌液:见附录A 中A.2。 3.3 亚硒酸盐胱氨酸(SC)增菌液:见附录A 中A.3。 3.4 亚硫酸铋(BS)琼脂:见附录A 中A.4。 3.5 HE 琼脂:见附录A 中A.5。 3.6 木糖赖氨酸脱氧胆盐(XLD)琼脂:见附录A 中A.6。 3.8 三糖铁(TSI)琼脂:见附录A 中A.7。 3.9 蛋白胨水、靛基质试剂:见附录A 中A.8。 3.10 尿素琼脂(pH 7.2):见附录A 中A.9。 3.11 氰化钾(KCN)培养基:见附录A 中A.10。 3.12 赖氨酸脱羧酶试验培养基:见附录A 中A.11。 3.13 糖发酵管:见附录A 中A.12。 3.14 邻硝基酚β-D 半乳糖苷(ONPG)培养基:见附录A 中A.13。 3.15 半固体琼脂:见附录A 中A.14。 3.16 丙二酸钠培养基:见附录A 中A.15。 1 前增菌 称取25 g(mL)样品放入盛有225 mL BPW 的无菌均质杯中,以8 000 r/min~10 000 r/min 均质 1 min~ 2 min,或置于盛有225 mL BPW 的无菌均质袋中,用拍击式均质器拍打1 min~2 min。 2 增菌 轻轻摇动培养过的样品混合物,移取1 mL,转种于10 mL TTB 内,于42 ℃±1 ℃培养18 h~24h。同时,另取1 mL,转种于10 mL SC 内,于36 ℃±1 ℃培养18 h~24 h。 3 分离 分别用接种环取增菌液1 环,划线接种于一个BS 琼脂平板和一个XLD 琼脂平板(或HE 琼脂平板或沙门氏菌属显色培养基平板)。于36 ℃±1 ℃分别培养18 h~24 h (XLD 琼脂平板、
第三篇主要的病原微生物 第十三章病原细菌 第四节沙门氏菌 沙门氏菌(Salmonella)种类繁多,目前已发现2000多个血清型,且不断有新的血清型发现。它们主要寄生于人类及各种温血动物肠道,有些专对人致病,有些专对动物致病,也有些对人和动物都能致病。 一、生物学特性 (一)形态与培养其形态与大肠杆菌相似,无芽孢,除鸡白痢和鸡伤寒沙门氏菌外,其余均有周鞭毛,多数有菌毛。革兰氏染色阴性。本菌为兼性厌氧菌。在普通培养基上均能生长,在含有乳糖、胆盐和中性红指示剂的麦康凯琼脂平板上或SS琼脂平板上形成无色半透明、中等大小、表面光滑的菌落,可与大肠杆菌等发酵乳糖的肠道菌加以区别。 沙门氏菌不发酵乳糖和蔗糖,能发酵葡萄糖、麦芽糖和甘露醇产酸产气,V-P 试验阴性,不水解尿素,不产生靛基质,有的产生硫化氢。生化反应对鉴定沙门氏菌有重要意义。 (二)抗原构造沙门氏菌抗原结构复杂,可分为O抗原、H抗原和毒力Vi 抗原三种。 O抗原为细胞壁的脂多糖,能耐热100℃达数小时,也不被酒精或0.1%石炭酸所破坏。菌体抗原有许多组成成分,以阿拉伯字1、2、3、4等数字代表。每种菌常有数种O抗原,有些抗原是几种菌共有的,将具有共同抗原的沙门氏菌归属一组,这样可以把沙门氏菌分为A、B、C、D、E等34组,对动物致病的大多数在A—E内。 H抗原为蛋白质,对热不稳定,65℃15min或纯酒精处理后即被破坏。H抗原有两种:第1相和第2相,前者用a、b、c、d等表示,称为特异相。后者用1、2、3、4等表示,是几种沙门氏菌共有的称非特异相。具有第1相和第2相抗原的细菌称为双相菌,仅有其中一相抗原者称为单相菌。 伤寒与丙型副伤寒沙门氏菌的某些菌株有Vi抗原,存在于O抗原的外层,它能阻碍O抗原与相应抗体的特异性结合。 (三)抵抗力本菌的抵抗力中等,与大肠杆菌相似,不同的是亚硒酸盐、煌绿等染料对本菌的抑制作用小于大肠杆菌,故常用其制备选择培养基,有利于分离粪便中的沙门氏菌。沙门氏菌在水中能存活2~3周,在粪便中可活1~2月。对热的抵抗力不强,60℃15min即可杀死,5%石炭酸、0.1%的升汞、3%的来苏儿10~20min内即被杀死。 二、致病性 沙门氏菌属的细菌均有致病性,致病的毒力因子有多种,其中主要的有脂多糖、肠毒素、细胞毒素及毒力基因等,具有极其广泛的动物宿主。感染动物后常导致严重的疾病,并成为人类沙门氏菌病的传染源之一。因此沙门氏菌病是一种重要的人畜共患病。本菌最常侵害幼、青年动物,使之发生败血症、胃肠炎及其
前言 本标准代替 GB/T 4789.4-2008《食品卫生微生物学检验沙门氏菌检验》。 本标准与 GB/T 4789.4-2008 相比,主要变化如下 ——修改了标准的中英文名称; ——修改了标准的范围; ——修改了培养基和试剂; ——修改了设备和材料; ——修改了附录 A。 本标准的附录 A、附录 B 为规范性附录。 本标准所代替的历次版本发布情况为: ——GB 4789.4-84、GB 4789.4-1994、GB/T 4789.4-2003、GB/T 4789.4-2008。 食品安全国家标准 食品微生物学检验沙门氏菌检验 1 范围 本标准规定了食品中沙门氏菌(Salmonella)的检验方法。 本标准适用于食品中沙门氏菌的检验。 2 设备和材料 除微生物实验室常规灭菌及培养设备外,其他设备和材料如下: 2.1 冰箱:2 ℃~5 ℃。 2.2 恒温培养箱:36 ℃±1 ℃,42 ℃±1 ℃。 2.3 均质器。 2.4 振荡器。 2.5 电子天平:感量 0.1 g。 2.6 无菌锥形瓶:容量 500 mL,250 mL。 2.7 无菌吸管:1 mL(具 0.01 mL 刻度)、10 mL(具 0.1 mL 刻度)或微量移液器及吸头。 2.8 无菌培养皿:直径 90 mm。 2.9 无菌试管:3 mm×50 mm、10 mm×75 mm。 2.10 无菌毛细管 2.11 pH 计或 pH 比色管或精密 pH 试纸。 2.12 全自动微生物生化鉴定系统。 3 培养基和试剂 3.1 缓冲蛋白胨水(BPW):见附录 A 中 A.1。 3.2 四硫磺酸钠煌绿(TTB)增菌液:见附录 A 中 A.2。 3.3 亚硒酸盐胱氨酸(SC)增菌液:见附录 A 中 A.3。 3.4 亚硫酸铋(BS)琼脂:见附录 A 中 A.4。 3.5 HE 琼脂:见附录 A 中 A.5。 3.6 木糖赖氨酸脱氧胆盐(XLD)琼脂:见附录 A 中 A.6 3.7 沙门氏菌属显色培养基。 3.8 三糖铁(TSI)琼脂:见附录 A 中 A.7。 3.9 蛋白胨水、靛基质试剂:见附录 A 中 A.8。 3.10 尿素琼脂(pH 7.2):见附录 A 中 A.9。 3.11 氰化钾(KCN)培养基:见附录 A 中 A.10。 3.12 赖氨酸脱羧酶试验培养基:见附录 A 中 A.11。 3.13 糖发酵管:见附录 A 中 A.12。 3.14 邻硝基酚-D 半乳糖苷(ONPG)培养基:见附录 A 中 A.13。 3.15 半固体琼脂:见附录 A 中 A.14。 3.16 丙二酸钠培养基:见附录 A 中 A.15。 3.17 沙门氏菌 O 和 H 诊断血清。 3.18 生化鉴定试剂盒。
几种常见葡萄球菌的性状比较 葡萄球菌是一群革兰氏阳性球菌,因常堆聚成葡萄串状而得名。葡萄球菌在自然界中分布比较广泛,在空气、水、土壤及物体表面均存在,是最常见的化脓性球菌,也是医院交叉感染的重要来源。 金黄色葡萄球菌是葡萄球菌属一种重要的食源性致病菌,是造成人类食物中毒的重要致病菌之一,在历年的食物中毒调查中,该菌占整个细菌性食物中毒的第1位或第2位[1-2]。金黄色葡萄球菌是食品检测中一个重要的检测项目,但由于葡萄球菌属具有很多共同的特性,在检验工作中难以迅速识别。本文就日常检验工作中检出的3种葡萄球菌(金黄色葡萄球菌、沃氏葡萄球菌和中间葡萄球菌)的部分生物性状进行比较,旨在为金黄色葡萄球菌的检验工作提供一定的参考。 1 试验菌株 3种菌株均为检验过程中分离的菌株,且经VITEK 2 全自动微生物分析系统鉴定,分别为金黄色葡萄球菌(生化编码分别为050402022761231,可能性为99%)、沃氏葡萄球菌(生化编码分别为000004010060271,可能性为94%)和中间葡萄球菌(生化编码分别为030412147723231,可能性为99%)。 2 试验方法 将3种菌株分别划线接种于营养琼脂、Baird-Parker平板、血平板和科玛嘉金黄色葡萄球菌显色平板上,同时进行革兰氏染色镜检和血浆凝固酶试验。 3 结果 3种菌株部分生物性状结果见下表: 表1 3种菌株的部分生物性状 营养琼脂金黄色菌落白色菌落白色菌落 Baird-Parker平板黑色菌落,圆润, 周围有晕圈 黑色菌落,圆润, 周围有晕圈 黑色菌落,圆润, 周围有晕圈 血平板黄色菌落,圆润, 溶血 灰白色菌落,圆润, 不溶血 白色菌落,圆润, 溶血 革兰氏染色镜检G+,葡萄样球菌G+,葡萄样球菌G+,葡萄样球菌血浆凝固酶试验阳性阴性阴性 科玛嘉金黄色葡萄球菌显色平板紫红色菌落,周围 有晕圈 蓝绿色菌落蓝色菌落 3.1 营养琼脂平板 葡萄球菌对营养要求不高,在营养琼脂平板上生长良好,形成圆形凸起、边缘整齐、表面光滑、湿润、不透明的菌落。金黄色葡萄球菌在营养琼脂上基本为金黄色菌落,但有时金黄色不是很明显,其余葡萄球菌为白色菌落。 3.2 Baird-Parker平板 金黄色葡萄球菌在Baird-Parker平板上为圆形,直径2mm-3mm,颜色呈灰色或黑色,边缘为淡色,周围为一浑浊带,在其外层有一透明圈。用接种针接触菌落有似奶油至树胶样
沙门氏菌基本知识及检测方法 沙门氏菌属(Salmonella)是肠杆菌科的一个大属,有2000多个血清型,我国发现的约有100个。沙门氏菌广泛存在于猪、牛、羊、家禽、鸟类、鼠类等多种动物的肠道和内脏中。1880年Eberth首先发现伤寒杆菌,1885年Salmon分离到猪霍乱杆菌,由于Salmon发现本属细菌的时间较早,在研究中的贡献较大,遂定名为沙门氏菌属Salmonella 。本属细菌绝大多数成员对人和动物有致病性,能引起人和动物的败血症与胃肠炎,甚至流产,并能引起人类食物中毒,是人类细菌性食物中毒的最主要病原菌之一。 根据沙门氏菌的致病范围,可将其分为三大类群。第一类群:专门对人致病。如伤寒沙门氏菌、副伤寒沙门氏菌(甲型、乙型、丙型)。第二类群:能引起人类食物中毒——食物中毒沙门氏菌群,如鼠伤寒沙门氏菌、猪霍乱沙门氏菌、肠炎沙门氏菌、纽波特沙门氏菌等。第三类群:专门对动物致病,很少感染人,如马流产沙门氏菌、鸡白痢沙门氏菌。致病性最强的是猪霍乱沙门氏菌(Salmonella cholerae),其次是鼠伤寒沙门氏菌(Salmonella typhimurium)和肠炎沙门氏菌(Salmonella enteritidis)。 一、沙门氏菌属的生物学特征: 1.形态染色特性:G-无芽孢杆菌。大小通常为 0.7~1.5μm × 2.0~5.0μm,菌端钝圆,散在,偶有短丝状,无荚膜,除鸡白痢沙门氏菌和鸡伤寒沙门氏菌外均有周身鞭毛,能运动,绝大多数菌株有菌毛。需氧或兼性厌氧菌,生长温度范围为10~42℃,最适生长温度为37℃,适宜pH为6.8~7.8,对营养要求不高,在普通培养基中生长旺盛,胆盐可促进其生长。 2.培养特性:需氧或兼性厌氧菌;生长温度范围为10~42℃,最适生长温度为37℃;适宜pH为6.8~7.8;对营养要求不高,在普通培养基中生长旺盛;胆盐可促进其生长。 §普通琼脂:圆形、光滑、无色半透明、边缘整齐或不太整齐的中等大小(2 ~ 4mm)菌落。鸡白痢、鸡伤寒、猪副伤寒、甲型副伤寒沙门氏菌等只能长成细小菌落。§麦康凯琼脂和伊红美兰琼脂(EMB):菌落无色半透明
2020版药典微生物限度计数—沙门菌 2020版本药典 (1) 菌种及菌液制备 1) 菌液制备 将铜绿假单胞菌、大肠埃希菌、金黄色葡萄球菌、沙门菌分别接种在胰酪大豆胨琼脂培养基上,35℃条件下培养24小时,将新鲜培养物用pH7.0的0.9%无菌氯化钠溶液制成适宜浓度的菌悬液。(2) 控制菌检查方法适用性试验 控制菌检査用培养基的适用性检查项目包括促生长能力、抑制能力及指示特性的检查,各培养基的检查项目及所用的菌株见表1。 表1 控制菌检査用培养基的促生长能力、抑制能力和指示特性 沙门菌菌检查方法适用性试验 1、RV沙门菌增菌液体培养基促生长能力检查:分别接种不大于l00cfu的乙型副伤寒沙门菌于被检培养基和对照培养基中,在35℃
条件下培养18小时。 2、RV沙门菌增菌液体培养基抑制能力检查:分别接种不大于l00cfu的金黄色葡萄球菌于被检培养基和对照培养基中,在35℃条件下培养24小时。 3、木糖赖氨酸脱氧胆酸盐琼脂培养基促生长能力检查:分别接种不大于l00cfu的乙型副伤寒沙门菌于被检培养基和对照培养基中,在35℃条件下培养18小时。 4、木糖赖氨酸脱氧胆酸盐琼脂培养基指示特性检查:分别接种不大于l00cfu的乙型副伤寒沙门菌于被检培养基和对照培养基中,在35℃条件下培养18小时。 5、木糖赖氨酸脱氧胆酸盐琼脂培养基抑制能力检查:分别接种不大于l00cfu的乙型副伤寒沙门菌于被检培养基和对照培养基中,在35℃条件下培养24小时。 6、三糖铁琼脂培养基指示特性检查:分别接种不大于l00cfu的乙型副伤寒沙门菌于被检培养基和对照培养基中,在35℃条件下培养18小时。 7、三糖铁琼脂培养基抑制能力检查:分别接种不大于l00cfu的乙型副伤寒沙门菌于被检培养基和对照培养基中,在35℃条件下培养18小时。 (3) 沙门菌检査 1) 供试液制备和增菌培养 取10g供试品直接接种至90ml的胰酪大豆胨液体培养基中,混匀,35℃培养24小时。选择和分离培养取上述培养物0.1ml接种至10mlRV沙门增菌液体培养基中,35℃培养24小时。取少量RV沙门
沙门氏菌 沙门氏菌属肠杆菌科,革兰氏阴性肠道杆菌,己发现1800种以上。除可感染人外,还可感染很多动物包括哺乳类、鸟、爬行类、鱼、两栖类及昆虫。沙门氏菌病是公共卫生学上具有重要意义的人畜共患病之一,人畜感染后可呈无症状带菌状态,也可表现为有临床症状的致死疾,它可能加重病态或死亡率,或者降低动物的繁殖生产力。 沙门氏菌属(Salmonella)是一大群寄生于人类和动物肠道内,生化反应和抗原构造相似的革兰氏阴性杆菌,有的专对人类致病,有的只对动物致病,也有对人和动物都致病,这些统称为沙门氏菌。 沙门氏菌目前已经发现1800种以上,按抗原成分可分为甲、乙、丙、丁、戊等基本菌型。其中与人类疾病有关的主要有甲组的副伤寒甲杆菌,乙组的副伤寒乙杆菌和鼠伤寒杆菌,丙组的副伤寒丙杆菌和猪霍乱杆菌,丁组的伤寒和肠炎杆菌。 此菌可引起禽伤寒、鸡白痢、猪霍乱、鼠伤寒沙门氏菌病、猪副伤寒、马流产沙门氏菌病等疾病。致病性最强的是猪霍乱沙门氏菌(Salmonella cholerae),其次是鼠伤寒沙门氏菌(Salmonella typhimurium)和肠炎沙门氏菌(Salmonella enteritidis)。感染沙门氏菌或食用被带菌者粪便污染的食品,可使人发生食物中毒。据统计在世界各国的种类细菌性食物中毒中,沙门氏菌引起的食物中毒常列榜首。,近日美国多地暴发疑似由生鸡肉引发的沙门氏菌疫情,至少42%患者已入院治疗。数据显示,已有18个州的278人感染具有耐药性的海德堡沙门氏菌。
沙门氏菌属肠道细菌科,包括那些引起食物中毒、导致肠胃炎、伤寒和副伤寒的细菌。能引起食物传播性疾病,近年来,已经成为最常见的食物中毒原因。肠炎沙门氏菌感染通常源于奶制品、禽产品和肉产品;鸡肉和鸡蛋尤其是高风险食品。沙门氏菌感染的症状通常是肠胃出现问题,包括恶心、腹部绞痛、呕吐和腹泻,一般最多持续7天。在免疫力低下的人群中,如果不及时服用抗生素类药品,沙门氏菌感染将导致生命危险。 关注食品安全,关注三方圆
金黄色葡萄球菌 生物学特性: 1.球菌,直径0.8-1.0μm左右,显微镜下排列成葡萄串状 2.无芽胞、鞭毛,无荚膜 3.革兰氏染色阳性 4.化能异养菌,呼吸代谢和发酵代谢 5.高度的耐盐性(10-15%NaCl肉汤中生长) 培养特性: 1.营养要求不高 2.需氧或兼性厌氧,在好氧环境下生长最好 3.最适生长温度37°C,干燥环境下可存活数周 4.最适生长pH 7.4 5.菌落光滑、低凸、闪光、奶油状、并且有完整的边缘。 6.血平板菌落周围形成透明的溶血环 生化特性: (1)可分解葡萄糖、麦芽糖、乳糖、蔗糖,产酸不产气。甲基红反应阳性,VP反应弱阳性。 (2)金黄色葡萄球菌在厌氧条件下分解甘露醇产酸(非致病性菌则无此现象) (3)许多菌株可分解精氨酸,水解尿素,还原硝酸盐,液化明胶。
(4)具有较强的抵抗力,磺胺类药物敏感性低,对青霉素、红霉素 等高度敏感 金黄色葡萄球菌的致病力强弱主要取决于其产生的毒素和侵袭性酶: a.溶血毒素外毒素,分α、β、γ、δ四种,能损伤血小板,破坏溶酶 体,引起肌体局部缺血和坏死; b.杀白细胞素可破坏人的白细胞和巨噬细胞 c.血浆凝固酶当金黄色葡萄球菌侵入人体时,该酶使血液或血浆中的纤维 蛋白沉积于菌体表面或凝固,阻碍吞噬细胞的吞噬作用。葡 萄球菌形成的感染易局部化与此酶有关; d.脱氧核糖核酸酶金黄色葡萄球菌产生的脱氧核糖核酸酶能耐受高温,可用来 作为依据鉴定金黄色葡萄球菌 e.肠毒素金黄色葡萄球菌能产生数种引起急性胃肠炎的蛋白质性肠 毒素,分为A、B、C、D、E及F五种血清型。 此外,金黄色葡萄球菌还产生溶表皮素、明胶酶、蛋白酶、脂肪酶、肽酶等。 培养基菌落形态 甘露醇氯化钠琼脂 金黄色,圆形凸起,边缘整齐,外围有黄色环,菌落直径0. 7?lmm 卵黄氯化钠琼脂 金黄色,圆形凸起,边缘整齐,外围有卵磷脂分解的乳浊圈,菌落直径l?2mm
沙门氏菌生化鉴定 WEIHUA system office room 【WEIHUA 16H-WEIHUA WEIHUA8Q8-
沙门氏菌生化试验判定步骤 表1 三糖铁琼脂 赖氨酸脱羧酶初步判断斜面底层产气硫化氢 产碱红产酸黄+(-)+(-)黑+紫可疑沙门氏菌产碱红产酸黄+(-)+(-)黑-黄可疑沙门氏菌产酸黄产酸黄+(-)+(-)黑+紫可疑沙门氏菌 三糖铁琼脂原理分析:本培养基适合于肠杆菌科的鉴定。用于观察细菌对糖的利用和硫化氢(变黑)的产生。该培养基含有乳糖、蔗糖和葡萄糖的比例为10:10:1,只能利用葡萄糖的细菌,葡萄糖被分解产酸可使斜面先变黄,但因量少,生成的少量酸,因接触空气而氧化,加之细菌利用培养基中含氮物质,生成碱性产物,故使斜面后来又变红,底部由于是在厌氧状态下,酸类不被氧化,所以仍保持黄色。而发酵乳糖的细菌,则产生大量的酸,使整个培养基呈现黄色。如培养基接种后产生黑色沉淀,是因为某些细菌能分解含硫氨基酸,生成硫化氢,硫化氢和培养基中的铁盐反应,生成黑色的硫化亚铁沉淀。 底层产酸:是因为细菌分解糖类物质使酚红退色变黄。 斜面产碱,低层产酸:是细菌分解葡萄糖(不能分解乳糖和蔗糖),由于量较少进而分解蛋白胨而产碱变红。因为底层是厌氧环境,葡萄糖分解慢,24小时培养后还没分解蛋白胨产碱;而斜面是需氧环境分解较快,一般8小时左右就把葡萄糖分解完(此时斜面也是酸性),但继而分解蛋白胨产碱,斜面又转为碱性。 2-志贺氏菌:都能分解葡萄糖,产酸不产气,大多不发酵乳 糖,不产生H2S。 4-大肠杆菌:能分解葡萄糖产酸产气,大多数能分解乳糖,不 产生H2S。 3-沙门氏菌:能分解葡萄糖,不发酵乳糖,大多数产生H2S, 多数产气。 赖氨酸脱羧酶试验 1、试验管及对照管均要加一层约10mm厚的灭菌石蜡或矿物油以覆盖表面,此可使培养基中的溶解氧通过细菌消耗掉,并控制培养基的pH。 2、阳性试验管培养初期(10—12h)因发酵葡萄糖产酸变黄,继续培养由于氨基酸脱羧产生胺类而使培养基由酸变碱,故又由黄变为紫色。阴性试验管则始终呈黄色。 氨基酸脱羧酶试验 ?(1)原理:某些细菌可产生氨基酸脱羧酶使氨基酸脱羧生成胺和二氧化碳。由于胺的生成使培养基变为碱性,可用指示剂指示出来。?(2)方法:将待检菌分别接种于1支氨基酸(赖氨酸,鸟氨酸或精氨酸)脱羧酶试验管和1支氨基酸脱羧酶对照管(无氨基酸),各覆盖至少高度的无菌
沙门菌检查法 1 简述 沙门菌属是肠杆菌科的重要致病菌,按Bergey系统细菌学手册第一卷(1984),沙门菌分5个亚属。2003年出版的第八版的临床微生物手册将沙门菌属分成两个菌种即肠炎沙门菌和乍得沙门菌,其中肠炎沙门菌分6个亚种,包括常见的伤寒、甲型副伤寒、乙型副伤寒、丙型副伤寒、,鼠伤寒,猪霍乱等沙门菌杂内,迄今已发现2501个血清型。O抗原抗血清A-E群包含了沙门菌分离株的95%,所以常用沙门菌A-F O多价血清进行沙门菌初筛试验。药品中的沙门菌,是以鉴定沙门菌属为准,即对没10g(或10ml)药品中是否检出沙门菌作出检验报告。 由于沙门菌血清型繁多,各血清型的生化及血清学特性虽密切相关,却不尽相同,采用一种增菌培养基和两种分离培养基,不可能涵盖所有沙门菌的最适增菌及分离条件。 此外,由于药品在生产过程中,常受到加热、干燥等加工步骤的影响,药品中污染的沙门菌可受到损伤或呈休眠状态,故须在增菌培养前先进行预增菌。然后再进行增菌及分离、三糖铁琼脂初步鉴别、生化试验、血清学试验等步骤。 2 仪器、设备及用具(见大肠埃希菌2)。 3 试液指示液(参见大肠埃希菌3) 3.1 无菌脲试液[附录2.5]。 3.2 酚磺酞指示液[附录 4.4]。
3.3 亮绿试液[附录2.9]。 3.4 氰化钾试液[附录2.14]。 3.5溴甲酚紫指示液[附录 4.5]。 3.6 革兰染色液[附录2.4,2.10,2.16]。 3.7 沙门菌属A-F“O”多价血清(即O多价1)生物制品研究所供应。 4 培养基 4.1 营养琼脂培养基[附录 5.2]。 4.2 营养肉汤培养基[附录 5.1]。 4.3 半固体营养琼脂培养基[附录 5.3]。 4.4 曙红亚甲蓝琼脂培养基(EMB)[附录 5.8]。 4.5 麦康凯琼脂培养基(MacC)[附录 5.9]。 4.6 四硫磺酸钠亮绿培养基(TTB)[附录 5.11]。 4.7 三糖铁琼脂培养基(TSI)[附录 5.10]。 4.8 胆盐硫乳琼脂培养基(DHL)[附录 5.13]。 4.9 沙门菌属志贺菌属琼脂培养基(SS)[附录 5.12]。 4.10 蛋白胨水培养基[附录 5.18]。 4.11 脲(尿素)琼脂培养基[附录 5.23]。 4.12 氰化钾培养基[附录 5.24]。 4.13 赖氨酸脱羧酶培养基[附录 5.25]。 5 对照用菌液 取乙型副伤寒沙门菌[CMCC(B)50094]是营养琼脂斜面培养物少许,接种至5ml营养肉汤培养基内,36℃±1℃培养18~24h后,用0.9%
培养基名称:沙门氏菌显色培养基 英文名称:Chromogenic Salmonella Agar 沙门氏菌显色培养基用途:用于沙门氏菌的快速分离和鉴定。 沙门氏菌显色培养基使用原理: 蛋白胨和酵母膏粉提供碳氮源和微量元素;氯化钠可维持均衡的渗透压;琼脂是培养基的凝固剂;胆盐抑制革兰氏阳性菌;选择性添加剂增强培养基的抑制杂菌的能力;混合色素分别与沙门氏菌和大肠菌群所对应的酶发生特异性反应,水解底物,释放出显色基团,在淡黄色平板上沙门氏菌产生品红色的菌落,大肠菌群产生蓝绿色的菌落。 沙门氏菌显色培养基配方(每升): 蛋白胨19.6g 酵母膏粉3g 氯化钠5g 胆盐 1.5g 琼脂12g 混合色素 6.4g 最终pH7.0±0.2 沙门氏菌显色培养基使用方法: 1、称取沙门氏菌显色培养基47.5g,混合均匀加热至100℃,并按常规不断搅拌直至完全溶解(不能持续高温加热,建议不要重复煮溶),不需高压灭菌,冷至50℃,加入10支沙门氏菌选择性添加剂(冻干粉每支需先用1ml无菌水溶解),混匀,倾注灭菌平皿。 2、按国家标准、SN标准、FDA标准或其它方法制备样品液与增菌液。 3、建议使用二步增菌法: (1)前增菌:将处理过的样品25g置于225mL缓冲蛋白胨水中,混合均匀后37℃培养6~8h; (2)选择性增菌:取前增菌液1mL加入到9mL四硫磺酸钠煌绿增菌液(TTB)中,混合均匀后37℃培养18~24h;
4、用接种环取增菌液一环,划线接种于沙门氏菌显色平板上,置于36±1℃培养18-24小时。 5、观察结果。挑取显色平板上呈品红色,扁平透明,边缘光滑,直径约2mm的可疑菌落进行进一步的试验。 6、可使用MicrogenTMGN-ID或API20E或生化管试验,对疑似沙门氏菌菌落进行生化鉴定。 质量控制: 沙门氏菌显色培养基倾注平皿后呈淡黄色,下列菌株接种后于36±1℃培养18—24h生长情况如下表。 菌名菌号生长状况培养特征 鼠伤寒沙门氏菌CMCC50115良好菌落品红色 大肠埃希氏菌ATCC25922良好菌落蓝绿色 奇异变形杆菌CMCC(B)49005良好菌落无色 粪肠球菌ATCC29212受抑制----- 贮存:贮存于避光、阴凉干燥处,用后立即旋紧瓶盖。贮存期二年。 规格:可配置1L的培养基干粉。
沙门氏菌致病性的研究 发表时间:2014-07-03T16:23:20.497Z 来源:《中外健康文摘》2014年第10期供稿作者:张敏 [导读] 伤寒沙门氏菌和副伤寒沙门氏菌可以引起伤寒,一种以发热,肠穿孔,出血,淋巴结肿大等为特征的系统性疾病[6, 7]。 张敏 (四川省成都邛崃市医疗中心医院检验科 611530) 【摘要】沙门氏菌是革兰氏阴性菌,导致伤寒及胃肠炎等,是威胁人类健康的一类病原菌。沙门氏菌通过自身的毒力基因编码一系列的毒力因子以达到其感染宿主的目的。为了更好的研究沙门氏菌的致病机理,目前已经建立鼠,牛,线虫等动物模型。通过这些动物模型的研究发现,沙门氏菌主要利用其毒力岛1和毒力岛2编码的三型分泌系统分泌效应蛋白。这些效应蛋白改变宿主细胞的信号通路,促进沙门氏菌入侵宿主细胞,并有助于其在宿主细胞的存活和复制。另一方面,宿主的遗传学和抵抗力也影响沙门氏菌感染的易感性。本文主要关注沙门氏菌感染后与宿主的相互作用。 【关键词】糖尿病实验室诊断 【中图分类号】R446 【文献标识码】A 【文章编号】1672-5085(2014)10-0054-04 1.沙门氏菌病 沙门氏菌病是指由沙门氏菌引起的疾病。沙门氏菌是革兰氏阴性的胞内细菌[1-3],有两个种属,即邦戈沙门氏菌(S. bongori)和肠道沙门氏菌(S. enterica)。邦戈沙门氏菌主要存在于爬行动物,很少引起温血动物的感染[4]。肠道沙门氏菌有两千多个血清型,其中一些血清型在世界范围内尤其是发展中国家引起严重的感染[5]。 伤寒沙门氏菌和副伤寒沙门氏菌可以引起伤寒,一种以发热,肠穿孔,出血,淋巴结肿大等为特征的系统性疾病[6, 7]。伤寒沙门氏菌有高度的宿主特异性,只引起人类疾病并不感染其它动物[8]。它通过粪口途径传播,通常是由于食物或者水被细菌感染[9-11]。如果没有并发症的发生,这种疾病通常会在4个月后痊愈。它多发于亚洲,非洲和南美[7]。 肠炎沙门氏菌(S. Enteritidis)和鼠伤寒沙门氏菌(S. Typhimu rium)引起胃肠炎或者食物中毒,一种以腹泻,腹痛,恶心,呕吐发热等为特点的自限性疾病[12, 13]。急性肠炎的特点是由于肠多核白细胞(PMN)的聚集从而导致的粘膜水肿和感染[13]。症状发生在食用了细菌感染的禽类或者蛋类6-72小时后,最长一周,然后自发的恢复。在北美,肠炎沙门氏菌(S. Enteritidis)是食物传播疾病最常见的原因之一。无免疫应答者和婴幼儿是严重肠炎的易感人群,导致系统感染甚至死亡[14]。与有宿主特异性的伤寒沙门氏菌不同,肠炎沙门氏菌(S. Enteritidis)和鼠伤寒沙门氏菌(S. Typhimurium)没有宿主特异性,在人类和其他动物都可以引起肠炎[15]。 2.沙门氏菌毒力影响因素 沙门氏菌的致病性主要与染色体上成簇分布的编码致病相关基因的特定区域-致病岛(Salmonella pathogenicity island,SPI)相关[16]。致病岛是染色体上不连续的致病基因。革兰氏阴性菌的共同特点是致病岛编码毒力因子以及调节和分泌毒力因子的装置。目前,已在沙门氏菌中发现了5个致病岛,即SPI-l~SPI-5。其中SPI1和SPI2和致病性密切相关,SPI1和SPI2基因的突变严重影响沙门氏菌感染宿主的能力。SPI1和SPI2各自编码不同的Ⅲ型分泌系统,TTSS1(type Ⅲ secretion system 1)和TTSS2(type Ⅲ secretion system 2)[16]。TTSS是分子注射器,把毒力蛋白即效应蛋白直接注入到宿主细胞,影响细胞功能,促进感染的发生[17]。每个Ⅲ型分泌系统在感染的不同阶段转运一系列效应蛋白以改变宿主细胞的途径。两个Ⅲ型分泌系统在感染的不同阶段都发挥关键作用[18, 19]。 2.1沙门氏菌毒力岛1(SPI1) 所有的邦戈沙门氏菌(S. bongori)和肠道沙门氏菌(S. enterica)都有毒力岛1[20],目前发现无论是系统性疾病还是感染性腹泻毒力岛1在沙门氏菌感染的小肠阶段都发挥重要作用[21, 22]。所以有学者认为获得了毒力岛1使得沙门氏菌成为肠道病原菌。在鼠的伤寒模型中,毒力岛1突变使得经口腔的感染减轻但是并不影响系统感染[23]。经过口腔感染沙门氏菌,毒力岛1在其入侵上皮细胞过程中是至关重要的。毒力岛1是40KB的DNA区域编码三型分泌系统,效应蛋白和调节蛋白[24]。大部分毒力岛1的基因在类似于小肠环境的条件下表达,一旦沙门氏菌在细胞内的膜性结构中存活复制,毒力岛1的基因表达就受到抑制。这些基因的表达由位于毒力岛1区域的调节子控制,分别为HilA, HilC, HilD, InvF, and SprB[22, 25, 26]。HilA的作用非常重要,删除HilA的沙门氏菌表型与与删除整个毒力岛1相似[27]。毒力岛1 的调节子也可以调控毒力岛2.比如HilA结合并抑制启动子ssaH,其为毒力岛2的编码基因。HilD结合并激活ssrAB启动子,其为毒力岛2主要的调节基因。双组份系统PhoP/Q在毒力岛1 和毒力岛2的调节中都发挥重要作用。 毒力岛1的效应蛋白影响宿主的一系列功能,比如细胞骨架的重排促进沙门氏菌入侵上皮细胞[28-33];中性粒细胞的募集[13, 15, 34-36]。在牛的胃肠炎模型中,很多毒力岛1的效应蛋白通过诱导自身或者宿主细胞的细胞因子的分泌,促进多核白细胞的迁移和液体的聚集。沙门氏菌入侵宿主细胞后毒力岛1分泌的效应蛋白的作用已经成为研究的热点[37]。毒力岛1分泌的一些效应蛋白,像SopB,SopD和SopE存在于很多沙门氏菌的血清型中。最近有研究表明,在鼠的感染模型中发现沙门氏菌感染的后期仍有SopB,SopD,SopE和SipA的表达分泌[37]。这表明这些毒力岛1表达分泌的效应蛋白在感染后期可能也发挥作用。但是具体作用和机制还不清楚。 2.2沙门氏菌毒力岛2(SPI2) 毒力岛2只存在于肠道沙门氏菌(S. enterica),而邦戈沙门氏菌(S. bongori)是没有毒力岛2的[38]。学者认为获得毒力岛2的是沙门氏菌进化为系统性细菌和细胞内细菌的关键一步。在鼠伤寒的动物模型中,毒力岛2的突变严重影响它的毒力,使其不能在器官内增殖[39]。因此,毒力岛2与沙门氏菌在细胞内复制和系统性感染相关[40]。毒力岛2的突变降低沙门氏菌在巨噬细胞内的存活能力,可能是由于其不能形成膜性结构(SCV)。这个膜性结构是沙门氏菌存活和复制的一个细胞内小泡[41]。毒力岛2抑制抗原递呈,抑制DC细胞激活T细胞,因此它可以逃避内源性和适应性免疫系统的追杀[42]。 最近有研究表明在链霉素预处理的鼠模型中,毒力岛2在沙门氏菌入侵上皮细胞阶段也发挥重要作用。这表明在沙门氏菌引起的伤寒和胃肠炎中,毒力岛2也有一定作用。毒力岛2的基因位于沙门氏菌染色体40-kb的两个不同区域,可能是通过两次独立的事件获得。大的区域编码主要的毒力因子,包括三型分泌系统装置,调节因子,效应蛋白等。双组份系统SsrAB调节毒力岛2的基因,是激活毒力岛2转录的调节因子[43, 44]。PhoP/Q和OmpR/Z也在毒力岛2的调节中发挥重要作用[45]。 经过毒力岛2编码的三型分泌系统分泌的蛋白由转运子和效应蛋白组成。SseBCD与毒力岛2效应蛋白转运到宿主细胞相关[46]。有研究