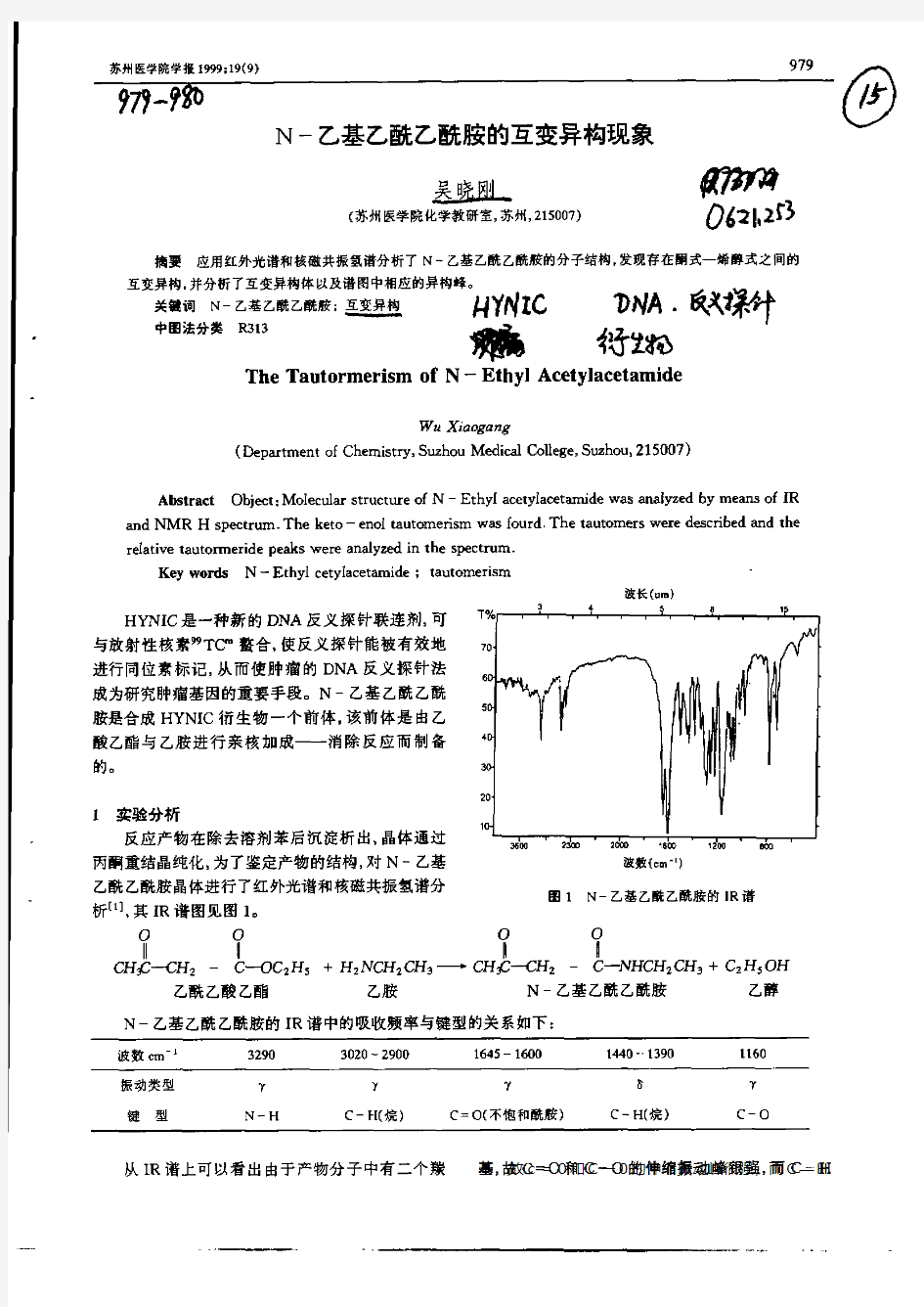
N,N-二甲基乙酰胺 一概述 1基本情况 名称:N,N-二甲基乙酰胺(简称DMAC) 分子式:C4H9NO 分子量:87.12 CAS号:127-19-5 性质 无色透明液体,可燃。能与水、醇、醚、酯、苯、三氯甲烷和芳香化合物等有机溶剂任意混合。冰点-20℃,沸点166℃,96℃(10.7kPa),85-87℃(4.4kPa),74-74.5℃(3.47kPa),66-67℃(2.0kPa),62-63℃(1.6kPa),相对密度0.9366(25/4℃),0.9599(0/4℃),折射率1.4380。闪点(开杯)70℃。 制备方法 1.乙酐法二甲胺与醋酐在0-20℃时进行酰化反应,然后用液碱低温中和除去醋酸,分离出醋酸钠,中和液再进行碱洗,精馏,取沸程164-166.5℃馏分为成品。原料消耗定额:乙酐(95%)1150kg/t、二甲胺(40%)1898kg/t。 2.乙酰氯法。由二甲胺与乙酰氯反应,也可制备得到二甲基乙酰胺。该工艺与国内现行乙酐法工艺相比,生产成本降低,经济效益有所提高。 3.醋酸法。抚顺市化工设备研究院采用醋酸与二甲胺合成法,取得了良好成果。该工艺特点是采用先进的催化反应精馏技术,使反应强化,能耗降低,分离效果和产品收率大大提高,工艺过程简化。该工艺与醋酐法合成二甲基乙酰胺工艺相比,生产成本降低,经济效益有所提高。中国目前多用。 4.羰基合成法。国外研究将三甲胺和一氧化碳进行羰基化合成,生成N,N-二甲基乙酰胺的方法。反应中用铁、钴、镍的碘化物或溴化物作催化剂。 用途 DMAC主要用作合成纤维(丙烯腈)和聚氨酯纺丝及合成聚酰胺树脂的溶剂,也用于从C8馏分分离苯乙烯的萃取蒸馏溶剂,并广泛用于高分子薄膜、涂料和医药等方面。目前在医药和农药上大量用来合成抗菌素和农药杀虫剂。还可用作反应的催化剂、电解溶剂、油漆清除剂以及多种结晶性的溶剂加合物和络合物。
第一章第二节《有机物的结构特点》—同分异构现象教学设计一、教学目标 知识目标 1.掌握同系物、同分异构体的概念,能准确判断有机化合物的同分异构体; 2.了解常见有机化合物同分异构的基本类型; 3.会正确书写简单有机化合物的同分异构体; 4.了解键线式的含义。 能力目标: (1)通过对同系物、同分异构体的概念的比较理解,帮助学生学会深化概念理解的学习方法; (2)通过在练习中找出判断同分异构体以及拼凑和书写同分异构体的方法,培养学生学习有机化学的思维方法、培养学生一定的空间想象能力和解决实际问题的一些技巧。 二、教学重点、难点 教学重点:有机物的同分异构现象产生的本质原因和同分异构体的判断; 教学难点:同分异构体的判断和书写 三、教学设计思路 1.教材内容的重整 教材中内容呈现的顺序和课时安排是:(1)本章一开始便引出官能团的概念,介绍有机化合物的分类方法(第一节 1课时)。→(2)碳原子的成键特点和成键方式以及有机化合物的同分异构现象(第二节 1课时)。→(3)数目庞大的有机化合物,需要有专有的名称与之一一对应,引入有机化合物的命名(第三节 1课时)的学习。→(4)最后进入“有机化合物研究方法”的学习(第四节 2课时)。 也就是说“同分异构体”知识是放在“有机物的系统命名法”教学之前进行,从有机化合物的同分异构现象与碳原子的成键特点和成键方式有关引入,这有着知识逻辑上的关系,有其内容呈现的优点;但从教学中,由于学生的空间想象能力较差,虽然对“同分异构体”的概念有所理解,但实际做题上,若把有机物的结构简式变形书写,由于空间想象能力差,经常分不清“同一物质”与“同分异构体”,而且,书写同分异构体时,经常重复书写也不知道,针对这种情况,若先把有机物的系统命名法教给学生,然后学会从给有机物进行命名,通过命名来检验或判断同分异构体,学生就更容易掌握。加上“有机化合物的命名方法以及同分异构体的判断”是后续学习、交流和研究有机化学必备的知识。因此,我把教材的这部分内容(原第二节和第三节内容)的呈现以及课时进行了重整: 第二节:碳原子的成键特点和有机化合物的命名(2课时) 具体内容:一、碳原子的成键特点Array 二、烷烃的命名 (由碳原子的成键特点可造成有机化合物的数目庞大的,这需要有专有的名称与之一 一对应,从而先引入“烷烃的命名法”学习。)
第七章有机化学中的同分异构现象 同分异构现象是指有机化合物具有相同的分子式,但具有不同结构的现象。由于碳原子特殊的成键方式,使得有机化学中存在着普遍的同分异构现象。依照结构上的差异,同分异构体可以被分为两大类:即构造异构体和立体异构体。 构造异构体是指具有相同的分子式,但各原子间以共价键连接的顺序不同而产生的异构体。立体异构体则是指具有相同的分子式,各原子间具有相同的连接顺序,但各原子或原子团在空间排列的相对位置不同所产生的异构体。 7.1 有机化学中的构造异构 构造异构体按照其结构的特点又可以进一步细分为以下三种常见的类型:碳链异构、位置异构和官能团异构。 碳链异构是指由于分子中碳链形状不同而产生的异构现象。这种异构体的数量随着分子中碳原子数的增加快速增加,构成数量庞大的有机化合物。具有1-3个碳原子的烷烃没有构造异构体,而4个碳原子的烷烃包含正丁烷和异丁烷两种异构体。戊烷包含3种构造异构体,己烷的异构体有5种,庚烷有9种,癸烷有75种。 新戊烷 正戊烷异戊烷 2,2-二甲基丁烷 己烷2-甲基戊烷 3-甲基戊烷2,3-二甲基丁烷 位置异构是指由于取代基或官能团在碳链上或碳环上的位置不同而产生的异构现象。这种异构现象普遍存在于烯烃、炔烃、醇、酚、酮等具有官能团的有机化合物中。例如, 1-丁烯 2-丁烯1-丁炔 2-丁炔 OH OH O O 3-戊酮 1-丁醇 2-丁醇2-戊酮
Cl OH Cl OH 4-氯苯酚 3-氯苯酚 官能团异构是指由于分子中官能团的不同而产生的异构现象。单烯烃与环烷烃、炔烃与二烯烃、醇与醚、醛与酮、烯醇与酮、酯和羧酸、酚和芳香醇等都属于官能团异构。例如, O OH CHO O O O O OH COOH COOCH 3环戊烷1-戊烯 1,3-丁二烯 2-丁炔 甲乙醚1-丙醇丙酮 丙醛 1,3-戊二酮 4-羟基-3-戊烯酮 丁酸 丙酸甲酯 OH OH 苯甲醇 对甲苯酚 7.2 有机化合物的立体异构现象 1874年,年轻的物理化学家范霍夫(J. H. Van ’t Hoff )和勒贝尔(J. A. Le Bel )根据有机分子的旋光性等实验事实,分别独立地发表论文提出碳的四价是指向四面体的四个顶点,即碳原子的四面体理论,打破了有机分子的平面结构理论,开创了有机分子立体结构的先河。以碳原子的四面体理论为基础的现代立体化学理论已经有了高度的发展和更加丰富的内涵。 立体异构体主要包括构象异构、几何异构和光学异构三大类。几何异构现象主要发生在环烷烃和烯烃分子中,光学异构则主要发生在具有手性特征的分子中,主要包括对映异构和非对映异构两类异构体。 7.2.1 构象异构 分子式相同,原子的结合顺序即构造式也相同,但由于σ单键的旋转使分子中的原子或者原子团在空间的位置或者取向不同。这种通过单键旋转而导致分子中原子或者原子团在空间的不同取向叫做构象,由此得到的不同空间结构叫做构象异构。比如乙烷中的两个甲基
苯甲酰胺的用途 医药中间体用于合成医药 1、N苄基二氧代噻唑烷基苯甲酰胺衍生物的制造中间体及其制造方法 2、新的吗啉代苯甲酰胺盐 3、苯甲酰胺衍生物及含有它们的药物 4、取代的2氨基苯甲酰胺天冬氨酸特异性半胱氨酸蛋白酶抑制剂及其应用 5、5氯2甲氧基N(2(4甲氧基3甲氨基硫代羰基氨基磺酰苯基)乙基)苯甲酰胺的钠盐的晶形 6、二氢茚基取代的苯甲酰胺、其制备方法、其作为药物的应用、和含有它们的药物制剂 7、苯甲酰胺衍生物、农业与园艺用杀虫剂及其用途 8、N(11二甲基乙基)4[[(5乙氧基4顺[2(4吗啉代)乙氧基]2氧代螺[环己烷13'[3H]吲哚]1'(2H)基]磺酰基]3甲氧基苯甲酰胺及其盐的新制备方法 9、包含苯甲酰胺衍生物作为活性成分的药物制剂 10、具有组蛋白脱乙酰酶抑制剂活性的苯甲酰胺制剂 11、多晶型的N[3[[2(34二甲氧基苯基)乙基]氨基]丙基]4硝基苯甲酰胺盐酸化物 12、苯甲酰胺和相关的因子X抑制剂 13、硝基一磺基苯甲酰胺类化合物 14、氨基苯甲酰胺的制备方法 15、杀虫的邻氨基苯甲酰胺 16、用于治疗疼痛的羟苯基哌嗪基甲基苯甲酰胺衍生物 17、用于治疗疼痛的喹啉基亚哌啶4基甲基苯甲酰胺衍生物 18、治疗疼痛的羟苯基亚哌啶4基甲基苯甲酰胺衍生物 19、(R)N[5甲基8(4甲基哌嗪1基)四氢2萘基]4吗啉代苯甲酰胺的新形态 20、联苯甲酰胺类化合物 21、新的胍基苯甲酰胺 22、作为降低脂质剂的联苯甲酰胺化合物 23、作为X因子抑制剂的羟苯甲酰胺衍生物 24、4胍基苯甲酰胺类抗生育化合物 25、4氟N(12二氢化茚2基)苯甲酰胺及其作为药物的用途 26、基于丙酰胺和吡啶基甲基苯甲酰胺衍生物的杀真菌组合物 27、邻氨基苯甲酰胺类化合物、其制备方法、其作为抗心律不齐剂的应用及其药物制剂 28、作为EGRF2和EGFR3抑制剂的选择性邻氨基苯甲酰胺吡啶酰胺 29、4(苯基哌啶4基亚基甲基)苯甲酰胺衍生物及其在治疗疼痛、焦虑或胃肠疾病中的用途 30、4(苯基哌啶4基亚基甲基)苯甲酰胺衍生物及其在治疗疼痛、焦虑或胃肠疾病中的用途 31、4(苯基哌啶4基亚基甲基)苯甲酰胺衍生物及其在治疗疼痛、焦虑或胃肠疾病中的用途 32、4(苯基哌啶4基亚基甲基)苯甲酰胺衍生物及其在治疗疼痛、焦虑或胃肠疾病中的用途 33、带有杂芳基磺酰基侧链的邻氨基苯甲酰胺、其制备方法、其用作药物或诊断剂的用途以及含有所述化合物的药物制剂 34、4(苯基(哌啶4基)氨基)苯甲酰胺衍生物及其在治疗疼痛、焦虑症或胃肠道疾病中的应用 35、4(苯基(哌啶4基)氨基)苯甲酰胺衍生物及其在治疗疼痛、焦虑症或胃肠病中的应用 36、4(苯基(哌嗪基甲基)苯甲酰胺衍生物及其在治疗疼痛、焦虑症或胃肠病中的应用 37、4(苯基(哌啶4基)氨基)苯甲酰胺衍生物及其在治疗疼痛、焦虑症或胃肠病中的应用
同分异构体的书写及判断专题 一、碳链异构 熟记C1-C6的碳链异构: CH4、C2H6、C3H8无异构体;C4H10 2种、C5H12 3种、C6H14 5种。 书写方法:减碳法 例1:C7H16的同分异构体共有几种 例2:相对分子质量100的烃分子结构中有4个甲基共有几种 例3:C9H20的烷烃众多同分异构体中有A B C三种,分别只能有且只有一种单烯烃加氢得到,则A B C的结构简式分别为 【方法小结】:主链由长到短,支链由整到散,位置由心到边,连接不能到端,排布对邻到间,对称碳上防重现。碳总为四键,规律牢记心间。 二、位置异构 1、烯炔的异构(碳链的异构和双键或叁键官能团的位置异构) 方法:先写出所有的碳链异构,再根据碳的四键,在合适位置放双键或叁键官能团。 例4:请写出C6H12的单烯烃主链4个碳的同分异构体 例5:C5H12O2的二元醇主链3个碳的有____种,主链4个碳的有____种 2、苯同系物的异构(侧链碳链异构及侧链位置“邻、间、对”的异构) 例6:请写出如C9H12属于苯的同系物的所有同分异构体 【注意】苯环上有两个取代基时有3种,苯环上连三个相同取代基有3种、连三个不同取代基有10种 3、烃的一元取代物的异构:卤代烃、醇、醛、羧酸、胺都可看着烃的一元取代物 方法:取代等效氢法(对称法)、烃基转换法 【取代等效氢法】 等效氢的概念: ①分子中同一个碳原子上连接的氢原子等效。 ②同一个碳原子上所连接的甲基上的氢原子等效。③分子中处于对称位置上的氢原子是等效的。如 分子中的18个H原子是等效的。 取代等效氢法的关键:观察并找出分子结构中的对称要素 例7、C3H7X ________种碳链,共有__________种异构体 C4H9X ________种碳链,共有_________种异构体 C5H11X ________种碳链,共有_________ 种异构体 【注意】这里的一元取代基X,可以是原子,如卤原子,也可以是原子团,如-OH、-NH2、-CHO、-COOH、HCOO-等。因此,已知丁基-C4H9有四种,则可断定丁醇、丁胺、戊醛、戊酸以及甲酸丁酯都有4种异构体。 《针对练习》 1、乙苯的异构体有4种,则对应环上的一氯代物的种数为() A.12种B.10种C.9种D.7种 2、菲和蒽互为同分异构体,菲的结构简式如右图,从菲的结构简式分析,菲的一氯取代物共有() A.4种B.5种C.10种D.14种 3.分子式为C11H16的一烷基取代苯的同分异体共有种 4.对位上有-C4H9的苯胺可能的同分异构体共有种,写出它们的结构简式: 5.含碳原数少于10的烷烃中,其中一卤代物不存在异构体的有4 种,它们分别是: 6.已知烯烃C6H12的一氯代物只有一种,则可断定该烯烃的分子结构为______________。 【烃基转换法】 概念方法:烃基转化法是先找出组成有机物的烃基种类,然后再写出它的同分异构体,这种方法适合于烃的衍生物,如根据丙基有2种结构,丁基有4种结构,戊基有8种结构,就可快速判断短链烃的衍生物的同分异构体种类。《针对练习》丁基异构的应用 (1)写出丁基的四种同分异构体: CH3CH2CH2CH2- (2)写出分子式为C5H10O的醛的各种同分异构体并命名: CH3-CH2-CH2-CH2-CHO 戊醛 (3)分子式为C5H12O的醇有种能被红热的CuO氧化成醛? 4、烃的二元(或三元、多元)取代物的异构 方法:有序法(定一移一)、换元法、 【有序法(定一移一)】 概念:有序法要求解决问题时遵循一定的特定线索和步骤去探索的一种思维方法。 应用有序法解决烃的多元取代物异构体问题的步骤顺序是:先写出碳链异构,再在各碳链上依次先定一个官能团,接着在此基础上移动第二个官能团,依此类推,即定一移一 例8:二氯丙烷有__________种异构体,它们的结构简式是: 《针对练习》 1.蒽的结构式为它的一氯代物有种,二氯代物又有种。 2.1,2,3-三苯基环丙烷的三个苯基可以分布在环丙烷环平面的上下,因此有如下两个异构体: 据此,可判断1,2,3,4,5-五氯环戊烷(假定五个碳原子也处于同一平面上)的异构体数目是() A.4 B.5 C.6 D.7 【换元法】 例9.已知C6H4Cl2有三种异构体,则C6H2Cl4有___________种异构体。(将H代替Cl) 《针对练习》 1.如图所示,C8H8分子呈正六面体结构,因而称为“立方烷”,它的六氯代物的 同分异构体共有_________种
同分异构现象和同分异构体: 1.概念:化合物具有相同的分子式.但结构小同,因而产生了性质上的差异,这种现象叫同分异构现象。具有同分异构现象的化合物互为同分异构体。 2.同分异构体的基本类型 (1)碳链异构:指的是分子中碳骨架不同而产生的同分异构现象。如所有的烷烃异构都属于 碳链异构。 (2)位置异构:指的是分子中官能团位置不同而产生的同分异构现象。如l一丁烯与2一丁 烯、l一丙醇与2一丙醇、邻二甲苯与间二甲苯及对二甲苯。 (3)官能团异构:指的是有机物分子式相同,但具有不同官能团的同分异构体的现象。常见 的官能团异构关系如下表所示:
(4)顺反异构:由于碳碳双键不能旋转而导致分子中原子或原子团在空间的排列方式不同所 产生的异构现象。两个相同的原子或原子团排列在双键的同一侧的称为顺式结构;两个相同的原子或原子团排列在双键的两侧的称为反式结构。如 同分异构体的写法: 1.烷烃的同分异构体的写法烷烃只存在碳链异构,其书写技巧一般采用“减碳法”,可概括为“两注意,四句话”。 (1)两注意:①选择最长的碳链为主链;②找出主链的中心对称线。 (2)四句话:主链由长到短、支链由整到散,位置由心到边,排布邻、间、对。 例如,C6H14的同分异构体可按此法完整写出(为了简便,在所写结构式中删去了氢原子):
2.烯烃的同分异构体的写法分子组成符合CnH2n的烃除烯烃外,还有环烷烃(n≥3),并且烯烃中双键的位置不同则结构不同,有的烯烃还存在顺反异构,所以烯烃的同分异构体比烷烃复杂得多。以C5H10为例说明同分异构体的写法: 共有5种烯烃,其中(2)还存在顺反异构体,5种环烷烃,共计11种。 3.苯的同系物的同分异构体的写法由于苯环上的侧链位置不同,可以形成多种同分异构体。
二甲基乙酰胺msds 安全技术说明书 化学品中文名:N,N-二甲基乙酰胺二甲基乙酰胺;乙酸二甲酰胺 化学品俗名或商品名:DMAC 英文名:N,N-Imethyl Acetamide,Acetic acid dimethyl amid , DMA 分子式:C4H9NO分子量:87.12 CAS号:127-19-5 RTECS:号:AB7700000 EC编号:616-011-00-4 主要用途:主要应用领域:聚酰亚胺、药物合成、合成纤维(腈纶和氨纶)。 第二部分危险性概述 危险性类别:可燃液体 二甲基乙酰胺侵入途径:蒸气吸入、皮肤及眼睛接触,皮肤吸收,食入。 健康危害:急性中毒主要有严重的刺激症状、头痛、焦虑、恶心、呕吐、腹痛、消化 道出血、便秘、肝损害及血压升高。可经皮肤吸收,对皮肤有刺激性。慢性作用有皮肤、粘膜刺激,神经衰弱综合症,血压偏低。尚有恶心、呕吐、胸闷、食欲不振、胃痛、便秘及肝大和肝功能变化。 环境危害:该物质对环境可能有危害,对水体应给予特别注意。 燃爆危险:遇明火,高热能引起燃烧爆炸。能与浓硫酸、发烟硝酸强烈反应,甚至发 生爆炸。与卤化物(如四氯化碳)能发生强烈反应。若遇高热,容器内压增大,有开裂和爆炸的危险。 第三部分成分/组成信息 有害物成分二甲基乙酰胺浓度99%CAS No.127-19-5 第四部分急救措施 皮肤接触二甲基乙酰胺:立即脱去污染的衣着,立即用流动清水彻底冲洗至少15分钟,就医。眼睛接触:立即提起眼睑,用大量清水彻底冲洗至少15分钟,就医。 吸入二甲基乙酰胺:迅速脱离现场至空气新鲜处。保持呼吸道畅通。呼吸困难时给输氧、呼吸停止 时,立即进行人工呼吸。就医。 食入二甲基乙酰胺:如误食了DMAC,不要人为诱发呕吐,而应立即喝几杯水,就医。 第五部分消防措施 危险特性:二甲基乙酰胺易燃,遇明火,高热能引起燃烧爆炸。该物质分解可产生二甲胺、乙酸。 在火灾中释放刺激性或有毒烟雾(或气体一氧化氮)。在高于70℃的环境中,气相与空气混合可形成爆炸性混合物。在铁存在下可与高度卤化的化合物,如四氯化碳或六氯化苯以及强氧化剂发生强烈的放热反应。若遇高热,容器内压增大,有开裂和爆炸的危险。 有害燃烧产物:二甲胺、乙酸、一氧化碳、二氧化碳、氮氧化物等。灭火方法:灭火剂:二氧化碳、泡沫、干粉、砂土。 第六部分泄露应急处理 防护措施:建议应急处理人员戴好防毒面具,穿一般消防防护服。
第四章立体异构现象
立体异构 构造异构 碳架异构 官能团位置异构 官能团异构 构型异构 构象异构 顺反异构 对映异构,又称旋光异构 CH 3CH 2CH 2CH 3CH 3CHCH 3 CH 3 CH 3CH CHCH 3 CH 2 CHCH 2CH 3CH 2 CH CH CH 2CH CCH 2CH 3 C C CH 3H CH 3 H C C H CH 3 CH 3 H H CH 3 H CH 3 H CH 3 CH 3 H H COOH OH CH 3 HO COOH H CH 3 H HH H H H H H H H H H
顺反异构 构造:分子中各原子的连接方式和连接次序 顺反异构体是分子中各原子的连接方式和次序相同,而分子中原子的空间排列方式不同,即分子构型不同,所以顺反异构是构型不同的化合物。由于构型不同而引起的异构现象又叫立体异构现象。
产生顺反异构的两个必要条件: ①分子中存在限制自由旋转的因素; ②两个不能自由旋转的碳原子各连有两个不同的原子或基团。 a ≠ b a 可以与d 或者e 相同,也可以不同; b 可以与d 或者e 相同,也可以不同。 d ≠ e 产生顺反异构的原因:分子中存在阻碍旋转的因素(双键、脂环)C C a b e d CH 3H CH 3 H CH 3H CH 3 H
顺式:两个不能自由旋转的碳原子上所连的两个相同的原子或 基团处于双键或脂环的同侧 (一)顺/反命名法 C C CH 3 H H CH 2CH 3C C H CH 2CH 3CH 3 H 顺-2-戊烯反-2-戊烯反式:两个不能自由旋转的碳原子上所连的两个相同的原子或 基团处于双键或脂环的异侧 cis -2-戊烯trans -2-戊烯
氰乙酰胺 1 分子结构 2 基本信息 中文名称:氰乙酰胺 英文名称:Cyanoacetamide 中文别名:氰基乙酰胺 英文别名:2-cyanoacetamide; Malonamide nitrile; 4,5-Dimethylresorcinol CAS号:107-91-5 分子式:C3H2N2O2 分子量:98.0602 3 物性数据 1. 性状:白色或黄色针状结晶或粉末。 2. 密度(g/mL,25℃):未确定 3. 相对蒸汽密度(g/mL,空气=1):未确定 4. 熔点(oC):121-122 5. 沸点(oC,常压):未确定 6. 沸点(oC, kPa):未确定 7. 折射率(D20):未确定 8. 闪点(oC):215 9. 比旋光度(oC):未确定 10. 自燃点或引燃温度(oC): 未确定 11. 蒸气压(mmHg, 20oC):未确定 12. 饱和蒸气压(kPa, 20oC):未确定 13. 燃烧热(KJ/mol):未确定 14. 临界温度(oC):未确定 15. 临界压力(KPa):未确定 16. 油水(辛醇/水)分配系数的对数值:未确定 17. 爆炸上限(%,V/V):未确定 18. 爆炸下限(%,V/V):未确定 19. 溶解性:微溶于水,溶于乙醇。 4 存储方法 1.储存于阴凉、通风的库房。远离火种、热源。应与氧化剂、还原剂、酸类、还原剂分开存放,切忌混储。配备相应品种和数量的消防器材。储区应备有合适的材料收容泄漏物。 2.本品试剂用玻璃瓶装,每瓶25g,应密封贮存。 5 合成方法 可由氰乙酸乙酯与氨作用制得。将氰乙酸乙酯冷却至200℃以下,加入浓氨水进行反应,得混合物由浊变清,在冷水中冷却20分钟后析出沉淀,经过滤、甩干后得粗品,然后将氰乙酰胺粗品加入沸腾的乙醇中,待其溶解后,再加入少量活性炭脱色精制,过滤,滤液冷却析出沉淀,经甩干后于80-100℃下干燥制得氰乙酰胺精品。 6 主要用途 用机合成原料,用于合成丙二腈和电镀液,还用于药物氨苯喋啶、氨蝶呤的合成。
高中化学同分异构现象同分异构体推导专题讲练 1 概念辩析(同分异构同一种物质同系物) 同分异构化合物具有相同的分子式,但结构不同的现象称为同分异构现象。具有同分异构现象的化合物互称为同分异构体。在中学阶段,引起同分异构的原因主要有三种:碳架异构、位置异构和官能团异构。识别两者是否是同分异构体,首先要查碳原子数,判别分子式是否相同,然后再看结构式。在分子式相同的情况下,若结构不同,则两者必为同分异构体。 同一种物质两者不仅分子式相同,而且结构也完全相同,则为同一种物质。同一种物质应具有相同的物理参数,如有相同的熔沸点。判断两结构是否相同方法有二:(1) 将分子整体翻转或沿对称要素(面、线)旋转后能“重合”者;(2)用系统命名法命名,所得名称相同者。 同系物结构相似,在分子组成上相差一个或几个-CH2原子团的物质互称同系物.结构相相似是指分子中含有官能团的种类和数目都要相同.如乙醇与丙醇为同系物,但乙二醇与丙三醇就不属同系物了。 若已知两结构式要判断它们是否具有相同的分子式,数不饱和度要比数氢原子数目快捷得多。在C.O.N.Cl等原子数对应相同的前提下,不饱和度相同的,分子式一定相同。如 HO Cl O Cl 两者C.O. Cl原子数相同,不饱度都是4,所以两结构式具有相同的分子式。而结构显然不同,因此两者应为同分异构体。 对于稠环芳香烃利用公用边数目来确定两个已知结构式的关系则很方便。在苯环数相同的前提下,若公用边数相同,且各苯环排列顺序又相同,则两者表示的是同一种物质;若公用边数相同,且各苯环排列顺序不相同,则两者表示的是同分异构体;若公用边数不同,则两者即不是同分异构体,也不是同一物物质。例见[练1-3]。 [练1-1]下列4式表示的是棉子象鼻虫的四种的信息素的结构简式,其中互为同分异构体是(③④) 解析:②中含10个碳原子,①③④都有11个碳原子,③含一个-CH2OH,比①式(含一个-CHO)多二个氢,故①③不是同分异构体。③④分子式相同,但③式是一个六元环,④式是一个四元环,两者结构不同,故互为同分异构体。 [练1-2] 下列各组物质中属于同分异构体的是⑴⑶,属于同系物的是⑵,既不是同系物又不同分异构体的是⑷,属于同一种物质的是⑸。 ①⑤ ②乙酸和硬脂酸③硝酸乙烷和氨基乙酸④苯甲酸和对苯二甲酸 解析:①组属于同分异构体,分子式都是C7H8O,但前者属芳香醇,后者属酚;②组属同系物,同属一元脂脂酸系列,分子组成相差16个-CH2;③是同分异构体,要掌握同碳数的硝基烷和氨基酸是互为类别异构; ④组两者含碳数不同,不是同分异构体,两者虽都有含羧基-COOH,但含有羧基数不同,也不属同系物。 ⑤组要注意到C-C单键可绕键轴旋转,故两结构式是相同,表示的是同一种物质。 [练1-3] 萘分子的结构可以表示为或,两者是等同的。苯并[α]芘是强致癌物质(存在于烟囱灰、煤焦油、燃烧的烟雾和内燃机的尾气中)。它的分子由5个苯环并合而成,其结构式可以表示为(Ⅰ)或(Ⅱ)式:
实验十 乙酰丙酮互变异构现象的研究 一、实验目的 通过对互变异构体的核磁共振谱图的测定与分析,计算互变异构反应的平衡常数与自由焓,从而了解NMR 还可用于研究分子动态平衡过程及获取有关热力学参数。 二、实验原理 NMR 可研究化学动态学问题。它不仅可以跟踪化学反应过程,还可研究平衡体系中的交换过程等。NMR 是利用射频场来观测事物的,对于100 MHz 工作的仪器,射频场的频率在108 Hz ,人们将10-8 s 及更长的时间的区间称为NMR 时标。对于寿命为NMR 时标的物种的转变过程用NMR 来研究特别适宜,这样的过程包括许多平衡体系中的动态交换过程,比如同一分子存在的构象的转变、互变异构体间的转变、分子内转移、配体与配合物(或配离子)之间的交换等过程。在不同的实验条件下,如不同温度下,这些交换过程的NMR 图谱(峰位、峰形、峰面积等)会有很大的差异。当交换核的共振信号表现为分立而又无加宽时,在NMR 的时标上被认为是慢的化学交换过程。酮的烯醇化是常见的互变异构反应,1,3-二酮有如下互变异构反应: K =[烯醇式][酮式] 这是一个慢速反应过程,当利用化学位移差别较大的酮式亚甲基氢和烯醇式基烯基氢的峰面积A 来定量时,可按下式计算烯醇式所占质量分数w 及平衡常数K : A w A A =+(烯醇 )(烯醇)(烯醇)(酮式)/2 A K A = (烯醇)(酮式)/2 由K 推算互变异构反应的自由焓?G : ?G= - RT ln K 互变异构体中酮式和烯醇式的相对含量与分子结构、浓度、溶剂的极性及温度等因素有关。通常,在极性溶剂中,易形成分子间氢键,酮式异构体相对更稳定,如水中的乙酰丙酮烯醇式大约占15%;在非极性溶剂中,易形成分子内氢键,因此烯醇式异构体更稳定,占主要成分,如在正己烷中大约占92%。
硫代乙酰胺 硫代乙酰胺,化学品。用于生产催化剂、稳定剂、阻聚剂、电镀添加剂、照相药品、农药、染色助剂和选矿剂等。另外,使用硫代乙酰胺时一定要小心,因为该化学品能损伤肝脏。 CAS: 62-55-5 简称:TAA 分子式: CH3CSNH2 分子量: 75.13 熔点: 133-134℃ 中文名称: 硫代乙酰胺 乙硫酰胺 性质描述: 无色或白色结晶。熔点 133-134℃,25℃水中的溶解度16.3g/100ml,乙醇26.4g/100ml。极微溶于苯、乙醚。其水溶液在室温或50-60℃时相当稳定,但当有氢离子存在时,很快产生硫代氢而分解。新制品有时有硫醇臭、微吸潮。 生产方法: 乙腈与硫化氢反应,或使乙酰胺与五硫化二磷反应可制得硫代乙酰胺。 用途: 用于生产催化剂、稳定剂、阻聚剂、电镀添加剂、照相药品、农药、染色助剂和选矿剂等。也用作聚合物的硫化剂、交联剂、橡胶助剂和医药原料。 除此之外,使用硫代乙酰胺时一定要小心,因为本品能损伤肝脏[1]。 硫化氢气体具有毒性和臭味,实验时常用新配制的H2S饱和水溶液或硫代乙酰胺作为代用品。 硫代乙酰胺的化学性质(1)在酸性溶液中,硫代乙酰胺水解生成H2S,可代替H2S沉淀第II组阳离子。水解反应如下: CH3CSNH2+H2O CH3CONH2+H2S 长时间煮沸,CH3CONH2进一步水解: CH3CONH2+H2O<==>CH3COONH4 (2)在碱性溶液中,硫代乙酰胺水解生成S2-,可以代替Na2S使用,水解反应如下: CH3CSNH2+3OH-<==>CH3COO-+NH3+S2-+H2O (3)在氨溶液中,硫代乙酰胺水解生成HS-,可以代替(NH4)2S沉淀第III组阳离子。水解反应如下: CH3CSNH2+2NH3<==>CH3C(NH2)NH+NH+4+HS- 硫代乙酰胺的水解速度随温度升高而加快,反应一般在沸水浴中进行。在碱性溶液中其水解速度较在酸性溶液中为快。
同分异构现象----立体异构 一、构象异构 定义:构象异构:由于单键的自由旋转使分子中的原子或原子团在空间产生不同的排列形式。特点:由于单键的自由旋转,乙烷可以有无数的构象 优势构象:是交叉式 稳定性顺序: 对位交叉式> 邻位交叉式> 部分重叠式> 全重叠式
a C a C b d a C a C d b C * COOH H H 3C OH 二、构型异构 (一)顺反异构 1、产生条件:①分子中存在限制旋转的因素,如双键或脂环。②每个不能自由旋转的碳原子必须连有2个不同的原子或原子团。 2、顺反异构命名:2个相同原子或原子团处于 π 键或脂环平面同侧的异构体称为顺式,处于异侧的称为反式。 3、E 命名法:先根据次序规则确定连接在双键碳原子上的原子或原子团的大小顺序。当2个较大的原子或原子团在双键的同侧时,为Z 构型 ,在异侧的为E 构型。 ● E 命名法次序规则 a) 与双键直接相连的原子按原子序数大小排列,序数大的为大基团;同位素按质量大小排列(如D > H ) b) 如与双键碳直接相连的2个原子相同,则向外延伸,比较其次相连原子的原子序数,以确定原子团的 大小序数。 c) 当与双键相连的为不饱和基团时,如 ,看作碳2次与氧相连。例如 (二)对映异构 定义:两个分子成镜面对称,但又不能完全重叠,我们把这两个分子称为一对对映体,它们成对映异构(或旋光异构)。 1、手性 手性:实物与镜像不能完全重叠的性质叫手性。具有手性的分子叫手性分子。 ● 只有手性分子才有旋光异构现象。 ● 有机化合物分子具有手性。最普遍的因素有手性碳C* ● 手性碳原子是指连接4个不同的原子或原子团的碳原子 2、外消旋体与对映体 乳酸有两种构型(如下),它们互为实物与镜象,称为对映体, 等量的这两种构型的混合物称为外消旋体。 C O H
同分异构现象--- 立体异构 一、构象异构 定义:构象异构:由于单键的自由旋转使分子中的原子或原子团在空间产生不同的排列形式。特点:由于单键的自由旋转,乙烷可以有无数的构象 优势构象:是交叉式
稳定性顺序: 对位交叉式> 邻位交叉式> 部分重叠式> 全重叠式
二、构型异构 (一)顺反异构 1、产生条件:①分子中存在限制旋转的因素,如双键或脂环。②每个不能自由旋转的碳原子必须连有2个不同的原子或原子团。 a b a C C C C a d a b 2、顺反异构命名:2个相同原子或原子团处于π 键或脂环平面同侧的异构体称为顺式,处于异侧的称为反式。 3、E命名法:先根据次序规则确定连接在双键碳原子上的原子或原子团的大小顺序。当2个较 大的原子或原子团在双键的同侧时,为Z构型,在异侧 的为E构型。
*C ●E命名法次序规则 a) 与双键直接相连的原子按原子序数大小排列,序数大的为大基团;同位素按质量大小排列 (如D > H) b) 如与双键碳直接相连的2个原子相同,则向外延伸,比较其次相连原子的原子序数,以确 O 定原子团的大小序数。C H c) 当与双键相连的为不饱和基团时,如,看作碳2次与氧相连。例如 (二)对映异构 定义:两个分子成镜面对称,但又不能完全重叠,我们把这两个分子称为一对对映体,它们 成对映异构(或旋光异构)。 1、手性 H H C * C COOH 3 手性:实物与镜像不能完全重叠的性质叫手性。具有手性的分子叫 手性分子。OH ●只有手性分子才有旋光异构现象。 ●有机化合物分子具有手性。最普遍的因素有手性碳C* ●手性碳原子是指连接4个不同的原子或原子团的碳原子 H H 2、外消旋体与对映体 乳酸有两种构型(如下),它们互为实物与镜象,称为对C* 映体,等量的这两种构型的混合物称为外消旋体。 3. 如何表示对映体的构型? 费歇尔(Fisher)投影式:主链放在竖键上,编号最小的碳 原子放在上端。竖键连接的原子或原子团表示伸向纸的 后方,横键连接的原子或原子团表示伸向纸的前方。 CH3 OH COOH COOH OH CH3
第2课时有机化合物的同分异构现象及结构与性质的关系 1.理解同分异构现象与同分异构体。(重难点) 2.掌握有机化合物结构与性质的关系。(重点) [基础·初探] 1.同分异构体 分子式相同而结构不同的有机化合物,互为同分异构体。 2.同分异构体的类型 (1)相对分子质量相同的两种化合物互为同分异构体。( ) (2)H2O和H2O2互为同分异构体。( ) (3)同分异构体之间的转化属于化学变化。( ) (4)同系物之间可以互为同分异构体。( ) 【提示】(1)×(2)×(3)√(4)× [核心·突破] 1.同分异构体的书写 (1)以C7H16为例书写烷烃同分异构体
【特别提醒】 1.烷烃的同分异构体只有碳骨架异构,CH 4、C 2H 6、C 3H 8不存在同分异构体。
2.检查书写的同分异构体是否重复时,可先命名,若名称不重复,则书写不重复。 2.同分异构体数目的判断方法 (1)基元法 记住常见烃基的异构体种数,可快速判断含官能团有机化合物同分异构体的数目。 -C3H7有两种,-C4H9有4种,-C5H11有8种,如C4H9Cl、C4H9OH、C4H9-CHO等各有4种同分异构体。 (2)换元法 如:若C3H8的二氯代物有四种同分异构体,则其六氯代物的同分异构体也为四种(H和Cl相互替代)。 (3)定一(或二)移一法 对于二元取代物的同分异构体的判定,可固定一个取代基位置,再移动另一取代基,以确定同分异构体数目。 (4)对称法(又称等效氢法) 等效氢法的判断可按下列三点进行: ①同一甲基上的氢原子是等效的。 ②同一碳原子上所连甲基上的氢原子是等效的。 ③处于镜面对称位置上的氢原子是等效的(相当于平面成像时,物与像的关系) [题组·冲关] 题组1 同分异构体的判断 1.下列各组有机物中,互为同分异构体的是( )
异构现象和立体化学 具有相同分子式而有不同的分子结构、性质相异的化合物叫做同分异构体。 1.构造异构 分子式相同而构造式不同,即分子中原子互相连接的方式和次序不同,称构造异构。有碳架异构、位置异构、官能团异构、互变异构。 H10的烃中没有—CH2—,这个化合物的构造式如何? 【例1】C 4 解:C H10有二个碳架异构体:B.CH3CH2CH2CH3,故答案为A。 4 H8,某一溴代化合物有2种,其二溴代化合物有几种? 【例2】某有机化合物分子式为C 10 解:此化合物为萘。其一溴代物有两种位置异体、 ;其二溴代物有 10种位置异构体。 【例3】丁醇的同分异构体是哪一个? A.2-丁酮B.乙酸乙酯C.丁酸D.乙醚 CH2CH2CH2OH和乙醚CH3CH2OCH2CH3分子式相同,均为C4H10O,但官能团不同,解:丁醇CH 3 为官能团异构,故答案为D。 【例4】写出乙酰乙酸乙酯(Ⅰ)、硝基甲烷(Ⅱ)的互变异构体。 解:
β-酮酯类以及脂肪硝基化合物在酸或碱催化作用下,有酮式和烯醇式异构体同时存在,并迅速互变,构成动态平衡体系,称互变异构体。它们在化学上可以区分,并能各自分离成纯物质,其差异在于电子分布和某一相对流动原子或基团位置不同(大多数情况下是H)。能使烯醇式稳定的因素有:(1)能使双键稳定的因素,如C=O或Ph能与C=C双键共轭;(2)分子内氢键的形成。 2.立体异构 构造式相同但原子或基团在空间的排列不同(即构型不同)产生的异构现象叫立体异构。如顺反异构、对映异构。 (1)顺反异构 分子中存在双键或环等限制旋转的因素,使分子中某些原子或基团在空间位置不同,产生顺反异构现象。双键可以是C=C、C=N、N=N。双键产生顺反异构体的条件是双键两端每个原子所连二基团或原子不同。 【例1】下列物质哪一个可能以顺反异构体形式存在? A.C2H3Cl;B.C2H4Br2;C.C2H2Cl2;D.C6H4C12 =CHCl有一个C原子上所连二个原子相同,B.均为σ键可自由旋转,D.取解:C。因为A.CH 2 代苯只有位置异构,所以均不能产生顺反异构体。而C.有两种位置异构体,其中CH =CCl2的C原子 2 上所连二个基团相同,无顺反异构体;而CHCl=CHCl每个C原子上所连二个基团均不相同,故有顺反异构体。 (2)对映异构(旋光异构) 对映异构仅存在于具有手性的分子中,一个分子与其镜像不能重合叫手性分子。Van't Hoff总结了很多系列观察结果,提出判断分子是否具有手性的结论如下: X,CH2X2或CH2XY只有一种化合物,为非手性分子。 ①通式CH 3 ②通式CHXYZ(H、X、Y、Z均不相同)有二个对映异构体,为手性分子。即当一个C原子上连
同分异构体总结 一、同分异构体的数量判断: (1)烷烃的同分异构体的数量统计: 方法:采用减碳法统计、口诀:碳链由多到少、支链由整到散、支链位置由中间到两端。 注意点:(1)注意碳链的对称性、对称性相同的原子取代基取代的产物为同种物质 (2) 甲基不能在末端、乙基不能在倒数第二个碳原子上、依次类推 (3) 中间碳原子上每个最多有两个取代基 例题:找出C 7H 16的全部同分异构体 ① C — C — C —C — C — C — C 一种 C — C — C — C —C — C 取代基为一CH 3 (注意甲基不能在末端、同时注意对称性) a 3 3 a a 和3都可以取代共两种 C — C — C — C —C 取代基为一CH 2CH 3时有3 —种(乙基不能在末端及第二个碳原子上) 取代基为两个 一CH 3时有 a 1 a 1、a 13、a 1 a 2 >33四种(注意对称性) 取代基不能为 一CH 2CH 3 (乙基不能在末端及第二个碳原子上) 取代基为三个 一 CH 3,有a 1 a 1 a 2 一种(注意对称性) 所以共有:1+2+5+1=9种 练习:找出C 8H 18的全部同分异构体(18种) (2 )烯烃、炔烃、卤代烃、醇酚、醛酮、羧酸、酯的同分异构体 方法:(1 )先用减碳法写出所有的可能骨架类型 (2 )在碳骨架上插入官能团、注意官能团的插入的要求: ① 组成C=C 的两个碳原子不能有季碳(与四个碳原子相连的碳) ② 组成C 三C 的两个碳原子不能有季碳和叔碳(与三个碳原子相连的碳) ③ 一X 、—OH 的插入位置可以在两端的碳原子上、但不能在季碳上 ④ 一CHO 、— COOH 应该在碳链的末端、酮 0 应该在非两端的无取代基的仲碳上 —C — ⑤ 酯的同分异构体可以用生成酯的醇和羧酸的同分异构体数目相乘得到 ⑥ 插入官能团时注意对称性、避免重复计数 例题一:找出分子式为 C 5H 10的烯烃 解:先找碳骨架 Y P a C — C — C — C 丨 C 碳原子不是末端碳原子就是季碳原子、故没有烯烃 共有2+3=5种 C — C — C — C —C a 3 3 a a 、B 两个位置可以插入碳碳双键(注意对称性) 共两种 a 1 3 a 2 共1+4=5种 C — C — C — C a 、3、丫位可以插入碳碳双键 共三种
同分异构现象 学习目标: 1、以同分异构现象为例,认识物质的多样性与微观结构有关系。 2、以正丁烷和异丁烷、乙醇和二甲醚为例,认识有机物的同分异构现象 教学重点: 以C 4H 10、C 2H 6O 等同分异构体为例认识由于微观结构的不同从而导致的同分异构现象。 教学难点:同分异构体的概念,及其与几个相近概念的辨析。 学习过程: [复习回顾]1、 ?2 11 1为什么关系和H H (同位素,体现在质子数相同) 2、氧气和臭氧是什么关系?(同素异形体,体现在元素相同) 3、Fe 2O 3和Fe 3O 4的组成元素完全相同,它们是同素异形体吗? 依据碳原子和氢原子的价键规律,请你思考一下你可以拼成几种分子式符合C 4H 10的结构? [新课学习] [问题1] 依据碳原子和氢原子的价键规律,请你思考一下你可以拼成几种分子式符合C 4H 10 的结构? [小结]你们可以作出几种不同的分子结构模型? 对比两个模型,找找它们的联系? [课堂练习]:书写两种丁烷的结构简式。 ,但是空间结构 。同分异构现象: 同分异构体: [问题2] 两种丁烷空间结构不同,那么性质是否不同? 结论:同分异构体间性质有无差异? [问题3] 分子式为C 2H 6O 的有机物可以有几种不同的结构形成不同的化合物? [课堂练习]:书写分子式为C 2H 6O 两种结构简式。 [问题4] 能不能总结一下有机物种类繁多的原因是什么呢? [小结]
同位素 同素异形体 同分异构体 概念 研究对象 结构 物理性质 化学性质 判断规律 举例 课堂小结: 课堂限时练习: 1.下列各组物质中互为同分异构体的是 ( ) A. 1 H 与2 H B.O 2与O 3 C.甲烷与正丁烷 D.正丁烷与异丁烷 2.属于同分异构体的是 ( ) A.O 2和O 3 B. 2 H 2和3 H 2 C.H 2O 与H 2O 2 D.C 2H 5COOH 与CH 3COOCH 3 3.当今化学界关注的热点之一的C 60,它可以看成是石墨的 ( ) A.同素异形体 B.同分异构体 C.同位素 D.同一物质 4.据报道,科学家已成功合成了少量N 4,有关N 4的说法正确的是 ( ) A.N 4是N 2的同素异形体 B.N 4是N 2的同分异构体 C.相同质量的N 4和N 2所含原子个数比为1∶2 D.N 4的摩尔质量是56 g 5.下列化学式中,只表示一种纯净物的是 ( ) A.C B.CH 4 C.C 2H 6O D.C 4H 10 6.下列说法中正确的是 ( ) A .只含有一种元素的物质一定是纯净物 B .石墨转变为金刚石为化学变化 C .有单质参加的反应一定是氧化还原反应 D .相对分子质量相同的不同物质一定是同分异构体 7.有下列各组物质: A 、水银和汞 B 、 C C 13 612 6和 C 、红磷 、白磷 D 、金刚石与石墨 E 、 CH 3CH 2CHO(丙醛) CH 3COCH 3(丙酮) F 、氯水和液氯 (1)互为同位素的是________ (2)互为同分异构体的是________ (3)互为同素异形体的是________(4)属于同一物质的是________