
乙烯 烯烃
[教学目标]:
1. 使学生掌握乙烯的分子组成、结构式和空间结构;
2.使学生了解乙烯的物理性质和主要用途,掌握乙烯的化学性质和实验室制法;
3.使学生了解加成反应和聚合反应以及不饱和烃的概念;
4. 使学生了解烯烃在组成、结构、重要的化学性质上的共同点,以及物理性质随分子中的碳原子数目的增加而变化的规律性.
[教学重点]: 乙烯的化学性质、乙烯的实验室制法. [教学难点]: 乙烯的结构特点决定它的化学性质
[教学过程]:
一.乙烯的分子组成和结构.
[复习]:写出乙烷的分子式、电子式、结构式、结构简式.
[过渡]:在乙烷的球棍模型中去掉两个氢原子后就可以得到乙烯,那么在乙烯分子中碳、氢原子之间是如何结合的呢?写出乙烯的分子式、电子式、结构式、结构简式.
分子式:C 2H 4 电子式:
H
:C H ::C :H H
???
?
结构式:
H
C
H C
H
H -=-
|| 结构简式:CH 2 = CH 2
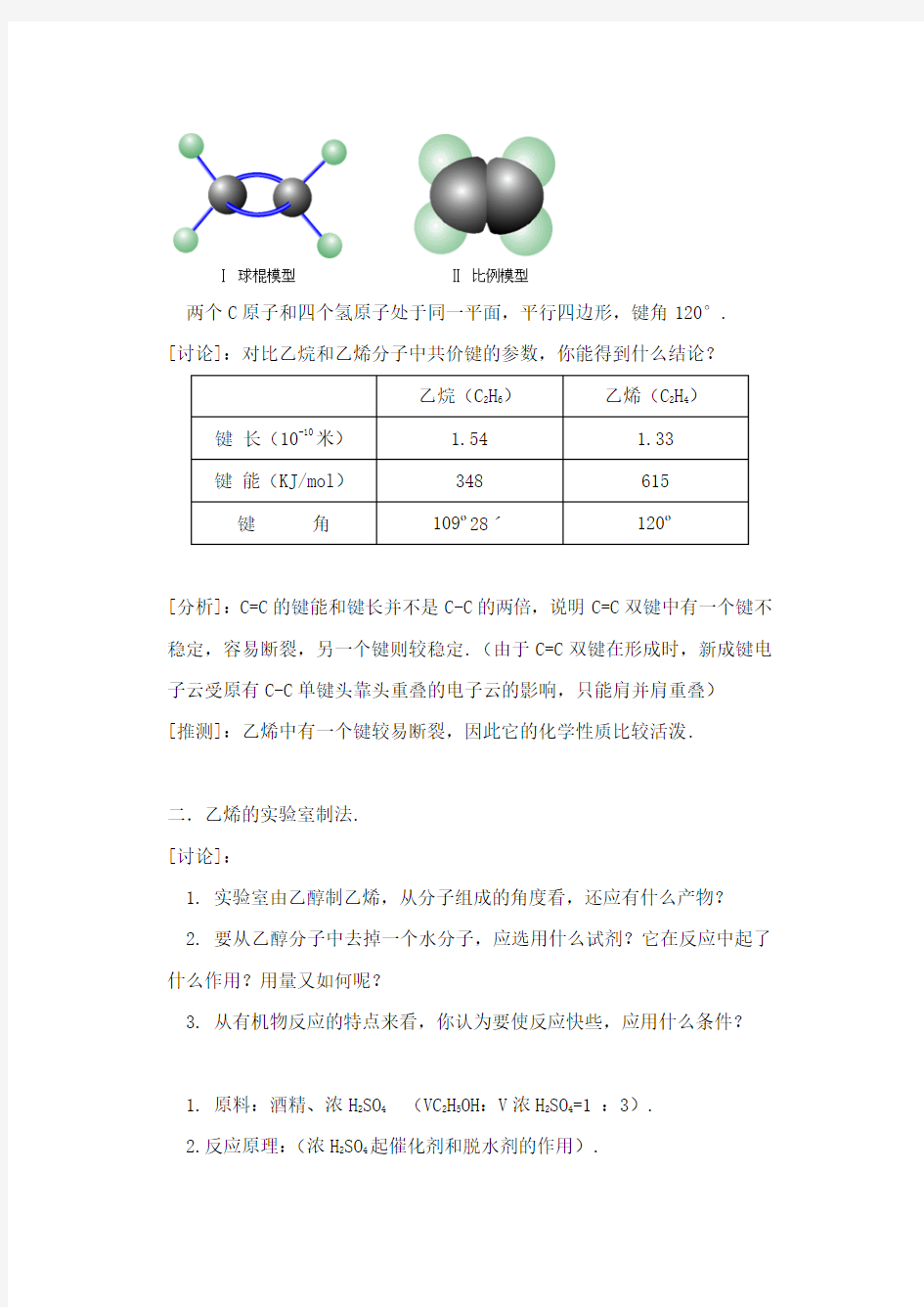
展示乙烯的球棍模型和比例模型:
两个C原子和四个氢原子处于同一平面,平行四边形,键角120°. [讨论]:对比乙烷和乙烯分子中共价键的参数,你能得到什么结论?
乙烷(C2H6)乙烯(C2H4)键长(10-10米) 1.54 1.33
键能(KJ/mol)348 615
键角109o28ˊ120o
[分析]:C=C的键能和键长并不是C-C的两倍,说明C=C双键中有一个键不稳定,容易断裂,另一个键则较稳定.(由于C=C双键在形成时,新成键电子云受原有C-C单键头靠头重叠的电子云的影响,只能肩并肩重叠)
[推测]:乙烯中有一个键较易断裂,因此它的化学性质比较活泼.
二.乙烯的实验室制法.
[讨论]:
1. 实验室由乙醇制乙烯,从分子组成的角度看,还应有什么产物?
2. 要从乙醇分子中去掉一个水分子,应选用什么试剂?它在反应中起了什么作用?用量又如何呢?
3. 从有机物反应的特点来看,你认为要使反应快些,应用什么条件?
1. 原料:酒精、浓H2SO4(VC2H5OH:V浓H2SO4=1 :3).
2.反应原理:(浓H2SO4起催化剂和脱水剂的作用).
3.装置原理:
(1).应选用怎样的装置制取乙烯呢?与以前学的哪种制气装置相似?(液+液
?→??气,发生装置和制氯气、氯化氢相似) (带支管的烧瓶叫做蒸
馏烧瓶)
(2).为何加入碎瓷片? (有机物的沸点较低,加入碎瓷片防止液体剧烈沸腾,即防止暴沸)
(3).温度计有何作用?温度计的水银球应插在什么位置合适?(瓶底、溶液中、液面上)为什么?(温度计水银球放在溶液中控制溶液的温度在170℃以减少副产物的生成) (4).如何收集?(排水集气法) 4.操作原理:
(1).安装顺序如何?(由下到上,由左到右)
(2). 酒精、浓H 2SO 4应如何混合?为什么?(先加酒精、后加浓H 2SO 4) (3).实验完毕,是先撤酒精灯,还是先撤导管?(先移导管后灭灯) 用制得的乙烯进行其性质实验.
三.乙烯的性质.
1. 物理性质:无色稍有气味的气体,比空气略轻,难溶于水.
2.化学性质. (1).氧化反应:
KJ 1411)l (O H 2)g (CO 2)g (O 3)g (H C 22242++??→?+点燃
CH 3CH 2OH CH 2
+ H 2O
浓H 2SO 4
170℃
CH 2
(产生黑烟是因为含碳量高,燃烧不充分;火焰明亮是碳微粒受灼热而发光)
CHO CH 2O CH CH 232
22催化剂加热加压
+= (PdCl 2-CuCl 2作催化剂)
(2).使高锰酸钾溶液褪色. 2.加成反应: 乙烯可使溴水褪色.
Br
|H
C
|H Br |C H |
H Br Br
H
C |H
C H |H ---?→
?-+-=-
1,2-二溴乙烷
从上述反应可知:乙烯分子里的双键里的一个键易于断裂,两个溴原子分别加在两个价键不饱和的碳原子上,生成了二溴乙烷.(此反应可区别甲烷和乙烯)
加成反应——有机物分里不饱和的碳原子跟其它原子或原子团直接结合生成别的物质的反应叫做加成反应.
如:
OH
CH CH O H CH CH Cl CH CH HCl CH CH Cl
CH Cl CH Cl CH CH CH CH H CH CH 232222322222223
3222--??→?+=-?→?+=-?→?+=-??→?+=?
加热加压
催化剂催化剂
3.聚合反应:
??→?=催化剂22CH nCH [ CH 2- CH 2 ]n
聚乙烯
由分子量小的化合物(单体)生成分子量很大的化合物(高分子化合物)的反应叫聚合反应.生成聚乙烯的反应可以看成是连续的加成反应,所以称为加聚反应.
加聚反应的实质是:不饱和键的断裂和相互加成.不论加成还是聚合,根本原因都是含有不饱和的C=C双键
[补充知识]:聚合反应中,又分为加聚反应和缩聚反应.由不饱和的单体分子相互加成且不析出小分子的反应,叫加聚反应;单体间相互反应而生成高分子,同时还生成小分子(如水、氨、氯化氢等)的反应叫缩聚反应.
聚乙烯是一种重要的塑料,如食品袋。
聚合反应中的单体、链节和聚合度
单体链节聚合度
四.乙烯的用途.
制取酒精、橡胶、塑料等,并能催熟果实.
乙烯的产量是衡量一个国家(石油化工)工业发展水平的标准.
五.烯烃.
1.结构特点和通式:
链烃分子里含有碳碳双键的不饱和烃,叫烯烃.
组成结构:均含有双键、组成上相差一个CH2原子团.
单烯烃的通式:C n H2n(n≥2)
二烯烃的通式:C n H2n-2(n≥3)
2.物理性质:碳原子数小于或等于4的烯烃在常温下是气态,熔沸点随碳原子数目的增加而增大.
3.化学性质:跟乙烯相类似.
(1).燃烧时火焰较烷烃明亮(含碳量高).
(2).分子里含有不饱和的双键,容易发生氧化、加成和聚合反应.
[补充知识]:烯烃的命名:与烷烃命名类似,但不完全相同.
①.确定包括双键在内的碳原子数目最多的碳链为主链.
②.主链里碳原子的依次顺序从离双键较近的一端算起.
③.双键的位置可以用阿拉伯数字标在某烯字样的前面. 又如:
CH3CH=CHCH-CH3 4-甲基-2-戊烯
CH3
[练习]:下面我们以戊烯为例练习烯烃的同分异构体的写法和命名.
(1).CH3CH2CH2CH=CH2 1-戊烯
(2).CH3CH2CH=CHCH3 2-戊烯
(3).CH3CH2C=CH2 2-甲基-1-丁烯
CH3
(4).CH3CH=C-CH3 2-甲基-2-丁烯
CH3
(5). CH2=CH-CH-CH3 3-甲基-1-丁烯
CH3
第三节乙烯和烯烃 教学目标: 1.乙烯的分子结构。 2.乙烯的物理性质、乙烯的化学性质(加成、氧化、聚合)。加成反应的概念,聚合反应、加聚反应的概念 3.实验室制取乙烯的原理、装置、操作要领、注意事项等 4.乙烯的用途(乙烯于人类生活的意义)。 5.烯烃的概念,烯烃的性质。 教学重点: 乙烯的化学性质。 教学难点: 乙烯的加成反应。第一课时 一、乙烯的分子结构(展示乙烯的球棍模型和比例模型)乙烯是一个平面型分子,即“六点共面”:二个 单键,它们彼此之间HC-C=CC原子和四个H原子均在同一平面内,有一个双键和四个 o。的键角约为120 乙烯共价键参数: 乙烷乙烯-10-10 1.33×10101.54×键长(m)28' o 约120o109键角 348 kJ/mol键能()615 通过乙烯与乙烷分子中键长、键能等数据的比较,可以看出乙烯分子结构中碳碳双键(C=C)键长小于碳碳单键(C-C);键能大于单键键能,但小于单键键能的两倍,结合乙烯的性质可认为双键中,两个键并不等同,其中一个键较稳定,另一个键较不稳定。从而说明乙烯的双键中有一个键容易断裂,这是乙烯化学性质比乙烷活泼的理论根据,这就在本质上加深了烯烃重要性质— 加成反应和加聚反应的认识, 进一步理解分子结构与性质的辩证关系。另外由于乙烯中存在碳碳双键结构,双键不能扭曲、旋转,这一点与乙烷有很大差异。 二、实验室制乙烯的原理、装置及注意事项:
1.药品:乙醇和浓硫酸(体积比:1∶3) 2.装置:根据反应特点属于液、液加热制备气体,所以选用反应容器圆底烧瓶。需要控制反应物温. 度在反应物170℃左右,所以需要用温度计且温度计水银球浸入液面以下,但又不能与烧瓶底部接触。由于有气体生成,所以需要在烧瓶中加入沸石(碎瓷片)防止暴沸。 3.反应原理: 浓HSO作用:既是催化剂又是脱水剂,在有机物制取时,经常要使用较大体积比的42浓硫酸,通常都是起以上两点作用。 4.收集:乙烯难溶于水,且由于乙烯的相对分子质量为28,仅比空气的相对平均分子质量29略小,故不用排气取气法而采用排水取气法收集。 5.气体净化:由于在反应过程中有一定的浓硫酸在加热条件下与有机物发生氧化一还原反应使生成的气体中混有SO、CO,将导致收集到的气体带有强烈的刺激性气味,因22此收集前应用NaOH溶液吸收SO、CO。226.注意事项:要严格控制温度,应设法使温度迅速上升到170℃。因为温度过低,在140℃时分子间脱水而生成过多的副产物乙醚(CH-CH-O-CH-CH)。温度过高,浓3322HSO使乙醇炭化,并与生成的炭发生氧化一还原反应生成CO、SO等气体。2422三、乙烯的重要性质 1.乙烯能使溴水和酸性KMnO溶液褪色,这是检验饱和烃与不饱和烃的方法。但两4者的反应类型是不同的,前者是加成反应,后者是氧化反应。加成反应有二个特点:①反应发生在不饱和的C=C键上,双键中的不稳定的共价键断裂,不饱和的C原子与其它原子或原子团以共价键结合。乙烯可以与多种物质发生加成反应,例如卤素单质、卤化氢、水、氢气等。②加成反应后生成物只有一种(不同于烷烃的取代反应)。 乙烯通过溴水,现象:溴水褪色 1,2一二溴乙烷(液态) 乙烯与氢气加成 乙烯与氯化氢加成: 溴乙烷.
第二节来自石油和煤的两种基本化工原料 第1课时 【教材内容分析】 乙烯和苯是两类烃的重要代表物。学习了甲烷和烷烃的性质,学生能初步从组成和结构的角度认识甲烷的性质,但需要对“结构与性质”的关系进一步强化认识;乙烯和苯的教学都能起到这种作用。另外,学生能从生活实际出发,认识乙烯和苯的广泛应用,再学习它们的性质,强化理论与实际的联系,使学生能够学以致用。 【教学目标设定】1、了解乙烯是石油裂化产物 2、探究乙烯分子的组成、结构式;掌握乙烯的典型化学性质,掌 握加成反应 3、了解乙烯的的用途(乙烯于人类生活的意义) 【教学重点难点】乙烯的加成反应、乙烯结构与性质的关系 【教学过程设计】 【引入】右图为刚刚摘下不久的香蕉和成熟 的香蕉,掺在一块放置几天的结果是香蕉已 经全部变黄。为什么刚刚摘取不久的青香蕉 与较熟的香蕉保存在一块就都变黄了呢? 这就是我们今天要学习的乙烯的功劳。 【板书】第二节来自石油和煤的两种基本 化工原料――乙烯 我们常说煤是工业的粮食,石油是工业的血 液,从煤和石油不仅可以得到多种常用燃 料,而且可以从中获取大量的基本化工原料。乙烯就是一种最重要的石油化工产品,也是重要的石油化工原料。衡量一个国家化工产业发展水平的标志是什么?(乙烯的产量)乙烯在化学工业上有哪些重要的用途? 参照课本P58思考与交流中乙烯的用途 【教师】到底乙烯是怎样的物质呢?能否从石油中得到乙烯? 从石油分溜中得到的石蜡油进一步加热会得到什么呢? 【探究实验】教材P59石蜡油的分解实验,将分解产生的气体通入溴水、高锰酸钾溶液,分别观察现象
【学生】观察现象,并填写下表 【学生】分组讨论,上述两种溶液褪色的原因?并填写上表中的结论 【教师】结构决定性质,乙烯的性质与甲烷的差异是由其不同的结构决定的决定的,乙烯与烷烃的结构有何差异呢? 【学与问】参照课本P59乙烯的球棍模型和比例模型,写出乙烯分子的电子式和结构式和结构简式。 【板书】一、乙烯的分子组成和结构 分子式:C 2H 4, 电子式: 结构式: 结构简式:CH 2== CH 2 【教师】乙烯分子二个碳原子和四个氢原子在同一个平面上,键角为1200 【板书】分子构型:平面型;键角:120° 【教师】乙烯分子在结构上最大的特点就是含有一个碳碳双键,是不饱和烃。乙烯分 子的这种不饱和性使得其化学性质非常活泼,可以发生很多化学反应。 【引导阅读】:乙烯的化学性质P60 【板书】二、乙烯的化学性质 【共同讨论】:师生共同进行 【板书】乙烯物理性质:无色稍有气味的气体,比空气轻,难溶于水。 1、氧化反应 (1)、燃烧—乙烯在空气中燃烧,产生明亮的火焰并伴有黑烟,同时放出大量的热。 反应方程式:C 2H 4+3O 2 ??→ ?点燃 2CO 2+2H 2O 【思考与交流】乙烯在空气中燃烧,为什么会有黑烟?
醋酸乙烯聚合反应 醋酸乙烯单体(VA)是一种容易发生聚合反应的化学中间体,也是许多聚合物和乳液应用的组成成分之一。实验室数据显示,正常情况下保存的规格级醋酸乙烯单体(VA)不会形成聚合物1,但是经验证明,聚合引发剂很容易被引入体系中,从而引发醋酸乙烯单体(VA)的聚合反应。正是由于该物质容易发生聚合,为防止失控的聚合事故的发生,应采取多种安全预防措施。失控的聚合反应是指醋酸乙烯(VA)发生无法控制的聚合反应。在可控的状况下,醋酸乙烯单体(VA)会聚合形成醋酸乙烯聚合物,但是当自由基含量过高时,就会发生失控的聚合反应。失控的醋酸乙烯聚合反应十分剧烈,产生的压力波动可达到40巴(580psig)1。而多数储罐无法承受这些压力环境。因此,为了防止失控的聚合反应事故的发生,采取必要的预防措施是十分重要的。 通常,一旦自由基引发了醋酸乙烯单体(VA)的聚合反应,很容易形成醋酸乙烯聚合物。自由基可以通过多种方式形成,而且当其遇到其它自由基以及单体本身时,自由基会变得非常活跃。其实并非所有醋酸乙烯聚合物的形成都会造成失控的聚合反应,但是仍需注意可能引起迅速的聚合反应发生的因素,以避免发生失控的聚合反应。引起自由基的形成并从而形成醋酸乙烯聚合物的因素主要包括1: 1.醋酸乙烯单体(VA)暴露在氧气(空气)中 2.较高的温度 3.储罐的材质,尤其是含有铁锈或其它金属氧化物 4.阳光或其它辐射源
5.存在已知的自由基引发剂,如过氧化物混和物 醋酸乙烯暴露在氧气或空气中会促使过氧化物的形成1。醋酸乙烯中的过氧化物在其分解时会造成剧烈的聚合物的形成2。 热作用会引发自由基的形成1。在室温下,热引发的自由基几率较低。但是当温度上升时,热引发作用对醋酸乙烯单体(VA)中自由基的产生会有很大的影响。 为了降低自由基的形成,在醋酸乙烯中应添加阻聚剂,作为自由基的净化剂。对苯二酚的稳定性作用源于对苯二酚与自由基发生反应,生成非常稳定的化合物,从而防止这些自由基与醋酸乙烯单体(VA)发生进一步的反应。因此,经常需注意的是,储存的醋酸乙烯单体(VA)中的对苯二酚的含量会随着时间的变化而逐渐减少。实际上,在正常条件下,对苯二酚的消耗量是相当低的,但是当温度升高或当暴露在氧气中而生成过氧化物的含量升高时,或在上述提及的其它可能产生自由基的情况下,对苯二酚的消耗量会增加。人们原以为,对苯二酚的阻聚作用在氧气中会更有效,因此,过去醋酸乙烯单体(VA)直接暴露在空气中储存。然而,现在的研究表明,由于醋酸乙烯的易燃性以及暴露在氧气中会形成过氧化物,醋酸乙烯最好是保存在干燥的氮气环境中3。 在碳钢槽罐中储存醋酸乙烯单体(VA)会增加生成醋酸乙烯聚合物的机率。实验证明,保存在碳钢储罐中对苯二酚的消耗量是保存在彩色玻璃储罐中的两倍3。此外,碳钢储罐中的铁锈对醋酸乙烯单体(VA)造成了更大的不稳定作用,同时也会造成对苯二酚的消耗。因此,为了降低引发聚合物形成的机率,醋酸乙烯单体(VA)应储存在纯净的碳钢储罐中。为了预防铁锈引发形成聚合物,在制造新的储罐时,建议使用不锈钢制造储罐,这样基本上就不会产生铁锈1。
从乙烯的结构式可以看出,乙烯分子里含有C=C双键,链烃分子里含有碳碳双键的不饱和烃叫做烯烃。乙烯是分子组成最简单的烯烃。 乙烯分子的空间构型 为了更简单形象地描述乙烯分子的结构,我们常用分子模型来表示(如下图)。在下图中,I 的球棍模型里,两个碳原子间用两根可以弯曲的弹性短棍来连接,用它们来表示双键。在下图中,II 是乙烯分子的比例模型。 乙烯分子的模型 实验表明,乙烯分子里的C=C双键的键长是 1.33×10-10m,乙烯分子里的两个碳原子和四个氢原子都处在同一平面上。它们彼此之间的键角约为120°。乙烯双键的键能是615kJ/mol,实验测得乙烷C-C单键的键长是1.54×10-10m,键能是348kJ/mol。这表明C=C双键的键能并不是C-C单键键能的两倍,而是比两倍略少。因此,只需要较少的能量,就能使双键里的一个键断裂。这从下面介绍的乙烯的化学性质是可以得到证实。 制取乙烯的原理 工业上所用的乙烯,主要是从石油炼制工厂和石油化工厂所生产的气体里分离出来的。 实验室里是把酒精和浓硫酸混合加热,使酒精分解制得。浓硫酸在反应过程里起催化剂和脱水剂的作用。 制取乙烯的反应属于液——液加热型 乙烯能使酸性KMnO4溶液很快褪色,这是乙烯被高锰酸钾氧化的结果,而甲烷等烷烃却没有这种性质。 乙烯的化学性质——加成反应 把乙烯通入盛溴水的试管里,可以观察到溴水的红棕色很快消失。 乙烯能跟溴水里的溴起反应,生成无色的1,2-二溴乙烷(CH2Br-CH2Br)液体。 这个反应的实质是乙烯分子里的双键里的一个键易于断裂,两个溴原子分别加在两个价键不饱和的碳原子上,生成了二溴乙烷。这种有机物分子里不饱和碳原子跟其它原子或原子团直接结合生成别的物质的反应叫做加成反应。 乙烯还能跟氢气、氯气、卤化氢以及水等在适宜的反应条件下起加成反应。 乙烯的化学性质——氧化反应 点燃纯净的乙烯,它能在空气里燃烧,有明亮的火焰,同时发出黑烟。 跟其它的烃一样,乙烯在空气里完全燃烧的时候,也生成二氧化碳和水。但是乙烯分子里含碳量比较大,由于这些碳没有得到充分燃烧,所以有黑烟生成。 乙烯不但能被氧气直接氧化,也能被其它氧化剂氧化。 把乙烯通入盛有高锰酸钾溶液(加几滴稀硫酸)的试管里。可以观察到溶液的紫色很快褪去。 乙烯可被氧化剂高锰酸钾(KMnO4)氧化,使高锰酸钾溶液褪色。用这种方法可以区别甲烷和乙烯。 乙烯的化学性质——聚合反应 在适当温度、压强和有催化剂存在的情况下,乙烯双键里的一个键会断裂,分子里的碳原子能互相结合成为很长的链。 这个反应的化学方程式用右式来表示:nCH2=CH2------------(催化剂) -[-CH--CH2-]-n
乙烯的化学性质教案 【篇一:高二化学乙烯教案】 第一课时 教学目标 知识技能:初步掌握乙烯分子的组成和结构;学会乙烯的实验室制 法和收集方法。能力培养:培养学生的观察能力、思维能力和实验 能力。 科学思想:通过乙醇在不同条件下反应产物不同,即物质所发生的 化学反应既决定于物质本身的性质,又决定于反应条件,渗透内因 和外因的辩证唯物主义教育。 科学品质:通过乙烯用途的介绍,激发学生的学习兴趣,对学生进 行爱国主义教育。在实验教学过程中,培养学生严谨求实、勇于探 索的科学态度。 科学方法:学习用表格的形式对知识进行分类归纳的方法。 重点、难点乙烯的结构和实验室制法;思维能力和实验能力的培养。教学过程设计 教师活动 学生活动 设计意图 【复习提问】我们已经学了烷烃,请大家用系统命名法给下列物质 命名: 【引入】不饱和烃:分子里碳原子所结合的氢原子数少于饱和链烃 里的氢原子数,分子里的这种碳原子还可以结合其他原子或原子团,这类烃叫不饱和烃。
【板书】第四章第四节乙烯 【提问】同学们常见塑料,大家想想哪些物品是用塑料制作的? 【设问】大家知道我手中这些塑料物品是用什么制造的吗? 做命名练习,但对后两个物质感到诧异。 阅读课本第84页,理解概念。 记笔记。 思考并举例。 回答:是乙烯。 温故知新,诱导学生进行对比,从而引出新概念。 培养学生阅读理解能力和自学能力。 激发学生学习兴趣。 续表 教师活动 学生活动 设计意图 【讲述】乙烯不仅可以制塑料,还可以制橡胶、纤维等。国际上评 价一个国家的石油工业发展水平的高低就是用乙烯的年产量衡量的。我国乙烯产量逐年迅猛增长,1997年乙烯产量为359万吨,比 1996年增长18%。 【提问】乙烯的用途如此广泛,请大家想想这和乙烯的什么因素有关? 【再问】那么乙烯的性质又是由它的什么因素决定的呢? 【引入】现在我们就来研究乙烯的结构。
第三节 乙烯 烯烃 [教学目标]1、使学生了解乙烯的物理性质和主要用途,掌握乙烯的化学性质和实验室制法。 2、使学生了解加成反应和聚合反应以及不饱和烃的概念。 3、使学生了解烯烃在组成、结构、重要的化学性质质上的共同点,以及物理性质随分子中碳原子数目的增加而变化的规律性。 [知识讲解] 一、乙烯的分子结构 1、不饱和烃: 断裂,这决定了乙烯的化学性质比较活泼。 二、乙烯的实验室制法 1、反应原理: 2、药品: 3、仪器:铁架台(铁圈、铁夹)、酒精灯、石棉网、圆底烧瓶、双孔橡皮塞、温度计、导气管、水槽、集气瓶等。 4、装置:“液体与液体混合物 气体”的装置(如右图): 5、收集: 三、乙烯的性质 指定温度
1、物理性质:通常情况下,乙烯是无色、稍有气味的气体,密度与空气相近,难溶于水。 2、化学性质: 1)氧化反应 ①易燃烧,燃烧时火焰明亮,产生黑烟。完全燃烧时: ②常温下易被氧化剂(如KMnO4溶液等)氧化。可使酸性KMnO4溶液褪色。此反应可用于烯烃与其它烷烃气体的鉴别。 2)加成反应: 说明:①乙烯与溴水的反应常用于烷烃与烯烃的鉴别,也可用来除去混在气态烷烃中的气态烯烃。 ②寻找出某些有机物的最适宜的制备途径。如氯乙烷的制备,有乙烷与Cl2取代反应和乙烯与HCl的加成反应两条途径,显然前者会产生多种氯代产物,而后者产物单一,当然选择后一种方法好。 ③加成反应的发生与否是不饱和烃与一般饱和烃在化学性质上最明显的差别,凡能发生加成反应的烃通常是不饱和烃。 3)聚合反应: 四、乙烯的用途 1、乙烯是石油化学工业最重要的基础原料。主要用于制造塑料、合成纤维、有机溶剂等。乙烯工业的发展水平,已成为衡量这个国家石油化学工业水平的重要标志之一。 2、乙烯是一种植物生长调节剂。它可以催熟果实。 五、烯烃 1、概念: 2、通式: 3、物理性质:碳原子数小于5的烯烃常温呈( )态。一般地烯烃分子中碳原子数越多,其熔、沸点越( ),相对密度越( )。 4、化学性质 1)氧化反应 ①易燃烧 ②使KMnO4溶液褪色 2)加成反应——不饱和烃的共性 3)加聚反应——烯烃的共性 ①一种单体: ②二种单体:
聚氯乙烯的聚合
在工业生产中,引发剂、分子量调节剂分别加入到反应釜中。引发剂用量为单体量的0.1% ~ 1%。 悬浮聚合目前大都为自由基聚合,但在工业上应用很广。如聚氯乙烯的生产75%采用悬浮聚合过程,聚合釜也渐趋大型化;聚苯乙烯及苯乙烯共聚物主要也采用悬浮聚合法生产;其他还有聚醋酸乙烯、聚丙烯酸酯类、氟树脂等。 聚合在带有夹套的搪瓷釜或不锈钢釜内进行,间歇操作。大型釜除依靠夹套传热外,还配有内冷管或(和)釜顶冷凝器,并设法提高传热系数。悬浮聚合体系粘度不高,搅拌一般采用小尺寸、高转数的透平式、桨式、三叶后掠式搅拌桨。 二、氯乙烯单体中杂质对聚合反应的影响 1.VCM中乙炔对聚合的影响 首先表现在对聚合时间和聚合度的影响上,见表1. 表1. VCM中乙炔对聚合的影响 可知聚合生产中除去单体中的乙炔很重要,一般要求低于10ppm (0.001%)。乙炔的主要危害是和引发剂的自由基、单体自由基发生链转移反应。当乙炔含量高时,生产上一般采取降低聚合温度的办法,以免树脂转型;或在聚合反应初期适当提高聚合温度,以消除诱导期的延长; 2.VCM中高沸物对聚合的影响 VCM中乙醛、二氯乙烯、二氯乙烷等高沸物,均为活泼的链转移剂,
从而降低PVC聚合度和降低反应速度。由于高沸物存在于VCM中不便于聚合温度的掌握,以及高沸物对分散剂的稳定性有明显的破坏作用,因此对VCM中的高沸物含量要严加控制。 此外,高沸物杂质高,影响树脂的颗粒形态,造成高分子歧化,以及影响聚合釜粘釜和“鱼眼”等。工业生产要求单体中高沸物总含量控制在100ppm(0.01%)以下,即单体纯度≥99.99%。一般高沸物含量较高时,可借降低聚合反应温度来处理。 3.铁质对聚合的影响 VCM中铁离子的存在,使聚合诱导期延长,反应速度减慢,产品热稳定性差,还会降低树脂的电绝缘性能(特别是铁离子混入PVC中时)。此外,铁离子还会影响产品颗粒的均匀度。 4.水质对聚合的影响。 聚合投料用水的质量,直接影响到产品树脂的质量。如硬度(表征水中金属等阳离子含量)过高,会影响产品的电绝缘性能和热稳定;氯根(表征水中阴离子含量)过高,特别对聚乙烯醇分散体系,易使颗粒变粗,影响产品的颗粒形态;PH值影响分散剂的稳定性,较低的PH值对分散体系有显著的破坏作用,较高的PH值会引起聚乙烯醇的部分醇解,影响分散效果及颗粒形态。此外,水质还会影响粘釜及“鱼眼”的生成。 表2. 纯水指标 三、聚合生产过程中常用的助剂 氯乙烯悬浮聚合过程中,聚合配方体系或为改善树脂性能而添加各种各样的助剂,其中用得比较广泛的有以下几种:分散剂、引发剂、PH 值调节剂、终止剂、消泡剂等。 1.分散剂
乙烯教案2 3eud教育网百万教学资源,完全免费,无须注册,天天更新~ 第1单元课时3 石油的炼制乙烯(二) 教学设计 一、学习目标 (1)了解乙烯的物理性质,掌握乙烯的化学性质。初步学会用官能团分析有机物性质的方法。 (2)探究乙烯分子的组成和结构式。提高对有机物结构与性质相互联系的分析能力。 (3)掌握加成反应的概念,对比取代反应和加成反应,联系烷烃和烯烃性质的变化规律,提高对同系物性质和结构的把握能力。 (4)通过催熟水果等实践活动,了解乙烯在自然的作用;引导学生关注人类面临的与化学相关的社会问题,如能源短缺、环保等,培养学生的社会责任感。二、教学重点与难点 乙烯的化学性质,难点是加成反应原理。 三、设计思路 之前学习了烷烃,后面将学习其他的烃和烃的衍生物,乙烯在高中有机化学中起着承前启后的作用。乙烯的实验室制法等知识,学 生在学习过程中有很大的难度,很难形成彼此有联系的观念。合理应用信息技术与学科整合,能够大大增加学生在教学过程中的参与性与主动性,降低教材难度。恰当的引导,分析,比较归纳,帮助学生充分理解知识点,提高学生学习的积极性。
四、教学过程 [学生活动]根据乙烯的分子式, 写出乙烯的分子式、电子式、结 构式、结构简式。组装乙烯分子 的球棍模型 3eud教育网教学资源集散地。可能是最大的免费教育资源网~ 3eud教育网百万教学资源,完全免费,无须注册,天天更新~ [提问]乙烯、乙烷在组成、结构上有哪些差异, [板书]一、乙烯的组成及结构特点(PPT2,3) 乙烯(CH) 乙烷(CH) 2426 结构式 结构简式 电子式 空间各原子的位 置 键角 [讨论]乙烷的结构与乙烯的结构有何不同, [提问]乙烯属于饱和烃吗? [板书]不饱和烃:烯烃 [提问] 那性质会有差异吗, [板书] 二、乙烯的化学性质
有机化学教案 第三章 ? ? 1 第三章 烯 烃 一、学习目的和要求 1. 掌握烯烃的构造异构和命名。 2. 掌握烯烃的结构。 3. 掌握烯烃结构的Z/E 标记法和次序规则。 4. 掌握烯烃的来源和制法。 5. 掌握烯烃的物理性质。 6. 掌握烯烃的化学性质:催化氢化、、亲电加成,马尔柯夫尼柯夫规则,硼氢化-氧化反应、臭氧化反应。 7. 了解烯烃的重要代表物:乙烯、丙烯和丁烯。 二. 本章节重点、难点 烯烃的分子结构、π键的特点、σ键与π键的区别、Z/E 标定法、记住次序规则、碳正离子的结构及其稳定性、亲电加成的反应历程和影响因素、乙烯的分子轨道、丙稀的游离基反应、马氏与反马氏规则。 三. 教学内容 烯烃是指分子中含有一个碳碳双键的开链不饱和烃,烯烃双键通过SP 2 杂化轨道成键,因此和烷烃相比,相同碳原子的烯烃比烷烃少两个碳原子,通式为CnH2n 。 3.1 烯烃的构造异构和命名 3.1.1 烯烃的同分异构 烯烃的同分异构现象比烷烃的要复杂,除碳链异构外,还有由于双键的位置不同引起的位置异构和双键两侧的基团在空间的位置不同引起的顺反异构。造异构 (以四个碳的烯烃为例): CH 3-CH 2-CH=CH 2 1-丁烯 位置异构 CH 3-CH=CH-CH 3 2-丁烯 构造异构 CH 3-C(CH 3)=CH 2 2-甲基丙烯 碳链异构
? ? 2 3.1.2 烯烃的命名 (1) 烯烃系统命名法 烯烃系统命名法,基本和烷烃的相似。其要点是: 1) 选择含碳碳双键的最长碳链为主链,称为某烯。 2) 从最靠近双键的一端开始,将主链碳原子依次编号。 3) 将双键的位置标明在烯烃名称的前面(只写出双键碳原子中位次较小的一个)。 4) 其它同烷烃的命名原则。 例如:CH 3—CH —CH=CH 2 的名称是3-甲基-1-丁烯。 CH 3 烯烃去掉一个氢原子后剩下的一价基团就是烯基,常见的烯基有: CH2=CH- 乙烯基 CH 3CH=CH- 丙烯基(1-丙烯基) CH 2=CH-CH 2- 烯丙基(2-丙烯基) CH2= C – CH3 异丙烯基 (2) 烯烃衍生物命名法(补充) 烯烃衍生物命名法是以乙烯为母体,将其他烯烃看成他们的烷基衍生物。例: CH 2=CH-CH 3 甲基乙烯 (CH 2)2C=CH 2 (不对称二甲基乙烯) 使用范围:结构简单的烯烃。 3.2 烯烃的结构 最简单的烯烃是乙烯,我们以乙烯为例来讨论烯烃双键的结构。 3.2.1 双键的结构 乙烯与丙烯的共价键参数如下: H 0.108nm 0.133nm 117° 121.7°
乙烯丙烯酸酯共聚物的合成方法研究进展 王昶昊施云海* 王以元 (华东理工大学化学工程研究所,上海) 摘要:本文对高压自由基聚合法和插入聚合法合成乙烯丙烯酸酯共聚物进行了简单的介绍,以引领国内进行该产品的合成与研究。 关键词:乙烯丙烯酸(酯)共聚物,自由基聚合,插入聚合,高压反应 引言 乙烯丙烯酸(酯)共聚物是系列化高分子聚合物[],国外可供的主要产品有:乙烯丙烯酸共聚物(,)、乙烯丙烯酸甲酯共聚物(,)、乙烯丙烯酸乙酯共聚物(,)、乙烯丙烯酸丁酯共聚物(,)、乙烯甲基丙烯酸甲酯共聚物(,)等等,由于这类物质的特殊性能,而广泛应用于包装、粉末涂层、粘合剂、热熔胶、密封材料、水性溶剂等领域。 乙烯丙烯酸酯共聚物的一般结构如图和图所示。 C H2H2 C CH H2 C C H2 H2 C C H2 H2 C CH H2 C C O CH2CH3 C O H3CH2 O O H2 C H2 H2 C CH H2 C CH H2 C CH H2 C C O CH2CH3 O C O CH2CH3 O C O CH2CH3 O C H2 图、乙烯丙烯酸酯共聚物(含支链较多) 图、乙烯丙烯酸酯共聚物(含支链较少) 其中图的乙烯丙烯酸酯共聚物中含有的支链较多,图要比图的结构规整一些。通常,在超高压下聚合制备的乙烯丙烯酸酯共聚物的支链数相对地要多一些。从图和图可看出,乙烯丙烯酸(酯)共聚物由于主链的饱和结构和较低的α含量,拥有远优于同类丙烯酸酯共聚物耐臭氧老化,耐紫外线老化的能力,更适合于用作低表面张力材料,如塑料薄膜之间的粘结和复合,塑料管材之间的粘结,防水管材的搭缝粘结。然而制造反应过程涉及高压与超高压,国内迄今没有工厂生产,所有产品均依赖进口解决。 .合成方法概述 搅拌釜式反应器中的共聚反应 以搅拌反应釜作为共聚反应器,在溶剂介质中进行乙烯和丙烯酸(酯)的聚合反应,通常可以大幅度地降低反应压力,以下列举了一些实例来说明[]。 1.1.1乙烯丙烯酸共聚物的合成方法 在 4.55L带磁力搅拌的高压釜中加入1600g纯水、300g叔丁醇和30g丙烯酸溶液。对反应釜进行脱气后,用压力的乙烯置换洗脱两次。接着用乙烯充至压力为,于搅拌下将料液加热至80℃时;然后泵入5g水的过硫酸钾溶液。再将压力调至下,后另外再加入1.25g 的过硫酸
第二节来自石油和煤的两种基本化工原料 一、教学目标 知识与技能 1.探究乙烯分子的组成、结构特点。 2.掌握乙烯的典型化学性质,掌握加成反应。 3.了解乙烯的的用途。 过程与方法 1.通过乙烯分子结构的推理过程,培养学生的抽象思维和逻辑思维能力。 2.从实验现象到乙烯结构的推理,使学生体会科学研究的方法。 情感、态度与价值观 1.通过对乙烯分子结构的推理,使学生体会到严谨求实的科学态度。 2.使学生领悟到化学现象与化学本质的科学辩证关系。 二、教学重点、难点 重点:乙烯的化学性质 难点:乙烯的分子结构、乙烯的加成反应 三、教学过程 【导入新课】我们常说煤是工业的粮食,石油是工业的血液,从煤和石油不仅可以得到多种常用燃料,而且可以从中获取大量的基本化工原料。那么从煤和石油中都能获得哪些重要的化工原料呢? 【板书】第二节来自石油和煤的两种基本化工原料――乙烯 【思考】衡量一个国家石油化工发展水平的标志是什么? 【投影】资料卡片——《乙烯装置简介》 【教师】到底乙烯是怎样的物质呢?能否从石油中得到乙烯?从石油分馏中得到的石蜡油进一步加热会得到什么呢? 【探究实验】投影教材P67石蜡油的分解实验,将分解产生的气体通入溴水、高锰酸钾溶液,分别观察现象 【观察与思考】1.实验中看到哪些现象? 2.石蜡油分解实验中生成的物质与甲烷的性质比较有什么异同? 3.由以上实验我们可以得出什么结论? 【学生】观看视频并思考 【教师】石蜡油分解得到的产物中含有与烷烃性质不同的烃——烯烃 【学与问】投影乙烯的球棍模型和比例模型,写出乙烯分子的电子式和结构式和结构简式。【板书】一、乙烯的分子组成和结构 H4,电子式:结构式: 分子式:C 结构简式:CH2=CH2 【思考与交流】乙烯分子的空间结构有什么特点? 【投影】乙烯分子的空间结构 【学生】观看视频并思考,回答,由教师补充 【板书】乙烯分子的空间结构的特点: 1.碳原子之间以双键结合,其中一根键不稳定。 2.原子之间的夹角均为120° 3.乙烯分子为平面型结构,所有原子都在同一平面内。 【教师】乙烯有哪些物理性质呢? 【投影】乙烯的物理性质:无色,稍有气味的气体,难溶于水(排水法收集) 【教师】由于乙烯分子中存在碳碳双键,所以乙烯表现出较活泼的化学性质。那么乙烯都能
教学要求及教学内容提纲 1.掌握烯烃的结构特征、通式和命名 2.理解烯烃的同分异构现象 3.了解烯烃的物理、化学性质 重点与难点: 重点: 1.烯烃的结构特征:π键的形成和特点;顺反异构的构型标记及次序规则 2.烯烃的化学性质 难点: 烯烃的结构特征 教学实施手段: 讲授、讨论、提问、讲评 推荐参考书及预复习任务: 参考书 参考书:《药用有机化学》郭扬主编,第一版,中国医药科技出版社 复习总结新课重点、难点内容 1.烯烃的定义 2.烯烃的分类 3.烯烃的异构现象:构造异构(碳链异构,位置异构);立体异构(顺反异构) 4.烯烃的性质:加成、氧化、聚合反应 教学过程
【引言】: 复习上节课的内容; 由烷烃的结构、命名、性质导入新课,并引入不饱和烃的概念。 【教师】: 如果烃分子中只有单键,则叫做饱和烃,饱和链烃称为烷烃,烷就是“完”全的意思,分子内只有单键且成链状。 如果各键没有被氢原子占满,富余的键会和其他碳原子组成双键或三键,就是不饱和烃。 不饱和烃中有双键的叫“烯”,是氢原子“稀”少的意思;有三键的为“炔”,是氢原子“缺”乏的意思。除此之外还有芳香烃,例如“苯”。不饱和烃的双键和三键不太牢固,比较容易断裂,容易发生化学反应。 {分类见教材25页} 【板书】:第一节 烯烃 【教师】: 烯烃是指分子中含有碳碳双键C=C 键的不饱和烃,根据含有碳碳双键的数目又可分为单烯烃、二烯烃和多烯烃。如果不加说明,通常所说的烯烃是指含有一个碳碳双键的单烯烃。 在单烯烃分子中,含有一个碳碳双键,所以它比相同碳数的烷烃少两个氢原子,单烯烃的通式为CnH2n 。 【板书】:(一):烯烃的结构 【教师】: 最简单的烯烃是乙烯。医药上,乙烯与氧的化合物可以作为麻醉剂。 以乙烯为例,介绍烯烃的结构特征。 H H H C C 双键基团是烯烃分子中的官能团,具有反应活性。 双键的表示方法:双键一般用两条短线来表示,如:C=C , 【教师】: 现代物理方法研究表明:乙烯分子中的碳碳双键的键能为610kJ.mol -1 ,键长为134pm , 而乙烷分子中碳碳单键的键能为345kJ.mol -1 ,键长为154pm 。比较可知,双键并不是单键的简单的加合。 【教师】:乙烯分子中,两个碳原子和四个氢原子都在一个平面上,即乙烯分子为平面分子。 【板书】:展示乙烯的分子结构{PPT 有动态版}
人教版高中化学必修2§3-2 来自石油和煤的两种基本化工原料(第一课时) 《乙烯》教学设计 新疆兵团二中王兰兰 一、整体设计思路 乙烯是一种重要的化工原料,其产品已渗透到人类生活的许多领域,在生活和工农业生产中具有广泛用途。乙烯是最简单的烯烃,也是不饱和烃的代表物质。通过乙烯的学习,不仅可以认识乙烯的分子结构、性质和用途,更重要的是让学生认识到学习有机化学的重要性以及有机物质与人类生活的关系。 本课以生活中的乙烯产品为载体,以乙烯结构与性质的探索为主线,以化学知识解释生活中的化学现象为目的,将自主、合作、探究的学习方式融入课堂教学,帮助学生认识乙烯产品的用途,体会有机物从结构到性质的学习方法,感受学习有机化学的有用与有趣,形成用辩证的思想认识化学品的意识。 本教学设计从社会热点问题出发,充分利用模型和实验,以问题引领学生探究乙烯的结构和性质,解决生活中的化学问题,促使学生认识社会发展与化学应用的密切关系,引导学生辩证地看待化学药品的使用。 教学中突出知识之间的联系,运用对比的方法,揭示乙烷和乙烯的异同点,加深对知识的理解。如乙烷分子中只有单健,而乙烯分子中含有碳碳双键,这就决定了它们虽然都可以和卤素单质反生反应,但所用试剂状态不同,反应条件不同,反应现象就不同,产物也不同,从而揭示出取代反应和加成反应的不同。对比是一种良好的思维习惯,对比不仅使学生掌握了知识,掌握了一种学习方法,更重要的是让学生感受到有机化学的学习是有规律可循的,可以增强学生学习化学的信心和乐趣。 在实际教学过程中,主要采用教师启发、设疑、讲解、对比等多种教学方式,通过学生“实验-探究”、“体验-感悟”、“交往-合作”、“活动-参与”、“发现-创造”来完成教学任务。 二、教学背景 教材内容分析:本节内容选自人教版高中化学必修2第三章第二节——来自石油和煤的两种基本化工原料。学生在第一节中以甲烷为例学习了有机物中碳原子的成键特点、取代反应、同分异构体及同系物等基本知识,为学习乙烯打下了一定基础。乙烯是学生认识不饱和烃的第一种有机物,是一种重要的基本化工原料,又是衡量一个国家石油化工发展水平的重要标志。乙烯在教材中有举足轻重的地位。 学生情况分析:本节课之前,学生已经学习了以甲烷为代表的简单烷烃的结构、性质(重点是取代反应)以及用电子式、结构式、结构简式表示有机物结构等基础知识。学生也掌握了碳的四价理论,为本节课的学习铺垫了基础。但需要对“结构与性质”的关系进一步深化认识,乙烯的教学就能起到这种作用。另外学生能从生活实际出发,认识乙烯的广泛应用,再学习它们的性质就能强化理论与实际的联系,帮助学生学以致用。
乙烯的性质各位评委老师好!我叫XXX,我申请的学科是高中化学,我抽到的说课题目是《XXXXXX》。 下面是我的说课内容。 《乙烯的性质》是选自人民教育出版社出版的全日制普通高级中学教科书(必修)《化学》第二册第五章第三节《乙烯》第一课时。本节内容是继烷烃之后,向学生介绍不饱和烃和烯烃的概念,乙烯的分子结构、实验室制法和乙烯的化学性质。在乙烯的化学性质中,又介绍了另一种重要的有机反应类型——加成反应。本节内容是学生在系统地学习了烷烃之后,已初步了解学习有机化学的方法的情况下学习的又一类烃,在教材中占据了重要的地位。且本节内容所涉及到的乙烯是一种重要的化工原料和产品,在工农业生产、日常生活、能源、药物等方面都占有重要的地位。通过乙烯的性质和用途的学习,可以进一步使学生认识到学习化学的重要性。 三、教学目标 初步掌握乙烯的重要物理、化学性质(加成反应、氧化反应和加聚)知识目标(1反应),了解乙烯的主要用途①使学生掌握乙烯分子的组成、结构式,重要的化学性质和用 途。②使学生学会乙烯的实验室制法和收集方法。 (2)能力目标①培养学生观察能力、思维能力、分析问题和解决问题的能力。②对学生进行科学抽象能力的指导。 四重点,难点:[教学重点] 乙烯的化学性质[教学难点] 乙烯的加成反应。 五、教学程序 【回忆】上节课我们学习了乙烯的结构,现在我们来复习一下。 【讲述】我们知道,乙烯具有平面结构,六个原子在一个平面内,这是它的第一个特点;第二,键角为120°;第三,碳与碳之间以双键的形式存在。 一、乙烯的物理性质(学生阅读课本) 乙烯是没有颜色、稍有气味的气体,密度为1.25g/L,比空气密度略小,难溶于水。(用排水法收集) 【讲述】好,这就是我们上节课学习的乙烯的结构。我们知道,乙烯的双键是不稳定的,它的一根键容易断裂,那么,这种结构会对乙烯的性质产生怎样一个影响呢?会不会使得它与甲烷的性质不同呢?这节课,我们就来学习乙烯的化学性质。 二、乙烯的化学性质 【讲述】乙烯的化学性质第一个体现是氧化性。首先,我们来看一个视频,看乙烯能否与氧气反应。 化反应氧、1. 看视频:点燃纯净的乙烯,观察其燃烧时的现象实验[1] 本实验你看到了什么现象。现在请位同学来为大家说说,【提问】好,实验就看到这里,同学,你在观看视频时有发现什么现象吗?** 同学为我们说出了他看到的实验现象,观察得挺细心。【点评】刚才**乙烯在空气中燃烧,火焰是明亮【解释】老师来总结一下**同学刚才看到的现象。首先,了,我们学过有什么气体可以使澄清的,而且伴有黑烟的生成。然后,澄清石灰水变浑浊
人教版高中化学必修2 §3-2 来自石油和煤的两种基本化工原料(第 一课时) 《乙烯》教学设计 一、整体设计思路 乙烯是一种重要的化工原料,其产品已渗透到人类生活的许多领域,在生活和工农业生产中具有广泛用途。乙烯是最简单的烯烃,也是不饱和烃的代表物质。通过乙烯的学习,不仅可以认识乙烯的分子结构、性质和用途,更重要的是让学生认识到学习有机化学的重要性以及有机物质与人类生活的关系。 本课以生活中的乙烯产品为载体,以乙烯结构与性质的探索为主线,以化学知识解释生活中的化学现象为目的,将自主、合作、探究的学习方式融入课堂教学,帮助学生认识乙烯产品的用途,体会有机物从结构到性质的学习方法,感受学习有机化学的有用与有趣,形成用辩证的思想认识化学品的意识。 本教学设计从社会热点问题出发,充分利用模型和实验,以问题引领学生探究乙烯的结构和性质,解决生活中的化学问题,促使学生认识社会发展与化学应用的密切关系,引导学生辩证地看待化学药品的使用。 教学中突出知识之间的联系,运用对比的方法,揭示乙烷和乙烯的异同点,加深对知识的理解。如乙烷分子中只有单健,而乙烯分子中含有碳碳双键,这就决定了它们虽然都可以和卤素单质反生反应,但所用试剂状态不同,反应条件不同,反应现象就不同,产物也不同,从而揭示出取代反应和加成反应的不同。对比是一种良好的思维习惯,对比不仅使学生掌握了知识,掌握了一种学习方法,更重要的是让学生感受到有机化学的学习是有规律可循的,可以增强学生学习化学的信心和乐趣。 在实际教学过程中,主要采用教师启发、设疑、讲解、对比等多种教学方式,通过学生“实验-探究”、“体验-感悟”、“交往-合作”、“活动-参与”、“发现-创造”来完成教学任务。 二、教学背景
高二化学课时练习《乙烯烯烃2》 一、选择题 1、通常情况下,乙烯是无色的稍有香甜气味的气体,但实验室制得的乙烯常有刺激性气味,这是因为乙烯中含有() (A)二氧化碳(B)二氧化硫(C)乙醚(D)乙醇 2、实验室制取乙烯的操作中,下列叙述不正确的是() (A)温度计要插入反应混合液中 (B)圆底烧瓶中要放入少量碎瓷片 (C)圆底烧瓶中注入酒精和稀硫酸的体积比为1:3 (D)加热时使液体温度迅速升高到170℃ 3、下列各组物质在一定条件下反应,可以制得较纯净的1,2-二氯乙烷的是()(A)乙烷与氯气混合(B)乙烯与氯化氢气体混合 (C)乙烯与氯气混合(D)乙烯通入浓盐酸 4、对比甲烷和乙烯的燃烧反应,下列叙述中正确的是() (A)二者燃烧时现象完全相同(B)点燃前都应验纯 (C)甲烷燃烧的火焰呈淡蓝色,乙烯燃烧的火焰较明亮 (D)二者燃烧时都有黑烟生成 5、下列物质可以发生加成反应的是() (A)乙烷(B)环丙烷(C)乙烯(D)聚乙烯 6、下列变化属于加成反应的是() (A)乙烯通入酸性高锰酸钾溶液(B)乙烯通入溴水 (C)乙醇与浓硫酸共热(D)乙烯与氯化氢在一定条件下反应 7、下列烃中,含碳量最低的是() (A)甲烷(B)丙烷(C)乙烯(D)环丙烷 8、将15g CH4和C2H4的混合气体通入盛有足量溴水的容器中,溴水的质量增加了7g,则混合气体中CH4与C2H4的体积比为() (A)1:2 (B)2:1 (C)3:2 (D)2:3 9、某种乙烯和氢气的混合气体VL,完全燃烧需要相同条件下的氧气2VL,则混合气体中乙烯和氢气的体积比是() (A)3:2 (B)2:3 (C)3:4 (D)4:3 10、关于实验室制取乙烯的实验,下列说法正确的是()。 (A) 反应容器(烧瓶)加入少许碎瓷片; (B) 反应物是乙醇和过量的3mol/L H2SO4混合液; (C) 温度计应插入反应溶液液面下,以便控制温度; (D) 反应完毕后先熄灭洒精灯,再从水中取出导管。 11、通常用来衡量一个国家石油化工发展水平的标志是() (A)石油的产量 (B)乙烯的产量 (C)塑料的产量 (D)合成纤维的产量 12、完全燃烧一定量的某有机物,生成88g CO2和27g H2O,下列说法正确的是()
安全管理编号:LX-FS-A55346 醋酸乙烯聚合反应 In the daily work environment, plan the important work to be done in the future, and require the personnel to jointly abide by the corresponding procedures and code of conduct, so that the overall behavior or activity reaches the specified standard 编写:_________________________ 审批:_________________________ 时间:________年_____月_____日 A4打印/ 新修订/ 完整/ 内容可编辑
醋酸乙烯聚合反应 使用说明:本安全管理资料适用于日常工作环境中对安全相关工作进行具有统筹性,导向性的规划,并要求相关人员共同遵守对应的办事规程与行动准则,使整体行为或活动达到或超越规定的标准。资料内容可按真实状况进行条款调整,套用时请仔细阅读。 醋酸乙烯单体(VA)是一种容易发生聚合反应的化学中间体,也是许多聚合物和乳液应用的组成成分之一。实验室数据显示,正常情况下保存的规格级醋酸乙烯单体(VA)不会形成聚合物1,但是经验证明,聚合引发剂很容易被引入体系中,从而引发醋酸乙烯单体(VA)的聚合反应。正是由于该物质容易发生聚合,为防止失控的聚合事故的发生,应采取多种安全预防措施。失控的聚合反应是指醋酸乙烯(VA)发生无法控制的聚合反应。在可控的状况下,醋酸乙烯单体(VA)会聚合形成醋酸乙烯聚合物,但是当自由基含量过高时,就会发生失控的聚合
乙烯的物理性质教案 小编为您收集整理的乙烯的物理性质,提供全面的乙烯的物理性质信息,希望对您有用! 乙烯的物理性质篇一:乙烯知识点 乙烯 1. 乙烯的组成和结构 分子式:电子式:结构式:结构简式:最简式: 构型:平面型 2. 乙烯的物理性质: 无色气体,稍有气味,溶于水,溶于有机溶剂。 3. 乙烯的化学性质: (1)氧化反应: ①燃烧:(验纯) ②与酸性高锰酸钾溶液退色(产物是CO2) (2)加成反应: ①与溴的四氯化碳溶液或溴水反应: ②与氢气加成: ③与氯化氢加成: ④与水加成 (3)加聚反应: 4. 用途:衡量国家石油化工的发展水平,植物生长调节剂,化工原料。 思考: 乙烯使溴水退色和使酸性高锰酸钾退色的原理是否相同? 怎样除甲烷中的乙烯?
1mol乙烯与氯化氢完全加成后再与氯气发生取代反应,消耗氯气多少mol?制取一氯乙烷最好的方法 烯烃: 概念:分子中含有的不饱和烃 单烯烃的通式:二烯烃的通式: 化学性质:与乙烯类似,可发生加成、氧化、加聚反应 思考:聚乙烯能使溴水退色吗? 实验室制取乙烯的化学方程式: ??C2H2↑+H2O C2H5OH 分子内脱水,浓硫酸:催化剂、脱水剂 T<140℃ 难反应 T≈140 乙醚(分子间脱水) T:140~170 混合物乙醚与乙烯 T≈170 乙烯 T>170 二氧化碳浓硫酸,170℃ 乙烯的物理性质篇二:乙烯的性质和用途 乙烯的性质各位评委老师好!我叫XXX,我申请的学科是高中化学,我抽 到的说课题目是《XXXXXX》。下面是我的说课内容。 《乙烯的性质》是选自人民教育出版社出版的全日制普通高级中学教科书(必修)《化学》第二册第五章第三节《乙烯》第一课时。本节内容是继烷烃 之后,向学生介绍不饱和烃和烯烃的概念,乙烯的分子结构、实验室制法和乙 烯的化学性质。在乙烯的化学性质中,又介绍了另一种重要的有机反应类型——加成反应。本节内容是学生在系统地学习了烷烃之后,已初步了解学习有机 化学的方法的情况下学习的又一类烃,在教材中占据了重要的地位。且本节内 容所涉及到的乙烯是一种重要的化工原料和产品,在工农业生产、日常生活、 能源、药物等方面都占有重要的地位。通过乙烯的性质和用途的学习,可以进 一步使学生认识到学习化学的重要性。