
教学设计]第三章第一节晶体的常识(晶胞)
江苏省如东高级中学张霞
教学设想
从教材看,本章首先从人们熟悉的固体出发,把固体分为晶体和非晶体两大类,引出了晶体的特征和晶胞的概念。晶胞是描述晶体结构的基本单元,是研究晶体结构的最基本概念,教科书利用图片、比喻等方式介绍了晶体与晶胞的关系,并通过例子介绍了如何计算晶胞中所含的原子数。
本教案选择《晶胞》作为学生自主学习的课题,试图利用多媒体课件和形象比喻等教学方式,使学生建构起晶胞的概念,通过动手制作晶胞模型并把自己制作的晶胞模型拼凑成晶体模型,体会晶胞与晶体之间的关系;再以课本上的问题设置矛盾,通过学生自学讨论,教师的适当点拨,总结归纳出一个晶胞中平均所含粒子个数的计算方法,在此过程中,提升学生的空间想象能力。
一、教学目标分析
知识与技能
1.了解晶体与晶胞的关系,体会由晶胞“无隙并置”构成晶体的过程。
2.通过自学讨论,掌握不同晶胞中平均所含粒子个数的计算方法。
过程与方法
1.运用多种教学媒体,借助形象的比喻,帮助学生建构抽象的空间结构。
2.知道研究晶体结构的一般方法。
情感态度和价值观
1、进一步形成求真务实、勤于思考的科学态度;形成敢于质疑、勇于创新的科学精神。
二、教学内容分析
对本节教学内容的处理方法:利用多媒体演示若干晶体和晶胞,组织学生讨论晶体与晶胞的关系,动手制作晶胞模型,引导学生建立以晶胞为基本结构研究晶体的思想,结合课本图3-7铜晶胞,展示实物模型,提出问题:为什么说一个晶胞里只含4个铜原子?学生自学、讨论并归纳出立方晶胞中平均所含粒子个数的计算方法,然后设置问题:如果为三棱柱晶胞或者六棱柱晶胞,又该如何计算?举一反三,巩固了学生对空间结构的理解和计算。最后利用课本学与问与课后习题3,进行训练反思。
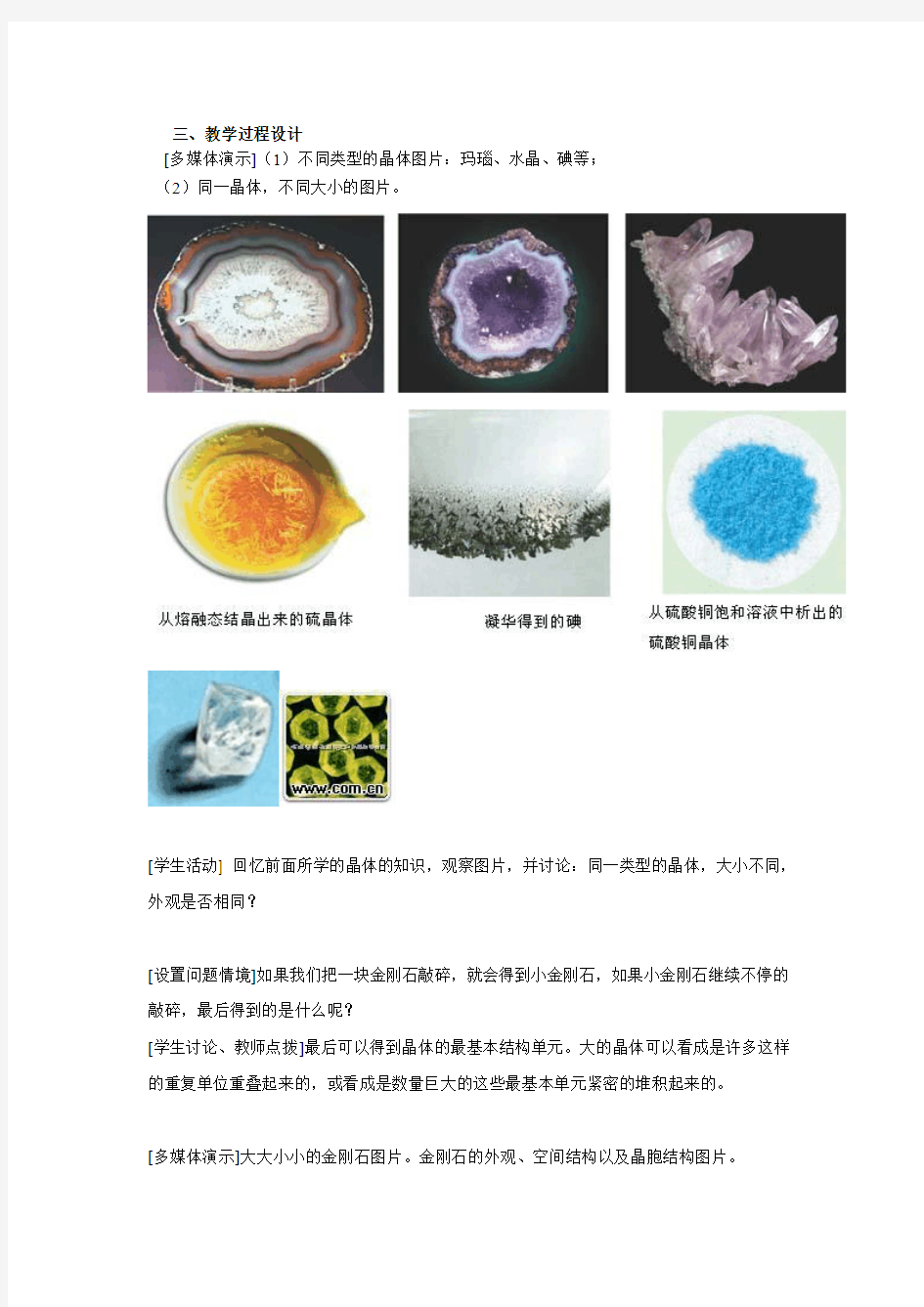
三、教学过程设计
[多媒体演示](1)不同类型的晶体图片:玛瑙、水晶、碘等;
(2)同一晶体,不同大小的图片。
[学生活动] 回忆前面所学的晶体的知识,观察图片,并讨论:同一类型的晶体,大小不同,外观是否相同?
[设置问题情境]如果我们把一块金刚石敲碎,就会得到小金刚石,如果小金刚石继续不停的敲碎,最后得到的是什么呢?
[学生讨论、教师点拨]最后可以得到晶体的最基本结构单元。大的晶体可以看成是许多这样的重复单位重叠起来的,或看成是数量巨大的这些最基本单元紧密的堆积起来的。
[多媒体演示]大大小小的金刚石图片。金刚石的外观、空间结构以及晶胞结构图片。
[师生总结]我们把这种描述晶体结构的基本单元叫做晶胞。它是保持晶体规则多面体外形的最小单位。晶体就是由无数个晶胞经过“无隙并置”而成的。
[学生活动]利用提供的纸、小木棍等工具,制作小的立方晶胞(按教师给定的尺寸),并将每8个同学所做的晶胞进行组合,要求尽可能结合紧密。讨论晶胞与晶体的关系,体会晶胞无隙并置构成晶体的过程。
[设置问题情境]图中所示金属铜的一个晶胞,它是一个立方体,含4个铜原子,但是从图中我们看到有14个铜原子,这是怎么回事?为什么说一个晶胞里只含4个铜原子呢?请同学们结合课本内容,先自己寻找出晶胞中所含原子个数的计算方法,然后以前后桌4个人一小组,讨论你们的结论是否正确。
[学生活动]自学、结论、交流。
[学生活动]以一个小组为代表,汇报讨论的结果,其他小组同学来判断是否正确,对不完整的地方进行补充,并归纳出最简洁的计算方法。
[师生总结](1)所有晶胞都是平行六面体,晶体可以看作是晶胞在三维空间里共面堆积
而成。每个晶胞的上、下、左、右、前、后共有六个与之共面的晶胞。
(2)处于晶胞顶点的粒子,同时为8个晶胞所共有,每个粒子只有1/8
属于晶胞;处于棱上的粒子,同时为4个晶胞所共有,每个粒子只有1/4
属于晶胞;处于面上的粒子,同时为两个晶胞所共有,每个粒子只有1/2属于晶胞;处于晶胞内部的粒子,完全属于该晶胞。
[思维拓展]在计算晶胞中所含平均原子数时,我们已经知道如果为立方结构,则有1/8,1/4,1/2和1,若换为六棱柱状呢?三棱柱又如何呢?
[学生活动]结合图片提供的结构,讨论交流得出六棱柱和三棱柱中所含平均原子个数的计算。六棱柱为1/6,1/3,1/2和1,而三棱柱为1/12,1/6,1/2和1。
[训练反思]教材P66学与问:图3-9依次是金属钠、金属锌、碘、金刚石晶胞的示意图,数一数它们分别平均含几个原子。
[巩固练习]教材P67习题3.下图的晶胞中各含有几个原子?
教后反思:
晶胞,是连接宏观晶体与微观原子之间的桥梁。晶胞是晶体微观结构的最基本单元,要研究晶体,必须先了解晶胞。虽然本教学案例侧重自主讨论的学习方式,但在教学过程中,基于教学内容的基础性和抽象性,我还是充分利用了多种教育、教学资源,比如多媒体演示
了多幅晶体和晶胞的图片,比如让学生自己动手制作晶胞模型并拼制成晶体模型,以使学生对晶胞有一个比较形象和具体的认识,然后再进行问题情境的创设(即晶胞中显示的原子是否全部为此晶胞所包含?),使学生比较顺利的完成了自主学习的任务,在此基础上,又进行了一定的变化,把立方晶胞拓展到棱柱晶胞,使学生对问题的认识得到深化,同时也完成了化学知识和技能方面的自我建构。
物质结构与性质 第一章原子结构与性质 第一节原子结构 第二节原子结构与元素的性质 归纳与整理复习题 第二章分子结构与性质 第一节共价键 第二节分子的立体结构 第三节分子的性质 归纳与整理复习题 第三章晶体结构与性质 第一节晶体的常识 第二节分子晶体与原子晶体 第三节金属晶体 第四节离子晶体 归纳与整理复习题 (人教版)高中化学选修3 《物质结构与性质》全部教学案 第一章原子结构与性质 教材分析: 一、本章教学目标 1.了解原子结构的构造原理,知道原子核外电子的能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子的排布。 2.了解能量最低原理,知道基态与激发态,知道原子核外电子在一定条件下会发生跃迁产生原子光谱。 3.了解原子核外电子的运动状态,知道电子云和原子轨道。 4.认识原子结构与元素周期系的关系,了解元素周期系的应用价值。 5.能说出元素电离能、电负性的涵义,能应用元素的电离能说明元素的某些性质。 6.从科学家探索物质构成奥秘的史实中体会科学探究的过程和方法,在抽象思维、理论分析的过程中逐步形成科学的价值观。 本章知识分析: 本章是在学生已有原子结构知识的基础上,进一步深入地研究原子的结构,从构造原理和能量最低原理介绍了原子的核外电子排布以及原子光谱等,并图文并茂地描述了电子云和原子轨道;在原子结构知识的基础上,介绍了元素周期系、元素周期表及元素周期律。总之,本章按照课程标准要求比较系统而深入地介绍了原子结构与元素的性质,为后续章节内容的学习奠定基础。尽管本章内容比较抽象,是学习难点,但作为本书的第一章,教科书从内容和形式上都比较注意激发和保持学生的学习兴趣,重视培养学生的科学素养,有利于增强学生学习化学的兴趣。 通过本章的学习,学生能够比较系统地掌握原子结构的知识,在原子水平上认识物质构成的规律,并能运用原子结构知识解释一些化学现象。 注意本章不能挖得很深,属于略微展开。
晶体的常识(晶胞)教 学设计
教学设计]第三章第一节晶体的常识(晶胞) 江苏省如东高级中学张霞 教学设想 从教材看,本章首先从人们熟悉的固体出发,把固体分为晶体和非晶体两大类,引出了晶体的特征和晶胞的概念。晶胞是描述晶体结构的基本单元,是研究晶体结构的最基本概念,教科书利用图片、比喻等方式介绍了晶体与晶胞的关系,并通过例子介绍了如何计算晶胞中所含的原子数。 本教案选择《晶胞》作为学生自主学习的课题,试图利用多媒体课件和形象比喻等教学方式,使学生建构起晶胞的概念,通过动手制作晶胞模型并把自己制作的晶胞模型拼凑成晶体模型,体会晶胞与晶体之间的关系;再以课本上的问题设置矛盾,通过学生自学讨论,教师的适当点拨,总结归纳出一个晶胞中平均所含粒子个数的计算方法,在此过程中,提升学生的空间想象能力。 一、教学目标分析 知识与技能 1.了解晶体与晶胞的关系,体会由晶胞“无隙并置”构成晶体的过程。 2.通过自学讨论,掌握不同晶胞中平均所含粒子个数的计算方法。 过程与方法 1.运用多种教学媒体,借助形象的比喻,帮助学生建构抽象的空间结构。 2.知道研究晶体结构的一般方法。 情感态度和价值观 1、进一步形成求真务实、勤于思考的科学态度;形成敢于质疑、勇于创新的科学精神。 二、教学内容分析 对本节教学内容的处理方法:利用多媒体演示若干晶体和晶胞,组织学生讨论晶体与晶胞的关系,动手制作晶胞模型,引导学生建立以晶胞为基本结构研究晶体的思想,结合课本图3-7铜晶胞,展示实物模型,提出问题:为什么说一个晶胞里只含4个铜原子?学生自学、讨论并归纳出立方晶胞中平均所含粒子个数的计算方法,然后设置问题:如果为三棱柱晶胞或者六棱柱晶胞,又该如何计算?举一反三,巩固了学生对空间结构的理解和计算。最后利用课本学与问与课后习题3,进行训练反思。 三、教学过程设计 [多媒体演示](1)不同类型的晶体图片:玛瑙、水晶、碘等; (2)同一晶体,不同大小的图片。
第三章晶体结构与性质 第一节晶体常识 第一课时 教学目标: 1、通过实验探究理解晶体与非晶体的差异。 2、学会分析、理解、归纳和总结的逻辑思维方法,提高发现问题、分析问题和解决问题的能力。 3、了解区别晶体与非晶体的方法,认识化学的实用价值,增强学习化学的兴趣。 教学重难点: 1、晶体与非晶体的区别 2、晶体的特征 教学方法建议:探究法 教学过程设计: [新课引入]:前面我们讨论过原子结构、分子结构,对于化学键的形成也有了初步的了解,同时也知道组成千万种物质的质点可以是离子、原子或分子。又根据物质在不同温度和压强 下,物质主要分为三态:气态、液态和固态,下面我们观察一些固态物质的图片。 [投影]:1、蜡状白磷;2、黄色的硫磺;3、紫黑色的碘;4、高锰酸钾 [讲述]:像上面这一类固体,有着自己有序的排列,我们把它们称为晶体;而像玻璃这一类 固体,本身原子排列杂乱无章,称它为非晶体,今天我们的课题就是一起来探究晶体与非晶体的有关知识。[板书]:—、晶体与非晶体 [板书]:1、晶体与非晶体的本质差异 [提问]:在初中化学中,大家已学过晶体与非晶体,你知道它们之间有没有差异? [回答]:学生:晶体有固定熔点,而非晶体无固定熔点。 [讲解]:晶体有固定熔点,而非晶体无固定熔点,这只是晶体与非晶体的表观现象,那么他 们在本质上有哪些差异呢? [投影]晶体与非晶体的本质差异 [板书]:自范性:晶体能自发性地呈现多面体外形的性质。 [解释]:所谓自范性即“自发”进行,但这里得注意,“自发”过程的实现仍需一定的条件。例如:水能自发地从高处流向低处,但不打开拦截水流的闸门,水库里的水不能下泻。 [板书]:注意:自范性需要一定的条件,其中最重要的条件是晶体的生长速率适当。 [投影]:通过影片播放出,同样是熔融态的二氧化硅,快速的冷却得到玛瑙,而缓慢冷却得到水晶过程。[设问]:那么得到晶体的途径,除了用上述的冷却的方法,还有没有其它途径呢?你能列举 哪些? [板书]:2、晶体形成的一段途径: (1)熔融态物质凝固; (2)气态物质冷却不经液态直接凝固(凝华); (3)溶质从溶液中析出。
第三章《晶体结构与性质》《晶体的常识》教学设计 一、教学目标 1、知识与技能 (1)知道获得晶体的几种途径 (2)理解晶体的特点和性质及晶体与非晶体的本质区别 (3)初步学会确定一个晶胞中平均所含粒子数的方法 2、过程与方法 (1)收集生活素材,结合已有知识和生活经验对晶体与非晶体进行分类 (2)学生通过观察、实验等方法获取信息 (3)学会运用比较、分类、归纳、概括等方法对获取的信息进行加工 3、情感态度与价值观 (1)培养学生科学探究的方法 (2)培养学生的动手能力、观察能力、自主学习的能力,保持对生活中化学的好奇心和探知欲,增强学生学习化学的兴趣。 二、教学重点 1、晶体的特点和性质及晶体与非晶体的本质区别 2、确定一个晶胞中平均所含粒子数的方法 三、教学难点 1、确定一个晶胞中平均所含粒子数的方法 四、教学用品 课前学生收集的各种固体物质、玛瑙耳坠和水晶项链、蜂巢、晶胞实物模型、乒乓球、铁架台、酒精灯、蒸发皿、圆底烧瓶、碘、水、多媒体等 五、教学过程 1.新课导入: [教师]上课前,我已经请同学们收集了一些身边的固体物质,大家都带来了吗?(学生:带来了)你们都带来了哪些固体呢?(学生七嘴八舌,并展示各自的固体)[教师]同学们带来的固体物质可真是琳琅满目啊!但是,我们每个人可能只带了几样,想知道别人收集了哪些固体物质吗?(学生:想)下面我们请前后四个同学组成一个小组,然后互相交流一下收集的各种固体物质,并讨论如何将这些固体物质进行分类呢? [分组讨论]互相交流各自所带的物品,并分类(教师进行巡视) [教师]:请这组同学将你们带来的固体和交流的结果汇报一下。 [学生汇报]:(我们讨论后觉得将粗盐、明矾、樟脑丸分为一类;塑料、玻璃片、橡胶分为另一类。教师追问:你们为什么会这样分呢?生:根据这些有规则的几何外形,而另一些没有。) [教师总结]这组同学收集的物品很丰富,并通过组内讨论确定了分类依据,然后进行了恰当的分类。其实,同学们也许没有留心观察,我们身边还有许多美丽的固体,当然也有的可能是我们日常生活中不易接触到的。下面,我们就一起欣赏一下这些美丽的固体。 [视频投影]雪花放大后的形状、烟水晶、石膏、毒砂、绿柱石、云母等晶体实物(并配以相应的解说,给学生了解到这些固态物质都有规则的几何外形。) [教师讲述]我们就将这些有规则几何外形的固体称之为晶体,而另一些没有规则几何外形的固体称之为非晶体。 [板书]一、晶体与非晶体 设计意图:课前请同学收集身边的固态物质,然后在课堂上展示,并分组交流讨论,最后进行分类,并在课堂上汇报。这样从学生身边的固体入手,直观、简洁地引入课题,潜移默化
目录 一、结构解析的过程 (一)空间群的确定 (二)结构解析 (三)结构精修 1、结构精修 2、检验精修完毕的参考标准 3、Code.ins文件中的指令和意义 4、CIF文件 5、用WinGX生成键长键角表 二、画图 1、XP中的指令 2、操作实例 三、H键分析 1、策略 2、步骤 3、实例 四、芳香环间的相互作用 1、作用模型 2、判断芳香环间相互作用的步骤 3、实例 五、CIF格式
一、结构解析的过程 WinGX程序平台集成了下列主要程序: 1、确定空间群 (XPREP) 2、结构解析(SHELXS-97、SIR-92、SIR-97、SIR-2002) 3、结构精修 (SHELXL) (一)空间群的确定 打开WinGX, 从标题栏File命令中选择CHANGE PROJECT下的Slect New Project, 此时会出现一个对话框,添加测得数据中的.hkl文件。 1)标题栏Data命令中选择Xprep, 出现一个新的对话框,输入.hkl的文件名。2)出现Select option命令,(HKLF代表衍射强度数据的格式, 矿物晶体通常用HKLF 3进行计算,合成晶体通常用HKLF 4进行计算)通常默认[4]。 3)出现Mean(I/sigma)代表平均信/噪比(该数值要求>7,12~20之间比较好)。 在Enter cell corresponding to indices in files: 命令下输入相应的晶胞参数。4)出现Select option 命令,选择对称性高的选项作为可能的空间群。[ent]后程 序接着显示有关参数,包括晶胞参数,体积,晶格类别等,并提示下一个选项H:Search for higher Metric Symmetry(寻找更高的对称性). H[ent]。 5)程序显示目前的晶胞参数和其它可能的晶胞选择A(或B, C) [ent]。认同程序的选择后,程序提示下一选项:S:Determine or input space group(确定或输入已知的空间群)。S[ent]。 6)程序提供可能的晶系选择,如三斜(P),单斜(M),正交(O)等。[ent]认同程序的选择后,程序将检查各种可能存在的系统消光现象,确认各种可能的空间群,并通过计算衍射数据的Mean[E*E-1]值,提示晶体所属的空间群
第一节晶体的常识 [学习目标] [知识梳理] 一、晶体与非晶体 1.晶体的自范性即___________________________________________________________ .晶体呈自范性的条件之_.曰是__________________________________________ . 2.得到晶体一般有三条途径:⑴______________ ,(2) _______________________________ , ⑶ _____________________________ 3. 3.晶体的熔点较 ___________ ,而非晶体的熔点__________________ ,区分晶体与非晶体 最可靠的科学方法是 __________________________________________________ . 二、晶胞 4. ______________________________________________________________________ 是晶胞。 [方法导引]
晶胞中粒子数的计算方法: 晶体结构类习题最常见的题型就是已知晶胞的结构而求晶体的化学式。解答这类习题首先要明确一个概 念:由晶胞构成的晶体,其化学式不一定是表示一个分子中含有多少个原子,而是表示每个晶胞中平均含有各类原子的个数,即各类原子的最简个数比。解答这类习题,通常采用分摊法。 在一个晶胞结构中出现的多个原子,这些原子并不是只为这个晶胞所独立占有,而是为多个晶胞所共有, 那么,在一个晶胞结构中出现的每个原子,这个晶体能分摊到多少比例呢。这就是分摊法。分摊法的根本目的就是算出一个晶胞单独占有的各类原子的个数。 分摊法的根本原则是:晶胞任意位置上的一个原子如果是被x个晶胞所共有,那么,每个晶胞对这个原子 分得的份额就是1/X。 下面对立体晶胞进行详细分析。在立体晶胞中,原子可以位于它的顶点,也可以位于它的棱上,还可以在 它的面上(不含棱),当然,它的体内也可以有原子; 每个顶点被8个晶胞共有,所以晶胞对自己顶点上的每个原子只占1/8份额; 每条棱被4个晶胞共有,所以晶胞对自己棱上的每个原子只占1/4份额; 每个面被2个晶胞共有,所以晶胞对自己面上(不含棱)的每个原子只占1/2份额; 晶胞体内的原子不与其他晶胞分享,完全属于该晶胞。 1.每个晶胞涉及同类A数目m个,每个A为n个晶胞共有,则每个晶胞占有A: mx 1/n。 2 ?计算方法 例1 .水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165k时形成的,玻璃态的水无固态形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是()A.水由液态变为玻璃态,体积缩小 B. 水由液态变为玻璃态,体积膨胀
[ 教学设计 ] 第三章第一节晶体的常识(晶胞) 江苏省如东高级中学张霞 教学设想 从教材看,本章首先从人们熟悉的固体出发,把固体分为晶体和非晶体两大类,引出了晶体的特征和晶胞的概念。晶胞是描述晶体结构的基本单元,是研究晶体结构的最基本概念,教 科书利用图片、比喻等方式介绍了晶体与晶胞的关系,并通过例子介绍了如何计算晶胞中所含的 原子数。 本教案选择《晶胞》作为学生自主学习的课题,试图利用多媒体课件和形象比喻等教学方式,使学生建构起晶胞的概念,通过动手制作晶胞模型并把自己制作的晶胞模型拼凑成晶体 模型,体会晶胞与晶体之间的关系;再以课本上的问题设置矛盾,通过学生自学讨论,教 师的适当点拨,总结归纳出一个晶胞中平均所含粒子个数的计算方法,在此过程中,提升学生的 空间想象能力。 一、教学目标分析 知识与技能 1.了解晶体与晶胞的关系,体会由晶胞“无隙并置”构成晶体的过程。 2.通过自学讨论,掌握不同晶胞中平均所含粒子个数的计算方法。 过程与方法 1.运用多种教学媒体,借助形象的比喻,帮助学生建构抽象的空间结构。 2.知道研究晶体结构的一般方法。 情感态度和价值观 1、进一步形成求真务实、勤于思考的科学态度;形成敢于质疑、勇于创新的科学精神。 二、教学内容分析 对本节教学内容的处理方法:利用多媒体演示若干晶体和晶胞,组织学生讨论晶体与晶胞的关系,动手制作晶胞模型,引导学生建立以晶胞为基本结构研究晶体的思想,结合课本 图 3-7 铜晶胞,展示实物模型,提出问题:为什么说一个晶胞里只含 4 个铜原子?学生自学、 讨论并归纳出立方晶胞中平均所含粒子个数的计算方法,然后设置问题:如果为三棱柱晶胞 或者六棱柱晶胞,又该如何计算?举一反三,巩固了学生对空间结构的理解和计算。最后利用课本学与问与课后习题3,进行训练反思。
第三章晶体结构与性质 第一节晶体的常识 教学目标: 1、了解晶体的有关常识,知道什么是晶体,什么是晶胞。 2、从微观角度认识晶体的排列方式,会简单计算晶胞的化学式。 3、了解人类探索物质结构的价值,认同“物质结构的探索是无止境的”观点,认识在分子等层次研究物质的意义。 教学重点:晶体、晶胞概念。 教学难点:计算晶胞的化学式。 教学过程: [导课]走进化学实验室,你能见到许多固体,如蜡状的白磷(P4)、黄色的硫黄、紫黑色的碘(I2)和高锰酸钾(KMnO4)、蓝色的硫酸铜(CuSO4·5H20)、白色的碳酸钙等。放眼世界,自然界中绝大多数矿物也都是固体。你一定还能说出生活中常见的更多的固体,如金属、玻璃、陶瓷、砖瓦、水泥、塑料、橡胶、木材…… 你是否知道固体有晶体和非晶体之分?绝大多数常见的固体是晶体,只有如玻璃之类的物质属于非晶体(又称玻璃体)。晶体与非晶体有什么本质的差异呢?今天我们开始学习…。 [板书]第三章晶体结构与性质 第一节晶体的常识 [投影] [思考] [ [ 发生的过程。不过,“自发”过程的实现,仍需要一定的条件。例如,水能白发地从高处流向低处,但不打开拦截水流的闸门,水库里的水就不能下泻。晶体呈现自范性的条件之一是晶体生长的速率适当。熔融态物质冷却凝固,有时得到晶体,但凝固速率过快,常常只得到看不到多面体外形的粉末或没有规则外形的块状物。 [板书]1、晶体的自范性即晶体能白发地呈现多面体外形的性质。 [投影]
[讲述]最有趣的例子是天然的水晶球。水晶球是岩浆里熔融态的Si02侵入地壳内的空洞冷却形成的。剖开水晶球,常见它的外层是看不到晶体外形的玛瑙,内层才是呈现晶体外形的水晶。其实,玛瑙和水晶都是二氧化硅晶体,不同的是,玛瑙是熔融态Si02快速冷却形成的,而水晶则是热液缓慢冷却形成的。 [讨论]除以上水晶和玛瑙是熔融态冷却得到的,根据所学知识还有那些方法得到晶体? [汇报并板书] 2、得到晶体一般有三条途径:(1)熔融态物质凝固;(2)气态物质冷却不经液态直接凝固(凝华); (3)溶质从溶液中析出。 [投影]硫晶体、碘晶体、硫酸铜晶体的获得 [分组实验1] 在一个小烧杯里加入少量碘,用一个表面皿盖在小烧杯上,并在表面皿上加少量冷水。把小烧杯放在石棉网上加热,观察实验现象。 [分组实验2]用显微镜观察几种晶体结构:(K2Cr2O7、KNO3、萘) [板书]3、晶体的自范性是晶体中粒子在微观空间里呈现周期性的有序排列的宏观表象。 [投影] [自学] [提问]什么是晶体的各向异性? [板书]4、晶体的特点①外形和内部质点排列的高度有序性;②各向异性;③晶体的熔点较固定。 [讲述]各向异性:像人们在观察大幅图案画时的视觉感受,对不同的图案画的感受当然是不同的,而对于同一幅图案画来说,由不同的方向审视时,也会产生不同的感受。所以,晶体的某些物理性质的各向异性同样反映了晶体内部质点排列的有序性,而且通过这些性质可以了解晶体的内部排列与结构的一些信息。而非晶体则不具有物理性质各向异性的特点。区分晶体和非晶体最可靠的科学方法是对固体进行X—射线衍射实验,有兴趣的同学可以阅读相关的科学视野。 [分组探讨]1、某同学在网站土找到一张玻璃的结构示意图如图3—5所示,这张图说明
物质结构要点 1、核外电子排布式 外围核外电子排布式价电子排布式 价电子定义:1、对于主族元素,最外层电子 2、第四周期,包括3d与4S 电子 电子排布图 熟练记忆 Sc Fe Cr Cu 2、S能级只有一个原子轨道向空间伸展方向只有1种球形 P能级有三个原子轨道向空间伸展方向有3种纺锤形 d能级有五个原子轨道向空间伸展方向有5种 一个电子在空间就有一种运动状态 例1:N 电子云在空间的伸展方向有4种 N原子有5个原子轨道 电子在空间的运动状态有7种 未成对电子有3个 ------------------------结合核外电子排布式分析 例2 3、区的划分 按构造原理最后填入电子的能级符号 如Cu最后填入3d与4s 故为ds区 Ti 最后填入能级为3d 故为d区 4、第一电离能:同周期从左到右电离能逐渐增大趋势(反常情况:S2与P3 半满或全 满较稳定,比后面一个元素电离能较大) 例3、比较C、N、O、F第一电离能的大小 --------------- F >N>O>C
例4、某元素的全部电离能(电子伏特)如下: 回答下列各问: (1)I6到I7间,为什么有一个很大的差值?这能说明什么问题? _________________________ (2)I4和I5间,电离能为什么有一个较大的差值_________________________________ (3)此元素原子的电子层有 __________________层。最外层电子构型为 ______________ 5、电负性:同周期从左到右电负性逐渐增大(无反常)------------F> O >N >C 6、对角线规则:某些主族元素与右下方的主族元素的性质有 些相似,被称为“对角线规则”如:锂和镁在空气中燃烧 的产物,铍和铝的氢氧化物的酸碱性以及硼和硅的含氧酸酸性的强弱 7、共价键:按原子轨道重叠形式分为:σ键和π键 (具有方向性和饱和性) 单键 -------- 1个σ键 双键------1个σ键和1个π键 三键---------1个σ键和2个π键 8、等电子体:原子总数相等,价电子总数相等----------具有相似的化学键特征 例5、N2 CO CN-- C22-互为等电子体 CO2 CS2 N2O SCN-- CNO-- N3- 互为等电子体 从元素上下左右去找等电子体,左右找时及时加减电荷,保证价电子相等。9、应用VSEPR理论判断下表中分子或离子的构型。
选修3第三章《晶体结构与性质》章教学设计 东莞市第一中学刘国强 一、本章教材体现的课标内容 1、主题:第一节晶体的常识 了解晶胞的概念,会计算晶胞中原子占有个数,并由此推导出晶体的化学式。 2、主题:第二节分子晶体与原子晶体 知道分子晶体与原子晶体的结构微粒、微粒间作用力的区别。 了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。 3、主题:第三节金属晶体 知道金属键的涵义,能用金属键理论解释金属的一些物理性质。 能列举金属晶体的基本堆积模型。 知道金属晶体的结构微粒、微粒间作用力与分子晶体、原子晶体的区别。 4、主题:第四节离子晶体 能说明离子键的形成,能根据离子化合物的结构特征解释其物理性质。 知道离子晶体的结构微粒、微粒间作用力与分子晶体。原子晶体、金属晶体的区别。 了解晶格能的应用,知道晶格能的大小可以衡量离子晶体中离子键的强弱。 二、本章教材整体分析 (一)教材地位 本单元知识是在原子结构和元素周期律以及化学键等知识的基础上介绍的,是原子结构和化学键知识的延伸和提高;本单元知识围绕晶体作了详尽的介绍,晶体与玻璃体的不同,分子晶体、原子晶体、金属晶体、离子晶体,从构成晶体的微粒、晶胞、微粒间的作用力,熔沸点比较等物理性质做了比较,结合许多彩图及详尽的事例,对四大晶体做了阐述;同时,本单元结合数学立体几何知识,充分认识和挖掘典型晶胞的结构,去形象、直观地认识四种晶体,在学习本单元知识时,应多联系生活中的晶体化学,去感受生活中的晶体美,去感受环境生命科学、材料中的晶体知识。 “本章比较全面而系统地介绍了晶体结构和性质,作为本书的结尾章,与前两章一起构成“原子结构与性质、分子结构与性质、晶体结构与性质”三位一体的“物质结构与性质”模块的基本内容。” “通过本章的学习,结合前两章已学过的有关物质结构知识,学生能够比较全面地认识物质的结构及结构对物质性质的影响,提高分析问题和解决问题的能力。” (二)内容体系 本单元知识内容分为两大部分,第一节简单介绍晶体的常识,区别晶体与非晶体,认识什么是晶胞:第二部分分为三节内容,第二节“分子晶体和原子晶体”分别介绍了分子晶体和原子晶体的结构特征及晶体特性,在陈述分子晶体的结构特征时,以干冰为例,介绍了如果分子晶体中分子问作用力只是范德华力时,分子晶体具有分子密堆积特征;同时,教科书以冰为例,介绍了冰晶体里由于存在氢键而使冰晶体的结构具有其特殊性。在第三节“金属晶体”中,首先从“电子气理论”介绍了金属键及金属晶体的特性,然后以图文并茂的方式描述了金属晶体的四种基本堆积模式。在第四节“离子晶体”中,由于学生已学过离子键的概念,教科书直接给出了NaCl和CsCl两种典型离子晶体的晶胞,然后通过“科学探究”讨论了NaCl和CsCl两种晶体的结构;教科书还通过例子重点讨论了影响离子晶体结构的几何因素和电荷因素,而对键性因素不作要求。晶格能是反映离子晶体中离子键强弱的重要数据,教科书通过表格形式列举了某些离子晶体的晶格能,以及晶格能的大小与离子晶体的性质的关系。
2 分子晶体与原子晶体 第一课时分子晶体 [教材内容分析] 晶体具有的规则的几何外形源于组成晶体的微粒按一定规律周期性的重复排列。本节延续前面一节离子晶体,以“构成微粒---晶体类型---晶体性质”的认知模式为主线,着重探究了典型分子晶体冰和干冰的晶体结构特点。并谈到了分子间作用力和氢键对物质性质的影响。使学生对分子晶体的结构和性质特点有里一个大致的了解。并为后面学习原子晶体做好了知识准备,以形成比较。 [教学目标设定] 1.使学生了解分子晶体的组成粒子、结构模型和结构特点及其性质的一般特点。 2.使学生了解晶体类型与性质的关系。 3.使学生理解分子间作用力和氢键对物质物理性质的影响。 4.知道一些常见的属于分子晶体的物质类别。 5.使学生主动参与科学探究,体验研究过程,激发他们的学习兴趣。 [教学重点难点] 重点掌握分子晶体的结构特点和性质特点 难点是氢键的方向性和氢键对物体物理性质的影响 从三维空间结构认识晶胞的组成结构 [教学方法建议] 运用模型和类比方法诱导分析归纳 [教学过程设计] 复问:什么是离子晶体?哪几类物质属于离子晶体? (离子化合物为固态时均属于离子晶体,如大部分盐、碱、金属氧化物属于离子晶体) 教师诱导:这些物质属于离子晶体吗?构成它们的基本粒子是什么?这些粒子间通过什么作用结合而成的? 学生分组讨论回答 板书分子通过分子间作用力形成分子晶体 二、分子晶体 1.定义:含分子的晶体称为分子晶体 也就是说:分子间以分子间作用力相结合的晶体叫做分子晶体 看图3-9,如:碘晶体中只含有I2分子,就属于分子晶体问:还有哪些属于分子晶体? 2.较典型的分子晶体有非金属氢化物,部分非金属单质,部分非金属氧化物,几乎所有的酸,绝大多数有机物的晶体。 3.分子间作用力和氢键
晶胞结构浅析 一、晶胞 晶体是由完全等同的晶胞并置无隙地堆积而成的,晶胞是晶体的基本重复单位,常说的晶胞类型就是指晶体的点阵类型。 晶胞有两个要素: (1)晶胞的大小和形状。晶胞平行六面体的大小和形状由其三边长a、b、c及其夹角α=b∧c,β= c∧a,γ= a∧b确定,这六个数称为晶胞参数。 (2)晶胞的内容,即晶胞中原子的种类、数目及位置。 二、晶胞的特点 (1) 晶胞具有平移性 整块晶体是由完全等同的晶胞并置无隙地堆积而成的。所谓“并置”,是指从一个晶胞到另一个晶胞,无须转动,是简单平移,晶体中不存在取向不同的晶胞。所谓“无隙”,指晶胞与晶胞总是共面共顶角共棱地比邻,晶胞间不留任何空隙。其实,“并置无隙”是晶胞本质特征——“平移性”的另一描述而已,不具有平移性就不是晶胞。 (2) 晶胞具有相同的顶角、相同的平行面和相同的平行棱。 观察一个晶胞,绝对不能把它当作游离孤立的几何体,而需“想象”它的上下左右前后都有共面共顶点共棱的完全等同的晶胞与之比邻。晶胞的平移性决定了晶胞具有相同的顶角、相同的平行面和相同的平行棱,否则就不具有平移性。 如图1中每个小立方体(图示大小的八分之一)不是NaCl晶胞,它们的顶角不等同,而其八倍体积的大立方体(图示大小)才是氯化钠晶胞;而图2中,CsCl晶胞不是左侧大立方体而是右侧小立方体。 qqqeee
图5 图1 图2 另外,可以选为晶胞的多面体较多,只要它们可以无隙并置地充满整个微观空间,即具有平移性,都可以选用,但现在通常谈论的三维晶胞,即“习用晶胞”,指的是平行六面体。也就是说,晶胞在三维空间为平行六面体,于是在二维空间是平行四边形。如图3是层型石墨原子分布图,六个碳原子组成的六边形并不是石墨的二维晶胞,而图中所示的三个平行四边形都是它的二维晶胞,因为它们都可以通过平移并置无隙地构成石墨层。石墨的三维晶胞则是相邻三个石墨层组成的平行六面体,上下层为该平行四边形,如图4 所示,而由相邻三个石墨层组成的六方柱体(上下层为六边形)是不符合约定俗成的习用晶胞定义的。 图3 图4 三、晶胞中原子坐标与原子的计数 1.原子坐标 为了给出原子的位置参数以描述原子在晶胞中的位置,必须建立坐标系,晶体的坐标系称为晶轴系。晶体的六个晶胞参数给出了晶体的“天然”坐标系。晶轴系以晶胞参数a 、 b 、 c 分别为x, y, z 三个坐标轴的单位向量a 、b 、c 的长度,三个轴之间的夹 角则分别相应于α、β、γ,因此常称晶胞参数a 、b 、c 为晶轴。晶轴系常采 用如图5所示的右手系。 晶胞中一个原子的位置P 由其位置向量 确定: =x a +y b +z c OP OP
高中化学选修三晶体结 构与性质全套教案 HUA system office room 【HUA16H-TTMS2A-HUAS8Q8-
第三章晶体结构与性质 第一节晶体常识 第一课时 教学目标设定: 1、通过实验探究理解晶体与非晶体的差异。 2、学会分析、理解、归纳和总结的逻辑思维方法,提高发现问题、分析问题和解决问题的能力。 3、了解区别晶体与非晶体的方法,认识化学的实用价值,增强学习化学的兴趣。 教学重难点: 1、晶体与非晶体的区别 2、晶体的特征 教学方法建议:探究法 教学过程设计: [新课引入]:前面我们讨论过原子结构、分子结构,对于化学键的形成也有了初步的了解,同时也知道组成千万种物质的质点可以是离子、原子或分子。又根据物质在不同温度和压强下,物质主要分为三态:气态、液态和固态,下面我们观察一些固态物质的图片。
[投影]:1、蜡状白磷; 2、黄色的硫磺; 3、紫黑色的碘; 4、高锰酸钾 [讲述]:像上面这一类固体,有着自己有序的排列,我们把它们称为晶体;而像玻璃这一类固体,本身原子排列杂乱无章,称它为非晶体,今天我们的课题就是一起来探究晶体与非晶体的有关知识。 [板书]:一、晶体与非晶体 [板书]:1、晶体与非晶体的本质差异 [提问]:在初中化学中,大家已学过晶体与非晶体,你知道它们之间有没有差异? [回答]:学生:晶体有固定熔点,而非晶体无固定熔点。 [讲解]:晶体有固定熔点,而非晶体无固定熔点,这只是晶体与非晶体的表观现象,那么他们在本质上有哪些差异呢? [投影] 晶体与非晶体的本质差异
[板书]:自范性:晶体能自发性地呈现多面体外形的性质。 [解释]:所谓自范性即“自发”进行,但这里得注意,“自发”过程的实现仍需一定的条件。 例如:水能自发地从高处流向低处,但不打开拦截水流的闸门,水库里的水不能下泻。 [板书]:注意:自范性需要一定的条件,其中最重要的条件是晶体的生长速率适当。 [投影]:通过影片播放出,同样是熔融态的二氧化硅,快速的冷却得到玛瑙,而缓慢冷却得到水晶过程。 [设问]:那么得到晶体的途径,除了用上述的冷却的方法,还有没有其它途径呢?你能列举哪些? [板书]:2、晶体形成的一段途径: (1)熔融态物质凝固; (2)气态物质冷却不经液态直接凝固(凝华); (3)溶质从溶液中析出。 [投影图片]: 1、从熔融态结晶出来的硫晶体; 2、凝华得到的碘晶体;
《晶体的常识》教学反思 晶体的常识安排在原子结构、分子结构以及结构决定性质的内容之后来学习,对于学生的学习有一定的理论基础。本章比较全面而系统地介绍了晶体结构和性质,不管是哪种类型的晶体,它们都具有一些共性,这些共性的内容作为第一节《晶体常识》。本节内容主要是通过介绍各种各样的固体为出发点来过渡到本堂课的主题——晶体和非晶体,晶体与非晶体的本质差异是本节课的重难点。由于这一节内容比较抽象,其间出现了诸多抽象名词,如:“自范性、各向异性、无隙并置、晶胞”,以及研究原子对晶胞的贡献等,如何将这些抽象的内容具体化、形象化,并深入浅出地介绍给学生,成为本节课的难点。作为执教者运用身边事物,直观录象、图片、亲自动手操作实验等方法,利用多种教学手段,比较巧妙地使科学知识与学生的认识、学生的情感产生共鸣,通过主观感悟使学生轻松地学习本节内容。 利用具体的实物和图片进行教学,让学生展示课前收集的各种固体,教师展示一些实验室常见的晶体实物:食盐、蓝矾、明矾、硝酸钾等和非晶体实物:玻璃、松香,一些塑料以及部分它们的图片,以物激趣,引出晶体的学习。然后提出疑问:如何对这些固体进行分类?提出晶体与非晶体的概念。这样从学生身边的固体入手,直观、简洁地引入课题,潜移默化地使学生融入课堂。合理地创设情境,培养学生把所学的化学知识与生活实际联系起来,从化学视角观察、分析周围的事物与现象,寻找其中的规律和联系,引导学生进行自主合作活动,提高学生学习化学的兴趣和学习效率。 展示玛瑙和水晶饰品学生描述外观,播放玛瑙和水晶形成过程的录像,提出问题:二者材质有何关系?水晶的天然规则几何外形是如何形成的?为何玛瑙不象水晶一样形成规则的几何外形?通过视频材料,给学生以直观的视觉感知,紧扣视频设计问题,层层推进,让学生对晶体形成过程中的“自范性”和“自范性条件”这两个难以理解的概念轻松地了解。展示晶体二氧化硅和非晶体二氧化硅的微观结构示意图,引导学生自主讨论为什么晶体呈现多面体外形?晶体有什么性质?怎样鉴别晶体与非晶体?分析晶体与非晶体的本质差异,通过对晶体内部微观结构的分析,培养学生实事求是、务实严谨的学习作风和学习化学的兴趣,通过“内部有序造就了外部有序”的事实,培养学生的探究精神。 通过和学生一起回忆水晶、玛瑙的形成过程,学生分组进行碘升华的实验,
第三章晶体结构与性质 ◇考纲解读: 一、考点(考查内容) 1、构成分子晶体、原子晶体、离子晶体、金属晶体的结构微粒及微粒间作用力的区别; 2、原子晶体、离子晶体、分子晶体熔、沸点的高低比较; 3、晶胞中实际拥有微粒的求算; 4、几种常见金属晶体的堆积模型。 二、考纲要求 1、了解晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质之间的关系; 2、知道金属键的含义,能用金属键理论解释金属的物理性质,能列举金属晶体的基本堆积模型; 3、了解分子晶体、原子晶体、离子晶体、金属晶体的结构微粒及微粒间作用力的区别。 三、考查角度 在选择题中主要考查晶体类型、四种晶体的区别等,在综合题中考查晶体的结构特点以及有关离子晶体晶胞中微粒数的计算。 第一节晶体的常识 一、晶体与非晶体 1、晶体与非晶体的区别:
【注意】:(1)、晶体有规则的几何外形,但有规则几何外形的不一定是晶体。 如:玻璃、塑料等相关制品不是晶体; (2)、同一物质可以是晶体,也可以是非晶体。如晶体SiO2和非晶体SiO2 。 2、获得晶体的三条途径: (1)、熔融态物质凝固; (2)、气态物质冷却不经液态直接凝固(凝华); (3)、溶质从溶液中析出。 二、晶胞 1、定义:为了描述晶体在微观空间里原子的排列,无须画出千千万万个原子,只需在晶体微观空间里取出一个基本单元即可。这种描述晶体结构的基本单元叫做晶胞。 2、晶胞(的特点)与晶体的关系:(1)、晶胞是描述晶体结构的基本单元; (2)、数量巨大的晶胞“无隙并置”构成晶体; 晶胞是晶体的代表,是晶体中的最小单位。晶胞并置起来,则得到晶体。晶胞的代表性体现在以下两个方面:一是代表晶体的化学组成;二是代表晶体的对称性,即与晶体具有相同的对称元素(对称轴、对称面和对称中心)。 一般说来,晶胞都是平行六面体。整块晶体可以看成是无数晶胞“无隙并置”而成。 【说明】:“无隙”,是指相邻晶胞之间没有任何间隙; “并置”,是指所有晶胞都是平行排列的,取向相同。 3、晶胞中粒子数目的计算方法——均摊法: 如果某个粒子为个晶胞所共有,则该粒子有属于这个晶胞。 (1)、在做由晶体结构确定物质的化学式的题目时,一般利用均摊法,如由立方体结构晶体的晶胞确定晶体化学式的方法: ①、处于立方体顶点上的粒子,同时为8个晶胞共有,每个粒子有属于该晶胞;
典型晶体晶胞结构1.原子晶体 (金刚石 ) 2.分子晶体
3.离子晶体 + Na - Cl
4.金属晶体 堆积模型简单立方钾型镁型铜型典型代表Po Na K Fe Mg Zn Ti Cu Ag Au 配位数 6 8 12 12 晶胞 5.混合型晶体——石墨 1.元素是Cu 的一种氯化物晶体的晶胞结构如图 13 所示,该氯化物的化学 式,它可与浓盐酸发生非氧化还原反应,生成配合物H n WCl 3,反应的化 学方程式为。 2.( 2011 山东高考)CaO 与NaCl 的晶胞同为面心立方结构,已知CaO 晶体密度为ag·cm-3,N A表示阿伏加德罗常数,则CaO 晶胞体积为cm3。 2.( 2011 新课标全国)六方氮化硼BN 在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚 石相当,晶苞边长为361.5pm ,立方氮化硼晶胞中含有______各氮原子、 ________各硼原子,立方氮化硼的密度是_______g ·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为N A)。
解析:描述晶体结构的基本单元叫做晶胞,金刚石晶胞是立方体,其中8 个顶点有8 个碳原子, 6 个面各有 6 个碳 原子,立方体内部还有 4 个碳原子,如图所示。所以金刚石的一个晶胞中含有的碳原子数= 8×1/8+6 ×1/2+4=8 ,因此立方氮化硼晶胞中应该含有 4 个 N 和 4 个 B 原子。由于立方氮化硼的一个晶胞中含有 4 个 4 25g 是,立方体的体积是(361.5cm)3,因此立方氮化硼的密度是 N 和 4 个 B 原子,其质量是 1023 6.02 g·cm-3。 3.( 4)元素金( Au )处于周期表中的第六周期,与Cu 同族, Au 原子最外层电子排布式为______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu 原子处于面心, Au 原子处于顶点位置,则该合金中Cu 原子与 Au 原子数量之比为 _______;该晶体中,原子之间的作用力是________; ( 5)上述晶体具有储氢功能,氢原子可进入到由Cu 原子与 Au 原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为_____。 4.( 2010 山东卷)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心, O2-处于晶胞棱边中心,该化合物化学式为,每个 Ba2+与个 O2-配位。 5.(4) CaC2晶体的晶胞结构与NaCl晶体的相似(如右图所示),但 CaC2晶体中含有的中哑 铃形 C 22 的存在,使晶胞沿一个方向拉长。CaC 2晶体中1个 Ca 2 周围距离最近的 C 22 数目 为。 6.( 09 江苏卷 21 A )③在 1 个 Cu2O 晶胞中(结构如图所示),所包含的Cu 原子数目 为。
第二节分子晶体与原子晶体 第二课时原子晶体 〖教学目标设定〗 1、掌握原子晶体的概念,能够区分原子晶体和分子晶体。 2、了解金刚石等典型原子晶体的结构特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。 〖教学难点重点〗 原子晶体的结构与性质的关系 〖教学过程设计〗 复习提问:1、什么是分子晶体?试举例说明。 2、分子晶体通常具有什么样的物理性质? 引入新课: 分析下表数据,判断金刚石是否属于分子晶体 展示:金刚石晶体 阅读:P68 ,明确金刚石的晶型与结构 归纳: 1.原子晶体:相邻原子间以共价键相结合而形成的空间网状结构的晶体。 2.构成粒子:原子; 3.粒子间的作用:共价键; 展示:金刚石晶体结构 填表:
归纳: 4.原子晶体的物理性质 熔、沸点_______,硬度________;______________一般的溶剂;_____导电。思考:(1)原子晶体的化学式是否可以代表其分子式,为什么? (2)为什么金刚石的熔沸点很高、硬度很大? (3)阅读:P69 ,讨论“学与问 1 ” 归纳:晶体熔沸点的高低比较 ①对于分子晶体,一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔沸点也越高。 ②对于原子晶体,一般来说,原子间键长越短,键能越大,共价键越稳定,物质的熔沸点越高,硬度越大。 合作探究: (1)在金刚石晶体中,每个C与多少个C成键?形成怎样的空间结构?最小碳环由多少个石中,含CC原子组成?它们是否在同一平面内? (2)在金刚石晶体中,C原子个数与C—C键数之比为多少? (3)12克金刚—C键数为多少N A? 比较:CO 2与SiO 2 晶体的物理性质 阅读:P68 ,明确SiO 2 的重要用途 推断:SiO 2晶体与CO 2 晶体性质相差很大,SiO 2 晶体不属于分子晶体 展示:展示SiO 2 的晶体结构模型(看书、模型、多媒体课件),分析其结构特点。 引导探究:SiO 2和C0 2 的晶体结构不同。在SiO 2 晶体中,1个Si原子和4个O原 子形成4个共价键,每个Si原子周围结合4个O原子;同时,每个O原子跟2个Si原子相结合。实际上,SiO 2 晶体是由Si原子和O原子按1:2的比例所组成的立体网状的晶体。
教师学科教案[ 20 – 20 学年度第__学期] 任教学科:_____________ 任教年级:_____________ 任教老师:_____________ xx市实验学校
第三章晶体结构与性质 第一节晶体的常识 教学目标: 1、了解晶体的有关常识,知道什么是晶体,什么是晶胞。 2、从微观角度认识晶体的排列方式,会简单计算晶胞的化学式。 3、了解人类探索物质结构的价值,认同“物质结构的探索是无止境的”观点,认识在分子等层次研究物质的意义。 教学重点:晶体、晶胞概念。 教学难点:计算晶胞的化学式。 教学过程: [导课]走进化学实验室,你能见到许多固体,如蜡状的白磷(P4)、黄色的硫黄、紫黑色的碘(I2)和高锰酸钾(KMnO4)、蓝色的硫酸铜(CuSO4·5H20)、白色的碳酸钙等。放眼世界,自然界中绝大多数矿物也都是固体。你一定还能说出生活中常见的更多的固体,如金属、玻璃、陶瓷、砖瓦、水泥、塑料、橡胶、木材…… 你是否知道固体有晶体和非晶体之分?绝大多数常见的固体是晶体,只有如玻璃之类的物质属于非晶体(又称玻璃体)。晶体与非晶体有什么本质的差异呢?今天我们开始学习…。 [板书]第三章晶体结构与性质 第一节晶体的常识 [投影] [思考] [ 自范性微观结构 晶体有(能自发呈现多面体外型)原子在三维空间里呈周期 性的有序排列 非晶体没有(不能自发呈现多面体外型)原子排列相对无序[ 发生的过程。不过,“自发”过程的实现,仍需要一定的条件。例如,水能白发地从高处流向低处,但不打开拦截水流的闸门,水库里的水就不能下泻。晶体呈现自范性的条件之一是晶体生长的速率适当。熔融态物质冷却凝固,有时得到晶体,但凝固速率过快,常常只得到看不到多面体外形的粉末或没有规则外形的块状物。 [板书]1、晶体的自范性即晶体能白发地呈现多面体外形的性质。 [投影] [讲述]最有趣的例子是天然的水晶球。水晶球是岩浆里熔融态的Si02侵入地壳内的空洞冷却形成的。剖开水晶球,常见它的外层是看不到晶体外形的玛瑙,内层才是呈现晶体外形的水晶。其实,玛瑙和水晶都是二氧化硅晶体,不同的是,玛瑙是熔融态Si02快速冷却形成