
弱电解质的电离学案
教学目标
1.知识与技能:
(1) 了解电解质、强电解质和弱电解质的概念。
(2) 能描述弱电解质在水溶液中的电离平衡,以及理解温度、浓度等条件对电离平
衡的影响。
(3) 了解弱电解质的电离平衡常数概念及电离平衡常数与电离程度的关系
2.过程与方法:
(1) 通过实验,培养学生观察、分析能力、对比总结能力。
(2) 通过运用化学平衡原理解决弱电解质的电离平衡问题,掌握推理、归纳、演绎
和类比等科学方法。
3.情感态度和价值观:
由弱电解质的电离、阴阳离子共存等特征,体会矛盾体双方相附相存的对立统一关系。通过电离平衡中电解质分子的电离、离子间的结合这种动态平衡关系,进
一步体验化学平衡的“动”、“定”、“变”等特征。
教学重点电离平衡的建立与电离平衡的移动。
教学难点外界条件对电离平衡常数、电离平衡的影响
教学过程
主题学习探究过程规律、方法归纳
课前热身
根据强弱电解质的区别填下面
相同条件下,同体积浓度都为0.1mol/L的盐酸和醋酸溶液中
(1)c(H+)的大小:盐酸醋酸;
(2)导电能力:盐酸_醋酸;
(3)都稀释10倍,PH值改变较大的。
基础再现
一、弱电解质的电离平衡
1.(1)电离平衡状态:在一定条件下(如温度、浓度),当电解质分子
时,电离过程就达到了平衡状态,叫做电
离平衡。
(2)电离平衡的特点:
(3)电离平衡的图象(自己画)
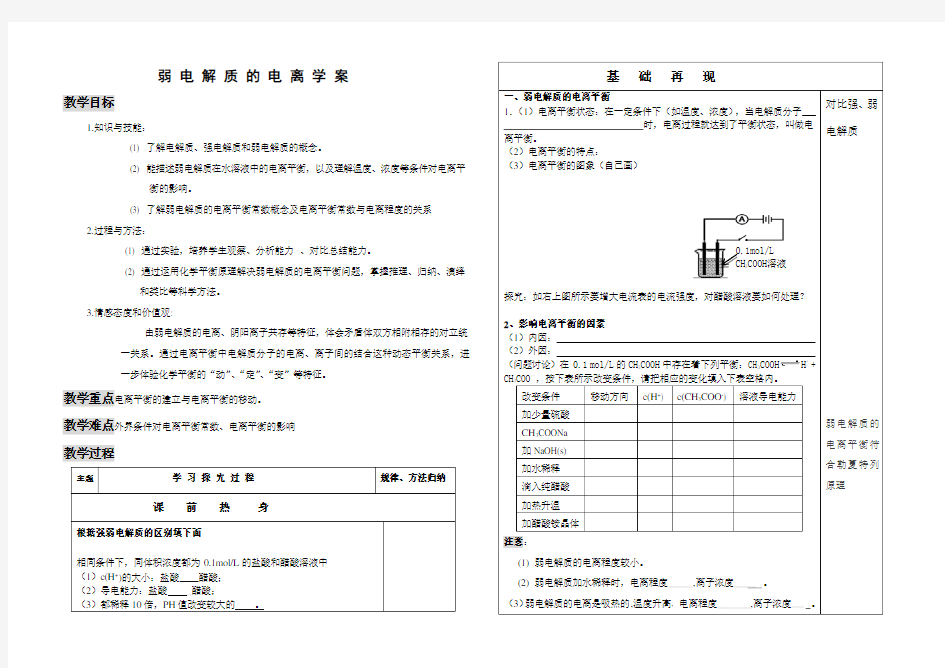
探究:如右上图所示要增大电流表的电流强度,对醋酸溶液要如何处理?
2、影响电离平衡的因素
(1)内因:
(2)外因:
(问题讨论)在0.1 mol/L的CH3COOH中存在着下列平衡:CH3COOH H++
CH3COO-,按下表所示改变条件,请把相应的变化填入下表空格内。
改变条件移动方向c(H+) c(CH3COO-) 溶液导电能力
加少量硫酸
CH3COONa
加NaOH(s)
加水稀释
滴入纯醋酸
加热升温
加醋酸铵晶体
注意:
(1)弱电解质的电离程度较小。
(2)弱电解质加水稀释时,电离程度_____,离子浓度_____ 。
(3)弱电解质的电离是吸热的,温度升高, 电离程度_______,离子浓度___ 。
对比强、弱
电解质
弱电解质的
电离平衡符
合勒夏特列
原理
0.1m o l/L
C H3C O O H溶液
3. 电离方程式的书写:
(1)CH3COOH (2)NH3·H2O
(3) NaOH (4) H2SO4
(5) H2CO3(6) NaHCO3
(7) NaHSO4 (8) H2S
〖针对练习〗
1.已知0.1 mol/L的醋酸溶液中存在电离平衡:CH
3
COOH
CH
3
COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( ) A、加少量烧碱溶液B、降低温度
C、加少量冰醋酸
D、加水电离方程式书写规律:
4、一元强酸与一元弱酸的比较
(1)相同物质的量浓度、相同体积的一元强与一元弱酸的比较
比较项目酸C(H+) PH 中和碱
的能力
与足量Zn反
应产生H2的量
开始反
应的速率应
(1)相同PH、相同体积的一元强与一元弱酸的比较
比较项目C
(H+) 溶液的物
质量浓度
中和碱
的能力
与足量Zn反
应产生H2的量
与足量锌反应
需时间应
一元强酸
一元弱酸
注:加入的锌指颗粒大小一致、质量相等时才能比较,但这种前提条件很难做到。
〖针对练习〗
2、H+浓度相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的质量相同,则下列说法正确的是
①反应所需要的时间B>A②开始反应时的速率A>B③参加反应的锌的物质的量A=B④反应过程的平均速率B>A⑤盐酸里有锌剩余⑥醋酸里有锌剩余
A、③④⑥
B、②③⑥
C、③④⑤
D、①②⑤强、弱电解
质的对比:
3、现有等体积的Ba(OH)2、KOH和NH3·H2O三种溶液,将它们分别与V1L、
V2L、V3L等浓度的盐酸混合,下列说法正确的是
A、若混合前三种溶液PH相等,将它们同等倍数稀释后则KOH溶液PH
最大
B、若混合前三种溶液物质的量浓度相等,混合后溶液呈中性,则V1>V2
>V3
C、若混合前三种溶液物质的量浓度相等,酸碱恰好完全反应,则V1>V2
>V3
D、若混合前三种溶液PH相等,酸碱恰好完全反应,则V1>V2>V3
〖思维激活〗衡量弱电解质强弱的物理量还有那些?
三、电离常数
1、电离常数
2、写出CH3COOH、NH3·H2O、H2S的电离平衡常数表达式
3. 电离平衡常数的影响因素是什么:
4.K与弱电解质的电离程度、弱电解质的酸性(或碱性)相对强弱有何关系:
〖针对练习〗
4.已知下面三个数据:7.2×10—4、4.6×10—4、4.9×10—4分别是下列有关
的三种酸的电离常数,若已知下列反应可以发生:
NaCN + HNO2===HCN + NaNO2
NaCN + HF=====HCN + NaF
NaNO2+ HF=====HNO2 + NaF
由此可判断下列叙述不正确的是()
A、K(HF)=7.2×10—4
B、K(HNO2)==4.9×10—4
C、根据两个反应即可得出结论
D、K(HCN)<K(HNO2)<K(HF)
总结:
〖巩固练习〗
1. 下列说法中正确的是()
A、能溶于水的盐是强电解质,不溶于水的盐是非电解质;
B、强电解质溶液中不存在溶质分子;弱电解质溶液中必存在溶质分子;
C、在熔融状态下能导电的化合物一定是离子化合物,也一定是强电解质;
D、Na
2O
2
和SO
2
溶液于水后所得溶液均能导电,故两者均是电解质。
E、强电解质溶液的导电能力比弱电解质溶液的强
2.为了证明某可溶性一元酸(HX)是弱酸,有如下实验方案,其中不合理的是()
A、室温下,测0.1mol/LHX溶液的PH,若PH>1,证明HX是弱酸
B、室温下,测1mol/LNaX溶液的PH,若PH>7,证明HX是弱酸
C、将等浓度、等体积的HCl和NaX溶液混合,若混合溶液PH<7,证明HX 是弱酸
D、相同条件下,对0.1mol/LHCl和0.1mol/LHX进行导电性实验,若与HX溶液相串联的灯泡较暗,证明HX为弱酸
3、已知某酸H2B在水溶液中存在下列关系①H2B H++HB-②HB-H++ B2-。关于该酸对应的酸式盐NaHB的溶液,下列说法中,一定正确的是()
A、NaHB属于弱电解质
B、溶液中的离子浓度c(Na+)>c(HB-)>c(H+)>c(OH-)
C、c(Na+)= c(HB-) + c(B2-) + c(H2B)
D、NaHB和NaOH溶液反应的离子方程式为H+ + OH— ==H2O
4、、0.1 mol/L氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是()
①电离度增大②c(NH3·H2O))增大
③NH4+数目增多④c(OH-)增大
⑤导电性增强⑥c(NH4+)/c(NH3·H2O)增大
A.①②③ B.①③⑤ C.①③⑥ D.②④⑥5. 把0.05mol NaOH固体分别加入到下列100mL液体中,溶液的导电性基本不变的是()A、自来水B、0.5mol/L盐酸
C、0.5mol/L醋酸
D、0.5mol/L氯化氨溶液
7. 用一定量的水稀释0.1mol/L的醋酸时,溶液中随着水量的增加而增大的是() A. n(H+) B. c(H+)
C. c(H+)/ c(CH3COOH)
D. c(CH3COOH)/c(H+)
8.在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如右图所示。回答:(1)“O”点导电能力为“0”的理由是_____________。
(2)A、B、C三点pH值由大到小的顺序是______。
(3) A、B、C三点电离程度最大的是________________。
(4)若使c点溶液中c(CH
3
COO-)增大,而c(H+)减小,可采取
的措施
①②
③
作业:试用简单的实验证明,在醋酸溶液中存在CH
3COOH CH
3
COO-+H+的电
离平衡。(写出步骤、现象、结论)