
第17卷 第3期 2007年3月
阿维菌素的生物合成研究进展与展望
*
陈 芝 宋 渊 文 莹 李季伦**
中国农业大学生物学院微生物系,北京100094
2006207219收稿,2006208218收修改稿
*国家重点基础研究发展计划资助项目(批准号:2003CB114205) **通信作者,E 2mail:lijilun @https://www.doczj.com/doc/f512204172.html,
摘要 阿维链霉菌(Str eptomyces aver mitilis )由于可以产生杀虫抗生素)))阿维菌素而备受研究者的青睐.多年来该菌得到了全面系统的研究,其基因组序列也已测定.文中综述了阿维链霉菌中阿维菌素生物合成代谢途径方面的研究,并对后续研究进行展望.关键词 阿维链霉菌 阿维菌素 次级代谢 生物合成 基因工程 组合生物合成
1 阿维链霉菌及其基因组信息
阿维菌素的产生菌)))阿维链霉菌(Strepto 2myces a ver mitilis )是1975年日本北里研究所从日本静岗县的一个土壤样品中分离得到的.阿维链霉菌自发现以来,以日本北里大学和北里研究所以及美国Merk 公司为主的研究小组分别对它开展了深入研究,形成了一个重要的抗生素研究领域.与其他链霉菌一样,阿维链霉菌不仅具有复杂的形态分化,也具有合成多种次级代谢产物的能力,由它产生的阿维菌素在医药、农业及畜牧业上有着重要的商业价值.目前对阿维链霉菌的研究主要集中在阿维菌素的生物合成领域[1)5].
链霉菌中天蓝色链霉菌(Str ep tomyces coelicol 2or )A3(2)[6]
、阿维链霉菌MA 24680[7]
和Strepto 2myces diver sa 的基因组序列已被测定,此外还有一些链霉菌(S.nour sei,S.a mbof a ciens,S.peucetius 和S.sca bies )的基因组正在测定中(https://www.doczj.com/doc/f512204172.html, /search.cgi).对它们的基因组序列的比较将为这些微生物的研究提供有价值的信息.阿维链霉菌的线状染色体大小为9025608bp,G+C 含量为70.7%,至少包含7577个开放阅读框(ORF),编码区占基因组的86.2%.ORF 平均大小为1034bp.阿维链霉菌还含有一个线性质粒
SAP1,大小为94287bp,G+C 含量为69.2%,含有96个ORF,编码区占质粒的79.0%.在阿维链霉菌的基因组中,大多数必需基因都位于一个高度保守的6.5Mb 的内部区域.染色体上靠近端粒的位置有两个保守性低的亚端粒区(subtelomeric re 2gions).有趣的是,50%以上的与次级代谢合成有关的基因(包括阿维菌素的生物合成基因)都位于亚端粒区,而在亚端粒区没有发现已知的必需基因.此外,亚端粒区含有基因组中大部分的转座因子[7].这些基因位于亚端粒区可能与阿维链霉菌的遗传不稳定性有关,在对阿维链霉菌培养过程中我们经常得到一些形态分化的突变株(光秃型突变株和白色突变株等),有些突变株同时丧失了合成阿维菌素的能力.
在阿维链霉菌的线状染色体上有30个基因簇与次级代谢合成有关,共有271个基因,占基因组的6.6%.它们广泛地分布于染色体上,但有一半位于染色体的末端.在质粒SA P1上没有发现与次级代谢有关的基因簇[7,8].在30个与次级代谢有关的基因簇中,有4个与黑色素的合成有关,其中两个负责酪氨酸酶及其辅酶的合成,另外两个分别与由尿黑酸生成的赭色色素和聚酮结构的黑色素的合成有关;合成类胡萝卜素和铁载体的基因簇分别由7个和5个基因组成;此外,有8个基因簇与非核
290
糖体肽类化合物的合成有关,还有4个基因簇与萜类化合物的合成有关.在30个次级代谢的基因簇中,有9个基因簇含有?型PKS基因(polyketide synthase),2个基因簇含有ò型PKS基因.目前已有3个?型PKS合成的化合物被鉴定,它们分别是阿维菌素、寡霉素以及菲律宾菌素(filipin)的衍生物)pentaene[8].
阿维链霉菌和其他链霉菌的基因组计划必将极大地推动对链霉菌形态分化和次级代谢的研究,最终揭示链霉菌复杂的调控网络.
2阿维菌素的生物合成基因簇
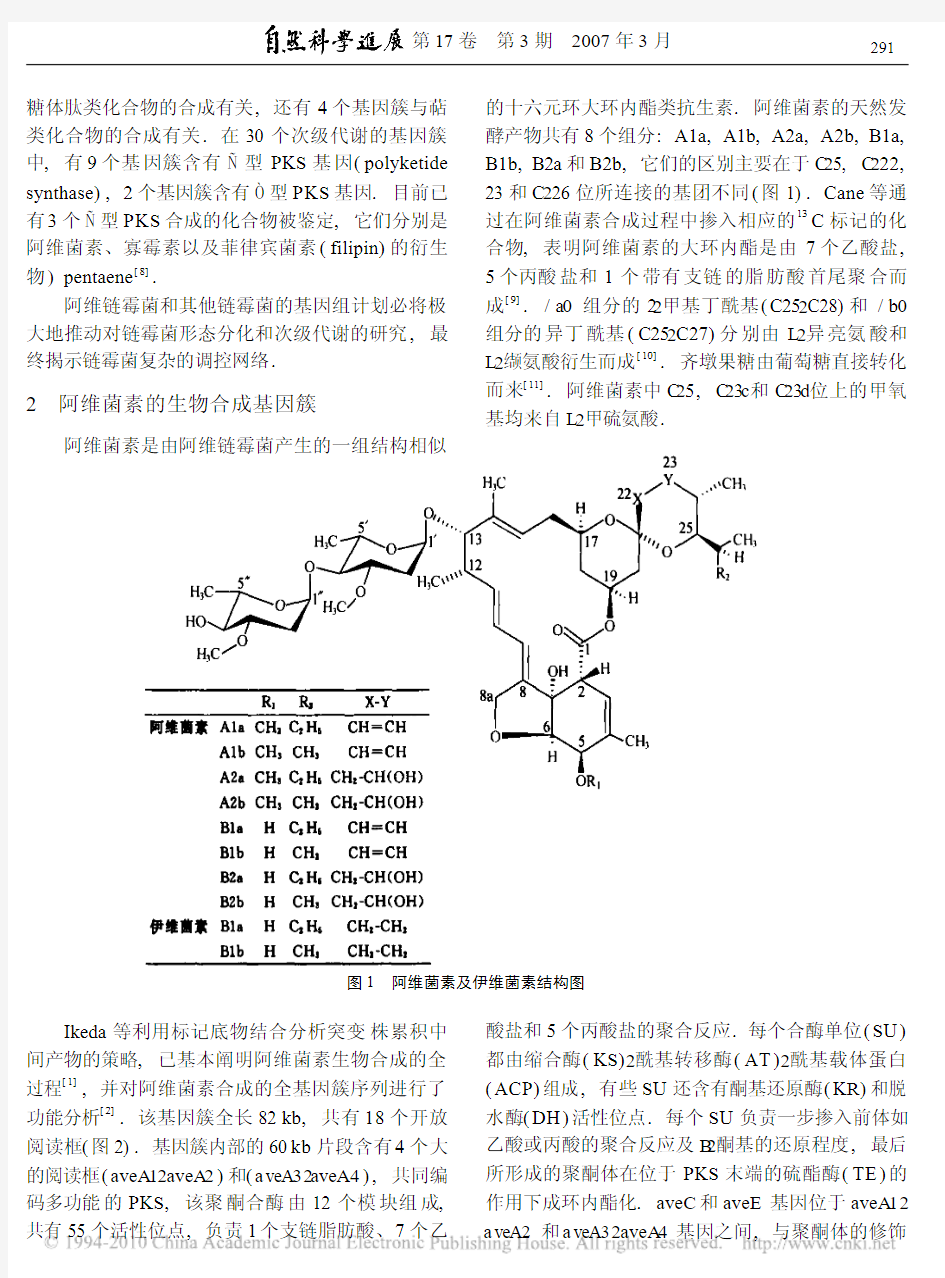
阿维菌素是由阿维链霉菌产生的一组结构相似的十六元环大环内酯类抗生素.阿维菌素的天然发酵产物共有8个组分:A1a,A1b,A2a,A2b,B1a, B1b,B2a和B2b,它们的区别主要在于C25,C222, 23和C226位所连接的基团不同(图1).Cane等通过在阿维菌素合成过程中掺入相应的13C标记的化合物,表明阿维菌素的大环内酯是由7个乙酸盐, 5个丙酸盐和1个带有支链的脂肪酸首尾聚合而成[9]./a0组分的22甲基丁酰基(C252C28)和/b0组分的异丁酰基(C252C27)分别由L2异亮氨酸和L2缬氨酸衍生而成[10].齐墩果糖由葡萄糖直接转化而来[11].阿维菌素中C25,C23c和C23d位上的甲氧基均来自L2甲硫氨酸.
图1阿维菌素及伊维菌素结构图
Ikeda等利用标记底物结合分析突变株累积中间产物的策略,已基本阐明阿维菌素生物合成的全过程[1],并对阿维菌素合成的全基因簇序列进行了功能分析[2].该基因簇全长82kb,共有18个开放阅读框(图2).基因簇内部的60kb片段含有4个大的阅读框(aveA12aveA2)和(a veA32aveA4),共同编码多功能的PKS,该聚酮合酶由12个模块组成,
共有55个活性位点,负责1个支链脂肪酸、7个乙酸盐和5个丙酸盐的聚合反应.每个合酶单位(SU)都由缩合酶(KS)2酰基转移酶(AT)2酰基载体蛋白(ACP)组成,有些SU还含有酮基还原酶(KR)和脱水酶(DH)活性位点.每个SU负责一步掺入前体如乙酸或丙酸的聚合反应及B2酮基的还原程度,最后所形成的聚酮体在位于PKS末端的硫酯酶(TE)的作用下成环内酯化.aveC和aveE基因位于aveA12 a veA2和a veA32aveA4基因之间,与聚酮体的修饰
291
第17卷第3期2007年3月
有关[12]
;在基因簇的右侧邻近aveA 4基因的上游,
是一套涉及合成和转移齐墩果二糖的8个基因(aveBI )aveBV I I I );紧邻aveA 1的上游(左方)是编码C52O 2甲基转移酶的a veD 基因,该基因负责将甲基转给阿维菌素B 的C 25位的2OH 从而形成阿维菌素A.a veF 紧邻a veD 的下游,两者转录方向一致,可能属于同一转录单位[1].aveF 编码C52酮基
还原酶,催化C 25位的酮基还原成羟基.aveR 位于a veF 的下游(但转录方向相反),它可能是阿维菌素生物合成全基因簇的正调控基因[2].aveR 突变株不能合成任何阿维菌素,也不能转化阿维菌素糖苷配基,对该基因序列分析表明具有H 2T 2H 结构,但是a veR 如何调控阿维菌素生物合成有待于进一步研究
.
图2 阿维菌素生物合成基因簇[2]
3 阿维链霉菌的基因工程改造
阿维菌素的生物合成途径已基本阐明,相关合成基因已被克隆和测序,阿维链霉菌的基因组序列也已清楚.这为利用基因工程手段改造阿维菌素生物合成基因簇从而对发酵产物进行有效的控制,以及合成新的阿维菌素衍生物及提高阿维菌素的产量提供了可能.目前对阿维链霉菌中代谢途径的改造主要集中在以下几个方面.
3.1 菌株高产性能的提高
阿维菌素是重要的杀虫抗生素,提高阿维菌素的产量具有重要的意义.在链霉菌中,次级代谢产物的生物合成是一个复杂的过程,受到不同水平的调控[13]
.抗生素的生物合成除受途径专一调节基因
(pathway 2specific r egulatory gene)控制之外[14]
,还受多效调控基因(pleiotropic regulatory genes)的控制,如a ba A,a ba B,af sQ 1和af sQ2等[15]
,其次还受到其他调控因子,如ppGpp,A 因子和磷酸盐等的调控[16)18].
Lee 等利用Southern 杂交在阿维链霉菌中检测
到了与S.lividans 中a f sR2基因的同源基因,将多
拷贝的a f sR 2基因分别转入阿维链霉菌野生型菌株和高产菌株中,阿维菌素的生物合成分别提高了2.3倍和1.5倍[19].H wang 等曾直接将一段包含编码膜蛋白or f X 的克隆片段(8.10kb)转入野生型阿维链霉菌,刺激了阿维菌素的生物合成,可使阿维
菌素的合成提高近3.5倍[20]
.对位于a veR 基因上游的aveR1,aveR 2基因进行全部或部分缺失,可使阿维菌素的产量提高3倍多[21].王晓芳等[22]对阿维链霉菌野生型菌株和高产菌株中a veR1,a veR2基因分别进行基因缺失,野生型菌株阿维菌素的合成提高了3倍多,但高产菌株产量基本没有提高,可能是高产菌株经历了多次的诱变,其调节基因可能发生了改变.这些结果表明虽然常规诱变育种是菌种选育的有效手段,但是利用基因工程手段也有可能进一步提高菌株的生产能力.Xiong 等利用PCR 介导的基因中断技术对bkdF 基因进行阻断,获得的突变株不再合成阿维菌素,只产生寡霉素,而且寡霉素的产量由原来的0.1mg/mL 提高到2.3mg/mL [23].这可能是由于阿维菌素和寡霉素都具有聚酮体结构,拥有共同的底物,阿维菌素合成被阻断导致了代谢流流向了寡霉素的合成.
292
第17卷 第3期 2007年3月
3.2菌株发酵性能的提高
阿维菌素的发酵是一个好氧的生物过程,一般对氧的需求比较敏感.由于氧在水中的低溶解性,在大规模深层发酵中,溶氧常成限制因素.文莹等通过将透明颤菌血红蛋白(VH b)基因置于硫链丝菌素诱导的启动子P tip A之下,转入阿维链霉菌,经摇瓶实验证实,表达的V H b蛋白在氧限条件下会明显促进阿维链霉菌的生长和阿维菌素的合成,而且在发酵液中溶氧状况越差,VH b蛋白的效果越显著[24].
3.3无效组分及有毒产物合成的阻断
Ikeda小组阐明了阿维菌素的生物合成途径,在明确阿维菌素生物合成途径的基础上,结合传统诱变构建了一系列仅产有效组分的基因工程菌株.经传统诱变获得了仅产4个/B0组分的突变株K2034(aveD)和仅产4个/a0组分的突变株K2021 (X)[10],前者是a veD基因(负责编码将B组分转化为A组分的C52O2甲基转移酶)发生了突变,使得菌株只能累积B组分[25];后者是X基因发生了突变.目前X基因尚未得到克隆,但不位于阿维菌素生物合成基因簇中,此基因的突变导致突变株只能合成仅产/a0组分的阿维菌素,推测这个基因可能为支链氨基酸脱氢酶.对这两株突变株进行原生质体融合,得到了仅产B1a和B2a两个组分的重组菌株K2038(aveD X)[10].再对重组菌株K2038内的aveC基因进行点突变,得到仅产单一组分B2a 的基因工程菌K2099(a veD X a veC)[1].阿维链霉菌不仅产生阿维菌素,还产生寡霉素.寡霉素是哺乳动物氧化磷酸化的抑制剂,对哺乳动物有很高的毒性.Ikeda等用Tn4560对阿维链霉菌进行转座诱变得到不产寡霉素的突变株,利用转座子上的遗传标记将寡霉素的生物合成基因克隆到温敏质粒上,对上述所构建的有效组分的基因工程菌进行基因取代,得到不产寡霉素仅产阿维菌素有效组分的基因工程菌[1].
我们实验室自20世纪90年代以来开展了对阿维菌素合成的研究,初期主要利用常规诱变手段提高阿维菌素产量,近年来也开展了对阿维链霉菌的基因工程改造.通过对aveD基因的插入失活,阻
断了C52O2甲基转移酶的合成,与a veD共转录的a veF的表达也被阻断,因此获得了直接合成C52O2阿维菌素B的基因工程菌[26].C52O2阿维菌素B可直接在C25位进行肟基化合成具有更高杀虫活性的阿维菌素52肟衍生物.此外,通过对a veD基因进行缺失突变,得到了仅产阿维菌素B组分的基因工程菌[27].在此基础上,张晓琳等通过同源双交换的方法将上述仅产阿维菌素B组分的基因工程菌染色体上长达90kb的寡霉素聚酮合酶基因簇(olmA)进行了缺失,得到不产寡霉素而仅产阿维菌素B组分的基因工程菌[28].
3.4组合生物合成
阿维菌素的大环内酯结构属于聚酮体,由阿维菌素PKS(AVES)催化形成.阿维菌素B1和B2的区别在于C222,23位不同,B1在C222,23位是CH=CH,而B2在C222,23位为CH22CH OH.根据聚酮体合成反应步骤与其PKS基因结构之间的一一对应关系,阿维菌素C222,23位的还原程度由AVES1模块2上的还原酶域DH和KR(DH22 KR2)决定.KR2将C223位的B2酮基还原成羟基后,在DH2的作用下脱水形成双键,最后的产物即为B1组分;如果DH不起作用,则最终形成的产物C223位保持羟基即为B2组分,因此推测B1组分和B2组分的共存可能是由于DH2的不完全活性所造成.将阿维菌素PKS模块2上的不完全活性的DH用完全活性的DH取代,仍有B2组分的合成.伊维菌素是阿维菌素B1在C222,23双氢还原物(图1),与阿维菌素B1相比,具有相同的杀虫活性,而毒性更低,因而被广泛应用于畜牧业上. Gaisser等用rapamycin PKS中模块13上的DH2ER (enoyl reductase烯基还原酶)2KR取代野生型阿维链霉菌中阿维菌素PKS模块2上的DH2KR结构域,获得的重组菌株具有直接合成C222,23双氢阿维菌素B1(即伊维菌素)和A1的能力,除产生以上组分外,该菌株同时还产生阿维菌素的8个组分[29].张晓琳以阿维链霉菌仅产B组分不产寡霉素的基因工程菌Olm73212为出发菌株,将其阿维菌素PKS模块2上的DH和KR结构域用来自于pik2 romycin PKS模块4中一套完整的DH2ER2KR所置换,得到不产寡霉素而产伊维菌素B1a的基因工程菌[30].
293
第17卷第3期2007年3月
3.5阿维菌素衍生物的产生
Doramectin是阿维菌素B1的cyclohexane2car2 boxylic acid(CH C)前体异构物,与伊维菌素相比,生物半衰期更长,杀虫效果更好.Cropp等将S.collius中的CH C2CoA合成基因转入阿维链霉菌的阿维菌素的前体合成阻断突变株中,使得突变株获得了合成Doramectin的能力[31].该突变株发酵产生Doramectin的同时还产生无效的CH C2B2组分,aveC编码产物控制Doramectin与CH C2B2的比例.Stutzman2Engwall等通过定点诱变和易错PCR在aveC基因中引入随机突变,获得了几株CH C2B1比例提高的突变株,其中一株CH C2B1的比例提高了4倍[32].他们又通过DNA重排(DNA shuffling)技术对aveC进行突变,将重排后的a veC 突变文库转化到阿维链霉菌中,得到几个产Dor2 amectin比例较高的转化菌株.对这些菌株中的aveC基因进行分析发现,最有效的突变a veC中有10个氨基酸发生了突变,所产CH C2B2B CH C2B1的比例为0.07B1,此比例与野生型菌株相比提高了23倍[33].
甲胺基阿维菌素(emamectin benzoate,即MK2 244)与阿维菌素相比具有更高的杀虫活性,在农业上得到广泛应用.在化学合成上,4d2氧2阿维菌素(4d2oxo2aver mectin)是由阿维菌素合成甲胺基阿维菌素的中间体,由于阿维菌素两个羟基的存在,必须在氧化前后对于其进行保护,使得生产成本大大提高.来自杀结核链霉菌(S.tuber cidicus)R2922的细胞色素P450单加氧酶Ema1能够选择性地催化阿维菌素形成4d2氧2阿维菌素[34].通过在阿维链霉菌中表达ema1,试图得到一步法合成4d2氧2阿维菌素的菌株.但只有生长初期的菌丝能够合成4d2氧2阿维菌素,处于稳定期的菌株则不能[35].而阿维菌素的合成主要在稳定期合成,这可能是所用启动子在稳定期时不易表达,而换成稳定期表达的启动子效果可能会好些.
4展望
阿维链霉菌自发现以来已有30a的时间,对于它的研究主要集中在阿维菌素的生物合成领域.提高阿维菌素的产量、选择性地合成活性组分和产生
有生物活性的阿维菌素衍生物及新代谢物一直是研究的热点.随着阿维链霉菌和其他链霉菌序列的测定,研究的重心将进一步拓展到次级代谢物产生的调控和形态分化调控方面,以揭示链霉菌复杂的调控网络.功能基因组研究还可以进一步了解链霉菌染色体复制及其稳定性,在提高工业菌株的遗传稳定性方面意义重大.
阿维链霉菌中阿维菌素和寡霉素基因簇中聚酮生物合成编控的分子机理的阐明和阿维链霉菌基因组序列的完成将为利用组合生物合成改造阿维链霉菌,形成一系列非天然的天然性化合物提供可能,在药物创新方面将有可能取得一系列突破.就目前而言,组合生物合成面临的最大障碍就是改造后的PKS合成的新代谢物产量太低.大多数情况下,杂合PKS合成新化合物的产量仅是野生型菌株原来抗生素产量的1%)50%,甚至更低[36].目前也有一些提高产量的途径:如增加PKS拷贝数或使用强启动子可使产量提高;将结构类似的聚酮化合物的PKS单元进行组合,由于它们生物合成的中间体结构相似,来自不同PKS的模块和结构域在功能上可以彼此互补,从而使杂合PKS具有较高的活性;通过替换整个模块或蛋白亚单位而不是单个酶域可以使产量提高100倍以上[37].目前构建的可直接合成伊维菌素的基因工程菌由于产量太低而无法应用于工业生产.如能利用阿维菌素结构类似物Milbemy2 cins或Melingmycins(它们在大环内酯的C22,23位为CH22CH2)的PKS基因对阿维菌素PKS的模块2进行整个置换有可能提高杂合PKS的活性,进而提高伊维菌素的产量.
此外,虽然阿维菌素的生物合成途径已经基本阐明,但是阿维菌素的生物合成调控途径和一些关键步骤还不清楚,基因簇中a veR和aveC的基因功能还不确定.推测a veR基因可能是阿维菌素的调控基因,但是a veR基因如何调控阿维菌素的生物合成还不清楚,有待于进一步研究.阿维菌素合成过程中决定阿维菌素B1B B2的比例的机制仍然不清楚.阿维菌素B1和B2组分的分化发生在阿维菌素的合成初期,但实验证实阿维菌素PKS模块2上的负责C22223位脱水的脱水酶并不能决定B2B B1的比例.目前的实验结果表明aveC可能决定阿维菌素B2B B1的比例[1,32,33],但其机制仍然不清楚,如AveC是如何催化C22223的脱水;是与阿维菌素
294第17卷第3期2007年3月
PKS 一起共同完成的,还是在阿维菌素糖苷配体形成之后等.由于阿维菌素B1具有最高的杀虫活性,如能仅发酵生产B1组分,将大大地简化生产和提取工艺,阿维菌素的生产成本也将降低.因此,研究阿维链霉菌中aveC 基因的功能,阐明决定阿维菌素B2B B1比例的机制,将为理性设计实验提高阿维菌素中有用组分B1的含量提供理论基础.
参 考 文 献
1 Ik eda H ,6m ura S.Control of avermectin biosyn th esis in Strep 2
tomyces avermitilis for the selective production of a useful com 2ponent.J An tib iot,1995,48(7):549)562
2 Ik eda H ,Non om iya T ,U sam i M,et https://www.doczj.com/doc/f512204172.html,anization of the bio 2
s yn thetic gen e cluster for the polyk etide an th elm intic m acr olide averm ectin in Strep tomyces aver mitilis .Proc Natl Acad Sci
U SA,1999,96(17):9509)9514
3 Ik eda H ,Nonomiya T ,6mura https://www.doczj.com/doc/f512204172.html,anization of biosynth etic
gene cluster for averm ectin in Str ep tomyces aver mitilis :Analysis of enzymatic domains in four polyk etide s ynthases.J In d Micro 2biol Biotechnol,2001,27(3):170)176
4 M acNeil DJ ,Occi JL,Gewain KM ,et https://www.doczj.com/doc/f512204172.html,plex organization
of the Strep tomy ces aver mitilis genes encoding th e avermectin polyketide s ynthase.Gene,1992,115:119)125
5 M acNeil DJ,Occi J L,Gewain KM ,et al.Correlation of th e
averm ectin polyketide synthase genes to the averm ectin s truc 2ture.Implications for design ing novel avermectins.An n N Y Acad Sci,1994,721:123)132
6 B entley SD,Chater KF,Cerdeno 2Tarraga,et https://www.doczj.com/doc/f512204172.html,plete ge 2
nom e sequ ence of the m od el actinomycete Streptom y ces coelicolor A3(2).Natu re,2002,417:141)147
7 Ik eda H ,Is hikawa J,Hanamoto A,et https://www.doczj.com/doc/f512204172.html,plete g enome s e 2
quence and comparative analysis of the industrial m icroorgan ism Strep tomy ces aver mitilis .Nat Biotech nol,2003,21:526)5318 6mu ra S,Ikeda H ,Ishikawa J,et al.Genome sequence of an in 2
dus trial microorganism Streptomyces aver mitilis :Deducing th e ability of producing s econdary metabolites.Proc Natl Acad Sci U SA,2001,98(21):12215)12220
9 Cane DE,Liang T C,Kaplan LK,et al.B ios ynthetic origin of
th e car bon s keleton and oxygen atoms of the avermectins.J Am Chem Soc,1983,105:4110)4112
10 6mu ra S,Ikeda H ,T an aka H.Selective produ ction of specific
componen ts of avermectin s in Strep tomyces aver mitilis .J Anti 2biot,1991,44(5):560)563
11 Ik eda H ,Kotak i H ,T anaka H ,et al.Involvement of glucos e
catabolism in averm ectin production by Str ep tomyces avermiti 2lis .Antimicr ob Agents Chem oth er,1988,32(2):282)28412
Pang CH,Matsu zak i K,Ik eda H ,et al.Produ ction of a new
methylated 6,8a 2seco 26,8a 2deoxy derivative of the averm ectin s by a trans formant strain of Str ep tomyces aver mitilis .J Antibiot,1995,48(1):92)94
13 Bibb MJ.Regulation of s econdary metab olism in streptomy cetes.
Curr Opin Microbiol,2005,8:208)215
14 Wietzorrek A,Bibb M J:A novel family of proteins that regu 2
lates antibiotic production in streptomycetes ap pears to contain an OmpR 2like DNA 2b inding fold.M ol M icrobiol,
1997,
25:
1181)1184
15 Sh eeler NL,MacMillan SV,Nodwell J R.Bioch emical activities
of the absA two 2com ponent system of Streptomyces coelicolor .J Bacteriol,2005,187:687)696
16 Chakraburtty R,Bibb M J.T he p pGpp synthetase gen e (r elA )of
Str ep tomyces coelicolor A3(2)play s a conditional role in an tib i 2otic production and morphological differ entiation.J B acteriol,1997,179:5854)5861
17 H orinouch i S,Beppu T.Regulation of secondary metabolis m and
cell differen tiation in Str ep tomyces :A 2factor as a microbial hor 2mone and th e AfsR protein as a com ponent of a two 2component regulatory sys tem.Gene,1992,115:167)172
18 Sola 2Landa A,Moura RS,Martin JF.T he two 2component
PhoR 2PhoP system controls both prim ary metab olism and sec 2ondary metabolite biosynthesis in Streptomyces lividans .Proc Natl Acad Sci USA,2003,100:6133)6138
19 Lee JY,H wang YS,Kim SS,et al.Effect of a global regulatory
gen e,af sR 2,from Strep tomy ces lividans on avermectin produ c 2tion in Strep tomyces aver m itilis .J Biosci Bioeng,2000,89:602)605
20 H wang YS,Kim ES,Biro S,et al.Cloning and analysis of a
DNA fragment stimulating avermectin production in variou s Str ep tomyces aver mitilis strains.Appl Environ Microbiol,2003,69:1263)1269
21 Stutzman 2Engwall K.Strep tomyces avermitilis regulatory genes
for increased avermectin production.United State Patent,6197591,2001203206
22 王晓芳,陈 芝,张晓琳,等.阿维链霉菌调节基因aveR 1,
aveR 2缺失对阿维菌素产量的影响.中国生物防治.2005,21(增刊):77)82
23 Xion g X,Liang YX,Zheng YH.Enhancemen t and selective pro 2
duction of oligomycin th rou gh inactivation of avermectin .s starter unit in Strep tomy ces aver mitilis .Biotechnol Lett,2006,28(12):911)916
24 文 莹,李季伦.透明颤菌血红蛋白基因在阿维链霉菌中的表
达.微生物学报,2000,40(1):50)56
25 Schulman MD,Valention D.Str ep tomyces aver mitilis mutants
defective in m ethylation of avermectins.Antimicr ob Agents Che 2mother,1987,31:744)747
26 陈 芝,宋 渊,文 莹,等.阿维链霉菌中a veD 基因阻断对
295
第17卷 第3期 2007年3月
阿维菌素合成的影响.微生物学报,2001,41(4):440)44627 陈 芝,文 莹,宋 渊,等.阿维链霉菌中aveD 基因缺失对
阿维菌素合成的影响.微生物学报,2002,42(5):534)53828 Zhang X,Chen Z,Zhao J ,et al.Deletion an aly sis of oligom ycin
PKS gen es (olmA )in Strep tomy ces avermitilis .Chin Sci Bull,2004,49(4):350)354
29 Gaisser S,Kellenberger L,Kaja A L,et al.Direct production of
ivermectin 2like drugs after domain exchange in the avermectin polyketide synthase of Str ep tomyces avermitilis https://www.doczj.com/doc/f512204172.html, Biomol Chem ,2003,1:2840)2847
30 Zhang X,Chen Z,L i M ,et al.Con struction of ivermectin pro 2
ducer by domain swaps of averm ectin poly ketide s ynthas e in Strep tomy ces aver mitilis .Appl Microbiol Biotech nol,2006,72(5):986)994
31 Cropp T A,Wils on DJ,Reyn olds KA.Iden tification of a cyclo 2
h exylcarb on yl CoA bios yn thetic gene clu ster and application in th e p rodu ction of doramectin.Nat Biotechnol,2000,18(9):980)983
32 Stu tzman 2En gwall K,Conlon S,Fedechk o R,et al.En gineering
th e aveC g ene to enh ance the ratio of d oramectin to its CH C 2B2analogue produced in Str ep tomyces avermitilis .Biotechn ol and B ioeng,2003,82:359)369
33 Stutzman 2Engwall K,Conlon S,Fedechk o R,et al.Sem i 2syn 2
thetic DNA shuffling of aveC leads to improved indus trial scale production of doramectin by Strep tomy ces avermitilis .M etab Eng,2005,7(1):27)37
34 Jun gman n V,Molnar I,H ammer PE,et al.Biocatalytic conver 2
sion of avermectin to 4d 2oxo 2avermectin:Ch aracterization of bio 2catalytically active bacterial strains and of cytoch rome p450mo 2nooxygen as e enzym es and their genes.Appl E nviron Microb iol,2005,71(11):6968)6976
35 Molnar I,H ill DS,Zirkle R,et al.Biocatalytic con version of
avermectin to 4d 2oxo 2avermectin:H eterologous ex press ion of the ema1cytochr om e P450monooxygenase.Appl En viron Microb i 2ol,2005,71(11):6977)6985
36 McDaniel R,T ham chaipen et A,Gu stafss on C,et al.M ultiple
gen etic modification s of the erythromycin polyketide syn th as e to produce a library of novel /unn atural 0natural produ cts.Proc Natl Acad Sci USA,1999,96:1846)1851
37 T ang L,Fu H ,McDaniel R.Formation of functional heterolo 2
gous complexes using subu nits from the picromycin,eryth rom y 2cin,and oleandomycin polyketide synth as es.Chem B iol,2000,7:77)84
隧道磁阻效应原理研究取得新进展
磁隧道结是磁随机存储器中的核心部件.寻找具有良好隧道磁阻效应的磁隧道结是制造性能优良的磁随机存储器的关键,是目前的研究热点之一.近年来,人们发现基于氧化镁绝缘层的磁隧道结在常温下具有非常巨大的隧道磁阻,大量的实验研究工作测出了相当多的试验数据.同时,一些研究组也做过相应的理论计
算,但是计算结果与实验数据一直符合得不好.
最近,中国科学院物理研究所纳米物理与器件实验室高鸿钧研究员的博士研究生胡亦斌、表面物理实验室的夏轲研究员和加拿大McGill 大学郭鸿教授研究组合作,运用郭鸿研究组自主开发的第一性原理输运计算方法和程序,对基于氧化镁绝缘层的磁隧道结在理论上进行了研究.研究结果表明,基于氧化镁绝缘层的磁隧道结确实存在非常巨大的隧道磁阻.他们还从理论上得到了基于氧化镁绝缘层的磁隧道结的伏安特性曲线,并与实验上测得的伏安特性曲线符合得很好.此外,由于理论计算时氧化镁绝缘层具有完美的界面,而在实验上不可能做到;同时,绝缘层两边的铁磁材料也不可能是纯粹的金属结构,有可能被氧化、存在缺陷等现象.他们通过相应的理论计算发现,上述原因都可以造成基于氧化镁绝缘层的磁隧道结的隧道磁阻有很大地下降,从而解释了理论计算的隧道磁阻比实验测出的数值大很多的问题.
相关研究结果发表在美国5物理评论快报6(Phys.Rev.Lett.97,226802(2006))上.该工作得到了国家自然科学基金以及国家科技部和中国科学院的资助.
(供稿:中国科学院物理研究所)
296
第17卷 第3期 2007年3月
兽用阿维菌素类药物剂型研究进展 发布: 2009-05-26 | 作者: admin | 来源: 转载 | 查看: 次 兽用阿维菌素类药物剂型研究进展 摘要: 阿维菌素类药物是目前最优良的一类广谱高效兽用抗寄生虫药物。本文就该类药物的不同剂型及其在兽医临床上的应用和毒理学等方面的研究进展进行了综述。 关键词: 阿维菌素类药物;剂型;毒理学;临床应用 阿维菌素类(Avermectins,AVMs)药物是由阿维链霉菌(Streptomycesavermitilis)产生的新型大环内酯类抗寄生虫药物,目前,在这类药物中已商品化的有阿维菌素(Avermectin,AVM)、伊维菌素(Ivermectin,IVM)、多拉菌素(Doramectin)和依立菌素(Eprinomectin)。阿维菌素类药物由于其优异的驱虫活性和较高的安全性,被认为是目前最优良、应用最广泛、销量最大的一类新型、广谱、高效、安全和用量小的兽用抗内、外寄生虫药,已广泛应用于兽医临床,在畜禽内、外寄生虫病的防治中发挥了重要作用。 1 制剂研究 不同制剂形式决定着阿维菌素类药物给药方式,并对其作用、药代动力学特征等具有明显的影响。如潘保良等[1]对阿维菌素长效注射液与阿维菌素普通注射液(阿福丁注射液)药物动力学的比较研究结果表明,阿维菌素长效注射液和阿福丁注射液在绵羊体内均呈二室代谢模型。长效注射液以1mg/kg体重进行颈部皮下注射得到以下药动学参数:吸收半衰期t1/2α=9.59h,消除半衰期 t1/2β=292.97h,达峰时间tmax=47.46h,最大血药浓度Cmax=13.91ng/mL,曲线下面积AUC=6235.48ng/mL·h,消除率CIB=0.034L/kg·h,表观分布容积 Vd=13.7L/kg。将阿福丁注射液以0.2mg/kg体重进行颈部皮下注射的药动学参数为:t1/2α=9.05h,t1/2β=144.34h,tmax=12.63h,Cmax=8.52ng/mLAUC=1017.35n g/mL·h,CIB=0.22L/kg·h,Vd=14.5L/kg。即阿维菌素长效注射液比普通注射液吸收慢、消除慢,在体内维持有效血药浓度的时间长,长效注射液维持有效血药浓度(0.5ng/mL血浆)的时间长于49d,而阿福丁注射液不足21d。又比如IVM对巴特斯细颈线虫(Nematodirusbattus)内服给药的效果优于注射给药,但对于痒螨,只有注射给药才能获得较好的疗效。因此,对阿维菌素类药物的剂型改进一直是研究的重点。已经开发并应用于兽医临床的阿维菌素制剂主要有预混剂、片剂、注射剂、口服液剂、粉剂、浇泼剂、喷雾剂、控释剂等,也研制开发出依维菌素预混剂、片剂、注射剂、口服液剂、糊剂、浇泼剂、控释剂等,研制开发出多拉菌素注射剂和浇泼剂及依立菌素浇泼剂等。这些制剂可以满足不同动物、不同饲养方式、不同寄生虫的用药需求,为广泛推广应用阿维菌素类抗寄生虫药物创造了良好的条件。陈克强等[2]将灭虫丁-7051混于兔用饲料粉中制成颗粒药料驱杀兔疥螨和兔耳痒螨,克服了经口投服操作麻烦、适口性差和对胃肠道有刺激性的缺点,且不影响药效。罗延红等[3]研制了供内服和外用的阿维菌素驱虫速溶片剂,对辅料进行了初步筛选,选择5种材料或颗粒(羧甲基淀粉钠、羟丙基纤维素、淀粉、聚乙烯吡咯烷酮和颗粒),采用正交试验法L8(27)探讨了最佳处方.用紫外分光光度法在波长为245nm处绘制阿维菌素标准曲线。三批阿维菌素片剂样品含
合成生物学研究进展及其风险 关正君魏伟徐靖 1合成生物学研究概况 合成生物学(synthetic biology)是在现代生物学和系统科学基础上发展起来的、融入工程学思想的多学科交叉研究领域。其包括了与人类自身和社会发展相关的研究方向和内容,为解答生命科学难题和人类可持续发展所面临的重大挑战提供了新的思路、策略和手段。2004年,合成生物学被美国麻省理工学院出版的Technology Review评为“将改变世界的十大新技术之一”。2010年12月,Nature杂志盘点出2010年12件重大科学事件,Science杂志评出的科学十大突破,合成生物学分别排名第4位和第2位。为此,世界各国纷纷制定合成生物学发展战略及规划,开展合成生物学研究,以抢占合成生物学研究和发展先机,促进了合成生物学基础研究和应用研究的快速发展。同时合成生物学的巨大应用潜力,还吸引了众多公司及企业参与到该领域的研究开发,推动着合成生物学产业化的进程。 合成生物学作为后基因组时代生命科学研究的新兴领域,其研究既是生命科学和生物技术在分子生物学和基因工程水平上的自然延伸,又是在系统生物学和基因组综合工程技术层次上的整合性发展。与传统生物学通过解剖生命体以研究其内在构造不同,合成生物学旨在将工程学的思想用于生物学研究中,以设计自然界中原本不存在的生物或对现有生物进行改造,使其能够处理信息、加工化合物、制造材料、生产能源、提供食物、处理污染等,从而增进人类的健康,改善生存的环境,以应对人类社会发展所面临的严峻挑战。 作为一个新的基础科学研究领域,合成生物学综合生物化学、生物物理和生物信息技术与知识,涵盖利用基因和基因组的基本要素及其组合,设计、改造、重建或制造生物分子、生物体部、生物反应系统、代谢途径与过程,乃至整个生物活动的细胞和生物个体。合成生物学使人们可以利用与物理学方法类似的模块构建和组装形成新的生命有机体,从而人工设计新的高效生命系统。中科院《2013年高技术发展报告》指出,DNA测序技术、DNA合成技术和计算机建模是支撑合成生物学发展的关键技术。近年来,大量物种的全基因组测序,为合成生物学家构建功能组件的底盘生物体系提供了丰富的遗传信息。快速、廉价的测序技术也促进了新的系统和物种的识别和解析。 2 合成生物学应用研究进展 2.1 合成生物学在医药工业领域的应用 2.1.1 天然药物合成生物学 天然药物合成生物学是在基因组学研究的基础上,对天然药物生物合成相关元器件进行发掘和表征,借助工程学原理对其进行设计和标准化,通过在底盘细胞中装配与集成,重建生物合成途径和代谢网络,从而实现药用活性成分定向、高效的异源合成,以解决天然药物
收稿日期:2007-10-24 基金项目:成都大熊猫繁育研究基金会项目(CPF08)作者简介:汪 涛(1983-),男,硕士研究生. 通讯作者:杨光友(1964-),男,教授,博士,博士生导师. 新型广谱抗生素类驱虫药)))塞拉菌素的研究进展 汪 涛1,杨光友1,王成东2,杨 智 2 (1.四川农业大学动物医学院,四川雅安625014;2.成都大熊猫繁育研究基地,四川成都610081) 中图分类号:S859179+ 6 文献标识码:A 文章编号:1004-7034(2008)011-0015 02 阿维菌素类药物是由链霉菌发酵产生的一组大环内酯类药物,是目前世界上效果最优良、使用最广的一类广谱高效抗寄生虫药,其中已商品化的药物包括阿维菌素(AVM )、伊维菌素(I V M )、多拉菌素(DR M )、埃谱利诺菌素(EPR )及塞拉菌素(SE I)等。塞拉菌素是由基因重组的阿维链霉菌(Strep to my ces aver m itilis)新菌株发酵而成的一种阿维菌素类抗生素。现将新型广谱抗生素类驱虫药)))塞拉菌素的研究进展综述如下。1 理化性质 塞拉菌素为白色或淡黄色结晶粉末,其化学名为25-环已烷基-25-去(1-甲丙基)-5-脱氧-22,23-二氢-5-(肟基)-阿维菌素B1单糖,它与其他阿维菌素类抗生素的最大区别是在C5位置上的取代基为肟基,其分子结构中具有较强的亲脂基团,脂溶性较高,水溶性较差。2 药理作用机理 塞拉菌素的药理作用机理与其他阿维菌素类药物相同,即通过干扰虫体谷氨酸控制的氯离子通道使虫体发生快速、致死性和非痉挛性的神经肌肉麻痹。由于吸虫、绦虫不含有受谷氨酸控制的氯离子通道,故塞拉菌素对吸虫和绦虫无效,只对部分线虫和节肢动物类体表寄生虫有杀灭作用。 Ph i p ps A N 等[1] 在研究塞拉菌素对猫栉首蚤的作用机理时发现,在干扰猫栉首蚤虫体内谷氨酸控制的氯离子通道中塞拉菌素的浓度显著高于伊维菌素的浓度,因此其杀灭猫栉首蚤的效果高于伊维菌素。3 药物剂型 塞拉菌素作为一种优良的宠物用抗寄生虫药物,其剂型的研究也取得了一定的进展。目前,塞拉菌素制剂共有3种剂型:透皮剂、口服剂和注射剂。市场上较为成熟的产品为美国辉瑞公司生产的供外用的 塞拉菌素透皮剂,中文商品名为/大宠爱0,该制剂具有操作简单、使用方便等特点。该药在2006年8月份正式获得农业部批文,获准进入中国宠物市场。此外,国外还有关于口服剂和注射剂的研究报道。4 药物代谢动力学研究 Saraso la P 等[2] 采用高效液相色谱法(HPLC )对犬(12只)和猫(12只)进行了口服(24.0m g /kg)和外用(24.0mg /kg)塞拉菌素的药物代谢动力学研究。结果发现:在外用组中,猫的最大血药浓度为5513?2173ng /mL,达到峰值时间为15?12h;犬的最大血药浓度为86.5?34.0ng /mL ,达到峰值时间为72?48h 。在口服组中,猫的最大血药浓度为11929?5922ng /m L ,达到峰值时间为7?6h ;犬的最大血药浓度为7630?3140ng /mL,达到峰值时间为8?5h 。犬和猫口服组的各项指标均优于外用组。5 驱虫活性5.1 对螨的驱杀效果 塞拉菌素对螨有良好的驱杀效果。M uraoka N 等人的研究表明,按6.0~11.0m g /kg 的剂量局部外用塞拉菌素对犬疥螨的治愈率达100%。Shanks D J 等人对犬(48只)和猫(32只)进行了外用塞拉菌素(6.0m g /kg)防治耳痒螨的试验,用药30d 后进行检查,检查结果经方差分析表明,治疗组的耳痒螨感染率极显著低于对照组。塞拉菌素对家兔、小白鼠及雪貂的感染螨同样有驱杀效果。M c T ier N 等人对48只感染耳痒螨的家兔局部外用塞拉菌素(6.0~18.0m g /kg ),用药56d 后耳痒螨被100%驱杀。Gonenc B 等人按10.0~12.4m g /kg 的剂量对感染螨的小白鼠进行了塞拉菌素的药效观察,用药7d 后螨被100%驱杀。M iller D S 等人的试验证明,塞拉菌素对雪貂自然感染的耳痒螨的驱杀率达100%。5.2 对蚤的驱杀效果 塞拉菌素对犬和猫的感染蚤同样有良好的驱杀效果。有研究表明,在单糖基C5-肟基阿维菌素的一系列衍生物中,对猫跳蚤(栉首蚤属)杀灭活性最高的是塞拉菌素,其最小可检验检测浓度(M DD )值 15 5黑龙江畜牧兽医62008年第11期
·综述· 鬼臼毒素生物合成研究进展 陆炜强,傅承新,赵云鹏 * (浙江大学生命科学学院濒危野生动植物保护生物学教育部重点实验室,浙江杭州310058) [摘要]鬼臼毒素(podophyllotoxin )是一种成功商品化的天然木脂素,其衍生物依托泊苷(etoposide )、替尼泊苷(tenipo-side )等在临床上广泛应用于抗肿瘤、抗病毒治疗。植物提取是鬼臼毒素的主要来源,面对野生资源压力,人们分别开展了植物野生变栽培、 植物细胞或器官培养、化学全合成等研究,以扩大鬼臼毒素来源。鬼臼毒素生物合成研究是开展植物规范化栽培和代谢工程的重要前提。20多年来尤其是近10年来,鬼臼毒素生物合成研究进展迅速,但鬼臼毒素的下游代谢以及整个合成途径基因水平的评述仍不足,因此作者专门针对鬼臼毒素的生物合成,对相关文献尤其是近10年的文献进行综述,重点介绍其合成途径关键环节的过程、主要产物、酶的特点与功能、已报道的酶编码基因等内容,以合理推测和概括鬼臼毒素的生物合成途径,同时对目前研究仍存在的问题和将来研究方向进行了讨论。 [关键词]鬼臼毒素;生物合成;规范化栽培;代谢工程[稿件编号]20101116002 [基金项目]国家科技支撑计划项目(2006BAI21B07);浙江省科技厅中药现代化专项(2006C13077)[通信作者]* 赵云鹏, Tel :(0571)88206463,E-mail :ypzhao @https://www.doczj.com/doc/f512204172.html, [作者简介]陆炜强, Tel :(0571)88206463,E-mail :lwq-711@ 163.鬼臼毒素(podophyllotoxin , PTOX )是植物来源天然产物成功商品化的经典案例。从其发现至今已有近1个世纪的历史,其具有良好的抗肿瘤、抗尖锐湿疣、抗艾滋病毒活性 [1-3] ,虽然自身毒副作用较大,但其半合成衍生物在保证治 疗效果的同时,大大降低了毒性,在临床治疗淋巴癌、肺癌等多种癌症中得到广泛应用, 如依托泊苷(etoposide ,VP-16),替尼泊苷(teniposide ,VM-26),依托泊苷磷酸酯(etopophos ),azatoxin ,tafluposide 等[4]。鬼臼毒素的传统和主要来源是植物提取,来源植物主要分布于小檗科足叶草属Podophyllum 、桃儿七属Sinopodophyllum 、八角莲属Dysosma 、山荷叶属Diphylleia 、Jeffersonia 属,其他还有亚麻科亚麻属Linum ,柏科刺柏属Juniperus 、崖柏属Thuja 、Callitris 属,唇形科山香属Hyptis 、百里香属Thymus 、香科科属Teucrium 、荆芥属Nepeta 、Eriope 属等[5-7]。由于过度采挖、生境破坏和植物自身生长缓慢等原因,鬼臼类野生植物资源逐渐枯竭、物种濒危,已难以满足鬼臼毒素生产的需求,人工规范化栽培势在必行,但目前桃儿七S .hexandrum (异名:Podophyllum hex-andrum ,P .emodi )、八角莲D .versipellis 的栽培刚刚起步,其他来源植物的新资源开发程度也有待进一步深入 [8-10] 。此外,虽然化学全合成技术已经有所突破,但是 复杂的合成过程、极低的合成效率(约为5%),使人工全合成鬼臼毒素目前仍难以实现商业化 [3,11] 。近年来基于 生物技术的植物代谢工程快速发展,为鬼臼毒素替代资源的开发提供了更多途径,如植物细胞或器官培养、生物转化等,但仍存在效率低、成本高的共性问题,目前尚未产业化 [5,12-14] 。因此,要彻底解决鬼臼毒素的来源问题, 仍需要对上述3种途径的关键科学和技术问题深入研究。 实现药用植物规范化栽培和植物细胞或器官培养生产鬼臼毒素的前提之一是必须充分阐明鬼臼毒素的生物合成途径及其调控机制。因此,自20世纪80年代末以来,学者们以足叶草Podophyllum spp.、亚麻Linum spp.等植物的组织或细胞培养体系为研究系统,探讨了鬼臼毒素的生物合成途径,取得了长足进展。前人综述了不同时期鬼臼毒素生物合成不同方面的研究进展 [6,12,15-19] ,揭示了合成途径的大体 框架,为后续的研究提供了良好的基础和背景。但是前人的综述大多是对鬼臼毒素的资源、化学、药理、生物合成、细胞或器官培养等内容的全面评述,或者是对整个木脂素类生物合成的综述, 对于鬼臼毒素生物合成的论述不够全面、详细,比如对鬼臼毒素下游的代谢往往没有讨论,而且对近几年已有新进展的相关酶编码基因的分离、扩增、表达也较少涉及。因此,本文专门针对鬼臼毒素的生物合成,对相关文献尤其是近10年的文献进行综述,重点介绍其合成途径关键环节的过程、主要产物、酶的特点与功能、鬼臼毒素下游代谢、已报道的酶编码基因等内容,以期继续推动该领域的研究,实现优质种源筛选、株系改良、栽培和培养条件优化、生产体系调控,为鬼臼类植物规范化栽培和代谢工程的产业化奠定
关于煤间接液化技术“费-托合成”的学习报告报告说明 F-T合成作为煤的间接液化的重要工艺,有着广泛的应用。本文将分别报告作者在F-T合成的基本原理、高低温工艺、催化剂以及F-T合成新工艺的学习情况。在以上学习的基础上,报告末尾有本人对F-T合成工艺改进的一点设想和建议。 一、F-T合成的基本原理 主反应 生成烷烃: (1) (2) 生成烯烃: (3) (4) 副反应 生成含氧有机物: (5) (6) (7) 生成甲烷: (8) 积碳反应: (9) 歧化反应:
(10) F-T合成利用合成气在炉内反应生成液体燃料,1-4式为目标反应,其中1和3是生产过程中主要反应。其合成的烃类基本为直链型、烯烃基本为1-烯烃。5-7式会生成含氧有机物的反应会降低产品品质;8式生成甲烷虽然是优质燃料但价值不高(原料合成气也为气体),往往需要分离出来进行制氢,构成循环;积碳反应主要是会对催化剂产生影响,温度过高时积碳反应产生的碳会镀在催化剂上(结焦现象),堵塞孔隙,造成催化剂失效。 二、高温工艺与低温工艺 反应温度不同,F-T合成液体产物C数目也不同(或者说选择性不同),基本上呈温度变高,碳链变短的趋势。低温工艺约在200-240摄氏度下反应,即可使用Fe催化剂也可用Co系催化剂,后者效果较好,产物主要是柴油、润滑油和石蜡等重质油品。高温工艺约在350摄氏度情况下反应,一般使用熔铁催化剂,产品主要是小分子烯烃和汽油。 由于温度不同,高低温工艺采用的反应器也有所不同,低温工艺主要采用固定床反应器、浆态床反应器;高温工艺主要用循环流化床、固定流化床反应器。 下面关于首先报告我对反应基本流程的认识 首先无论何种反应器都需要先将合成气和循环气加热到一定温度后输入反应器,再经过均布装置将合成气均匀散开,之后进入反应段。由于炉内反应基本为强放热反应,对于低温工艺需要设置通水的管道利用水汽蒸发转移热量提高效率,而高温工艺由于强烈的对流换热所以并不要求特殊的冷却系统。 反应段过后主要是催化剂回收和产品分离的问题,这一点主要是利用旋分器、重力沉降(反应中催化剂结团结块)等方式。图1为反应器的基本结构示意图 图错误!未指定顺序。反应器基本结构示意图 这里再简要报告我对以上提到的四类反应器认识 固定床反应器(Arge反应器) 由于催化剂到冷却界面的传热距离限制,固定床式反应器要想法设法增大表面积。早期由于管式反应器直径过大而采取了层炉式反应器,然而由于散热和催化剂利用效率的问题而不被广泛使用。随后的发展趋势就是反应器内“管”越来越多、越来越细;1955年Sasol公司开发了内含2052根直径50毫米“管”的固定床反应器;1990年Shell公司开发了内含26150根直径26毫米“管”的反应器。而“管越多、越细”,反应器的效率和生产能力也越高(这点后面要提到)。 这种反应器优点易于操作运行,产品易于分离,适用于蜡生产;但是缺点也很明显,由于此类反应器温度分布不均,其温度需要控制在较低水平,影响反应速率和产率,以及因此带来的对于催化剂细度的要求,使得催化剂利用效率低,用量大;同时反应器由于承受压降厚度较大,铁催化剂定期更换要求复杂的网络结构,加大了设备成本。 浆态床反应器
济南大学研究生课程考查试卷 课程编号:QZ283001课程名称:信息与文献检索学时16 学分 1 学号:20172120470 姓名牛浩学科、领域生物工程 学生类别:全日制专业学位成绩:任课教师(签名) 1、考核形式(采用大作业、论文、调研报告、实验报告等): 课程论文 2、考查(内容、目的等)具体要求: 写一篇与所从事专业相关的综述性论文 字数在3000字左右 书写格式规范,论述清晰,层次分明 3、成绩评定说明(含平时成绩、考核成绩): 平时成绩主要包括考勤和平时作业,考勤共计10分,平时作业共计20分,占总成绩的30%。 期末课程论文共计70分,占总成绩的70%。 总成绩为平时成绩与课程论文成绩的加和,即100分。
合成生物学在生物燃料领域的研究 摘要:本文简要介绍了合成生物学的概念,生物燃料的研究现状、研究前景以及未来可能会遇到的一些挑战。探讨了合成生物学在生物燃料研究中的应用进展包括提高生物质原料的转化特性、开发绿色高效生物催化剂、构建微生物细胞工厂以及设计合成多种生物燃料产品。最后对合成生物学在生物燃料领域的研究做出了展望。 关键词:合成生物学;生物燃料;研究现状;前景;挑战;应用进展 1 合成生物学概述 合成生物学(synthetic biology) 是综合了科学与工程的一个崭新的生物学研究领域。它既是由分子生物学、基因组学、信息技术和工程学交叉融合而产生的一系列新的工具和方法,又通过按照人为需求( 科研和应用目标),人工合成有生命功能的生物分子( 元件、模块或器件)、系统乃至细胞,并自系统生物学采用的“自上而下”全面整合分析的研究策略之后,为生物学研究提供了一种采用“自下而上”合成策略的正向工程学方法[1]。它不同于对天然基因克隆改造的基因工程和对代谢途径模拟加工的代谢工程,而是在以基因组解析和生物分子化学合成为核心的现代生物技术基础上,以系统生物学思想和知识为指导,综合生物化学、生物物理和生物信息技术与知识,建立基于基因和基因组、蛋白质和蛋白质组的基本要素( 模块) 及其组合的工程化的资源库和技术平台,旨在设计、改造、重建或制造生物分子、生物部件、生物系统、代谢途径与发育分化过程,以及具有生命活动能力的生物部件、体系以及人造细胞和生物个体。 2 生物燃料研究现状与挑战 2.1 生物燃料的研究现状 生物燃料主要包括纤维素生物燃料(乙醇、丁醇等)、微藻生物燃料(生物柴油、航空生物燃料等),以及最近两年研究较热的新型优质生物液体燃料(高级醇、脂肪醇、脂肪烃等)和利用新技术路线合成的生物乙醇与生物柴油(蓝藻乙醇、微生物直接利用纤维素水解糖体内合成生物柴油等)等。“可持续性”是生物燃料的核
阿维菌素生产工艺研究进展 化工107 10411120 蔡金鹏摘要: 阿维菌素是目前最有效的杀灭动植物寄生虫的抗生素之一。对阿维菌素高产菌株的培育、发酵培养基的优化以及产品的分离纯化进行了综述,指出阿维菌素是很有前景的一类低毒害生物农药 关键词: 阿维菌素;诱变育种;培养基;分离;结晶 1975年,日本北里研究所(KitasatoInstitute)从日本静冈川奈市的一个土壤样品中分离得到该菌株,研究初期即发现该菌株的发酵液具有很高的驱肠道寄生虫活性。它能有效地防治双翅目、同翅目、鞘翅目和鳞翅目害虫及多种害螨,特别是对常用农药有抗药性的害螨和害虫具有优异效果。阿维菌素为农用兽用杀虫、杀螨剂,大环内酯双糖类化合物。阿维菌素对昆虫和螨类具有触杀和胃毒作用并有微弱的熏蒸作用,致死作用较慢。但在植物表面残留较少。化学构成阿维菌素是一种高效、广谱的抗生素类杀虫杀螨剂。它是由一组大环内酯类化合物组成,活性物质为AVERMECTIN,对螨类和昆虫具有胃毒和触杀作用。喷施叶表面可迅速分解消散,渗入植物薄壁组织内的活性成份可较长时间存在于组织中并具有传导作用,对害螨和植物组织内取食危害的昆虫有长残效性。主要用于家禽、家畜体内外寄生虫和农作物害虫,如寄生红虫、双翅目、鞘翅目、鳞翅目和有害螨等。无致畸、致癌、致突变作用。天然Avermectins中含有8个组分,主要有4种即A1a、A2a、B1a和B2a,其总含量≥80%;对应的4个比例较小的同系物是A1b、A2b、B1b和B2b,其总含量≤20%。 阿维菌素分子式:
一.阿维菌素的性质特点介绍 1. 理化性质 原药精粉为白色或黄色结晶(含B1a≥90%),蒸气压<200nPa,熔点150- 155℃,21℃时溶解度在水中7.8微克/升、丙酮中100、甲苯中350、异丙醇 70,氯仿25(g/L)常温下不易分解。在25℃,pH5-9的溶液中无分解现象。农药上常用的叫做阿维菌素油膏,是阿维菌素精粉提炼后的附属品,为二甲苯溶解乳油装,含量在3-7%之间。 2.作用方式及特点 触杀,胃毒,渗透力强。它是一种大环内酯双糖类化合物。是从土壤微生物中分离的天然产物,对昆虫和螨类具有触杀和胃毒作用并有微弱的熏蒸作用,无内吸作用。但它对叶片有很强的渗透作用,可杀死表皮下的害虫,且残效期长。它不杀卵。其作用机制与一般杀虫剂不同的是它干扰神经生理活动,刺激释放r-氨基丁酸,而r-氨基丁酸对节肢动物的神经传导有抑制作用,螨类成、若螨和昆虫与幼虫与药剂接触后即出现麻痹症状,不活动不取食,2-4天后死亡。因不引起昆虫迅速脱水,所以它的致死作用较慢。对捕食性和寄生性天敌虽有直接杀伤作用,但因植物表面残留少,因此对益虫的损伤小。对根节线虫作用明显。 3.中毒症状 早期症状为瞳孔放大,行动失调,肌肉颤抖。一般导致患者高度昏迷。 4.急救治疗 经口:立即引吐并给患者服用吐根糖浆或麻黄素,但勿给昏迷患者催吐或灌任何东西。抢救时避免给患者使用增强γ-氨基丁酸活性的药物如巴比妥、丙戊酸等)。 二.菌种改造 在工业生产中,阿维菌素菌株的优劣对生产有很重要的影响。阿维菌素原始菌株发酵单位非常低,最先发现的菌株MA-4680的发酵单位只有9μg/mL,经改变发酵条件后有较大的提高,但也仅为120μg/mL,不适合进行大规模发酵生产。该菌株经过紫外诱变,从中选出一株突变株,发酵单位可达到500μg/mL,相比原始菌株有了长足的提高。冯军等[5]通过对原始菌株进行紫外诱变,得到一株耐链霉素的突变株,发酵单位提高了116倍,另一突变株发酵单位提高了215倍;再采用亚硝基胍进行诱变,发酵效价提高116倍,并且发酵产物中的B1a和B1b的比值由原来的8提高到20。于秀莲等[6]在亚硝基胍诱变过程中加入质量浓度为1g/L 的阿维菌素时,取得最佳诱变效果,正变率达到1313%;增加阿维菌素质量浓度则孢子的死亡率增加,正变率降低,负变率增加;当质量浓度达到3g/L时,正变率为零;以含甲硫氨酸质量
微生物药物合成生物学研究进展 武临专, 洪斌* (中国医学科学院、北京协和医学院医药生物技术研究所, 卫生部抗生素生物工程重点实验室, 北京100050) 摘要: 微生物次级代谢产物结构复杂多样, 具有抗细菌、抗真菌、抗肿瘤、抗病毒和免疫抑制等多种生物活性, 是微生物药物开发的源泉。当前, 微生物药物研究面临一些挑战: 快速发现结构新颖、生物活性突出的化合物; 理性化提高产生菌的发酵效价; 以及以微生物为新宿主, 实现一些重要天然药物的工业生产。合成生物学是在系统生物学和代谢工程等基础上发展起来的一门学科。本文对合成生物学在发现微生物新次级代谢产物、提高现有微生物药物合成水平和创制微生物次级代谢产物方面的研究进展进行了阐述。 关键词: 微生物药物; 合成生物学; 次级代谢产物; 生物合成 中图分类号: Q939.9; Q81; R914.5 文献标识码:A 文章编号: 0513-4870 (2013) 02-0155-06 Synthetic biology toward microbial secondary metabolites and pharmaceuticals WU Lin-zhuan, HONG Bin* (Key Laboratory of Biotechnology of Antibiotics of Ministry of Health, Institute of Medicinal Biotechnology, Peking Union Medical College and Chinese Academy of Medical Sciences, Beijing 100050, China) Abstract: Microbial secondary metabolites are one of the major sources of anti-bacterial, anti-fungal, anti- tumor, anti-virus and immunosuppressive agents for clinical use. Present challenges in microbial pharmaceutical development are the discovery of novel secondary metabolites with significant biological activities, improving the fermentation titers of industrial microbial strains, and production of natural product drugs by re-establishing their biosynthetic pathways in suitable microbial hosts. Synthetic biology, which is developed from systematic biology and metabolic engineering, provides a significant driving force for microbial pharmaceutical development. The review describes the major applications of synthetic biology in novel microbial secondary metabolite discovery, improved production of known secondary metabolites and the production of some natural drugs in genetically modified or reconstructed model microorganisms. Key words: microbial pharmaceuticals; synthetic biology; secondary metabolites; biosynthesis 来源于微生物的药物称为微生物药物(microbial medicine, microbial pharmaceuticals), 主要包括来源于微生物(特别是放线菌和真菌) 次级代谢产物的药物。 收稿日期: 2012-09-25; 修回日期: 2012-11-01. 基金项目: 国家“重大新药创制”科技重大专项资助项目(2012ZX09301002-001-016); 国家自然科学基金资助项目 (31170042, 81172964). *通讯作者 Tel: 86-10-63028003, E-mail: binhong69@https://www.doczj.com/doc/f512204172.html,, hongbin@https://www.doczj.com/doc/f512204172.html, 微生物药物例如抗生素, 在控制感染、免疫调节和治疗癌症等方面发挥了重要作用。目前, 已经从放线菌和真菌中发现了2万多种具有生物活性的次级代谢产物, 其中百余种成为微生物药物。随着对放线菌和真菌的持续开发利用, 直接从放线菌和真菌研制微生物新药难度越来越大, 主要原因在于: ①化合物排重难度很大(从微生物已经发现了25 000多种化合物); ②新微生物资源的分离培养工作没有突破性进展, 获得大量的、具有产生新次级代谢产物能 ·专题报道·
苦豆子生物碱的研究进展 发表时间:2014-01-14T11:36:51.670Z 来源:《医药前沿》2013年11月第33期供稿作者:韩玉刚张浩 [导读] 此外,苦参碱还试用于治疗病毒性肝炎、病毒性心肌炎。 韩玉刚张浩(解放军第206医院临床药学科吉林通化 134000) 苦豆子(sophora alopecuroides L)是豆科槐属植物,别名苦豆根、苦甘草、西豆根、苦豆草、欧苦参等,我国西北省区及中亚细亚一带均有分布。药用根、根茎、全草及种子,味苦性寒,有清热解毒、祛风燥热、止痛杀虫等作用。近年来的研究发现,其还有抗癌、抗炎、抗菌的作用。关于化学成分的研究的研究已有报道,为了更好的开发利用该资源,我们对其种子中生物碱成分的研究和药理作用的研究。已有报道鉴定的生物碱有氧化苦参碱(oxymatrine OMT)、氧化槐果碱(oxysophocarpine OSC)、苦参碱(matrine MT)、槐果碱(sophocarpine SC)、槐定碱(sophoridine SRI)和槐胺碱(sophoramine SA)、莱曼碱(lehmannine LEH)、苦豆碱(aloperine ALC)。现将近几年苦豆子类生物碱在抗炎方面的资料进行综述如下。 杨志伟等发现苦参总碱、苦豆总碱具有明显而独特的抗柯萨基B3组病毒(CVB3)的作用,通过对(CVB3)与各个药物在37℃作用2小时,然后测定病毒的TCID50。结果提示苦参总碱和苦豆总碱能有效的抑制CVB3繁殖,两总碱主要效应可能是直接灭活游离病毒以及进入细胞内发挥抗病毒作用。而且具有免疫调节功能。此外,苦参碱还试用于治疗病毒性肝炎、病毒性心肌炎。 李凡等的研究发现苦豆碱对多种致炎剂所引起的急性炎症和Ⅲ,Ⅳ型变态反应有显著的抑制作用。从免疫的角度对其进行研究。苦豆碱有抑制巨噬细胞产生包细胞介毒1(IL-2)的作用(p<0.01),并能直接抑制小鼠脾细胞增殖反应,同时能抑制脾细胞对豆蛋白A(CorA)诱导的T细胞增殖反应(p<0.01),对多种致炎剂诱发的动物炎症有拮抗作用。魏立民等指出氧化苦参碱对大鼠急性胰腺炎具有良好的治疗效果,其机制可能与其抑制料性细胞因素的产生有关,有学者的系列报道提出,苦参碱是一种新的有希望的眼炎药物,能够对抗晶状体蛋白诱发的家兔虹膜炎、睫状体炎,但是它不通过影响花生四烯酸链,而可能是一种全新的抗炎机制,何丽华等在临床采用苦参碱制成阴道栓剂治疗慢性宫颈炎。有效率达95.9%,治愈率为49.78%,治疗宫颈糜烂有效率为97.33%,并无腹痛、出血、感染、复发等副作用,可弥补物理治疗的不足。另外它对滴虫性阴道炎、霉菌性阴道炎等亦有一定的治疗作用。氧化苦参碱iv和im治疗各型湿疹皮炎,取得明显效果,有效率为84.8%,氧化苦参碱对大鼠变异性接触性皮炎具有一定的疗效。苦豆子碱片(每片重0sg,含生物碱30mg)通过临床证明可治疗细菌性痢疾、肠炎。 黄秀梅等对四种苦豆子生物碱抗炎的考察,通过用LPS刺激体外培养的小鼠腹腔巨噬细胞,使之剂理依赖性地产生肿瘤坏死因子,观察对巨噬细胞产生肿瘤坏死因子的影响。结果这四种苦参碱、氧化苦参碱、槐定碱和槐果碱都能显著抑制小鼠腹腔巨噬细胞有LPS诱导产生地TNFa,并有明显地剂量反应关系,进一步证实了此类生物碱的抗炎作用与其直接抑制TNFa的分泌有关。 给大鼠灌胃苦豆碱可明显抑制组胺、PGE25-HT和角叉莱胶引起的组肿胀,苦豆碱还能抑制霉菌素引起的足肿胀,对大鼠PCA反应、Arthus反应、可逆性被动Arthus反应以及结核菌素引起的大鼠迟发型皮肤超敏反应也有显著抑制作用,并能抑制组胺引起的毛细血管通透性增加和白细胞游走于体外,对红细胞膜也有明显稳定作用。以上表明,苦豆碱抗炎与免疫抑制作用主要与其抑制白细胞游走,稳定溶酶体膜,抑制PG、组胺等炎症介质的合成释放有关。 甘乐文等的氧化苦参碱对大鼠肝纤维化的影响的研究发现苦参碱能显著减轻大鼠肝细胞变形坏死和纤维组织增生,降低升高的ALT、HA。氧化苦参碱对四氯化碳引起的小鼠肝损伤、氨基个乳糖所致小鼠肝损伤有保护作用、可抑制肝组织内炎症活动度,下调血清TNFa水平,且在大剂量治疗组抑制的效果更好,下调幅度更大。 陈伟忠等对苦参碱对大鼠试验性肝纤维化的影响研究发现降低乐血清中ALT,降低血清HA的含量。降低Hyp的含量,能显著减少大鼠肝细胞变性坏死和纤维组织增生。病理结果显示治疗肝细胞变性坏死较模型组轻,结缔组织形成减少,说明苦参碱有抗纤维化作用,推测苦参碱可能通过保护肝细胞,抑制单核-巨噬细胞、枯否细胞分泌细胞因子而达到防治肝纤维化的作用。 苦豆子生物碱在抗炎,抗过敏有着很好的疗效,特别是在肝炎,肝硬化这些疑难杂症,博尔泰力就是用苦豆子生物碱做的制剂,治疗肝炎效果显著,得开发。豆子生物碱在妇科炎症也有广阔天地。为了更好的开发中药的苦豆子,对苦豆子生物碱的药理作用考察是很重要的。特别是抗病毒方面,有待于基础研究和临床应用进一步密切合作。 参考文献 [1].杨志伟,周娅,曹秀琴等。苦豆总碱、苦参总碱体外抗柯萨B3病毒的作用,宁夏医学杂志,2002,24(12):707-710. [2].魏立民,张兴荣,马述春等。生长抑素及氧化苦参碱治疗大鼠急性胰腺炎的试验研究。第二军医大学学报,1999,20(9):633-635. [3].黄秀梅,李波,沈连忠等。四种苦豆子生物碱对巨噬细胞产生肿瘤坏死因子a的影响。中药药理与临床,2001,17(3):12-14. [4].韩春雷,陈学荣,马俊江等。氧化苦参碱对大鼠变应性接触性皮炎药效学作用。北京医科大学学报,1996.28(1):59-61. [5].何丽华,刘世连,杨丽楠等。中药苦豆子治疗宫颈糜烂75例。中国民间疗法,2000,8,(10):32. [6].彭建华,于华等。博尔泰力治疗慢性乙型肝炎的临床疗效观察。中国城乡企业卫生,2001,6,(3):30. [7].陈伟忠,张俊平,许青等。苦参碱对大鼠实验性肝纤维化的影响。第二军医大学学报,1996,17(5):424-426. [8].周清荣,张园梅,申悦平等。苦参素治疗慢性乙型肝炎32例。中西医结合肝病杂志,2003,13(3):174-176. [9].李凡,石艳春,黄红兰等。苦豆碱对小鼠免疫细胞功能的影响。白求恩医科大学学报,1997,23(6):603-605. [10].甘乐文,王国俊,李玉莉等。氧化苦参碱对大鼠肝纤维化的影响。第二军医大学学报,1999120(7):445-448.
合成生物学的前景展望 目录: 前言 科学定义 学科特征 发展现状 前景展望 结语 前言 当今方兴未艾的合成生物学,是一门建立在生物信息学、DNA化学合成技术、遗传学和系统生物学之上的交叉学科。近十年来,该学科在病毒全基因组合成、标准化遗传回路和最小基因组研究中取得了巨大的突破,也展现了其在生物科学应用中扮演的重要角色。本文将通过介绍与分析合成生物学的相关信息展望合成生物学的发展前景。 科学定义 目前合成生物学研究涵盖范围广泛,对其定义的表述不尽相同:合成生物学领域知名的网站(http://syntheticbiology. org)这样描述该领域的主要研究内容:“设计和构建新型生物学部件或系统以及对自然界的已有生物系统进行重新设计,并加以应用。”2010年12月,美国13位知名专家共同完成了一份名为《新的方向》的研究报告,专门探讨合成生物学问题,文中将合成生物学的研究目标定位为:“将标准化的工程技术应用于生物学,以此创造出新型或具有特定功能的生命体或生物系统,以满足无尽的需求。”合成生物学组织(Synthetic Biology Community)网站上公布的合成生物学的定义则强调合成生物学的两条技术路线:(1)新的生物零件、组件和系统的设计与建造;(2)对现有的、天然的生物系统的重新设计。 综合起来,合成生物学可被理解为基于系统生物学的遗传工程从基因片段、人工碱基DNA子、基因调控网络与信号传导路径到细胞的人工设计与合成,类似于现代集成型建筑工程,将工程学原理与方法应用于遗传工程与细胞工程等生物技术领域,合成生物学、计算生物学与化学生物学一同构成系统生物技术的方法基础。 学科特征 1.多学科交叉性: 作为一个以多学科为基础的综合性交叉研究领域,对于生物学家,合成生物学打开了一扇探索生命奥秘的大门;工程学家更关注的是该如何将实验流程和各类生物学元件进行模块化、标准化,以及如何有效地控制多个元件的相互协调;而如何将标准化的生物学模块进行数字化、定量化评价,更好地为人造“软件”进行模拟计算从而指导生物系统的构建,则是计算科学在生命科学中应用的突出体现;化学家和药物学家则更愿意将合成生物学看作多种用途的新型工具,用于高效地生产新型燃料和药物。 2.超越传统技术的革新: 合成生物学改变了过去的单基因转移技术,开创综合集成的基因链乃至整个基因蓝图设计,并实现人工生物系统的设计与制造。从分子结构图式、信号传导网络、细胞形态类型到器官组织结构的多基因系统调控研究的系统遗传学,以及纳米生物技术、生物计算、
第17卷 第3期 2007年3月 阿维菌素的生物合成研究进展与展望 * 陈 芝 宋 渊 文 莹 李季伦** 中国农业大学生物学院微生物系,北京100094 2006-07-19收稿,2006-08-18收修改稿 *国家重点基础研究发展计划资助项目(批准号:2003CB114205) **通信作者,E -mail :lijilu n @https://www.doczj.com/doc/f512204172.html, 摘要 阿维链霉菌(S treptom yces avermitilis )由于可以产生杀虫抗生素———阿维菌素而备受研究者的青睐.多年来该菌得到了全面系统的研究,其基因组序列也已测定.文中综述了阿维链霉菌中阿维菌素生物合成代谢途径方面的研究,并对后续研究进行展望.关键词 阿维链霉菌 阿维菌素 次级代谢 生物合成 基因工程 组合生物合成 1 阿维链霉菌及其基因组信息 阿维菌素的产生菌———阿维链霉菌(S trepto -myces avermitilis )是1975年日本北里研究所从日本 静岗县的一个土壤样品中分离得到的.阿维链霉菌自发现以来,以日本北里大学和北里研究所以及美国Merk 公司为主的研究小组分别对它开展了深入研究,形成了一个重要的抗生素研究领域.与其他链霉菌一样,阿维链霉菌不仅具有复杂的形态分化,也具有合成多种次级代谢产物的能力,由它产生的阿维菌素在医药、农业及畜牧业上有着重要的商业价值.目前对阿维链霉菌的研究主要集中在阿维菌素的生物合成领域[1—5]. 链霉菌中天蓝色链霉菌(S treptomy ces coelicol -or )A3(2)[6] 、阿维链霉菌MA -4680[7] 和S trepto -myces div ersa 的基因组序列已被测定,此外还有一些链霉菌(S.noursei ,S.ambo faciens ,S.peucetius 和S.scabies )的基因组正在测定中(http ://w w w.geno mesonline.o rg /search.cgi ).对它们的基因组序列的比较将为这些微生物的研究提供有价值的信息.阿维链霉菌的线状染色体大小为9025608bp ,G +C 含量为70.7%,至少包含7577个开放阅读框(ORF ),编码区占基因组的86.2%.O RF 平均大小为1034bp.阿维链霉菌还含有一个线性质粒 SAP1,大小为94287bp ,G +C 含量为69.2%,含有96个O RF ,编码区占质粒的79.0%.在阿维链霉菌的基因组中,大多数必需基因都位于一个高度保守的6.5M b 的内部区域.染色体上靠近端粒的 位置有两个保守性低的亚端粒区(subtelome ric re -gio ns ).有趣的是,50%以上的与次级代谢合成有关的基因(包括阿维菌素的生物合成基因)都位于亚端粒区,而在亚端粒区没有发现已知的必需基因.此外,亚端粒区含有基因组中大部分的转座因子[7].这些基因位于亚端粒区可能与阿维链霉菌的遗传不稳定性有关,在对阿维链霉菌培养过程中我们经常得到一些形态分化的突变株(光秃型突变株和白色突变株等),有些突变株同时丧失了合成阿维菌素的能力. 在阿维链霉菌的线状染色体上有30个基因簇与次级代谢合成有关,共有271个基因,占基因组的6.6%.它们广泛地分布于染色体上,但有一半位于染色体的末端.在质粒SA P1上没有发现与次级代谢有关的基因簇[7,8].在30个与次级代谢有关的基因簇中,有4个与黑色素的合成有关,其中两个负责酪氨酸酶及其辅酶的合成,另外两个分别与由尿黑酸生成的赭色色素和聚酮结构的黑色素的合成有关;合成类胡萝卜素和铁载体的基因簇分别由7个和5个基因组成;此外,有8个基因簇与非核 290