
第十一章配合物结构
一、教学基本要求
1、熟悉配合物价键理论的基本要点,掌握用价键理论说明配合物的空间构型。
2、了解配合物的磁性、空间构型、内轨型、外轨型配合物等基本概念。
二、主要内容
(一)配合物的空间构型
1、配合物的空间构型是指配位体在中心离子(或原子周围)排布的几何构型。
2、测定方法:实验测定、普遍采用X射线衍射。
3、配合物空间构型不仅取决于配位数,还与中心离子和配位体的种类有关。配合物空间构型与配位数的关系见表11- 1。
(二)配合物的磁性
1、配合物的磁性是配合物的重要性质之一,它对配合物结构的研究提供了重要的实验依据。
2、含有未成对电子的的配合物具有顺磁性。
不含有未成对电子的的配合物具有反磁性。
3.通常用物质的磁矩(μ)来表示顺磁性配合物在磁场中产生的磁效应。
μ=√n(n+2) B.M n—未成对电子数
磁矩可借助磁天平测得,通过其可以确定未成对电子数。
(三)配合物的价键理论
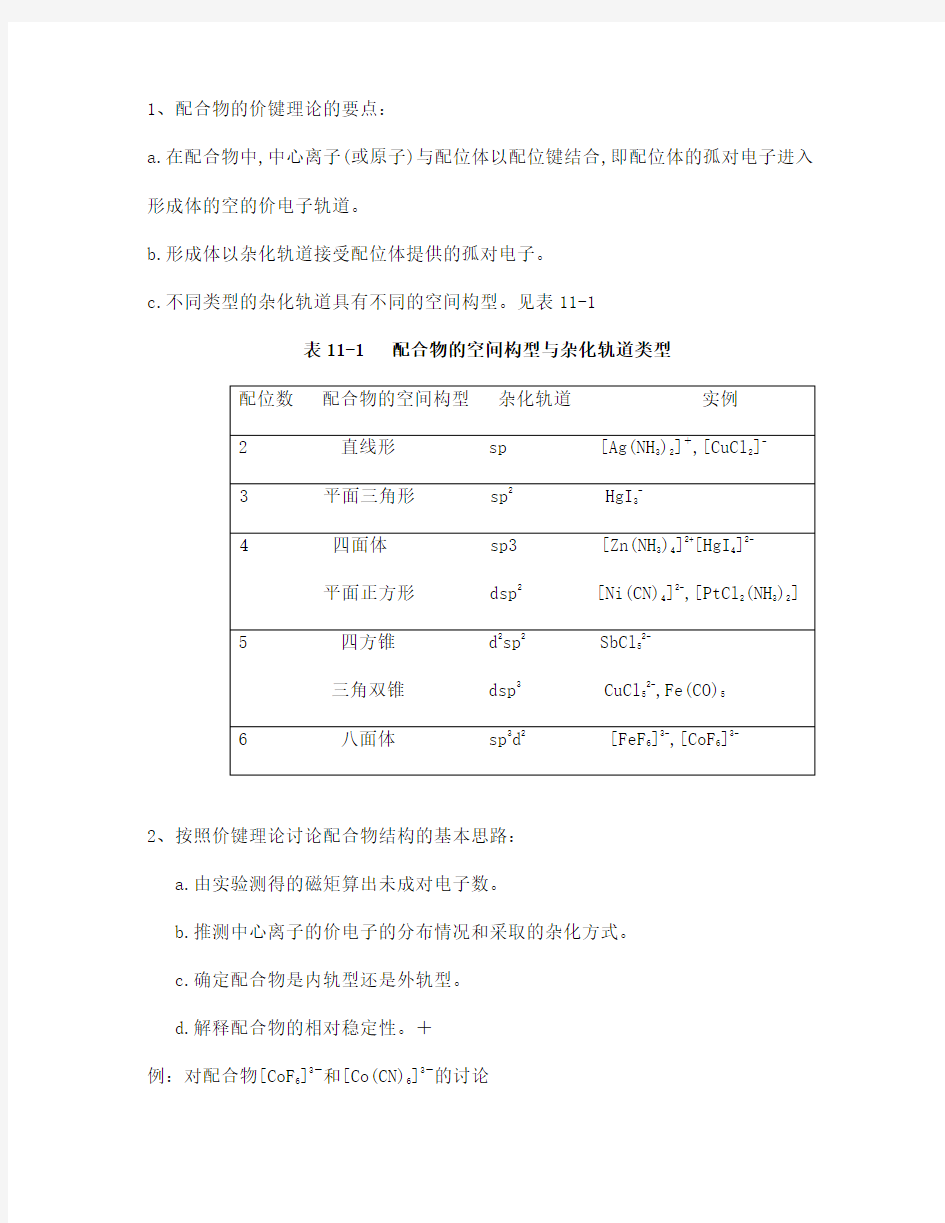
1、配合物的价键理论的要点:
a.在配合物中,中心离子(或原子)与配位体以配位键结合,即配位体的孤对电子进入形成体的空的价电子轨道。
b.形成体以杂化轨道接受配位体提供的孤对电子。
c.不同类型的杂化轨道具有不同的空间构型。见表11-1
表11-1 配合物的空间构型与杂化轨道类型
2、按照价键理论讨论配合物结构的基本思路:
a.由实验测得的磁矩算出未成对电子数。
b.推测中心离子的价电子的分布情况和采取的杂化方式。
c.确定配合物是内轨型还是外轨型。
d.解释配合物的相对稳定性。+
例:对配合物[CoF
6]3-和[Co(CN)
6
]3-的讨论
配合物以知磁矩
μ/B.M.
未成电
子数n
Co3+的价电子
排布
中心离
子的杂
化分式
配合物
的类型
相对稳
定性
[CoF
6
]3- 5.26 4 ↑↓↑↑↑↑
—————
sp3d2外轨型较高
[Co(CN)
6
]3-0 0 ↑↓↑↓↑↓d2sp3内轨型较低
配合物结构 一、配位化合物的定义 由提供孤电子对(NH 3、H 2O 、X - )或π电子(H 2C =CH 2 、 )的物种与提供适当空轨道的物种(金属原子或金属离子)组成的化合物称为配位化合物,简称为配合物。 二、配位化合物的组成 1.配合物由内界(inner )和外界(outer )组成。外界为简单离子,配合物可以无外界,但不可以无内界。例如: Fe(CO)5 Pt(NH 3)2Cl 2 2.内界由中心体(center )和配位体(ligand )组成。 (1) 中心体:提供适当的空轨道的原子或离子,绝大部分是d 区或ds 区元素。用M 表示。 (2) 配位体 (L)(简称配体):提供孤对电子对或π电子的离子,离子团或中性分子。 三、配位化合物的分类(Classification ) 1.Classical complexes :配体提供孤电子对,占有中心体的空轨道而形成的配合物。 例如:+23)Ag(NH ,- 34Cu(CN) 2.π-complexes :配体提供π电子,占有中心体的空轨道而形成的配合物。 例如:255)H Fe(C ,)]H C (K[PtCl 423(第一个π配合物,Zeise ’s salt ) M H 2C CH 2 M 配体提供:2个π电子 4个π电子 6个π电子 四、配位体(L )Ligand 1.根据配体中配位原子的不同,配体可分类成: (1) 单基(齿)配体(unidentate ligand ):配体中只含有一个配位原子; 例如:NH 3、H 2O 、X - 、 (py) (2) 多基(齿)配体(multidentate ligand ):配体中含有两个或两个以上的配位原子。由单齿配体组成 的配合物,称为简单配合物;由多齿配体组成的配合物,称为螯合物(chelate )。 2.一些常见的配体: (1) 单基配体:X -:F -(fluoro)、Cl -(chloro)、Br -(bromo)、I - (iodo)、H 2O (aquo)、 CO (carbonyl)、NO (nitrosyl)、C 5H 5N (py)、OH - (hydroxo) (2) 双基配体:en (乙二胺) H 2NCH 2CH 2NH 2(ethylenediamine ) ox 2-(草酸根) (oxalate ion ) gly - (氨基乙酸根) bipy (联吡啶) (2,2’-dipyridyl ) (3) 多基配体:EDTA (乙二胺四乙酸)(六齿)(H 4Y) (ethylenediaminetetracetato ) 五、配位数(Coordination Number ) 1.中心原子(或离子)所接受的配位原子的数目,称为配位数 2.若单基配体,则配位数 = 配体数;若多基配体,则配位数 = 配体数 ? 配位原子数 / 每个配体 3.确定配位数的经验规则—EAN 规则(Effective atomic number rule )或十八电子(九轨道)规则 (1) 含义: a .EAN 规则:中心体的电子数加上配体提供给中心体的电子数等于某一稀有气体的电子构型(36,54, 86) b .十八电子规则:中心体的价电子数 + 配体提供的电子数 =18,(n - 1)d 10n s 2n p 6 N O C O C O O H 2NCH 2C O O N N HOOCH 2C NCH 2CH 2N HOOCH 2C CH 2COOH CH 2COOH
解:错 第10章(03368)所有金属离子的氨配合物在水中都能稳定存在。.() 解:错 第10章(03369)价键理论认为,所有中心离子(或原子)都既能形成内轨型配合物,又能形成外轨型配合物。() 解:错 第10章(03370)所有内轨型配合物都呈反磁性,所有外轨型配合物都呈顺磁性。.() 解:错 第10章(03371)内轨型配合物往往比外轨型配合物稳定,螯合物比简单配合物稳定,则螯合物必定是内轨型配合物。.() 解:错 第10章(03372)内轨型配合物的稳定常数一定大于外轨型配合物的稳定常数。.() 解:错 第10章(03373)不论配合物的中心离子采取d2sp3或是sp3d2杂化轨道成键,其空间构型均为八面体形。.() 解:对 第10章(03374)[Fe(CN)6]3-和[FeF6]3-的空间构型都为八面体形,但中心离子的轨 道杂化方式不同。() 解:对 第10章(03375)[Fe(CN)6]3-是内轨型配合物,呈反磁性,磁矩为0。() 解:错 第10章(03376)K3[FeF6]和K3[Fe(CN)6]都呈顺磁性。() 解:对 第10章(03377)Fe2+的六配位配合物都是反磁性的。.() 解:错 第10章(03378)在配离子[AlCl4]-和[Al(OH)4]-中,Al3+的杂化轨道不同,这两种配 离子的空间构型也不同。() 解:错 第10章(03379)已知E(Cu2+/Cu)=,E([Cu(NH3)4]2+/Cu)=,则E([Cu(CN)4]2-/Cu)<。 () 解:对 第10章(03384)Ni2+的四面体构型的配合物,必定是顺磁性的。() 解:对 第10章(03380)已知E(Ag+/Ag)=,E([Ag(NH3)2]+/Ag)=,则E([Ag(CN)2]-/Ag)>。( ) 解:错 第10章(03381)按照价键理论可推知,中心离子的电荷数低时,只能形成外轨型配
第十一章 配合物结构之课后习题参考答案 2解:(1)[CuCl 2]-的磁距为0。 (2)[Zn(NH 3)4]2+的磁距为0。 (3)[Co(NCS)4]2-的磁距为87.3)23(3=+?。 3解: (1) (2) (3) 4解:(1)[Co(en)3]2+为外轨型 (2)[Fe(C 2O 4)3]3-为外轨型
(3)[(Co(EDTA)]-为内轨型 5解:Ni 2+离子的价电子构型为:3d 8。因Cl -为弱场配体,形成[NiCl 4]2-配离子时,其3d 轨道中的电子不会发生重排腾出空的3d 轨道,所以只能使用最外层的空轨道形成sp 3杂化,其空间构型为正四面体,[NiCl 4]2-含有2个未成对电子,其磁距=83.2)22(2=+?。 而CN -为强场配体,可使Ni 2+离子的3d 轨道上的电子重排,腾出1条空的3d 轨道,则采取dsp 2杂化,空间构型为平面正方形,无成单电子数,其磁距为0,所以是反磁性的。 6解:(1)[Ru(NH 3)6]2+中Ru 2+离子的价电子构型为4d 6, 形成配离子后处于低自旋状态, 即4d 上的成单电子重排成三对电子对, 无成单电子存在,其磁距为0. (2)[Fe(CN)6]3-中Fe 3+离子的价电子构型为3d 5, 形成配离子后处于低自旋状态, 即3d 上的成单电子重排成两对电子对, 有1个成单电子存在, 其磁距为73.1)21(1=+?. (3)[Ni(H 2O)6]2+中Ni 2+离子的价电子构型为3d 8, 形成配离子后处于高自旋状态, 即3d 上的成单电子不能重排, 则有2个成单电子存在, 其磁距为83.2)22(2=+? (4)[V(en)3]3+中V 3+离子的价电子构型为3d 2, 本身3d 轨道就有3条是空的,形成配离子时不需重排, 有2个成单电子存在, 其磁距为83.2)22(2=+?。 (5)[CoCl 4]2-中Co 2+离子的价电子构型为3d 7, 形成配离子后处于高自旋状态, 即3d 上的成单电子不能重排, 则有3个成单电子存在, 其磁距为87.3)23(3=+?。
配合物 知识点总结 一、配位化合物的定义 由提供孤电子对(NH 3、H 2O 、X - 或π电子的物种与提供适当空轨道的物种(金属原子或金属离子)组成的化合物称为配位化合物,简称为配合物。 二、配位化合物的组成 1.配合物由内界和外界组成。外界为简单离子,配合物可以无外界,但不可以无内界。例如:Fe(CO)5、Pt(NH 3)2Cl 2 2.内界由中心体和配位体组成。 (1) 中心体:提供适当的空轨道的原子或离子,绝大部分是d 区或ds 区元素。用M 表示。 (2) 配位体 (L)(简称配体):提供孤对电子对或π电子的离子,离子团或中性分子。 三、配位化合物的分类 1.配体提供孤电子对,占有中心体的空轨道而形成的配合物。例如:+23)Ag(NH ,- 34Cu(CN) 2.配体提供π电子,占有中心体的空轨道而形成的配合物。 例如:255)H Fe(C H 2C CH 2 M 配体提供:2个π电子 4个π电子 6个π电子 四、配位体 1.根据配体中配位原子的不同,配体可分类成: (1) 单基(齿)配体:配体中只含有一个配位原子;例如:NH 3、H 2O 。 (2) 多基(齿)配体:配体中含有两个或两个以上的配位原子。由单齿配体组成的配合物,称为简单配合物;由多齿配体组成的配合物,称为螯合物。 2.一些常见的配体: (1) 单基配体:X -:F -、Cl -、Br -、I -、H 2O 、CO 、NO 、OH - (2) 双基配体:en (乙二胺) H 2NCH 2CH 2NH 2、ox 2-(草酸根) 五、配位数 1.中心原子(或离子)所接受的配位原子的数目,称为配位数 2.若单基配体,则配位数 = 配体数;若多基配体,则配位数 = 配体数 ? 配位原子数 / 每个配体 六、配位化合物的命名 1.从总体上命名 (1) 某化某:外界是简单阴离子,[Cr(H 2O)4Cl 2]Cl ,氯化二氯·四氨合铬(Ⅲ) (2) 某酸某:a .外界是含酸根离子:[Co(NH 3)5Br]SO 4:硫酸溴·五氨合钴(Ⅲ) b .内界是配阴离子:K 3[Fe(CN)6]:六氰合铁(Ⅲ)酸钾 2.内界的命名 (1) 内界的命名顺序:配体名称 + 合 + 中心体名称 + (用罗马数字表示的中心体氧化数)例如:[PtCl 2(NH 3)(C 2H 4)]:二氯·氨·(乙烯)合铂(Ⅱ) (2) 配体的命名顺序: a .先无机配体后有机配体,有机配体名称一般加括号,以避免混淆; b .先命名阴离子配体,再命名中性分子配体; c .对于都是中性分子(或阴离子),先命名配体中配位原子排在英文字母顺序前面的配体,例如NH 3和H 2O ,应先命名NH 3; d .若配位原子数相同,则先命名原子数少的配体。例如:NH 3、NH 2OH ,先命名NH 3。 (3) 配体的名称 a .M ←SCN 硫氰酸根 (-SCN)、M ←NCS 异硫氰酸根 (-NCS)、M ←NO 2 硝基 (-NO 2)、M ←ONO 亚硝酸根 (-ONO)、 NO 亚硝酰基、CO 羰基、M ←CN 氰根、M ←NC 异氰根 3.多核配合物的命名
第十一章配合物结构 & 主要内容: q 配合物的空间构型和磁性 q 配合物的化学键理论 & 重点难点: q 配合物的结构理论,包括价键理论、晶体场理论和分子轨道理论。并根据这些理论解释配合物的有关性质。 q 由试验测得的磁矩算出未成对电子数;推测中心离子的价电子的分布情况和中心离子采取的杂化方式;确定配合物是内轨型还是外轨型,来解释配合物的相对稳定性。 q 根据晶体场分裂能与电子成对能的相对大小,判断在晶体场中中心离子的价电子在不同轨道中的分布,推论配合物类型,确定配合物的磁性,估算出配合物磁矩数值,进一步可计算晶体场稳定化能,说明配合物的相对稳定性。 & 教学目的: q 熟悉配合物价键理论的基本要点、配合物的几何构型与中心离子杂化轨道的关系。 q 了解内轨型、外轨型配合物的概念、中心离子价电子排布与配离子稳定性、磁性的关系q 了解配合物晶体场理论的基本要点;了解八面体场中d电子的分布和高、低自旋的概念,推测配合物的稳定性、磁性;了解配合物的颜色与d-d跃迁的关系。 & 授课学时 4学时 §11.1配合物空间构型和磁性 11.1.1 配合物的空间构型 配合物分子或离子的空间构型与配位数的多少密切相关。
由图可见,配合物的空间构型除了与配位数密切相关外,还与配体种类有关,例如,配位数 同样是4,但为四面体构型,而则为平面正方形。 11.1.2 配合物的磁性 磁性:物质在磁场中表现出来的性质。 顺磁性:被磁场吸引的性质。例如:O 2,NO,NO 2 等物质具有顺磁性。 反磁性:被磁场排斥的性质。大多数物质具有反磁性。 铁磁性:被磁场强烈吸引的性质。例如:Fe,Co,Ni属于铁磁性物质。 物质的磁性与内部的电子自旋有关。若电子都是偶合的,由电子自旋产生的磁效应彼此抵消,这 种物质在磁场中表现反磁性;反之,有未成对电子存在时,才会在磁场中显示磁效应,可用磁矩(μ)。 式中,μ为磁矩,单位是B.M.(玻尔磁子), n为未成对电子数。 可用未成对电子数目n估算磁矩μ。 n 0 1 2 3 4 5 μ/B.M. 0 1.73 2.83 3.87 4.90 5.92 物质的磁性亦可用磁天平测定。实验测得的磁矩与估算值略有出入,总趋势比较吻合。
117 晶体结构 一、基本概念(The Basic Concepts ): 1.晶体(Crystals ): (1)物质的质点(分子、离子或原子)在空间有规则地排列而成的、具有整齐外形的、以多面体出现的固体物质,称为 晶体。 (2) 晶体有同质多象性 由同样的分子(或原子)可以以不同的方式堆积成不同的晶体,这种现象叫做同质多象性。但 同一种物质的气态、液态只存在一种结构。 (3) 晶体的几何度量和物理效应常随方向不同而表现出量上的差异,这种性质称为各向异性。 2.晶格(Crystal lattices ) (1) 以确定位置的点在空间作有规则的排列所具有一定的几何形状,称为晶体格子,简称为晶格。 Fig. 8.10 The 14 Bravais unit cells 3.晶胞(Unit cells ) (1) 在晶格中,含有晶体结构,具有代表性的最小单元,称为单元晶胞,简称晶胞。 (2) 在晶胞中的各结点上的内容必须相同。 (3) 晶胞参数 晶胞参数:a 、b 、c 、α、β、γ (4) 分数坐标 用来表示晶胞中质点的位置 例如: 简单立方 立方体心 立方面心 (0, 0, 0) , (0, 0, 0), (21,21,21) (0, 0, 0) (21,21,0), (21,0,21), (0,21,2 1 ) α βγb c a
118 在分数坐标中,绝对不能出现1,因为1即0。这说明晶胞是可以前后、左右、上下平移的。等价点只需要一个坐标来表示即可,上述三个晶胞中所含的质点分别为1、2、4,所以分数坐标分别为1组、2组和4组。 (5) 晶面指数 晶面在三维空间坐标上的截距的倒数(h 、k 、l )来表示晶体中的晶面,称为晶面指数,如立方晶系中 (100),(110),(111)面分别为 (100) (110) (111) l Fig. 8.12 Selected planes and their Miller indices for cubic system 用X-ray 的衍射可以测量晶体中的面间距,2d ·sin θ = n ·λ。 d -晶体的面间距,θ-衍射角,n -衍射级数,λ-X-ray 的波长。 对于立方晶系,面间距(d )晶胞参数(a )之间的关系式: 222l k,h,/l k h a d ++= 4.根据晶体中质点内容的不同,晶体可分类成:金属晶体(metallic crystals )、离子晶体(ionic crystals)、原子晶体(atomic crystals)、分子晶体(molecular crystals)、混合晶体(mixture crystals) 二、金属键与金属晶体(Metallic Bond and Metallic Crystals ) 1.金属键理论(Metallic bond ) (1) 改性的共价键理论 (2) 能带理论(band theory )(以分子轨道理论为基础) (a) 能带理论的基本要点 (i) 按照分子轨道理论,把整个金属晶体看作一 个大分子,把金属 中能级相同的原子轨道线性组合(原子轨道重叠)起来,成为整个金属晶 体共有的若干分子轨道,合称为能带(energy band),即金属晶体中的n 个原子中的每一种能量相等的原子轨道重叠所形成的n 个分子轨道,称为一个能带; Fig. 8.15 Bands of molecular orbitals in a metal crystal. Fig 8.14 Arrangement of atoms in a lithium crystal
第十一章配合物结构 (11-1) 如果配合物具有平面四方形和八面体空间构性,这类配合无可能存在几何异构体。 (1)[Co(NH3)4(H2O)2]3+具有八面体空间构性,其顺、反几何异构体为: (3),(4)与(1)类似,请自行完成。 (2)[PtCl(NO2)(NH3)2]为平面四方形构型,其顺、反几何异构体为: (5)[IrCl3(NH3)3]为八面体构型,属[MX3A3]型配合物,其顺、反几何异构体分别称为面式和经式异构体: (11-3) 磁矩是研究配合物结构的重要实验数据之一。决定配合物磁矩的最最重要因素是中心离子或原子的未成对电子数,由试验测得磁矩后,可以推测出未成对电子数,进而确定形成体的价层电子排布、杂化轨道类型及配合物的空间构型。 [Co(H2O)6]2+的μ=4.3B.M,Co2+为3d7电子构型,推知Co2+的未成对电子数n=3,其价层电子排布为: 配合无为正八面体的空间构型。 [Mn(CN)6]4-:μ=1.8B.M,Mn2+为3d5电子构型,n=1。其价层电子分布为: 配合物的空间构型为八面体。 自行回答[Ni(NH3)6]2+的相关问题。 *如果已经确定配合物个体的空间构型,可推知形成体的杂化轨道类型,再确定其价层电子排布和未成对电子数,从而可估算出该配合物磁矩。(11-2)题就属这种情况,请自行完成本体的解答。同样,也可完成(11-5)题。 (11-4) 本题的解体思路与(11-3)相同。这里,主要是对三种常见的螯合剂en,C2O42-,EDTA 的配位原子种类和数目要进一步熟悉;同时对内轨型和外轨型配合物的概念要很了解。 [Co(en)3]2+:μ=3.82B.M,Co2+为3d7, n=3,每个en有两个配位原子N。Co2+ 的价层电子分布为: Co2+采用sp3d2杂化轨道成键,为外轨型配合物(即成键轨道为ns,np,nd),是正八面体空间构型。 [Fe(C2O4)33-]的5.75B.M,Fe3+为,n=5,其价层电子分布为: 1C2O42-个有2个配位O,Fe3+以sp3d2杂化轨道成键,是外轨型八面体配合物。[Co(EDTA)]-的,n=0,Co3+的价层电子分布为: 每个EDTA中有2个N和4个O为配位原子,Co3+以d2sp3杂化轨道与EDTA成键,该螯合物空间构型为八面体,是内轨型配合物(其成键轨道为(n-1)d,ns,np)。
晶体结构 一、基本概念(The Basic Concepts ): 1.晶体(Crystals ): (1)物质的质点(分子、离子或原子)在空间有规则地排列而成的、具有整齐外形的、以多面体出现的固体物质,称为 晶体。 (2) 晶体有同质多象性 由同样的分子(或原子)可以以不同的方式堆积成不同的晶体,这种现象叫做同质多象性。但 同一种物质的气态、液态只存在一种结构。 (3) 晶体的几何度量和物理效应常随方向不同而表现出量上的差异,这种性质称为各向异性。 2.晶格(Crystal lattices ) (1) 以确定位置的点在空间作有规则的排列所具有一定的几何形状,称为晶体格子,简称为晶格。 Fig. 8.10 The 14 Bravais unit cells 3.晶胞(Unit cells ) (1) 在晶格中,含有晶体结构,具有代表性的最小单元,称为单元晶胞,简称晶胞。 (2) 在晶胞中的各结点上的内容必须相同。 (3) 晶胞参数 晶胞参数:a 、b 、c 、α、β、γ (4) 分数坐标 用来表示晶胞中质点的位置 例如: 简单立方 立方体心 立方面心 (0, 0, 0) , (0, 0, 0), ( 21,21,21) (0, 0, 0) (21,21,0), (21,0,21), (0,21,2 1 ) 在分数坐标中,绝对不能出现1,因为1即0。这说明晶胞是可以前后、左右、上下平移的。等价点只需要一个坐标来表 α βγb c a
118 示即可,上述三个晶胞中所含的质点分别为1、2、4,所以分数坐标分别为1组、2组和4组。 (5) 晶面指数 晶面在三维空间坐标上的截距的倒数(h 、k 、l )来表示晶体中的晶面,称为晶面指数,如立方晶系中 (100),(110),(111)面分别为 (100) (110) (111) l Fig. 8.12 Selected planes and their Miller indices for cubic system 用X-ray 的衍射可以测量晶体中的面间距,2d ·sin θ = n ·λ。 d -晶体的面间距,θ-衍射角,n -衍射级数,λ-X-ray 的波长。 对于立方晶系,面间距(d )晶胞参数(a )之间的关系式: 222l k,h,/l k h a d ++= 4.根据晶体中质点内容的不同,晶体可分类成:金属晶体(metallic crystals )、离子晶体(ionic crystals)、原子晶体(atomic crystals)、分子晶体(molecular crystals)、混合晶体(mixture crystals) 二、金属键与金属晶体(Metallic Bond and Metallic Crystals ) 1.金属键理论(Metallic bond ) (1) 改性的共价键理论 (2) 能带理论(band theory )(以分子轨道理论为基础) (a) 能带理论的基本要点 (i) 按照分子轨道理论,把整个金属晶体看作一个大分子,把金属 中能级相同的原子轨道线性组合(原子轨道重叠)起来,成为整个金属晶体共有的若干分子 轨道,合称为能带(energy band),即金属晶体中的n 个原子中的每一种能量相等的原子轨道重叠所形成的n 个分子轨道,称为一个 能带; Fig. 8.15 Bands of molecular orbitals in a metal crystal. Fig 8.14 Arrangement of atoms in a lithium crystal
配合物的结构和性质 【学习目标】 了解配合物的结构和性质 【知识要点】 1.配离子的空间构型 配位数杂化轨道类型空间构型例子 2 sp [Ag(NH3)2]+ 3 sp2[CO3]2-、[NO3]- 4 sp3[Zn(NH3)4]2+ 4 (dsP2) [Ni(CN)4]2A+ 6 (d2sp3) [A1F6]2- 2.顺、反异构体 化学组成相同的配合物可以有不同的结构,这就是配合物的异构现象。主要是指化学组成相同,仅仅由于配体围绕中心离子的位置不同而产生的结构、性质不同的几何体。最常见的有顺式、反式两种异构体。 (1)存在于含有两种或两种以上配位体的配合物(某些有机物中也存在)。 (2)顺式——指相同配体彼此位于邻位。 反式——指相同配体彼此处于对位。 (3)在配位数为、或的配合物中,不存在顺、反异构体。因上述构型中配位位置都是彼此相邻的。 (4)顺、反异构体性质同。 3.配合物的稳定性 配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当作为中心原子的金属离子相同时,配合物的稳定性与有关。如CO与血红素中的Fe2+形成的配位键比O2与Fe2+形成的强。 (1)配位原子的电负性__________________________________________________ (2)配位体的碱性____________________________________________________ (3)螯合效应_________________________________________________________ 4.配合物的命名 (1)配合物内界命名。一般按如下顺序:配体个数(用一、二、三……表示)一配体名称(不同配体名称之间以中圆点“·”隔开)一“合”字一中心原子名称一中心原子的化合价(在括号中用罗马数注明)。如:[PtCl4]四氯合铂(Ⅱ) (2)自右向左阴离子名称在前,阳离子名称在后。若阴离子部分是简单离子则称“某化某”,若阴离子为复杂离子则称“某酸某”。如: 5.配合物的类型(了解) 配合物的范围极广,主要可以分为以下几类: (1)简单配位化合物:指由单基配位体与中心离子配位而形成的配合物。这类配合物通常配体较多,在溶液中可以逐级解离成一系列配位数不同的配离子。 (2)螯合物:具有环状结构的配合物叫螯合物或配合物。
配合物知识点总结 一、 配位化合物的定义 由提供孤电子对(NH 3、H 2O 、X 「或n 电子的物种与提供适当空轨道的物种(金属原子或金属离子)组成的化合物 称为配位化合物,简称为配合物。 二、 配位化合物的组成 1配合物由内界和外界组成。外界为简单离子,配合物可以无外界,但不可以无内界。例如: Fe (CO )5、Pt (NH 3) 2Cl 2 2. 内界由中心体和配位体组成。 (1) 中心体:提供适当的空轨道的原子或离子,绝大部分是 d 区或ds 区 元素。用M 表示。 (2) 配位体(L )(简称配体):提供孤对电子对或 n 电子的离子,离子团或中 性分子。 三、 配位化合物的分类 1. 配体提供孤电子对,占有中心体的空轨道而形成的配合物。例如: Ag (NH 3)2 , Cu (CN ) 3- 2?配体提供n 电子,占有中心体的空轨道而形成的配合物。 例如:Fe (C 5H 5)2 M M 配体提供:2个n 电子 4个n 电子 四、 配位体 1. 根据配体中配位原子的不同,配体可分类成: (1)单基(齿)配体:配体中只含有一个配位原子;例如: NH 3、H 2O 。 ⑵ 多基(齿)配体:配体中含有两个或两个以上的配位原子。由单齿配体组成的配合物,称为简单配合物;由多齿配 体组成的配合 物,称为螯合物。 2. —些常见的配体: (1)单基配体:X 「: F 「、C 「、Br 「、「、出0、CO 、NO 、OH 一 ⑵ 双基配体:en (乙二胺)H 2NCH 2CH 2NH 2、ox (草酸根) 五、 配位数 1?中心原子(或离子)所接受的配位原子的数目,称为配位数 2?若单基配体,则配位数 =配体数;若多基配体,则配位数 =配体数 配位原子数/每个配体 六、 配位化合物的命名 1.从总体上命名 (1) 某化某:外界是简单阴离子, [Cr (H 2O )4Cl 2]Cl ,氯化二氯 四氨合铬(川) (2) 某酸某:a .外界是含酸根离子:[Co (NH 3)5Br]SO 4:硫酸溴 五氨合钴(川) b. 内界是配阴离子:K 3[Fe (CN )6]:六氰合铁(川)酸钾 2?内界的命名 (1)内界的命名顺序:配体名称 +合+中心体名称 + (用罗马数字表示的中心体氧化数 )例如:[PtCl 2(NH 3) (C 2H 4)]:二 氯氨(乙烯)合铂(n ) ⑵配体的命名顺序: a. 先无机配体后有机配体,有机配体名称一般加括号,以避免混淆; b. 先命名阴离子配体,再命名中性分子配体; c. 对于都是中性分子(或阴离子),先命名配体中配位原子排在英文字母顺序前面的配体,例如 NH 3和H 2O ,应先命 名 NH 3; A > M 6个n 电子
第十一章配合物结构 [教学要求] 1.熟悉配合物价键理论的基本要点、配合物的几何构型与中心离子杂化轨道的关系。了解内轨型、外轨型配合物的概念、中心离子价电子排布与配离子稳定性、磁性的关系。 2.了解配合物晶体场理论的基本要点;了解八面体中d电子的分步和高自旋、低自旋配合物等概念。推测配合物的稳定性、磁性。了解配合物的颜色与d -d跃迁的关系。 [教学重点] 1. 配合物的异构问题 2. 配合物的价键理论 [教学难点] 配合物的几何异构和对映异构, 晶体场理论 [教学时数] 10学时 [主要内容] 1.配位化合物的基本概念:什么叫配合物,组成,命名。 2.配合物的价键理论:配合物的立体结构和几何异构,配合物类型简介(简单配离子、螯合物、多核配合物)。 3.晶体场理论要点:简介d轨道的能级分裂和晶体场效应:八面体场的分裂、四面体场的分裂、平面四边形场的分裂;分裂能和影响分裂能的因素,稳定化能;晶体场理论对配合物性质的解释(颜色、磁性)。 [教学内容] §11.1 配合物的空间构型、异构现象和磁性 11.1.1 配合物的空间构型 配合物的空间构型五花八门,但其基本规律是: (1) 形成体在中间,配位体围绕中心离子排布 (2) 配位体倾向于尽可能远离,能量低,配合物稳定
配合物分子或离子的空间构型与配位数的多少密切相关。 11.1.2 配合物的异构现象 化学家将组成相同而结构不同的分子或复杂离子叫做异构现象,这样的分子和离子叫做异构体。金属配合物表现出多种形式的异构现象,其中以几何异构和旋光异构最重要。 1.几何异构现象: 按照配体对于中心离子的不同位置区分。 cis-[PtCl2(NH3)2] :顺式,棕黄色,极性分子 trans-[PtCl2(NH3)2]:反式,淡黄色,非极性分子 顺式Pt(Ⅱ)配合物显示治癌活性。 2. 旋光异构现象 由于分子的特殊对称性形成的两种异构体而引起的旋光性相反的现象。两种旋光异构体互成镜像关系。 例如:cis-[CoCl2(en)2]+ 具有旋光异构体,为手性分子。
第十一章 配合物结构 1. 根据下列配离子的磁矩画出它们中心离子的价层电子分布,指出杂化轨道类型和配离 子的空间构型。 [Co (H 2O )6] 2+ [Mn (CN )6] 4+ [Ni (NH 3)6] 2+ μ/B.M. 4.3 1.8 3.11 解: 磁矩是研究配合物结构的重要实验数据之一。 决定配合物磁矩的最主要因素是 :中心离子或原子的未成对电子数。 由实验测得磁矩后,可以推测出未成对电子数,进而确定形成体的价层电子排布、杂 化轨道类型及配合物得空间构型。 [Co (H 2O )6] 2+ 的μ=4.3B.M., Co 2+ 为 3d 7 电子构型, 推知 Co 2+ 的未成对电子数 n=3, 其价层电子排布: 3d 4d 4s 4p ↑ ↑ ↑ ↑ ↑ ↑ H2O H2O H2O H2O H2O H2O sp 3 d 2 杂化 配合物为正八面体的空间构型。 [Mn (CN )6] 4+ :μ=1.8 B.M., Mn 2+ 为 3d 5 电子构型, 其价层电子分布为 3d 4s 4p ↑ ↑ ↑ ↑ ↑ ↑ CN - CN - CN - CN - CN - CN - d 2 sp 3 杂化 配合物的空间构型为正八面体。 ●自行回答[Ni (NH 3)6] 2+ 的相关问题。 ●如果已经确定配合物个体的空间构型, 可推知形成体的杂化轨道类型,再确定其价层电子 排布和未成对电子数,从而可估算出该配合物磁矩。(11—2)题就属这种情况,请自行完成 本题的解答。同样,也可完成(11—5)题。
2. 下列配离子中未成对电子数各是多少?估计其磁距各为多少?(B.M.) (1)[Ru(NH3)6] 2+ (低自选状态); (2)[Fe(CN)6] 3- (低自选状态); (3)[Ni(H2O)] 2+ ; (4)[V(en)3] 3+ ; (5)[CoCl4] 2- ; 解:内轨型、外轨型的概念是配合物价键理论中的概念; 高自旋和低自旋的概念属于晶体场理论的范畴。 如果某八面体配合物按价键理论是内轨型的,则按晶体场理论往往是低自旋的,即形成 体的未成对电子数 n尽可能的小。 同样,外轨型与高自旋是相对应的,形成体的未成对电子数在形成配合物前后不改变。 (1) Ru 2+ 的价层电子构型为 4d 6 ,按晶体场理论,[Ru(NH3)6] 2+ 为低自旋状态,则其 电子排布式为t 6 2e e 0 g ,n=0,估计磁矩μ=0。 (2)Fe 3+ 的价层电子构型为 3d 5 ,[Fe(CN) 6] 3- 为低自旋,其电子排布式为t 5 2e e 0 g ,n=1, μ≈1.73B.M.。 (2) Ni 2+ 的价层电子构型为 3d 8 ,d 8 电子构型的离子只能形成高自旋配合物,因此, [Ni(H2O)] 2+ 的电子排布式为t 6 2e e 2 g ,n=2,μ≈2.83B.M. (4) V 3+ 的价层电子构型为 3d 2 , 中心离子 d 2 构型的配合物其电子排布式只能t 2 2e e 0 2e , n=2, μ≈2.83B.M. (5)Co 2+ 的价层电子构型为 3d 7 ,[CoCl4] 2- 为四面体空间构型的配合物,其电子排布式表 示为 e 4 t 3 2 ,n=3,μ≈3.87B.M. ●按晶体场理论,配合物中心离子的电子排布式与配合物个体的空间构型有关。 3. 已知下列配合物的分裂能(△0)和中心离子的电子成对能(P)表示出各中心离子的 d 电子在 e g 轨道和 t2g 轨道的分布,并估计其磁距(B.M.)各为多少?指出这些配合物中何者 为高自旋,何者为低自旋。 [Co(NH3)6] 2+ [Fe(H2O)6] 2+ [Co(NH3)6] 2+ M n+ 的P/cm -1 22500 17600 21000 △0/cm -1 11000 10400 22900 解:根据晶体场理论,确定八面体空间构型的配合物的中心离子 M n+ 的 d 电子排布式的基
配合物的形成与空间构型 题组一配合物的形成与判断 1.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是( ) A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 B.沉淀溶解后,生成深蓝色的配离子[Cu(NH3)4]2+ C.向反应后的溶液中加入乙醇,溶液没有发生变化 D.在[Cu(NH3)4]2+离子中,Cu2+提供孤电子对,NH3提供空轨道 答案 B 解析硫酸铜溶液中加入氨水先生成蓝色沉淀氢氧化铜,继续加入氨水生成[Cu(NH3)4]2+,铜离子浓度减小;加入乙醇后有深蓝色晶体[Cu(NH3)4]SO4·H2O析出;在[Cu(NH3)4]2+中,NH3分子中的氮原子提供孤电子对,Cu2+提供空轨道。2.下列物质不是配合物的是( ) A.K2[Co(SCN)4] B.Fe(SCN)3 C.CuSO4·5H2O D.NH4Cl 答案 D 解析A项,钴离子提供空轨道、硫氰根离子提供孤电子对而形成配位键,所以该物质属于配合物;B项,铁离子提供空轨道、硫氰根离子提供孤电子对而形成配位键,所以该物质为配合物;C项,铜离子提供空轨道、水分子中氧原子提供孤电子对而形成配位键,所以该物质属于配合物;D项,铵根离子中N原子含有孤电子对,氢离子提供空轨道,形成配位键,而配合物是中心原子(或离子)提供空轨道,NH+4不是配离子,所以NH4Cl不是配合物。 题组二配合物组成的分析及判断 3.[Co(NH3)5Cl]2+配离子,中心离子的配位数是( ) A.1B.2C.4D.6 答案 D 解析[Co(NH3)5Cl]2+中,Co3+为中心离子提供空轨道,Cl-、NH3为配体提供孤电子对,有1个氯离子和5个氨分子作配体,配位数为6。 4.配位化合物的数量巨大,组成和结构形形色色。配合物[Cu(NH3)4](OH)2的中心离子、配体、中心离子的化合价和配位数分别为( ) A.Cu2+、NH3、+2、4 B.Cu+、NH3、+1、4 C.Cu2+、OH-、+2、2 D.Cu2+、NH3、+2、2 答案 A 解析配合物[Cu(NH3)4](OH)2中,Cu2+为中心离子,化合价为+2,配体为NH3,配位数为4。 5.关于下列说法正确的是( ) A.配合物[Zn(NH3)4]Cl2配位数为6 B.配合物[Zn(NH3)4]Cl2中,配体为NH3和Cl-,[Zn(NH3)4]2+为内界
第十一章配合物结构 一、教学基本要求 1、熟悉配合物价键理论的基本要点,掌握用价键理论说明配合物的空间构型。 2、了解配合物的磁性、空间构型、内轨型、外轨型配合物等基本概念。 二、主要内容 (一)配合物的空间构型 1、配合物的空间构型是指配位体在中心离子(或原子周围)排布的几何构型。 2、测定方法:实验测定、普遍采用X射线衍射。 3、配合物空间构型不仅取决于配位数,还与中心离子和配位体的种类有关。配合物空间构型与配位数的关系见表11- 1。 (二)配合物的磁性 1、配合物的磁性是配合物的重要性质之一,它对配合物结构的研究提供了重要的实验依据。 2、含有未成对电子的的配合物具有顺磁性。 不含有未成对电子的的配合物具有反磁性。 3.通常用物质的磁矩(μ)来表示顺磁性配合物在磁场中产生的磁效应。 μ=√n(n+2) B.M n—未成对电子数 磁矩可借助磁天平测得,通过其可以确定未成对电子数。 (三)配合物的价键理论
1、配合物的价键理论的要点: a.在配合物中,中心离子(或原子)与配位体以配位键结合,即配位体的孤对电子进入形成体的空的价电子轨道。 b.形成体以杂化轨道接受配位体提供的孤对电子。 c.不同类型的杂化轨道具有不同的空间构型。见表11-1 表11-1 配合物的空间构型与杂化轨道类型 2、按照价键理论讨论配合物结构的基本思路: a.由实验测得的磁矩算出未成对电子数。 b.推测中心离子的价电子的分布情况和采取的杂化方式。 c.确定配合物是内轨型还是外轨型。 d.解释配合物的相对稳定性。+ 例:对配合物[CoF 6]3-和[Co(CN) 6 ]3-的讨论
配合物以知磁矩 μ/B.M. 未成电 子数n Co3+的价电子 排布 中心离 子的杂 化分式 配合物 的类型 相对稳 定性 [CoF 6 ]3- 5.26 4 ↑↓↑↑↑↑ ————— sp3d2外轨型较高 [Co(CN) 6 ]3-0 0 ↑↓↑↓↑↓d2sp3内轨型较低