
JuLI
高级细胞成像仪活细胞荧光成像仪活细胞观测仪
Nanoentek JuLI FL fluorescence live cell movie analyzer Nanoentek JuLI Smart fluorescent cell analyzer digitalbio Nanoentek
仪器特点:
·将细胞计数和细胞分析两种功能集于一身;
·通过荧光和亮光两种方式进行细胞成像;
·50,000小时寿命的蓝光LED ;
·一键获取图像功能; ·LCD 触摸屏
·连续储存的细胞图像可转化成影像资料;
·通过新式分析软件可对荧光细胞进行全面分析,使得出芽增殖分析,活细胞计数等数据更加可靠;
·通过无线保真技术可轻易将图像、影像等资料传输至PC 。
仪器用途:
·活细胞成像;
·细胞迁移测定; ·优化细胞分析; ·细胞培养质量控制; ·出芽增殖检测;
·GFP 转染细胞定量; ·通过台盼蓝检测存活细胞;
活细胞成像
活细胞实时动态影像技术
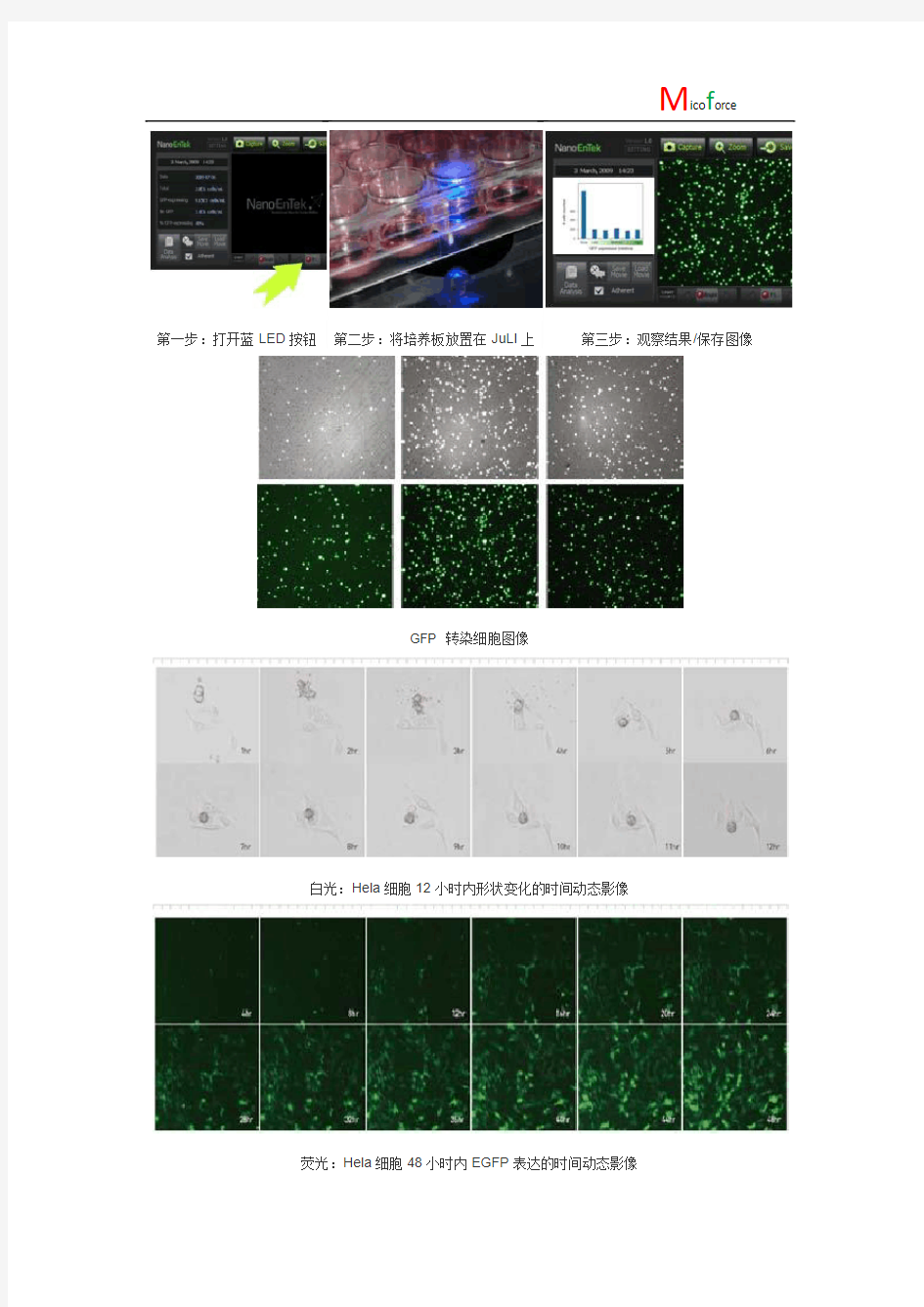
操作使用非常简单:
第一步:打开蓝LED按钮第二步:将培养板放置在JuLI上第三步:观察结果/保存图像
GFP 转染细胞图像
白光:Hela细胞12小时内形状变化的时间动态影像
荧光:Hela细胞48小时内EGFP表达的时间动态影像
仪器参数:
电源:AC 100-240V, 50-60Hz
CPU : AMD AU1250
放大率:10x和20x
滤光器:激发光、散射光、二向色滤光片
光源:白光/蓝光LED(488nm)
可选:
白光/绿光(532nm)
白光/红光(630nm)
相机:CMOS 1.3M像素(1280X1024)
显示器:7 ’ TFT-LCD (WVGA, 800×480)重量:<5Kg
尺寸:220×375×220 mm
?J uLI高级细胞成像仪活细胞荧光成像仪活细胞观测仪
??可放在培养箱或生物安全柜中使用,进行活细胞实时观察和时间序列(Time lapse)实验
?Wi-Fi传输:可在iPhone、iPad、PC等终端上进行实时监控,而无需从培养箱中取出
?一体化设计,触屏操控,外观时尚,操作简便
?超长寿命:配置40,000小时的蓝色LED光源(可选红色)
?使用环境无限制:可在任意室内光线(光照或暗室)条件下观察
?三种观察模式,满足不同要求:白光、荧光及叠加模式,图像清晰
?自带图像分析软件:扩展JuLI的应用功能,可进行细胞增殖、迁移、计数、及细胞表面标记物分析等
?仪器用途:
??活细胞成像;(定时拍摄功能)
??细胞迁移测定;
??优化细胞分析;
??细胞培养质量控制;
??细胞增殖分析
?
?仪器参数:
电源:AC 100-240V, 50-60Hz
CPU : AMD AU1250
放大率:10x和20x
滤光器:激发光、散射光、二向色滤光片
光源:白光/蓝光LED(488nm)
可选:
白光/红光(630nm)
相机: CMOS 1.3M像素(1280X1024)
显示器:7 ’ TFT-LCD (WVGA, 800×480)
重量:<5Kg
尺寸:220×375×220 mm
?
流式细胞术(Flow Cytometry,FCM)是一种对液流中排成单列的细胞或其它生物微粒(如微球,细菌,小型模式生物等)逐个进行快速定量分析和分选的技术。作为应用流式细胞术进行检测的技术平台,现代流式细胞仪产生于上世纪六七十年代。经过近四十年的发展和完善,今天的流式细胞仪已经十分成熟,并被广泛的运用于从基础研究到临床实践的各个方面,涵盖了细胞生物学、免疫学、血液学、肿瘤学、药理学、遗传学及临床检验等领域,在各学科中发挥着重要的作用。 现代流式细胞术综合了流体力学技术、激光技术、电子物理技术、光电测量技术、计算机技术、荧光化学技术及单克隆抗体技术,是多学科多领域技术进步的结晶。随着现代科技的高速发展,为了满足生命科学对细胞分析更高层次的要求,流式细胞技术仍然在快速发展,并已经在检测技术、分选技术及高通量分析等方面取得了许多突破。本文就流式细胞术的最新进展做一些介绍。 RealTime ready 智力大冲浪!答对5题,即获赠美国傲仕优质保温杯! 一、流式细胞检测与细胞成像的结合 使用传统的流式细胞检测技术,研究人员可以分析成千上万个细胞,获得每个细胞的散射光信号和荧光信号的数值,从而得到细胞群体的各种统计数据,并可以找到稀有的细胞亚群。但是传统流式细胞检测技术仍然存在局限,那就是获得的细胞信息很有限。细胞对研究人员来说,只是散点图上的一个点,而不是真实的细胞图像,缺乏细胞形态学、细胞结构及亚细胞水平信号分布的相关信息。要想获得细胞图像,研究人员就必须使用显微镜进行观察,但显微镜能够观察的细胞数量是非常有限的,很难提供细胞群体的量化与统计数据。因此,使用传统的细胞分析技术,我们就只能面对这样的两难选择,没有一种技术可以既提供细胞群体的统计数据,又获得细胞图像。不过,最近美国Amnis公司推出的ImageStream成像流式细胞仪,给传统细胞分析带来突破性的变革。 ImageStream是一种台式多谱段成像流式细胞仪(Multispectral Imaging Flow Cytometry),能够同时采集6个检测通道中的细胞图像(图1)。它将流式细胞检测与荧光显微成像结合于一身,既能提供细胞群的统计数据,又可以获得单个细胞的图像,从而提供细胞形态学、细胞结构和亚细胞信号分布的信息。
GE超高分辨活细胞成像系统 利用活细胞成像工作站进行细胞和基因的功能研究,是生物医学研究的最新趋势。固定细胞观察仅能提供固定瞬间细胞的静态信息,无法反映细胞在正常生理生化条件下的状态。活细胞观察,对处于正常生理状况下的细胞进行全程扫描和记录,获得其连续、全面、动态过程由于其显示的正常细胞动态的活动过程,很容易发现和确定细胞间相互作用和信号传导的过程,以及在活细胞水平上的生物分子间的相互作用,不仅可以解决长期以来悬而未解的问题,更为未来的研究提出新的问题,指出新的方向。 一、活细胞成像系统原理 目前主流的活细胞成像系统从原理上可以分为两大类: 基于宽场反卷积技术 基于共聚焦技术 两种技术作为目前最流行的活细胞成像技术,均可以实现在维持细胞存活的情况下,快速获取单一焦平面的信号,在具体性能上则各有擅长。 宽场反卷积技术 对光线进行反卷积运算是光学成像领域的成熟技术,最早由美国国家航空航天局开发并成为观察微弱天体信号的标准技术。去卷积和共聚焦技术是光学显微镜领域获得单一焦平面光线的两大主流技术(J.M.Murray, live cell imaging, 2010)。通过将非焦平面的光线还原至焦平面上,大大提高了样品信号的强度以及图像的信噪比。由于去卷积技术设计到大量的后期运算,因此在高性能计算机发明以前,一直受制于运算能力,没有得到大规模的推广。随着近年来计算机性能的大幅提升和价格的下降,去卷积技术逐渐成为光学显微镜的主流技术。一个点光源经过显微镜的光路,由于镜片对光线的衍射和散射,最终呈现在观察者面前的是一个模糊的点,所以点光源变成模糊的点的过程即为卷积。反卷积就是把模糊的点还原成点光源的过程。 以API 公司的DeltaVision系统为例,其反卷积过程经历以下几步: 1)首先通过无数的计算和实验,得到点光源经过显微镜物镜后变模糊的规律,建立模型。 2)选择完美的物镜,保证样品信号经过物镜后变模糊的规律符合步骤一中得到的模型。 3)将通过显微镜光路的所有的光信号进行收集,因为点光源经过显微镜光路后会变成一个空 间中的倒圆锥形,所以在收集信号的时候需要很准确的记录信号的Z 轴信息。 4)对收集到的所有光信号按照步骤一中的模型进行还原,最终将模糊的点还原成清晰的点, 客观反映它在空间的位置和强度。 目前去卷积技术越来越广泛地应用于生物学图像的研究中。 共聚焦技术 共聚焦显微镜它采用点光源(point lightsource) 照射标本,在焦平面上形成了一个轮廓分明 的小的光点(light spot ) ,该点被照射后发出的荧光被物镜收集,并沿原照射光路回送到探测器。探测器前方有一个针孔(pinhole) ,几何尺寸可调。这样,来自焦平面的光,可以会聚在探 测针孔范围之内,而其它来自焦平面上方或下方的散射光,都被挡在探测针孔之外而不能成象。 光束扫描器又分为单光束、多光束或狭缝扫描器几种。其中单光束扫描获得的图像质量最好, 狭缝扫描器虽然产生图像的速率很高(可达实时水平) ,但其图像信噪比低于单光束扫描,这是 因为从狭缝长轴来的漫射光不能被有效遮挡。多光束扫描如碟片式共聚焦是由电动马达驱动
细胞免疫荧光步骤集团文件发布号:(9816-UATWW-MWUB-WUNN-INNUL-DQQTY-
方法一: 1.首先需要把细胞养在玻璃片上(悬浮细胞需要用多聚赖氨酸包被过的玻 璃片) 2.然后在4%PFA里面室温下固定30分钟,PBS洗两次,0.1% TX-100室 温下作用1-2分钟使细胞膜通透。 3.接下来进行荧光标记,需要在一个大的容器(面积大,扁平状的,比如 大的培养皿)里面,放一张用水打湿的滤纸,以保持湿度。 4.剪一片合适大小的parafilm,在上面滴上稀释在1%BSA/TBS中的一抗 (稀释倍数依具体抗体而定),每个玻璃片30ul足够,把玻璃片盖在上面(细胞面朝下),室温下孵育30分钟,然后在PBS里洗三次。 5.接下来二抗孵育步骤同上。 6.最后,在载玻片加上mounting medium(大约每个玻璃片加10ul),把 玻璃片放上去(细胞面朝下),37度30分钟,然后就可以在荧光显微镜下观察了。 7.抗体很重要,不能有非特异性结合。你可以先做WB检测一下你的抗 体,看看有没有杂带。 8.双标的话,可以把两个一抗一起加或者分别标记两次(可以都试一下看 看那种方法合适)。如果一个抗体需要二抗,一个是直接荧光标记的,可以把荧光标记的那个和另外一个的二抗一起加。 方法二: 1.选取一抗时要来源于两种不同的动物,我用的是来源于rabbit和rat 的抗体,二抗则是不同荧光信号标记的,我用的是donkey anti- rabbit-FITC(绿)和donkey anti-rat-Tex-Red(红)。 2.我的做法是两种一抗同时孵育,然后两种二抗同时孵育。抗体浓度、孵 育时间要仔细摸索,我感觉一抗4度孵育过夜比较好,背景比较清晰。 3.我的阳性对照用的是阳性组织切片,阴性对照则分别是家兔和大鼠的 IgG,荧光标记物对照是PBS+荧光标记物。 4.封闭血清与二抗来源动物一致,我用的是10%的正常donkey血清。 5.其余步骤同一般免疫荧光单标操作。 方法三:
免疫荧光操作步骤及注意事项 免疫荧光技术是在免疫学、生物化学和显微镜技术的基础上建立起来的一项技术。它是根据抗原抗体反应的原理,先将已知的抗原或抗体标记上荧光基团,再用这种荧光抗体(或抗原)作为探针检查细胞或组织内的相应抗原(或抗体)。利用荧光显微镜可以看见荧光所在的细胞或组织,从而确定抗原或抗体的性质和定位,以及利用定量技术(比如流式细胞仪)测定含量。 紫外光激发荧光物质放射荧光示意图 免疫荧光实验的主要步骤包括细胞片制备、固定及通透(或称为透化)、封闭、抗体孵育及荧光检测等。细胞片制备(通俗的说法是细胞爬片)是免疫荧光实验的第一步,细胞片的质量对实验的成败至关重要,原因很简单,如果发生细胞掉片,一切都无从谈起。这一步关键的是玻片(Slides or Coverslips)的处理以及细胞的活力,有人根据成功经验总结出许多有益的细节或小窍门,非常值得借鉴。固定和通透步骤最重要的是根据所研究抗原的性质选择适当的固定方法,合适的固定剂和固定程序对于获得好的实验结果是非常重要的。免疫荧光中的封闭和抗体孵育与其它方法(如ELISA或Western Blot)中的相同步骤是类似的,最重要的区别在于免疫荧光实验中要用到荧光抗体,因此必须谨记避光操作,此外抗体浓度的选择可能更加关键。最后需要注意的是,标记好荧光的细胞片应尽早观察,或者用封片剂封片后在4?或-20?避光保存,以免因标记蛋白解离或荧光减弱而影响实验结果。
由于操作步骤比较多,同时在分析结果时无法像WB那样可以根据分子量的大小区分非特异性识别,所以要得到一个完美的免疫荧光实验结果,除了需要高质量的抗体,以及对实验条件进行反复优化外,还必须设立严谨的实验对照。总之,免疫荧光实验从细胞样品处理、固定、封闭、抗体孵育到最后的封片及观察拍照,每步都非常关键,需要严格控制实验流程中每个步骤的质量,才能最终达到你的实验目的。 基本实验步骤: (1) 细胞准备。对单层生长细胞,在传代培养时,将细胞接种到预先放置有处理过的盖玻片的培养皿中,待细胞接近长成单层后取出盖玻片,PBS洗两次;对悬浮生长细胞,取对数生长细胞,用PBS离心洗涤(1000rpm,5min)2次,用细胞离心甩片机制备细胞片或直接制备细胞涂片。 (2) 固定。根据需要选择适当的固定剂固定细胞。固定完毕后的细胞可置于含叠氮纳的PBS中4?保存3个月。PBS洗涤3×5 min. (3) 通透。使用交联剂(如多聚甲醛)固定后的细胞,一般需要在加入抗体孵育前,对细胞进行通透处理,以保证抗体能够到达抗原部位。选择通透剂应充分考虑抗原蛋白的性质。通透的时间一般在5-15min.通透后用PBS洗涤3×5 min. (4) 封闭。使用封闭液对细胞进行封闭,时间一般为30min. (5) 一抗结合。室温孵育1h或者4?过夜。PBST漂洗3次,每次冲洗5min. (6) 二抗结合。间接免疫荧光需要使用二抗。室温避光孵育1h.PBST漂洗3次,每次冲洗5min后,再用蒸馏水漂洗一次。 (7) 封片及检测。滴加封片剂一滴,封片,荧光显微镜检查。 (一)细胞准备 用于免疫荧光实验的细胞可以是直接生长在盖玻片上的贴壁细胞,也可以是经过离心后涂片的悬浮细胞或者是将取自体内的组织细胞悬液离心后涂片。贴壁良好
为活细胞研究设计光学显微系统时,首要考虑的是检测器的敏感度(对信号乃至噪音的检测),图像获取的速度,以及在此基础上标本的可行性。对于固定细胞的成像,曝光时间及光强度相对来说都很高,这时可能会造成光漂白;然而对于活细胞成像,上述光的影响必须去除。几乎在所有情况下,活细胞显微镜都会在尽可能高的图像质量与尽可能好的细胞活性之间取得一个平衡。对于此类实验,时间及空间上的分辨率需要设定在能满足实验要求的水平上,而不是给予过度的光照或设定过多采样时间点。 基本上,一个理想的活细胞成像系统必需有足够的敏感度,来满足在弱荧光条件下仍能得到高图片质量;同时,系统也必需足够快,以记录整个动态过程。另外,这个系统还需要有足够高的分辨率以捕捉样品细节,并且能够准确的实时测量每个微小的光强变化。然而不幸的是,要改善上述的任意一条都需建立在牺牲其它性能的基础上。因此现在还不能够设计出一个可以满足所有要求的活细胞成像体系。研究人员现在只能在尽量减低不重要的信息的遗失的同时,尽可能的获得最优的重要参数。这样,显微镜的配置最终取决于成像的要求,对于样品在实验期间活性的要求,进行标记的难度水平,以及仪器的可用性等实际因素。 如图一(Figure 1)所示为一台倒置研究级显微镜,它配有四个相机接口,并可满足对培养的组织的研究。在四个接口上分别配有四个不同的相机,每一个都用来获取不同的图像。在大多数情况下,这种显微镜的分光设计是100%进入相机或以80:20的比例同时分配给相机和目镜。在弱光成像时,研究人员必需确保将最敏感的相机接在100%分光口上。在图一中,彩色CCD(Full color CCD)接在显微镜的底部(a),它从物镜接受的光信号不经过棱镜或反光镜的反射。这样的相机通常用来进行多色荧光或明场拍摄。显微镜右侧连接高效的电子倍增电荷偶联设备(Electron Multiplying Charge Coupled Device,EMCCD)(b),它通常用来检测极弱的荧光信号。接在显微镜左侧的相机(c)配有一个高量子效应的感应器,可以感应700-1000nm 波长范围内的光,所以这个相机可以用来进行微分干涉相称(differential interference contrast,DIC)观察方法下厚标本的红外线照明成像。最后,对于高分辨率的单色荧光成像,如全内反射荧光或其它荧光技术,图一中的显微镜在前部(d)
请问你曾经被IHC、ICC和IF所困扰过吗? 作者:北京义翘神州 在实验中,有没有一种感觉,就是对免疫组化(IHC),免疫细胞(ICC),以及免疫荧光(IF)傻傻分不清,那么今天我们就来讨论一下这三者的区别,先贴图上来以便有个大致的区分。 从图中我们可以看出,免疫检测技术可以根据报告标签的不同,分为免疫化学和免疫荧光两类,而根据样品类型不同,可以分为组织和细胞检测技术。因此,才会延伸出三个相近的概念。 为了更好的区分这三个概念,我们还可以根据他们的英文词根来分析一下,他们的英文名分别是免疫组织化学Immunohistochemistry (IHC),免疫细胞化学Immunocytochemistry (ICC),免疫荧光Immunofluorescence (IF)。 词根分析: Immuno-指的是免疫技术(例如,抗体和抗原的结合) Histo-指的是组织(细胞以及它周围的细胞外基质) Cyto-指的是细胞(不包含细胞外的基质) Chemistry-在这里指的是化学检测方法(例如,颜色的变化)
Fluorescence-对被激发的荧光团的检测 通过对词根的解释,相信你在心中不再迷茫了吧。 这三个应用技术都属于免疫技术,都是将抗原与抗体的结合可视化,即通过一定的方法可以直接看到实验结果。而常用的方法就是化学显色和荧光显色。如果报告标签是酶促的,就是免疫化学,如果是荧光的,就是免疫荧光。 其实我们纠结免疫荧光的一个原因还在于免疫荧光的英文名字Immunofluorescence (IF),但若是写成免疫组织荧光(IHF)或是免疫细胞荧光(ICF),那我们是不是就豁然开朗了。虽然这两个词汇在英文文献中应用的还不是很广泛,但绝对不是我自己杜撰的哦,已经有些学者在使用了,规范化应该也只是时间的问题。 可能文字描述还是有些晦涩难懂,那我们就直接上图吧。先不看下面答案,仅从几张图片,你能明白哪张图代表哪种应用吗? A免疫组织化学:兔EGFR单克隆抗体(10001-R043-50)—人胎盘
转化医学着眼于将生物医学基础研究和解决临床问题结合起来,将基础研究的成果转化为疾病预防、诊断、治疗及预后评估的新手段,已经逐步成为了医学界关注的热点之一。细胞水平的研究,是转化医学研究的重要方向,而一些创新性技术手段在细胞研究领域的应用,正加速转化医学研究在细胞水平的进展。活细胞成像和超高分辨率成像技术,作为细胞水平研究的重要手段,也为转化医学的发展注入了新的活力。通过活细胞成像技术,对细胞内的蛋白的表达、细胞器的运动等动态过程进行长期动态观察,可为疾病诊断、新药开发提供更多的线索。以下就对几个典型的活细胞成像应用于转化医学中的实例进行介绍: 自噬在黑色素瘤治疗中的研究 细胞内的基本上所有的细胞器都通过自噬途径得到降解。一些重要的疾病如阿兹海默综合征、动脉粥样硬化都伴随着自噬途径的缺陷,因此一些自噬途径的重要调控因子已经成为最近医学研究和药物开发的热点。 化合物polyinosine-polycytidylic acid可以诱导黑色素瘤细
胞内的自噬途径激活。在加入polyinosine-polycytidylic acid后,细胞内很短时间内就可以看到自噬体标记蛋白LC3在细胞内出现,并伴随着细胞的凋亡。(Targeted activation of innate immunity for therapeutic induction of autophagy and apoptosis in melanoma cells. Cancer Cell, 16, 103-114.) 特异性结核杆菌抗生素的研发 结合杆菌是造成肺结核的主要病原菌,开发低毒高特异性的抗生素是目前结核病防治的重要方向。 在对结核杆菌的繁殖进行连续观察检测的同时,在灌流培养基中中加入不同的化合物,从而监测不同化合物对结核杆菌的抑制作用,最终可以得到对结核杆菌有显著抑制作用的化合物并可进入下游的临床试验。(Simple model for testing drugs against nonreplicating Mycobacterium tuberculosis. Antimicrob Agents Chemother, 54, 4150-4158.)
Science:活细胞代谢成像新方法 0 25细胞S-腺苷甲硫氨酸成像图,随着每个时间点蛋氨酸(右下)的增加,荧光强度也增高 通过基因工程技术使得细胞表达一种经修饰(改造)过的RNA,又称Spinach,研究人员能对活细胞中的小分子代谢物进行成像,并观察它们随时间变化是如何改变的。每个细胞新陈代谢都会产生代谢产物。假如能得知产物生成效率的话,就能辨识如癌症状态下细胞代谢的异常或确定药物能否将细胞的代谢状况恢复到正常状态。 康奈尔大学威尔医学院的研究人员说发表在3月9日的《科学》杂志上的相关论文详细描述了这种先进的技术方法,这一技术将有可能彻底颠覆以往对代谢组学的认识,提供数千种细胞内代谢产物的动态变化的化学指纹图谱。 威尔康乃尔医学院药理学副教授Samie R. Jaffrey博士说:“动态观察到代谢产物的变化将为我们提供新的和强大的武器,方便我们了解代谢在疾病状态下是如何改变的,并帮助我们找到可以将它们恢复到正常水平的方法”。Jaffrey博士领导威尔康乃尔的其他三名研究人员共同完成了这项研究。他说:“细胞的代谢水平调控着细胞诸多功能,也正因为如此,代谢水平的变化可以是细胞内在特定的时间内发生什么变
化的写照”。 例如生物学家都知道,肿瘤细胞存在代谢异常,这些细胞对葡萄糖能源的利用存在异常并产生独特的代谢产物如乳酸,从而有不一样的新陈代谢过程。Jaffrey博士说:“能够看到这些代谢异常的话,就可以了解癌症的发生发展。但是到现在为止,测量活细胞中代谢产物一直非常困难。 Jaffrey博士和他的团队展开的科学研究表明:可以用特定的RNA序列来检测细胞中代谢产物的水平。这些RNAs是基于能在细胞发出绿色光的Spinach RNA设计的。Jaffrey博士研究小组修改Spinach的RNAs,使得它们一旦遇到它们专属绑定的代谢物时就关闭,造成Spinach荧光开启。他们设计出了RNA序列以追踪细胞中五个不同代谢产物包括二磷酸腺苷、细胞能量分子ATP和参与调节基因活性的甲基化过程的SAM(S-腺苷蛋氨酸)水平的变化。他说:“在此之前,一直没有人能够实时观察到细胞中代谢产物水平是如何变化的”。 Jaffrey博士说:“在活细胞中运用RNA传感器,研究人员能够测量单个细胞中的目标代谢产物水平随着时间的变化而 发生的改变,你可以看到这些代谢物如何响应信号刺激或遗传变化进而发生动态变化的。你可以筛选出能使得这些基因异常发生正常化的药物,我们的一个主要目标是确定药物是否能使细胞的新陈代谢正常化。
方法一: 1.首先需要把细胞养在玻璃片上(悬浮细胞需要用多聚赖氨酸包被过的玻璃片) 2.然后在4%PFA里面室温下固定30分钟,PBS洗两次,0.1% TX-100室温下作用1-2分钟 使细胞膜通透。 3.接下来进行荧光标记,需要在一个大的容器(面积大,扁平状的,比如大的培养皿)里面, 放一张用水打湿的滤纸,以保持湿度。 4.剪一片合适大小的parafilm,在上面滴上稀释在1%BSA/TBS中的一抗(稀释倍数依具体 抗体而定),每个玻璃片30ul足够,把玻璃片盖在上面(细胞面朝下),室温下孵育30分钟,然后在PBS里洗三次。 5.接下来二抗孵育步骤同上。 6.最后,在载玻片加上mounting medium(大约每个玻璃片加10ul),把玻璃片放上去(细 胞面朝下),37度30分钟,然后就可以在荧光显微镜下观察了。 7.抗体很重要,不能有非特异性结合。你可以先做WB检测一下你的抗体,看看有没有杂带。 8.双标的话,可以把两个一抗一起加或者分别标记两次(可以都试一下看看那种方法合适)。 如果一个抗体需要二抗,一个是直接荧光标记的,可以把荧光标记的那个和另外一个的二抗一起加。 方法二: 1.选取一抗时要来源于两种不同的动物,我用的是来源于rabbit和rat的抗体,二抗则是不 同荧光信号标记的,我用的是donkey anti-rabbit-FITC(绿)和donkey anti-rat-Tex-Red(红)。 2.我的做法是两种一抗同时孵育,然后两种二抗同时孵育。抗体浓度、孵育时间要仔细摸索, 我感觉一抗4度孵育过夜比较好,背景比较清晰。 3.我的阳性对照用的是阳性组织切片,阴性对照则分别是家兔和大鼠的IgG,荧光标记物对 照是PBS+荧光标记物。 4.封闭血清与二抗来源动物一致,我用的是10%的正常donkey血清。 5.其余步骤同一般免疫荧光单标操作。 方法三: 1.片子的制作:可以做细胞爬片,细胞甩片,还有直接在24well/12well/96well中直接染色 2.细胞爬片的制作:直接购买公司的已经处理过的细胞爬片,要是自己制作的话,就用无菌 的盖玻片用多聚赖氨酸处理后让细胞自己爬片
细胞免疫荧光实验步骤 细胞免疫荧光实验步骤 简单实验步骤如下: 1.漂洗血清蛋白H7.2-7.4 37度 PBS 2小时. 2.-20度甲醇固定20分钟后,自然、干燥 10分钟 3.PBS洗净:3min*3 4.1%Triton:25min-30min.配成50ultriton+5mlpBS 5.PBS洗净:2*5min 6.羊血清封闭:37度,20分钟 7.一抗,4度过夜,一般要大于18小时或者37度1-2小时 8.4度PBS洗净,3min*5次 9.二抗37度小于一小时 10.37度PBS洗净,3*5min 凉干封片(封闭液PH8.5) 活细胞免疫荧光技术-流式细胞仪标本的制备 (一)制备活性高的细胞悬液(培养细胞系、外周血单个核细胞、 胸腺细胞、脾细胞等均可用于本法) ↓ 用10%FCS RPMI1640调整细胞浓度为 5×106~1×107/ml ↓ 取40μl细胞悬液加入预先有特异性McAb(5~50μl) 的小玻璃管或塑料离心管,再加50μl 1∶20(用DPBS 稀释)灭活正常兔血清 ↓4℃ 30min 用洗涤液洗涤2次,每次加洗涤液2ml左右 1000rpm×5min
↓ 弃上清,加入50μl工作浓度的羊抗鼠 (或兔抗鼠)荧光标记物,充分振摇 ↓4℃ 30min 用洗涤液洗涤2次,每次加液2ml左右 1000rpm×5min ↓ 加适量固定液(如为FCM制备标本,一般加入 1ml固定液,如制片后在荧光显微镜下观察, 视细胞浓度加入100~500μl固定液) ↓ FCM检测或制片后荧光显微镜下观察 (标本在试管中可保存5~7天) (二)试剂和器材 1. 各种特异性单克隆抗体。 2. 荧光标记的羊抗鼠或兔抗鼠第二抗体,灭活正常兔血清。 3. 10% FCS RPMI1640, DPBS、洗涤液、固定液(见附录)。 4. 玻璃管、塑料管、离心机、荧光显微镜等。 (三)注意事项 1. 整个操作在4℃下进行,洗涤液中加有比常规防腐剂量高10倍的NaN 3,上述实验条件是防止一抗结合细胞膜抗原后发生交联、脱落。 2. 洗涤要充分,以避免游离抗体封闭二抗与细胞膜上一抗相结合,出现假阴性。 3. 加适量正常兔血清可封闭某些细胞表面免疫球蛋白Fc受体,降低和防止非特异性染色。 4. 细胞活性要好,否则易发生非特异性荧光染色。 附: 1. DPBS (×10, 贮存液)
荧光共振能量转移(FRET)影像系统
Olympus(北京)销售服务有限公司上海分公司
PDF created with pdfFactory Pro trial version https://www.doczj.com/doc/683027495.html,
荧光共振能量转移(FRET)影像系统
一、研究目的
随着生命科学研究的不断深入, 光学显微镜使我们理解了细胞结构和有关功能。 但是分子 生物学研究已经显示了分子事件,例如信号传导和基因翻译,需要蛋白质的装配成特殊的大 分子复合体等。对各种生命现象发生的机制,特别是对细胞内蛋白质间相互作用的研究变得尤 为重要。 传统的生物物理或生物化学方法例如亲和色谱法或免疫沉淀反应法和近来的酵母双杂 交、磷酸化抗体、免疫荧光、放射性标记等方法等,都需要破碎细胞或对细胞造成损伤,无 法做到在活细胞生理条件下实时地对细胞内蛋白质-蛋白质间相互作用进行动态研究。 而基于强度的影像技术FRET方法,使得研究活细胞内的这些相互作用变得容易了,荧光 共振能量转移( FRET)是用于对生物大分子之间相互作用定性、定量检测的一种有效方法。根 据所基于的荧光显微镜配置不同而有不同的应用侧重,可在多细胞,单细胞,细胞膜,细胞 器等不同层次对生物大分子间的相互作用距离,动力学特性等进行研究。
二、FRET的原理和实现方法
FRET的原理和发生的基本条件:
1. 2. 3. 4. 发色团之间的距离在10A到100A 。 供体D的荧光光谱和受体A的吸收光谱足够多的重叠。 供体D的量子产率和受体A的吸收系数足够大。 D和A的跃迁偶极矩有最佳的相对取向,或者两者之一有一定的快速旋转的自由度。
FRET的实现方法:
1) 稳态方法(基于供体、受体的三通道计算校准) 供体荧光的减弱-主要的方法 受体荧光的增强 激发光谱和吸收光谱的比较 2) 3) 光漂白方法 (Pb-FRET) 时间分辨方法(TR-FRET) 供体荧光的衰减 受体荧光的增长
PDF created with pdfFactory Pro trial version https://www.doczj.com/doc/683027495.html,
免疫组化与免疫荧光 一、两者都是蛋白定位的检测(也就是确定蛋白是表达在细胞核/浆/膜)。 二、区别是: 1、概念和基本原理 免疫组织化学又称免疫细胞化学,是指带显色剂标记的特异性抗体在组织细胞原位通过抗原抗体反应和组织化学的呈色反应,对相应抗原进行定性、定位、定量测定的一项新技术。它把免疫反应的特异性、组织化学的可见性巧妙地结合起来,借助显微镜的现像和放大作用,在细胞,亚细胞水平检测各种抗原物质,并可在原位显示相应的基因和基因表达产物。免疫组织化学技术现已有:免疫荧光组织(细胞)化学技术、免疫酶组织(细胞)化学技术、亲和组织化学技术、免疫金银及铁标记免疫组织化学技术等。 免疫荧光组织(细胞)化学技术是采用荧光素标记的已知抗体(或抗原)作为探针,检测待测组织、细胞标本中的靶抗原(或抗体),形成的抗原抗体复合物上带有荧光素,在荧光显微镜下,由于受高压汞灯光源的紫外光照射,荧光素发出明亮的荧光,这样就可以分辨出抗原(或抗体)的所在位置及其性质,并可利用荧光定量技术计算抗原的含量。以达到对抗原物质定位、定性、定量测定的目的。 2、标本制作: 免疫荧光一般用冰冻切片,减少杂质干扰;而酶免疫组化一般用石蜡切片或冰冻切片均可以。 3、实验步骤:免疫荧光染色步骤简单,而酶免疫组化方法较为复杂,多了DAB显色过程。 4、染色后的标本保存:免疫荧光染色后的标本一般短时间拍照,时间长了荧光衰退;而酶免疫组化染色标本可以长期保存。 5、免疫组化结果除了知道蛋白是在细胞浆还是细胞膜表达高些,还可以用软件做相对定量分析。 6、免疫荧光得到的图片是彩色的,漂亮些,可以发高档次文章。 免疫学三大工具:免疫组化、Western、ELISA,分别用于定位,定性和定量。
激光全息细胞成像及分析系统应用 细胞活力 激光全息细胞成像及分析系统可以实时监测细胞死亡过程,以及通过图像进行记录。全息技术再不需要荧光标记的情况下可以得到细胞形态学数据。Khmaladze A. et al(2012和Pavillion N. et al(2012使用DHM 研究细胞死亡过程,观察到死亡过程中细胞体积显著减小。Kuhn et al(2013使用DHM 研究活/死细胞特点时得到实验结果和和基于荧光标记方法结果相一致。他们使用PI 和Hoechst 标记细胞。染料法鉴定细胞死活是目前常见的鉴定方法,其中台盼蓝染色方法最常见。台盼蓝可穿透变性的细胞膜,与解体的DNA 结合,使其着色,而活细胞能阻止染料进入细胞内,故可以鉴别死细胞与活细胞。鼠成纤维细胞L929接种在μ-slide(Ibidi,Germany 上,肿瘤药物依托泊苷etoposide(100μM处理细胞,使用激光全息细胞分析系统(M3 分析细胞的死亡,并与台盼蓝染色法进行比较。图1中左图为台盼蓝染色结果,右图为全息结果,细胞越白,细胞越厚。死细胞是圆的,薄的。两种方法得到的结果是 一样的。
图1
图2细胞厚度VS 细胞体积,死亡细胞集中在绿色区域 细胞凋亡 细胞死亡起码有两种方式,即细胞坏死(necrosis)与细胞凋亡(apoptosis。细胞坏死是细胞受到强烈理化或生物因素作用引起细胞无序变化的死亡过程。表现为细胞胀大,胞膜破裂,细胞内容物外溢,核 变化较慢,DNA 降解不充分,引起局部严重的炎症反应。细胞凋亡是指为维持内环境稳定,由基因控制的细胞自主的有序的死亡。在这两种过程中,细胞体积都会减少,形态学都会发生变化。 前列腺癌细胞DU145和小鼠成纤维细胞L929分别接种在IBIDI-micro slides (IBIDI)上,接种24h 后,50μM依托泊苷(etoposide 处理细胞,HoloMonitor M3分析细胞死亡过程。
细胞迁移/侵袭实验分析 ——LumaScope活细胞成像系统 细胞迁移实验是普遍应用于评价损伤修复、贴壁肿瘤细胞转移或血管再生等的典型实验。传统方法是应用无菌枪头(Tip)在细胞培养容器上划痕来实现。但是此种方法无法实现在不同孔中划出同样大小的划痕。Oris TM迁移/侵袭试剂盒能够提供更加精确的方法,在培养容器中生成一个圆形区域。这种方法同样适用于观察不同方向的细胞迁移。LumaScope活细胞成像系统具备传统显微镜的功能,可应用于细胞或组织培养实验室的日常细胞观察。如细胞状态实时检测、远程传送和监控、细胞计数、形态观察、染色观察等。LumaScope可放置于培养箱中实现细胞的长时间的连续成像和定点监测。这种应用大大提高了实验过程检测的便捷性和结果的准确性。 本文将描述如何结合LumaScope与Oris TM迁移/侵袭试剂盒来实现细胞迁移/侵袭实验。实验结果可通过Image J软件来进行分析,最终得到细胞迁移的数量和速度数据。 细胞迁移分析: Day 1:am 9:00插入Stoppers,接种细胞; pm 4:00(根据细胞贴附状况),拔除stoppers,PBS洗一遍后加入新鲜培养液。Day 2:根据要观察的时间点设置LumaScope成像参数进行成像,并进行量化分析。 细胞侵袭分析: Day 1:am 9:00包被薄层BME(用无血清培养液制备),插入stoppers,接种细胞; pm 4:00 (根据细胞状况),拔除stoppers,包被厚层BME(含血清生长因子),再在第二层gel上面加上一层无血清培养液 Day 2:根据要观察的时间点设置LumaScope成像参数进行成像,并进行量化。
IncuCyte:非标记的、长时间动态活细胞成像分析仪 典奥生物 目前,大部分的细胞检测方法采用的仍然是传统的终点法——仅仅给出最终结果,而且往往需要标记细胞和破坏细胞。这种方法无法得到细胞在生长时的真正状态,也无法对细胞的生长过程做出动态的监测和分析。美国Essen公司开发了一款非标记的、长时间动态活细胞成像分析仪——IncuCyte,用一种非侵入式的方法,记录细胞的实时生长状态。 IncuCyte是一套用于长时间动态,非伤害式的活细胞成像分析平台。IncuCyte分为信号采集机和控制机两部分,信号采集机可放置于培养箱中,中间放置多种规格尺寸的板、皿、瓶及载玻片,在其下方有显微照相设备,通过显微拍照,对培养细胞进行连续的监测,并通过连接电脑和网络进行远程控制、数据读取与分析。系统可自动集中每个时间点的图像并自动生成动态录像(live video)。用户除了可以得到各种格式的图像或动态录像外,还可以得到由系统软件自动依据饱和度和计数分析生成的基于图像应用的图表,以显示细胞的变化及趋势。IncuCyte FLR可采集相差图像和荧光图像,可显示GFP,YFP和荧光素等;IncuCyte EX可以与自动化的平板和液体处理系统整合。它们都进行了光学组件的优化,成像清晰,无传统的光晕问题。 图1:培养箱中的IncuCyte IncuCyte的优势:1)培养的细胞用相位差显微镜或荧光显微镜直接监测,为非破坏性的监测,细胞不用染色便可以观察监测,影像效果好;2)监测过程中细胞无需离开培养箱,不用担心培养条件的改变对细胞的影响;3)真正的长时间的动态活细胞成像,可达数天或数月,且没有传统显微系统的光晕问题,可以在384微孔板内监测细胞形态;4)图像处理软件自动依据饱和度和计数分析,量化细胞增殖;5)自动输出细胞生长曲线和细胞生长录像;6)通量大,可同时监测6块标准规格的细胞培养板/皿/瓶,细胞在384微孔板内实验,可以减少宝贵的药品消耗;7)支持超过200种的标准培养容器,无需特殊的培养容器,节约后期实验成本;8)可远程监控,进行数据读取和分析,无需反复出入细胞房,避免了潜在的污染隐患及人工出入观测之麻烦。
方法一: 1. 首先需要把细胞养在玻璃片上(悬浮细胞需要用多聚赖氨酸包被过的玻璃片) 2. 然后在 4%PFA 里面室温下固定 30 分钟, PBS 洗两次, 0.1% TX-100 室温下作用 1-2 分钟使细 胞膜通透。 3. 接下来进行荧光标记,需要在一个大的容器(面积大,扁平状的,比如大的培养皿)里面,放一 张用水打湿的滤纸,以保持湿度。 4. 剪一片合适大小的parafilm ,在上面滴上稀释在1%BSA/TBS 中的一抗(稀释倍数依具体抗体而定), 每个玻璃片 30ul 足够,把玻璃片盖在上面(细胞面朝下),室温下孵育 30 分钟,然后在 PBS 里洗三次。 5. 接下来二抗孵育步骤同上。 6. 最后,在载玻片加上mounting medium (大约每个玻璃片加10ul),把玻璃片放上去(细 胞面朝下), 37 度 30 分钟,然后就可以在荧光显微镜下观察了。 7. 抗体很重要,不能有非特异性结合。你可以先做 WB 检测一下你的抗体,看看有没有杂带。 8. 双标的话,可以把两个一抗一起加或者分别标记两次(可以都试一下看看那种方法合适)。如果一 个抗体需要二抗,一个是直接荧光标记的,可以把荧光标记的那个和另外一个的二抗一起加。 方法二: 1. 选取一抗时要来源于两种不同的动物,我用的是来源于rabbit 和 rat 的抗体,二抗则是不 同荧光信号标记的,我用的是donkey anti-rabbit-FITC (绿)和donkey anti-rat-Tex-Red (红)。 2. 我的做法是两种一抗同时孵育,然后两种二抗同时孵育。抗体浓度、孵育时间要仔细摸索,我感觉 一抗 4 度孵育过夜比较好,背景比较清晰。 3. 我的阳性对照用的是阳性组织切片,阴性对照则分别是家兔和大鼠的IgG,荧光标记物对 照是PBS+荧光标记物。 4. 封闭血清与二抗来源动物一致,我用的是10%的正常 donkey 血清。 5. 其余步骤同一般免疫荧光单标操作。 方法三: 1. 片子的制作:可以做细胞爬片,细胞甩片,还有直接在24well/12well/96well 中直接染色 2. 细胞爬片的制作:直接购买公司的已经处理过的细胞爬片,要是自己制作的话,就用无菌 的盖玻片用多聚赖氨酸处理后让细胞自己爬片 3. 细胞甩片:需要甩片机将细胞悬液均匀甩到玻片上。 4. 其实小的 well 的话,可以直接拿来染色,没问题的。 5?固定:用PBS洗去培养液,用固定液(如甲醇和丙酮;4%多聚甲醛;酒精。。。)固定细胞。
免疫荧光通用操作规程 冰冻切片的免疫荧光 1,动物组织直接OCT包埋,或灌流后的组织30%蔗糖溶液4℃过夜后,OCT包埋。-20℃保存3月,-80℃长期保存。请勿保存于液氮。2,冰冻切片机切片至少10um,空气干燥2分钟后,-20℃储存 3,切片从-20取出后,在通风橱放10-30分钟以去除水汽,4%PFA 固定15分钟,或-20℃丙酮固定15分钟置通风橱2小时 4, 1XPBS清洗玻片,3X5min 从此请保持玻片湿润 5,有时,抗原修复3小时会得到更好的结果。为此请:选用稳定的抗原修复方式(真空负压.微波修复.高压修复.隔水加热.电炉加热)…关注修复的温度,时间(抗原修复时在有效的温度范围内所持续的时间),抗原修复液必须遵循自然降温规律,使用足量的抗原修复液…选择不同PH值的修复液(A液枸盐酸缓冲液PH6.0,B液EDTA-Na缓冲液PH8.0,C液枸盐酸缓冲液PH4.5) 6,室温封闭1小时 封闭液:5%BSA+10%二抗种属来源的正常血清in 1xPBS 条件封闭液:1%BSA+3%二抗种属来源的正常血清in 1xPBS(细胞因子,无需封闭的蛋白
7,一抗4℃过夜 请用封闭液稀释一抗 8, 第二天Wash,1XPBS, 2x1min 9,二抗,1:1000 (alexa系列)1:300(dyelight )in封闭液,避光室温1小时 10, Wash,1XPBS, 3x5min 11, DAPI 染核5min, 12,DDW Rinse 13,抗淬灭剂封片,(避免气泡)避光置于通风橱过夜 14,干片后4℃保存 石蜡切片的免疫荧光 1,动物组织取出后经固定-脱水-包埋(见随后操作步骤),制成石蜡包块 2,组织学染色切片厚度2um,免疫荧光染色切片厚度至少6um,切片复水:58℃20min- xylene 2x10min- 100%EtoH2x10min 95%EtoH2x10min- 70%EtoH10min-,DDW5min
TILL 活细胞实时成像显微系统 TILL Photonics是一家从事活细胞实时成像显微系统产品的生产厂商。TILL Photonics 总部位于德国慕尼黑, 其创始人Rainer Uhl 博士发明了世界上第一台单色光镜显微镜光源(polychrome Ⅰ),并一直致力于多种先进的显微技术产品的研发和改进。 TILL Photonics 最早从事专业的显微镜光源生产,为著名显微镜生产商Zeiss 和Leica 配置显微镜光源。随着公司的发展和技术的革新,TILL有了自己的显微镜产品,并发展成为拥有多项专利和先进的显微成像技术的高科技企业。 TILL 活细胞实时成像显微成像系统 高分辨率荧光成像系统不仅仅意味着一台荧光显微镜。先进的显微成像技术需要一系列的配套仪器:高敏感度相机,高速切换的光源,甚至需要不同激光光源和其他设备。 德国TILL“All for One”数码显微成像系统iMIC system,是市面上最快速,精准的科学控制平台,拥有模块化的设计和微秒级实时控制ICU控制中心,实现荧光成像、拍摄及数据传输的同步获得,成为真正的实时成像显微系统。 独家开发的应用软件能完美控制荧光成像和光源切换,使其两者能够完美配合。 I MIC系统具有高度灵活性,特有 的Polytrope装置,可根据客户要要量身定制显微镜的配置,允许每个组件的升级,可同时满足FRET,FRAP,TIRF,SI等多种显微成像实验的需要。
基于iMIC可实现的技术 荧光显微镜技术:高分辨率, 精确到分子级别的显微镜。 两种荧光光源可供选配:Polychrome V 连续波长光源、Oligochrome快速切换的光源。 FRET:荧光共振能量转移技术是用于对生物大分子之间相互作用定性、定量检测的一种有效方法。TILL 显微镜系统通过添加Dichrotome 这一组件实现特殊光路模式,并配有双CCD相机来实现同时对两种荧光染料成像的显微成像技术。
免疫荧光染色大全(精华版) 组织免疫荧光法 (1)将待染组织切片置于65摄氏度恒温箱烤片1h,脱蜡 (2)1×PBS 洗涤 3 次,每次 5min。 (3)0.5%Triton X-100(PBS 配制)室温通透 10min (4)1×PBS 洗涤 3 次,每次 5min。 注意:步骤(3)和(4)用于检测细胞核抗原,细胞膜抗原直接跳过此步骤(5)抗原修复:使用柠檬酸盐缓冲液进行抗原修复,微波炉微波高火3min,后转成低火 15min。 (6)1×PBS 洗涤 3 次,每次 5min。 (7)3% H2O2,室温孵育30min,目的是灭活内源性过氧化物酶。 (8)1×PBS 洗涤 3 次,每次 5min。 (9)使用1% BSA进行室温封闭 30min,用于封闭非特异性抗原表位。 (10)按抗体推荐使用说明书孵育特异性一抗,4°C 湿盒中静置过夜。(11)次日取出切片,室温下复温 30min。 (12)1×PBS 洗涤 3 次,每次 5min。 (13)选取相应的免疫荧光二抗滴加于血管组织上,37°C避光孵育30min。(14)1×PBS洗涤 3 次,每次 5min。 (15)避光条件下,DAPI 染液染细胞核,浓度和时间根据试剂说明书使用(16)1×PBS洗涤 3 次,每次5min。 (17)在血管组织上滴加抗荧光淬灭剂进行封片。 (18)使用荧光显微镜进行观察拍照。 贴壁细胞免疫荧光法 (1)在培养板中接种的带染色的细胞爬片用PBS泡洗3次×3min (2)4%多聚甲醛固定细胞爬片15min (3)1×PBS洗涤 3 次,每次5min。 (4)0.5%Triton X-100(PBS配制)室温通透10min (5)1×PBS洗涤 3 次,每次5min。 (6)1%BSA室温封闭30min (7)弃掉封闭液,细胞爬片滴加适量稀释至适当比例的一抗,4℃孵育过夜(8)1×PBS洗涤 3 次,每次5min。 (9)细胞爬片滴加稀释至适当比例的荧光二抗 (10)1×PBS洗涤 3 次,每次5min。 (11)DAPI染细胞核,浓度和时间根据试剂说明书使用 (12)1×PBS洗涤 3 次,每次5min。 (13)用抗荧光淬灭剂封片 (14)荧光显微镜下观察采集图像 细胞免疫荧光(悬浮细胞方法一) (1)收集悬浮细胞,细胞在冰浴中冷却,然后用台式离心机于4℃以800 g 离心5 min,吸去培养液并以4℃ 1×PBS重悬细胞。