
循环伏安法测定亚铁氰化钾的电极反应过程
实验目的
(1) 学习固体电极表面的处理方法; (2) 掌握循环伏安仪的使用技术;
(3) 了解扫描速率和浓度对循环伏安图的影响
实验原理
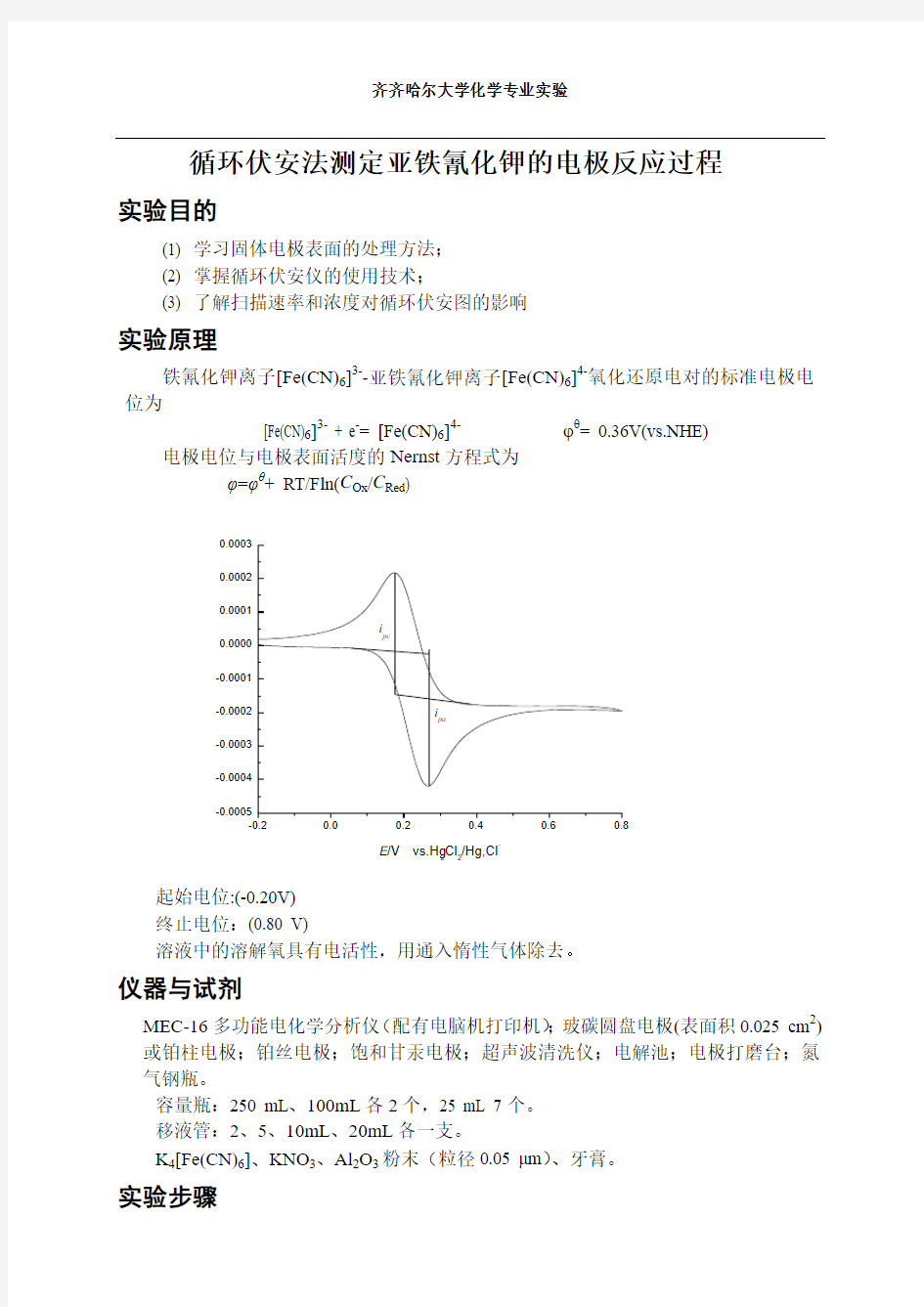
铁氰化钾离子[Fe(CN)6]3--亚铁氰化钾离子[Fe(CN)6]4-氧化还原电对的标准电极电位为
[Fe(CN)6]3- + e -= [Fe(CN)6]4- φθ= 0.36V(vs.NHE) 电极电位与电极表面活度的Nernst 方程式为 φ=φθ+ RT/Fln(C Ox /C Red )
-0.2
0.00.20.4
0.60.8
-0.0005
-0.0004-0.0003-0.0002-0.00010.0000
0.00010.00020.0003i pa
i pc
I /m A
E /V vs.Hg 2Cl 2/Hg,Cl
-
起始电位:(-0.20V) 终止电位:(0.80 V)
溶液中的溶解氧具有电活性,用通入惰性气体除去。
仪器与试剂
MEC-16多功能电化学分析仪(配有电脑机打印机);玻碳圆盘电极(表面积0.025 cm 2)或铂柱电极;铂丝电极;饱和甘汞电极;超声波清洗仪;电解池;电极打磨台;氮气钢瓶。
容量瓶:250 mL 、100mL 各2个,25 mL 7个。 移液管:2、5、10mL 、20mL 各一支。
K 4[Fe(CN)6]、KNO 3、Al 2O 3粉末(粒径0.05 μm )、牙膏。
实验步骤
1、指示电极的预处理
玻碳圆盘电极:用牙膏将电极表面抛光,然后在蒸馏水中超声波清洗,再用蒸馏水清洗,待用。
铂柱电极用金相砂纸细心打磨,超声波超声清洗,蒸馏水冲洗备用。 2、溶液的配制
配制0.20 mol/L KNO 3溶液250mL ,再用此溶液配制0.10 mol/L 的 K 4[Fe(CN)6]溶液100mL 备用。
3、支持电解质的循环伏安图 在电解池中,放入25mL 0.2 mol·L -1 KNO 3溶液,插入电极,以新处理的铂电极为工作电极,铂丝电极为辅助电极,饱和甘汞电极为参比电极,进行循环伏安仪设定,扫描速率为100mV/s ;起始电位为-0.20V ,终止电位为0.80V 。开始循环伏安扫描,记录循环伏安图。
4、K 4 [Fe(CN)6]溶液的循环伏安图
在-0.20至0.80V 电位范围内,以60 mV/s 的扫描速度分别作0.01 mol·L -1、0.02 mol·L -1、0.04 mol·L -1、0.06 mol·L -1、0.08 mol·L-1的K 4 [Fe(CN)6]溶液(均含支持电解质KNO 3浓度为0.20mol·L -1)循环伏安图。
5、不同扫描速率K 4 [Fe(CN)6]溶液的循环伏安图 在0.04 mol·L -1 K 4 [Fe(CN)6]溶液中,以10mV/s 、20 mV/s 、60 mV/s 、100 mV/s 、150 mV/s 、200 mV/s ,在-0.20至0.80V 电位范围内扫描,分别记录循环伏安图。
数据处理
1、从 K 4[Fe(CN)6]溶液的循环伏安图,测量i pa 、i pc 、pa ?和pc ?值。
2、分别以i pa 和i pc 对K 4[Fe(CN)6]溶液浓度c 作图,说明峰电流与浓度的关系。
3、分别以i pa 和i pc 对12
υ作图,说明峰电流与扫描速率间的关系;计算玻璃碳圆盘电极
的表面积。
4、计算i pa /i pc 值、?? 值;说明K 4[Fe(CN)6]在溶液中的电极过程的可逆性。
注意事项
1. 实验前电极表面要处理干净。
2. 扫描过程保持溶液静止。
思考题
1. K 3[Fe(CN)6与K 4[Fe(CN) 6溶液的循化伏安图是否相同?为什么?
2. 如何说明K 4[Fe(CN)6]在溶液中的电极过程的可逆性?
3. 若实验中测得的条件电位值和1/2?值与文献值有差异,试说明其原因。
实验4-1 不同浓度的K 4 [Fe(CN)6 ]溶液循环伏安图0.0601
V s -?
实验4-2 不同速率扫描K
·)
亚铁氰化钾的测定方法公司标准化编码 [QQX96QT-XQQB89Q8-NQQJ6Q8-MQM9N]
亚铁氰化钾的测定方法 1.亚铁氰化钾标准溶液:称取亚铁氰化钾0.1993g,精确到0.0001 g。加少量水溶解,定容至1 OOmL o(此时亚铁氰根的浓度为1g/L)。吸取该溶液l OmL,定容至100mL,即制得亚铁氰化钾标准工作液(1 OOmg/L )。 2. 40g/L的硫酸亚铁溶液:称取40g七水硫酸亚铁,溶解于1L水中(40g/L ) o 3. 0.001 mol/L的氢氧化钠溶液:称取0.0400g的氢氧化钠溶解到1L水中。 4. 0.0001 mol/L的氢氧化钠溶液:吸取上述溶液1 OmL溶解到1 OOmL水中。 5. 1: 10的盐酸溶液:l OmL的盐酸溶解到1 OOmL的水中。 6. 1: 100的盐酸溶液:吸取上述溶液l OmL溶解到1 OOmL的水中。 7. 5g/L的碳酸钾溶液:称取O.5g碳酸钾溶解于100mL容量瓶中,定容,摇匀。 8.5g/L的碳酸氢钾溶液:称取O.5g碳酸氢钾溶解于1 OOmL容量瓶中,定容,摇匀。 9. 5g/L的氰化钾溶液:称取O.5g氰化钾溶解于1 OOmL容量瓶中,定容,摇匀。 10. 5g/L的硫氰化钾溶液:称取O.5g硫氰化钾溶解于1 OOmL容量瓶中,定容,摇匀。 11. 5g/L的硫代硫酸钠溶液:称取O.5g硫代硫酸钠溶解于1 OOmL容量瓶中,定容,摇匀。 12. 5g/L的亚硫酸钠溶液:称取O.5g亚硫酸钠溶解于100mL容量瓶中,定容,摇匀。 标准曲线的绘制: 取6个100mL烧杯,分别编号为1号,2号,3号,4号,5号,b号。分别吸取亚铁氰化钾标准溶液1mL, 3mL, 5mL, 7mL, 9mL, 11mL到1号至6号烧杯中, 均加入4mL硫酸亚铁溶液。(亚铁氰化钾浓度分别为2mg/L, 6mg/L, l0mg/L 14mg/L, 18mg/L和22mg/L)。再均加入去离子水30mL。用1:100的HCL和 0.001 mol/L的NaOH溶液调节溶液pH至1-2。将这6个烧杯中的溶液转移至6个 50mL的容量瓶中,编号1号至6号。再用去离子水定容,摇匀,显色30min。用1 cm比色皿,空白溶液为参比,在760nm处测量1号至6号溶液吸光度。然后以吸光度为纵坐标,亚铁氰化钾浓度为横坐标,绘制标准工作曲线。
直接电位法—用氟离子选择电极测定水中氟 一、实验目的:掌握用离子选择电极测定微量离子的原理和实验方法。 二、实验原理: 氟离子选择电极由氟化镧单晶膜制成,其电极电位F ? 与F ―浓度之间的关系符合Nernst 方程: --=F lga F 2.303RT K F ? 它与参比电极(SCE, 接正极)一起插入含F ―试液组成电池,当控制试液的离子强度保持恒定时,其电池的电动势可表示为: -?+-=-=F C lg F 2.303RT γ???K E SCE F SCE 即: E = K′ + S lg C F 式中K′与SCE ?、内?(内参比电极的电位)、不?(膜不对称电位)、液?(液接电位)、 活度系数γ有关,在一定条件下是常数。S 为斜率。它与温度。离子选择电极性质有关,理论值是F 2.303RT 。一定温度下,每只电极有其固定的S 值。所以电动势E 与F ―浓度的对数lg C F 成直线关系,这就是用氟离子选择电极(直接电位法)测定F ―的理论依据。 ① 选择性 阴离子: : OH- LaF 3 + 3OH - = La(OH)3↓ + 3F - 阳离子: Fe 3+、Al 3+、Sn(Ⅳ) ( 易与F -形成稳定配位离子) ② 支持电解质------控制试液的离子强度。 ③ 总离子强度调节缓冲液-----控制试液pH 和离子强度以及消除干扰。 三、实验仪器及药品 pHS –2型酸度计、氟离子选择性电极、饱和甘汞电极、电磁搅拌器 100 mg·L -1 F -的标准贮备液、总离子强度缓冲溶液(TISAB )。 四、实验步骤: 1. 溶液配制
(1) 标准系列的配置:用吸量管分别移取10 mg·L -1的氟标准溶液1.00、2.00、4.00、6.00、8.00、10.00于六支50 mL 的容量瓶中,各加入TISAB 液10 mL, 用去离子水稀释至刻度,摇匀,即得氟离子浓度相应为0.20、0.40、0.80、 1.20、1.60、 2.00 mg·L -1的标准系列。 (2) 水样的稀释处理:移取含氟离子量﹤4 mg·L -1的水样10 mL 于100 mL 容量瓶中,加入TISAB 溶液20 mL ,用去离子水稀释至刻度,摇匀。 2. 清洗电极 将氟电极接仪器负极接线柱,甘汞电极接仪器正极接线柱。将两电极插入蒸馏水中,开动搅拌器,搅洗电极几分钟,使电位小于-200 mV ,若读数大于-200mV ,则更换蒸馏水,如此反复几次即可达到电极的空白值。若仍不能使电位小于-200 mV ,可用金相砂轻轻擦拭氟电极,继续清洗至-200 mV 。 3. 标准曲线的测绘 将配置好的标准系列溶液由稀到浓依次倒入100 mL 塑料烧杯中,放入搅拌棒,插入清洗合格的电极(用滤纸吸去水滴),搅拌2分钟,停止15s 读其静态下的稳定电位值。照此测量、记录各标准溶液的电位值。每次更换时,都必须用滤纸吸干电极上附着的溶液,并且用少量待测溶液润洗烧杯。 4. 水样的测定 重新用去离子水清洗电极。 移取稀释处理后的水样50 mL 于干净的150 mL 的烧杯中,按照上述“3”的方法测量、记录水样的电位值(E )。然后,没加入100 mg·L -1的氟标准溶液0.5 mL 就测量、记录一次电位值,连续标加5次,记录各累加体积及其相应的电位值(E 1、E 2、…、E 5)。 五、数据处理 1. 绘制标准曲线,在半对数坐标纸上以E 对C F 作图(或在方格纸上以E 对lg C F 作图)绘制标准曲线。根据所测水样的电位值从标准曲线上查出被测试液F -浓度(C F ),计算出试样中氟含量。 2. 用标准加入法算出原水样的氟离子浓度。 S x V V )1(10C C S E S F -=?-
第十三章电化学分析法 一、选择题 1. 下列( )不是玻璃电极的组成部分。 A.Ag-AgCl 电极 B.一定浓度的HCl 溶液 C.饱和KCl溶液 D .玻璃管 2.测定溶液PH值时,所用的指示电极是: ( ) A.氢电极 B.铂电极 C.氢醌电极 D.玻璃电极 3.测定溶液PH时,所用的参比电极是: ( ) A.饱和甘汞电极 B.银-氯化银电极 C.玻璃电极 D.铂电极 4.在电位滴定中,以△E/△V为纵坐标,标准溶液的平均体积V为横坐标,绘制△E/△V~ V曲线, 滴定终点为:( ) A.曲线的最高点 B. 曲线的转折点 C.曲线的斜率为零时的点 D. △E/△V=0对应的 5.在电位法中离子选择性电极的电位应与待测离子的浓度() A.成正比 B.的对数成正比 C.复合扩散电流公式 D. 符合能斯特方程式 6.玻璃电极使用前一定要在水中浸泡24h以上, 其目的是( ) A.清洗电极 B.活化电极C.校正电极 D.检查电极好坏 7.25℃时, 标准溶液与待测溶液的pH值变化一个单位,电池电动势的变化为( ) A.0.058V B.58V C.0.059V D.59V 8.pH玻璃电极膜电位的产生是因为( ) A.电子得失 B. H+穿过玻璃膜C.H+被还原 D. 溶液中H+和玻璃膜水合层中的H+的交换作用 9.在离子选择性电极分析法中,( )说法不正确。 A. 参比电极电位恒定不变 B.待测离子价数愈高,测定误差愈大 C.指示电极电位与待测离子浓度呈能斯特响应 D.电池电动势与待测离子浓度成线性关系。 10.电位滴定与容量滴定的根本区别在于()。 A.滴定仪器不同 B.指示终点的方法不同
实验报告 实验课程:仪器分析 学生姓名:崔清玥 学号:41307209 专业班级:化学(创新)1301 实验名称:循环伏安法测定亚铁氰化钾
i —E 曲线 一、实验目的 1、学习固体电极表面的处理方法。 2、掌握循环伏安仪的使用技术。 3、了解扫描速率和浓度对循环伏安图的影响。 二、实验原理 铁氰化钾离子-亚铁氰化钾离子氧化还原电对的标准电极电位 电极电位与电极表面活度的Nernst 方程 峰电流与电极表面活度的Cotroll 方程 其中:i p 为峰电流;n 为电子转移数;D 为扩散系数;v 为电压扫描速度;A 为电极面积;c 为被测物质浓度。 从循环伏安图可获得氧化峰电流i pa 与还原峰电流i pc ,氧化峰电位ψpa 与还原峰电位ψpc 。 对于可逆体系,氧化峰电流i pa 与还原峰电流i pc 绝对值的比值。 i pa /i pc =1 氧化峰电位ψpa 与还原峰电位差ψpc : △ψ=ψpa -ψpc =2.2RT/nf≈0.058/n(V) 条件电位ψθ′ : ψθ′=(ψpa +ψpc )/2 在一定扫描速率下,从起始电位(-0.2 V )正向扫描到转折电位(+0.8 V )期间,溶液中 [Fe(CN)6]4-被氧化生成[Fe(CN)6]3-,产生氧化电流;当负向扫描从转折电位(+0.8 V )变到 原起始电位(-0.2 V )期间,在指示电极表面生成的[Fe(CN)6]3- 被还原生成[Fe(CN)6]4- ,产生还原电流。 为了使液相传质过程只受扩散控制,应在加入电解质和溶液处于静止下进行电解。实验前电极表面要处理干净。 [] [] 3466Fe(CN)Fe(CN)e - - -+=Red ox ' 0pa ln c c nF RT + =???c v AD n i 2/12/12/35p 1069.2?=
第一章绪论1.分离技术的三种分类方法各有什么特点? 答:(1)按被分离物质的性质分类分为物理分离法、化学分离法、物理化学分离法。 (2)按分离过程的本质分类分为平衡分离过程、速度差分离过程、反应分离过程。 (3)场流分类法 2.分离富集的目的? 答:①定量分析的试样通常是复杂物质,试样中其他组分的存在常常影响某些组分的定量测定,干扰严重时甚至使分析工作无法进行。这时必须根据试样的具体情况,采用适当的分离方法,把干扰组分分离除去,然后才能进行定量测定。②如果要进行试样的全分析,往往需要把各种组分适当的分离,而后分别加以鉴定或测定。③而对于试样中的某些痕量组分,进行分离的同时往往也就进行了必要的浓缩和富集,于是就便于测定。因此物质的化学分离和测定具有同样重要意义。 3.什么是直接分离和间接分离? 答:直接分离是将待测组分从复杂的干扰组分分离出来;间接分离是将干扰组分转入新相,而将待测组分留在原水相中。 4.阐述浓缩、富集和纯化三个概念的差异与联系? 答:富集:通过分离,使目标组分在某空间区域的浓度增大。浓缩:将溶剂部分分离,使溶质浓度 提高的过程。纯化:通过分离使某种物质的纯度提高的过程。 根据目标组分在原始溶液中的相对含量(摩尔分数)的不同进行区分:
(方法 被分离组分的摩尔分数)富集 <0.1;浓缩 0.1-0.9;纯化 >0.9。 5.回收因子、分离因子和富集倍数有什么区别和联系? 答:(1)被分离物质在分离过程中损失量的多少,某组分的回收程度,用回收率来表示。 待测组分A 的回收率,用RA 表示,QA °---为富集前待测物的量;QA---富集后待测物的量。%100?=οA A A Q Q R (2)分离因子:两组分的分离程度。用SA , B 表示。B A B A B A B ,//R R Q Q Q Q S A =??= A —待测组分; B —干扰组分。如果待测组分A 符合定量要求,即可认为QA ≈ Q oA ,SA,B ≈ Q oB/QB = 1/RB ,常量组分测定:SA,B ≈103;分离因子越大,分离效果越好。 (3)富集倍数:目标组分和基体组分的回收率之比,用F 表示,οο M M T T M T Q Q Q Q R R F //== RT 为组分的回收率;RM 为基体的回收率; QT °为富集前待测物的量; QT 为富集后待测物的量;QM °为富集前基体的量;QM 为富集后基体的量。 第二章 分离过程中的热力学 2.气体分子吸附在固体吸附剂表面时,某吸附等温线可以由朗格缪尔吸附方程得到。试分析吸附物质的吸附平衡常数K 与该气体物质在气相的分压p 需满足什么条件才能使朗格缪尔吸附等温线近似为直线。 答:溶质吸附量q 与溶质气体分压p 的关系可以用朗格缪尔吸附方程表示:p K p K q q A A +=1max ,式中qmax 为溶质在固相表面以单分子层覆盖的最大容量;KA 为溶质的吸附平衡常数。在低压时,p K q q p K A A max 1=,《。
1 氟离子选择电极直接电位法测定牙膏中的氟实验报告 试剂与仪器 试剂 (1)F-标准溶液(L):实验室提供; (2)TISAB(总离子强度调节缓冲溶液):实验室提供,在500ml水中,加入57ml冰醋酸,的氯化钠和的柠檬酸钠,用水稀释至1L,pH值为至。 表一:TISAB的组成与离子强度 组成C i Z i2 NaCl(1mol/L) Hac(L) NaAc(L) 柠檬酸三钠(L) I Z I2= mol/L pH=~ 112+112=2 弱酸 += += 仪器 pH510型pH计/离子计;电磁搅拌器;氟离子选择性电极,Ag/AgCl电极,超声波清洗器。 ~mol/L的氟的标准溶液系列的配置 取50ml的容量瓶,加入L氟标准液,加入25mlTISAC,用水稀释至刻度。照此法,配置~的氟的标准溶液,浓度差为10倍。 标准氟工作曲线的制作 利用pH510型pH计/离子计,由稀至浓测量上述标准溶液系列的电位值。 以F-浓度的对数为横坐标,电位(mV)为纵坐标,绘制标准曲线。标准曲线如图一。 牙膏中氟含量的测定 准确称取的牙膏样品于小烧杯中,用25mlTISAB稀释转移到50ml容量瓶。定容,超声波震荡几分钟。 取待测液用以上pH510型pH计/离子计测量此时溶液的电位值,记录于表一。 根据标准氟工作曲线以及样品的电位值求出牙膏中所含有的氟的浓度,并与国家标准进行比对。
3 结果与讨论 数据记录 表二:离子选择性电极直接测量牙膏中氟含量的结果记录表 C F- / mol/L E /mV 空白液483 419 358 300 242 牙膏样品316 表三:样品测定结果记录表 样品质量/g牙膏中氟含量/% 316 数据处理 根据所获得的实验数据,用Excel软件合成E(mV)-(-lgC F-)工作曲线,得到的工作曲线图和关系数据如图一所示: 图一:E(mV)-(-lgC F-)工作曲线
循环伏安法测定亚铁氰化钾 实验目的 (1) 学习固体电极表面的处理方法; (2) 掌握循环伏安仪的使用技术; (3) 了解扫描速率和浓度对循环伏安图的影响 实验原理 铁氰化钾离子[Fe(CN)6]3--亚铁氰化钾离子[Fe(CN)6]4-氧化还原电对的标准电极电位为 [Fe(CN)6]3- + e -= [Fe(CN)6]4- φθ= 0.36V(vs.NHE) 电极电位与电极表面活度的Nernst 方程式为 φ=φθ+ RT/Fln(C Ox /C Red ) -0.2 0.00.20.4 0.60.8 -0.0005 -0.0004-0.0003-0.0002-0.00010.0000 0.00010.00020.0003i pa i pc I /m A E /V vs.Hg 2Cl 2/Hg,Cl - 起始电位:(-0.20V) 终止电位:(0.80 V) 溶液中的溶解氧具有电活性,用通入惰性气体除去。 仪器与试剂 MEC-16多功能电化学分析仪(配有电脑机打印机);金电极;铂丝电极;饱和甘汞电极; 容量瓶:250 mL 、100mL 各2个,25 mL 7个。 移液管:2、5、10mL 、20mL 各一支。 NaCl 溶液、K 4[Fe(CN)6]、、Al 2O 3粉末(粒径0.05 μm ) 实验步骤
1、指示电极的预处理 金电极用金相砂纸细心打磨,超声波超声清洗,蒸馏水冲洗备用。 2、溶液的配制 配制0.20 mol/L NaCl溶液250mL,再用此溶液配制0.10 mol/L的K4[Fe(CN)6]溶液100mL备用。 3、支持电解质的循环伏安图 在电解池中,放入25mL 0.2 mol·L-1 NaCl溶液,插入电极,以新处理的铂电极为工作电极,铂丝电极为辅助电极,饱和甘汞电极为参比电极,进行循环伏安仪设定,扫描速率为0.1V/s;起始电位为-0.20V,终止电位为0.80V。开始循环伏安扫描. 4、K4 [Fe(CN)6]溶液的循环伏安图 在-0.20至0.80V电位范围内,以0.1V/s的扫描速度分别作0.01 mol·L-1、0.02 mol·L-1、0.04 mol·L-1、0.06 mol·L-1、0.08 mol·L-1的K4 [Fe(CN)6]溶液(均含支持电解质NaCl浓度为0.20mol·L-1)循环伏安图 5、不同扫描速率K4 [Fe(CN)6]溶液的循环伏安图 在0.08 mol·L-1 K4 [Fe(CN)6]溶液中,以0.1V/s、0.15 V/s、0.2V/s、0.25 V/s、0.3V/s、0.35V/s,在-0.20至0.80V电位范围内扫描,做循环伏安图 数据处理 1、从K4[Fe(CN)6]溶液的循环伏安图,测量i pa、i pc值。 -1;起始电位为-0.20V,终止电位为0.80V) 2、分别以i pa和i pc对K4[Fe(CN)6]溶液浓度c作图,说明峰电流与浓度的关系。
第二章化学热力学初步 1. 热力学第一定律W U- = Q ?,由于U为状态函数,所以Q和W也是状态函数,对吗?为什么? 答:不对。Q和W只有在能量交换的时候才会有具体的数值,并且随途径不同,共和热的数值都会有变化,所以不是状态函数。 2. 解释下列名词 (1) 体系与环境 (2) 热(Q) (3) 功(W) (4) 焓(H)和焓变(H ?) (5) 热力学能U (6) 恒容反应热(Q V)和恒压反应热(Q p) 答:(1) 热力学中称研究的对象为体系,称体系以外的部分为环境。 (2) 体系在变化过程中吸收的热量为Q。 (3) 体系对环境所做的功。 (4) H=U+PV 当泛指一个过程的时候,其热力学函数的改变量为焓变。 (5) 体系内一切能量的总和叫热力学能。 (6) 在恒容过程中完成的化学反应,其热效应称为恒容反应热。 在恒压过程中完成的化学反应,其热效应称为恒压反应热。 3. 什么叫状态函数?它具有何特性? 答:藉以确定体系状态的物理量称为体系的状态函数。它具有加和性。 4. 何谓热效应?测量方法有哪两种? 答:化学反应的热效应为当生成物和反应物的温度相同时,化学反应过程中的吸收或放出的热量。可以选择恒压和恒容两种条件下测量。 5. 什么叫热化学方程式?书写热化学方程式要注意哪几点? 答:表示出反应热效应的化学方程式叫做热化学方程式。书写化学方程式时要注意一下几点:(1)写热化学方式式,要注意反应的温度和压强条件,如果反应是在298K和1.013×105Pa下进行时,习惯上不予注明。(2)要注明物质的聚集状态和晶形。(3)方程式中的配平系数只是表示计量数,不表示分子数。但计量数不同时,同一反应的反应热数值也不同。 6. ①无机化学中常用的反应热有哪几种?反应热的实质是什么?什么类型的化学反应Q V=Q p?等摩尔的NaOH和NH3·H2O溶液分别与过量的HCl溶液中和所放热量是否相等?为什么? ②反应2N2(g)+O2(g)=2N2O(g)在298K时,ΔrH m?=164K J·mol-1, 求反应的ΔU? 答:①无机化学中常用的反应热有恒压反应热和恒容反应热。 反应热的实质是:当生产物与反应物的温度相同时,化学反应过程中的吸
陕西师范大学仪器分析实验 姓名:颜琦 实验日期:2014.11.12 学号:41207081 室温:17℃ 专业:化学二班 实验名称:循环伏安法测定亚铁氰化钾 1.实验目的 1.1学习固体电极表面的处理方法。 1.2掌握循环伏安法的使用技术。 1.3了解扫描速率和浓度对循环伏安图的影响。 2.实验原理 2.1 [Fe(CN)6]3-+e -[Fe(CN)6]4- 2.2 电极电位与电极表面活度的Nernst 方程为 )(Re d Ox c c In F RT +=θ ?? 2.3峰电流与电极表面活度的Ctroll 方程为 c v AD n i p 21 21235 1069.2?= s cm D /1061.626-?=(扩散系数) n=1(电子转移数) A (电极表面积) v(电压扫描速度) c (被测物质浓度) 2.4在一定扫描速率下: 从起始电位(-0.20V )正向扫描到转折电位(+0.80V )期间,溶液中[Fe(CN)6]4- V 36.0=θ?
被氧化生成[Fe(CN)6]3-,产生氧化电流。 当负向扫描,从转折电位(+0.80V)扫描到起始电位(-0.20V),溶液[Fe(CN)6]3-被还原[Fe(CN)6]4-,产生还原电流。 2.5循环伏安法电流-电位曲线为: 3.实验仪器与试剂 循环伏安仪 指示电极:铂电极 辅助电极:铂丝电极 参比电极:饱和甘汞电极 0.5mol/LK4[Fe(CN)6]溶液 1.0mol/LNaCl溶液 4.实验过程 4.1打开电脑和循环伏安仪,预热10min。 4.2指示电极的预处理 铂电极用Al2O3粉末将电极表面抛光,蒸馏水冲洗。 4.3支持电解质的循环伏安图 在电解池中放入0.10mol/LNaCl溶液,分别插入参比、辅助、指示电极,连接循环伏安仪,设定扫描速率为0.1V/s,起始电位为-0.2V,终止点位为0.8V,开始循环伏安扫描。 4.4不同浓度的K4[Fe(CN)6]溶液的循环伏安图
第一章 绪论 1.分离技术的三种分类方法各有什么特点? 答:(1)按被分离物质的性质分类分为物理分离法、化学分离法、物理化学分离法。 (2)按分离过程的本质分类分为平衡分离过程、速度差分离过程、反应分离过程。 (3)场流分类法 2.分离富集的目的? 答:①定量分析的试样通常是复杂物质,试样中其他组分的存在常常影响某些组分的定量测定,干扰严重时甚至使分析工作无法进行。这时必须根据试样的具体情况,采用适当的分离方法,把干扰组分分离除去,然后才能进行定量测定。②如果要进行试样的全分析,往往需要把各种组分适当的分离,而后分别加以鉴定或测定。③而对于试样中的某些痕量组分,进行分离的同时往往也就进行了必要的浓缩和富集,于是就便于测定。因此物质的化学分离和测定具有同样重要意义。 3.什么是直接分离和间接分离? 答:直接分离是将待测组分从复杂的干扰组分分离出来;间接分离是将干扰组分转入新相,而将待测组分留在原水相中。 4.阐述浓缩、富集和纯化三个概念的差异与联系? 答:富集:通过分离,使目标组分在某空间区域的浓度增大。浓缩:将溶剂部分分离,使溶质浓度提高的过程。纯化:通过分离使某种物质的纯度提高的过程。 根据目标组分在原始溶液中的相对含量(摩尔分数)的不同进行区分: (方法 被分离组分的摩尔分数)富集 <0.1;浓缩 0.1-0.9;纯化 >0.9。 5.回收因子、分离因子和富集倍数有什么区别和联系? 答:(1)被分离物质在分离过程中损失量的多少,某组分的回收程度,用回收率来表示。 待测组分A 的回收率,用RA 表示,QA °---为富集前待测物的量;QA---富集后待测物的量。%100?= A A A Q Q R (2)分离因子:两组分的分离程度。用SA , B 表示。B A B A B A B ,//R R Q Q Q Q S A =??= A —待测组分;B —干扰组分。如果待测组分A 符合定量要求,即可认为QA ≈ Q oA ,SA,B ≈ Q oB/QB = 1/RB ,常量组分测定:SA,B ≈103;分离因子越大,分离效果越好。 (3)富集倍数:目标组分和基体组分的回收率之比,用F 表示, M M T T M T Q Q Q Q R R F //== RT 为组分的回收率;RM 为基体的回收率; QT °为富集前待测物的量; QT 为富集后待测物的量;QM °为富集前基体的量;QM 为富集后基体的量。 第二章 分离过程中的热力学 2.气体分子吸附在固体吸附剂表面时,某吸附等温线可以由朗格缪尔吸附方程得到。试分析吸附物质的吸附平衡常数K 与该气体物质在气相的分压p 需满足什么条件才能使朗格缪尔吸附等温线近似为直线。 答:溶质吸附量q 与溶质气体分压p 的关系可以用朗格缪尔吸附方程表示:p K p K q q A A +=1max ,式中qmax 为溶质在固相表面以单分子层覆盖的最大容量;KA 为溶质的吸附平衡常数。在低压时,p K q q p K A A max 1=,《。
§2.1内能、焓、自由能和吉布斯函数的全微分 热力学函数中的物态方程、内能和熵是基本热力学函数,不仅因为它们对应热力学状态描述第零定律、第一定律和第二定律,而且其它热力学函数也可以由这三个基本热力学函数导出。焓:自由能: 吉布斯函数: 下面我们由热力学的基本方程(1) 即内能的全微分表达式推导焓、自由能和吉布斯函数的全微分 ?焓、自由能和吉布斯函数的全微分 o焓的全微分 由焓的定义式,求微分,得, 将(1)式代入上式得(2) o自由能的全微分 由得 (3) o吉布斯函数的全微分
(4) 从方程(1)(2)(3)(4)我们容易写出内能、焓、自由能和吉布斯函数的全微分dU,dH,dF,和dG独立变量分别是S,V;S,P;T,V和T,P 所以函数U(S,V),H(S,P),F(T,V),G(T,P)就是我们在§2.5将要讲到的特性函数。下面从这几个函数和它们的全微分方程来推出麦氏关系。 二、热力学(Maxwell)关系(麦克斯韦或麦氏) (1)U(S,V) 利用全微分性质(5) 用(1)式相比得(6) 再利用求偏导数的次序可以交换的性质,即 (6)式得(7) (2)H(S,P)
同(2)式相比有 由得(8) (3)F(T,V) 同(3)式相比 (9) (4)G(T,P) 同(4)式相比有 (10) (7),(8),(9),(10)式给出了热力学量的偏导数之间的关系,称为麦克斯韦(J.C.Maxwell)关系,简称麦氏关系。它是热力学参量偏导数之间的关系,利用麦氏关系,可以从以知的热力学量推导出系统的全部热力学量,可以将不能直接测量的物理量表示出来。例如,只要知道物态方程,就可以利用(9),(10)式求出熵的变化,即可求出熵函数。
五、循环伏安法测定亚铁氰化钾 实验目的 学习固体电极表面的处理方法。 掌握循环伏安仪的使用技术。 了解扫描速率和浓度对循环伏安图的影响 一、实验原理 铁氰化钾离子-亚铁氰化钾离子氧化还原电对的标准电极电位 电极电位与电极表活度的N e r n s t 方程 峰电流与电极表面活度的C o t r o l l 方程 循环伏安法 在一定扫描速率下,从起始电位(-0.2 V )正向扫描到转折电位(+0.8 V )期间,溶液中[F e (C N )6]4-被氧化生成[F e (C N )6]3-,产生氧化电流;当负向扫描从转折电位(+0.8 V )变到原起始电位(-0.2 V )期间,在指示电极表面生成的[F e (C N )6]3- 被还原生成[F e (C N )6]4- ,产生还原电流 二、注意事项 为了使液相传质过程只受扩散控制,应在加入电解质和溶液处于静止下进行电解。 [] [] 3466Fe(CN)Fe(CN)e - - - +=0 0.36V (.N H E ) vs ? =Red c nF c v AD n i 2 /12 /12 /35 p 1069.2?=
4.不同扫描速率K4[F e(C N)6]溶液的循环伏安图:在0.040m o l·L-1 K4[F e(C N)6]溶液中,以100m V·s-1、150m V·s-1、200m V·s-1、250 m V·s-1、300m V·s-1、350m V·s-1,在-0.2至+0.8V电位范围内扫描,分别记录循环伏安图、 五、数据处理 1.从K4[F e(C N)6]溶液的循环伏安图上,读取i p a、i p c、v1/2、的值。 2.分别以i p a、i p c对K4[F e(C N)6]溶液的浓度作图,说明峰电流与浓度的关系。 3.分别以i p a、i p c对v1/2作图,说明峰电流与扫描速率间的关系。 4.计算i p a/i p c的值、值和值;说明K3[F e(C N)6]在K C l溶液中电极过程的可逆性 六、注意事项 1.实验前电极表面要处理干净。 2.扫描过程保持溶液静止。 3.K4[F e(C N)6]和K3[F e(C N)6]的循环伏安图是否相同,为什么? 4.设计一测定扩散系数的电化学方法。 5.若实验中测得的条件电极电位和与文献值有差异,说明其原因
亚铁氰化钾的测定方法 1.亚铁氰化钾标准溶液:称取亚铁氰化钾,精确到g。加少量水溶解,定容至1 OOmL o(此时亚铁氰根的浓度为1g/L)。吸取该溶液l OmL,定容至100mL,即制得亚铁氰化钾标准工作液(1 OOmg/L )。 2. 40g/L的硫酸亚铁溶液:称取40g七水硫酸亚铁,溶解于1L水中(40g/L ) o 3. mol/L的氢氧化钠溶液:称取的氢氧化钠溶解到1L水中。 4. mol/L的氢氧化钠溶液:吸取上述溶液1 OmL溶解到1 OOmL水中。 5. 1: 10的盐酸溶液:l OmL的盐酸溶解到1 OOmL的水中。 6. 1: 100的盐酸溶液:吸取上述溶液l OmL溶解到1 OOmL的水中。 7. 5g/L的碳酸钾溶液:称取碳酸钾溶解于100mL容量瓶中,定容,摇匀。 L的碳酸氢钾溶液:称取碳酸氢钾溶解于1 OOmL容量瓶中,定容,摇匀。 9. 5g/L的氰化钾溶液:称取氰化钾溶解于1 OOmL容量瓶中,定容,摇匀。 10. 5g/L的硫氰化钾溶液:称取硫氰化钾溶解于1 OOmL容量瓶中,定容,摇匀。 11. 5g/L的硫代硫酸钠溶液:称取硫代硫酸钠溶解于1 OOmL容量瓶中,定容,摇匀。 12. 5g/L的亚硫酸钠溶液:称取亚硫酸钠溶解于100mL容量瓶中,定容,摇匀。标准曲线的绘制: 取6个100mL烧杯,分别编号为1号,2号,3号,4号,5号,b号。分别吸取亚铁氰化钾标准溶液1mL, 3mL, 5mL, 7mL, 9mL, 11mL到1号至6号烧杯中,均加入4mL硫酸亚铁溶液。(亚铁氰化钾浓度分别为2mg/L, 6mg/L, l0mg/L 14mg/L, 18mg/L和22mg/L)。再均加入去离子水30mL。用1:100的HCL和mol/L 的NaOH溶液调节溶液pH至1-2。将这6个烧杯中的溶液转移至6个 50mL的容量瓶中,编号1号至6号。再用去离子水定容,摇匀,显色30min。用1 cm比色皿,空白溶液为参比,在760nm处测量1号至6号溶液吸光度。然后以吸光度为纵坐标,亚铁氰化钾浓度为横坐标,绘制标准工作曲线。
潍坊职业学院教案案首
3)孤立体系(isolated system ) 体系与环境之间既无物质交换,又无能量交换,故又称为隔离体系。有时把封闭体系和体系影响所及的环境一起作为孤立体系来考虑 注意: 可见,体系与环境的划分并不是绝对的,实际上带有一定的人为性。原则上说,对于同一问题,不论选哪个部分作为体系都可将问题解决,只是在处理上有简便与复杂之分。因此,要尽量选便于处理的部分作为体系。一般情况下,选择哪一部分作为体系是明显的,但是在某些特殊场合下,选择方便问题处理的体系并非一目了然。 2 、状态函数
体系的一些性质,其数值仅取决于体系所处的状态,而与体系的历史无关;它的变化值仅取决于体系的始态和终态,而与变化的途径无关。具有这种特性的物理量称为状态函数(state function)。 状态函数的特性可描述为:异途同归,值变相等;周而复始,数值还原。 状态函数在数学上具有全微分的性质。 体系的性质-状态函数性质 用宏观可测性质来描述体系的热力学状态,故这些性质又称为热力学变量。可分为两类: 广延性质(extensive properties) 又称为容量性质,它的数值与体系的物质的量成正比,如体积、质量、熵等。这种性质有加和性,在数学上是一次齐函数。 强度性质(intensive properties) 它的数值取决于体系自身的特点,与体系的数量无关,不具有加和性,如温度、压力等。它在数学上是零次齐函数。指定了物质的量的容量性质即成为强度性质,如摩尔热容。 3.过程与途径 (1)体系状态的任何变化称过程(process)。 始态————————————————→终态 过程(具体可通过不同的途径来实现) (2) 实现状态变化的具体步骤称为途径(path)。 根据过程有无相变及化学反应分: 简单状态变化过程:T,p,V变化 化学变化过程 相变过程 常见的变化过程 ◆恒温过程:T始=T终=T外=常数 ◆恒压过程: p始=p终=p外=常数
硫酸亚铁分光光度法测定工业盐中的亚铁氰化钾 1 原理 亚铁氰化钾在酸性条件下与硫酸亚铁作用,生成白色亚铁氰化亚铁沉淀,受空气氧化生成普鲁士蓝,在670nm波长下用光度法测定。 2 试荆和溶液 2.1 硫酸溶液(1+20) 2.2 硫酸亚铁溶液(40g/L):称取硫酸亚铁(FeSO 4·7H 2 0)40g,溶于1L硫酸溶 液(2.1)中,摇匀,过滤。 2.3 氯化钠 2.4 亚铁氰化钾标准溶液:准确称取亚铁氛化钾{K 4[Fe(CN) 6 ·3H 2 0)0.1993 g, 精确到0.0001 g,加少量水溶解,稀释至100 mL 2.5 亚铁氰化钾标准工作溶液:吸取亚铁氰化钾标准溶液(2.4 )5.00mL,稀 释至100 mL 2.6 氢氧化钠溶液(1.0mol/L):称取氢氧化钠10.0g ,溶于250m L水中。 3 仪器设备 一般实验室仪器及符合GB/T 9721规定的分光光度计。 4 分析步骤 4.1 标准曲线制作 吸取亚铁氰化钾标准工作溶液(2.5)0,10,20,30,40,50μg于50m L比色管中,加氯化钠(2.3)5g,加水溶解。加40 g/L硫酸亚铁溶液(2.2)4mL,加水稀释至刻度,摇匀,放置10 min,用1 cm(或3 cm,5 cm)比色池,在波长670 nm 处,以试剂空白为参比测定吸光度。以吸光度为纵坐标,对应亚铁氰根微克数为横坐标绘制标准曲线。 4.2 样品的测定 称取样品5.0g 置于50m L比色管中,加40ml水溶解(若溶液混浊应过滤),加40g/L硫酸亚铁溶液(2.2)4 ml,以下同4.1操作,由测得的吸光度从标准曲线上查出亚铁氰根质量。
循环伏安法测定铁氰化钾电极反应过程 一、实验目的: (1) 学习固体电极表面的处理方法; (2) 掌握循环伏安仪的使用技术; (3) 了解扫描速率和浓度对循环伏安图的影响 二、试验原理 循环伏安法(CV)是最重要的电分析化学研究方法之一。在电化学、无机化学、有机化学、生物化学等研究领域得到了广泛应用。由于其操作简便、图谱解析直观,因而一般是电分析化学的首选方法。 CV方法是将循环变化的电压施加于工作电极和参比电极之间,记录工作电极上得到的电流与施加电压的关系曲线。这种方法也常称为三角波线性电位扫描方法。图1中表明了施加电压的变化方式:起扫电位为+0.8V,反向/起扫电位为-0.2V,终点又回扫到+0.8V,扫描速度可从斜率反映出来,其值为50mV/s。虚线表示的是第二次循环。一台现代伏安仪具有多种功能,可方便地进行一次或多次循环,任意变换扫描电压范围和扫描速度。 当工作电极被施加的扫描电压激发时,其上将产生响应电流。以该电流(纵坐标)对电位(横坐标)作图,称为循环伏安图。典型的循环伏安图如图2所示。该图是在1.0mol/L的KNO3电解质溶液中,6×10-3mol/L 的K3Fe(CN)6在 Pt工作电极上反应得到的结果。 从图可见,起始电位Ei为+0.8V(a点),电位比较正的目的是为了避免电极铁氰化钾电解。在一定扫描速率下,从起始电位(0.8V)正向扫描到转折电位
(0.181V)期间,溶液中[Fe(CN)6]3-被还原生成[Fe(CN)6]4-,产生阴极电流(b点);随着电位变负,阴极电流迅速增加(bcd曲线),直至电极极表面[Fe(CN)6]3-浓度趋近零,电流在d点达到高峰,然后迅速衰减(def)因为表面附近溶液中的[Fe(CN)6]3-几乎全部转变为[Fe(CN)6]4-而耗尽,即所谓贫乏效应,当电压扫直-0.15v,虽然已经转向开始阳极扫描,但此时电极电位相当负,扩散至电极表面的[Fe(CN)6]3-仍在不断还原,故仍呈阴极电流而不是阳极电流。当电极继续正向扫描从转折电位(0.181V)变到电位(0.110V)期间,在电极表面生成的[Fe(CN)6]4-被氧化生成[Fe(CN)6]3-,产生阳极电流。随着扫描电位正移迅速增加,电极表面[Fe(CN)6]4-浓度趋近零,阳极电流达到峰值(j点),扫描继续正移,电极表面附近[Fe(CN)6]4-耗尽,阳极电流衰减最小(k点),当电压扫至0.8V,完成一次循环。当电位从正向负扫描时,电活性物质在电极上发生还原反应,产生还原波,其峰电流为ipc,峰电位为Epc;当逆向扫描时,电极表面的还原态物质发生氧化反应,其峰电流为ipa,峰电位为Epa。 图 2 6×10–3 mol/L在1 mol/L的KNO 溶液中的循环伏 3 安图扫描速度:50 mV/s 铂电极面积:2.54 mm2
选择电极直接电位法测定牙膏中的氟离子含量 111111 (1111111院,,519072) 摘要: 本文采用氟离子选择性电极直接电位分析法测定了牙膏样品中的氟元素含量。使用TISAB(总离子强度调节缓冲溶液)稳定溶液的总离子强度及pH,测定了一系列含氟离子溶液的标准曲线,在0.01-0.00001 mol/L的围线性相关系数为1.0000。结果表明本牙膏样品中的氟含量为0.595 mg/g,符合标准规定的含氟牙膏中氟含量围。 关键词: 氟离子牙膏选择电极直接电位法 1 前言 氟为人体必需元素,若饮用水中氟含量过高,会引起牙釉和骨软症,而适量氟对预防龋齿有利。龋病是一种危害人类牙齿最常见的多发病,尤其以儿童更为普遍。如何能及早预防儿童龋病的发生,是当今口腔医学上一重大课题。目前最简便有效的方法是使用含氟化钠的牙膏刷牙,其目的是使氟离子与牙齿表面钙盐结合形成抗酸蚀能力较强的氟磷灰石保护层,以增强牙齿的抗酸蚀能力,达到预防龋齿的目的。又由于氟化钠有毒,须严格控制其用量,因此测定牙膏中氟的含量具有重要的实际意义[1]。 目前氟化物的测定方法主要有[2-3]:分光光度法、离子色谱法、滴定法、扫描极谱法、原子发射光谱法、荧光法、气相色谱法等。其中比色法方法简单,但灵敏度低;分光光度法测定时要将样品中F-转化为吸光物质,受条件影响因素较多;离子色谱法作为一种新技术, 发展很快, 但此法大多用于测定阴离子且仪器昂贵;滴定法涉及样品预处理操作,手续繁杂,特别对微量元素的测定准确度和精密度不高;气相色谱法需对分析物进行衍生。
本实验采用氟离子选择性电极法,直接溶样测定牙膏中游离氟,该法与其他方法相比,操作更简单,方便快速,灵敏度高准确,选择性好,仪器简单,成本低,是一种实用的测定氟离子方法。 自从氟离子选择电极问世以来,用该电极直接电位法测定各种水样中的氟便是一种普遍、方便和准确的方法。氟离子选择电极简称为氟电极,其敏感膜是LaF 3单晶(结构简图见图1)。 以氟电极为指示电极,Ag-AgCl 参比电极电极为参比电极,插入试液中,组成一个测量电池: 氟离子选择电极│F -试液│参比电极 当试液的离子强度为定值时,电池的电动势E 与F -试液的浓度C F -有确定的关系: --=F C F RT K E lg 303.2 (1) E 与C F -成线性关系,因此可以用直接电位法测定F -的浓度。 当氟电极插入到F -溶液中时,F -在晶体膜表面进行交换,25℃时有 E = K - 0. lga F - = K + 0. pF - (2) 离子选择性电极测量的是溶液中的离子活度,通常定量分析需要测量的是离子的浓度,不是活度,所以必须控制试液的离子强度,才可以近似认为测量的是离子浓度。本实验用标准工作曲线法测定水中氟离子的含量,测量的pH 值围为5.0-6.0,加入含有氯化钠、乙酸及柠檬酸钠的总离子强度调节缓冲剂(TISAB )以控制酸度、保持一定的离子强度和消除干扰离子对测定的影响。
关于亚铁氰化钾的使用情况 亚铁氰化钾(别名:黄血盐),为浅黄色单斜体结晶或粉末,无臭,略有咸味,相对密度1.85。常温下稳定,加热至70℃开始失去结晶水,100℃时完全失去结晶水而变为具有吸湿性的白色粉末。高温下发生分解,放出氮气,生成氰化钾和碳化铁。溶于水,不溶于乙醇、乙醚、乙酸甲酯和液氨。其水溶液遇光分解为氢氧化铁,与过量Fe3+反应,生成普鲁士蓝颜料。 CAS登录号:14459-95-1(三水)/13943-58-3(无水) 英文名:Potassium Ferrocyanide 分子式:K4Fe(CN)6·3H2O 分子量:422.42 作用:作为抗结剂使用 使用法规: I、允许作为食品添加剂使用——GB2760-2011 使用标准: 备注:1、食品添加使用标准(GB2760-2011)见附件一 2、检测方法(GB25581-2010)见附件二 II、允许作为饲料添加剂使用——欧盟委员会议 文件结论:允许作为抗结剂加入到饲料中 文章重点语句摘录:
Principally on the basis of data compiled for food application as anticaking agent in salt, the use of these ferrocyanides in salt for feed use is acceptable as regards safety for target animals and human consumer. 使用标准:建议参照人类食物使用标准(水平) 文章重点语句摘录: 1、As the risk for workers in production plants is considered low due to the biological properties, it is recommended to maintain the same conditions as applied in premises for human food salt preparation. 2、Ideally the same dose levels should be used for humans and animals. 备注:1、欧盟委员会理事会议原件见附件三