xxxxxxx有限公司生产工艺规程
1 目的:建立板蓝根生产工艺规程,用于指导现场生产。
2 范围:板蓝根生产过程。
3 职责:生产部、饮片车间、质保部。
4 制定依据:《药品生产质量管理规范》(2010修订版)
《中国药典》2020年版。
5 产品概述:
5.1 产品基本信息
5.1.1产品名称:板蓝根
5.1.2规格:厚片
5.1.3性状:本品呈圆形的厚片。外表皮淡灰黄色至淡棕黄色,有纵皱纹。切面皮部黄白色,木部黄色。气微,味微甜后苦涩。
5.1.4企业内部代码:
5.1.5性味与归经:苦,寒。归心、胃经。
5.1.6功能与主治:清热解毒,凉血利咽。用于温疫时毒,发热咽痛,温毒发斑,痄腮,烂喉丹痧,大头瘟疫,丹毒,痈肿。
5.1.7用法与用量:9~15g。
5.1.8贮藏:置干燥处,防霉,防蛀。
5.1.9包装规格:3g/袋;5g/袋;10g/袋;60g/罐;80g/罐;100g/罐;0.5kg/袋;1kg/袋;10kg/袋;15kg/袋;18kg/袋;20kg/袋;25kg/袋;30kg/袋;50kg/袋。
5.1.10贮存期限:36个月
5.2 生产批量:5~10000kg
5.3 辅料:无
5.4 生产环境:一般生产区
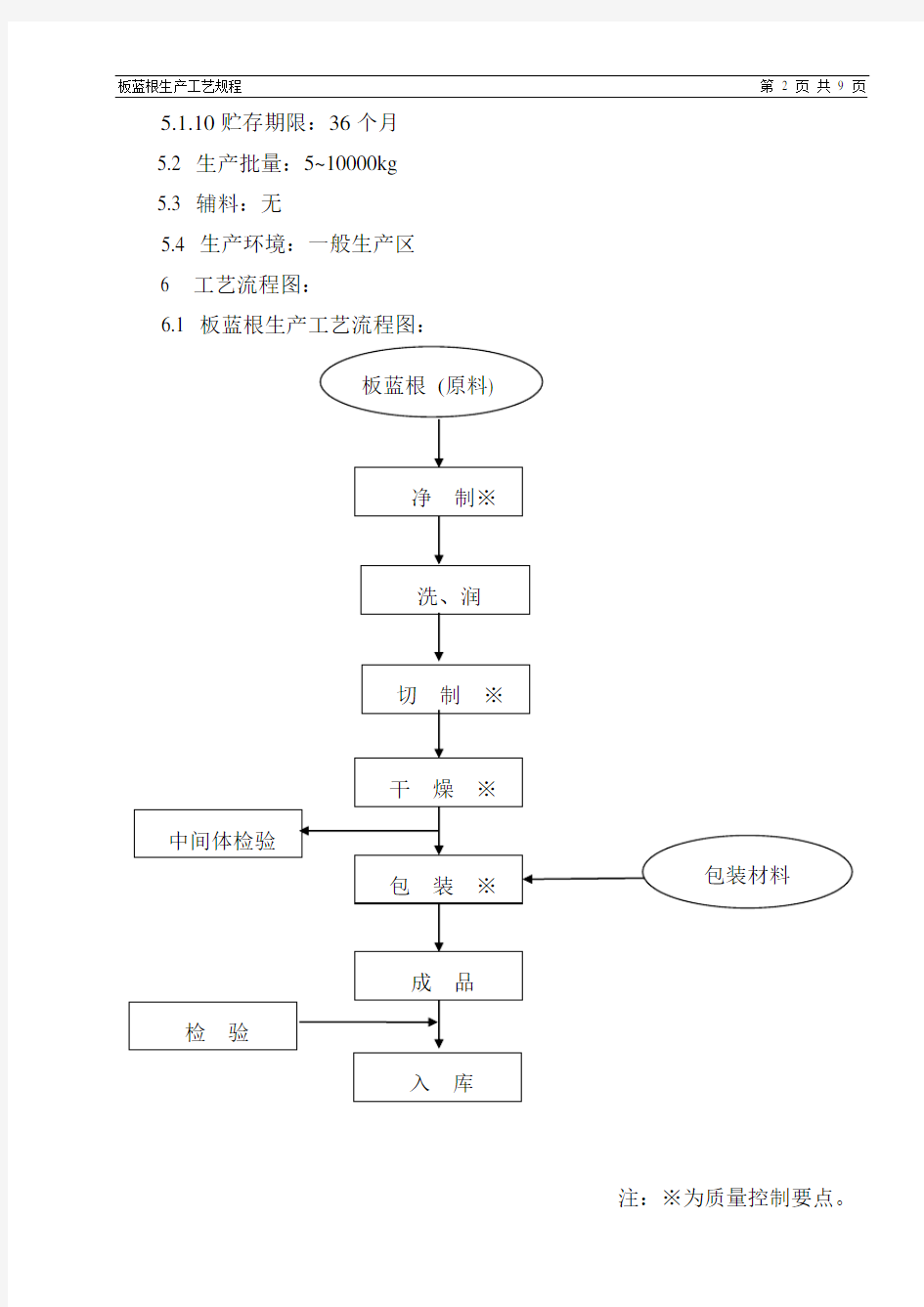
6 工艺流程图:
6.1 板蓝根生产工艺流程图:
注:※为质量控制要点。
6.2 生产操作过程与工艺条件: 6.2.1领料
6.2.1.1饮片车间根据批准的批生产指令,按照“生产过程物料管理程序”,凭填写品名、编码、领料量、数量的指令单到原料库领取板蓝根原料。
6.2.1.2领料过程中必须核对原药材品名、编码、件数、数量、合格标志等内容。
6.2.2 净制:
6.2.2.1取原料,置于不锈钢挑选台上,按照《净制岗位标准操作规程》手工挑选,除去杂质。将净板蓝根置净料袋或周转箱。
6.2.2 .2净制结束后,称量,标明品名、批号、总件数、总数量。将净板蓝根转至下道工序,及时清场并填写生产记录。
6.2.2.3质量要求
6.2.2.3.1生产操作过程中,药材不得直接接触地面。
6.2.2.3.2生产操作过程中,物料必须每件有正确的标识,设备必须有运行标志。
6.2.2.3.3净制标准
(1)抽样方法:随机取样3次,每次500g ,检查杂质数量。
(2)合格标准:照《杂质检查法》(检验操作规程附录12)测定,杂质不得过3%。
6.2.2.4净药材物料平衡限度 指标:95-100%。 计算公式如下:
++=
100%
净药材量杂物量取样量
净制物料平衡指标(%)投料量
6.2.2.5偏差处理:如有偏差,应按《偏差处理管理规程》(GLSC08-023)的要求,启动生产过程的偏差,直到得出无潜在风险为至。如有质量风险,则进行纠正和预防,按质量事故处理。
6.2.3洗、润:按照《洗、润岗位标准操作规程》要求,将药材从滚筒口送
入洗药机中后,按《洗药机标准操作及维护保养规程》启动机器,开启水泵,饮用水将通过水泵喷水管喷入旋转着的洗药筒内,使洗药筒内的药物得到充分清洗后,肉眼观察无泥沙。将洗净的板蓝根置于洗药池润透或置于软化箱软化,控制好温度和时间(温度40-50℃,时间10-15分钟以内),不得重复软化。
6.2.3.1洗、润结束后, 称量,标明品名、批号、总件数、总数量。将洗、润后的板蓝根转至下道工序,及时清场并填写生产记录。
6.2.3.2质量要求
6.2.3.2.1生产操作过程中,药材不得直接接触地面。
6.2.3.2.2生产操作过程中,物料必须每件有正确的标识,设备必须有运行标志。
6.2.3.2.3洗润标准
(1)抽样方法:随机取样3次,每次150g。用目测法、弯曲法检查,应符合标准。
(2)合格标准:用肉眼观察无泥沙,药材弯曲而不折断,润药程度符合规定。
6.2.3.2.4偏差处理:如有偏差,应按《偏差处理管理规程》(GLSC08-023)的要求,启动生产过程的偏差,直到得出无潜在风险为至。如有质量风险,则进行纠正和预防,按质量事故处理。
6.2.4切制:按照《切片岗位标准操作规程》和《切药机标准操作及维护保养规程》调整好切药机后,启动切药机,然后不断将药材加入料槽内,每30分钟检查出料情况,不符合规格的异形片不得超过10%。
6.2.4 .1切制结束后,称量,标明品名、批号、总件数、总数量。将切制后的饮片转至下道工序,及时清场并填写生产记录。
6.2.4.2质量要求
6.2.4.2.1生产操作过程中,药材不得直接接触地面。
6.2.4.2.2生产操作过程中,物料必须每件有正确的标识,设备必须有运行标志。
6.2.4.2.3切制标准
(1)抽样方法:随机取样3次,每次100g 。用目测法检查,应符合标准。 (2)合格标准:异形片不得过10%。 6.2.4.3切制材物料平衡限度 指标:90~99%。 计算公式如下:
%100%?+=
润药后数量
杂物量
切制后数量)切制物料平衡(
6.2.4.4偏差处理:如有偏差,应按《偏差处理管理规程》(GLSC08-023)的要求,启动生产过程的偏差,直到得出无潜在风险为至。如有质量风险,则进行纠正和预防,按质量事故处理。
6.2.5干燥:按照《干燥岗位标准操作规程》和《热风循环烘箱标准操作及维护保养规程》将饮片分别均匀装在烘盘中,架在烘车上,推入热风循环烘箱内,设定温度60-80℃,当温度达到60℃后,持续60-90分钟,或置阳光棚晾晒。
6.2.6干燥结束后称量,标明品名、批号、总件数、总数量。将干燥后的饮片运至车间中转间,及时清场并填写生产记录。
6.2.6.1填写请验单,通知质量检验人员取样检验,检验合格后方可流入下道工序。
6.2.6.2质量要求:
6.2.6.2.1生产操作过程中,药材不得直接接触地面。
6.2.6.2.2生产操作过程中,物料必须每件有正确的标识,设备必须有运行标志。
6.2.6.2.3干燥标准:
(1)取样方法:随机在不同物料筐中取样5处,每次100g 。用“四分法”取样约100g 。
(2)合格标准:用《水分测定法》(检验操作规程附录15)测定,应不得过13.0%。
6.2.6.3物料平衡:
(1)物料平衡指标:≥60%。
(2)物料平衡公式:
%
100%?+=
净药材投料量取样量
干燥后数量)干燥物料平衡(
(3)投料量按净制后药材数量计算。
6.2.6.4偏差处理:如有偏差,应按《偏差处理管理规程》(GLSC08-023)的要求,启动生产过程的偏差,直到得出无潜在风险为至。如有质量风险,则进行纠正和预防,按质量事故处理。
6.2.7包装 6.2.
7.1 内包装
6.2.
7.1.1包装工序按照《饮片包装岗位标准操作规程》根据批包装指令,填写领料单,填写品名、批号、领料量,注意核对合格标志。
6.2.
7.1.2 根据指令要求的规格,产量,计算所需包材的数量,标签的量,凭批包装指令单领取包材及标签。
6.2.
7.1.3标签(合格证)领取:持《批包装指令》、《物料状态卡》向车间QA 申请标签(合格证),并进行复核,无误的签字领用。
6.2.
7.1.4分装过程中,要求称量准确,封口严密,标签注明品名、批号、产地、规格、生产日期、生产厂家、执行标准、及合格标志。
6.2.
7.1.5各种包装内包重量偏差应符合下表规定:
内包装装量偏差允许值表
6.2.
7.1.6装量误差:应符合下表规定。
内包装装量偏差允许值表
6.2.
7.1.7填写请验单,通知质量部取样,待检验合格后换绿色标识。 6.2.7.2内包装标准:
(1)抽样方法:随机取样5袋。复核重量、检查标签和封口质量。 (2)合格标准:标签位置端正一致,内容准确;装量误差符合要求,封口严密。
6.2.
7.3物料平衡限度: 6.2.7.3.1内包装物料平衡 (1)标准:98-100% (2)计算公式如下:
++%=
100%
?合格品数量废弃物量取样量
内包装工序物料平衡()投料量(半成品)
6.2.
7.3.2合格证和包装袋物料平衡 (1)标准:100% (2)计算公式如下:
++%=
100%
?使用量损坏量剩余量
包装(标签、包装材料)物料平衡()领用量
6.2.
7.4偏差处理:如有偏差,应按《偏差处理管理规程》(GLSC08-023)的要求,启动生产过程的偏差,直到得出无潜在风险为至。如有质量风险,则进行纠正和预防,按质量事故处理。
6.2.8外包装:
6.2.8.1按《批包装指令》单中规定的包装规格,领取外包材;
6.2.8.2检查核对:对指定批号的板蓝根饮片,逐件核对《物料状态卡》和数量应正确一致。
6.2.8.3标签(合格证)领取:持《批包装指令》、《物料状态卡》向车间
QA 申请标签(合格证),并进行复核,无误的签字领用。
6.2.8.4装箱或装袋:按指定数量,整齐码放在纸箱或编织袋内,保证内包装袋(PE 罐)之间松紧适宜。
6.2.8.5封口:纸箱:胶带在纸箱开口处粘贴,要求平整牢固;编织袋用手提高速缝包机封口。
6.2.8.6挂签:在编织袋的右上角位置缝上或在纸箱的右上角空白位置贴上标签。
6.2.8.7交料:经QA 检查合格,将外包合格的饮片交仓库待验。 6.2.8.8清场:包装结束,及时清场并填写批生产记录。
6.2.9包装完毕,及时填写饮片包装生产记录, 入成品库待验,贴黄色待验标识。
6.2.10外包装标准:
(1)抽样方法:随机取样3件。复核数量、检查标签和封口质量。 (2)合格标准:标签位置端正一致,内容准确;装量误差符合要求,封口严密。
6.2.11合格证和包装袋物料平衡 (1)标准:100% (2)计算公式:
%
100?++=
领用量剩余量
损耗量使用量包装材料物料平衡限度
6.2.12总收率
(1)控制标准: ≥80% (2)计算公式如下:
%100%?=
投料数量
成品量
)收率(
6.2.13工艺环境卫生要求:
6.2.13.1 设备、容器、器具,生产场所,进入生产区的人员、物料必须按程
序净化。(详见第10条工艺操作过程中支持文件)
6.2.13.2 产品生产结束后按各岗位清场SOP要求,严格清洁、清场,并由QA监督检查合格后颁发清场合格证。
6.2.13.3生产全过程,由QA质量管理员监督。
7 原料、中间体、成品、包装材料的质量标准详见第10条工艺操作过程中支持文件。
8 物料平衡:各工序的物料平衡标准值一年修订一次,修订依据为该岗位上一年生产物料平衡的平均值为下一年的标准值,除包装工序外。
1生产车间工艺操作规程 1).二氧化碳的物理性质 为了便于生产操作管理,本处列出与装置有关的二氧化碳物理性质数据,以便工作时参考。 表1 二氧化碳的相变参数
2).液体二氧化碳产品规格 本装置生产的产品:质量符合GB10621-2006标准的食品级二氧化碳产品。
3).生产工序说明 本装置通过对二氧化碳原料气进行压缩,然后依次经过“夹心饼”精脱硫、催化氧化脱烃、分子筛干燥、冷凝液化、浅低温提纯等工序,得到质量符合 GB10621-2006标准的食品级二氧化碳产品。 脱硫 二氧化碳原料气中含有以H 2 S、COS为主的多种形态的硫化物,脱硫的目的一是保证产品质量,二是保护脱烃催化剂。脱硫的任务及指标是保证原料气中的总硫≤。本装置采用“夹心饼”精脱硫工艺,即原料气先经过氧化铁预脱硫,脱除原料气中的绝大部分H2S,然后再经过水解塔,将原料气中的COS转化为H2S,然后在经 过活性炭精脱硫塔,脱除残余的H 2 S。主要反应如下: 预脱硫塔:Fe 2O 3 .H 2 O+3H 2 S= Fe 2 S 3 .H 2 O+3H 2 O Fe 2O 3 .H 2 O+3H 2 S=2 FeS+S+4H 2 O 水解塔:COS+H2O=H 2S+CO 2 精脱硫塔:H 2S+1/2O 2 =S+H 2 O
催化氧化脱烃 催化氧化脱烃的主要目的是脱除原料气中的H 2 、CO、烃类(碳氢化合物)等 可燃杂质。原料气经过预热至380℃后进入脱烃塔,在脱烃塔中贵金属(活性氧 化铝负载铂、钯)催化剂存在的条件下,原料气中的可燃杂质与O 2 发生催化燃 烧反应,生成CO 2和H 2 O,脱烃过程操作温度为380~500℃。由于硫化物会使脱烃 催化剂中毒,因此必须保证进入脱烃系统原料气中的总硫≤。 分子筛脱水 利用分子筛将原料气中的微量水脱除,保证原料气中的水分≤20ppm,分子筛吸附饱和后加热再生循环使用。分子筛吸附塔一共设置两台,一台吸附,一台再生,切换使用,采用热再生方式进行再生,利用放空尾气进行吹冷。 液化提纯 原料气经过液化后进入提纯塔进行精馏提纯,利用精馏原理,根据二氧化碳与杂质组分的沸点不同,在特定条件下将杂质加以分离,提高二氧化碳纯度,降低消耗。 4).工艺流程简述 从界外来的原料气进入压缩机(C0101),压缩过程中,从压缩机二段引出去预脱硫塔(T0201A/B),脱除原料气中的H 2 S。预脱硫塔共设置2台,可串可并,根据脱硫剂的使用情况进行串联或并联使用。经过预脱硫后的原料气返回压缩机(C0101)三段入口,经过三段压缩后,经过脱硫加热器预热至60℃~90℃后进入水解塔(T0202),将原料气中的有机硫水解为无机硫,然后进入精脱硫塔 (T0203)脱除原料气中残余的H 2 S。从精脱硫塔出来脱硫合格的原料气,经过脱烃热交(E0202)预热380℃,再经过脱烃电加热器(F0201)后进入脱烃塔(T0204),当温度不够时,开脱烃电加热器(F0201)进行提温。脱烃塔(T0204)出来的高温原料气经过脱烃热交(E0202)回收热量后,经过脱硫水冷器(E0203)冷却至常温,然后经过除湿器(E0204)与回冰机系统的气氨换热而被冷却至-5℃,冷却除湿除去原料气中的部分水分,除湿器(E0204)出来的原料气进入分子筛塔(T0205A/B),经过分子筛吸附脱水使水分≤20ppm,分子筛塔一开一备,当水份接近20ppm时,则启用备用塔,该塔退出再生 (再生时引入经电加热器加热至约250℃的空气进行再生,当再生气出口温度≥150℃时,再生结束,用提纯塔放空气冷却到35℃后备用)。
目录 1 概述 (1) 2 验证目的 (1) 3 适用范围 (1) 4 职责 (1) 5 验证人员 (1) 6 验证要求 (1) 7 验证工艺 (2) 8 工艺描述 (2) 9 取样计划及可接受标准 (5) 10 验证过程 (6) 11 验证结果与评价 (8) 12 偏差 (10) 13 稳定性试验 (10) 14 再验证 (10)
1概述 1.1产品描述 1.2公司生产的*****为无菌原料药,其工艺验证主要为工艺过程的验证,包括精制结晶、 过滤洗涤烘干、包装和无菌生产验证,以及不溶性颗粒的控制。 1.3验证采用同步验证,取连续三批试生产批的数据利用制图(或表)统计分析方法进行数 据分析。 1.4本验证是在厂房设施验证、设备验证、设备清洗验证、工艺用水验证、无菌生产验证已 完成的基础上进行的。 2验证目的 通过验证证明*****无菌原料药的生产工艺处于控制状态,所有被定义为关键工艺及控制参数范围已被验证,此工艺能恒定地生产出符合预先规定的质量标准的产品。 3适用范围 适用于公司*****无菌原料药生产工艺的验证 4职责 4.1生产技术部负责验证方案和验证报告的起草、生产计划的安排(包括与各部门的协调)。 4.2生产车间负责生产的进行和批生产记录的填写。 4.3质量管理部负责检验方法的验证和中间过程、产品的检测。 4.4验证工作组负责验证方案和验证报告的审核和批准。 5验证人员 6 6.1所有原辅料必须通过各个原辅料测试标准规定的所有项目 6.2
6.3 品分成三个1/3部分,在每个部分中取样,开始的1/3为B;中间的1/3为M,末了的1/3为E。 6.3.1验证时的取样除常规取样点外,还必须增加额外的取样点。 6.3.2每个部位的样品,必须单独测试有关项目。 7验证工艺 8 8.1工艺流程图及工序管理点 8.1.1工艺流程图
课程设计论文 题目:年产2亿袋板蓝根颗粒剂车间工艺设计 学院轻工化工学院 专业班级 12制药工程(1)班 组员姓名马展鹏 3112001673 (组长) 吴健辉 3112001677 陈少茹 3212001684 韩冬秀 3212001687 韦增晖 3212001696 叶芷欣 3212001700 指导老师谭伟 2015年12月
目录 一、设计任务与分工 (5) 二、产品概述 (6) 三、生产处方 (6) 3.1 所用原辅材料清单 (6) 3.2 生产处方 (6) 四、生产工艺规程与物料衡算图表 (6) 五、生产操作过程及工艺条件 (9) 5.1药材炮制 (9) 5.2药材炮制收率 (9) 5.3 提取: (9) 5.3.1 领料 (9) 5.3.2 煎煮 (9) 5.3.3 醇沉 (9) 5.3.4 回收乙醇并浓缩 (9) 5.3.5制粒 (10) 六、生产过程的质量监控要求: (10) 七、原辅料、包装材料、中间体(半成品)、成品质量标准 (11) 7. 1原辅料质量标准及检验规程 (11) 7.2中间体(半成品)质量标准及检验规程 (12) 7.3成品质量标准及检验规程 (12) 八、消耗定额和物料平衡 (12) 8.1. 物料消耗定额计算及损耗率 (12) 8.2 各工序物料平衡 (13) 九、设备选型 (15) 9.1提取罐设备 (15) 9.2醇沉罐 (15) 9.3浓缩罐 (16) 9.4粉碎设备 (16) 9.5制粒设备 (16) 9.6干燥设备 (18) 9.7制粒机选型 (18) 9.8 包装设备的选型 (19) 十、主要设备和生产能力 (21) 十一、工艺管道的选择 (21) 11.1 中国的GMP对于管道设计安装要求 (21) 11.2中国的GMP对于管道材质要求 (22) 11.3管道的连接 (22) 11.4阀门的选择 (23) 11.5 各工艺设备材质的选择 (23) 十二、工艺卫生要求 (24)
一、石灰生产工艺流程图
二、主要参数 1 窑体主要参数 1)有效高度 21.7 m 。 2)有效容积 150 m3 。 3)窑衬外径 4.6 m 。 4)窑衬内径 3 m 。 5)高径比 7.58 。 6)焙烧带高度 5 m 。 7)烧嘴:低压套筒式。 8)烧嘴数量:2排共28只。 9)上下排烧嘴距离:2.5M。 10)上下排烧嘴布置:平面对称、上下错排。 2、煤气与助燃空气参数 1)煤气热值:850~950KCaL/NM3 2)空气过剩系数:1.05~1.15 三、技术要求 1 石灰石(执行YB/T5279-1999 二级石灰石标准) 1)粒度规格:40~80 mm。 2)成分: CaO > 52 % MgO < 3 % SiO < 2.2 % S < 0.10 % P < 0.02 % 3)石灰石应具备良好的热稳定性,加热过程无爆裂。 4) 石灰石中不得混入杂质。 2 燃料 1)高、焦混合煤气 2)高炉煤气热值:≥ 740 KCaL/M3 3)焦炉煤气热值:≥ 4000 KCaL/M3 4)焦炉煤气比例: 3~5 % 3 石灰主要指标(执行厂内控标准 JGN52-1999 ) CaO > 88 % MgO < 5 % SiO < 3 % S < 0.07 % 灼减:6% 活性度:300ML 4 烘窑 1)新窑衬烘窑烘炉时间不小于168小时 原则:驱除水分、烧结好炉衬。 2)新窑烘窑要求 升温速度:每小时不大于10~15℃。 保温:150℃、350℃、600℃进行保温,保温时间20~24小时。 烘炉终结温度:850~900℃。
烘窑前加入1米厚的石料保护炉底。 石灰窑烘炉曲线图(后附) 5 操作控制要求 A、焙烧温度控制: 1)焙烧带温度:1050~1150℃。 2)预热带温度:400~900℃。 3)冷却带温度:900~200℃。 4)窑顶烟气出口温度:≤ 600℃。 5)出窑石灰温度:≤ 200℃。 B、风气配比 1)煤气量:8500~10000 Nm3/h 2)空气量:6800~8000 Nm3/h 3)空气过剩系数:1.05-1.15 4)一次助燃空气与二次空气比:4:6~3:7 5)煤气压力:14000~18000 Pa 6)空气压力:13000~15000 Pa C、装料、出料 1)先上料再出料 2)每小时装料一次,每次6-9吨。 3)每小时出料一次,上多少出多少,保持料线高度1.5~2米。 D、焙烧检验项目 1)石灰窑烟气成分(CO CO2 O2 ...)。 2)石灰产品的生烧量、过烧量、活性度及化学成分。 E、休风操作要点 1)煤气降压操作,由加压煤气降至常压煤气。 2)空气压力,随煤气压力的降低相应的进行降压操作,保持空气与煤气压力差 < 3000 Pa 。 3)煤气压力由高压降至常压后,关闭烧嘴阀门。 4)烧嘴阀门关闭5分钟后,关闭二次风阀门,再停风机。 F、复风操作要点 1)启动风机,将风压与煤气压力匹配得当。 2)先送二次风,5分钟后再开烧嘴风气阀,进入煤气常压焙烧。 3)调整煤气、空气的流量、压力配比,使之运行稳定。 4)转入加压操作,根据煤气压力的升高,随时提升空气压力,稳定风气压力配比。 5)转入正常生产操作。
关于原料药合成路线长短的考虑审评四部黄晓龙 近年来,随着对原料药生产厂实施GMP认证以及法规对生产工艺与申报工艺一致性的要求,各方面对原料药的生产与质量要求越来越严。而另一方面,国内各种小型化工厂或公司看准时机纷纷生产一些与原料药合成相关的中间体或原料药粗品,销售给原料药生产厂。因此,部分原料药生产厂为降低GMP管理与生产的成本,改用外购中间体甚至是原料药粗品作为起始原料,缩短合成路线的事情时有发生。具体有以下一些情况:1)将原批准工艺的前面步骤转到联营企业,由联营企业按原工艺制得粗品或最后一步中间体后,再由申报单位通过精制或一两步反应制得成品;2)购买其他公司按化工产品生产的中间体,再由申报单位按后续工艺完成原料药的制备;3)委托其他企业生产中间体,再由申报单位按后续工艺完成原料药的制备。 对此类情况,究竟应当如何考虑?下面仅从技术的角度谈几点个人看法,以供有关各方在决策时参考。首先,我们应当认识到:对药品质量的管理与控制不能仅停留在对终产品的质量检测上,而需要对药品的生产、流通等各环节进行全程的监管,才能有效地保证患者能用上质量可控的药品。这也是国内外对药品实行GMP、GSP等管理的主要原因。对于原料药的管理也同样如此,原料药生产厂只有切实按照GMP的要求组织对原料药的生产,才可能得到质量稳定可控的原料药,这也是原料药不同于一般化工产品的关键所在。其次,按照GMP的要求生产出来的药用中间体或粗品,其各方面(如生产环境、对有毒溶剂与试剂的使用、药检部门的有效监管等)的要求与一般的化工产品有着本质的区别,质量也更有保证,不会掺杂对身体有害的杂质。其三,原料药生产厂很难准确了解外购的中间体或粗品的生产过程,对其中可能含有的工艺杂质与残留溶剂难以把握,这样就导致在后续的工艺过程中很难采取针对性的措施加以纯化,并在原料药的质量研究与标准中进行分析与控制,从而给药品的安全性带来隐患。并且这些中间体或粗品的生产厂在今后的生产过程中,很可能会对生产工艺进行变更,如不及时告知原料药生产厂,则很难对此种变更可能对质量的影响进行及时有效的研究与控制,从而影响原料药的质量。其四,从合成工艺本身来说,每一步化学反应结束后,一般会根据反应的实际情况,对反应产物作针对性的分离纯化,然后再进行下一步反应。如果外购的中间体或粗品并不是严格按照药品GMP的要求进行生产与质量控制,要想在后续短短的几步工艺中对所有的杂质进行纯化是很困难的,更何况对杂质的概况一无所知时就更是如此。最后,原料药质量标准中的各杂质(包括有机、无机杂质与溶剂残留量等)检查项都是根据具体的生产工艺与质量研究结果确定的,如果外购中间体或粗品的生产工艺发生了改变,而原料药厂又不能及时准确地获知有关信息的话,现行的质量标准就很可能检测不出新引入的工艺杂质。 正是基于以上一些考虑,国外药政管理当局在审评原料药的制备工艺资料时,均对其合成路线的长短有所要求。例如,FDA要求合成原料药的反应步数至少应为三步。欧盟要求至少有一步化学反应(不包括成盐或精制)是在申报的企业生产,并且要在起始原料中确定一个关键原料,该原料也应在符合GMP条件的车间进行生产。一般而言,合成原料药的制备工艺应该从该药品的主结构开始形成之前的原料开始申报。 因此,建议我国的原料药申报企业在确定申报合成路线的长短时应首先考虑对产品质量的影响。尽量使用工艺成熟、质量有保证的起始原料。并在本企业进行三步以上的化学反应,以保证有足够的工艺步骤针对性地对杂质进行分离、纯化。对外购的起始原料和中间体,应在详细了解其制备工艺的基础上,进行全面的质量研究,对工艺涉及的有关物质及残留溶剂做必要的控制,结合后续工艺要求制定可行的外购起始原料和中间体的质量要求。另外,为保证外购起始原料和中间体的生产工艺与质量的稳定,应与外购起始原料和中间体的生产厂建立可靠的信息共享机制,一旦工艺有改变,则原料药的申报单位应重新对外购的起始原料和中间体进行质量研究,评估这种工艺改变对其质量的影响,并对终产品进行严格的质量研究,保证其质量不低于原工艺产品。
目录: 1、产品名称及剂型 2、产品概述 3、处方和依据 4、生产工艺流程图 5、原药材的整理炮制 6、提取生产操作过程和工艺条件 7、制剂生产操作过程和工艺条件 8、成品放行 9、质量监控 10、原辅料质量标准和检查方法及复检前最长储存期 11、半成品质量标准、成品法定标准和企业内控标准及依据 12、包装材料质量标准、检验方法及内包材包装前的最长贮存时间 13、成品放行依据 14、工艺卫生要求 15、各设备标准操作程序 16、技术安全及劳动保护 17、劳动组织、岗位定员、工时定额、产品生产周期 18、原辅料消耗定额 19、包装材料消耗定额 20、动力消耗定额 21、物料平衡 22、成品容器、包装材料 23、综合利用和环境保护 1.产品名称及剂型
1.1产品名称:板蓝根颗粒 1.2汉语拼音:Banlangen Keli 1.3产品代码:01 1.4剂型:颗粒剂 1.5批准文号:国药准字Z+数字(8个) 2.产品概述 2.1性状:本品为浅棕黄色至棕褐色的颗粒;味甜,微苦。 2.2功能主治:清热解毒,凉血利咽。用于肺胃热盛所致的咽喉肿痛,口咽干燥;急性扁桃体炎见上述证候者。 2.3用法用量:开水冲服,一次5-10g,一日3-4次。 2.4规格:每袋装10g。 2.5 贮藏:密封。 2.6有效期:36个月 3.处方和依据 3.1处方: 理论产量222袋(每袋10g) 板蓝根 3.1kg 蔗糖2kg 糊精55g 制成颗粒 2.22kg 3.2处方依据:《中国药典》2010年版第二增补本
4.
5.原药材的整理炮制: 6. 提取生产操作过程和工艺条件: 6.1药材称量:领料称量人员按生产指令领取所需药材。在领取时,应先核对物料品名是否与指令相符,在称量前应先检查衡器的定期校验证是否在有效期内,并调整至零位平衡后方可称量。称量时,应1人称量,另1人独立复核,及时填写称量记录、复核记录,并由称量人、复核人签字确认。 6.2提取、浓缩:取处方量净制后的板蓝根药材,投入多功能提取罐内,第一次加药材5倍量水,煎煮2小时,第二次加药材5倍量水,煎煮1小时,煎液滤过,滤液合并,浓缩至相对密度为1.20(50℃测),置沉淀罐中,加乙醇使含醇量达60%,搅拌均匀,静置沉淀8小时,取上清液,回收乙醇,浓缩至相对密度1.30(80℃),得浸膏,装入洁净容器内,称重,挂标签,检验合格后入冷库。 7.制剂生产操作过程和工艺条件: 7.1称配:按生产指令领取所需板蓝根浸膏、蔗糖、糊精,并核对品名、批号、数量是否与指令相符,执行称量岗位标准操作程序,及时记录。 7.2粉碎:蔗糖按粉碎岗位标准操作程序进行粉碎,全部通过80目筛,98%通过100目。 7.3混合、制粒:取蔗糖粉、糊精置槽型混合机内,混合均匀,加入浸膏搅拌均匀,用14目尼龙筛网,按摇摆式颗粒机标准操作程序进行制粒。 7.4干燥:按沸腾干燥机标准操作规程进行干燥,进风温度控制在90-100℃,出风温度55-65℃,干颗粒水分控制在≤3.0%。 7.5整粒:用10目和40目筛网,按方型振动筛标准操作程序进行整粒,将合格颗粒置洁净容器内,密封,并标明品名、批号、数量、操作人。 7.6混合:将合格颗粒置多项运动混合机中混合90分钟,挂标签,入中转站,执行中转站管理规程。 7.7分装:按岗位生产指令,领取检验合格的颗粒,并核对品名、批号、数量是否和指令相符。按指令领取并核对复合膜品名、规格、数量是否与指令相符。按颗粒分装机标准操作程序进行分装。在分装过程中及时自检,装量范围±4%。半成品及时传入外包间。 7.8外包装:按生产指令领取说明书、印有批号的中袋(小盒)、大箱,并核对品名、数量及检验单后,按外包装岗位SOP进行操作。QA按取样标准取样,按成品项下标准要求进行全检。 7.9入库:将检验合格的药品登记品名、数量后,入常温成品库。批与批之间,不同品种之间应有明显界限,不得混放。按该品种的贮存条件进行贮存。
XXXXXX(产品)生产工艺操作规程1、产品概述 2、产品和原料的物化性质 2.1产品XXXXX 2.1.1、化学名称: 化学结构: 分子量: 2.1.2、产品的物理性质: 2.1.3、化学性质 2.2、原料的物化性质: 2.2.1、原料XXXX物化性质 2.2.2、原料XXXXXX物化性质
. . . . . 3、产品及原料质量标准:3.1、产品XXXXXX质量标准 外观: 3.2、原料质量标准:(例如) 3.2.3、环已烷
外观:无色透明液体,含量≥99.0%,水分≤0.02%。 3.2.4、三氯甲烷 符合GB4118—92一等品标准, 外观:无色透明液体,含量≥99.0%,酸度≤0.001%,水分≤0.01%。 3.2.5、硫酸 外观:无色透明液体,含量≥98%。 3.2.6、碳酸钠 符合GB210—92一级品标准, 外观:白色固体,含量≥98.8%,水不溶物≤0.1%。 4、生产工艺原理 5、生产工艺流程叙述 5.1、工艺流程叙述: 7、主要工艺控制点: 7.2、原料配比及生产控制点 (分工序叙述) 7.2.6、公用工程准备:
8、开停车操作:(例如) 8.1、开车前准备: 8.1.1、仔细检查各种设备、管道和阀门,是否漏气、漏料,管道是否畅通; 8.1.2、各阀门是否灵活好用,开关位置是否正确; 8.1.3、各泵机是否能正常运转; 8.1.4、仪表是否指示正确灵活好用。 8.1.5、空车时中间罐、成粉器试真空达到0.06MPa 以上; 8.1.6、备足各种原料,通知冷冻准备开车送冷冻盐水,做好开车记录; 8.1.7、放空冷凝器开启冷乙二醇水溶液进出口阀门,吸附器充填硅胶; 8.2、备料 8.2.1、在乙二醇水溶液罐E118、E117、E120中配制足量的30%乙二醇水溶液, 8.2.2、E118的乙二醇水溶液通过盘管用冷冻盐水降温到约00C用于冷凝器E111、成 粉器R116、真空泵前冷凝器E127、真空泵后冷凝器E130、集中放空冷凝器E152冷凝物料、中间罐R114物料的冷却、冷凝; 8.2.3、E117、E120的用蒸汽分别加热到约400C、80~850C备用; 8.2.4、在碱溶液罐V103中放入约4吨自来水,加入200kg无水碳酸钠,用P104打 循环配制成约5%的碳酸钠水溶液,经分析合格后,再用P104打到碱高位罐V113中备用。 8.2.5、原料、公用工程达到生产要求和规定指标后,往高位罐备足各种原料。 8.3、开车操作 8.3.1、合成工序: 1)、关闭反应锅放料底阀,打开反应锅冷凝器冷乙二醇水溶液进出口阀门,往冷凝器 中通冷乙二醇水溶液; 2)、从高位罐中放入1000L环已烷, 从高位罐加三氯乙醛,开动搅拌; 3)、打开反应锅夹套进出口阀门,往夹套内通80~850C的热乙二醇水溶液预热物料, 当物料温度达到600C以上时,开始自高位罐滴加二甲酯; 4)、滴加二甲酯时,控制滴加速度及调节反应锅夹套进出口阀门,保持反应温度76—
1. 目的:为了加强原料药杂质管理,确保上市药品质量。 2. 适用范围:本公司生产的原料药产品。 3. 责任者:QC、QC负责人、QA负责人、质量受权人。 4. 内容: 4.1杂质的定义及分类 4.1.1定义:任何影响药品纯度的物质均称为杂质。。 4.1.2分类: ●按化学特性分类:有机杂质、无机杂质、有机挥发性物质。(1)有机物质 ①有关物质 -起始原料 -中间体、副产物 -降解产物 -聚合物 -异构体 ②多晶型杂质 (2)无机杂质 -无机盐 阴离子 阳离子
-重金属催化剂 -过滤介质、活性炭 (3)有机挥发性物质 残留溶剂 ●按来源分类:有关物质(反应前体、中间体、副产物、降解产物等)、其它杂质、外来物质。 ●按结构分类:其他甾体、其他生物碱、几何异构体、光学异构体和聚合物。 4.2杂质的检测方法 ●原子吸收分光光度法:检查金属杂质 ●毛细管电泳法:抑肽酶中检查去丙氨酸-去甘氨酸-抑肽酶和去丙氨酸-抑肽酶两个特定杂质 ●色谱法:液相色谱法,检查有机杂质的主要方法 薄层色谱法,作为液相色谱法的补充 气相色谱法:检查挥发性杂质 ●热分析法:检查不同晶型的杂质(影响生物利用度和稳定性) ●拉曼光谱法、红外光谱法、X-射线粉末衍射 ●生物检定法、酶联免疫试剂盒(抗生素残留量) 4.3杂质的控制 4.3.1残留溶剂控制 ●标准起草过程中,应针对所用到的有机溶剂进行检查; ●建议采用了顶空进样方式和程序升温梯度洗脱的方法; ●应注意供试品溶液的配制,要求供试品在溶剂中溶解; ●方法学试验应进行回收试验,确认是否有基质干扰; ●采用标准加入法,该方法可减少基质干扰,提高方法的准确度。 4.3.1.1残留溶剂检测的常见问题 ①共出峰干扰 ②热降解干扰 ③基质效应的影响 ④药品溶解性的影响
滑动水口生产工艺操作规程 1、范围 本规程适用于滑动水口的原料管理、预混合工艺、泥料配料混碾工艺、成型工艺、半成品检验及不合格品处置方法;半成品热处理、成品检验及取样、入库及贮存和滑动水口标识说明。 2、引用标准 GB/T 7321—2004 《定形耐火制品试样制备方法》 GB/T 2997—2000(2004)《致密定刑耐火制品体积密度、显气孔率和真气孔率试验方法》 GB/T 5072—2008 《常温耐压强度试验方法》 GB/T 3002—2004 《高温抗折强度试验方法》 GB/T 10325—2001(2004)《定形耐火制品抽样验收规则》 GB/T 10326—2001(2004)《定刑耐火制品尺寸外观及断面的检查方法》 GB/T 16546—1996(2004)《定形耐火制品包装、标志、运输和储存》 3、滑动水口的型号和形状尺寸 根据生产计划,按照工艺卡上砖型尺寸进行生产。 4、工艺流程 滑动水口经过原料采购、化验,配料,混碾搅拌,压制成型,烘烤干燥,成品检验,入库等工艺流程。 5、设备和仪器管理 5.1 S114混碾机。 5.2 1000吨电动压砖机,1250吨手动压砖机。 5.3 游标卡尺、测量试样尺寸和检查其几何形状的工具。 5.4 100、500磅秤、模具等装置。 5.5 仪器设备必须保持干净整洁,摆放在规定的位置。 5.6 搅拌机要求每天在停机后清理一次,保持搅拌机内干净;每天生产前必须检查搅拌机刮板是否能正常,检查搅拌机运转是否正常。
每天配料前必须检查磅秤是否正常。 6、原料管理 6.1 根据生产工艺的要求,技术质量部制订原料的规格、品位及控制要求。 6.2 采购部向获得质量管理体系认可的合格分供方采购原料,所采购的各种原料由质检部门依据原料检验准则验收并取样化验,判定合格后方可使用。 6.3 储运部负责对库存原料的管理,验收合格的原料,必须按要求分类堆放,并给予明确的标识。验收不合格的原料不得投入生产,质检部门必须给予禁止使用标识。 6.4 入库的原料储运部必须按标准贮存及管理,避免滴漏、遇水及雨淋。 6.5 生产班组使用原料时,必须在指定的合格的原料区(有原料理化指标检验合格标识)按严格的领料程序领料,即必须由专人领料和填写领料单;原则是在每天作业完,打扫设备和现场卫生后,按生产计划和配料单计算后在储运部仓库保管员的监督和指导下领好下一天的各种原辅材料;原则每天领料一次,领好的各种原辅材料必须按照规定堆放在指定的存放区域和料仓内。 7、配料 7.1 按照生产要求,对指定生产砖型,严格按照生产工艺卡指标进行称量配料,每种物料重量误差控制在该物料重量的5%以内。 7.2 为防止细粉受潮,细粉在搅拌时再单独称量加入。 8、泥料预混及要求
复方板蓝根颗粒工艺验证方案文件形成: 文件控制: 变更记载:
复方板蓝根颗粒工艺验证方案 1.主题内容: 本方案规定了复方板蓝根颗粒生产工艺的验证方法及标准。 2.适用范围: 本方案适用于复方板蓝根颗粒生产工艺验证。 3.简介: 3.1. 概述: 根据四川广元蓉成制药有限公司工艺验证管理规程有关规定,在变更生产场地和设备时需要对其生产工艺进行全面的验证,确保现行的工艺流程可以持续稳定的生产出合格的产品。公司新建提取车间、口服固体制剂车间,其生产线目前试生产品种为复方板蓝根颗粒,为确认按制订的复方板蓝根颗粒生产工艺规程进行操作,能始终生产出质量稳定可靠的合格产品,特制订本验证方案对复方板蓝根颗粒生产工艺进行验证。我们对复方板蓝根颗粒的生产过程中提取、浓缩、制粒、分装(内包装)等生产关键工序进行验证。 把每一操作工序段作为一个验证小节,每项小节包括单元项目、执行文件、取样及检验方法、可接受标准、验证记录等几个方面。本次复方板蓝根颗粒试生产在我公司提取车间、口服固体制剂车间进行,验证批次为三批。具体验证时间以生产部实际生产时间为准。 3.2.验证产品基本信息: 3.2.1.产品名称和产品代码: 3.2.1.1.产品名称:复方板蓝根颗粒 汉语拼音名:汉语拼音: Fufang Banlangen Keli
3.2.1.2.产品代码:C-010 3.2.2.产品概述 3.2.2.1.剂型:颗粒剂 3.2.2.2.规格:每袋装15g 3.2.2.3.批量:720kg 3.2.2. 4.产品特点 3.2.2. 4.1.性状:本品为棕色的颗粒;味甜、微苦。 3.2.2. 4.2.功能与主治:清热解毒,凉血。用于温病发热,出斑,风热感冒,咽喉肿烂,流 行性乙型脑炎,肝炎,腮腺炎。 3.2.2. 4.3.用法用量:口服,一次15g,一日3次,重症加倍;小儿酌减。预防流感、乙脑,一日15g,连服5日。 3.2.2. 4.4注意事项:糖尿病患者慎用。 3.2.2. 4. 5.贮藏:密封,防潮。 3.2.2. 4.6.有效期:二年 3.2.2. 4.7.批准文号:国药准字Z51022154 3.2.3批生产记录编号:SC-SRD-09-028-00 4.验证目的: 4.1.本次验证旨在证明在生产场地和设备变更的情况下,按复方板蓝根颗粒生产工艺规程、 有关GMP管理规程、标准操作程序及验证文件的要求,连续进行三批试生产,证明设计的工艺过程的实用性,设计的生产工艺和设计产品质量能够符合复方板蓝根颗粒的质量标准。确认本生产工艺稳定、操作程序合理、设备与生产能力相匹配、质量监控点合理,具有可靠性和重现性,保证生产处于受控状态,确保能连续地生产出合格的产品。 4.2.本方案确定了在实际操作条件下需要监控的关键工艺参数和变量,概括了对中间品样品 的取样与检测要求,并规定工艺监控及产品检测的可接受标准。 4.3.为避免记录重复,批生产记录作为原始记录备查,验证方案中只记录重点控制项目、重 点结果和数据。 5.实施验证人员及主要职责:
生产工艺和操作规程 生产车间岗位职责 建湖子木实业有限公司
魔芋小结生产工艺及其说明(表式)
魔芋小结生产操作规程 序言: 根据Q/JHCG0001S-2010 制定以下操作规程 一、个人生产前清洁卫生 1. 所有员工必须穿着统一工作服、工作鞋,戴工作帽,换衣后内衣不得外露,裤脚必须塞在工作鞋里,头发和耳朵不得露在帽子外面。 2. 进入生产区域不得佩戴首饰,不得留有长指甲,每周检查一次。 3. 洗手消毒:清水洗一洗手液一清水冲洗一消毒液浸泡30秒一烘干 4. 用滚轮除去身上灰尘和毛发。 二、生产前设备检查、工具清洗消毒 1. 生产前对设备进行检查,排除故障和安全隐患。 2. 生产前工器具清洗后用消毒液消毒。 3. 设备清洗后100C蒸汽消毒。 4. 预先配好定型流槽的专用水。 5. 定型流水槽放水前清洗,检查槽壁。 6. 检查管道口是否清洁,放掉管道内的剩水,待清洁水色正常后方可放水。 三、配制工艺用水和生产用水 1. 配制定型流槽用水:1700升清水,加入1.1千克食用氢氧化钙,完全溶解。 pH 值:11.0-11.7 。 2. 配制养护水:按照6.5-7.0 ? 比例,在清水内加入食用氢氧化钙,完全溶解 pH 值:11.5-11.8 。 3. 配制塑封水:按照6.0-6.5 ? 比例,在清水内加入食用氢氧化钙,完全溶解pH 值:11.6-12.0 4. 各种工艺用水和生产用水调节pH值,用清水或食用氢氧化钙。 5. 质检人员全程监督配制过程,并且将检测和调整数据记录在案。 四、备料
1. 质检部门对每一批次原料都应该进行仔细检查,检查内容包括:产地、包装、数量、清洁度、白洁度和统一性。 2. 质检部门对每一批次原料都应该事先做小样试验,计算好膨胀倍率,将结果填写在备用原料单(货卡)上。 3. 质检部门对每一批次食用氢氧化钙以及辅料进行严格检查和测试。 4. 生产时操作工应该按照领料单说明,向仓库领取指定批号的原料及辅料。 5. 领取指定批号的原料及辅料时,应该做到两人复核。 五、投料 1. 向清洗好的搅拌桶内注入清水,至750升时质检员取第一次水样。 2. 启动循环泵,清水注至1000升时,质检员在循环泵出水口取第二次水样。 3. 当水温达到20C±2C时,打开搅拌机,一分钟后,将原料缓慢投入搅拌桶内使其充分搅拌均匀,此时循环泵将原料从底部抽出,从上部注入搅拌桶。 4. 原料搅拌7分钟时,用长柄橡皮刮板将搅拌桶边缘的原料仔细刮入搅拌桶内。 5. 原料搅拌8至10分钟,停止搅拌机,倒开循环泵,使管道内原料全部进入搅拌桶内。 6. 关闭电源,盖上搅拌桶盖子,使搅拌桶内原料静置膨胀。 7. 原料静置,按照不同的倍率,膨胀时间90分钟一120分钟。 六、食用氢氧化钙溶液配制和均质机操作 1. 按照领料单规定,向仓库领取规定数量的食用氢氧化钙。 2. 在清洁的250L容量不锈钢桶内注入20C±2C的净化水100升,加入食用氢氧化钙,充分搅拌,使食用氢氧化钙完全溶解。 3. 测定并调整食用氢氧化钙溶液,使其pH值控制在12.0-12.5之间。 4. 将符合要求的食用氢氧化钙溶液倒入离心桶内,开动搅拌使其保持均匀。 5. 将均质机、离心桶、搅拌桶,三者管道准确连接。 6. 膨胀原料与食用氢氧化钙溶液混合比为10:1,食用氢氧化钙溶液流量为:70升/小时。 7. 均质机转速650转/分钟。 七、定型流槽准备 1. 将配好的定型流槽水注入流槽加热至70C。 2. 加入300g原料溶解于水槽中。 3. 用丝网清除水中络合物,直至看不见络合物为止。 八、出丝 1. 在定型流槽的喷头上安装带有标准孔径和密度的出丝板,出丝板应该安装紧密,不能出现泄漏。
目的:建立板蓝根颗粒工艺规程,指导生产,确保产品质量。 范围:板蓝根颗粒生产的全过程。 责任:生产部、固体制剂车间、供应部、储运部。 内容: 1. 药品名称 1.1 商品名:板蓝根颗粒 1.2 汉语拼音:BANLANGEN KELI 2. 药品剂型:颗粒剂 3. 药品概述 3.1 性状:本品为棕色或棕褐色的颗粒;味甜、微苦。 3.2 功能主治:清热解毒,凉血利咽,消肿。用于热毒壅盛,咽喉肿痛;扁桃腺炎、腮腺炎见上述证候者。 3.2 规格:每袋装10g 3.3 用法与用量:开水冲服,一次5~10g,一日3~4次。 3.4有效期:二年。 3.5贮藏:密封。 4. 药品处方 4.1 处方依据:中华人民共和国药典2005年版一部 4.2 标准处方:1000g 板蓝根:1400g 5.颗粒剂生产工艺流程示意图及环境区域划分
图标: 物料 检验 质量检验 质量检验 质量检验
6.操作过程及工艺方法 6.1 备料: 6.1.1车间领料员根据批生产指令填写领料单,按照车间领料操作规程(编号:SOP-A0-023-00 )从仓库领取各种需要的原辅料,进行外包装的清洁处理。 6.1.2按照《粉碎、过筛工序标准操作规程》(编号:SOP-A1-021-00 )操作,过80目筛。 6.1.3清场:按照生产部制定的清场管理规程要求,对备料、粉碎操作涉及的工作场所、操作台面和环境进行清场; 6.1.4及时填写批生产记录。 6.2称量: 6.2.1校正衡器、检查原辅料外观质量、核对品名及检验报告书、按处方准确称取符合细度要求的原料和辅料; 6.2.2按照称配工序操作规程(编号:SOP-A1-022-00 )分别进行生产板蓝根颗粒各原辅料的称量。 6.2.3 称量容器的重量要记录; 6.2.4 往容器中加所称量的物料时,要轻拿轻放,防止产生灰尘。直到达到所需要的重量为止并记录; 6.2.5第二个操作者进行全过程的复核,包括:所称量物料的名称、批号和数量,称量操作经双人复核无误后转入下一生产工序。
蓝天学校食堂生产工艺流程及操作规程 为了加强学校食堂管理,强化责任,规范流程,提高效率,确保安全,现就学校食堂操作 规程明确如下: 一、食品加工流程: 原料进货验收 ------ 择洗 ------ 精洗——切配 ------ 加工制作 ------ 备菜间存放——分发 二、餐具洗消流程: 餐具清洗消毒 ------ 浸泡 ------- 漂洗 ------ 存放保洁 三、餐具回收流程 餐具回收——残存物清理——归类——清洗 四、分餐运输流程 运输 ------ 抬入餐厅 ------ 分配到分餐窗口 ------ 厨房间卫生 ----- 厨房卫生管理 操作规程: 原料进货 1、学校一切食品必须定点采购,采购食品及其原料时,应向供货者索取食品的检验合格 证或者化验单(即索证)。 2、索证时对索证食品的卫生检验合格证,化验单必须查清产品名称,生产企业名称,生产 日期,批号等。 3、索证食品的卫生检验合格证,化验单如为复印件,应加盖检验单位印章。4、包装食品必须检查食品标签,严禁“三无”产品进库。5、食品进库或制作加工前必须由验收员 验收,签字二、食品粗加工 1、动物性食品禽、肉、鱼和植物蔬菜等分开加工,生熟菜墩要分开 使用,肉类、蔬菜清洗池要分开使用,防止相互影响。 2解冻融解应提前进行,在常温下自然解冻,不用热水融解禽、肉、鱼类食品,处理后的 食品应分类摆放,用洁净的容器存贮,防止与未经处理食物接触造成污染。 3每天工作前处理好使用的设施,清洗水池,地面,容器架、框、刀具等,工作结束时要 搞好卫生,及时处理垃圾及废异物。 4加工间应保持墙面、地面清洁,加工原料应计划出库、采购缩短存放备用时间,防止腐败 变质,所有加工食物都应严格验收检查及至取样式检验,不符合规定和标准的不予接收,不 可加工处理。先处理的 食品原料应先提供使用,粗加工间内的工具,用具,工作服不得外借使用,并经常清洗保持 清洁。 三、烹调加工 1、烹调加工所用原料应保持新鲜,冷冻的肉、禽、水产应在室温下缓缓地彻底融解,不能 热水融解应急处理。 2、灶房内的所有原料进入时要认真检查,发现卫生问题及时处理,不干净返回粗加工间 重新处理,腐败变质或感官性状异常的应停止使用。 3、调料应认真检查,发现异杂物等及时筛选,禁止使用假冒伪劣原料。 4、非食品用原料严格控制,禁止入内,防止误食引发食物中毒。
化工工艺操作规程的内容 一、工艺技术规程 1、产品概述 1.1 产品名称、化学结构式、主要理化性质。 1.2 产品质量规格、技术标准、包装运输方式、贮存期限。 1.3 主要用途。 1.4 原辅材料名称、规格及主要指标检验方法。 2、生产工艺过程 化学反应过程和生产流程图。 2.1 化工工艺路线及其基本原理。 2.2 主要化学反应及副反应。 2.3 主要物流的平衡及流向。 2.4 带有控制点的工艺及设备流程图。 3、生产控制技术 3.1工艺控制点示意图。 3.2各项工艺操作指标。 3.3主要生产工序的控制方法,仪表控制、装置和设备的报警联锁。 4、物耗能耗指标 5、不合格产品的处理 6、安全生产技术 6.1 使用、产生有毒有害物质一览表。
6.2 易燃易爆工序一览表。 6.3 危险化学品的安全管理(贮存、运输要点)。 6.4 可能发生的事故及处理预案。 6.5 工业卫生和劳动保护。 7、环境保护。 7.1 三废排放示意图。 7.2 三废排放及其治理。 7.3 三废排放标准和现状对比。 7.4 副产回收的处理的综合利用。 8、劳动组织和生产管理 9、设备一览表及主要设备生产能力 10、仪表计量一览表及主要仪表规格型号 11、附录 11.1有关理化常数、曲线、图表、计算公式、换算表。 二、岗位操作法内容 工艺编号岗位编号 1、岗位职责 2、本岗位工艺指标和操作指标一览表 3、本岗位制成品的质量标准或规格 4、原辅材料和其他材料规格、性能 5、本岗位的工艺流程图,本岗位和上、下道工序的关系。 6、生产操作方法与要求。
6.1开车 开车前的准备、正常开车和系统开车操作。 6.2 停车 正常停车、临时停车、紧急停车和系统停车操作。 6.3 不正常现象及其处理方法。 7、原始记录格式和记录要求 8、生产控制和分析 9、交接班制度、巡回检查制度和重点操作复核制度 10、安全生产 11、工业卫生和劳动保护 12、三废处理与环境保护 13、设备仪表一览表 14、计量器具及仪器仪表的检查和校正
复方板蓝根颗粒工艺规程
目录 1.产品名称及剂型 (3) 2.产品概述 (3) 3.处方和依据 (3) 4.生产工艺流程图 (4) 5.工艺操作过程及工艺条件 (4) 6.质量监控 (7) 7.质量标准 (8) 8.物料平衡计算 (10) 9.技术经济指标的计算及原、辅、包装材料的消耗定额 (11) 10.工艺卫生 (12) 11.主要设备一览表 (12) 12.技术安全及劳动保护 (13) 13.劳动组织定员定岗、生产周期 (13) 14.环境保护 (14) 15.附录 (14)
1 产品名称及剂型 1.1 通用名复方板蓝根颗粒 1.2 汉语拼音 Fufang Banlangen Keli 1.3 剂型颗粒剂 2 产品概述 2.1 性状本品为棕色的颗粒;味甜,微苦。 2.2 功能主治清热解毒,凉血。用于温病发热,出斑,风热感冒,咽喉肿烂,流行性 乙型脑炎,肝炎,腮腺炎。 2.3 用法用量口服,一次15g,一日3次,重症加倍;小儿酌减。预防流感、乙脑,一日15g, 连服5日。 2.4 规格每袋装15g(相当原生药15g) 2.5 有效期 24个月 2.6 贮藏密封,防潮。 3 处方和依据 3.1 处方 板蓝根600g 大青叶900g 3.2 制法以上二味,加水煎煮两次,每次1小时,滤过,合并滤液,浓缩至适量,加入三倍量乙醇, 搅匀,静置24小时,滤过,滤液回收乙醇,浓缩至稠膏状,加入蔗糖粉1425g及淀粉适 量,混匀,制成颗粒,干燥,即得。 3.3 处方依据 3.3.1 执行标准部颁标准中药成方制剂第十二册。 3.3.2 批准文号国药准字Z51022587
生产操作规程和管理制度 第一章总则 第一条为保证车间生产及各项工作照章操作、有序进行,进一步增强员工责任感,加强安全防范意识,特制定本制度。 第二条适用范围 1、本制度适用于公司的生产车间; 2、本制度适用于生产车间全体试用员工和正式录用员工。 第二章管理人员岗位职责 第一条厂长岗位职责 1、在总经理和分管副总经理的领导下,全面负责生产一线的生产、技术、安全、设备等工作的管理和指挥。 2、根据公司制定的生产经营目标和任务,科学合理的组织生产,及时处理在实施过程中遇到的困难和问题,确保生产任务的完成。 3、监督和指导生产班组严格按生产工艺和操作规程操作。严把质量关,对产品质量负主要责任。 4、牢固树立成本意识,强化成本管理,扎实做好节能降耗工作。 5、负责员工的日常管理和教育,不断提高员工的综合素质。 6、根据生产需要调配生产线员工岗位。 第二条副厂长岗位职责 1、协助厂长完成车间的各项管理工作。 2、负责抓好机电设备维修和保养工作。 3、完成公司交办的其他任务。 第三条班(组)长岗位职责 1、在厂长和副厂长的直接领导下,全面负责本班(组)各项管理工作。 2、加强现场管理,每小时对本班(组)的各道工序巡查一次,内容包括: (1)巡查设备转动情况,发现异常要及时通知相关人员进行维修和保养。
(2)巡查产品质量情况,发现产品质量问题要及时进行处理。 (3)巡查员工工作情况,对脱岗、串岗、睡班的除批评纠正外,要做记录,报相关部门按公司规章制度处罚; (4)巡查安全生产情况,发现问题及时处理,做到防微杜渐。 第三章生产员工岗位职责及操作规程 第一条生产员工包括:各工段员工、机修工、电工、叉车生产车司机、五金仓库保管员等。 第二条生产员工岗位职责总体要求 1、严格执行公司各项规章制度,不得有迟到、早退现象。 2、努力学习本岗位的机器性能,掌握工艺要求,熟练操作机器。 3、操作人员应提前15分钟到岗,做好开机前的准备工作,检查设备运转状况,发现问题及时向有关人员反映。 4、保障下工段的原料供给。对堆场的原材料,要切实做到先进先用。 5、定期对设备转动部位加润滑油,做好设备的日常保养维护工作。 6、搞好本工段的地机及机台的卫生,及时清除杂物。清洁区内要做到无垃圾堆积,机器设备上无明显的灰尘。 7、设备发生故障后,应及时通知机电人员进行维修,个人不得随便乱动,以免发生意外事故。 8、服从班(组)长的工作安排。 9、严格按交接班制度进行交接。 10、提高安全意识,做好防范,杜绝人身和设备事故。 11、在发生突发事件时,应立即按下总停紧急按钮,争取以最快的速度把有故障的设备停止下来,以免造成更大的事故发生。 第三条各工段岗位职责和生产操作规程 一、削片工段 (一)岗位职责: 1、保障刨片工段的原料供给及原料的配比。 2、铲车在运输枝桠材时,要做到远近搭配、干湿搭配。 3、控制电耗,每吨木材耗电不超过5度。